Maksimalan broj orbitala u nivoima. Zadaci za dio o osnovama strukture atoma
U ovom odeljku možete pronaći glavne vrste zadataka na temu strukture atoma: reprezentacija elektronska konfiguracija, definicija kvantnih brojeva i dr.
Zadatak 1. Masa neutrona je 1,67*10 -27 kg, a brzina mu je 4*10 2 m/s. Odredite de Broljevu talasnu dužinu.
Zadatak 2. Sastaviti elektronske formule i grafički predstaviti distribuciju elektrona duž kvantne ćelije za navedene elemente. Analizirati mogućnosti razdvajanja uparenih elektrona pri pobuđivanju atoma sa formiranjem valentnih elektrona u skladu sa teorijom spin-valencije. Ugljik, hlor.
Zadatak 3. Sastaviti elektronske formule i grafički prikazati raspodjelu elektrona u kvantnim ćelijama za navedene elemente. Analizirati mogućnosti razdvajanja uparenih elektrona pri pobuđivanju atoma sa formiranjem valentnih elektrona u skladu sa teorijom spin-valentnosti.
hlor, berilijum argon
Zadatak 4. Šta kvantni broj određuje broj orbitala u datom podnivou atoma? Koliki je broj orbitala na s-, p-, d- if- podnivoi?
11 i 25.
Rješenje:
Rješenje: Glavni kvantni broj n karakterizira energiju i veličinu orbitale i uzima vrijednosti samo cijelih brojeva od 1 do ∞.
Bočni kvantni broj (orbitala) l karakterizira geometrijski oblik orbitale i za svaki energetski nivo uzima vrijednosti cijelih brojeva od 0 do (n-1).
Kod višeelektronskih atoma, energija elektrona također ovisi o vrijednosti l. Dakle, stanje elektrona karakteriziraju različite vrijednosti l nazivaju se energetskim podnivoima:
l=0, s-orbitale su sferne
l=1, p-orbitale su u obliku bučice
l=2, d-orbitale imaju složeniji oblik
l=3, f-orbitale imaju složeniji oblik
Magnetski kvantni broj m l karakterizira smjer orbitale u prostoru i uzima vrijednost od - l … 0 … +l .
s-podnivo karakterizira vrijednost l=0, m l = 0
p-podnivo karakterizira vrijednost l=1, m l = -1; 0; +1 (3 orbitale)
d-podnivo karakterizira vrijednost l=2, m l = -2; -jedan; 0; +1; +2 (5 orbitala)
f-podnivo karakterizira vrijednost l=3, m l = -3; -2; -jedan; 0; +1; +2; +3 (7 orbitala)
m l određuje broj orbitala na datom energetskom podnivou atoma.
Spin kvantni broj m s karakterizira rotaciju elektrona oko njegove ose i uzima vrijednosti + ½ i - ½.
Na 4. nivou moguća su 4s, 4p, 4d energetska stanja za vanjski sloj atoma.
Zapišimo skup kvantnih brojeva za njih:
4s: n =4, l = 0, m l = (2l+1)=1 (1 orbitala), m s = ±½
4p: n =4, l = 1, m l = (2l+1)=3 (3 orbitale -1,0,+1), m s = ±3½
4d: n =4, l = 2, m l = (2l+1)=5 (5 orbitala -2,-1,0,+1,+2), m s = ±5½
gospođa naznačeno za maksimalan broj elektrona.
Maksimalan broj elektrona po p-podnivou je 6 prema .
Ψ2 u ovoj oblasti je maksimum.
Rice. 2.3. Distribucija vjerovatnoće da se elektron nalazi u atomu vodonika.
Može se reći da fluktuira ne sam elektron, već vjerovatnoću njegovog pronalaska bilo gde u atomu.
Dakle, atom zbog talasne prirode elektrona
nema tačne geometrijske dimenzije i nepromijenjen oblik.
Elektron u atomu je talasni objekat. Međutim, gubitak elektrona od strane atoma (jonizacija atoma) uvijek se javlja u obliku jednog
fisioni elektron kao čestica.
2.7. Struktura elektronskih omotača atoma. kvantni brojevi
Integracijom Schrödingerove jednadžbe, nalazi se valna funkcija Ψ=f(x,y,z) . Određivanjem Ψ moguće je procijeniti vrijednost Ψ 2 dV – vjerovatnoću
vjerovatnoća pronalaska elektrona u volumenu prostora dV koji okružuje atomsko jezgro.
Posljedica rješavanja Schrödingerove jednadžbe su tri kvantna broja koja karakteriziraju ponašanje elektrona u atomu.
2.7.1. Glavni kvantni broj (n)
Glavni kvantni broj karakteriše (u prvoj aproksimaciji) ukupna energija elektrona ili njegov energetski nivo.
Definiše dimenzije atomska orbitala . Što više "n", to veća veličina atomska orbitala, što znači da je elektron udaljeniji od jezgra, pa je njegova energija veća.
Za n=1 moguće je jedno rješenje Schrödingerove jednadžbe.
Za n=2 postoje četiri moguća rješenja, za n=3 devet rješenja Schrödingerove jednačine, itd. Općenito, za svaku vrijednost "n" postoje "n2" rješenja.
Ova rješenja su orbitalne valne funkcije, ili orbitale elektrona.
Koncept "orbitale" ne treba poistovjećivati s konceptom "orbite", koji se koristi u Bohrovoj teoriji. Orbita se u Borovoj teoriji shvata kao putanja (put) elektrona oko jezgra.
Orbitale se mogu smatrati nekim područjima oko jezgra kojima elektroni imaju pristup. (ali ih ne popunjava uvijek)
yut). Ovo je lokus tačaka gde je verovatnoća pronalaženja elektrona u pobuđenom stanju maksimalna (~95%).
Pošto elektron ima negativni naboj, njegova orbitala se može smatrati nekim distribucija naplate. Ova distribucija se još naziva elektronski oblak.
Skup elektrona sa istom vrijednošću "n" naziva se energetski nivo (ili ljuska, ili sloj elektrona).
jesti). Kod nepobuđenih atoma, maksimalna vrijednost "n" odgovara broju perioda ovog elementa u tabeli D.I. Mendeljejev.
Nivoi energije se ponekad označavaju velikim slovima.
(Najčešće se koriste brojevi.)
2.7.2. Orbitalni kvantni broj (l)
Orbitalni kvantni broj određuje oblik elektronskog oblaka (međutim, ovo je nedvosmisleno samo za atom vodonika sa jednim elektronom).
Kod višeelektronskih atoma, l također karakterizira energiju. U ovim atomima, elektroni datog energetskog nivoa su grupisani u podnivoe sa različitim energijama.
Svaka vrijednost l odgovara određenoj energiji
podnivo neba. Skup elektrona sa istim "n" i "l" naziva se podnivo (ili podljusku).
Orbitalni kvantni broj ima vrijednosti od 0 do (n-1): 0.1,2.3,…….(n-1).
Češće, vrijednost "l" umjesto brojeva, oni se izražavaju malim slovima latiničnog pisma.
l = 0 1 2 3 ... | ||
oznaka s p d f …. |
||
(Više od četiri podnivoa u nepobuđenim atomima nije popunjeno, budući da vrijednosti l = 0,1,2,3 opisuju elektrone svih trenutno poznatih elemenata).
Tabela 2.1 |
|||
Odnos između glavnih i orbitalnih kvantnih brojeva |
|||
kvantni broj (n) | Orbitalna vrijednost |
||
kvantni broj | |||
la(l) | |||
0,1,2(s-, p-, d-) | |||
0,1,2,3 (s-, p-, d-, f-) | |||
Orbitale za koje je l = 0, | |||||||
oblik lopte (sfere) | pozvao | ||||||
orbitale (uslovno prikazane u | |||||||
krugovi). | |||||||
Elektroni sa l = 0 nazivaju se s-elektroni. |
|||||||
Kao što se može vidjeti iz tabele 2.1, s-orbitala je |
|||||||
na svim nivoima energije. Na prvom |
|||||||
nivo energije postoje samo s- |
|||||||
orbitale. | |||||||
Orbitale za koje je l =1 imaju |
|||||||
oblik bučice (osmi volumen) i na- |
|||||||
nazivaju se p-orbitale (elektroni –p- |
|||||||
elektrona). p-orbitale su na svim |
|||||||
nivoa osim prvog. | |||||||
Orbitale sa l =2 imaju | složeniji |
||||||
oblik (volumenski "list djeteline") i na- |
|||||||
nazivaju se d-orbitale. | |||||||
d-orbitale su na svim nivoima, osim na prvom |
|||||||
prvi (n=1) i drugi (n=2). | |||||||
Orbitale sa l =3 (f-orbitale) |
|||||||
komplikovanije od d-orbitala. Oni su, |
|||||||
počevši od četvrtog nivoa. | |||||||
Orbitalna energija | (podnivoi), | ||||||
koji su na istom energetskom nivou, nisu isti i rastu u nizu:
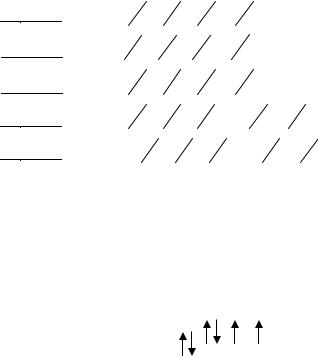
Es Distribucija podnivoa po energiji prikazana je na grafikonu Energetski podnivo je označen na sljedeći način: glavni kvant broj je napisan arapskim brojevima, orbitalni - odgovarajući supa od kupusa latiničnim slovima. Podnivoi Rice. 2.4. Šema podjele energetskih nivoa na podnivoe. Na primjer: 4d je d-podnivo četvrtog energetskog nivoa (n=4,l=2). Broj vrijednosti l za svaki nivo jednak je broju vrijednosti glavnog kvantnog broja (vidi tabelu 2.1), tako da je broj podnivoa na nivou također jednak glavnom kvantnom broju "n". 2.7.3. Magnetski kvantni broj (ml) Magnetski kvantni broj karakterizira orijentaciju elektronskog oblaka u prostoru u odnosu na magnetsko polje. On određuje elongaciju elektronskog oblaka duž osa, tj. njegov pomak u prostoru duž ose, koji se poklapa sa smjerom magnetskog polja. "ml" može uzeti bilo koje pozitivne i negativne vrijednosti cijelih brojeva od -l do +l, uključujući nulu. Broj "ml" vrijednosti određuje broj orbitala u datom podnivou. Na primjer: s-podnivo: l =0 → ml = 0 → 1 orbitalni p-podnivo: l =1 → ml = –1, 0, +1 → 3 orbitale d-podnivo: l =2 → ml = –2, – 1, 0, +1, +2 → 5 orbitala f-podnivo: l =3 → ml = –3, –2, –1, 0, +1, +2, +3 → 7 orbitala. Generalno, broj orbitala u podnivou je jednak ml =2l +1 (2.10). Grafički, svaka orbitala je prikazana kao ćelija (kvant ćelija) □ , a elektron u njoj je u obliku strelice. s-podsloj: p-podsloj: d-podsloj: f-podsloj: Ukupan broj orbitala na energetskom nivou je: Dakle, svaka orbitala i elektron koji se nalazi u ovoj orbitali karakteriziraju tri kvantna broja - glavni (n), orbitalni (l) i magnetni (m l). Tabela 2.2 Broj orbitala u energetskim nivoima odrediti ml vrijednost puhati- orbitale 2, -1, 0, +1, +2 2, -1, 0, +1, +2 3,-2,-1,0,+1,+2,+3 Elektron se odlikuje još jednim - spin kvantni broj. 2.7.4. Spin kvantni broj (ms) "m s" karakteriše unutrašnje kretanje elektrona - spin. Povezan je sa sopstvenim magnetnim momentom elektrona, zbog njegovog kretanja oko svoje ose. Jednostavno rečeno, "ms" Izražava smjer rotacije elektrona oko svoje ose. Ovaj kvantni broj uzima samo dvije vrijednosti: 1 2 i −1 2 Ako su smjerovi rotacije elektrona oko jezgre i oko njegove ose isti (na primjer, u smjeru kazaljke na satu), tada "ms" uzima vrijednost +1/2, a ako se ne poklapaju, onda -1/2. Dva elektrona sa istim vrijednostima n, l i ml, ali sa suprotno usmjerenim spinovima (antiparalelni) nazivaju se upareni ili usamljeni par elektrona. Elektroni sa nezasićenim spinovima nazivaju se nespareni (ili "lezni"). Orbitala bez elektrona naziva se prazna orbitala. 2.8. Struktura višeelektronskih atoma Za osnovno (nepobuđeno) stanje atoma dat je zapis o raspodjeli elektrona u atomu (ili elektronskoj konfiguraciji elementa) po nivoima, podnivoima i orbitalama. Ako je jedan ili više atoma u pobuđenom stanju, tada će elektronska konfiguracija također karakterizirati pobuđeno stanje atoma. Prilikom pisanja elektronske konfiguracije, glavni kvantni broj (n) je označen brojevima, podnivoi (s, p, d, f) su označeni slovima, a stepen do slova je broj elektrona u datom podnivou. Na primjer, 4d3 - postoje 3 elektrona na d-podnivou četvrtog energetskog nivoa. Vodik - 1s1 Litijum - 1s2 2s1 Magnezijum - 1s2 2s2 2p6 3s2 itd. Raspodjela elektrona u orbitalama u atomima određena je s tri glavne odredbe: Paulijev princip; -
princip najmanje energije; Gundovo pravilo. 2.8.1. Paulijev princip (1925.) Na osnovu analize spektra elemenata i njihovih pozicija u periodnom sistemu, Pauli je izveo najvažniji princip: Atom ne može imati dva elektrona sa istim vrijednostima sva četiri kvantna broja, tj. bilo koja dva elektrona u atomu moraju se razlikovati za najmanje jedan kvantni broj. Ili: orbitala ne može sadržavati više od dva elektrona, koji moraju imati suprotne spinove. Posljedice iz Paulijevog principa: 1. Već je ranije napomenuto da je broj orbitala na nivou jednak kvadratu glavnog kvantnog broja, tj.: Norb = n2, a pošto u orbitali ne mogu biti više od dva elektrona, onda: Maksimalni broj elektrona u nivou je dvostruko veći od kvadrata glavnog kvantnog broja. n=1: (Nel =2 12 =2 elektrona) n=2: (Nel =2 22 = 8 elektrona) n=3: (Nel =2 32 = 18 elektrona) n=4: (Nel =2 42 \u003d 32 elektrona) 2. Gore je također napomenuto da je broj orbitala na datom podnivou jednak broju vrijednosti magnetnog kvantnog broja za ovaj podnivo (ml = 2l + 1), a pošto ne može biti više od dva elektrona po orbitali, tada: Maksimalni broj elektrona na podnivou jednak je dvostrukom broju vrijednosti magnetskog kvantnog broja za ovaj podnivo: Na s-podnivou: Nel = 2 (2 0 + 1) = 2 elektrona (s-elektrona); na p-podnivou: Nel =2·(2·1+1) =6 elektrona (p-elektrona); na d-podnivou: Nel = 2 (2 2 + 1) = 10 elektrona (d-elektrona); na f-podnivou: Nel = 2 (2 3 + 1) = 14 elektrona (f-elektrona). 2.8.2. Princip najmanje energije Kao što je gore navedeno, najstabilnije stanje elektrona u atomu odgovara minimalnoj vrijednosti njegove energije, a elektron koji je u orbiti najbližoj jezgri ima minimalnu energiju. Svako drugo stanje je pobuđeno, nestabilno - iz njega elektron spontano prelazi u stanje sa nižom energijom. Redoslijed smještaja elektrona u atomu treba da odgovara njihovoj najvećoj povezanosti sa jezgrom, tj. elektron mora imati najmanju energiju. Dakle, elektron ne zauzima viši energetski podnivo sve dok na donjem ima slobodnih mjesta na kojima će elektron imati najmanju energiju. nije ispravno u pravu Pravila Klečkovskog: 1. Pošto je energija elektrona uglavnom određena vrijednostima glavnog i orbitalnog kvantnog broja, prvo se popunjava podnivo za koji je zbir n + l manji. Na primjer, od dva podnivoa 3d i 4s, podnivo 4s će prvo biti ispunjen elektronima: 3d: (n+l =3+2=5)4s→3d 4s: (n+l =4+0=4) 2. Ako su zbroji n + l isti za različite podnivoe, tada se prvi popunjava podnivo sa manjim "n" , jer je doprinos energiji elektrona u "n" veći od doprinosa " l ". Na primjer, na podnivoima 5s, 4p i 3d sume n+ l su isti: 5s: (5+0=5), 4p: (4+1=5), 3d: (3+2=5). Sljedeći- Shodno tome, punjenje ide po šemi: 3d→4p→5s. 2.8.3. Gundovo pravilo Orbitale unutar datog podnivoa se prvo popunjavaju jednim elektronom , tj. svaki elektron se nalazi u zasebnoj ćeliji u obliku nesparenog elektrona. Ovaj obrazac je zbog činjenice da se elektroni jače odbijaju, kada zauzimaju istu orbitalu. Stoga, oni imaju tendenciju da zauzmu različite orbitale, tada će odbijanje biti manje (tj. i manje energije). Isti smjer okretanja također doprinosi smanjenju energije; to je zbog činjenice da se elektroni sa istim spinom izbjegavaju jedni druge kada se kreću i stoga se manje odbijaju. Ova konzistencija se zove elektronska korelacija. Drugim riječima, za datu vrijednost l» elektroni u atomu su raspoređeni tako da njihov ukupan spin broj (Σm s ) je bio maksimum. Razmotrimo, na primjer, koji raspored tri elektrona na p-podnivou odgovara stabilnom stanju atoma: Σms = − 1
Σms = Σms = − 1
Σms = − 1
− 1
Primjer. Okarakterizirajte stanja elektrona u atomu sa četiri kvantna broja: elektron Ustanovljen na osnovu spektroskopskih, hemijskih i rendgenskih zraka Noskopski podaci, redoslijed kojim se orbitale popunjavaju elektronima je sljedeći: 1s2 | 2s2 2p6 | 3s2 3p6 | 4s2 3d10 4p6 | 5s2 4d10 5p6 | 6s2 5d1 4f14 5d2÷10 6p6 | 7s2 6d1 5f14 6d2÷10 …7p6 | Na primjer, prema gornjoj formuli, napravit ćemo shemu punjenja elektronske orbitale: cirkonij 40 Zr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 100 Fm:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14 5d9 6p6 7s2 6d1 5f11 . Ovisno o tome koji je podnivo posljednji popunjen elektronima, razlikuju se: s-elementi - u njihovim atomima, s-podnivo vanjskog nivoa je posljednji koji je ispunjen elektronima (u tabelama su najčešće obojeni crvenom bojom); p-elementi - u njihovim atomima, p-podnivo vanjskog nivoa (narandžasta boja) je posljednji koji je ispunjen elektronima (od 1 do 6); d-elementi - u njihovim atomima, d-podnivo pred-eksternog nivoa je poslednji koji je ispunjen elektronima (od 1 do 10), a na spoljašnjem nivou većina njih ima dva elektrona (s2). Nakon toga, na osnovu suptilnih spektralnih studija, ustanovljeno je da sva 32 d-elementa nemaju dva elektrona na vanjskom nivou (ns). Za 9 elemenata: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au - po jedan (ns1 ), dok paladiju (Pd) nedostaju oba elektrona (5s0 ). To je zbog "proboja" (ili "neuspjeha") elektrona sa vanjskog s-podnivoa na pred-vanjski d-podnivo (jedan elektron "padne" u devet elemenata, a dva u paladijum). "Proboj" ili "neuspjeh" karakterizira egzotermni efekat i dovodi do stabilnije konfiguracije (d-elementi - plavo). f-elementi - u njihovim atomima, f-podnivo trećeg nivoa je posljednji koji je ispunjen elektronima, računajući od vanjskog (obično crnog). POGLAVLJE 3. PERIODIČNI SISTEM D.I.MENDELEEVA orbitalni oblik Magnetski kvantni brojm l karakteriše magnetni moment elektrona. Određuje orijentaciju kvantnog podnivoa u prostoru. Broj projekcija podnivoa na smjer linija magnetskog polja je kvantiziran i jednak je broju orbitala na datom podnivou. Može se reći da magnetni kvantni broj određuje broj orbitala u podnivou. m l uzima vrijednosti od –l preko nule do +l. m l = –l,…,+1, 0, –1,…, +l. Razmotrimo podnivo s. Za njega: l=0, m l =0 At Podnivo R ima l=1, a m l = –1, 0, +1 U ovom slučaju, prema pravilima kvantizacije, već postoje tri projekcije. Dakle, postoje tri p-orbitale na p-podnivou. sl2.2. Za d-podnivo: l=2, m l = –2, –1, 0, +1, +2. To znači da se, prema kvantnoj teoriji, d-podnivo sastoji od pet d-orbitala. Podnivo f ima l=3, m l = –3, –2, –1, 0, +1, +2, +3. Dakle, f-podnivo se sastoji od sedam f-orbitala. Broj orbitala na podnivou može se odrediti iz izraza m l =2l+1: l vrijednost: 0, 1, 2, 3, ……. podnivo: s, p, d, f, ……. broj orbitala: 1, 3, 5, 7, ……. Spin kvantni brojm s karakteriše pravi moment momenta, koji izgleda kao da je posledica "rotacije" elektrona oko sopstvene ose. Uzima dvije vrijednosti: +1/2 i –1/2, što odgovara dva moguća smjera rotacije elektrona. m s = +1/2; -1/2. Dobiven je iz eksperimenata Sterna i Gerlacha. Razmatrani kvantni brojevi određuju energiju elektrona, zapreminu i oblik prostora u kojem je vjerovatno da će boraviti u cirkumnuklearnom volumenu, tj. veličina, oblik i orijentacija orbitale u prostoru. Budući da je valna funkcija rješenje Schrödingerove jednadžbe za sve moguće vrijednosti kvantnih brojeva, možemo reći da je valna funkcija, pak, funkcija razmatranih kvantnih parametara n, l i m l , gdje je: n= 1, 2, 3, 4,…, l= 0, 1, 2, 3,…,n–1 m l =–l,…, –1, 0, +1,…, +l atomske orbitale. Budući da je vjerovatnoća pronalaženja elektrona u prostoru udaljenom od jezgra vrlo mala, kada se govori o orbitalama, misli se na takvo područje oko atomskog jezgra unutar koje je koncentrisano 90-95% elektronskog naboja. Sa stanovišta kvantne mehanike, atomske orbitale su geometrijski prikaz valne funkcije (n, l, m l). Z Y je odredio položaj elektrona u trodimenzionalnom prostoru i Oni su stavili tačku na to mjesto, zatim kroz niz takvih definicija X bi dobio sliku u obliku prostornog oblaka Nogo tačke sa mutnim ivicama /Sl.2.3.) T Z s-orbitalni. Postoji za l=0. Vrijednost m l je također Y nula. Imamo samo jednu vrijednost m l =0. shodno tome, S-orbitala ima maksimalnu simetriju. Ona ima X sfernog oblika (Sl.2.4.). U ovom slučaju, vjerovatnoća od kretanje elektrona u cirkumnuklearnom prostoru određeno je: sl.2.4. je samo radijus vektor i ne zavisi od kuta koordinata. elektron odgovara krivulji sa maksimumom (slika 2.5.). Maksimum širenja vjerovatnoće je na 0 r 1 r,A 0 udaljenost od jezgra r 1 koja odgovara poluprečniku sl.2.5. prva Borova orbita. p-orbitala. Postoji za l=1. m l = -1, 0, +1. Z p-orbitala se pojavljuje na drugom i svim narednim Y ne može svaki nivo imati tri p-orbitale. p-orbitala X leže u prostoru u pravcu koordinata Px ose. Zovu se, respektivno, p x, p y, p z -orbitale Py (sl.2.6.). R dz 2 dx 2 y 2 dxy dxz dyz d-orbitalni. Pojavljuje se na l=2 na trećem kvantnom nivou. Na d-podnivou već može postojati pet različitih stanja elektrona, tako da d-podnivo svakog kvantnog nivoa sadrži pet d-orbitala. U ovom slučaju, m l uzima pet vrijednosti: m l = -2, -1, 0, +1, +2, d-orbitale imaju složeniji oblik od p-orbitala, ili su u obliku četiri latice ili u obliku oblik bučice sa obodom (Sl.2.7.). f-orbitalni. Pojavljuje se kada je l=3. f-orbitale mogu biti samo na četvrtom i udaljenijem nivou. Kako pri l=3 m l ima 7 vrijednosti /–3, –2, –1, 0, +1, +2, +3/, onda na f-podnivou može postojati sedam orbitala. Oblik f-orbitala je čak složeniji od oblika d-orbitala. f-orbitale su prikazane kao složene šesterokrake figure. Oblik orbitala i njegova orijentacija igraju značajnu ulogu u formiranju hemijskih veza, jer ova dva faktora određuju prirodu i stepen preklapanja elektronskih oblaka spojnih atoma. 2.1.5. Struktura elektronskih omotača atoma. Kompletna elektronsko-energetska struktura atoma je unaprijed određena skupom razmatranih kvantnih brojeva. Glavni kvantni broj n određuje ne samo broj kvantnog nivoa, već takođe ukazuje na broj podnivoa sadržanih u ovom nivou. Na primjer, kada je n=3, imamo treći kvantni nivo, koji se sastoji od tri podnivoa: s-, p-, d-podnivoa. Što je kvantni nivo udaljeniji od jezgra, što je kapacitetniji, sastoji se od više podnivoa. Broj orbitala na nivou može se odrediti formulom k n =n 2 , a broj orbitala na podnivou, kao što je već pomenuto, formulom k l =2l+1. Razmotrimo teorijsku šemu međusobnog rasporeda kvantnih nivoa i podnivoa. /Fragment za prva četiri nivoa/. Na četiri okomite linije crtamo vrijednosti kvantnih brojeva n, l, m l i m s. Sl.2.8.). Već znamo da što je veća numerička vrijednost n, to je kvantni nivo kapacitetniji. Stoga je na slici napravljena duža po visini. Druga vertikalna linija, vezana za kvantni broj l, pokazuje podelu kvantnih nivoa na podnivoe. Prvi kvantni nivo sastoji se od samo jednog podnivoa /označenog kao s-podnivo/. Drugi kvantni nivo je već podeljen na dva podnivoa: s-podnivo i p-podnivo. Treći nivo je podeljen na tri podnivoa /s, p i d/, a četvrti je podeljen na četiri podnivoa /s, p, d i f/. kvantni podnivoi orbitalnih elektrona viši nivo u orbitalama vena Fig.2.8. Treća vertikalna linija odgovara kvantnom broju m l . Ovo pokazuje podjelu kvantnog podnivoa na orbitale. Broj orbitala po podnivou je broj vrijednosti koje magnetski kvantni broj uzima. S-podnivo se sastoji od samo jedne orbitale, tako da postoji samo jedna orbitala na prvom kvantnom nivou. P podnivo se sastoji od tri orbitale. m l = -2, -1, 0, +1, +2 f-podnivo povećao je svoj kapacitet na sedam orbitala f-podnivo m l = -3, -2, -1, 0, +1, +2 +3 Četvrta vertikalna linija je dodijeljena spin kvantnom broju m s . Gledajući unaprijed, primjećujemo da ovaj kvantni broj unaprijed određuje mogući broj elektrona u orbitali. Prema odgovarajućem postulatu, u orbitali mogu biti dva elektrona, ali moraju imati različite spinove, tj. različite vrijednosti m s: +1/2 i –1/2. U tom smislu, četvrta vertikalna linija pokazuje maksimalnu zauzetost kvantnog podnivoa i nivoa elektronima. Na s-podnivou - 2 elektrona Na p-podnivou - 6 elektrona Na d-podnivou - 10 elektrona Na f-podnivou - 14 elektrona Maksimalni broj elektrona po podnivou može se odrediti formulom: Teorijski slijed rasporeda kvantnih nivoa i podnivoa izgleda ovako: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f6s6p6d6f7s7f7s7s Međutim, kada se kvantni nivoi podijele na podnivoe, gornji teoretski slijed je narušen. Određuje se stvarni raspored podnivoa Vladavina Klečkovskog, prema kojem je niz podnivoa određen ukupnom vrijednošću dva kvantna broja n i l. U slučaju kada za dva ili više podnivoa n + l ima istu vrijednost, tada prvi ide podnivo sa manjom vrijednošću n. 1s - 2s - 2p - 3s - 3p - 3d - 4s - 4p - 4d - 4f - 5s -5p - 5d - 5f (n+l) 1 2 3 3 4 5 4 5 6 7 5 6 7 8 Prema pravilu Klečkovskog, stvarni slijed podnivoa je sljedeći: 1s2s2p3s3p4s3d4p5s4d5p6s5d4f5d 2–5 6p7s6d 1 5f 6d 2–5 7str. Struktura elektronskih omotača atoma prikazana je na sljedećem dijagramu (slika 2.9.): 2.1.6. Osnovni principi raspodjele elektrona u atomu. Razmatrana elektronska ljuska atoma ispunjena je elektronima u skladu s tri principa: princip najmanje energije, Paulijev princip / pravilo / Hund. princip najmanjeg navodi da elektron u atomu zauzima onaj slobodni podnivo na kojem će imati minimalnu energetsku vrijednost. Na drugi način, elektron ostaje na podnivou na kojem se ostvaruje najjača veza sa jezgrom. Redoslijed u kojem su podnivoi ispunjeni odgovara stvarnoj lokaciji podnivoa u strukturi elektronske ljuske atoma datoj gore: 1s2s2p3s3p4s3d –… itd. /cm. iznad/. Paulijev princip/Paulijeva zabrana/ kaže da atom ne može imati ni dva elektrona sa istim vrijednostima četiri kvantna broja. Posljedica. Orbitala može sadržavati dva elektrona s različitim spinovima (tj. s različitim vrijednostima spin kvantnog broja: m s = +1/2 i m s = –1/2). Treći princip je Hundov princip ili pravilo/Hunda/. Objašnjava redosled kojim elektroni ispunjavaju kvantni podnivo. Unutar podnivoa elektroni su raspoređeni na način da njihov ukupan kvantni broj ima maksimalnu vrijednost /prvo jedan elektron po orbitali, a zatim uparivanje/. Ispravna raspodjela će biti, na primjer, tri p-elektrona na ovaj način: U zavisnosti od toga koji je podnivo ispunjen poslednjim elektronima, razlikuju se s-, p-, d-, f-elementi. s-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju s-podnivo vanjskog kvantnog nivoa. /Na primjer, natrijum, magnezijum, kalijum, kalcijum itd./. p-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju p-podnivo vanjskog kvantnog nivoa. /Na primjer, ugljenik, kiseonik, hlor itd./. D-podnivo, ispunjen poslednjim elektronima, klasifikuje elemente kao d-elemente. /Na primjer, d-elementi su titan, hrom, gvožđe, bakar, jer u ovim elementima posljednji elektroni zauzimaju d-podnivo pretposljednjeg nivoa/. f-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju f-podnivo drugog izvan kvantnog nivoa. /Na primjer, prazeodim, europijum, erbijum, itd./. 2.1.7. Slika elektronske strukture atoma pomoću elektronskih formula i kvantnih ćelija. Elektronska struktura bilo kojeg atoma predstavljena je elektronskim formulama. U elektronskim formulama, kvantni elektronski nivo je označen numeričkom vrednošću glavnog kvantnog broja n, podnivo je napisan slovnom oznakom odgovarajućeg podnivoa, a broj elektrona u podnivou je označen stepenom podnivoa oznaka. Na primjer, 3d 5 znači da postoji pet elektrona na d-podnivou 3. kvantnog nivoa. Elektronska formula bilo kojeg elementa sastoji se od kompletnog skupa takvih fragmenata, kao što je navedeno u primjeru. Dakle, elektronska formula atoma titanijuma /№22/ je: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 . Zbir svih snaga je 22, što znači da atom titana, koji ima nuklearni naboj od +22, sadrži 22 elektrona na elektronskoj ljusci, koji svojim ukupnim negativnim nabojem (–22) kompenziraju pozitivni naboj atomsko jezgro, što atom čini složenim električno neutralnim sistemom. Pogodnije je sastaviti elektronske formule nakon razmatranja strukture periodnog sistema elemenata D.I. Mendeljejeva. Gledajući unapred i na osnovu znanja stečenog u srednjoj školi, predstavićemo periodični sistem elemenata u obliku elektronskih formula. (Sl. 2.10.) Kasnije ćemo se vratiti na pisanje elektronskih formula određenog elementa u periodnom sistemu i razmotriti algoritam pomoću kojeg je lako naučiti kako napisati elektronsku formulu bilo kojeg elementa. Drugo, struktura elektronske ljuske atoma prikazana je pomoću kvantnih ćelija. IV 4s 2 3d 10 4p 6 V 5s 2 4d 10 5p 6 VI 6s 2 5d 1 4f 14 5d 9 6p 6 VII 7s 2 6d 1 5f 14 6d 9 7p 6 Već smo koristili kvantne ćelije, iako nismo uveli koncept „kvantne ćelije“. Kvantna ćelija nije ništa drugo do grafički prikaz orbitale. Prikazana je ćelijom, a elektroni u orbitali su prikazani strelicom koja stoji u ćeliji. Jedna ćelija je dodeljena za s-podnivo, pošto s-podnivo ima samo jednu orbitalu. Za p-podnivo su dodijeljene tri ćelije jer p-podnivo sadrži tri p-orbitale. D-podnivo je predstavljen sa pet ćelija, a f-podnivo sa sedam ćelija. Elektronska struktura atoma titana, za koju smo već napisali elektronsku formulu, prikazanu pomoću kvantnih ćelija, izgleda ovako: 2.1.8. O individualnosti svakog hemijskog elementa. "Lična karta" hemijskog elementa može se nazvati njegovom elektronskom formulom. Gledajući je, hemičar će reći mnogo o individualnosti ovog "hemijskog karaktera". Već znamo da je univerzalna karakteristika elementa pozitivan naboj atomskog jezgra, a ako pogledate još dublje, onda broj pozitivno nabijenih elementarnih čestica - protona. Povećanje njihovog broja dovodi do nagle promjene svojstava. Počinje djelovati univerzalni zakon prirode - zakon prelaska količine u kvalitet. Međutim, na promjenu kvalitativnih pokazatelja elementa ne utječe samo broj protona, već i broj neutrona u jezgru. Kao što je već napomenuto, elementi koji imaju isti broj protona u jezgri, ali različit broj neutrona nazivaju se izotopi. Svaki element ima svoj broj izotopa: jedan ima više, drugi manje. Kada je u tabeli D.I. Mendeljejev označava atomsku masu elementa kao razlomak, to ne znači da u jezgru postoji razlomak elementarnih čestica, u ovom slučaju se uzima prosječna atomska masa svih izotopa datog elementa, uzimajući u obzir njihov kvantitativni sadržaj u prirodi. Ali ako u egzaktnim eksperimentima koristimo takvu "prosječnu" atomsku masu, onda to neće biti sasvim točno, jer nakon "prosječenja" ovaj izotop gubi svoju individualnost, posebno ako je izotop radioaktivan. U praksi, oni još više odstupaju od prave vrijednosti kada koriste ne atomsku masu, već maseni broj "A", tj. cijeli broj najbliži atomskoj masi. Možda je, kada se razmatraju individualne karakteristike elementa, bolje uzeti atomsku masu izotopa koja je u prirodi procentualno veća, odnosno onaj koji je najstabilniji /ili nestabilniji/, ako je riječ o radioaktivnom elementi. Kao što vidite, zakon prelaska količine u kvalitet za hemijske elemente se sprovodi u dva pravca: proton i neutron. Prema protonu: pojava sljedećeg protona u jezgru naglo dovodi do novog elementa, a prema neutronu: proširuje kvalitet ovog elementa do pojave radioaktivnosti. To se može vidjeti na primjeru vodonika. Ako se jezgru vodika doda proton, onda se već time poriču svi kvaliteti vodonika kao elementa /datog pojedinca/ i pretvara ga u novi element - helijum /tj. u novu osobu. Dodatak neutrona ne negira sam element vodonika, već širi granice njegove kvalitete, formirajući izotop vodika 2 1 H / koji se naziva deuterijum 2 1 D / a zatim izotop 3 1 H / koji se zove tricij 3 1 T / . Sa povećanjem broja neutrona, element dobiva dodatne karakteristike, u ovom slučaju radioaktivnost. Ispoljavanje radioaktivnih svojstava pojedinačnim izotopima daje takvim elementima posebnu individualnost, moglo bi se reći opasnu individualnost, ako elemente posmatramo sa ekološkog stanovišta. AT Slični sažetci: Van't Hoffovo pravilo. Arrheniusova jednadžba i njena primjena. Teorija aktivnih sudara reagujućih molekula. Osnove teorije prelaznog stanja. Kinetika heterogenih reakcija. Osobine heterogenih procesa. Homogena i heterogena kataliza. Primjena zakona djelovanja mase za reakcije na površinama. Algoritmi za izvođenje kinetičkih jednačina za linearne mehanizme zasnovani na metodama teorije grafova. Primjena teorije grafova u kemijskoj kinetici. Niz orijentisanih lukova. Toplotni efekat hemijske reakcije ili promena entalpije sistema usled hemijske reakcije. Uticaj spoljašnjih uslova na hemijsku ravnotežu. Utjecaj tlaka, koncentracije i temperature na ravnotežni položaj. Vrste hemijskih veza. Pojam i vrste složenih reakcija. Reverzibilne reakcije različitog reda. Najjednostavniji slučaj dvije paralelne ireverzibilne reakcije prvog reda. Mehanizam i faze uzastopnih reakcija. Osobine i brzina lančanih i spregnutih reakcija. Problemi hemijske kinetike, faze hemijskog procesa. Otvoreni i zatvoreni sistemi, zakon održanja mase i energije. Hesov zakon i njegova posljedica, brzina reakcija. Fenomen katalize, homogene, heterogene, redoks reakcije. Kod heterogene katalize katalizator i reaktanti su u različitim fazama, najčešće je katalizator čvrsta, a reaktanti su u tekućem ili plinovitom stanju, a reakcija se odvija na granici između dvije faze, odnosno na površini. katalizatora. Poeto... Pojam i predmet proučavanja hemijske kinetike. Brzina hemijske reakcije i faktori koji na nju utiču, metode merenja i značaj za različite industrije. Katalizatori i inhibitori, razlika u njihovom djelovanju na kemijske reakcije, primjena. Klasifikacija katalizatora zasniva se na određenom skupu svojstava ili karakteristika. Klasifikacija prema vrsti supstanci, stepenu diskretnosti i kolektivnosti delovanja, prema specifičnostima elektronske strukture. Upotreba u hemijskim reakcijama. Teorijski dio. Odjeljak hemije koji proučava brzinu i mehanizam fizičkih i hemijskih procesa naziva se hemijska kinetika. Kinetika vam omogućava da saznate prave mehanizme procesa. U hemijskoj kinetici razlikuju se homogeni i heterogeni procesi. Tumačenje trimolekulskih reakcija prema Trautzu. Konačna jednačina za brzinu reakcije svjetlosti. Koncept efikasne energije aktivacije. Formule za kvazistacionarne koncentracije slobodnih valencija. Osobitosti nerazgranatih lančanih procesa. Ovisnost kemijske reakcije o koncentraciji reaktanata pri konstantnoj temperaturi. Brzina hemijskih reakcija u heterogenim sistemima. Uticaj koncentracije početnih supstanci i produkta reakcije na hemijsku ravnotežu u homogenom sistemu. Pojmovi kataliza, katalizator i katalitički proces, njihove različite definicije. Mehanizmi za ubrzavanje reakcija katalizatorima. Hemijska (nebiološka) kataliza. Sinteza dietil etera iz alkohola uz učešće sumporne kiseline. Teorije katalize. Hemijska kinetika i njen značaj u kontroli hemijskih procesa. Klasifikacija reakcija prema protočnim medijima, njihove karakteristike. Brzina hemijskih reakcija, njena zavisnost od temperature okoline i prisustva svetlosti. Princip rada katalizatora. Proces grananja lanca. Fotohemijska inicijacija. Efikasna energija aktivacije. Aktivni centri, načini njihovog formiranja i gašenja. parcijalni pritisak. Tumačenje granica paljenja lanca. Praksa i teorija nuklearne eksplozije. Brzina hemijske transformacije na površini u stacionarnom režimu. Difuzijski i kinetički način rada. površinska adsorpcija. Površinski heterogeni katalitički proces. Ograničavajući režimi razgranate lančane reakcije. Grananje i lomljenje. Definicija katalize i njena uloga u industriji. Selektivnost i opšte ideje o pojmu "mehanizam hemijske reakcije". Klasifikacija katalitičkih sistema po fazama i tipovima reakcija. Adsorpcija i osnovni zahtjevi za industrijske katalizatore.



karakterizirana su stanja 2 i 5. Dakle, upravo ona odgovaraju stabilnom stanju atoma.
Osnove hemije
 Može postojati samo jedna projekcija sfernog podnivoa. (Sl. 2.1.), koji ima vrijednost "nula". Dakle, postoji samo jedna s-orbitala na s-podnivou.
Može postojati samo jedna projekcija sfernog podnivoa. (Sl. 2.1.), koji ima vrijednost "nula". Dakle, postoji samo jedna s-orbitala na s-podnivou. elektronski oblak. Ako u svakom trenutku
elektronski oblak. Ako u svakom trenutku koji oblak naboja se naziva oblak elektrona. Njegova gustina, proporcionalna 2 , je direktna mjera vjerovatnoće pronalaska elektrona. Granična površina oblaka, koja sadrži 90-95% naboja elektrona, daje oblik orbite.
koji oblak naboja se naziva oblak elektrona. Njegova gustina, proporcionalna 2 , je direktna mjera vjerovatnoće pronalaska elektrona. Granična površina oblaka, koja sadrži 90-95% naboja elektrona, daje oblik orbite.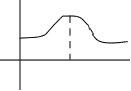 Radijalna raspodjela elektronske gustine za 1s
Radijalna raspodjela elektronske gustine za 1s Pz nivoi. Pošto m l ima tri vrijednosti, onda na p-podnivoima
Pz nivoi. Pošto m l ima tri vrijednosti, onda na p-podnivoima ima oblik pehara. Sve tri p-orbitale su locirane
ima oblik pehara. Sve tri p-orbitale su locirane Slika 2.6. Z Y Y Z Z
Slika 2.6. Z Y Y Z Z

f
4f
d
4d
str
4p
s
4s
d
3d
str
3p
s
3s
n=2
––
str
2p
s
2s
n=1
–
s
1s
6p
6s
4d
5s
3d
4s
3s
2s
1s
Sl.2.9.
I
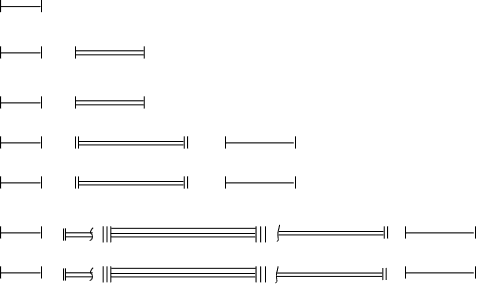
 1s2
1s2II 2s 2 2p 6
4p
3d
3p
2p






