Raspodijelite silikonske elektrone među kvantnim ćelijama. Raspodjela elektrona vanadijuma po kvantnim ćelijama
Zadaci za dio 1
Uzorak izvršenja zadaća
Struktura atoma
Zadatak 1. a) Navedite numeričke vrijednosti glavnog i orbitalnog kvantnog broja ovih podnivoa, izračunajte redoslijed njihovog punjenja: 5 str, 7str, 7s.
Rješenje. 5str 7str 7s
Značenje n 5 7 7
Značenje l 1 1 0
Suma ( n +l ) 6 8 7
Redoslijed popunjavanja (na osnovu pravila Klečkovskog):
1 – 5str; 2 – 7s; 3 – 7str.
b) Distribuirati po kvantnim ćelijama valentnih elektrona 2s 2 2str 4, odrediti hemijski element i njegovu poziciju u D.I. Mendeljejev (broj perioda, grupa, podgrupa).
Rješenje. Valentni elektroni u kvantnim ćelijama su raspoređeni na sljedeći način: 2 s 2 2str 4
Predloženi element kiseonik nalazi se u drugom periodu, šestoj grupi, glavnoj podgrupi periodnog sistema D.I. Mendeljejev.
u) Napišite elektronske formule atoma i jona, navedite njihov položaj u D.I. Mendeljejev (broj perioda, grupa, podgrupa): K, Zn 2+ .
Rješenje. Elektronska formula hemijskog elementa kalijuma je sljedeća: 1 s 2 2s 2 2str 6 3s 2 3str 6 4s jedan . Nalazi se u četvrtom periodu, prvoj grupi, glavnoj podgrupi periodnog sistema D.I. Mendeljejev. Elektronska formula katjona Zn 2+: 1 s 2 2s 2 2str 6 3s 2 3str 6 3d 10 . Hemijski element cink se nalazi u četvrtom periodu, druga grupa, sporedna podgrupa.
Uradite isto za sve zadatke.
STRUKTURA ATOMA
U Periodnom sistemu D. I. Mendeljejeva (Tabela P.4) sve poznatih elemenata. Sastoji se od sedam perioda (1-3 - mali, 4-7 - veliki), 8 grupa. Svaka grupa je podijeljena na glavne i sekundarne podgrupe. Glavna podgrupa sadrži elemente malih i velikih perioda, a sporedna samo velike.
Primjer 1 Navedite u periodičnom sistemu D.I. Mendeljejevski položaj (broj perioda, broj grupe, glavna ili sekundarna podgrupa) atoma elementa s nuklearnim nabojem od 85.
Rješenje. Element (85 At) je u 6. periodu, 7. grupa, glavna podgrupa.
Atomi elemenata sastoje se od pozitivno nabijenog jezgra (protona i neutrona) i elektrona. Broj elektrona jednak je atomskom broju elementa. Stanje elektrona u atomu karakteriziraju kvantni brojevi n,l,ml i ms, koji su imenovani respektivno najvažnije, orbitalni, magnetni i spin.
Redoslijed popunjavanja orbitala elektronima određen je sljedećim pravilima V. Klečkovskog:
punjenje se odvija uzlaznim redoslijedom iznosa ( n + l);
Pri istim vrijednostima ove sume prvo se popunjava podnivo sa nižom vrijednošću glavne vrijednosti kvantni broj n.
Redoslijed punjenja elektrona nivoi energije a podnivoi u višeelektronskim atomima imaju oblik
1s<2s<2str<3s<3str<4s<3d <4str<5s<4d <5str<6s<5d 4f<6str <7s<6d 5f<7str.
Primjer 2. Koristeći pravila Klečkovskog izračunajte koji podnivo je prvi ispunjen elektronima 4 R ili 5 s.
Rješenje. Za 4 R-podnivo lok + l= 4 + 1 = 5; za 5 s-podnivo Sn+l= 5 + 0 = 5. Pošto je zbir isti, prvo se popunjava podnivo sa nižom vrednošću n, tj. 4 R.
Primjer 3 Prema raspodjeli valentnih elektrona - 3d 5 4s 2 Odredite koji je element, označite njegov simbol i napišite kompletnu elektronsku formulu.
Rješenje. Vrijednost glavnog kvantnog broja posljednjeg energetskog nivoa odgovara soba period, tako da je element u 4. period. Zbir valentnih elektrona pokazuje soba grupa u kojoj se element nalazi, u ovom slučaju broj grupe 7. Pošto su valentni elektroni uključeni d-podnivo, onda je ovo element bočna podgrupa: 25 Mn 1 s 2 2s 2 2str 6 3s 2 3str 6 3d 5 4s 2 .
Primjer 4. Napišite potpunu elektronsku formulu atoma elementa s nuklearnim nabojem 22.
Rješenje. 22 Ti 1 s 2 2s 2 2str 6 3s 2 3str 6 3d 2 4s 2 .
Primjer 5. Napišite kompletne elektronske formule jona Fq, Sn 2+.
Rješenje. Kada se formira negativno nabijeni ion, neutralni atom elementa prihvata elektrone: F 0 + 1 ē = Fq, elektronska formula jona 9 Fq1 s 2 2s 2 2str 6. Pozitivno nabijeni ion se dobija kada neutralni atom elementa odustane od elektrona: Sn 0 - 2 ē = Sn 2+ ; elektronska formula jona 50 Sn 2+ 1 s 2 2s 2 2str 6 3s 2 3str 6 3d 10 4s 2 4str 6 4d 10 5s 2 5str 0 .
Zadaci za dio 1
Svaki zadatak sadrži tri pitanja(a B C).
| Broj posla | a) Navedite numeričke vrijednosti glavnog i orbitalnog kvantnog broja ovih podnivoa, izračunajte redoslijed njihovog punjenja | b) Rasporediti valentne elektrone među kvantnim ćelijama, odrediti hemijski element i njegovu poziciju u sistemu D.I. Mendeljejeva (broj perioda, grupa, podgrupa) | c) Napišite elektronske formule predloženih atoma i jona, navedite njihov položaj u sistemu D.I. Mendeljejeva (broj perioda, grupa, podgrupa) |
| 3str; 4s; 2str | 3d 1 4s 2 | Fe, Na+ | |
| 3d; 4str; 3str | 3d 2 4s 2 | Co, Cl- | |
| 5d; 4str; 4d | 3d 3 4s 2 | Ni, Ba2+ | |
| 3d; 4f; 5s | 3d 5 4s 1 | Zn, Ca2+ | |
| 4d; 4s; 5s | 4d 5 5s 2 | Sn, S 2- | |
| 6s; 4str; 4f | 3d 6 4s 2 | W, U 3+ | |
| 3d; 5s; 7str | 3d 7 4s 2 | S, La 3+ | |
| 4d; 6s; 5d | 3d 8 4s 2 | Ž, Tl 3+ | |
| 4str; 5str; 4f | 3d 10 4s 1 | Br, Zr 4+ | |
| 3d; 3str; 2s | 3d 10 4s 2 | Al, Hg2+ | |
| 5d; 3s; 6s | 4s 2 4str 1 | Pb, Au 3+ | |
| 6d; 4f; 5str | 4s 2 4str 2 | Ge, Ag+ | |
| 5d; 3str; 4d | 4 s 2 4str 3 | Ga, Sb 3+ | |
| 7s; 6str; 4d | 4s 2 4str 4 | N, Bi 3+ | |
| 5d; 4str; 3d | 4s 2 4str 5 | Cl, Pb 2+ | |
| 5s; 6s; 4str | 4s 2 4str 6 | Y, Hf 4+ | |
| 6str; 5f; 6d | 5d 7 6 s 2 | Zr, At- | |
| 5d; 5s; 4f | 5d 10 6 s 2 | Ta, Ga 3+ | |
| 3s; 4d; 3str | 5d 3 6 s 2 | Cr, Se 2- | |
| 5f; 4d; 4s | 5d 5 6 s 2 | Mo, Cu 2+ |
Predavanje 5. GLAVNI KVANTNI BROJ (n) Broj (n) karakteriše ukupnu energiju elektrona u atomu. Može uzeti vrijednosti cijelih brojeva: 1, 2, 3 ... n Svaka vrijednost kvantnog broja n ima svoj energetski nivo. Broj energetskih nivoa u atomu naseljen elektronima jednak je broju perioda u kojem se element nalazi u periodnom sistemu.

GLAVNI KVANTNI BROJ (n) Na primjer, elektroni u atomu bilo kojeg elementa koji pripada trećem periodu nalaze se na tri energetska nivoa. Elektroni koji se nalaze na energetskom nivou najbližem nizu (n=1) imaju najnižu energiju. Kada apsorbuje kvantnu energiju (E=hν), elektron prelazi na viši energetski nivo. Kada se kreće na niži nivo, elektron emituje kvantum energije. (nastavak)

ORBITALNI KVANTNI BROJ (ɭ) Broj ɭ određuje oblik orbitale, a time i elektronskog oblaka. Može uzeti vrijednost od nule do n-1: ɭ = 0, 1, 2, 3 … n-1 Na primjer, ako je glavni kvantni broj četiri (n=4), tada ɭ uzima vrijednosti 0, 1, 2, 3.

Elektroni s istim vrijednostima broja n, ali različitim (ɭ), donekle se razlikuju po energiji. Stoga se kaže da se elektroni datog energetskog nivoa grupišu u energetske podnivoe. ORBITALNI KVANTNI BROJ (ɭ) Ovim podnivoima su dodijeljene sljedeće slovne oznake: Orbitalni kvantni broj (l) Oznaka energetskog podnivoa s p d f (nastavak)

Broj podnivoa u svakom energetskom nivou jednak je njegovom kvantnom broju, tj. broj ovog nivoa. Prvi energetski nivo (n=1) sastoji se od jednog s - podnivoa; drugi (n=2) - sa dva (s; p) podnivoa; treći (n=3) - od tri (s; p; d) podnivoa; četvrti (n=4) – od četiri (s; p; d; f) podnivoa: Glavni kvantni broj (n) (broj nivoa) Vrste podnivoa s s, p s, p, d s, p, d, f ORBITALNI KVANTNI BROJ ( ɭ ) (nastavak)

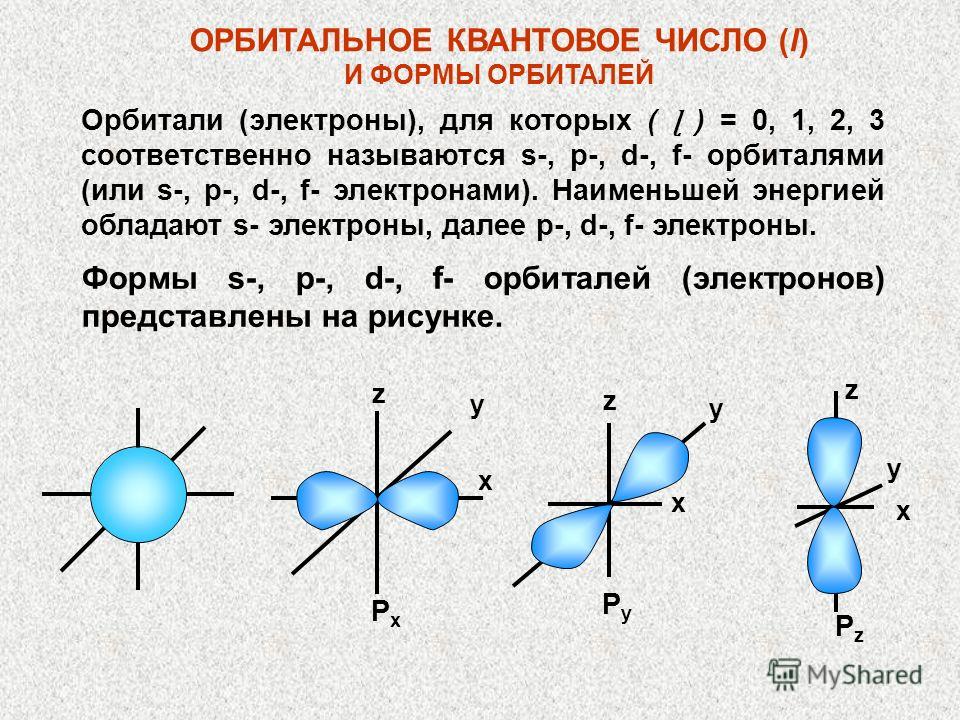
ORBITALNI KVANTNI BROJ (l) I ORBITALNI OBLICI Orbitale (elektroni) za koje je (ɭ) = 0, 1, 2, 3 respektivno se nazivaju s-, p-, d-, f-orbitale (ili -, f- elektroni). Najmanju energiju imaju S-elektroni, zatim p-, d-, f-elektroni. Oblici s-, p-, d-, f-orbitala (elektrona) prikazani su na slici. x x x z PyPy PzPz y y y z z PxPx
Broj m karakterizira prostorni raspored orbitala (oblaka). Može uzeti sve cjelobrojne vrijednosti od – ɭ do + ɭ, uključujući nulu: m = – l … 0 … + l Na primjer: sa ɭ = 2 imamo m = – 2, – 1, 0, + 1, + 2 m zavisi od orbitalnog kvantnog broja i označava broj energetskih stanja (orbitala) u kojima elektron datog podnivoa može biti (sa datom vrednošću ɭ). Broj orbitala sa datom vrijednošću (ɭ) je 2 ɭ + 1 MAGNETSKI KVANTNI BROJ (m)

ODNOS MAGNETNIH I ORBITALNIH KVANTNIH BROJEVA Orbitalni kvantni broj (ɭ) Magnetski kvantni broj (m) Broj orbitala (oblaka) – 1, 0, + 1 – 2, – 1, 0, + 1, + 2 –3, – 2 , – 1, 0, +1, +2,

KVANTNE ĆELIJE (ORBITALE) Svaka orbitala je obično predstavljena pravougaonikom koji se još naziva i kvantna ćelija s - podnivo se sastoji od 1 ćelije p - podnivo se sastoji od 3 ćelije d - podnivo se sastoji od 5 ćelija f - podnivo se sastoji od 7 ćelija s p d f

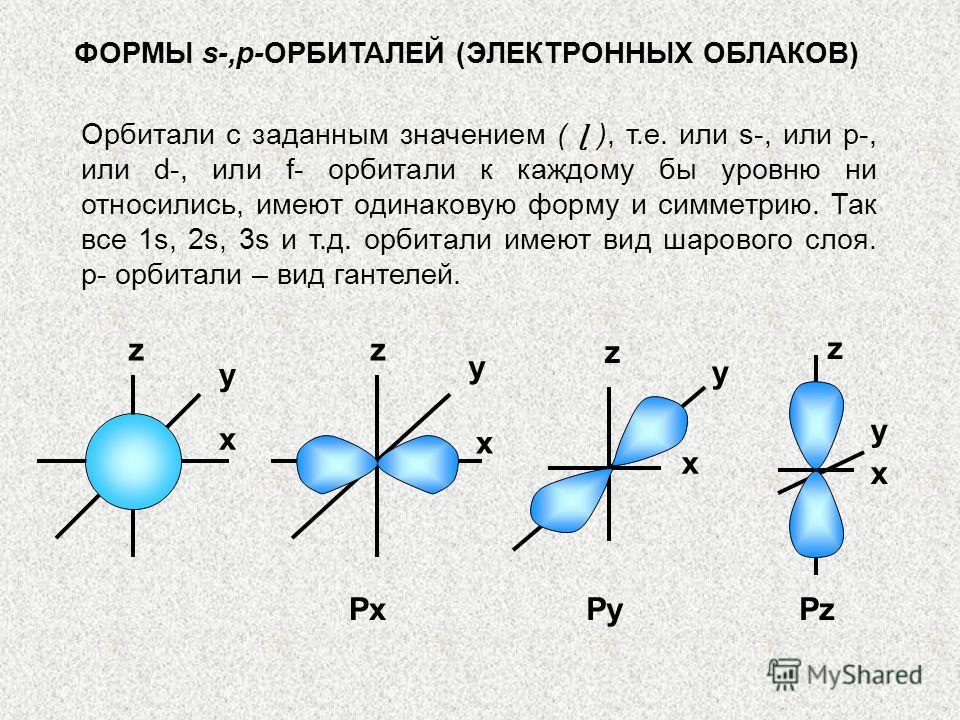
OBLICI s-,p-ORBITALA (ELEKTRONSKI OBLACI) Orbitale sa datom vrijednošću (ɭ), tj. ili s-, ili p-, ili d-, ili f-orbitale na svakom nivou, imaju isti oblik i simetriju. Dakle, sve je 1s, 2s, 3s, itd. orbitale su sferne. p-orbitale su vrsta bučice. x x x x y z PxPyPz y y y z z z
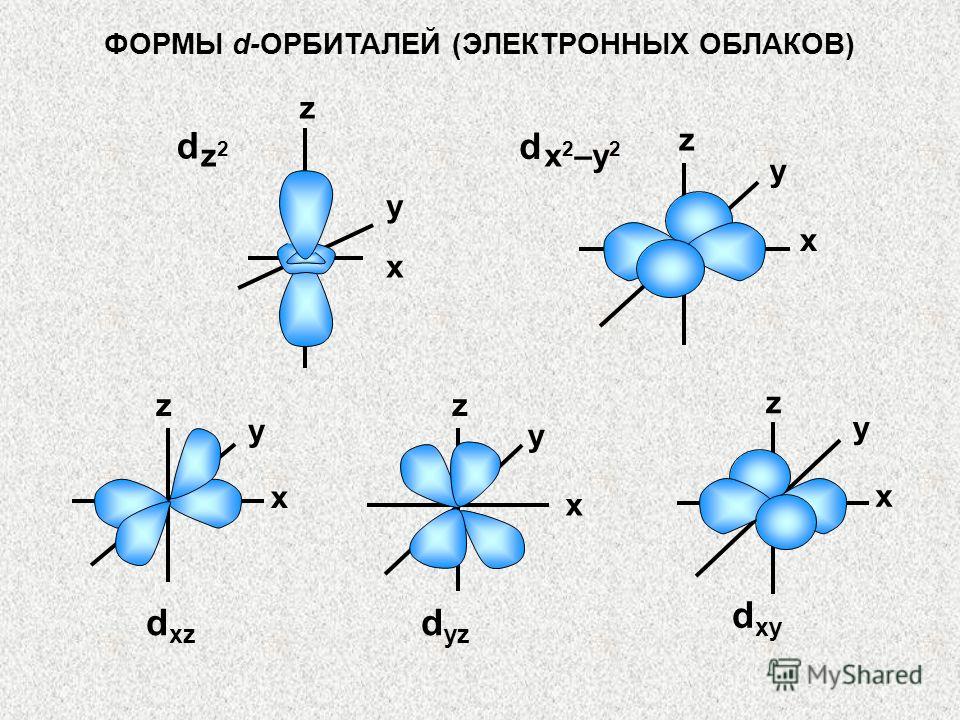
SPIN KVANTNI BROJ (S) Za datu vrijednost m, broj s može imati samo dva značenja: Hipoteza da elektron ima tzv. spin iznesena je 1925. (u početku se - radi jasnoće - vjerovalo da je ovo fenomen je sličan rotaciji Zemlje oko svoje ose dok se kreće u orbiti oko Sunca). + ½ i – ½ U stvari, spin je čisto kvantno svojstvo elektrona koji nema klasične analoge. Strogo govoreći, spin je pravi ugaoni moment elektrona, koji nije povezan sa kretanjem u prostoru. Za sve elektrone, apsolutna vrijednost spina je uvijek s = 1/2. Projekcija spina na osu Z (magnetski spin broj) može imati samo dvije vrijednosti: m S = +1/2 ili m S = -1/2.

"Ne mogu postojati dva elektrona u atomu sa istim vrijednostima sva četiri kvantna broja." Pošto AO karakterišu tri kvantna broja n, l, m, onda ne može sadržati više od dva elektrona sa suprotnim spinovima: PAULIJSKI PRINCIP X e = 2 (2l + 1); s–2; p–6; d - 10; f – 14 Maksimalan broj elektrona je: Na podnivou: Na nivou: N = 2n2

„Prilikom popunjavanja nivoa i podnivoa elektronima, redosled postavljanja elektrona u atom treba da odgovara njihovoj najvećoj povezanosti sa jezgrom, tj. elektron mora imati najnižu energiju." PRINCIP NAJMANJE ENERGIJE Ovaj princip izražava opšte termodinamičke zahteve za stabilnost sistema: maksimalna stabilnost odgovara minimalnoj energiji. U praksi se "princip najmanje energije" primjenjuje u obliku pravila Klečkovskog:

Uporedimo rezervu energije na podnivoima: 4s 
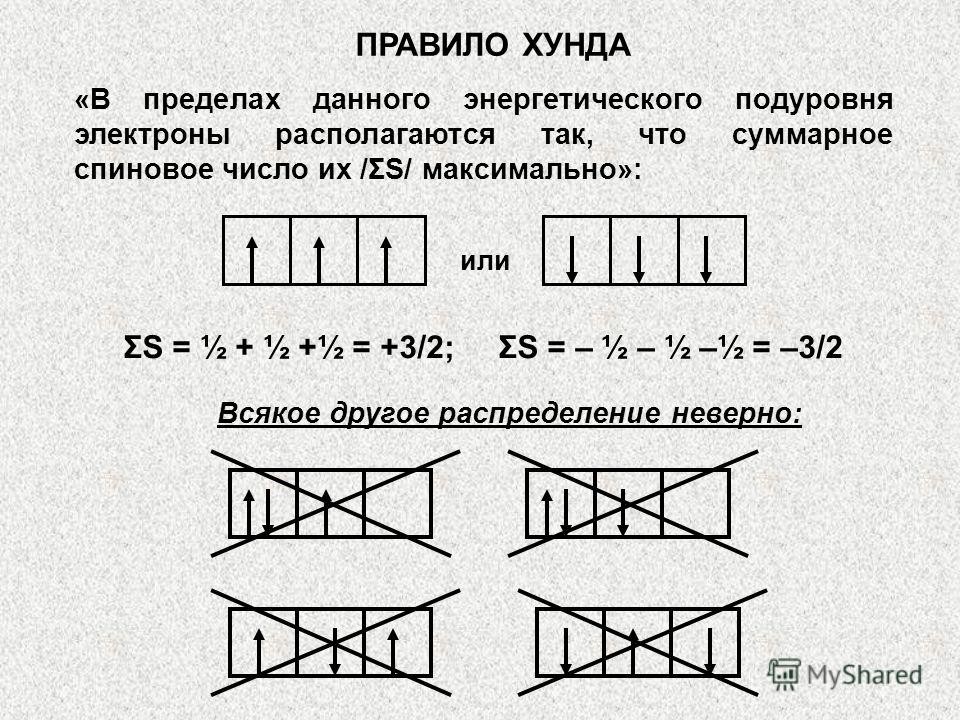
Na podnivoima 3d, 4p i 5s zbir (n+l) je jednak 5: PODNIVO (n + l) 3+2=5 4+1=5 5+0=5 3d 4p 5s 1s2s2p3s4s3d4p5s4d5p6s4f5d Klechkovsky's's rule. Primjer 2: U ovom slučaju prvo se popunjava podnivo sa nižom vrijednošću glavnog kvantnog broja n, tj. u sljedećem nizu: 3d 3p 5s Općenito, popunjavanje nivoa i podnivoa ide sljedećim redoslijedom: 6p7s5f6d6p7s5f6d


U elektronskim formulama, slova s, p, d, f označavaju energetske elektrone. Brojevi ispred slova označavaju energetski nivo na kojem se nalazi dati elektron, a indeks u gornjem desnom uglu je broj elektrona na ovom podnivou. Zapis 5p 3 znači da postoje tri elektrona na p-podnivou peti energetski nivo. ELEKTRONSKA FORMULA ATOMA

Prilikom sastavljanja elektronske formule atoma bilo kojeg elementa, mora se voditi sljedećim redoslijedom: 1. Odrediti redni broj elementa (i, shodno tome, broj elektrona u atomu); 2. Odrediti broj energetskih nivoa na kojima će se nalaziti elektroni /po broju perioda/; 3. Rasporediti elektrone na podnivoe i nivoe, vodeći se zahtjevima glavnih odredbi. ELEKTRONSKA FORMULA ATOMA

4. Rasporedite elektrone po energetskim nivoima i podnivoima, rukovodeći se zahtevima Paulijevog pravila, Klečkovskog i Hundovog pravila, kao i sledećom tabelom: ELEKTRONSKA FORMULA ATOMA Broj nivoa Broj podnivoa Tipovi podnivoa Broj orbitala Maks. broj elektrona po podnivou 11 1s s 2p s 3p 3d s 4p 4d 4f
1. Sastavite elektronsku formulu atoma sumpora: 1. Sumpor ima serijski broj 16: ima samo 16 elektrona u atomu 2. Sumpor je u trećem periodu: 16 elektrona se nalazi na tri nivoa energije: 1s 2s2p 3s3p3d 3. Rasporedimo 16 elektrona po energetskim podnivoima u skladu sa principom najmanje energije i Paulijevim principom: 16 S - 1s 2 2s 2 2p 6 3s 2 3p 4 - formula atoma sumpora. SASTAVLJANJE ELEKTRONSKE FORMULE ATOMA

2. Sastavite formulu atoma (Ca) kalcijuma: 1. Serijski broj Ca = 20: u atomu ima 20 elektrona 2. Ca je u četvrtom periodu: 20 elektrona se nalazi na četiri nivoa: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. Podijeli 20 elektrona: 20 Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 0 4s 2 ili 1s 2 2s 2 2p 6 3s 6 4 s

3. Sastavite formulu atoma titana /Ti/: 1. Serijski broj Ti = 22: u atomu ima 22 elektrona 2. Ti je u 4. periodu: elektroni se nalaze na 4 nivoa: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 3. Podijelite 22 elektrona na podnivoe, ispunjavajući zahtjeve Paulijevog principa i principa najmanje energije: 22 Ti - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 ili 22 Ti2 - 1s 2 2 2p 6 3s 2 3p 6 3d 2 4s 2 SASTAVLJANJE ELEKTRONSKE FORMULE ATOMA

4. Sastavite formulu atoma cerija (Ce): 1. Serijski broj Ce = 58: u atomu se nalazi 58 elektrona 2. Ce je u šestom periodu: 58 elektrona se nalazi na šest nivoa: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p … 3. Rasporedi 58 elektrona po podnivoima 58 Ce – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 6s 2 p 6 2 p 6 2 5 4f (n + l = = 7) 5p (n + l == 6) 5s (n + l == 5) 6s (n + l == 6) 5s 5p 6s 4f

U zavisnosti od toga koji je podnivo ispunjen elektronima, svi elementi se dele u četiri tipa (familije): 1) S - elementi: ispunjen je S-podnivo spoljašnjeg nivoa. Njihova opšta formula je: … nS 2 n – broj perioda S-elementi uključuju prva dva elementa svakog perioda. 2) P-elementi: P-podnivo eksternog nivoa je ispunjen. Njihova opšta formula je: … nS 2 n P 1–6 P-elementi uključuju poslednjih šest elemenata svakog perioda /osim 1. i 7./. ČETIRI VRSTE ELEMENATA

3) d - elementi: ispunjavaju d-podnivo drugog nivoa spolja. Njihova opšta formula je: ... (n-1) d 1-10 nS 2 Na spoljašnjem nivou imaju 2 ponekad 1 elektron (s 1-2). D-elementi uključuju 10 elemenata velikih perioda koji se nalaze između s- i p-elemenata. ČETIRI VRSTE ELEMENATA ili (n-2) f 1-14 (n-1) d 1 nS 2 4) f - elementi: ispunjavaju d-podnivo drugog nivoa spolja. Njihova opšta formula je: ... (n-2) f 1-14 nS 2 f-elementi uključuju lantanoide i aktinide

Sastavljanje elektronskih konfiguracija atoma bez pomoći periodnog sistema Da biste to uradili, morate znati: 1. Koliko elemenata sadrži period: period Broj elemenata u periodu = 18 3 = 36 4 = 54 5 = 86 6 nije završeno

2. Da su prva dva elementa u periodu S-elementi. 3. Zadnjih šest elemenata svakog perioda (osim 1. i 7.) su p-elementi elemenata (počevši od 3.) velikih perioda - to su d-elementi. 5. Lantan (57 La) prati 4f elementa. 6. Nakon aktinijuma (89 Ac), slijedi 5f elemenata Kompilacija elektronskih konfiguracija atoma bez pomoći periodnog sistema

3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = 0, postoji samo jedan" title="(!LANG: Rješenje 3. Ne, jer za d-podnivo l = 2 , što je moguće samo za vrijednosti n > 3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = O, postoji samo jedan" class="link_thumb"> 34 !} Rešenje 3. Ne, jer je za d-podnivo l = 2, što je moguće samo za vrednosti n > 3. Rešenje 4. Svaki AO karakterišu tri vrednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Kod l = 0 postoji jedna vrijednost m l = 0 (jedan AO), a kod l = 1 postoje tri vrijednosti m l = 1 , 0, + 1 (ukupno tri AO), dakle, ukupan broj AO na L-nivou je četiri. PRIMJERI i IZAZOVI 3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = 0 postoji samo jedan "> 3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti kvantnih brojeva: n, l , m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Kod l = 0 postoji jedna vrijednost m l = 0 (jedan AO), a kod l = 1 postoje tri vrijednosti m l = 1, 0, + 1 (ukupno tri AO), dakle, ukupan broj AO na L-nivou je četiri. PRIMJERI i PROBLEMI "> 3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti od kvantni brojevi: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = 0, postoji samo jedan" title="(!LANG: Rješenje 3. Ne, jer za d-podnivo l = 2 , što je moguće samo za vrijednosti n > 3. Rješenje 4. Svaki AO karakteriziraju tri vrijednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = O, postoji samo jedan"> title="Rešenje 3. Ne, jer je za d-podnivo l = 2, što je moguće samo za vrednosti n > 3. Rešenje 4. Svaki AO karakterišu tri vrednosti kvantnih brojeva: n, l, m l. Nivo L (n = 2) ima dva podnivoa: l = 0 i l = 1. Za l = 0 postoji samo jedan"> !}
Razmatrana elektronska ljuska atoma ispunjena je elektronima u skladu sa tri principa: princip najmanje energije, Paulijev princip / pravilo / Hund.
Princip najmanjeg glasi da elektron u atomu zauzima slobodni podnivo na kojem će imati minimalnu energetsku vrijednost. Na drugi način, elektron ostaje na podnivou na kojem se ostvaruje najjača veza sa jezgrom.
Redoslijed popunjavanja podnivoa odgovara gore navedenom stvarnom rasporedu podnivoa u strukturi elektronske ljuske atoma:
1sà2sà2pà3sà3pà4sà3d –… itd. /cm. iznad/.
Paulijev princip /Paulijeva zabrana/ kaže da atom ne može imati ni dva elektrona sa istim vrijednostima četiri kvantna broja.
Posljedica. Orbitala može sadržavati dva elektrona s različitim spinovima (odnosno s različitim vrijednostima spin kvantnog broja: ms = +1/2 i ms = –1/2).
Treći princip je princip ili pravilo Gunda /Hunde/. Objašnjava redosled kojim elektroni ispunjavaju kvantni podnivo. Unutar podnivoa elektroni su raspoređeni na način da njihov ukupan kvantni broj ima maksimalnu vrijednost /prvo jedan elektron po orbitali, a zatim uparivanje/. Ispravna raspodjela će biti, na primjer, tri p-elektrona na ovaj način:
U zavisnosti od toga koji je podnivo ispunjen poslednjim elektronima, razlikuju se s-, p-, d-, f-elementi.
s-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju s-podnivo vanjskog kvantnog nivoa. /Na primjer, natrijum, magnezijum, kalijum, kalcijum itd./.
p-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju p-podnivo vanjskog kvantnog nivoa. /Na primjer, ugljenik, kiseonik, hlor itd./.
D-podnivo, ispunjen poslednjim elektronima, klasifikuje elemente kao d-elemente. /Na primjer, d-elementi su titan, hrom, gvožđe, bakar, jer u ovim elementima posljednji elektroni zauzimaju d-podnivo pretposljednjeg nivoa/.
f-elementi su oni elementi u čijim atomima posljednji elektroni zauzimaju f-podnivo drugog izvan kvantnog nivoa. /Na primjer, prazeodim, europijum, erbijum, itd./.
2.1.7. Slika elektronske strukture atoma pomoću elektronskih formula i kvantnih ćelija.
Elektronska struktura bilo kojeg atoma predstavljena je elektronskim formulama. U elektronskim formulama, kvantni elektronski nivo je označen numeričkom vrednošću glavnog kvantnog broja n, podnivo je napisan slovnom oznakom odgovarajućeg podnivoa, a broj elektrona u podnivou je označen stepenom podnivoa oznaka. Na primjer, 3d5 znači da postoji pet elektrona na d-podnivou 3. kvantnog nivoa. Elektronska formula bilo kojeg elementa sastoji se od kompletnog skupa takvih fragmenata, kao što je navedeno u primjeru. Dakle, elektronska formula atoma titanijuma /№22/ je: 1s22s22p63s23p64s23d2. Zbir svih snaga je 22, što znači da atom titana, koji ima nuklearni naboj od +22, sadrži 22 elektrona na elektronskoj ljusci, koji svojim ukupnim negativnim nabojem (–22) kompenziraju pozitivni naboj atomsko jezgro, što atom čini složenim električno neutralnim sistemom.
Pogodnije je sastaviti elektronske formule nakon razmatranja strukture periodnog sistema elemenata D.I. Mendelejeva. Gledajući unapred i na osnovu znanja stečenog u srednjoj školi, predstavićemo periodični sistem elemenata u obliku elektronskih formula. (Sl. 2.10.) Kasnije ćemo se vratiti na pisanje elektronskih formula određenog elementa u periodnom sistemu i razmotriti algoritam pomoću kojeg je lako naučiti kako napisati elektronsku formulu bilo kojeg elementa. Drugo, struktura elektronske ljuske atoma prikazana je pomoću kvantnih ćelija.

 I 1s2
I 1s2
II 2s2 2p6
VI 6s2 5d1 4f14 5d9 6p6
VII 7s2 6d1 5f14 6d9 7p6
Već smo koristili kvantne ćelije, iako nismo uveli koncept „kvantne ćelije“. Kvantna ćelija nije ništa drugo do grafički prikaz orbitale. Prikazana je ćelijom, a elektroni u orbitali su prikazani strelicom koja stoji u ćeliji. Jedna ćelija je dodeljena za s-podnivo, pošto s-podnivo ima samo jednu orbitalu. Za p-podnivo su dodijeljene tri ćelije jer p-podnivo sadrži tri p-orbitale. D-podnivo je predstavljen sa pet ćelija, a f-podnivo sa sedam ćelija.
Elektronska struktura atoma titana, za koju smo već napisali elektronsku formulu, prikazanu pomoću kvantnih ćelija, izgleda ovako:
Ministarstvo poljoprivrede Ruske Federacije
FGOU VPO "Uljanovska državna poljoprivredna akademija"
Zadaci za testove i ispitna pitanja iz discipline
Uljanovsk - 2010
A.L. Ignatov. Zadaci za testove i ispitna pitanja iz discipline "Hemija" / Ed. prof. IN AND. Kostina. - Državna poljoprivredna akademija Uljanovsk, 2009, 58s.
Recenzent: Kafiyatullina A.G., kandidat hemije, viši predavač na Katedri za hemiju Uljanovskog državnog pedagoškog univerziteta. I.N. Uljanova»
Ovaj priručnik sadrži kontrolne zadatke za glavne dijelove kursa hemije, primjere rješavanja tipičnih zadataka i listu ispitnih pitanja.
Za studente Tehničkog fakulteta dopisnih predmeta u specijalnosti: 110301 „Mehanizacija poljoprivrede“, 110304 „Tehnologija održavanja i popravke mašina u agroindustrijskom kompleksu“, 190601 „Automobili i automobilska industrija“.
© A.L. Ignatov, 2010.
© FGOU VPO "Uljanovska državna poljoprivredna akademija", 2010.
KONTROLNI ZADACI
STRUKTURA SUPSTANCE
Primjeri rješavanja tipičnih problema
Zadatak 1. Koji energetski podnivo atoma je ranije ispunjen elektronima: a) 4s ili 3d; b) 5p ili
4d; c) 6p ili 4f?
Rješenje. Redoslijed popunjavanja energetskih podnivoa elektronima određen je pravilom Klečkovskog, prema kojem se podnivoi popunjavaju elektronima po redu sukcesivnog povećanja zbira glavnog i orbitalnog kvantnog broja (n + l), a za iste vrijednosti ove sume, redom povećanja glavnog kvantnog broja n. Nađimo zbir (n+l) za energetske podnivoe navedene u uslovu problema.
Zbir n+l 4+0=4 |
Prema tome, u slučaju (a), 4s podnivo je prvo ispunjen elektronima, a zatim 3d podnivo; u slučaju (b), prvo 4d, zatim 5p; u slučaju (c), prvo 4f, zatim 6p.
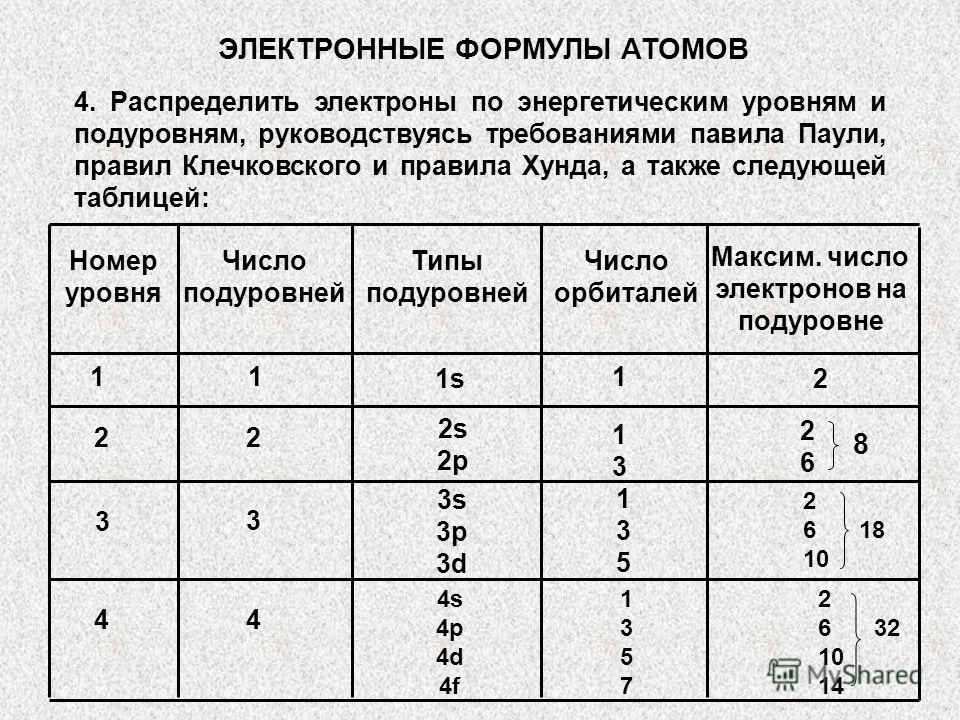
Zadatak 2. Rasporedite elektrone po nivoima, napišite elektronsku formulu atoma Fe u osnovnom i pobuđenom stanju, naznačite kvantna stanja njegovih valentnih elektrona i rasporedite ih po kvantnim ćelijama.
Rješenje. Rješenje ovog problema mora početi određivanjem broja nivoa koje će zauzeti elektroni u nepobuđenom atomu željeza. Njihov broj je određen brojem perioda u kojem se element nalazi. Za gvožđe je jednako 4. Na prva dva nivoa, maksimalni broj elektrona je 2 i 8, respektivno (određeno udvostručenim kvadratom glavnog kvantnog broja 2n2). Maksimalni broj valentnih elektrona određen je brojem grupe u kojoj se nalazi element (VIII). Pošto se gvožđe nalazi u bočnoj podgrupi, njegovi valentni elektroni su raspoređeni između s - podnivoa spoljašnjeg energetskog nivoa i d - podnivoa predspoljnog nivoa. Dakle, postoje 2 elektrona u 4s stanju, a 6 u 3d stanju (broj grupe minus 2). Ukupan broj elektrona na pretposljednjem energetskom nivou atoma željeza je 14.
Dakle, elektroni u nepobuđenom atomu gvožđa su raspoređeni između nivoa na sledeći način:
Svaki n-ti nivo je podijeljen na n podnivoa. Prilikom pisanja elektronske formule atoma, podnivoi su raspoređeni u rastućem redoslijedu zbira glavnog i orbitalnog kvantnog broja:
Valentni elektroni - 3d 6 4s2.
Redoslijed popunjavanja kvantnih ćelija podnivoa elektronima određen je Hundovim pravilom prema principu najveće apsolutne vrijednosti ukupnog spina:
U pobuđenom atomu gvožđa, jedan s - elektron ide na 4p - podnivo. U pobuđenom stanju, elektroni su raspoređeni po kvantnim ćelijama na sljedeći način:
Zadatak 3. Napišite elektronske formule Mn2+, S2-, Br- jona.
Rješenje. Na atomu Mn (d-element) elektroni su raspoređeni
nivoi energije kako slijedi: 1s2 2s2 2p6 3s2 3p6 3d 5 4s 2
Kada se u d - elementima formiraju pozitivni ioni, uvijek se prvi uklanjaju s-elektroni vanjskog sloja, odnosno za Mn + 2 vrijedi elektronska formula:
1s2 2s2 2p6 3s2 3p6 3d 5 4s 0
tada će za ion S2– doći do “kompletiranja” 3p podnivoa
S2– :1s2 2s2 2p6 3s 2 3p 6
Sličan “završetak” podnivoa dešava se tokom formiranja Briona:
Br:1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 5
Br– :1s2 2s2 2p6 3s2 3p6 3d10 4s 2 4p 6 |
|||||||
Zadatak 4. Navedite položaj elementa u periodnom sistemu (period, grupa, podgrupa), ako je poslednji elektron u njegovom atomu pao u stanje: a) 3d6; b) 4p2 .
Obrazložite odgovor.
Rješenje. a) Ako je posljednji elektron udario atom u d-stanju, onda je to element bočne podgrupe. U atomima elemenata sekundarnih podgrupa, posljednji valentni elektron pada na d - podnivo pretposljednjeg energetskog nivoa. Iz ovoga slijedi da su n-1=3 i n=4. Vrijednost glavnog kvantnog broja - 4 - određuje broj perioda - 4. Pošto je stanje 4s ispunjeno elektronima prije 3d, ukupan broj elektrona koji mogu biti valentni je 4: 3d2 4s2. To znači da se radi o elementu 4. perioda IV grupe bočne podgrupe - titanijum (Ti).
b) Ako je zadnji elektron ušao u atom u p-stanju, onda je to element glavne podgrupe.
U atomima elemenata glavnih podgrupa, valentni elektroni nalaze se na vanjskom energetskom nivou. Stoga vrijednost glavnog kvantnog broja - 4 - određuje broj perioda. Pošto je p-stanje vanjskog nivoa ispunjeno elektronima nakon s-stanja, ukupan broj valentnih elektrona, jednak 4, određuje broj grupe. Dakle, ovo je element 4. perioda IV grupe i glavne podgrupe - germanijum.
Zadatak 5. Odredite koji se oblaci elektrona preklapaju u molekulu BCl3, koji ugao veze ima molekul, da li je molekul BCl3 polarni ili ne. Obrazložite svoj odgovor, razmotrite strukturu molekula BCl3 sa stanovišta VS metode (valentne veze).
Rješenje. Prema položaju elementa u periodnom sistemu navedite kvantna stanja valentnih elektrona u atomima koji formiraju veze i rasporedite ih prema
kvantne ćelije: B…2s 2 2p1 , ali pošto atom bora formira tri hemijske veze, on je u pobuđenom stanju i dolazi do hibridizacije sp2 elektronskih orbitala; formiraju se tri hibridna elektronska oblaka.
22p1 | ||||||||
B* ….2s1 2p2 | ||||||||
23p5 | ||||||||
P-elektron je uključen u formiranje veze u hloru.
B–Cl veze nastaju preklapanjem hibridnih elektronskih oblaka atoma V i oblaka p-elektrona atoma Cl.
Smjer hibridnih elektronskih oblaka trovalentnog atoma B određuje smjer veza i oblik molekula BCl3. B–Cl veze su usmjerene pod uglom od 1200°, a molekula BCl3 ima oblik ravnog trougla. Šema formiranja veze u molekulu prikazana je na Sl.1.
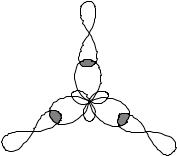
Vektori dipolnog momenta veze µb >0 usmjereni su prema atomu veće elektronegativnosti. Ukupni dipolni moment PM molekula je 0, tj. molekul je nepolaran, iako su sve B–Cl veze polarne.
Zadatak 6. Kakav je odnos čestica u kristalima sljedećih supstanci: CH4, Ne, Rb, RbF, Si, ZnSe? Koju vrstu kristalne rešetke prema prirodi čestica i vrsti veza između njih imaju te tvari u
kondenzovano stanje?
Rješenje. Kristale metana i neona karakterizira molekularna rešetka. Na mjestima prve kristalne rešetke nalaze se nepolarne molekule CH4, između kojih djeluje disperziona komponenta van der Waalsovih sila. Interakcija disperzije se također manifestira u kristalima između jednoatomskih neonskih molekula.
Rubidijum je metal; kristalni rubidijum karakteriše metalna rešetka; veza između kationa rubidijuma koji se nalaze na mestima rešetke je metalna.
U jedinjenju RbF radi tipična ionska veza, jer razlika u elektronegativnosti atoma
više od dvije jedinice: ΔX RbF \u003d XF - XRb \u003d 4,0 - 0,8 \u003d 3,2 (Dodatak I), kristale RbF karakterizira ionska rešetka, na čijim čvorovima se nalaze pozitivni i negativni ioni Rb + i F - , između kojih je jonska veza.
Kristalni silicijum (silicijum je nemetal) ima kovalentnu kristalnu rešetku poput dijamanta, u kojoj je svaki atom silicijuma povezan sa četiri susedna atoma nepolarnom kovalentnom vezom. Kristali cinkovog selenida imaju kovalentnu rešetku.
Polarna kovalentna veza djeluje između atoma cinka i selena koji se nalaze na čvorovima kristalne rešetke, budući da je ∆XZnSe = 2,4 - 1,6 = 0,8
Vježba 1
Zadaci su dati u tabeli 1. Broj varijante odgovara redu, broj zadatka odgovara koloni.
1. Rasporedite elektrone po energetskim nivoima, napišite elektronsku formulu atoma predloženu u zadatku, naznačite kvantna stanja valentnih elektrona, rasporedite ih među kvantnim ćelijama u nepobuđenim i pobuđenim stanjima, naznačite kojoj elektronskoj porodici pripada ovaj element?
2. Napišite elektronske formule predloženih jona, navedite kvantna stanja valentnih elektrona i rasporedite ih po kvantnim ćelijama.
3. Kojim redoslijedom će podnivoi predloženi u zadatku biti ispunjeni elektronima? Dajte objašnjenje.
4. Prema kvantnom stanju posljednjeg elektrona naznačiti položaj elementa u periodnom sistemu (period, grupa, podgrupa).
5. Razmotrite strukturu molekula predloženih u zadatku sa stanovišta metode valentnih veza, naznačite






