Füzyon ısısı nedir. Petrol ve gazın büyük ansiklopedisi
Bir maddenin durumlardan birinde olabileceği iyi bilinen bir gerçektir - gaz, sıvı, katı. Ve birinden diğerine geçebilir. En basit örnek - bir parça buz erir, sıvıya dönüşür ve sonra buhara dönüşür. Tüm bu buhara dönüşme sürecinde, erime aşaması çok ilginçtir ve parametrelerinden biri de füzyonun özgül ısısıdır.
Erimenin nasıl gerçekleştiğini hatırlarsanız, birkaç aşama ayırt edilebilir. Örnek olarak liderliği ele alalım. İlk aşamada kurşun ısıtılır, sıcaklık 327'ye (erime noktası) yükselir. Erime başladıktan sonra uzun süre hiçbir şey olmaz.
Kurşunun sıcaklığı, kendisine verilen ısıya rağmen sabit kalır ve tüm süreç tamamlanana kadar öyle kalır. Ve ancak bundan sonra, sürekli ısıtma ile sıcaklık tekrar yükselmeye başlar. Gözlemlenen resimden bazı sonuçlar çıkar. Katı bir cisimde, tüm moleküller belirli bir düzendedir ve komşu moleküllere sıkı bir şekilde bağlıdır.
Başka bir yere serbestçe hareket edebilmeleri için, erime işlemi sırasında meydana gelen komşu moleküllerle olan bağların kırılması gerekir. Bunu yapmak için, vücut, füzyon ısısı adı verilen belirli bir ısıyı transfer etmelidir. Her madde farklı miktarda ısı gerektirir. Bunun nedeni, bir maddenin bir kilogram maddeyi eritmek için harcanan ısı miktarı olarak tanımlanan öz füzyon ısısı gibi bir özelliğinden kaynaklanmaktadır. Ölçü birimi Joule/kilogramdır.
Daha önce de belirtildiği gibi, her malzeme için bu değer farklıdır. eriyen kurşun, buz için aynı değerden farklıdır. Ve burada çok meraklı bir an ortaya çıkıyor. Çeliğin özgül ergime ısısı ortalama 85 kJ/kg'dır ve su (buz) için aynı parametre ortalama 335 kJ/kg'dır. Buz için bu parametrenin yüksek bir değeri, doğanın harika bir armağanı olarak kabul edilebilir.
Gerçekten de, bu sayede tüm kar, buz anında erimez, ancak her şey uzun süre olur. Aksi takdirde kar çok çabuk erir, taşkınlar daha bol ve yıkıcı olur. Ek olarak, suyun bu tür benzersiz özellikleri, gezegendeki iklimin dengelenmesine katkıda bulunur.
Bireysel malzemelerin füzyonunun özgül ısısı hakkında veri içeren tablolar vardır. Bu değer bilinerek malzemeyi eritmek için ne kadar ısıya ihtiyaç olduğu hesaplanır ve eritmeyi gerçekleştirmek için ne kadar yakıt gerektiği belirlenir. Vücut erime noktasına kadar ısıtılırsa, yalnızca erime için ısı gerekir ve sıcaklığı erime noktasının altındaysa, maddeyi ısıtmak için ısı gerekir.
Bu tür hesaplamalar, endüstride üretim maliyetlerinin hesaplanmasında son derece faydalıdır.
Bu arada, erimiş madde soğuduğunda, erime işleminin tersi gerçekleşir - kristalleşme. Bu durumda madde soğuduğunda moleküller arasındaki kopmuş bağlar yeniden kurulur ve ısı açığa çıkar.
Bir maddenin erime süreci ve bu süreçte meydana gelen olaylar göz önüne alındığında, özgül füzyon ısısı gibi bir kavram tanımlanmıştır. Bu gösterge farklı maddeler için karşılaştırıldı ve buzdaki bu parametrenin yüksek değerinin gezegenin iklimi üzerinde ne kadar faydalı bir etkisi olduğu belirlendi.
Sayfa 3
273 K'da buzun erimesi ve suyun buharlaşmasının özgül ısıları sırasıyla 0 33 ve 2 5 MJ/kg'dır.
Hava, suyun 0 C'de olduğu, suyun %117'sinin bir baskıda buharlaştığı ve yoğun buharlaşma nedeniyle tüm buharlaşmamış suyun donduğu ısı yalıtımlı bir kaptan hızla dışarı pompalanır. Buzun erime özgül ısısı 0 33 MJ/kg'dır.
Isıtıcısı 1 kg suyun kütlesi mi olan, döngüsel olarak çalışan bir makineden elde edilebilecek maksimum iş Lmax nedir? ilk sıcaklık T 373 K ve buzdolabı - m2 - 1 kg buz, tüm buz eridiğinde T2 273 K sıcaklıkta. Şu anda T suyunun sıcaklığı ne olur? Buzun özgül erime ısısı q 335 kJ / kg'dır, suyun özgül ısısının sıcaklığa bağımlılığı ihmal edilir.
Erime ve katılaşmanın meydana geldiği ısı transfer işlemlerinin birçok hesaplaması denklem kullanılarak yapılır. ısı dengesi. Örnek olarak, bir kalorimetre kullanarak buzun erimesinin özgül ısısını belirlerken böyle bir denklemin nasıl derlendiğini düşünün.
0 C'de 100 g su bulunan bir kaptan hava hızla dışarı pompalanır; aynı zamanda yoğun buharlaşma nedeniyle buharlaşmamış su donar. Bu şekilde ne kadar su buza dönüştürülebilir. 0 C / - 597 cal / g'de özgül buharlaşma ısısı; buzun erimesinin özgül ısısı A 80 cal/g'dir.Kabın termal olarak yalıtılmış olduğunu düşünün.
0 C sıcaklıkta t100 g su kütlesi olan bir kaptan hava hızla dışarı pompalanır; aynı zamanda yoğun buharlaşma nedeniyle buharlaşmamış su donar. Bu şekilde hangi su kütlesi buza dönüştürülebilir? 0 C / - 2 49 MJ / kg'da özgül buharlaşma ısısı; buzun erimesinin özgül ısısı Х 0 336 MJ/kg Kap, termal olarak yalıtılmış olarak kabul edilir.
0 C'de suyun özgül buharlaşma ısısı 2,54 - 10e J / kg, buzun erimesinin özgül ısısı 3 35 105 J / kg'dır.
Ortaya çıkan buz farklı fiziksel özellikler itibaren sıradan buz, 0 C sıcaklığa sahiptir. Özısı-10 C ila OS arasındaki sıcaklık aralığındaki su, cl 4 17 103 JDkg K'ye eşittir); bu sıcaklık aralığında buzun özgül ısı kapasitesi c2 2 17 103 JDkg K'dir); 0 C'de buzun erimesinin özgül ısısı 3 32 105 J/kg'dır.
V 2 l sıvı nitrojen, tt - 195 C sıcaklıkta bir Dewar kabında depolanır. t ° C sıcaklıkta 40 g buzun eriyeceği biliniyorsa, azot ha'nın özgül buharlaşma ısısını belirleyin. 22 5 saat içinde aynı gemide. Sıvı nitrojen yoğunluğu p 8 - 102 kg / m3; buzun erimesinin özgül ısısı X l 3 3 105 J / kg. Kabın içindeki ısı besleme hızının, kabın içindeki ve dışındaki sıcaklık farkıyla orantılı olduğunu varsayalım.
Kütlesi M 0.1 kg ve sıcaklığı t 20 C olan eterin buharlaşmasıyla 0 C'de buza dönüştürülebilen suyun m kütlesini belirleyin. Isı alışverişi sadece eter ile su arasında gerçekleşir. Eter g buharlaşma özgül ısısı 3 8 105 J / kg, eriyen buzun özgül ısısı A 3, 3 - 105 J / kg, suyun özgül ısısı sv 4200 J / kg K, eter se 2100 J / kg K .
-20 C sıcaklıktaki 6 kg ağırlığındaki bir buz parçası, 60 C sıcaklıktaki suya indirildi; su kütlesi 10 kg'dır. Buzun özgül ısı kapasitesi 2 1 kJ / (kg - K); buz erime özgül ısısı - 0 33 MJ / kg.
Refrakter cisimlerin özgül füzyon ısısının belirlenmesi Yüksek sıcaklık eritme) zor bir iştir. Buz gibi düşük erime noktalı bir kristalin özgül füzyon ısısı, bir kalorimetre kullanılarak belirlenebilir. Kullanarak - enerjinin korunumu yasasını, buz erimesinin özgül ısısını belirlememize izin veren ısı dengesi denklemini (§ 209) oluşturacağız.
Su, belirli önlemlere tabi olarak, 4 - 10 C sıcaklığa kadar aşırı soğutulabilir. Suyun bu hali kararsızdır ve herhangi bir bozulma ile su, t ° C sıcaklıkta buza dönüşür. su sıcaklığa bağlı değildir ve 4 2 kJ / (kg - C) ve buzun erime özgül ısısı g 0 / 34 MJ / kg'a eşittir.
-8 C sıcaklıkta alınan bir buz parçası, 18 C'de 1 kg su içeren 300 g kütleli pirinç kalorimetreye indirilir. Suyun özgül ısı kapasitesi 4 19 kJ / (kg - K), buz - 2 1 kJ / (kg - K ), pirinç - 0 38 kJ / (kg - K); buzun erimesinin özgül ısısı 0 33 MJ/kg'dır.
V2 l sıvı nitrojen, bir Dewar kabında tl - - 195 C sıcaklıkta depolanır. Sıvı azo p8'in yoğunluğu 102 kg / m3'tür; buz erime özgül ısısı Yal 3 3 - 105 J/kg. Haznenin içindeki ms besleme hızının, kabın içindeki ve dışındaki sıcaklık farkıyla orantılı olduğunu varsayalım.
Sıcaklık arttıkça katılar ve sıvılar yükselir kinetik enerji parçacıkları: daha hızlı salınmaya başlarlar. Belirli bir madde için oldukça kesin olan belirli bir sıcaklıkta, parçacıklar arasındaki çekim kuvvetleri artık onları kristal kafesin düğümlerinde tutamaz (uzun menzilli düzen kısa menzilli olur), ve kristal erimeye başlar, yani. madde sıvılaşmaya başlar.
erime - bir maddenin katı halden sıvı hale geçmesi süreci.
Sertleşme - bir maddenin sıvı halden katı hale geçmesi süreci.
Erime işlemi sırasında kristalin sıcaklığı sabit kalır. Bu sıcaklığa denir erime noktası. Her maddenin kendi erime noktası vardır.
Bir deneyim: Sokaktan (veya dondurucudan) biraz kar getirirler ve sıcaklığındaki değişimi bir termometre ile gözlemlerler. İlk başta karın sıcaklığının yükseldiğini ve daha sonra erime sürecinde sabit kaldığını (termometre okumalarının değişmediğini) görüyorlar. Ve ancak tüm karlar eridikten sonra oluşan suyun sıcaklığı tekrar yükselmeye başlar.
Erime sırasında sıcaklığın sabitliği, termometrelerin kalibre edilmesine, sigortaların ve kesin olarak belirlenmiş bir sıcaklıkta eriyen göstergelerin yapılmasına izin verdiği için büyük pratik öneme sahiptir. Erime noktasının bilinmesi çeşitli maddeler tamamen yerel bir bakış açısından önemlidir: Aksi takdirde, bu tencerenin veya tavaların bir gaz brülörünün ateşinde erimeyeceğini kim garanti edecek?
Erime noktası ve buna eşit katılaşma sıcaklığı, bir maddenin karakteristik bir özelliğidir. Merkür -39 o C sıcaklıkta erir ve katılaşır, bu nedenle Uzak Kuzey'de cıva termometreleri kullanılmaz. Bu enlemlerde cıvalı termometreler yerine alkol termometreleri kullanılır (-114 o C). En refrakter metal tungstendir (3420 o C).
Bir maddeyi eritmek için gereken ısı miktarı aşağıdaki formülle belirlenir:
, burada m maddenin kütlesidir, füzyonun özgül ısısıdır.
j/kg
Özgül füzyon ısısı - 1 kg cismi erime noktasında eritmek için gereken ısı miktarı. Her maddenin kendi vardır. Tabloda bulunur.
Bir maddenin erime noktası basınca bağlıdır. Erime üzerine hacmi artan maddeler için, basınçtaki bir artış erime noktasını arttırır ve bunun tersi de geçerlidir. Suda erime sırasında hacim azalır ve basınç arttığında buz daha düşük bir sıcaklıkta erir.
Katılaşma sırasında atomlar tekrar belli bir sıraya dizilir ve katılaşma ısısı açığa çıkar. Vücut tamamen katılaştığı anda sıcaklığı düşmeye başlar.
Bilet numarası 5.
İlgili bilgi:
- A. sıcaklık, ylgaldylyk, aua kozgalysynyn zhyldamdygy, infrakyzyl saulelen.
- Tokluk - malzemelerin düşük sıcaklıklarda gevrek kırılmaya direnme yeteneği.
- Durum diyagramı, sıcaklık-konsantrasyon koordinatlarında oluşturulmuştur.
- Van der Waals izotermleri ve gerçek izotermlerle karşılaştırılması. Kritik sıcaklık. Van der Waals gazının iç enerjisi.
- Buharlaşma ve yoğunlaşma. Bağıl nem ve ölçümü. Kaynamak. Kaynama sıcaklığı. Özgül buharlaşma ısısı.
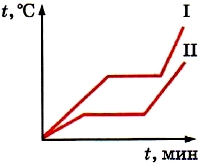
Bir önceki paragrafta, buzun erime ve katılaşma grafiğini ele aldık. Grafik, buz erirken sıcaklığının değişmediğini göstermektedir (bkz. Şekil 18). Ve ancak tüm buz eridikten sonra ortaya çıkan sıvının sıcaklığı yükselmeye başlar. Ama sonuçta buz, erime işlemi sırasında bile ısıtıcıda yanan yakıttan enerji alır. Ve enerjinin korunumu yasasından, yok olamayacağı sonucu çıkar. Eritme sırasında yakıtın enerji tüketimi nedir?
Kristallerde moleküllerin (veya atomların) kesin bir düzende düzenlendiğini biliyoruz. Ancak kristallerde bile termal hareket halindedirler (salınım). Vücut ısıtıldığında ortalama sürat moleküler hareket artar. Sonuç olarak, ortalama kinetik enerjileri ve sıcaklıkları da artar. Grafikte bu, AB kesitidir (bkz. Şekil 18). Sonuç olarak, moleküllerin (veya atomların) titreşim aralığı artar. Vücut erime sıcaklığına ısıtıldığında, kristallerdeki parçacıkların düzenindeki düzen bozulacaktır. Kristaller şekillerini kaybeder. Madde erir katı hal sıvı içine.
Sonuç olarak, bir kristal cismin erime noktasına kadar ısıtıldıktan sonra aldığı tüm enerji, kristalin yok edilmesi için harcanır. Bu bağlamda, vücut ısısı yükselmeyi bırakır. Grafikte (bkz. Şekil 18) bu BC bölümüdür.
Deneyler, aynı kütleye sahip çeşitli kristalli maddelerin bir erime noktasında bir sıvıya dönüştürülmesi için farklı miktarda ısı gerektiğini göstermektedir.
Kütlesi 1 kg olan kristal bir cismin erime noktasında tamamen sıvı hale geçmesi için ne kadar ısı verilmesi gerektiğini gösteren fiziksel niceliğe denir. özısı erime.
Özgül füzyon ısısı λ (Yunanca "lambda" harfi) ile gösterilir. Birimi 1 J/kg'dır.
Deneyde özgül füzyon ısısını belirleyin. Böylece, buzun erime özgül ısısının 3.4 105 - olduğu bulunmuştur. Bu, 0 °C'de alınan 1 kg ağırlığındaki bir buz parçasının aynı sıcaklıktaki suya dönüştürülmesi için 3.4 105 J enerji gerektiği anlamına gelir. Ve erime noktasında alınan 1 kg ağırlığındaki bir kurşun çubuğu eritmek için 2.5 104 J enerji alacaktır.
Bu nedenle, erime noktasında, bir maddenin iç enerjisi, sıvı hal daha fazla içsel enerji katı haldeki maddenin kütlesi aynıdır.
Erime için gereken ısı Q miktarını hesaplamak için kristal gövde kütle m, erime noktasında alınan ve normal atmosferik basınç, füzyonun özgül ısısını λ vücut kütlesi m ile çarpmanız gerekir:
Bu formülden belirlenebilir ki
λ = Q / m, m = Q / λ
Deneyler, tedavi edildiğinde kristal madde Eridiğinde emilen ısının tam olarak aynı miktarı açığa çıkar. Yani 1 kg ağırlığındaki suyun 0°C sıcaklıkta katılaşması sırasında 3.4 105 J'ye eşit bir ısı açığa çıkar. 0 ° C

Bir madde katılaştığında, her şey ters sırada gerçekleşir. Soğutulmuş erimiş bir maddedeki moleküllerin hızı ve dolayısıyla ortalama kinetik enerjisi azalır. Çekici kuvvetler artık yavaş hareket eden molekülleri birbirine yakın tutabilir. Sonuç olarak, parçacıkların düzeni düzenli hale gelir - bir kristal oluşur. Kristalizasyon sırasında açığa çıkan enerji, muhafaza için harcanır. Sabit sıcaklık. Grafikte bu, EF bölümüdür (bkz. Şekil 18).
Toz partikülleri gibi herhangi bir yabancı partikül sıvının en başından itibaren mevcutsa kristalizasyon kolaylaşır. Kristalleşme merkezleri haline gelirler. Normal koşullar altında, bir sıvıda, yakınında kristal oluşumunun meydana geldiği birçok kristalleşme merkezi vardır.
Tablo 4
Belirli maddelerin özgül füzyon ısısı (normal atmosfer basıncında)

Kristalleşme sırasında enerji serbest bırakılır ve çevredeki cisimlere aktarılır.
Kütlesi m olan bir cismin kristalleşmesi sırasında açığa çıkan ısı miktarı da formülle belirlenir.
Bu durumda vücudun iç enerjisi azalır.
Örnek. Turist çay hazırlamak için tencereye 2 kg ağırlığında ve 0 °C sıcaklıkta buz koyar. Bu buzu 100°C'de kaynar suya dönüştürmek için ne kadar ısı gerekir? Su ısıtıcısını ısıtmak için harcanan enerji dikkate alınmaz.

Bir turist delikten aynı kütlede ve aynı sıcaklıkta su alırsa, buz yerine ne kadar ısıya ihtiyaç duyulur?
Problemin durumunu yazalım ve çözelim.

sorular
- Maddenin yapısı doktrini temelinde cismin erime süreci nasıl açıklanır?
- Erime noktasına kadar ısıtılmış kristal bir cismin erimesi sırasında harcanan yakıt enerjisi nedir?
- füzyonun özgül ısısı nedir?
- Maddenin yapısı doktrini temelinde sertleşme süreci nasıl açıklanır?
- Erime noktasında alınan kristal bir cismi eritmek için gereken ısı miktarı nasıl hesaplanır?
- Erime noktasına sahip bir cismin kristalleşmesi sırasında açığa çıkan ısı miktarı nasıl hesaplanır?
Egzersiz 12
Egzersiz yapmak
- Sobanın üzerine iki özdeş kutu yerleştirin. Birine 0,5 kg ağırlığında su dökün, diğerine aynı kütlede birkaç buz küpü koyun. Her iki kavanozdaki suyun kaynamasının ne kadar sürdüğünü not edin. Deneyiminizin kısa bir hesabını yazın ve sonuçları açıklayın.
- “Amorf cisimler” paragrafını okuyun. Erime amorf cisimler". Bununla ilgili bir rapor hazırlayın.






