Protonun keşfi. Çekirdeğin proton-elektronik modeli
Şek.131
SI cinsinden maruz kalma doz hızı birimi Coulomb/kilogram/saniye.
Sistem dışı birim - saatte röntgen. 1 R ç
h = 7.17 C ç
kg s. Maruz kalma doz oranı 1 Р ç
h, emilen doz hızına karşılık gelir 8.77 10 -3 Gy ç
3600 sn \u003d 2,44 10 - -6 Gy ç
İle birlikte.
9. Radyoaktif radyasyonun biyolojik etkisi radyoaktivitenin keşfinden sonraki ilk yıllarda keşfedildi ve çalışılmaya başlandı. 1945 yılında atom silahlarının kullanılmaya başlanması ve ardından atom enerjisinin barışçıl kullanımı ile bu çalışmalar özellikle yoğunlaşmıştır. Radyasyonun biyolojik etkisinin ana özellikleri şunlardır:
a.Hayati aktivitedeki derin rahatsızlıklar, ihmal edilebilir miktarda enerjiden kaynaklanır.. Böylece, ölümcül bir dozla ışınlandığında bir memelinin veya bir kişinin vücudu tarafından emilen enerji, ısıya dönüştürülürse, vücudun sadece 0.001 ° C ısınmasına yol açacaktır.
b.Radyasyon kalıtsal aparata zarar verir, etkisi sadece ışınlanmış bireyi değil, aynı zamanda sonraki yavrularını da etkiler.
içinde. Radyasyon hasarı doğada gizlidir (gizlidir) . Hemen görünmez, ancak bir süre sonra ortaya çıkar.
Radyasyonun biyolojik bir nesne ile etkileşimi şu şekilde karakterize edilir: eşdeğer doz
D e = kD, nerede D- emilen doz k- Lafta kalite faktörü. Değer k daha tehlikeli bu tür Canlı bir organizma için radyasyon. İçin β
- ve
g-ışınları k= 1, yavaş nötronlar için k= 3, hızlı nötronlar ve protonlar için k= 10, nükleer fisyon parçaları için k = 20.
SI cinsinden eşdeğer doz birimi elek(Sv), 1 Sv = 1 J ç kilogram.
Yakın zamana kadar eşdeğer doz şu şekilde ölçülüyordu: rem. Baer, ifadenin kısaltmasıdır. rad'nin biyolojik eşdeğeri. 1 geri = 0,01 Sv, 1 Sv = 100 geri.
§onsekiz. Atom çekirdeğinin yapısı sorunu
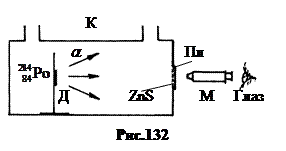 1. Protonun Keşfi .
1919'da Ernst Rutherford nitrojen çekirdeklerinin yapay dönüşümüne öncülük etti. Kurulum şeması Şekil 132'de gösterilmiştir. Alfa-aktif polonyum preparasyonu, küvet K içindeki tutucu D'ye uygulandı. Sintilasyonlar a-parçacıklar, bir mikroskop M ile ZnS tozu içeren bir cam plaka üzerinde gözlemlenebilir. Alfa parçacıkları, 7.58 MeV enerjiye ve hücrede yaklaşık 7 cm'lik normal basınçta havada serbest bir yola sahiptir. a-partiküller Pl plakasına ulaşabilir ve üzerinde parıldamalara neden olabilir. Normal ve yüksek basınçta a-partiküller Pl plakasına ulaşmadı.
1. Protonun Keşfi .
1919'da Ernst Rutherford nitrojen çekirdeklerinin yapay dönüşümüne öncülük etti. Kurulum şeması Şekil 132'de gösterilmiştir. Alfa-aktif polonyum preparasyonu, küvet K içindeki tutucu D'ye uygulandı. Sintilasyonlar a-parçacıklar, bir mikroskop M ile ZnS tozu içeren bir cam plaka üzerinde gözlemlenebilir. Alfa parçacıkları, 7.58 MeV enerjiye ve hücrede yaklaşık 7 cm'lik normal basınçta havada serbest bir yola sahiptir. a-partiküller Pl plakasına ulaşabilir ve üzerinde parıldamalara neden olabilir. Normal ve yüksek basınçta a-partiküller Pl plakasına ulaşmadı.
Küvet farklı gazlarla dolduruldu, ardından sintilasyonlar gözlendi. a-düşük basınçlarda parçacıklar ve artan basınçla kaybolmaları.
Küvet nitrojen N2 ile doldurulduğunda sınırlayıcıdan daha yüksek basınçlarda bile Pl plakasında parıldamalar gözlendi. Çünkü a-parçacıklar fosfora ulaşamadı, etkileşim sürecinde varsayım yapmak kaldı a-azot çekirdekli parçacıklar doğdular diğer bazı iyonlaştırıcı parçacıklar.
Elektrik ve manyetik alanların süperpozisyonu, doğmakta olan yeni bir parçacığın pozitif yük, elektron yüküne mutlak değerde eşit ve yaklaşık olarak hidrojen kütlesine eşit bir kütle. Açıkçası, bu bir hidrojen atomunun çekirdeğidir, a-parçacık - bir helyum atomunun çekirdeği.
1910'larda, tüm kimyasal elementlerin çekirdeğinin hidrojen çekirdeklerinden - yani tablodaki en basit, ilk elementin çekirdeğinden - oluştuğu fikri ortaya atıldı. Bu nedenle Rutherford, yeni parçacığı "proton", Yunancadan. protolar- ilk. (Daha önce, 1815'te, kimyager William Prout tarafından kimyasal elementlerin bileşimi ile ilgili benzer bir fikir dile getirildi).
Patrick Blackett 1925'te kendisi tarafından geliştirilmiş bir bulut odası kullanılarak nitrojen deneylerine devam edildi (bkz. s. 132). İyonlaştırıcı parçacıkların sisli izlerinin aynı anda farklı yönlerden iki kamerayla çekilmesini otomatikleştirdi. Bu, parçacık yörüngelerinin uzamsal biçimini yeniden yapılandırmayı mümkün kıldı. 23.000 fotoğrafı inceledikten sonra, a-Çarpışmadaki parçacık azot çekirdeği tarafından emilir, ardından bu yeni çekirdek bir proton çıkarır. Yükün ve kütlenin korunumu dikkate alındığında, bir nükleer reaksiyon aşağıdaki gibi yazılabilir: ![]() Rutherford, 1919 Protonun Keşfi (18.1)
Rutherford, 1919 Protonun Keşfi (18.1)
Rutherford'un deneylerinde proton enerjisi yaklaşık 6 MeV idi ve yol uzunluğu 28 cm idi.
2. Protonun özellikleri. Serbest durumda proton - kararlı temel parçacık , bir hidrojen atomunun çekirdeği. Nükleer reaksiyonlarda, genellikle sembolü ile gösterilir. proton kütlesi m p bir elektronun kütlesinin neredeyse 2000 katı ben, m p = 1836ben\u003d 1.67239 10 -27 kg.
Döndür, yani kendi açısal momentumu proton elektronla aynıdır. Fiziksel eksene yansıması sadece iki değer alabilir, L sz =±ћ/ 2. Döndür kuantum sayısı s proton, elektron gibi bir yarı tamsayıdır. Bu nedenle, elektron sistemi gibi proton sistemi de tanımlanmıştır. Fermi-Dirac istatistikleri.
Protonun manyetik dönüş momenti. §2'de zaten belirtildiği gibi, Bohr'un hidrojen atomu teorisinde, en düşük enerji durumundaki bir elektronun yörüngesel manyetik momenti ( n= 1) J'ye eşittir ç Tl (bkz. f. 2.18). Daha yüksek bir enerji seviyesinde, manyetik moment n kat daha fazla nerede n– seviye numarası, Mn = n M bir . Manyetik momentin minimum değerine denir. Bohr manyetonu. Bu, atomların elektron kabuklarının fiziğindeki minimum manyetik momenttir. Bu nedenle Bohr magnetonu, elektronların manyetik momentleri için bir ölçü birimi olarak kullanılır.
Stern ve Gerlach'ın homojen olmayan bir manyetik alanda atomik ışınların bölünmesine ilişkin deneylerinden şu sonucu çıkardı: bir elektronun spin manyetik momenti Bohr magnetonuna eşittir. Bu nedenle, protonun keşfinden sonra, protonun spin manyetik momentinin elektronun kütlesi yerine Bohr magneton formülü ile belirlendiğini varsaymak doğaldı. ben durmalı proton kütlesi m p. ![]() J ç
TL. (18.2)
J ç
TL. (18.2)
değer M Ararım nükleer manyeton. Bohr magnetonundan 1836 kat daha küçüktür ve nükleer fizikte manyetik momentler için bir ölçü birimi olarak kullanılır.
Ancak ölçümler, protonun spin manyetik momentinin nükleer magnetondan 2.79 kat daha büyük olduğunu ve ![]() J ç
TL. (18.3)
J ç
TL. (18.3)
3. Proton emisyonlu nükleer reaksiyonlar bombardıman sırasında daha sonra gözlendi a-bor, flor, sodyum, alüminyum ve fosfor parçacıkları.
dikkat, ki a-parçacıklar sadece hafif çekirdeklerle etkili bir şekilde etkileşime girebilir. Çekirdeğin elektriksel itme kuvvetinin üstesinden gelmek için, a-parçacık kinetik enerjiye sahip olmalıdır E, çekirdeğe yaklaşma reaksiyonu için gerekli olan potansiyel enerjiden daha az değil. ![]() (18.4)
(18.4)
Buradan maksimum sayıyı bulabilirsiniz. Zçekirdeği kullanılabilir olan öğe
a-enerjili parçacıklar E. ![]() . (18.5)
. (18.5)
Çekirdek yarıçapı m. a-enerjili parçacıklar E≈ 10 MeV, elde ederiz
Bu fazla tahmin edilen bir sayıdır. Deneylerin gösterdiği gibi, etkili etkileşim
a-çekirdeği olan parçacıklar yalnızca Z≤ 20, yani kalsiyuma kadar.
4. Nötronun keşfi. 1930'a gelindiğinde, ateşlendiğinde bazı elementlerin, örneğin Be, Li, O 2 olduğu ortaya çıktı. a-parçacıklar proton yaymazlar. Bu nedenle, soru ortaya çıktı: kabuklu olduğunda ne olur? a-parçacıklar çekirdekte proton yaymaz mı?
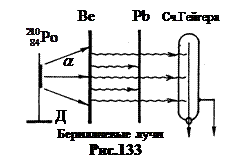 1930'da Walter Bothe ve Hans Beckerşeması Şekil 133'te gösterilen bir deney kurun. D tutucuya yerleştirildi a- aktif ilaç. Özelliği, deneyimlemiş olmasıdır. a- polonyum -210 çekirdeğinin çürümesi, kararlı bir kurşun izotopunun çekirdeğine dönüşür. Bu nedenle polonyum-210'un hazırlanması başka bir radyasyon vermez. Enerji a-parçacık y, y'den daha küçüktür, 5.25 MeV'dir. Ancak deneyler için seçilen hafif berilyumun çekirdeklerine nüfuz etmek için, Z= 4, bu yeterliydi.
1930'da Walter Bothe ve Hans Beckerşeması Şekil 133'te gösterilen bir deney kurun. D tutucuya yerleştirildi a- aktif ilaç. Özelliği, deneyimlemiş olmasıdır. a- polonyum -210 çekirdeğinin çürümesi, kararlı bir kurşun izotopunun çekirdeğine dönüşür. Bu nedenle polonyum-210'un hazırlanması başka bir radyasyon vermez. Enerji a-parçacık y, y'den daha küçüktür, 5.25 MeV'dir. Ancak deneyler için seçilen hafif berilyumun çekirdeklerine nüfuz etmek için, Z= 4, bu yeterliydi.
Proton yaymayan çekirdeklerin çinko sülfür ZnS'de flaş vermeyen başka radyasyon yaymasından korkuluyordu. Bu nedenle çinko sülfür elek, bir Geiger sayacı ile değiştirildi. Eylemi, sayacın içine uçan bir nükleer parçacığın içindeki gazı iyonize etmesine dayanır. Sonuç olarak, sayaç devresinde bir akım darbesi belirir (Geiger sayacı hakkında daha fazla ayrıntı için, bkz. s. 130).
ışınlandığında a- deneyimlerin gösterdiği gibi berilyum, bor, lityumdan plaka parçacıkları, bir tür radyasyon ortaya çıkar ve Geiger sayacının zayıf deşarjlarına neden olur. Berilyum özellikle güçlü radyasyon verdi. Bunlar berilyumışınların muazzam bir nüfuz edici etkisi vardı: 2 cm kalınlığında bir kurşun levha, yoğunluklarını sadece %14 oranında azalttı.
Bothe ve Becker berilyum ışınlarının çok sert olduğunu öne sürdüler. g-kuanta. Kurşunda absorpsiyon ile enerjilerinin 7 MeV olduğu bulundu. Ama enerji a-partiküller 5.25 MeV idi. Enerji artışı nereden geldi?
1931 yılında Irene ve Frederic Joliot-Curie. Kurşun levhalar yerine parafin tabakaları yerleştirerek, havada maksimum aralığı 26 cm olan berilyum ışınlarının etkisi altında parafinden protonların yayıldığını buldular Bu aralık 4.5 MeV'lik bir proton enerjisine karşılık geldi.
Parafinler doymuş hidrokarbonlardır. Genel formül CnH2n+2. içlerinde Büyük sayı hidrojen atomları. Parafinin berilyum ışınlarıyla ışınlanması sırasında protonların görünümü Curies tarafından yorumlanmıştır. Compton saçılması g-protonlardaki kuantumlar - hidrojen atomlarının çekirdeği. Geri tepme protonu saçıldığında ileri doğru hareket eder. g kuantum geri yansıtılır, θ
= π
. Buradan ![]() nerede m p protonun kütlesi, λ
0 berilyumun dalga boyu g-kuanta. Enerji E nakavt edilen protonun enerji kaybına eşit olması gerekir g-kuantum, (18.6)
nerede m p protonun kütlesi, λ
0 berilyumun dalga boyu g-kuanta. Enerji E nakavt edilen protonun enerji kaybına eşit olması gerekir g-kuantum, (18.6)
varsayalım ki 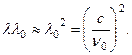 O zamanlar
O zamanlar 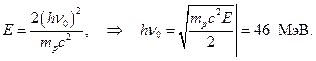
Yani berilyumun enerjisi g-kuanta, kurşundaki absorpsiyondan hesaplanan, 7 MeV, parafinden atılan protonların enerjisinden - 46-48 MeV. Üstelik, ortaya çıkıyor ki α - 5.25 MeV enerjili parçacıklar nakavt g- 46-48 MeV enerjili kuantum!
1932'de berilyum ışınlarının doğası çalışmasına dahil edildi. James Chadwick. Kurulum şeması, Bothe ve Becker'in şemasından pratik olarak farklı değildi, sadece Geiger sayacı yerine Curie gibi bir iyonizasyon odası kullandı. Chadwick berilyum ışınlarının saçılımını sadece parafin tarafından değil, aynı zamanda diğer maddeler tarafından da araştırdı. Enerji g-nitrojen geri tepme çekirdeklerinin enerjisinden ölçülen kuantum, eşit olduğu ortaya çıktı hv= 150 MeV.
Yani, berilyum ışınlarının hangi hipoteze göre g-kuanta, çelişkili sonuçlara yol açtı. Ölçüm yöntemine bağlı olarak, enerji g-quanta farklıydı ve 7, 48, 150 MeV olarak gerçekleşti. Bu, bu hipotezin yanlışlığını kanıtladı.
Aynı 1932'de Chadwick, berilyum radyasyonunun nötr parçacıkların akışı hangi adını verdi nötronlar. Nötronların sembolüdür. Nötron üretiminin nükleer reaksiyonu aşağıdaki gibi yazılabilir:
![]() nötron keşif reaksiyonu, 1930-32 .
(18.7)
nötron keşif reaksiyonu, 1930-32 .
(18.7)
Chadwick ayrıca nötronun kütlesinin ilk ölçümlerini yaptı. Nötronun kütlesinin protonun kütlesine yakın olduğu ortaya çıktı. Nötron kütlesinin tam değeri, nötronları içeren çeşitli nükleer reaksiyonların kütle dengesinden elde edildi.
5. Nötronun özellikleri. Serbest nötron - kararsız temel parçacık bir protona, bir elektrona ve bir elektron antinötrinosuna bozunur. ![]() (18.8)
(18.8)
Ortalama nötron ömrü τ ≈ 16 dakika. Bir nötronun kütlesi, bir protonun kütlesinden biraz daha büyüktür ve mn = 1838 ben\u003d 1.6760 10 -27 kg. nötron dönüşü ħç 2. Bu nedenle, elektronlar ve protonlar gibi nötronlar tanımlanır Fermi-Dirac istatistikleri.
Proton ve nötronun spin manyetik momentlerinin oranı
M p cM n = - 3ç
2. "Eksi", nötronun içsel mekanik ve manyetik momentlerinin yönleri anlamına gelir. zıttır.
Nötronların yüksek nüfuz gücü, elektrik yükünün olmamasından kaynaklanmaktadır. Nötronlar pratik olarak atomların elektron kabuklarıyla etkileşime girmezler ve aksine a-parçacıklar ve protonlar çekirdekten uzaklaşmazlar. Bu nedenle, düşük enerjilerde bile nötronlar atom çekirdeğine yaklaşabilir ve onlar tarafından yakalanabilir.
Hızlı nötronları kaydetmek için hidrojen çekirdekleriyle esnek çarpışmaları kullanılır. Proton ve nötronun kütlelerinin pratik eşitliği nedeniyle, bir nötronun sabit bir protonla elastik etkisi sırasında, nötronun kinetik enerjisinin çoğu ikincisine aktarılır. Sonuç olarak, nötron pratikte durur ve proton, nötronun başlangıç enerjisine yakın bir enerjiyle aynı yönde hareket eder. Yol boyunca, proton yoğun iyonizasyon üretir ve bu nedenle bir iyonizasyon odası, bir Geiger sayacı veya bir bulut odası tarafından kaydedilebilir.
Atom çekirdeği ile birkaç ardışık çarpışmadan sonra, hızlı nötronlar fazla enerjilerinden vazgeçer ve ardından termal hızlarla kaotik bir hareket gerçekleştirir. Bu tür termal nötronlar için, hidrojen atomlarının çekirdekleri üzerine saçılma yoluyla yukarıda açıklanan kayıt yöntemi uygun değildir. Bu durumda, çekirdeğe nüfuz eden bir nötronun ikincisinden kaçışa yol açtığı nükleer reaksiyonlar kullanılır. a yüksek enerjili parçacıklar. Örneğin, ![]() (18.10)
(18.10)
6. Çekirdeğin yapısı sorunu. XX yüzyılın 30'lu yıllarının başında. Atomun aşağıdaki yapısal elementleri keşfedildi: elektron, 1897, Thomson; proton, 1919 Rutherford;
nötron, 1932 Chadwick. Radyoaktivitenin keşfi ve ilk nükleer reaksiyonların gözlemlenmesi şu soruyu acil hale getirdi: Atom çekirdeği nasıl düzenlenir?
Her şeyden önce, bir atomun çekirdeğinin, bazı hareketsiz nükleer tuğlalardan yapılmış bir top olarak temsil edilemeyeceği açık hale geldi. Atomun çekirdeği çok nükleer elementlerin hareket ettiği küçük bir alan hacmi. Yani, henüz bilinmeyen bazı yasalara göre hareket eden ve etkileşime giren nükleer nesneler sistemidir.
Her şeyden önce, şu soruyu cevaplamak gerekiyordu: Çekirdek hangi parçacıklardan oluşur. Tarihsel olarak iki seçenek düşünülmüştür: proton-elektron ve proton-nötron çekirdekleri.
a.Proton-elektron çekirdeği. 1930'da nötronun keşfinden önce Paul Dirac Prout'un tüm kimyasal elementlerin hidrojenden oluştuğu fikrini analiz etti. Çekirdeğin yapısı sorununa uygulandığında, bu fikir, elementlerin tüm çekirdeklerinin hidrojen atomunun çekirdeğinden, yani protonlardan oluştuğu gerçeğine indirgendi. (Hidrojen izotop döteryum sadece 2 yıl sonra keşfedildi). Ancak bu, periyodik tablodaki elementin seri numarasının kütle numarasına eşit olması gerektiği anlamına gelir. Ancak tabloda böyle bir unsur yok. Helyum'un zaten bir seri numarası var Z= 2 ve kütle numarası ANCAK= 4. Sanki çekirdekteki 4 protondan 2'si nötralize olmuş gibi. Helyum çekirdeğinin 4 proton ve 2 elektron içerdiği varsayılabilir. Ancak bu durumda Heisenberg belirsizlik ilkesi ile çelişkiler vardır. Gerçekten de, koordinat-momentum için belirsizlik ilişkisinden ifade edilen çekirdekteki momentumun belirsizliği: (18.11)
Ancak Δ koordinatının belirsizliği Xçekirdek yarıçapından daha büyük olamaz, en az Δ X≈ r 0 . Rutherford'un 1909'daki deneylerinden r 0 ≈ 10 –15 m Çekirdekteki bir elektronun momentumu, momentumun belirsizliğinden daha az olamaz, ![]() ve göreli formülden (18.12) minimum hızı
ve göreli formülden (18.12) minimum hızı
Burada ben elektronun kalan kütlesidir. Hesaplamalardan sonra elde ederiz v = 0,99998c, nerede İle birlikteışık hızıdır. Göreceli formül tarafından hesaplanan kinetik enerjiçekirdekteki elektron 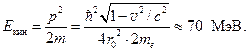
Ancak çekirdekten yayılan elektronlar β -çürüme, 10 MeV içinde bir enerjiye sahip. Böylesine çarpıcı bir çelişkiye inandırıcı bir açıklama bulmak çok zordur.
Çekirdeğin proton-elektron modelinin ikinci zorluğuna denir. nitrojen felaketi. Özü aşağıdaki gibidir.
Atomik spektrumların aşırı ince bölünmesinden manyetik momenti hesaplamak mümkün oldu. atom çekirdeği. Elektronun spin manyetik momentinden yaklaşık 1000 kat daha az olduğu ortaya çıktı. Çekirdekte çift sayıda elektron varsa, çekirdeğin bu kadar küçük bir manyetik momenti, çekirdekteki elektronların zıt dönüşlerle çiftler oluşturması ile açıklanabilir, bu nedenle çekirdeğin manyetik momenti, çekirdeğin manyetik momentinin toplamıdır. protonların anları. Ve protonun manyetik momenti elektronun anından 658 kat daha azdır.
Ancak bir nitrojen atomunun çekirdeğinde 14 proton ve 7 elektron olmalıdır. 6 elektron zıt spinli çiftler oluşturursa, bir elektron eşleşmemiş olarak kalır. Bu eşleşmemiş elektron, nitrojen çekirdeğine sahip olduğu aynı manyetik momenti, yani çift sayıda elektrona sahip çekirdeklerden 1000 kat daha fazlasını sağlamalıdır. Ama bu değil. Azot çekirdeğinin manyetik momenti, diğer çekirdeklerinkiyle aynı sıradadır.
b.Proton-nötron çekirdeği. Nötronun keşfinden altı aydan kısa bir süre sonra, neredeyse aynı anda ve birbirinden bağımsız olarak Dmitry Ivanenko ve Werner Heisenbergönerildi proton-nötronçekirdek bileşimi. Daha sonra geliştirilen çekirdeğin proton-nötron modeli deneyle mükemmel bir uyum içindedir ve artık genel olarak kabul edilmektedir. Bu modele göre, bir atomun çekirdeği şunları içerir: Z protonlar ve A'dan Z'ye nötronlar. Burada Z- periyodik tablodaki elementin seri numarası. çekirdek şarj q= +, yani sayı Z sık sık denir Görev numarası. değer ANCAK aranan kütle Numarası. Bu, karbon birimlerinde ifade edilen ve en yakın tam sayıya yuvarlanmış elementin atom kütlesine eşit bir tamsayıdır. Çekirdekteki proton ve nötronlara denir nükleonlar(lat. çekirdek- çekirdek). Bu, çekirdeğin bileşimindeki proton ve nötronun farklı durumlarda tek ve aynı parçacık olduğunu vurgular. Kütle Numarası ANCAKçekirdekteki nükleon sayısıdır. Çekirdekteki proton ve nötron sayıları arasındaki orana bağlı olarak, izotoplar, izobarlar ve izotonlar.
izotoplar(Yunanca isos - eşit, topos - yer) - aynı sayıda proton içeren, yani aynı sayıya sahip olan çekirdekler Z, ve farklı sayıda nötron. Tüm izotoplar, periyodik tablonun bir hücresine yerleştirilir ve bir tanesinin çeşitleridir. kimyasal element. İzotopların sayısı farklıdır Nçekirdekteki nötronlar. Örneğin, hidrojen izotopları:
Protium, , çekirdek-proton, Z = 1, A = 1, N = A–Z= 0, nötron yoktur.
Döteryum, çekirdek-döteron, Z = 1, A = 2, N= 1, bir nötron.
Trityum, , triton çekirdeği, Z = 1, A = 3, N= 2, iki nötron.
Helyum izotopları:
, Z= 2 (iki proton), A = 3, N= 1 (bir nötron), kararlı.
, Z = 2, A = 4, N= 2 (iki nötron), kararlı.
, Z = 2, A = 6, N= 4 (dört nötron), kararsız.
, Z = 2, A = 8, N= 6 (altı nötron), kararsız.
Şu anda bilinen elemanların bir numarası vardır. Z yaklaşık 105'e ulaşır. Bu element sayısı, bilinen yaklaşık 1500 izotoptan sorumludur. Öğe başına ortalama
14 izotop. bunlardan 1 tanesi ç
5 - kararlı ve 4 ç
5 - kararsız.
Aynı kimyasal elementin izotopları aynı kimyasala sahiptir ve hemen hemen aynıdır. fiziksel özellikler. Bu nedenle izotopların ayrılması karmaşık bir fizikokimyasal problemdir. Hidrojen izotopları en belirgin şekilde farklılık gösterir.
izobarlar(itibaren izo- ve Yunan baros- yerçekimi) - aynı kütle numarasına sahip çekirdekler ANCAK. Örneğin, trityum ve helyum. 3 nükleonları vardır, ancak protonlar ve nötronlar arasındaki oran farklıdır. trityum Z = 1, N= 2, helyum için Z = 2, N = 1.
izotonlar nötron sayıları aynı olan çekirdeklerdir. İzobarlar gibi izotonlar da farklı kimyasal elementlerin çekirdekleridir. Örneğin çekirdek ve 3 nötron içerir.
Sözler izobarlar ve izotonlar kelimeden çok daha az kullanılır izotoplar.
1. Çekirdek boyutlarıüç şekilde belirlenir: hızlı elektronların çekirdeklerine saçılarak, spektrumları inceleyerek mezoatomlar ve nötron çekirdekleri tarafından kırınım.
a. Hızlı elektronların çekirdekleri üzerinde saçılma belirlemenizi sağlar çekirdeğin elektrik yarıçapı R e-posta Enerjisi en az 100 MeV olması gereken elektronlar, çekirdekle elektromanyetik etkileşim yaşar, ancak nükleer değil. Bu nedenle, saçılmalarına dayanarak, aslında sadece çekirdekteki protonların dağılımını yargılayabilir.
b. Mezoatomların spektrumları yani elektronlardan birinin değiştirildiği atomlar müon. müon µ - temel parçacık, yükü yüke eşit elektron ve kütle 207 kat daha büyük, m= 207ben. Elektron gibi, müon da nükleer etkileşimlere katılmaz. Mezoatomların spektrumları, çekirdeğin yapısı hakkında sıradan atomların spektrumlarından daha fazla bilgi verir, çünkü müon, daha büyük kütlesi nedeniyle çekirdeğe elektrondan 207 kat daha yakın hareket eder. Müon, çekirdeğin içinde bile nispeten fark edilir bir zaman harcar.
içinde. nötron çekirdekleri tarafından kırınım 20 MeV mertebesinde bir enerji ile nötronların deneyimlediği avantaja sahiptir. nükleerçekirdek ile etkileşim. Bu etkileşimin yarıçapı çok küçüktür. Bu nedenle, nötronlar çekirdek üzerinde belirgin bir şekilde kırınım yaparlar, yani doğrusal hareketten saparlar, yalnızca çekirdeğe çok yakın ve çekirdeğin içinde uçarlar. Çekirdeğin hem dışından hem de içinden geçen nötronların oluşturduğu maksimum kırınım genişliğinden, çekirdeğin nötronlar için hem boyutu hem de şeffaflık derecesi tahmin edilebilir.
Nötronların çekirdekler tarafından kırınımı, nükleer çekim kuvvetlerinin etki ettiği bölgenin yarıçapını belirlemeyi mümkün kılar. Aslında bu, çekirdeğin nükleonlarının yoğunlaştığı alandır. Deneylerden anlaşılacağı çekirdeğin yarıçapı, içerdiği nükleonların A sayısının küp köküyle orantılıdır., ![]() m (19.1)
m (19.1)
Çekirdekteki nükleon konsantrasyonunu hesaplayalım. Bunun için kütle numarası Açekirdeğin hacmine bölünmesi gerekir. .
Bir nükleonun kütlesi ile çarpma m p= 1.67·10 -27 kg, nükleer maddenin ortalama yoğunluğunu ρ elde ederiz. .
Nükleer maddenin yoğunluğu, çekirdekteki nükleon sayısına bağlı değildir. Bütün çekirdeklerde aynıdır ve devasa bir değerdir. Böyle bir maddenin bir milimetre küpü 200.000 tonluk bir kütleye sahip olacaktır. yoğunluk olduğunu ρ nükleer maddenin sabit olması, çekirdekteki nükleonların paketlenme anlamında sıvı moleküllere benzediğini gösterir. Bir sıvıdaki molekül başına ortalama hacmin damla boyutuna bağlı olmadığı gibi, bir çekirdekteki nükleon başına ortalama hacim de çekirdeğin boyutuna bağlı değildir.
2. Nükleer kuvvetler. Rutherford'un 1909'daki deneyleri. dağılma ile a-parçacıklar, Coulomb yasasının mikrokozmosta çekirdek boyutuna kadar yerine getirildiğini göstermiştir. Ancak bu, çekirdekteki protonlar arasında büyük itici kuvvetlerin hareket etmesi gerektiği anlamına gelir. Bir helyum çekirdeğindeki iki proton için bu kuvvetlerin büyüklüğünü bulalım. Helyum çekirdeğindeki nükleon sayısı. Formülden (19.1) helyum çekirdeğinin yarıçapı R\u003d 1.25 10 -15 4 1/3 \u003d 2 10 -15 m Protonların çekirdek çapının 2 ucunda olduğunu varsayıyoruz R= 4 10 -15 m O zaman aralarındaki itme kuvveti:
Çekirdek, protonların bu kadar büyük bir karşılıklı itmesine rağmen, neden bileşenlerine dağılmıyor?
Çekirdeklerin deneysel olarak gözlemlenen kararlılığı, şu anlama gelir: elektrik kuvvetleri nükleer parçacıklar arasındaki itme, ayrıca çekim kuvvetleri de vardır. Bu güç olamaz yerçekimi çekiciliği. Onlara potansiyel enerji
– Gmp/2R= – 6.7 10 -11 (1.7 10 -27) 2 /4 10 -15 = – 5 10 -50 J, proton itme potansiyel enerjisi ise (1/4) πε
0)/(e 2 /2R) ≈ 6 10 -14 J! Bu 36 kat daha yüksek.
Sonuç olarak, atom çekirdeği durumunda, yeni, özel bir etkileşim türüyle karşı karşıyayız. Bu etkileşime denir kuvvetli ve buna yanıt veren güçler - nükleer. Komple teori nükleer kuvvetler henüz inşa edilmedi, ancak birçok deneysel gerçeği açıklama ve tahmin etmede büyük başarı elde etti. Nükleer kuvvetler hakkında temel modern fikirler şunlardır:
a. Bir nükleer alanın varlığı . Tıpkı elektrik kuvvetlerinin maddenin varlığıyla koşullanması gibi. elektromanyetik alan, nükleer kuvvetler, maddi bir nükleer alanın varlığından kaynaklanmaktadır. EM alanının kaynakları, elektrik yüklü herhangi bir madde parçacığıdır - elektronlar, protonlar, vb. Nükleer alanın kaynakları nükleonlardır - protonlar ve nötronlardır. Nükleonların belirli bir nükleer yük.
b. Nükleer kuvvetlerin şarj bağımsızlığı . nükleer yük nükleonlar büyüklük ve işaret bakımından aynıdır. Nükleonun elektrik yüküne (proton) sahip olup olmamasına (nötron) bağlı değildir. Nükleer kuvvetlerin yardımıyla bir nötron ile bir nötron, bir nötron ile bir proton ve iki proton aynı şekilde etkileşir.
içinde. Kısa menzilli nükleer kuvvetler. Nokta kaynaklar (yükler, kütleler) arasındaki mesafenin karesiyle orantılı olarak azalan Coulomb ve yerçekimi kuvvetlerine kıyasla, nükleer kuvvetler çok daha hızlı azalır. Çekirdeğin çapı kadar mesafelerde çok büyüktürler, ancak zaten üç çap mesafesinde pratik olarak görünmezler. Nükleonlar birbirine yaklaştığında, çekimin yerini itme alır.
G. Nükleer kuvvetler merkezi değil. etrafındaki elektrik alanı nokta şarjı ve nokta kütlelerin etrafındaki yerçekimi alanı merkezi olarak simetriktir. Tek bir nükleonun nükleer alanı merkezi simetriye sahip değildir. Bu, nükleonlarda spin mekanik ve manyetik momentlerin varlığından kaynaklanmaktadır. Nükleonlar arasındaki etkileşim, spinlerinin yönüne bağlıdır. Örneğin, bir nötron ve bir proton, ağır hidrojenin - döteronun - çekirdeğinde, ancak mekanik dönüşleri birbirine paralel ise bir arada tutulur.
d. Nükleer kuvvetlerin doygunluk özelliği. Bilindiği gibi, iki elektrik yükünün etkileşim enerjisi, üçüncü bir yükün varlığına bağlı değildir ( Üstüste binme ilkesi). Sonraki her bir yükün eklenmesiyle, sistemin enerjisi, eklenen yükün miktarıyla orantılı olarak artar. Her elektrik yükü, sınırsız sayıda başka yük ile etkileşime girebilir. Elektrik kuvvetlerinin doygunluğu yoktur.
Nükleer kuvvetlerin doygunluğu, çekirdekteki her nükleonun sınırlı sayıda nükleonla etkileşime girebilmesidir. Bu, elementlerin kimyasal değerlerine biraz benzer. Örneğin, bir karbon atomu C, dört hidrojen atomu H ile birleşerek bir metan molekülü CH4'ü, iki oksijen atomu (C02) vb. oluşturmak üzere birleşebilir. Nükleonlar arasında kimyasal elementler arasında olduğu gibi bir çeşitlilik yoktur. Bu nedenle, nükleer kuvvetlerin doygunluğu, kendini şu şekilde gösterir: özgül bağlanma enerjisi(nükleon başına enerji) çekirdekteki nükleon sayısındaki artışla artmaz, yaklaşık olarak sabit kalır.
3. Çekirdek kütlesi bir kimyasal element atomunun kütlesinden yalnızca elektron kabuğunun kütlesinin değeri ile farklıdır. Periyodik tabloda, atom kütleleri atomik kütle birimleri a.m.u olarak ifade edilir. sabah bir 1'e eşittir ç 12 kütle bir karbon atomu, 1 amu = 1,66 10 -27 kg. Ana karbon izotopunun çekirdeğinde (dünyada %99) 12 nükleon bulunduğundan, a.m.u. bir nükleonun kütlesine yakın.
Bir elektronun kütlesi ben= 5.5 10 -4 amu Elektron kabuğunun kütle oranı Zme bir atomun kütlesine hidrojen içindir ben/m() = 5.5 10 -4 ç 1.008 = 0.0005, yani %0.05. Diğer atomlar için bu oran daha da küçüktür, çünkü çekirdekteki nükleon sayısı atomdaki elektron sayısından daha hızlı büyür. uranyum atomunda Zme/m() = 0,0002 (%0,02). Bu nedenle, hesaplamaların dört basamaktan fazla olmayan bir doğruluk gerektirdiği durumlarda, periyodik tablodan bir kimyasal element atomunun kütlesi, çekirdeğin kütlesi olarak alınabilir.
olarak nükleer Fizik Doğada var olmayanlar da dahil olmak üzere daha önce bilinmeyen izotoplar, nükleer reaksiyonlar yoluyla keşfedildi ve sentezlendi.
Kimyasal ölçüm yöntemleri atom kütleleri yapay izotopların çok az etkili olduğu kanıtlandı. 1919'da francis aston yapılar kütle spektrografı- iyonları kütlelerine göre yüksek doğrulukla ayırabilen bir cihaz.
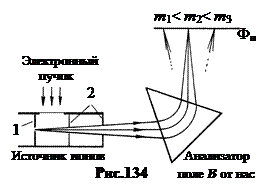 Herhangi bir kütle spektrografı üç ana bölümden oluşur: iyon kaynağı, analizör ve alıcı. İyon kaynağında iyonlar oluşur ve zayıf ayrışan bir ışın oluşur. Analiz cihazında, ışın, iyon kütlelerinde farklılık gösteren ve alıcı cihazın yüzeyine odaklanan birkaç ışına bölünmüştür - bir fotoğraf plakası. Şekil 134, bu kütle spektrograflarından birinin diyagramını göstermektedir. İncelenen elementin buhar jeti iyon kaynağının 1 deliğine girer ve içinden çıkan elektron ışını tarafından iyonize edilir. Ortaya çıkan iyonlar, diyaframlar 2 tarafından hızlandırılır ve hizalanır.
Herhangi bir kütle spektrografı üç ana bölümden oluşur: iyon kaynağı, analizör ve alıcı. İyon kaynağında iyonlar oluşur ve zayıf ayrışan bir ışın oluşur. Analiz cihazında, ışın, iyon kütlelerinde farklılık gösteren ve alıcı cihazın yüzeyine odaklanan birkaç ışına bölünmüştür - bir fotoğraf plakası. Şekil 134, bu kütle spektrograflarından birinin diyagramını göstermektedir. İncelenen elementin buhar jeti iyon kaynağının 1 deliğine girer ve içinden çıkan elektron ışını tarafından iyonize edilir. Ortaya çıkan iyonlar, diyaframlar 2 tarafından hızlandırılır ve hizalanır.
Analizör bir sektör manyetik alanıdır ATşeklin düzlemine dik olarak yönlendirilir. Bu manyetik alanda, kaynaktan biraz farklı açılarda yayılan iyonlar saptırılır ve odaklanır. İyonun sektörde hareket ettiği dairenin yarıçapı ne kadar büyükse, özgül yükü o kadar küçüktür, ![]() . (19.2)
. (19.2)
(Bkz. Elektrik, §14). Burada v iyonun hızı, e/m onun özel ücretidir.
Sonuç olarak, aynı izotopun iyonları, fotoğraf plakası Фп üzerinde aynı yere düşer ve üzerinde resmin düzlemine dik olan dar bir çizgi oluşturur. Kütle spektrografları, izotopların kütlelerini 10 -5 ¸10 -6 bağıl hatasıyla ölçmeyi mümkün kılar.
Fotoğraf plakasını bir Faraday kabı ile değiştirirsek ve iyon akımını ölçersek, iyon ışınlarının yoğunluğunu belirleyebilir ve iyon karışımındaki izotopların göreceli bolluğunu bulabiliriz. Böyle bir cihaz denir kütle spektrometresi.
4 . Kütle kusuru ve nükleer bağlanma enerjisi.çekirdek kütlesi m i her zaman kurucu nükleonlarının kütlelerinden daha küçüktür Zm p+ (A'dan Z'ye)mn.D değeri m = Zmp + (A'dan Z'ye)mn –m ben (19.3)
 aranan kütle kusuru. Burada m p,mn,m ve ben proton, nötron ve çekirdeğin geri kalan kütleleriyim.
aranan kütle kusuru. Burada m p,mn,m ve ben proton, nötron ve çekirdeğin geri kalan kütleleriyim.
Gerçek şu ki, serbest nükleonlar birleştiğinde, kütle Δ'yi alıp götüren EM radyasyon kuantumları şeklinde enerji açığa çıkar. m. bağ enerjisi Eçekirdekteki nükleon sayısı aşağıdaki formülle hesaplanır E sv = D mc 2 , (19.4)
nerede cışığın boşluktaki hızıdır. Çekirdeği yok etmek, yani nükleonlara bölmek için enerji vermek gerekir. E, bağlanma enerjisinden daha az değil, E≥ E St.
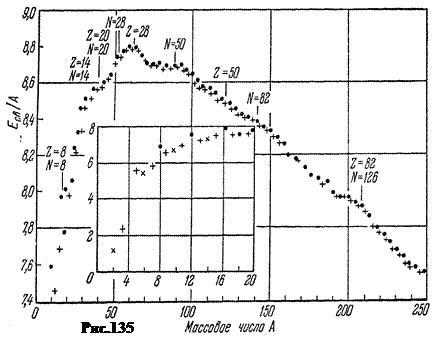
Çekirdeklerin stabilitesini değerlendirmek için gösterge özgül bağlanma enerjisi E St. CA, yani 1 nükleon başına enerji. Şekil 135, modülünün kütle numarasına deneysel bağımlılığını gösterir. A MeV/nükleondaki kararlı çekirdekler. Siyah noktalar, proton sayısının bulunduğu çift-çift çekirdekleri ifade eder. Z ve nötron sayısı A'dan Z'ye- çift sayılar. Düz haçlar - tuhaf olan çekirdeklere A. Eğik haçlar, tek-tek çekirdekleri ifade eder.
Ek, döteryum ile başlayan hafif çekirdekler için spesifik bağlanma enerjisini gösterir ( A= 2) ve neon ile biten ( A = 20).
İlk yaklaşımda, spesifik bağlanma enerjisi 7.4 MeV arasında değişir. ç döteryumda 8.8 MeV'ye kadar nükleon ç nükleon demirde, yani yaklaşık 1.4 MeV içinde ê nükleon. Ancak değişimin doğası gösterge niteliğindedir. Döteryumdan demire, büyüklük E St. CA büyür, maksimuma ulaşır A= 56, yani demir çekirdek bölgesinde. Büyüme ile demirden sonra Aözgül bağlanma enerjisi 7.5 MeV'ye düşer ç nükleon periyodik tablonun sonunda.
Eğrinin maksimumu, en kararlı çekirdeklere karşılık gelir. Bunlar, çekirdekleri içerir E St. CA> 8,6 MeV ç nükleon, eşit kalsiyum ile başlayan ve çift eşit kurşun ile biten E St. CA= 7,9 MeV ç nükleon. En hafif çekirdekler A < 20 энергетически выгодно сливаться друг с другом в более тяжёлые с выделением füzyon enerjisi. En ağır çekirdekler için A> 207, aksine, enerjinin serbest bırakılmasıyla devam eden parçalara bölünme süreci faydalıdır, buna denir. atomik.
İlginç bir şekilde, Şekil 135'teki bazı elementlerin çekirdekleri, eğrinin seyrinden biraz daha yüksektir. Bunlar, proton sayısının bulunduğu çekirdeklerdir. Z veya nötron sayısı N=A-Z sözde eşit sihirli sayılar: 2, 8, 20, 28, 50, 82, 126. Bu çekirdekler komşularına göre daha fazla mukavemete sahiptir. Çifte sihirli çekirdekler özellikle güçlüdür.Bunlardan çekirdek o kadar güçlüdür ki, ağır çekirdeklerin çürümesi sırasında bile bozulmadan uçar ( a-parçacık).
5 . Çekirdek dönüşleri.§18'de daha önce bahsedildiği gibi, protonlar ve nötronlar, elektronlarınkiyle aynı olan spin mekanik momentlerine sahiptir. Fiziksel eksene izdüşümünde, proton, nötron ve elektronun spin mekanik momentleri değerleri alabilir. L sz = ± ћç 2.
Spin momentlerinin deneysel olarak belirlenmesi için tüm yöntemler Ls protonlar, nötronlar ve çekirdekler mekanik spin momentlerinin bağlantısına dayanır Ls manyetik dönüş momentleri ile Hanım. arasındaki ilişkiyi bilmek Ls ve Hanım bu parçacıklar için manyetik moment M s'nin büyüklüğüne ve özelliklerine göre mekanik Ls.
en erken deneysel yöntemler manyetik dönüş momentlerinin belirlenmesi M s, hidrojen (proton dönüşü), döteryum (nükleer dönüş proton + nötron → nötron dönüşü) ve diğer atomların optik spektrumlarının aşırı ince yapısının çalışmasına dayanıyordu. Daha sonra, radyospektroskopi ile manyetik bir alandaki çekirdeklerin davranışını incelemeye başladılar. Kısa ömürlü izotopların çekirdeklerinin dönüşleri şu şekilde belirlenir: nükleer reaksiyonlar korunum yasalarına dayanarak, uyarılmış çekirdeklerin dönüşleri - yaydıklarına göre g-radyasyon.
Deneyler, çekirdeğin dönme momentlerinin (sırasıyla mekanik ve manyetik), çekirdeği oluşturan nükleonların momentlerinin geometrik toplamlarına eşit olduğunu göstermektedir. Her nükleonun toplam momentumunun, spin ve yörünge (yani, nükleonun çekirdekteki belirli bir "yörünge" boyunca hareketi ile ilişkili) anlarının toplamı olduğu akılda tutulmalıdır. Bir çekirdekteki bir nükleonun yörüngesel mekanik momenti, spin momentinin aksine, yalnızca tamsayı değerleri alabilir. Eğer bir L sz= ± ћç 2, o zaman L lz =± nћ, nerede n bir tamsayıdır. Nükleer spinlerle ilgili temel deneysel gerçekleri listeleyelim.
a. Çekirdeklerin mekanik momentlerini eşit olarak döndürün A her zaman tamsayıdır, tek A ile yarı tamsayı . Örneğin, döteronun dönüşü L sz = ± ( ћç 2+ћç 2) = ± ћ . Bir döteryum çekirdeğindeki bir nötron ve bir protonun dönüşleri paraleldir.
b. Temel durumdaki tüm çift-çift çekirdeklerin spin mekanik momentleri sıfıra eşittir. . Proton - nötron döteryum çiftindeki dönüşler paralel olduğundan, şu sonuca varmak gerekir: antiparalel dönüşler yalnızca aynı adı taşıyan çiftler halinde olabilir yani proton-proton ve nötron-nötron için.
içinde. Kalan kararlı çekirdeklerin spin mekanik momentleri, 9ћç 2, yani çekirdeğe giren tüm parçacıkların dönüş ve yörünge momentlerinin mutlak değerlerinin toplamına kıyasla çok küçüktürler. Bu, nükleonların çoğunun, sıfır toplam momentuma sahip kapalı kabuklarda güçlü bir şekilde bağlı olduğunu ve nükleer dönüşün oluşumuna katılmadığını göstermektedir.
6. Çekirdeklerin manyetik momentleri. Sıfır olmayan spinli her çekirdeğin bir manyetik momenti vardır. M çekirdeğin düzgün bir dış manyetik alanla etkileşimini karakterize eden B . Manyetik momentin yönü M mikropartiküller, spin mekanik momentinin yönü ile çakışır Ls imzalamak kadar. Ms = g Ls (19.5)
Burada g – jiromanyetik oran. Proton için pozitiftir (vektörler Hanım ve Ls çakışır, nötron için negatiftir (vektörler Hanım ve Ls zıttır). Çekirdeklerin ve nükleonların manyetik momentlerini belirlemek için birçok yöntem vardır. Bunlardan üçünü ele alalım.
a. Optik spektrumların aşırı ince yapısının incelenmesi. Bu yöntem bir önceki paragrafta zaten belirtilmiştir. Sadece bu şekilde nükleer manyetik momentlerin elektronun spin manyetik momentinden üç büyüklük mertebesi daha küçük olduğunu tespit etmenin mümkün olduğunu ekliyoruz. nükleer magneton M i = eћç 2m p= 5.05 10 -27 J ç TL. Bu yüzden aşırı ince bölme spektral çizgilerüç büyüklük sırası daha az iyi yapı, elektronun dönme momentinin yörünge ile etkileşimi nedeniyle.
 b. Nükleer manyetik rezonans yöntemi
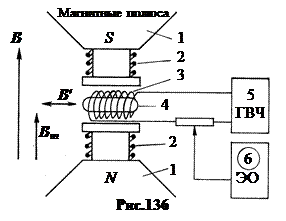
güçlü bir sabit manyetik alanda bulunan bir çekirdeğin dönüşünün, belirli bir rezonans frekansının zayıf bir yüksek frekanslı alanının etkisi altında "devrilebilmesi" gerçeğinde yatmaktadır. Kurulum şeması Şekil 136'da gösterilmiştir.
b. Nükleer manyetik rezonans yöntemi
güçlü bir sabit manyetik alanda bulunan bir çekirdeğin dönüşünün, belirli bir rezonans frekansının zayıf bir yüksek frekanslı alanının etkisi altında "devrilebilmesi" gerçeğinde yatmaktadır. Kurulum şeması Şekil 136'da gösterilmiştir.
 Üç manyetik alanlar. İlk olarak, güçlü bir kalıcı manyetik alan B≈ Mıknatıslar tarafından oluşturulan 1 T 1. Manyetik alanın amacı B
nükleer manyetik moment arasındaki bağlantının kopmasıdır ve elektron kabuğu, nükleer seviyelerin aşırı ince Zeeman bölünmesinin oluşturulması. İkinci olarak, bobin 3 tarafından jeneratörden 5 oluşturulan yüksek frekanslı alan B
"
, dik yönlendirilmiş B
. alan frekansı B
"
değişebilir. Bu alanın amacı, nükleer dönüşün rezonans kırılmasıdır. Üçüncüsü, bobinler 2 tarafından oluşturulan modüle edici değişken alan B
m, yönlendirilmiş paralel B
ve 50 Hz'lik düşük bir sabit frekansa sahiptir. Bu alanın amacı, rezonansta osiloskop 6 üzerinde durağan bir resim elde etmek için nükleer dönüşün tersine çevrilmesini saniyede 50 kez tekrarlamaktır. Örnek tarafından rezonansta emilen enerjiyi ölçerek, güçlü bir manyetik alanın indüksiyonu B
ve jeneratörün frekansı, modern tesislerde çekirdeğin manyetik momentini 6 ondalık basamak doğrulukla belirlemek mümkündür.
Üç manyetik alanlar. İlk olarak, güçlü bir kalıcı manyetik alan B≈ Mıknatıslar tarafından oluşturulan 1 T 1. Manyetik alanın amacı B
nükleer manyetik moment arasındaki bağlantının kopmasıdır ve elektron kabuğu, nükleer seviyelerin aşırı ince Zeeman bölünmesinin oluşturulması. İkinci olarak, bobin 3 tarafından jeneratörden 5 oluşturulan yüksek frekanslı alan B
"
, dik yönlendirilmiş B
. alan frekansı B
"
değişebilir. Bu alanın amacı, nükleer dönüşün rezonans kırılmasıdır. Üçüncüsü, bobinler 2 tarafından oluşturulan modüle edici değişken alan B
m, yönlendirilmiş paralel B
ve 50 Hz'lik düşük bir sabit frekansa sahiptir. Bu alanın amacı, rezonansta osiloskop 6 üzerinde durağan bir resim elde etmek için nükleer dönüşün tersine çevrilmesini saniyede 50 kez tekrarlamaktır. Örnek tarafından rezonansta emilen enerjiyi ölçerek, güçlü bir manyetik alanın indüksiyonu B
ve jeneratörün frekansı, modern tesislerde çekirdeğin manyetik momentini 6 ondalık basamak doğrulukla belirlemek mümkündür.
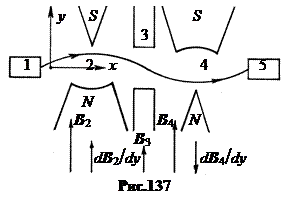
içinde. Isidor Rabi yöntemi, 1937 Nükleer manyetik rezonans yöntemi, bir nötronun manyetik momentini ölçemez, çünkü nötronlar bir ampulde tutulmazlar, sadece kirişlerde bulunurlar. Rabi yönteminin şeması Şekil 137'de gösterilmektedir. Kaynak 1'den gelen nötron ışını, zıt yönlü gradyanlara sahip, oldukça homojen olmayan iki manyetik alan 2 ve 4'ten art arda geçer. dBcdy. Homojen olmayan bir manyetik alanda, spin manyetik momenti olan bir parçacığın yörüngesi, manyetik momentin yönüne bağlı olarak gradyan boyunca veya gradyan karşısında eğridir. Birinci manyetik alan 2 nötronların yörüngesini büker, ikinci alan 4 onları dedektör 5'e odaklar. Şimdi, alanlar arasındaki boşluk 3'te, sabit güçlü homojen ve zayıf yüksek frekanslı manyetik alanların bir kombinasyonu aşağıdakilerden dahil edilir: önceki şemada, nötron dönüşü rezonansta dönecektir. Sonuç olarak, bu nötronlar ikinci homojen olmayan alan 4 tarafından odaklanmayacak ve dedektör 5'e düşmeyecektir. Bu nedenle, yüksek frekansın frekansına bağlı olarak dedektördeki sayma yoğunluğunun grafiğinde keskin bir düşüş olacaktır. -rezonansta frekans alanı. Konumu, nötronun manyetik momentinin büyüklüğünü belirleyecektir.
Rabi yöntemi ayrıca moleküler ışınları kullanabilir ve çekirdeklerin manyetik momentlerini belirleyebilir.
Nükleonların ve atom çekirdeğinin manyetik momentleri ile ilgili temel deneysel gerçekleri listeleyelim.
a. Protonun manyetik dönüş momentleri Mp ve nötron Mn şunlardır: Mp= 2,79 ben, Mn = –1,91 ben. Burada ben = hah 2m p= 5.05 10 -27 J ç Tl nükleer magnetondur.
b . Sıfır spinli çekirdeklerin manyetik momentleri sıfırdır..
içinde . Sıfırdan farklı spinli çekirdeklerin manyetik momentleri nükleer magneton düzeyindedir.
G. Nükleonların spin manyetik momentleri toplamsal değildir. Örneğin, döteron, paralel dönüşlü bir proton ve bir nötrondan oluşur. Döteronun toplam manyetik momenti M d = M p + Mn= 2,79 ben – 1,91 ben = 0,88 ben. Ama deneyim verir md = 0,86 ben. Bu toplamsızlık, nükleonlar arasında hareket eden kuvvetlerin merkezi olmamasıyla bağlantılıdır.
7 . Atom çekirdeği modelleri.İki ana zorluk nedeniyle tutarlı bir çekirdek teorisi henüz oluşturulmamıştır: nükleonlar arasında hareket eden kuvvetlerin yetersiz bilgisi ve hantallık. kuantum sorunu birçok beden. Sonuçta, kütle numarası olan bir çekirdek A en az aşağıdakilerden oluşan bir sistem tarafından tanımlanmalıdır: A denklemler. Bu zorluklar, çekirdeğin belirli bir dizi özelliğini basit denklemler yardımıyla tanımlamayı mümkün kılan nükleer modeller yaratılarak kısmen aşılabilir.
Her biri kendi nükleer özelliklerini ve kendi fenomen yelpazesini tanımlayan yaklaşık bir düzine model geliştirilmiştir. Bunlardan ikisini ele alalım.
a. damla modeli. teklif edildi Yakov Frenkel Bu modeldeki çekirdek sıvı damlasına, uyarılan çekirdek ise ısıtılmış damlaya benzetilmiştir. E, nükleon sayısı ile uyarılmış bir çekirdeğin enerjisi ise A nükleonlara 3 serbestlik derecesi atadıktan sonra şunu elde ederiz:
![]() . (19.6)
. (19.6)
E = 10 MeV'de T≈ 10 9 K. Nötron, proton emisyonu ve a-Böyle bir modeldeki parçacıklar, damla çekirdeğin buharlaşması olarak yorumlanabilir.
Düşme modelinin temeli, nükleer kuvvetlerin kısa menzilli etkisi ve yoğunluğun A kütle numarasından bağımsızlığıydı. Düşme modeli, bir çekirdekteki parçacıkların bağlanma enerjisi için yarı deneysel bir formül türetmeyi ve tanımlamayı mümkün kıldı. ağır çekirdeklerin fisyon süreci.
b. Kabuk modeli. 1951'de teklif edildi. Maria Goeppert-Mayer. Kabuk modelinin temeli, sözde özellikle kararlı çekirdeklerin varlığı gerçeğiydi. büyülü ve çift büyülü.
Bu modelde nükleonların birbirinden bağımsız hareket ettiği kabul edilir. ortalama merkezi simetrik alan. Atomda olduğu gibi çekirdeğin de ayrık seviyeler Pauli ilkesini dikkate alarak nükleonlarla dolu. Bu seviyeler şu şekilde gruplandırılmıştır: kabuklar her biri belirli sayıda nükleon içerebilir. Tamamen doldurulmuş bir kabuk, kararlı bir çekirdek oluşturur.
Sihirli ve çift sihirli çekirdeklerin varlığının deneysel gerçeğinden, doldurulmuş kabukların sihirli sayıda 2, 8, 20, 28, 50, 82, 126 nükleon içerdiği sonucu çıkar. onların sihirli olmayan komşuları. İki kat büyüye ek olarak (bunun dışında), buna şunlar dahildir:
Kabuk modeli matematiksel olarak iyi gelişmiştir ve sihirli çekirdeklerin ve 1 nükleon (eksik veya fazla) farklılık gösteren komşu çekirdeklerin özelliklerini açıklamaya olanak tanır. Bu modelde, nükleonlar arasında etkili olan gerçek kuvvetler, nükleonların birbirinden bağımsız olarak hareket ettiği kendi kendine tutarlı bir alan ile değiştirilir. Bina kabuklarının şeması, periyodik tabloyu doldurmayı biraz andırıyor, ancak ciddiyetten daha düşük.
Rutherford'un deneyleri, atomun pozitif yüklü küçük bir çekirdekten ve onun etrafında dönen elektronlardan oluştuğunu kanıtladı. Atomun kendisinin boyutuna kıyasla çekirdeğin son derece küçük olduğu ortaya çıktı. Çekirdek atomdan 100.000 kat daha küçüktür.
Atom çekirdeği bir bezelye boyutuna yükseltilirse, atomun çapı Ostankino kulesinin yüksekliğine eşit olacaktır.
Daha ileri çalışmalar, atom çekirdeğinin yükünün, D.I.'nin periyodik tablosundaki elementin seri numarası Z'nin ürününe eşit olduğunu göstermiştir. Mendeleyev üzerinde temel ücret. Yani atom numarası Z atomdaki elektron sayısını, çekirdekteki proton sayısını belirler.

Çekirdek yalnızca protonlardan oluşuyorsa, herhangi bir kimyasal elementin çekirdeğinin kütlesi, protonların kütlesi Z'ye eşit olacaktır. Ama aslında, tüm elementlerin çekirdeklerinin kütlesi çok daha büyüktür. Bu nedenle, 1920'de Rutherford, elektriksel olarak nötr bir parçacığın varlığını önerdi. Bu parçacık daha sonra deneysel olarak keşfedildi. onu aradılar nötron.
1932'de teklif ettiler proton-nötron modeli atom çekirdeği. Protonlar ve nötronlar denir nükleonlar.
Toplam nükleon sayısına (proton + nötron) denir. kütle numarası A. Şu anda, kimyasal elementlerin atomları için aşağıdaki tanımlamalar kabul edilmektedir:
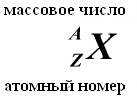

Çekirdek kararlılığı
Çekirdek neden kararlı? Yaklaşık 230 N gibi muazzam büyüklükteki Coulomb itme kuvvetleri, çekirdeğin içindeki protonlar arasında hareket eder, ancak çekirdek dağılmaz! Kararlılığın nedeni, farklı nitelikteki kuvvetlerin varlığıdır, bunlara denir güçlü etkileşimler.
Bu kuvvetler, Coulomb itici kuvvetlerinden 100 kat daha büyüktür. Sadece 10-15 m mesafelerde görünürler, sadece çekim kuvvetleridirler.
çekirdek kütlesi
Tüm çekirdeklerin (hidrojen hariç) kütleleri, onları oluşturan serbest proton ve nötronların kütlelerinden daha azdır. kütle farkı denir kütle kusuru.
Nötronun keşfi, atom çekirdeğinin yapısı fikrinde hemen bir değişikliğe yol açtı. Nötronun keşfinden önce var olan çekirdeğin proton ve elektronları içerdiği hipotezi çoğu bilim insanı tarafından desteklenmedi. 1932'de, olağanüstü keşifler için şaşırtıcı derecede üretken olan Rus bilim adamı Dmitry Dmitrievich Ivanenko, çekirdeğin proton-nötron modeli hakkında bir hipotez ortaya koydu, modelindeki elektronlar çekirdeğin bir parçası değildi. Bir süre sonra Heisenberg, benzer bir çekirdek modelini ifade etti. Bu modelin birçok bilim adamı tarafından şüpheyle kabul edildiğini söylemek gerekir. Onlara, P bozunması sırasında elektron emisyonuyla çelişiyor gibi geldi. Heisenberg, "en seçkin fizikçiler tarafından ağır bir şekilde eleştirildi" diye hatırladı. Ivanenko, hem bilim adamlarını keşfinin doğruluğuna ikna etmek hem de önceliğini savunmak için çok çaba harcadı. Kısa süre sonra çekirdeğin proton-nötron modeli tanındı ve genel olarak kabul edildi, ancak atomun çekirdeği hala birçok sır içeriyor. Bir atomun çekirdeğini oluşturan parçacıklar hakkında birkaç söz söyleyelim. (Kuantum mekaniğine göre hem protonların hem de nötronların da dalga özelliklerine sahip olduğu unutulmamalıdır).
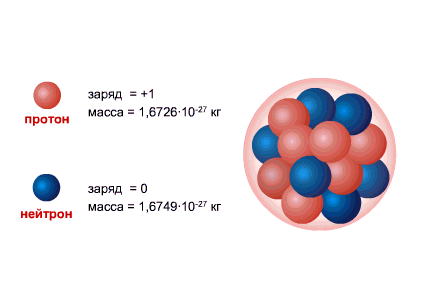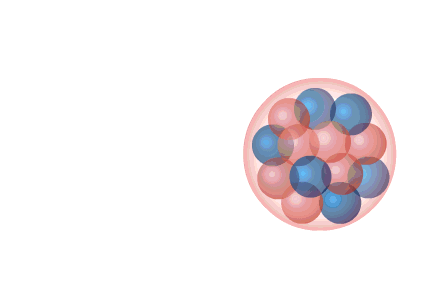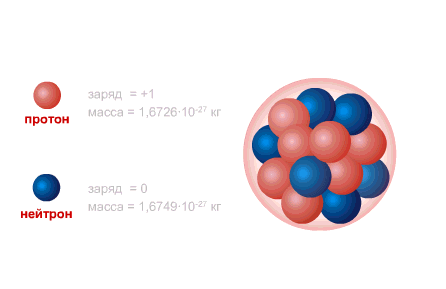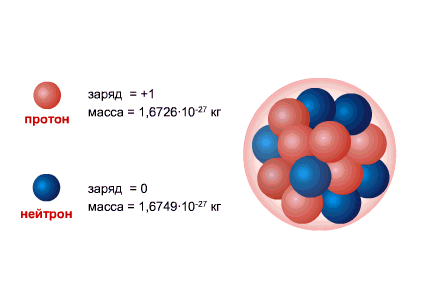
PROTON hidrojen atomunun çekirdeğidir, yükü büyüklük olarak elektron yüküne eşittir ve işaret olarak zıttır (+e = 1,6 x 10-19 C), ve kütle (mp = 1.6726485 ± 0.0000086) x 10- 27 kilogram.
NEUTRON, sıfıra eşit bir yüke ve pratik olarak bir protonun kütlesine (mm = 1.674954 ± 0.000009) x 10-27 kg'a eşit bir kütleye sahiptir. 1, Nötronlar ve alınan protonlar yaygın isim nükleonlar. Çekirdekteki toplam nükleon sayısı, yani. çekirdekteki proton ve nötron sayısına kütle numarası denir ve A harfi ile gösterilir. Çekirdekteki proton sayısı Z ile gösterilir. Atom numarası olarak adlandırılır ve elektron sayısına da eşittir. atomun dış kabuğunda. Çekirdekteki nötron sayısı N = A - Z.
Joliot-Curie eşlerinin önerisi üzerine kimyasal elementler, element tanımının solunda iki indeks ile gösterilir: Üst indeks kütle numarasını, alt indeks proton sayısını gösterir, örneğin, 13 Al, 11 H. Aynı kimyasal elementin çekirdeğinde, nötron sayısı farklı olabilir ve proton sayısı aynıdır. Proton sayıları aynı, nötron sayıları farklı olan bu tür çekirdeklere izotop denir. Bazı izotoplar doğada bulunmaz, ancak nükleer reaksiyonlar sonucunda bilim adamlarının laboratuvarlarında elde edilebilir.
Atom çekirdeği- Merkezi kısmı atom, onun ana ağırlık(%99.9'un üzerinde). Çekirdek pozitif yüklüdür, çekirdeğin yükü belirler kimyasal element atomun ait olduğu. Çeşitli atomların çekirdeklerinin boyutları birkaç femtometreler atomun kendisinden 10 bin kat daha küçük olan.
Atom çekirdeği çalışmaları nükleer Fizik.
Atom çekirdeği oluşur nükleonlar- pozitif yüklü protonlar ve nötr nötronlar aracılığıyla birbirine bağlı olan güçlü etkileşim. Proton ve nötronun kendi açısal momentumları vardır ( geri), eşittir [sn 1] ve ilgili manyetik moment. Çekirdeğinde nötron içermeyen tek atom hafif hidrojendir ( protiyum).
Belirli sayıda proton ve nötron içeren bir parçacık sınıfı olarak kabul edilen atom çekirdeğine genel olarak nüklid .
Çekirdekteki proton sayısına onun adı verilir. Görev numarası- bu numara seri numarasına eşittir eleman atomun ait olduğu tablo (Periyodik eleman sistemi) Mendeleyev. Çekirdekteki proton sayısı yapıyı belirler elektron kabuğu nötr atom ve dolayısıyla Kimyasal özellikler karşılık gelen eleman. Bir çekirdekte bulunan nötron sayısına denir. izotop numarası. Proton sayıları aynı, nötron sayıları farklı olan çekirdeklere denir. izotoplar. Nötron sayıları aynı, proton sayıları farklı olan çekirdeklere denir izotonlar. İzotop ve izoton terimleri, belirtilen çekirdekleri içeren atomlarla ilgili olarak ve ayrıca bir kimyasal elementin kimyasal olmayan çeşitlerini karakterize etmek için de kullanılır. Bir çekirdekteki toplam nükleon sayısına çekirdek denir. kütle Numarası() ve yaklaşık olarak periyodik tabloda belirtilen bir atomun ortalama kütlesine eşittir. Kütle numarası aynı fakat proton-nötron bileşimi farklı olan nüklidlere denir. izobarlar.
Herhangi bir kuantum sistemi gibi, çekirdekler de yarı kararlı uyarılmış durumda olabilir ve bazı durumlarda ömür bu durum yıl olarak hesaplanır. Çekirdeklerin bu tür uyarılmış hallerine denir. nükleer izomerler .
Rutherford'un deneyleri, atomun pozitif yüklü küçük bir çekirdekten ve onun etrafında dönen elektronlardan oluştuğunu kanıtladı. Atomun kendisinin boyutuna kıyasla çekirdeğin son derece küçük olduğu ortaya çıktı. Çekirdek atomdan 100.000 kat daha küçüktür.
Atom çekirdeği bir bezelye boyutuna yükseltilirse, atomun çapı Ostankino kulesinin yüksekliğine eşit olacaktır.
Daha ileri çalışmalar, atom çekirdeğinin yükünün, D.I.'nin periyodik tablosundaki elementin seri numarası Z'nin ürününe eşit olduğunu göstermiştir. Mendeleev temel ücrette. Yani atom numarası Z atomdaki elektron sayısını, çekirdekteki proton sayısını belirler.

Çekirdek yalnızca protonlardan oluşuyorsa, herhangi bir kimyasal elementin çekirdeğinin kütlesi, protonların kütlesi Z'ye eşit olacaktır. Ama aslında, tüm elementlerin çekirdeklerinin kütlesi çok daha büyüktür. Bu nedenle, 1920'de Rutherford, elektriksel olarak nötr bir parçacığın varlığını önerdi. Bu parçacık daha sonra deneysel olarak keşfedildi. onu aradılar nötron.
1932'de teklif ettiler proton-nötron modeli atom çekirdeği. Protonlar ve nötronlar denir nükleonlar.

Toplam nükleon sayısına (proton + nötron) denir. kütle numarası A. Şu anda, kimyasal elementlerin atomları için aşağıdaki tanımlamalar kabul edilmektedir:
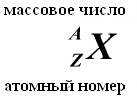

Çekirdek kararlılığı
Çekirdek neden kararlı? Yaklaşık 230 N gibi muazzam büyüklükteki Coulomb itme kuvvetleri, çekirdeğin içindeki protonlar arasında hareket eder, ancak çekirdek dağılmaz! Kararlılığın nedeni, farklı nitelikteki kuvvetlerin varlığıdır, bunlara denir güçlü etkileşimler.
Bu kuvvetler, Coulomb itici kuvvetlerinden 100 kat daha büyüktür. Sadece 10-15 m mesafelerde görünürler, sadece çekim kuvvetleridirler.
"Atom çekirdeğinin yapısı" - Ernest Rutherford (atomun yapısı). Görünmezden ölebilirsin. Becquerel Antoine Henri - 1897 "Kısa kollu kahraman" Toplu kusur?m ENERJİ!!! Igor Vasilievich Kurchatov. Atomun yapısı. vücut üzerinde biyolojik etki. Atom çekirdeğinin yapısı. Radyoaktivite - kendiliğinden radyasyon (uranyum tuzlarının bir fotoğraf plakası üzerindeki etkisi).
"Atomun çekirdeğinin yapısı" - Nükleer reaktör. Atom çekirdeğinin radyoaktif dönüşümü. kütle numaraları kimyasal elementler. Atomun yapısı. Uranyum çekirdekleri nötronlarla bombalanır. Atomun Rutherford modeli. İncelenen metalden folyo. Atom çekirdeğinin bileşimi. Rutherford'un deneyleri 1. Kalın duvarlı kurşun bir kaba bir radyum tanesi yerleştirildi.
Fiziğin “çekirdeğin yapısı” - Proactinius. Atom çekirdeğinin proton-nötron modeli. Yarım hayat. Nötronun keşfinin tarihi hakkında bilgi edinin. Görev numarası. radyasyon. Çekirdeklerde kaç nükleon bulunur. Atom çekirdeğinin yapısı. Bilinmeyen ürün. Cihaz. İzotoplar. parçacık. Nötron. Radyasyon. Atomun yapısı. Helyum çekirdeği. Yeni öğe.
"Atomun yapısı ve atom çekirdeği" - Enerji seviyesi(elektronik katman). Elektronik bir formül yazın. Elektronların alt düzeylere dağılımı. Atomun bileşimi. Atomların elektronik formüllerine örnekler. Hedefler. Azot atomunun elektronik grafik diyagramı. Bir atomda bir elektron bulma. Çekirdeği açmak. Elektron orbitallerinin görüntüsü. Enerji düzeyinde elektronların dağılımı için kurallar.
"Atom çekirdeğinin bileşimi" - NÜKLEER KUVVETLER - çekirdekteki protonları ve nötronları bağlayan çekici kuvvetler. Yük sayısı, temel olarak ifade edilen çekirdeğin yüküne eşittir. elektrik ücretleri. Yük sayısı, kimyasal elementin sıra sayısına eşittir. Görevler. Bir yükün varlığına bağlı değildir. Ders planı. Genel formçekirdek atamaları. Atom çekirdeğinin bileşimi.
"Atom çekirdeğinin bileşimi" - Atom çekirdeğinin boyutları. Bir atomun çekirdeğinin bileşimi. Çekirdek şarj. Çekirdeğin proton-nötron modeli. Bir kimyasal elementin atomunun çekirdeği. Proton ve nötron. Bir atomun çekirdeği. Radyoaktivite. Çekirdekteki nükleonların spesifik bağının grafiği. Rutherford'un deneylerinin şeması. Görev numarası. Nükleer kuvvetlerin özellikleri. Bir atomun çekirdeğindeki nötron sayısı. Nötronun keşfi.
Konuda toplam 7 sunum var






