Un grup este un rând vertical de elemente
Serii de elemente în cadrul cărora proprietățile se schimbă secvențial, cum ar fi o serie de opt elemente de la litiu la neon sau de la sodiu la argon, numite de Mendeleev perioade. Dacă scriem aceste două perioade una sub alta, astfel încât sodiul să fie sub litiu, iar argonul să fie sub neon, atunci obținem următorul aranjament de elemente:
Cu acest aranjament, elementele care sunt similare în proprietățile lor și au aceeași valență, de exemplu, litiu și sodiu, beriliu și magneziu etc., cad în coloanele verticale.
Împărțind toate elementele în perioade și așezând o perioadă sub alta, astfel încât elemente similare ca proprietăți și tip de compuși formați să cadă una sub alta, Mendeleev a întocmit un tabel, pe care l-a numit sistemul periodic de elemente pe grupuri și serii. Acest tabel în formă modernă, completat cu elemente descoperite după Mendeleev, este dat la începutul cărții.
Este alcătuit din zece rânduri orizontale și opt coloane verticale, sau grupuri, în care elemente asemănătoare între ele sunt plasate unul sub celălalt.
Să fim mai întâi atenți la aranjarea elementelor în rânduri orizontale. Există doar două elemente în primul rând - hidrogen și heliu. Aceste două elemente alcătuiesc prima perioadă. Al doilea și al treilea rând sunt formați din elementele pe care le-am considerat deja și formează două perioade a câte opt elemente fiecare. Ambele perioade încep cu un metal alcalin și se termină cu un gaz nobil. Toate cele trei perioade sunt numite perioade minore.
Al patrulea rând începe, de asemenea, cu un metal alcalin - potasiu. Judecând după cum s-au schimbat proprietățile în cele două rânduri anterioare, ne-am aștepta ca aici să se schimbe în aceeași secvență, iar al șaptelea element din serie să fie din nou halogen, iar al optulea - un gaz nobil. Cu toate acestea, acest lucru nu este observat. În loc de halogen, pe locul șapte se află manganul, un metal care formează atât oxizi bazici, cât și acizi, dintre care doar cel mai mare este similar cu oxidul de clor corespunzător. După mangan, mai sunt trei metale pe același rând - fier, cobalt și nichel, care sunt foarte asemănătoare între ele. Și doar următorul, al cincilea rând, începând cu cupru, se termină cu criptonul de gaz nobil. Al șaselea rând începe din nou cu rubidul de metal alcalin și așa mai departe.Astfel, în elementele care urmează argonului, o repetare mai mult sau mai puțin completă a proprietăților se observă numai după optsprezece elemente, și nu după opt, așa cum a fost cazul în al doilea. și al treilea rând. Aceste optsprezece elemente formează al patrulea - așa-numita perioadă mare, constând din două rânduri.
A cincea perioadă majoră este formată din următoarele două rânduri, al șaselea și al șaptelea. Începe această perioadă metal alcalin rubidiu și se termină cu xenonul de gaz nobil.
În al optulea rând, după lantan, există paisprezece elemente numite lantanide (sau lantanide), care sunt extrem de asemănătoare cu lantanul și între ele. Având în vedere această similitudine, datorită particularității structurii atomilor lor (vezi § 32), lantanidele sunt de obicei plasate în afara tabelului general, notând doar în caseta pentru lantan poziția lor în sistem.
Deoarece radonul de gaz nobil care urmează xenonului se află doar la sfârșitul celui de-al nouălea rând, al optulea și al nouălea rând formează, de asemenea, o perioadă mare - al șaselea, care conține treizeci și două de elemente.
În perioade mari, nu toate proprietățile elementelor se schimbă la fel de consistent ca în a doua și a treia. Aici, există încă o anumită periodicitate în schimbarea proprietăților în cadrul perioadelor în sine.
Astfel, cea mai mare valență a oxigenului crește inițial uniform la trecerea de la un element la altul, dar apoi, atingând un maxim la mijlocul perioadei, scade la două, după care crește din nou la șapte până la sfârșitul perioadei. În acest sens, perioadele mari sunt împărțite fiecare în două părți (două rânduri).
A zecea serie, care constituie a șaptea - încă neterminată - perioadă, conține nouăsprezece elemente, dintre care primele și ultimele treisprezece au fost obținute doar relativ recent prin mijloace artificiale. Cele paisprezece elemente care urmează actiniului sunt similare ca structură a atomilor lor cu actiniul; de aceea, sub denumirea de actinide (sau actinide), acestea sunt plasate, asemenea lantanidelor, în afara mesei generale.
În coloanele verticale ale tabelului, sau în grupuri, există elemente care au proprietăți similare. Prin urmare, fiecare grup vertical este, parcă, o familie naturală de elemente. Există opt astfel de grupuri în tabel. Numerele grupurilor sunt marcate în partea de sus cu cifre romane.
Elementele din primul grup formează oxizi cu formula generala, în al doilea - RO, în al treilea - etc. Astfel, cea mai mare valență a elementelor fiecărei grupe în ceea ce privește oxigenul corespunde, cu puține excepții, numărului de grup.
Comparând elemente aparținând aceluiași grup, este ușor de observat că, începând de la al cincilea rând (a patra perioadă), fiecare element prezintă cea mai mare asemănare nu cu elementul situat direct sub sau deasupra lui, ci cu elementele separate de acesta prin o celulă. De exemplu, în a șaptea grupă, bromul nu se alătură direct clorului și iodului, ci este separat de clor prin mangan și de iod prin tehnețiu; elemente similare din al șaselea grup - seleniul și telurul sunt separate de molibden, care este foarte diferit de ele; rubidium, care se află în primul grup, prezintă o mare asemănare cu cesiul, care se află în al optulea rând, dar seamănă puțin cu argintul situat direct sub el etc.
Acest lucru se explică prin faptul că din al patrulea rând încep perioade mari, fiecare constând din două rânduri situate unul deasupra celuilalt. Deoarece într-o perioadă proprietățile metalice slăbesc în direcția de la stânga la dreapta, este clar că în fiecare perioadă mare elementele rândului superior (par) le au mai pronunțate decât elementele celui inferior (impare). Pentru a marca diferența dintre rânduri, elementele primelor rânduri ale perioadelor mari sunt deplasate spre stânga în tabel, iar elementele din al doilea rând sunt deplasate la dreapta.
Astfel, începând din a patra perioadă, fiecare grupă a sistemului periodic poate fi împărțită în două subgrupe: „par”, formată din elemente ale rândurilor superioare, și „impar”, formată din elemente ale rândurilor inferioare. În ceea ce privește elementele perioadelor mici, pe care Mendeleev le-a numit tipice, în primul și al doilea grup ele sunt mai aproape în proprietățile lor de elementele rândurilor pare și sunt deplasate la stânga, în altele - de elementele rândurilor impare și sunt deplasate. La dreapta.
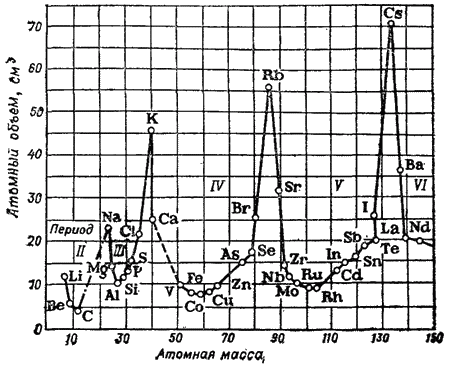
Orez. 1. Dependenţa volumului atomic al unui element de masa atomică.
Prin urmare, elementele tipice sunt de obicei combinate cu elemente similare de rânduri pare sau impare într-un subgrup principal, iar celălalt subgrup este numit secundar.
La construirea sistemului periodic, Mendeleev s-a ghidat după principiul aranjarii elementelor în funcție de creșterea maselor atomice. Cu toate acestea, după cum se poate observa din tabel, în trei cazuri acest principiu a fost încălcat. Da, argon masă atomică 39,948) este înainte de potasiu (39,098), cobalt (58,9332) este înainte de nichel (58,70) și teluriu (127,60) înainte de iod (126,9045). Aici Mendeleev s-a abătut de la ordinea pe care a adoptat-o, pornind de la proprietățile acestor elemente, care necesitau tocmai o astfel de secvență a aranjamentului lor. Astfel, el nu a acordat o importanță excepțională masei atomice și, stabilind locul unui element în tabel, s-a ghidat de totalitatea proprietăților sale. Studiile ulterioare au arătat că aranjarea elementelor în sistemul periodic realizată de Mendeleev este absolut corectă și corespunde structurii atomilor (pentru mai multe detalii, vezi capitolul III).
Deci, în sistemul periodic, proprietățile elementelor, masa lor atomică, valența și caracterul chimic se modifică într-o succesiune cunoscută, atât pe direcția orizontală, cât și pe cea verticală. Locul unui element în tabel este determinat, așadar, de proprietățile acestuia și, invers, fiecărui loc îi corespunde un element care are un anumit set de proprietăți.
Prin urmare, cunoscând poziția unui element în tabel, puteți specifica proprietățile acestuia destul de precis.
Nu numai proprietățile chimice ale elementelor, ci și foarte multe proprietăți fizice substanțe simple se schimbă periodic dacă le considerăm funcţii ale masei atomice.
Periodicitatea schimbării proprietăți fizice substanțele simple se dezvăluie clar, de exemplu, când se compară volumele lor atomice.
Arată în fig. 1 curba arată cum se modifică volumul atomic al elementelor odată cu creșterea masei atomice: metalele alcaline au cele mai mari volume atomice.
Multe alte constante fizice ale substanțelor simple se modifică și ele periodic.
Dmitri Ivanovici Mendeleev s-a născut la 27 ianuarie (8 februarie) 1834 în orașul Tobolsk, în familia directorului gimnaziului local. După ce a absolvit gimnaziul din Tobolsk, a intrat la Institutul Pedagogic din Sankt Petersburg, unde a absolvit în 1855 cu medalie de aur. În 1859, după ce și-a susținut teza de master pe tema „On volume specifice”, Mendeleev a plecat în străinătate într-o călătorie științifică de doi ani. După întoarcerea în Rusia, a fost ales profesor mai întâi la Institutul Tehnologic din Sankt Petersburg, iar doi ani mai târziu - la Universitatea din Sankt Petersburg, unde a condus lucrări științifice și pedagogice timp de 33 de ani. În 1892, Mendeleev a fost numit curator științific al Depozitului de Greutăți și Măsuri Exemplare, care a fost transformat la inițiativa sa în 1893 în Camera Principală de Greutăți și Măsuri (acum Institutul de Cercetare de Metrologie All-Union, numit după D. I. Mendeleev).
Cel mai mare rezultat al activității creatoare a lui Mendeleev a fost descoperirea lui în 1869, adică la vârsta de 35 de ani, a legii periodice și crearea sistemului periodic de elemente. Dintre celelalte lucrări ale lui Mendeleev, cele mai importante sunt „Studii ale soluțiilor apoase conform gravitație specifică”, teza de doctorat „Despre combinația alcoolului cu apa” și „Înțelegerea soluțiilor ca asociații”. Conceptele de bază ale teoriei chimice sau hidrate a soluțiilor dezvoltate de Mendeleev formează o parte importantă a teoriei moderne a soluțiilor.
Lucrarea remarcabilă a lui Mendeleev este cartea sa „Fundamentals of Chemistry”, în care pentru prima dată toate Chimie anorganică prezentate în termenii legii periodice.
Combinând organic teoria cu practica, Mendeleev a acordat de-a lungul vieții sale multă atenție dezvoltării industriei interne.
În 1984 comunitatea științifică Uniunea Sovieticăși multe țări ale lumii au sărbătorit solemn o sută cincizeci de ani de la nașterea lui D. I. Mendeleev, un om de știință remarcabil care a descoperit legea periodică și a creat sistemul periodic de elemente.
Sistem periodic elemente chimice
În prezent, sunt cunoscute 109 elemente chimice. Ultimele elemente au fost obținute în cantitate de doar câțiva atomi și nu au nicio semnificație practică. Cu toate acestea, sistemul periodic poate fi extins și mai mult.
Forme imagine grafică sistemul periodic (tabelul periodic) poate fi diferit; principalele două dintre ele sunt: lung si scurt.
În forma lungă a tabelului, fiecare perioadă este scrisă pe un rând. În scopuri educaționale, se folosește de obicei forma scurtă a tabelului, în care perioade lungi sunt scrise pe două rânduri.
Sistemul periodic este format din șapte perioade, dispuse orizontal în masă, și opt grupuri dispuse vertical.
O perioadă este un rând orizontal de elemente, care începe (cu excepția primei perioade) cu un metal alcalin și se termină cu un gaz inert (nobil).
Prima perioadă conține 2 elemente, a 2-a și a 3-a perioadă - câte 8 elemente. Se numesc prima, a doua și a treia perioadă perioade mici (scurte). Perioadele a 4-a și a 5-a conțin câte 18 elemente fiecare, a 6-a perioadă - 32 de elemente, a 7-a perioadă conține elemente de la a 87-a și mai departe, până la ultimul dintre elementele cunoscute în prezent - a 109-a. Se numesc perioadele a patra, a cincea, a șasea și a șaptea perioade mari (lungi).
Fiecare grup Sistemul periodic este format din două subgrupe: subgrupul principal (A) și subgrupul secundar (B). Subgrupul principal conţine elemente de perioade mici şi mari (metale şi nemetale). subgrup lateral conţine elemente doar de perioade mari (numai metale).
De exemplu, subgrupul principal al grupului I este format din elementele litiu, sodiu, potasiu, rubidiu, cesiu și franciu, iar subgrupul secundar al grupului I este format din elementele cupru, argint și aur. Subgrupul principal al grupului VIII este format din gaze inerte, iar subgrupul secundar este metalele fier, cobalt, nichel, ruteniu, rodiu, paladiu, osmiu, iridiu, platină, hassiu și meitneriu. .
Proprietățile substanțelor simple și ale compușilor elementelor se modifică monoton în fiecare perioadă şi spasmodic la limitele perioadelor. Această natură a modificării proprietăților este sensul dependenței periodice.
LA perioade de la stânga la dreapta, proprietățile nemetalice ale elementelor cresc monoton, în timp ce proprietățile metalice slăbesc. De exemplu, în a doua perioadă, litiul este un metal foarte activ, beriliul este un metal care formează un oxid amfoter și, în consecință, un hidroxid amfoter, B, C, N, O sunt nemetale tipice, fluorul este cel mai activ nemetal, neonul este un gaz inert. Astfel, la limitele perioadei, proprietățile se schimbă brusc: perioada începe cu un metal alcalin și se termină cu un gaz inert.
LA perioade de la stânga la dreapta, proprietățile acide ale oxizilor elementului și hidraților acestora cresc, în timp ce proprietățile de bază slăbesc. De exemplu, în a treia perioadă, oxidul de sodiu este un oxid bazic, oxidul de magneziu este bazic, oxidul de aluminiu este amfoter, iar oxizii de siliciu, fosfor, sulf și clor sunt oxizi acizi. Hidroxidul de sodiu este o bază tare (alcalină), hidroxidul de magneziu este o bază slabă insolubilă, A1 (OH) 3 este un hidroxid amfoter insolubil, acidul silicic este un acid foarte slab, H 3 PO 4 este un acid de rezistență medie, sulfuric este un acid puternic, HClO 4 (percloric) este cel mai puternic acid din această serie.
LA principalele subgrupuri de sus în jos, proprietățile metalice ale elementelor sunt îmbunătățite, în timp ce proprietățile nemetalice sunt slăbite. De exemplu, în subgrupa 4A: carbonul și siliciul sunt nemetale, germaniul, staniul, plumbul sunt metale, iar staniul, plumbul sunt metale mai tipice decât germaniul. În subgrupa 1A, toate elementele sunt metale, dar conform proprietăți chimice se poate urmări, de asemenea, întărirea proprietăților metalice de la litiu la cesiu și franciu.
Ca urmare, proprietățile metalice în cel mai exprimată în cesiu și franciu și nemetalice - în fluor.
LA principalele subgrupuri de sus în jos, proprietățile de bază ale oxizilor și hidraților acestora cresc, în timp ce proprietățile acide slăbesc. De exemplu, în subgrupa 3A: B 2 O 3 - oxid acid, și T1 2 O 3 - bazică. Hidrații lor: H 3 BO 3 este un acid, iar T1 (OH) 3 este o bază.
1. Descoperirea legii periodice de către D.I. Mendeleev.
2.
Descoperirea legii periodice de către D.I. Mendeleev
În ziua descoperirii legii periodice de către D.I. Mendeleev este considerat 1 martie 1869, deși calea către această descoperire a fost mulți ani mai târziu. Acum numele lui Mendeleev a intrat pentru totdeauna pe lista numelor celor mai mari oameni de știință din lume, iar descoperirea sa a devenit baza chimiei moderne.
Baza clasificării elementelor chimice D.I. Mendeleev a pus două proprietăți de bază cunoscute la acea vreme: 1) masa atomică; 2) proprietăți chimice. Lucrarea asupra sistematicii elementelor cunoscute (au fost 63 cunoscute atunci) a constat în faptul că D.I. Mendeleev a aranjat elementele în funcție de creșterea masei lor atomice, ținând cont de proprietățile lor fundamentale. El a descoperit că elementele similare din punct de vedere chimic apar la intervale regulate și că astfel multe dintre proprietățile lor sunt repetate periodic într-o serie de elemente. S-a stabilit dependența proprietăților elementelor de masele atomice.
Acest model a fost exprimat în legea periodică: proprietățile corpurilor simple, precum și formele și proprietățile compușilor elementelor, sunt într-o dependență periodică de mărimea greutăților (maselor) atomice ale elementelor.
Legea este un nou instrument puternic în studiul elementelor. El a făcut posibilă predefinirea proprietăților elementelor care nu au fost încă descoperite. Așa că a descris proprietățile elementelor necunoscute la acel moment sub nr. 21, 31, 32 (a lăsat celule goale). În timpul vieții lui D.I. Mendeleev, aceste trei elemente au fost descoperite: în 1875. descoperit 31 Ga (Lecoq de Boisbaudran), 1879 - 21 Sc (Nilson și Cleve), 1886 - 32 Ge (Winkler) și plasat în sistemul periodic. Aceste trei elemente ale D.I. Mendeleev a numit „întăritorii” legii periodice. El a scris: „Viitorul nu amenință legea periodică cu distrugerea, ci doar suprastructura și dezvoltarea ulterioară sunt promise”. Aranjarea elementelor prin creșterea masei atomice, D.I. Mendeleev a abandonat acest principiu de trei ori. Deci 18 Ar(A=39,948) costă până la 19 K(A=39,098); 27Co(A=58,933) este până la 28Ni(A=58,70); 52 Te(127,60) la 53 I(A=126,904). Astfel, el nu a acordat o importanță excepțională masei atomice, ci a stabilit locul elementului în tabel, ținând cont de totalitatea proprietăților elementelor. Dezvoltarea teoriei structurii atomului a arătat că plasarea elementelor de către D.I. Mendeleev în sistemul periodic este absolut corect și corespunde structurii atomilor.
În prezent, sunt deschise 114 articole. Există limite ale sistemului periodic? Știința răspunde: nu pot exista granițe clar delimitate - nici începutul, nici sfârșitul sistemului periodic. Deci, în 1953, a fost descoperit pozitroniul (Ps), a cărui masă este de aproape 1000 de ori mai mică decât atomul de hidrogen. El descoperă sistemul de elemente Mendeleev.
Pozitroniul poate fi reprezentat ca un electron și un pozitron. Un pozitron este o particulă care are o masă similară cu un electron, dar are o sarcină pozitivă. Positroniul (Ps) este un electron și un pozitron care se mișcă în jurul unui centru de greutate comun. Pozitroniul este format dintr-o înveliș electron-pozitron și nu are nucleu, dar are o durată de viață scurtă: aproximativ 10 -7 - 10 -10 sec. și dispare odată cu emisia de fotoni. Positroniul deschide tabelul periodic al elementelor, este un agent reducător puternic și poate participa la reacții chimice ca agent reducător. De exemplu, reface ionii: Fe 3+ la Fe 2+
Descoperirea pozitroniului a ridicat problema existenței unei lumi materiale complet diferite, construite din anti-atomi. Într-adevăr, pozitroniul este situat la granița dintre atomi - constând dintr-un nucleu încărcat pozitiv și electroni încărcați negativ și anti-atomi – sisteme de nuclee încărcate negativ și pozitroni încărcați pozitiv:
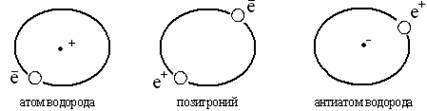
Antiatomii există, unii dintre ei (antiatomi de hidrogen, heliu) au fost studiati experimental. Prin urmare, nu se poate vorbi de începutul sistemului periodic, deoarece tabelul privind pozitroniul poate repeta în lumea antiatomilor structura tabelului periodic al lui D.I. Mendeleev.
Există o dezvoltare a sistemului de elemente chimice în domeniul elementelor grele: elementul 114 a fost deja descoperit. Este posibil să apară noi modele care să completeze (dar să nu încalce) legea D.I. Mendeleev.
Sfârșitul natural al sistemului periodic este determinat de numărul atomic al elementului pentru care durata medie de viață nucleul atomic devine mai mică de 1 * 10 -15 sec. Pentru elementele cu numere de serie 108-114 acest timp este de aproximativ 1*10 -12 sec. Dezvoltarea teoriei nucleelor atomice a făcut posibil să se considere că, la numere de serie mari, pot exista așa-numitele „insule de stabilitate”, i.e. atomi individuali cu o durată lungă de viață.
pana la inceput
Construirea sistemului periodic (perioada, grupa, subgrupa).
Expresia legii periodice este sistemul periodic al elementelor chimice. Sistemul periodic este o reprezentare grafică a legii periodice. În 1869, Mendeleev a dat o schiță a tabelului - o formă lungă, iar în 1870 a propus o formă scurtă. Au fost aduse unele modificări semnificative versiunii moderne a formei scurte (gazele nobile au fost mutate din grupul zero în grupul al optulea). În prezent, sunt cunoscute câteva sute de variante ale sistemului periodic de elemente (mai mult de 400) și toate conțin practic principiul de construcție propus de Mendeleev.
Sistemul periodic este format din 7 perioade și 8 grupe.
Perioadă - un rând orizontal de elemente, dispuse în ordinea creșterii sarcinii nucleare a atomilor, începând cu un metal tipic (alcalin), trecând printr-un element amfoter și terminând cu un nemetal (gaze nobile). Numărul perioadei indică numărul de niveluri de energie. Perioadele sunt mici și mari.
Malyugin 3. Structura sistemului periodic. Perioadele.
Versiunea pe perioadă scurtă a tabelului periodic este formată din perioade, serii, grupuri și subgrupe.
În versiunea pe termen lung, seriale nu sunt indicate.
Perioada - un rând orizontal al sistemului periodic de elemente chimice, aranjat în ordinea crescătoare a sarcinii nucleului atomic, care începe cu un metal alcalin ( Li, Na, K.Rb, Cs, Fr) și se termină cu un gaz inert (El, Ne, Ar, kr, Xe, Rn).
Excepții: prima perioadă, care începe cu hidrogen (nemetal).
Sistemul periodic are șapte perioade și 10 serii.
Perioadele sunt împărțite în mici și mari.
Prima perioada, care conține 2 elemente și, de asemenea a doua si a treia, cu 8 elemente fiecare, sunt numite mici. Ele constau dintr-un rând orizontal.
Perioadele rămase, având două rânduri orizontale în fiecare, se numesc mari.
Perioadele a patra și a cincea conțin fiecare câte 18 elemente chimice. Perioadele a cincea și a șasea - câte 32 de elemente chimice. A șaptea perioadă conține, conform ultimelor date, 32 de elemente, dintre care multe sunt obținute artificial prin efectuarea unei reacții de fuziune nucleară.
Fiecare perioadă majoră are două rânduri.
Se numesc rândurile superioare ale perioadelor mari chiar, rândurile de jos ciudat. În rânduri egale de perioade mari sunt doar metale.
În a șasea perioadă după lantanul La (numărul de serie Z=57) există 14 elemente (numerele de serie Z=5, care sunt similare ca proprietăți cu lantanul și se numesc lantanide, sunt situate în partea de jos a tabelului periodic.
În perioada a șaptea incompletă după actiniu Ac (numărul de serie Z = 89) există 14 elemente (numerele de serie Z =, care sunt similare ca proprietăți cu actiniul și sunt numite actinide. Ca și lantanidele, ele sunt situate în partea de jos a tabelului periodic (Fig. 1)
Fig.1. Aranjamentul perioadelor și serii
în sistemul periodic
Tabelul 1. Numărul de elemente în perioade:
Numărul perioadei | Număr de rânduri | Numele perioadei | Numărul de elemente | Numărul de elemente pe subgrupe |
||
latură | Lantanide/ actinide |
|||||
2 rânduri + lantanide | ||||||
2 rânduri + actinide |
Modele observate în perioade.
Fiecare perioadă (cu excepția primei) începe cu un metal tipic (Li, Na, K, Rb, Cs, Fr) și se termină cu un gaz nobil (He, Ne, Ar, Kr, Xe, Rn), precedat de un non tipic. -metal (F, Cl, Br, I, At).
În fiecare perioadă, de la stânga la dreapta, sarcina nucleului atomic crește, raza atomului scade, are loc o slăbire a metalului și întărirea proprietăților nemetalice, o slăbire a reducerii și întăririi proprietăților oxidante. a elementelor şi a substanţelor simple şi complexe pe care le formează.
Întrebări pentru autoexaminare
1. Din ce elemente structurale este compus tabelul periodic al elementelor chimice?
2. Ce este o perioadă?
3. Câte perioade și rânduri sunt în sistemul periodic?
4. Câte elemente sunt în fiecare perioadă?
5. Ce perioade sunt numite mici și de ce?
6. Câte serii au perioade mici?
7. Ce perioade se numesc mari? Câte rânduri au perioade lungi?
8. Ce trăsături există în structura perioadelor VI, VII?
9. Ce elemente încep fiecare perioadă?
10. Ce elemente se încheie fiecare perioadă?
11. Ce elemente preced gazele nobile (inerte)?
12. Cum se modifică proprietățile elementelor în perioade de la stânga la dreapta?
Vizualizați răspunsul
1. Din perioade, serii, grupuri și subgrupe.
2. Perioada - un rând orizontal al sistemului periodic de elemente chimice, dispus în ordinea crescătoare a sarcinii nucleului atomic, care începe cu un metal alcalin (Li, Na, K. Rb, Cs, Fr) și se termină cu un gaz inert (He, Ne, Ar, Kr, Xe, Rn).
3. 7 perioade și 10 rânduri.
4. Vezi tabelul 1.
5. Perioadele I, II si III se numesc mici, contin, respectiv, 2, 8, 8 elemente chimice.
6. Perioadele mici au câte un rând. Vezi fig.1.
7. Perioadele IV, V, VI, VII sunt numite mari. Fiecare perioadă majoră are 2 rânduri. Vezi fig.1.
8. VI conține 14 elemente - lantanide, perioada VII conține 14 elemente de actinide. Pentru comoditate, acestea sunt situate în partea de jos a mesei.
13. Fiecare perioadă (cu excepția primei) începe cu un metal alcalin tipic (Li, Na, K, Rb, Cs, Fr)
14. Fiecare perioadă se termină cu un gaz nobil (He, Ne, Ar, Kr, Xe, Rn).
15. Sunt precedate de nemetale tipice - halogeni (F, Cl, Br, I, At).
16. În fiecare perioadă, de la stânga la dreapta, are loc o slăbire a metalelor și întărirea proprietăților nemetalice, o slăbire a reducerii și întăririi proprietăților oxidante ale elementelor și substanțelor simple și complexe pe care le formează.
Sarcini pentru soluție independentă
1. În ce perioadă și serie sunt elementele cu numerele de serie 14, 48, 52, 56, 78? Specificați simbolul lor, numele rusesc, masa atomică relativă.
2. Scrieți simbolurile, denumirile și masele atomice relative ale elementelor din seria impară a perioadei IV.
3. Care element are proprietăți metalice mai pronunțate – calciu sau potasiu? De ce?
4. Care element are proprietăți nemetalice mai pronunțate: fosforul sau clorul? De ce?
5. Ce element al perioadei a patra este cel mai activ non-metal? De ce?
6. Care element din perioada a cincea este cel mai activ metal? De ce?
Vezi răspunsul:
Număr de serie | ||||||
Simbol element | ||||||
Masa atomică relativă |
impar este al 5-lea rând al PSHE, include elemente incluse |
|||||||||
Simbol element | |||||||||
Număr de serie | |||||||||
nume rusesc | germaniu | ||||||||
Masa atomică relativă |
3. Potasiu. Trebuie să te uiți la poziția elementelor în PSCE. Potasiul (K) și calciul (Ca) sunt în aceeași (a patra) perioadă. Într-o perioadă, proprietățile metalice slăbesc de la stânga la dreapta.
4. Clorul. Trebuie să te uiți la poziția elementelor în PSCE. Fosforul (P) și clorul (Cl) sunt în aceeași (a treia) perioadă. Într-o perioadă, de la stânga la dreapta, proprietățile nemetalice cresc.
5. Cel mai activ nemetal al acestei perioade este bromul. Într-o perioadă, de la stânga la dreapta, proprietățile nemetalice cresc. Kryptonul element inert nu prezintă activitate chimică, este precedat de cel mai activ nemetal.
6. Cel mai activ metal al acestei perioade este rubidiul. Perioada începe cu un metal alcalin activ (Li, Na, K. Rb, Cs, Fr), la deplasarea de la stânga la dreapta în perioadă, proprietățile metalice slăbesc .






