Structura moleculei Structura moleculei
STRUCTURA MOLECULEI
STRUCTURA MOLECULEI- (structura moleculară), aranjarea reciprocă a atomilor în molecule. Pe parcursul reacții chimice are loc o rearanjare a atomilor în moleculele reactivilor și se formează noi compuși. Prin urmare, una dintre problemele chimice fundamentale este de a elucida aranjarea atomilor în compușii inițiali și natura modificărilor în formarea altor compuși din aceștia. Primele idei despre structura moleculelor s-au bazat pe analiza comportamentului chimic al materiei. Aceste idei s-au complicat pe măsură ce s-au acumulat cunoștințele despre proprietățile chimice ale substanțelor. Aplicarea legilor de bază ale chimiei a făcut posibilă determinarea numărului și tipului de atomi care alcătuiesc molecula unui compus dat; aceste informații sunt conținute în formula chimică. De-a lungul timpului, chimiștii și-au dat seama că o singură formulă chimică nu este suficientă pentru a caracteriza cu exactitate o moleculă, deoarece există molecule de izomeri care au aceleași formule chimice, dar proprietăți diferite. Acest fapt i-a condus pe oamenii de știință la ideea că atomii dintr-o moleculă trebuie să aibă o anumită topologie, stabilizată de legăturile dintre ei. Această idee a fost exprimată pentru prima dată în 1858 de chimistul german F. Kekule. Conform ideilor sale, o moleculă poate fi descrisă folosind o formulă structurală, care indică nu numai atomii înșiși, ci și legăturile dintre ei. Legăturile interatomice trebuie să corespundă de asemenea cu aranjarea spațială a atomilor. Etapele dezvoltării ideilor despre structura moleculei de metan sunt prezentate în Fig. 1. Structura r corespunde datelor moderne: molecula are forma unui tetraedru regulat, în centrul căruia se află un atom de carbon, iar la vârfuri - atomi de hidrogen.
Orez. 1. PATRU METODE DE IMAGINIREA UNEI MOLECULE DE METAN. A - formula chimica. Sunt indicate doar numărul și tipul atomilor; b - formula structurala; c - schema reală a moleculei; d - aranjarea spațială a atomilor într-o moleculă.
Astfel de studii, însă, nu au spus nimic despre dimensiunea moleculelor. Aceste informații au devenit disponibile doar odată cu dezvoltarea unor metode fizice adecvate. Cea mai importantă dintre acestea a fost difracția cu raze X. Din imagini împrăștiate raze X pe cristale, a devenit posibil să se determine poziția exactă a atomilor într-un cristal, iar pentru cristalele moleculare, a fost posibilă localizarea atomilor într-o singură moleculă. Alte metode includ difracția electronilor pe măsură ce trec prin gaze sau vapori și analiza spectrelor de rotație ale moleculelor. Toate aceste informații sunt doar ideea generala despre structura moleculei. natură legături chimice vă permite să explorați modernul teoria cuantica. Și deși structura moleculară nu poate fi încă calculată cu o precizie suficient de mare, toate datele cunoscute despre legăturile chimice pot fi explicate. Existența unor noi tipuri de legături chimice a fost chiar prezisă.
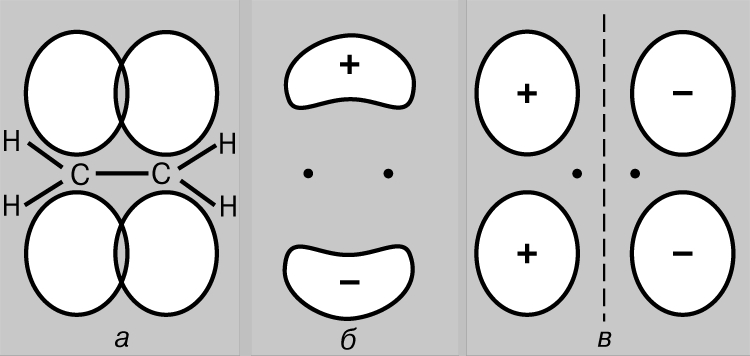
Legătură covalentă simplă. Molecula de hidrogen H 2 este formată din doi atomi identici. Conform măsurători fizice lungimea legăturii - distanța dintre nucleele atomilor de hidrogen (protoni) - este de 0,70 (1 = 10-8 cm), ceea ce corespunde razei atomului de hidrogen în starea fundamentală, adică. în starea cea mai scăzută de energie. Legătura dintre atomi poate fi explicată doar presupunând că electronii lor sunt localizați în principal între nuclee, formând un nor de particule de legare încărcate negativ și ținând împreună protoni încărcați pozitiv. Luați în considerare doi atomi de hidrogen în starea fundamentală, de exemplu. starea în care electronii lor se află în orbital 1s. Fiecare dintre acești electroni poate fi gândit ca o undă, iar orbital ca o undă staționară. Când atomii se apropie unul de celălalt, orbitalii încep să se suprapună (Fig. 2) și, ca și în cazul undelor obișnuite, apare interferența - suprapunerea undelor (funcțiile de undă) în regiunea de suprapunere. Dacă semnele funcțiilor de undă sunt opuse, atunci undele se distrug între ele în timpul interferenței (interferență distructivă), iar dacă sunt aceleași, atunci se adaugă (interferență constructivă). Când atomii de hidrogen se apropie unul de celălalt, sunt posibile două rezultate, în funcție de faptul dacă funcțiile de undă sunt în fază (Fig. 2a) sau în antifază (Fig. 2b). În primul caz, se va produce interferență constructivă, în al doilea - distructivă și vor apărea doi orbitali moleculari; unul dintre ele se caracterizează printr-o densitate mare în regiunea dintre nuclee (Fig. 2c), în timp ce celălalt se caracterizează printr-o densitate scăzută (Fig. 2d) - de fapt, un nod cu amplitudine zero care separă nucleele.
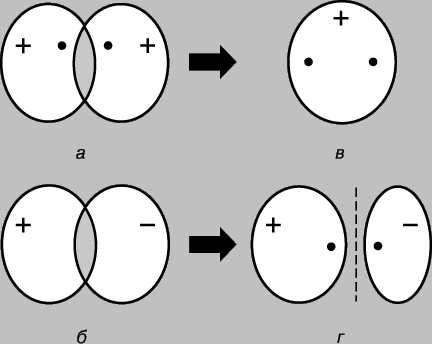
Orez. 2. REZULTATELE SUPRAPUNĂRII ORBITALILOR 1S ALE ATOMILOR DE HIDROGEN. a - fazele funcţiilor de undă coincid; se observă interferență constructivă și ca urmare se formează un orbital molecular cu o densitate mare în regiunea dintre nuclei (c); b - fazele funcţiilor de undă nu coincid; apare interferența distructivă, având ca rezultat formarea unui orbital molecular cu o densitate scăzută între atomi (r).
Astfel, atunci când atomii de hidrogen se apropie și interacționează, orbitalii 1s formează doi orbitali moleculari, iar doi electroni trebuie să umple unul dintre ei. Electronii din atomi se străduiesc întotdeauna să ocupe poziția cea mai stabilă - cea în care energia lor este minimă. Pentru orbitalul prezentat în Fig. 2c, o densitate mare este caracteristică în regiunea dintre nuclee și fiecare electron care ocupă acest orbital va fi de cele mai multe ori aproape de nuclee încărcate pozitiv, de exemplu. a lui energie potențială va fi mic. Dimpotrivă, orbitalul prezentat în Fig. 2d, densitatea maximă apare în regiunile situate în stânga și în dreapta nucleelor, iar energia electronilor din acest orbital va fi mare. Deci, electronii au mai puțină energie atunci când ocupă orbital, iar această energie este chiar mai mică decât ar avea dacă atomii ar fi infinit depărtați unul de celălalt. Deoarece există doar doi electroni în acest caz, ambii pot ocupa o orbită mai avantajoasă din punct de vedere energetic dacă spinurile lor sunt antiparalele (principiul Pauli). Prin urmare, energia unui sistem format din doi atomi de hidrogen scade pe măsură ce atomii se apropie unul de celălalt, iar pentru a îndepărta apoi atomii unul de celălalt, este necesară energie, egal cu energia formarea unei molecule stabile de hidrogen H2. Rețineți că o condiție necesară pentru existența unei molecule de hidrogen este localizarea preferențială a electronilor între nuclee în conformitate cu ceea ce am spus deja mai sus. Orbitul molecular c se numește orbital de legătură, iar orbital r se numește orbital de slăbire. Luați în considerare acum apropierea a doi atomi de heliu (numărul atomic 2). Și aici, suprapunerea orbitalilor 1s are ca rezultat formarea a doi orbitali moleculari, dintre care unul corespunde unei energii inferioare, iar celălalt unei energii superioare. De data aceasta, însă, trebuie plasați 4 electroni în orbitali, câte 2 electroni de la fiecare atom de heliu. Doar două dintre ele pot umple orbitalul de legătură cu energie joasă, celelalte două trebuie să ocupe orbitalul de energie înaltă r. Scăderea energiei datorită localizării favorabile a primei perechi este aproximativ egală cu creșterea energiei din cauza nefavorabile. pozitia celei de-a doua perechi. Acum apropierea atomilor nu dă un câștig de energie, iar heliul molecular He2 nu se formează. Acest lucru poate fi ilustrat convenabil cu o diagramă (Fig. 3); diferiți orbitali de pe ea sunt reprezentați sub formă niveluri de energie unde se pot găsi electroni. Acestea din urmă sunt indicate de săgeți îndreptate în sus și în jos pentru a distinge direcțiile învârtirilor. Doi electroni pot ocupa același orbital numai dacă spinurile lor sunt antiparalele.
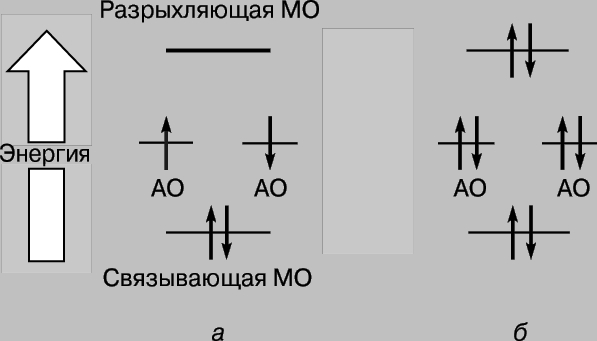
Orez. 3. MODIFICĂRI ALE ENERGIEI ELECTRONILOR în timpul formării (a) moleculelor de hidrogen și (b) heliu. Electronii sunt afișați cu săgeți îndreptate în sus și în jos pentru a le distinge spinurile. Orbitii moleculari cu energie joasă sunt legați, în timp ce orbitalii moleculari cu energie înaltă sunt antilegători.
Aceste principii generale sunt îndeplinite în formarea moleculelor din atomi. De îndată ce doi atomi se apropie atât de aproape încât orbitalii lor atomici (AO) încep să se suprapună, apar doi orbitali moleculari (MO): unul se leagă, celălalt se slăbește. Dacă fiecare dintre AO are doar un electron, ambele pot ocupa o legătură MO cu o energie mai mică decât cea a AO și pot forma o legătură chimică. Legăturile de acest tip, numite acum covalente, sunt cunoscute de multă vreme chimiștilor (ideea unei legături covalente a stat la baza teoriei octetului a legăturii formulată de chimistul fizic american G. Lewis în 1916). Formarea lor a fost explicată prin socializarea unei perechi de electroni prin atomi care interacționează. Conform conceptelor moderne, rezistența legăturii depinde de gradul de suprapunere a orbitalilor corespunzători. Toate cele de mai sus sugerează că legăturile dintre atomi pot fi formate în timpul socializării nu numai a doi, ci și a unuia sau a trei electroni. Cu toate acestea, ele vor fi mai slabe decât legăturile covalente convenționale din următoarele motive. Când se formează o legătură cu un electron, energia unui singur electron scade, iar în cazul formării legăturilor ca urmare a socializării a trei electroni, energia a doi dintre ei scade, în timp ce al treilea, dimpotrivă, crește, compensând scăderea energiei unuia dintre primii doi electroni. Drept urmare, legătura de trei electroni rezultată este de două ori mai slabă decât legătura covalentă obișnuită. Socializarea unui și a trei electroni are loc în timpul formării ion molecular hidrogen H 2+ și, respectiv, molecule HHe. În general, legăturile de acest tip sunt rare, iar moleculele corespunzătoare sunt foarte reactive.
Valenţă. Legături donator-acceptor. Toate cele de mai sus presupun că atomii pot forma atâtea legături covalente câte orbitali sunt ocupați de un electron, dar nu este întotdeauna cazul. (În schema de umplere AO acceptată, indicați mai întâi numărul învelișului, apoi tipul de orbital și apoi, dacă există mai mult de un electron în orbital, numărul lor (superscript). Deci, notația (2s) 2 înseamnă că orbitalul s al celui de-al doilea înveliș conține doi electroni.) Atomul de carbon în starea fundamentală (3P) are configurația electronică (1s) 2 (2s) 2 (2px)(2py), în timp ce doi orbitali nu sunt umpluți , adică conţin un electron. Cu toate acestea, compușii de carbon divalenți sunt foarte rari și au activitate chimică ridicată. De obicei, carbonul este tetravalent și acest lucru se datorează faptului că este nevoie de foarte puțină energie pentru a ajunge la starea excitată 5S (1s) 2 (2s) (2px)(2py)(2pz) cu patru orbiti gol. Costurile energetice asociate cu tranziția unui electron de 2s la un orbital 2p liber sunt mai mult decât compensate de energia eliberată în timpul formării a două legături suplimentare. Pentru formarea AO neumplută este necesar ca acest proces să fie favorabil energetic. Atomul de azot cu configurația electronică (1s) 2 (2s)2(2px)(2py)(2pz) nu formează compuși pentavalenti, deoarece energia necesară pentru a transfera electronul 2s la orbitalul 3d pentru a forma configurația pentavalentă (1s). ) 2 (2s )(2px)(2py)(2pz)(3d) este prea mare. În mod similar, atomii de bor cu configurația obișnuită (1s) 2 (2s)2(2p) pot forma compuși trivalenți în starea excitată (1s) 2 (2s)(2px)(2py), care apare atunci când un electron de 2s trece la 2p. -AO, dar nu formează compuși pentavalenți, deoarece trecerea la starea excitată (1s)(2s)(2px)(2py)(2pz), datorită transferului unuia dintre electronii 1s la mai multe nivel inalt, necesită prea multă energie. Interacțiunea atomilor cu formarea unei legături între ei are loc numai în prezența orbitalilor cu energii apropiate, adică. orbitali cu același număr cuantic principal. Datele relevante pentru primele 10 elemente ale tabelului periodic sunt rezumate mai jos. Starea de valență a unui atom este starea în care formează legături chimice, cum ar fi starea 5S pentru carbonul tetravalent.
Aceste modele sunt prezentate în următoarele exemple:
Toate cele de mai sus se aplică numai atomilor neutri. Ionii și atomii corespunzători au numere diferite de electroni; ionii pot avea aceeași valență ca alți atomi cu același număr de electroni. Deci, ionii N + și B au același număr de electroni (șase) ca atomul de carbon neutru și, în consecință, sunt tetravalenți. Ionii de amoniu NH 4 + și hidrura de bor BH 4 - formează săruri complexe și în lor configuratie electronica similar metanului CH 4 . Să presupunem acum că moleculele de amoniac NH3 și trifluorura de bor BF3 se apropie reciproc. Când un electron trece de la un atom de azot la unul de bor, obținem doi ioni, NH 3 + și BF 3 - , fiecare cu un orbital gol, ceea ce poate duce la formarea unei legături covalente. Molecula H3N-BF3 este un analog electronic al 1,1,1-trifluoretanului H3C-CF3. Legăturile formate ca urmare a transferului interatomic de electroni urmat de formarea unei legături covalente se numesc legături donor-acceptor.
Geometria moleculelor. Hibridizare. Toți orbitalii atomici, cu excepția lui s, sunt asimetrici sferic, iar gradul de suprapunere cu AO al altor atomi depinde de orientarea reciprocă a orbitalilor. Astfel, p-AO se va suprapune cu AO al altui atom în cel mai, dacă acesta din urmă este situat de-a lungul axei sale (Fig. 4a). Aceasta înseamnă că legăturile formate ca urmare a suprapunerii AO trebuie să aibă o geometrie specifică. Luați în considerare un atom de carbon în starea 5S. Are câte un electron în trei orbitali p și într-un al patrulea orbital s simetric sferic. S-ar părea că cele trei legături pe care le formează vor diferi de a patra, în timp ce legăturile p vor fi situate în direcții reciproc perpendiculare de-a lungul axelor p-AO. De fapt, există o altă imagine complet simetrică. Cel mai simplu mod de a-l explica este după cum urmează. Setul de orbitali (2s)+(2px)+(2py)+(2pz) este o anumită cantitate de „spațiu orbital” capabil să dețină patru perechi de electroni. Putem obține o descriere echivalentă a acestei situații amestecând toți orbitalii și împărțind suma lor în patru părți egale, astfel încât fiecare dintre orbitalii mixți sau hibridi rezultați să aibă o pereche de electroni. Prin urmare, starea 5S a carbonului poate fi reprezentată ca (1s)2(t 1)(t 2)(t 3)(t 4), unde ti sunt orbitali hibrizi, ceea ce explică cu succes formarea unei molecule de carbon tetravalent simetric. Să luăm acum în considerare ce se întâmplă atunci când p-AO este amestecat cu s-AO. Întărirea unei jumătăți a ganterei p în timpul interferenței va fi invariabil însoțită de o slăbire a celeilalte jumătăți a acesteia (Fig. 4b), ducând la formarea unui orbital hibrid asimetric (Fig. 4c). Acesta va fi suprapus efectiv de alți orbitali orientați în aceeași direcție, cu formarea de legături suficient de puternice. Acesta este unul dintre motivele pentru care atomul de carbon preferă să formeze legături prin hibridizare AO. Dar există un alt motiv. Luați în considerare un compus tipic de carbon tetravalent, cum ar fi metanul CH4. În ea, fiecare atom de hidrogen este ținut aproape de atomul de carbon de o pereche de electroni în comun. Aceste perechi se resping reciproc, iar configurația optimă a moleculei este astfel încât să se afle la distanța maximă posibilă unul de celălalt. În acest caz, atomii de hidrogen vor fi localizați la vârfurile unui tetraedru obișnuit, iar atomul de carbon va fi în centrul acestuia. O astfel de geometrie poate fi realizată folosind așa-numita. sp 3 orbitali hibrizi, fiecare dintre care este format din 1/4 din 2s-AO și unul dintre 2p-AO. Toți acești orbitali au formă identică, formează cu ușurință legături și sunt direcționați de la atomul de carbon din centrul unui tetraedru regulat către cele patru vârfuri ale sale (Fig. 1d).
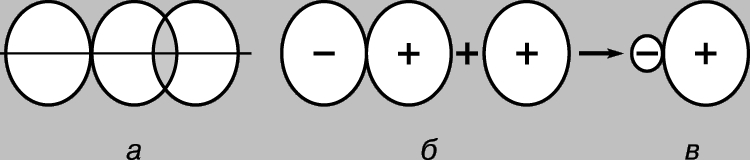
Orez. 4. Suprapunerea orbitalului p CU orbitalul altui atom este cea mai eficientă atunci când acesta din urmă este orientat de-a lungul aceleiași axe (a). Suprapunerea orbitalului p atomic cu orbitalul s (b) duce la formarea unei „gantere” asimetrice (c).
Atomul de azot ar putea forma legături doar cu ajutorul 2p-AO, unghiurile dintre care ar fi de 90°, dar respingerea reciprocă a perechilor de electroni de legătură și a perechilor de electroni nelegatori ai celei de-a 2-a învelișuri este minimizată dacă „tetraedrica” Orbitii sp3 participă la formarea legăturilor. Aici, însă, apare o altă caracteristică. Pentru ionul N+, configurațiile (1s)2(2s)(2p)3 și (1s)2(t)4, unde t sunt AO hibrizi sp3, sunt într-adevăr echivalente. Un alt lucru este atomul de azot neutru, al 7-lea electron al căruia poate ocupa fie 2s-AO, iar apoi se va obține configurația (1s)2(2s)(2p) 4, fie t-AO în configurația (1s). )2(t) 5 . Deoarece 2s-AO este situat sub 2p-AO și, prin urmare, sub orice orbital sp-hibridizat, prima configurație este mai favorabilă din punct de vedere energetic și ar fi de așteptat ca, în egală măsură, azotul trivalent să prefere configurația „nehibridizată”. Cu toate acestea, respingerea reciprocă a perechilor de electroni este aparent suficientă pentru ca hibridizarea să aibă loc, în care unghiurile de legătură într-un astfel de compus de azot precum amoniacul NH3 sunt apropiate de unghiurile corespunzătoare într-un tetraedru obișnuit, de exemplu. la 109°. Același lucru este valabil și pentru oxigenul divalent din compoziția moleculei de apă H 2 O. În toate aceste cazuri, atomii legați ocupă trei (sau două) vârfuri ale tetraedrului, iar perechile de electroni singuri din învelișul 2 ocupă vârfurile rămase. . Raționament similar se aplică și altor elemente tipice din grupele IV, V și VI ale tabelului periodic. Elementele tetravalente din grupa IV (Si, Ge, Sn și Pb) formează întotdeauna structuri tetraedrice, cu toate acestea, alte elemente din grupele V și VI (P, S, As, Se, Sb, Te) diferă de azot și oxigen și formează compuși cu unghiuri de legătură, aproape de 90°. Aparent din cauza dimensiune mai mare aceşti atomi de repulsie reciprocă electroni de valență nu este suficient pentru a face posibilă hibridizarea observată pentru N și O.
Legături care implică orbitali d. Spre deosebire de azot, atomul de fosfor poate forma cinci legături covalente. În starea fundamentală, fosforul are configurația (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)(3p z) și este trivalent, formând, ca și azotul, compuși ai PF 3 tip. Cu toate acestea, în acest caz, participarea electronilor 3s la formarea legăturilor este posibilă, deoarece d-AO (3d) are același principal număr cuantic. Într-adevăr, sunt cunoscuți și compuși ai fosforului pentavalent de tip PF 5, unde fosforul este în starea de valență +5, în concordanță cu configurația electronică (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)( 3p y)(3p z )(3d); legăturile în acest caz se formează ca urmare a hibridizării sp 3 d (adică, ca rezultat al amestecării unui s-, trei p- și un d-AO). Bipiramida triunghiulară este structura optimă din punctul de vedere al reducerii respingerii reciproce a perechilor de electroni de valență (Fig. 5a). Sulful poate fi nu numai divalent, ci și tetra- (SF4) și hexavalent (SF 6), fiind în stările (1s) 2 (2s) 2 (2p) 6 (3s) 2 (3p x)(3p y)( 3p z)(3d) și (1s) 2 (2s) 2 (2p) 6 (3s)(3p x)(3p y)(3p z)(3d 1)(3d 2), respectiv. În compușii de sulf tetravalent, repulsia reciprocă a electronilor celui de-al treilea înveliș este optimizată prin hibridizarea orbitalilor tuturor electronilor săi. Structura compușilor de acest tip este similară cu cea a PF 5 , dar unul dintre vârfurile bipiramidei triunghiulare este ocupat de o pereche de electroni singuri ai celei de-a treia învelișuri (Fig. 5b). În compușii cu sulf hexavalenți, repulsia reciprocă a electronilor este minimizată în timpul hibridizării sp 3 d 2, când toți orbitalii sunt echivalenți și îndreptați către vârfurile unui octaedru regulat (Fig. 5c).
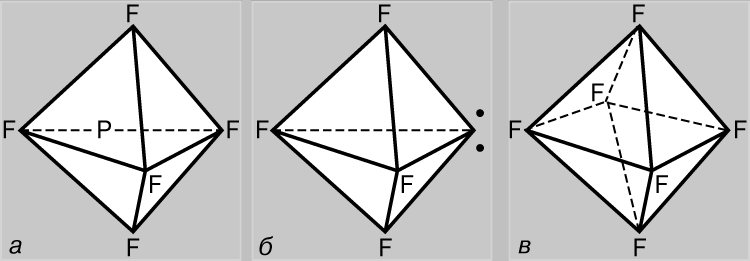
Orez. 5. PENTAFLUORURA DE FOSFOR (a) se formează cu participarea electronului 3s. Molecula de tetrafluorura de sulf (b) are o formă similară, dar unul dintre vârfurile bipiramidei triunghiulare este ocupat de o pereche de electroni neîmpărțiți ai celei de-a treia învelișuri (puncte). În hexafluorura de sulf (c), toți orbitalii sunt echivalenti și direcționați către vârfurile unui octaedru regulat.
Până acum, am luat în considerare doar acele elemente ale tabelului periodic în care cochiliile cu orbitali d sunt fie complet umplute, fie complet libere. Să ne oprim acum asupra elementelor de tranziție, în care aceste cochilii nu sunt complet umplute. Energia electronilor din diferiții orbitali ai celei de-a treia învelișuri crește în următoarea ordine: 3s
Conexiuni multiple. Unul dintre compușii cunoscuți ai carbonului este etilena C2H4, în care fiecare atom de carbon este legat doar de alți trei atomi. Prin analogie cu borul, se poate presupune că o astfel de geometrie va fi optimă, în care orbitalii hibrizi sp 2 se află în același plan. În acest caz, fiecare atom de carbon va avea un orbital p neutilizat (în hibridizarea sp 2), care conține unul dintre cei patru electroni de valență. Dacă toți cei șase atomi de etilenă se află în același plan, atunci cei doi p-AO neutilizați se suprapun unul cu celălalt, așa cum se arată în Fig. 6, a. Această suprapunere duce la formarea unei perechi de MO: o legare (Fig. 6b) și una de slăbire (Fig. 6c). Deoarece fiecare dintre ele conține doar un electron, ele pot forma o legătură MO de energie scăzută. Astfel, între atomii de carbon apare o legătură suplimentară, iar formula structurală a etilenei are forma
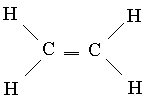
Acest nou tip de legătură diferă de cele formate prin suprapunerea orbitalilor de-a lungul liniei de legătură a atomilor în două privințe. Link-uri de ultimul tip, single Conexiuni C-C, sunt simetrice axial și, prin urmare, nu sunt afectate de rotația grupurilor pe care le leagă. În schimb, suprapunerea orbitalilor p depinde dacă toți cei șase atomi din molecula de etilenă se află în același plan, deoarece p-AO-urile trebuie să fie paralele pentru o suprapunere optimă. Astfel, dacă rotația în jurul unei singure legături C-C poate avea loc relativ liber, atunci în jurul unei legături duble C=C este foarte dificilă. Într-adevăr, molecula de etilenă este o structură plată rigidă. A doua diferență se referă la gradul de suprapunere orbitală. Suprapunerea încrucișată a p-AO este relativ ineficientă și, prin urmare, acest tip de legătură este slab. Prin urmare, etilena este mai reactivă decât compușii saturați care au doar legături simple.
Orez. 6. DACĂ TOȚI ȘASE ATOMI DE ETILEN se află în același plan, atunci doi neutilizați orbitali p atomici participă la suprapunerea transversală (a). Acest lucru duce la formarea unei perechi de orbitali moleculari - legare (b) și slăbire (c).
Legăturile formate atunci când orbitalii se suprapun de-a lungul liniei de legătură a atomilor (suprapunere longitudinală) se numesc legături s, iar când se suprapun transversal - legături p. Moleculele unor compuși, cum ar fi acetilena C2H2, conțin legături triple. În ele, fiecare atom de carbon este legat de vecinul său prin legături s formate din orbitali sp-hibrizi. Sunt coliniari, astfel încât patru atomi dintr-o moleculă de acetilenă se află pe aceeași linie dreaptă. P-AO-urile rămase ale atomilor de carbon, atunci când se suprapun, formează două legături p.
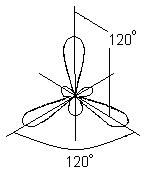
compuși aromatici. Molecula de benzen C6H6 este reprezentată ca un inel cu șase atomi de carbon, fiecare dintre care are atașat și un atom de hidrogen (Fig. 7a). Deoarece fiecare atom de carbon are trei vecini, se poate presupune că legăturile corespunzătoare sunt formate ca urmare a hibridizării sp 2 și se află în același plan la un unghi de 120° unele față de altele. Într-adevăr, molecula de benzen este o structură plată. P-AO neutilizate ale atomilor de carbon pot forma legături p (Fig. 7b), dar pentru benzen situația este mai complicată decât în cazurile considerate mai sus, când legăturile s-au format ca urmare a suprapunerii perechilor AO. În benzen, 2p-AO al fiecărui atom de carbon trebuie să se suprapună la fel de eficient cu 2p-AO al tuturor atomilor vecini. (Aici putem trage o analogie cu interferența cu unde multiple comparând suprapunerea orbitalilor dintr-o moleculă de benzen cu suprapunerea undelor difractate pe două fante sau pe un rețele de difracție.) Ca rezultat, pentru benzen obținem un set de inele moleculare. orbitali care acoperă toți cei șase atomi de carbon (Fig. 7, V). energie totală sistemele cu o astfel de configurație electronică sunt mai mici decât dacă p-AO formează legături p obișnuite în perechi. Într-adevăr, benzenul este mai stabil și mai puțin activ decât ne-am putea aștepta pe baza structurii sale „clasice” (Fig. 7d). Toate legăturile din molecula sa sunt simetrice, iar lungimile lor sunt aceleași, iar din punct de vedere al rezistenței ele ocupă o poziție intermediară între legăturile simple și duble. Sunt de asemenea cunoscuți și alți compuși în care electronii p participă la formarea MO "multicentri" și pentru care caracteristici similare lungimea legăturilor și activitatea chimică.
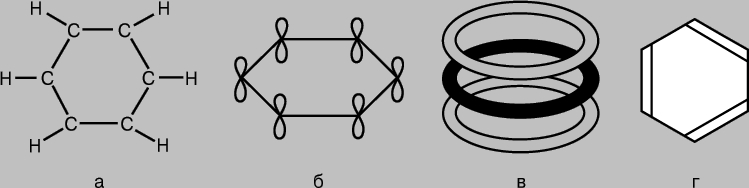
Orez. 7. MOLECULA DE BENZEN C 6 H 6 este un inel cu șase atomi de carbon, fiecare dintre care este, de asemenea, conectat la un atom de hidrogen (a). Orbitalii p „extra” ai atomilor de carbon se suprapun cu formarea de legături p (b), rezultând un set de orbitali moleculari inel care acoperă toți cei șase atomi (c). Ca rezultat, benzenul este un compus mai stabil și mai puțin activ decât s-ar putea aștepta din structura sa „clasică” (d).
Compuși care conțin legături multicentrice. Chiar și în molecule simple precum CH4, orbitalii moleculari individuali interacționează în mod necesar unul cu celălalt. Prin urmare, ideea de legături covalente localizate în două centre poate fi considerată doar ca o aproximare. De regulă, totuși, aceste interacțiuni sunt slabe, deoarece gradul de suprapunere orbitală este mic (cu excepția p-MO în compușii aromatici și înrudiți). Cu toate acestea, nu poate fi exclusă existența unor molecule cu AO care se suprapun în mod multiplicat, responsabile de formarea de legături prin împărțirea electronilor cu trei sau mai mulți atomi. Un exemplu este diboranul B2H6, care are șase perechi de electroni de valență; acest lucru nu este suficient pentru a forma cele șapte legături necesare pentru a crea structura clasică H3B-BH3. H. Longe-Higgins a propus structura diboranului, prezentată în fig. 8, a. În această structură, atomii centrali de hidrogen sunt legați prin legături cu trei centre formate ca urmare a suprapunerii orbitalilor hibrid sp3 a doi atomi de bor cu 1s-AO al atomului de hidrogen (Fig. 8b). Patru din cele șase perechi de electroni de valență sunt implicate în formarea de legături S obișnuite cu atomi de hidrogen „terminali” și două perechi - legături cu trei centre. Un exemplu mai complex de legătură multicentrică este oferit de molecula de dibenzencrom (Fig. 8c). Inelele benzenice din această moleculă sunt conectate la atomul de metal prin orbitali multicentrici complecși, care sunt formați ca urmare a suprapunerii p-MO al benzenului cu 3d-, 4s- și 4p-AO ale atomului central. Sunt cunoscuți și alți compuși similari având o structură tip sandwich.
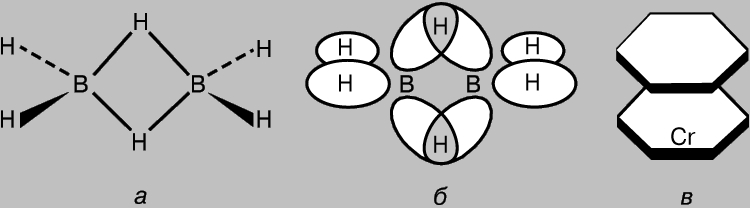
Orez. 8. În DIBORANE (a), atomii de hidrogen sunt legați prin legături cu trei centre formate ca urmare a suprapunerii orbitalilor hibrid sp3 a doi atomi de bor cu orbitalul atomic 1s al hidrogenului (b). Un exemplu mai complex de formare a legăturilor de acest tip este molecula de dibenzencrom (c).
perspective. Până în prezent, principiile generale ale structurii moleculelor pot fi considerate stabilite. Au fost dezvoltate metode fizico-chimice pentru determinarea structurii moleculelor complexe, inclusiv a celor biologice. În viitorul apropiat, progresul este posibil în două direcții conexe. Ar trebui să ne așteptăm, în primul rând, la o creștere a preciziei calculelor mecanice cuantice și, în al doilea rând, la o îmbunătățire metode experimentale măsurători ale parametrilor moleculari corespunzători.
LITERATURĂ
Kondratiev V.N. Structura atomilor si moleculelor. M., 1959 Coulson C. Valence. M., 1965 Slater J. Structura electronică molecule. M., 1965 Cartmell E., Fouls G. Valence and structure of molecules. M., 1979
Monoxidul de carbon, cunoscut și sub numele de monoxid de carbon, are o compoziție moleculară foarte puternică, este inert în el proprietăți chimiceși este slab solubil în apă. Acest compus este, de asemenea, incredibil de toxic; atunci când intră în sistemul respirator, se combină cu hemoglobina din sânge și nu mai transporta oxigen către țesuturi și organe.
Denumiri chimice și formulă
Monoxidul de carbon este cunoscut și sub alte denumiri, inclusiv monoxidul de carbon II. În viața de zi cu zi, este denumit în mod obișnuit monoxid de carbon. Acest monoxid de carbon este un gaz otrăvitor, incolor, insipid și inodor. Formula sa chimică este CO și masa unei molecule este de 28,01 g/mol.

Impact asupra organismului
Monoxidul de carbon se combină cu hemoglobina pentru a forma carboxihemoglobina, care nu are capacitatea de a transporta oxigen. Inhalarea vaporilor săi provoacă leziuni ale sistemului nervos central (central sistem nervos) și sufocare. Lipsa de oxigen rezultată provoacă dureri de cap, amețeli, scăderea ritmului cardiac și a ritmului respirator, ducând la leșin și moartea ulterioară a corpului.

Gaz toxic
Monoxidul de carbon este produs prin arderea parțială a substanțelor care conțin carbon, de exemplu în motoare combustie interna. Compusul conține 1 atom de carbon legat covalent la 1 atom de oxigen. Monoxidul de carbon este extrem de toxic și este una dintre cele mai frecvente cauze de otrăvire fatală la nivel mondial. Expunerea poate provoca leziuni ale inimii și altor organe.
Care sunt beneficiile monoxidului de carbon?
În ciuda toxicității sale grave, monoxidul de carbon este extrem de util - datorită tehnologiilor moderne, din acesta sunt create o serie de produse vitale. Monoxidul de carbon, deși astăzi este considerat un poluant, a fost întotdeauna prezent în natură, dar nu în cantități precum, de exemplu, dioxidul de carbon.
Cei care cred că compusul monoxid de carbon nu există în natură se înșală. CO se dizolvă în roca vulcanică topită la presiuni mari în mantaua pământului. Conținutul de oxizi de carbon din gazele vulcanice variază de la mai puțin de 0,01% până la 2%, în funcție de vulcan. Deoarece natura naturală a acestui compus nu este o valoare constantă, nu este posibil să se măsoare cu precizie emisiile de gaze naturale.

Proprietăți chimice
Monoxidul de carbon (formula CO) se referă la oxizi care nu formează sare sau indiferenți. Cu toate acestea, la o temperatură de +200 o Cu ea reacționează cu hidroxidul de sodiu. În acest timp, are loc formarea formiat de sodiu:
NaOH + CO = HCOONa (sare de acid formic).
Proprietățile monoxidului de carbon se bazează pe capacitatea sa de reducere. Monoxid de carbon:
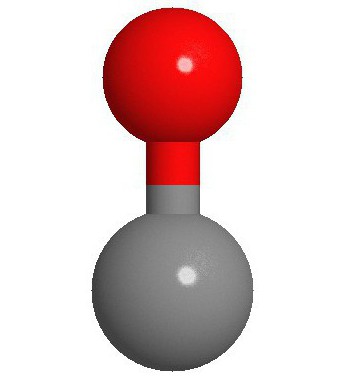
Structura moleculei
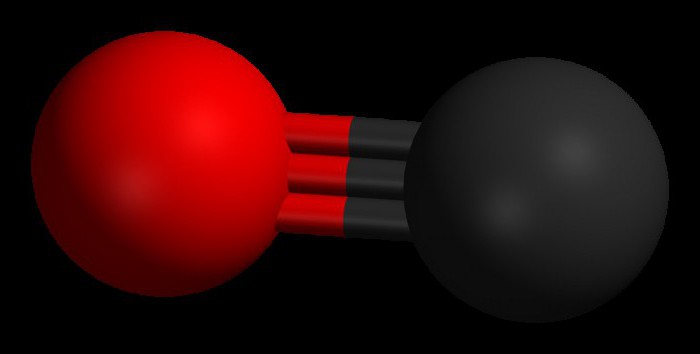
Cei doi atomi care alcătuiesc molecula de monoxid de carbon (CO) sunt legați printr-o legătură triplă. Două dintre ele sunt formate prin fuziunea electronilor p ai atomilor de carbon cu oxigenul, iar al treilea se datorează unui mecanism special datorat orbitalului liber 2p al carbonului și perechii de electroni 2p de oxigen. Această structură oferă moleculei o rezistență ridicată.
Un pic de istorie
Mai mult Aristotel de la Grecia antică a descris fumurile toxice produse de cărbunii aprinși. Mecanismul morții în sine nu era cunoscut. Cu toate acestea, una dintre metodele străvechi de execuție a fost încuierea infractorului într-o baie de aburi, unde erau cărbuni mocniți. Medicul grec Galen a sugerat că apar anumite modificări în compoziția aerului care provoacă rău atunci când este inhalat.
În timpul celui de-al Doilea Război Mondial, gazul din monoxid de carbon a fost folosit ca combustibil pentru autovehicule în părți ale lumii unde benzina și motorina erau rare. Au fost instalate generatoare externe (cu câteva excepții) de cărbune sau lemn, iar un amestec de azot atmosferic, monoxid de carbon și o cantitate mică de alte gaze a fost alimentat într-un amestecător de gaz. Era așa-numitul gaz de lemn.
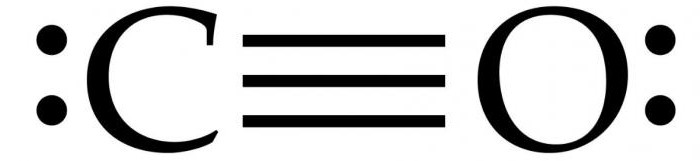
Oxidarea monoxidului de carbon
Monoxidul de carbon se formează în timpul oxidării parțiale a compușilor care conțin carbon. CO se formează atunci când nu există suficient oxigen pentru a produce dioxid de carbon (CO 2 ), cum ar fi atunci când un cuptor sau un motor cu ardere internă funcționează într-un spațiu închis. Dacă oxigenul este prezent, precum și anumite alte concentrații atmosferice, monoxidul de carbon arde, emițând lumină albastră, producând dioxid de carbon, cunoscut sub numele de dioxid de carbon.
Gazul de cărbune, utilizat pe scară largă până în anii 1960 pentru iluminatul interior, gătit și încălzire, avea CO ca componentă predominantă a combustibilului. Unele procese în tehnologii moderne, cum ar fi topirea fierului, încă produc monoxid de carbon ca produs secundar. Compusul CO însuși este oxidat la CO2 la temperatura camerei.
Există CO în natură?
Există monoxid de carbon în natură? Una dintre sursele sale naturale este reacții fotochimice care apar în troposferă. Se preconizează că aceste procese vor putea genera aproximativ 5×10 12 kg de substanță e anual. Printre alte surse, așa cum am menționat mai sus, se numără vulcanii, incendiile de pădure și alte tipuri de ardere.
Proprietăți moleculare
Monoxidul de carbon are Masă molară 28.0, ceea ce îl face puțin mai dens decât aerul. Lungimea legăturii dintre doi atomi este de 112,8 micrometri. Acesta este suficient de aproape pentru a oferi una dintre cele mai puternice legături chimice. Ambele elemente dintr-un compus CO au împreună aproximativ 10 electroni într-o înveliș de valență.
De regulă, o legătură dublă are loc în compușii organici carbonil. trăsătură caracteristică Molecula de CO este că o legătură triplă puternică apare între atomi cu 6 electroni comuni în 3 orbitali moleculari legați. Deoarece 4 dintre electronii împărtășiți provin de la atomul de oxigen și doar 2 din carbon, un orbital legat este ocupat de doi electroni din O 2 , formând o legătură dativă sau dipolară. Aceasta determină o polarizare C ← O a moleculei cu o mică sarcină „-” pe carbon și o mică sarcină „+” pe oxigen.
Cei doi orbitali legați rămași ocupă o particulă încărcată de carbon și una de oxigen. Molecula este asimetrică: oxigenul are o densitate de electroni mai mare decât carbonul și este, de asemenea, puțin încărcat pozitiv în comparație cu carbonul negativ.
chitanta
În industrie, monoxidul de carbon CO se obține prin încălzirea dioxidului de carbon sau a vaporilor de apă cu cărbune fără acces la aer:
CO 2 + C \u003d 2CO;
H 2 O + C \u003d CO + H 2.
Ultimul amestec rezultat se mai numește și apă sau gaz de sinteză. În condiții de laborator, monoxidul de carbon II prin expunerea acizilor organici la acid sulfuric concentrat, care acționează ca un agent de deshidratare:
HCOOH \u003d CO + H2O;
H 2 C 2 O 4 \u003d CO 2 + H 2 O.
Principalele simptome și ajutor pentru otrăvirea cu CO
Monoxidul de carbon provoacă otrăvire? Da, și foarte puternic. Intoxicația cu monoxid de carbon este cea mai frecventă apariție la nivel mondial. Cele mai frecvente simptome:
- senzație de slăbiciune;
- greaţă;
- ameţeală;
- oboseală;
- iritabilitate;
- pofta de mancare;
- durere de cap;
- dezorientare;
- deficiență de vedere;
- vărsături;
- leșin;
- convulsii.
Expunerea la acest gaz toxic poate provoca daune semnificative, care adesea pot duce la afecțiuni cronice pe termen lung. Monoxidul de carbon poate provoca daune grave fătului unei femei gravide. Victimelor, de exemplu, după un incendiu, ar trebui să li se acorde asistență imediată. este urgent să chemați o ambulanță, să dați acces la aer curat, să îndepărtați îmbrăcămintea care restricționează respirația, calm, cald. Otrăvirea severă, de regulă, este tratată numai sub supravegherea medicilor, într-un spital.
Aplicație
Monoxidul de carbon, așa cum am menționat deja, este otrăvitor și periculos, dar este unul dintre compușii de bază care sunt utilizați în industria modernă pentru sinteza organică. CO este utilizat pentru a produce metale pure, carbonili, fosgen, sulfură de carbon, alcool metilic, formamidă, acizi aromatici. Această substanță este folosită și ca combustibil. În ciuda toxicității și otrăvirii sale, este adesea folosit ca materie primă pentru producerea diverse substanțeîn industria chimică.
Monoxid de carbon vs dioxid de carbon: care este diferența?
Monoxidul de carbon și dioxidul de carbon (CO și CO 2 ) sunt adesea confundate unul cu celălalt. Ambele gaze sunt inodore și incolore și ambele afectează negativ sistemul cardiovascular. Ambele gaze pot pătrunde în organism prin inhalare, piele și ochi. Acești compuși, atunci când sunt expuși unui organism viu, au o serie de simptome comune - dureri de cap, amețeli, convulsii și halucinații. Majoritatea oamenilor le este greu să facă diferența și nu își dau seama că evacuarea mașinii emite atât CO, cât și CO 2 . În interior, o creștere a concentrației acestor gaze poate fi periculoasă pentru sănătatea și siguranța persoanei expuse la acestea. Care este diferența?
La concentrații mari, ambele pot fi fatale. Diferența constă în faptul că CO 2 este un gaz natural obișnuit necesar tuturor vieții vegetale și animale. CO nu este obișnuit. Este un produs secundar al arderii combustibilului fără oxigen. Diferența chimică critică este că CO 2 conține un atom de carbon și doi atomi de oxigen, în timp ce CO are doar unul. Dioxidul de carbon este neinflamabil, în timp ce monoxidul este mai probabil să se aprindă.
Dioxidul de carbon se găsește în mod natural în atmosferă: oamenii și animalele inspiră oxigen și expiră dioxid de carbon, ceea ce înseamnă că ființele vii pot rezista la cantități mici din acesta. Acest gaz este necesar și pentru realizarea fotosintezei de către plante. Cu toate acestea, monoxidul de carbon nu apare în mod natural în atmosferă și poate provoca probleme de sănătate chiar și la concentrații scăzute. Densitatea ambelor gaze este, de asemenea, diferită. Dioxidul de carbon este mai greu și mai dens decât aerul, în timp ce monoxidul de carbon este puțin mai ușor. Această caracteristică a acestora ar trebui să fie luată în considerare atunci când se instalează senzori corespunzători în case.
Prin legătură chimică se înțelege tipuri diferite interacțiuni care determină existența stabilă a compușilor biatomici și poliatomici: molecule, ioni, substanțe cristaline. Prin natura sa, o legătură chimică este o interacțiune între nucleele încărcate pozitiv și electronii încărcați negativ, precum și electronii între ei. Principalele tipuri de legături chimice: covalente, ionice, metalice. Două metode sunt utilizate pentru a descrie o legătură covalentă - metoda legăturii de valență (MVS) și metoda orbitalelor moleculare (MMO).
Metoda VS se bazează pe următoarele prevederi:
1. La formarea unei legături covalente (un mecanism de schimb pentru formarea unei legături) sau a unei perechi de electroni a unui atom participă numai electronii neperechi ai doi atomi cu spin direcționat opus.
Donator și orbital liber al altui atom - acceptor (mecanism donor-acceptor).
2. O legătură chimică covalentă între doi atomi are loc ca urmare a suprapunerii orbitali atomici cu formarea perechilor de electroni (socializarea a doi electroni).
Conform teoriei legăturilor de valență, o legătură covalentă este îndreptată spre suprapunerea maximă a orbitalilor atomici ai atomilor care interacționează.
Structura geometrică (spațială) a unei molecule constând din mai mult de doi atomi se datorează aranjament reciproc orbitalii atomici implicați în formarea legăturilor chimice. Molecula AB 2 poate avea un liniar ![]() , sau o structură unghiulară (a). Molecula AB 3 poate avea forma unui triunghi regulat (b), o piramidă trigonală (c). Molecula AB 4 are forma unui tetraedru (d).
, sau o structură unghiulară (a). Molecula AB 3 poate avea forma unui triunghi regulat (b), o piramidă trigonală (c). Molecula AB 4 are forma unui tetraedru (d).
A) 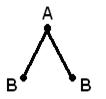 b)
b) 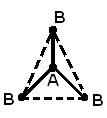 V)
V) 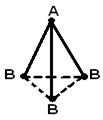 G)
G) 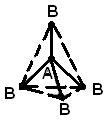
Structura spațială a unei molecule este determinată de tipul de hibridizare a orbitalilor de valență ai atomului central și de numărul de perechi de electroni neîmpărțiți conținute în stratul de electroni de valență.
Exemplul 1 Descrieți structura moleculelor din punctul de vedere al metodei legăturilor de valență: a) РН 3 , b) BBr 3 . Ce orbitali atomici sunt implicați în formarea legăturilor chimice? Specificați tipul de hibridizare (dacă are loc hibridizarea). Care este structura spațială a acestor molecule?
Soluţie. a) Formarea moleculei de PH 3.
Să scriem formulele electronice ale atomilor care formează molecula PH 3 în starea fundamentală (normală): 15 Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; 1 H 1s 1
Formule electron-grafice ale nivelului extern al acestor atomi:
În această moleculă, atomul central este un atom de fosfor, în care doar orbitalii p participă la formarea a trei legături chimice, situate pe același subnivel și având aceeași formă și aceeași energie. În consecință, nu există hibridizare în molecula de PH3.
Pentru o reprezentare vizuală a schemelor de valență, se poate folosi următoarea metodă. Electronii aflați pe stratul exterior de electroni sunt indicați prin puncte situate în jurul simbolului chimic al atomului. Electronii comuni a doi atomi sunt indicați prin puncte plasate între simbolurile lor chimice; o legătură dublă sau triplă este indicată prin două sau, respectiv, trei perechi de puncte comune. Folosind aceste notații, formarea moleculei de PH 3 poate fi reprezentată după cum urmează:
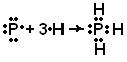 H
H
ê
Această schemă poate fi scrisă diferit: H - P - H, unde fiecare pereche de electroni care leagă doi atomi corespunde unei liniuțe reprezentând legătură covalentăîn formule structurale.
p – norii de electroni ai atomului de fosfor sunt orientați în direcții reciproc perpendiculare (de-a lungul axelor de coordonate) –p x, p y, p z și au formă de gantere. La atomul de hidrogen în formarea unei substanțe chimice Comunicații R-N este implicat un electron s, care are o formă de nor sferică. Când se formează o moleculă PH 3, norii de electroni p ai atomului de fosfor se suprapun cu norii de electroni s a trei atomi de hidrogen:
În conformitate cu cerințele metodei legăturilor de valență, trei legături
P - H ar trebui să fie situat la unghiuri apropiate de 90 ° C. Prin urmare, aranjarea spațială a legăturilor simple determină structura geometrică a moleculei. Molecula PH 3 ar trebui să aibă forma unei piramide trigonale:
În vârful piramidei se află un atom de fosfor, iar în vârful bazei sunt atomi de hidrogen.
b) Formarea moleculei BBr 3. În molecula ВВr 3, atomul central este un atom de bor.
Formule electronice ale atomilor:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Formulele grafice electronice ale nivelului extern au forma:
Deoarece borul din compus este trivalent, notăm formula electrografică a atomului de bor în stare excitată:
În formarea a trei legături chimice în molecula BBr 3 sunt implicați un orbital s- și doi p-orbitali, localizați la subniveluri diferite și având formă diferităși energie diferită
În acest caz, în locul celui original s- și doi p-orbitali ai atomului de bor excitat, se formează trei orbitali hibrizi echivalenți (sp 2 - hibridizare). Cu hibridizarea sp 2, norii de electroni hibrizi sunt aranjați în direcții care se află în același plan și sunt orientați la unghiuri de 120 ° unul față de celălalt:
Acest tip de hibridizare corespunde formării unei molecule triunghiulare plate. Când se formează molecula BBr 3, trei orbitali hibrizi ai atomului de bor se suprapun cu orbitalii p-electronici ai trei atomi de brom:
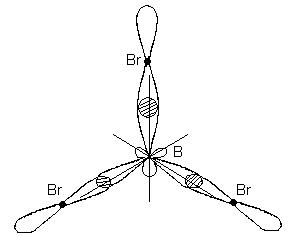
Molecula BBr 3 are forma unui triunghi regulat plat cu un atom de bor în centru și atomi de brom la vârfuri. Toate cele trei legături B-Br din molecula BBr 3 sunt echivalente.
Exemplul 2 Desenați schemele energetice pentru formarea moleculei F 2 și a ionului molecular F 2 + folosind metoda orbitalului molecular. Câți electroni sunt în orbitalii de legare și antilegare? Care este ordinea legăturilor în aceste particule? Precizați caracteristica lor magnetică (paramagnetism sau diamagnetism).
Soluţie. Conform teoriei orbitalilor moleculari (MMO), o moleculă este considerată ca o colecție de nuclee încărcate pozitiv și electroni încărcați negativ, unde fiecare electron se mișcă în câmpul altor electroni și al tuturor nucleelor.
A descrie o moleculă conform teoriei MMO înseamnă a determina tipul orbitalilor ei, energiile lor și a determina natura distribuției electronilor peste orbitali.
Când se formează o moleculă, apar două tipuri de orbitali moleculari - legarea și slăbirea. Dacă, în timpul formării unei molecule din atomi, tranziția unui electron la un orbital molecular este însoțită de o scădere a energiei, atunci un astfel de orbital molecular este legarea. Dacă tranziția unui electron la un orbital molecular este însoțită de o creștere a energiei, atunci un astfel de orbital molecular va fi slăbirea.
Electronii din molecule sunt localizați în orbitalii s- și p-moleculari. S-orbitalii pot fi formați prin suprapunerea s - orbitalii atomici și suprapunerea 2p x - orbitalii atomici. În acest caz, se formează orbitali moleculari: s-bonding (s st) și s-loosening (s raz). Când orbitalii atomici 2p y și 2p z se suprapun, se formează orbitali moleculari: p sv2Py, p sv2P z și p ori 2Py, p ori 2P z. Ordinea de plasare a electronilor în orbitalii moleculari este aceeași ca și în cazul orbitalilor atomici, adică corespunde principiului energiei minime, principiului lui Pauli, regula lui Hund.








