Koliki je pritisak pare zasićenja. Zavisnost pritiska zasićene pare o temperaturi. Kipuće
Tema: Osnove molekularne kinetičke teorije
Lekcija: Ovisnost o pritisku zasićena para od temperature. Kipuće
U prethodnim lekcijama uveli smo koncept idealnog gasa kao modela u kojem se sve gasni zakoni koje smo proučavali. Međutim, to ne znači da je molekularna fizika, a posebno molekularno-kinetička teorija, ograničena na proučavanje samo idealnih gasova. Za stvarne gasove, naravno, važe naši proračuni na temu "osnovi molekularno-kinetičke teorije". Međutim, očekuje se da će odnos između parametara stvarnih plinova imati nešto drugačiji oblik od ovog odnosa za idealne plinove.
Uzmite u obzir takav pravi gas kao što je zasićena para. Podsjetimo da se zove samo zadani trajekt gasovitom stanju određenu supstancu (najčešće, kada se kaže "para", misli se upravo na vodenu paru). Zasićena para znači sljedeće:
Definicija. Zasićena para Para u dinamičkoj ravnoteži sa svojom tečnošću. To jest, broj molekula tečnosti koji napuštaju tečnost tokom određenog vremenskog perioda je u proseku jednak broju molekula pare koji se vraćaju nazad u tečnost (vidi sliku 1). Iznad bilo koje površine tekućine uvijek postoji područje zasićene pare. Da bi se stvorila šira površina, potrebno je spriječiti izlazak molekula pare u okolinu (hermetički zatvoriti posudu).
Da biste razumjeli razliku između zasićene pare i idealnog plina, morate zamisliti dva eksperimenta.
Prvo, uzmimo hermetički zatvorenu posudu s vodom i počnemo je zagrijavati. Kako temperatura raste, molekuli tekućine će se povećavati kinetička energija, i sve veći broj molekula će moći da pobegne iz tečnosti (vidi sliku 2), pa će se koncentracija pare povećati, a samim tim i njen pritisak. Dakle, prva pozicija:

Rice. 2. T 2 > T 1
Međutim, ova odredba je sasvim očekivana i nije toliko zanimljiva kao sljedeće. Ako stavite tečnost sa zasićena para ispod pokretnog klipa i počnite spuštati ovaj klip, tada će se, nesumnjivo, koncentracija zasićene pare povećati zbog smanjenja volumena. Međutim, nakon nekog vremena, para će se kretati s tekućinom u novu dinamičku ravnotežu kondenzacijom viška količine pare, a tlak se na kraju neće promijeniti. Druga pozicija teorije zasićene pare:
Sada, treba napomenuti da pritisak zasićene pare, iako ovisi o temperaturi, poput idealnog plina, ali priroda ove ovisnosti je nešto drugačija. Činjenica je da, kao što znamo iz osnovne jednačine MKT, pritisak gasa zavisi i od temperature i od koncentracije gasa. Dakle, pritisak zasićene pare nelinearno zavisi od temperature sve dok se koncentracija pare ne poveća, odnosno dok sva tečnost ne ispari. Grafikon ispod (slika 3) prikazuje prirodu zavisnosti pritiska zasićene pare od temperature,

Rice. 3
štaviše, prelazak iz nelinearnog preseka u linearni samo znači tačku isparavanja cele tečnosti. Pošto pritisak zasićenog gasa zavisi samo od temperature, moguće je apsolutno nedvosmisleno odrediti koliki će biti pritisak zasićene pare na datoj temperaturi. Ovi omjeri (kao i vrijednosti gustine zasićene pare) navedeni su u posebnoj tabeli.
Skrenimo sada pažnju na ono važno fizički proces kao ključanje. Već u osmom razredu ključanje je bilo definisano kao proces vaporizacije intenzivniji od isparavanja. Sada ćemo malo proširiti ovaj koncept.
Definicija. Kipuće- proces isparavanja koji se odvija u cijeloj zapremini tečnosti. Šta je mehanizam ključanja? Činjenica je da u vodi uvijek postoji otopljeni zrak, a kao rezultat povećanja temperature, njegova topljivost se smanjuje i formiraju se mikromjehurići. Pošto dno i zidovi posude nisu savršeno glatki, ovi mehurići se lepe za neravnine na unutrašnjoj strani posude. Sada dio vode i zraka postoji ne samo na površini vode, već i unutar zapremine vode, a molekuli vode počinju da prelaze u mjehuriće. Tako se unutar mjehurića pojavljuje zasićena para. Dalje, ovi mehurići počinju da plutaju, povećavajući zapreminu i uzimajući veći broj molekula vode u sebe, i pucaju na površinu, ispuštajući zasićenu paru u okolinu (slika 4).
Rice. 4. Proces vrenja ()
Uslov za formiranje i uzdizanje ovih mjehurića je sljedeća nejednakost: pritisak zasićene pare mora biti veći ili jednak atmosferskom pritisku.
Dakle, pošto pritisak pare zasićenja zavisi od temperature, tačka ključanja je određena pritiskom okruženje: što je manji, to je niža temperatura tečnost ključa, i obrnuto.
U sljedećoj lekciji počet ćemo razmatrati svojstva krutih tijela.
Bibliografija
- Myakishev G.Ya., Sinyakov A.Z. Molekularna fizika. Termodinamika. - M.: Drfa, 2010.
- Gendenstein L.E., Dick Yu.I. Fizika 10 razred. - M.: Ileksa, 2005.
- Kasyanov V.A. Fizika 10 razred. - M.: Drfa, 2010.
- Physics.ru ().
- Chemport.ru ().
- Narod.ru ().
Zadaća
- Stranica 74: br. 546-550. fizika. Knjiga zadataka. 10-11 razredi. Rymkevich A.P. - M.: Drfa, 2013. ()
- Zašto penjači ne mogu da kuvaju jaja na visini?
- Na koje načine možete rashladiti topli čaj? Opravdajte ih u smislu fizike.
- Zašto bi se pritisak gasa na gorioniku trebao smanjiti nakon ključanja vode?
- * Kako se voda može zagrejati iznad sto stepeni Celzijusa?
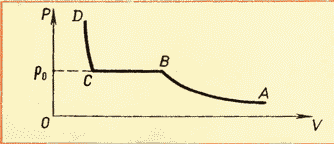
Poznavanje izoterme realnog gasa na različitim temperaturama (vidi sliku 6.4) omogućava nam da zaključimo da da pritisak pare zasićenja raste sa porastom temperature. Pošto pritisak zasićene pare ne zavisi od zapremine, zavisi samo od temperature. Međutim, zavisnost p(T), eksperimentalno utvrđeno, nije proporcionalno, kao u idealnom gasu pri konstantan volumen(Karlov zakon). Sa povećanjem temperature, pritisak zasićene pare raste brže od pritiska idealnog gasa (slika 6.5, deo krive AB). Ovo postaje posebno očigledno ako kroz tačku povučemo izohoru ALI(isprekidana linija). Zašto se ovo dešava?
Kada se tečnost zagreje parom u zatvorenoj posudi, deo tečnosti se pretvara u paru. Kako temperatura raste, brzina isparavanja se povećava i ravnoteža između tekućine i pare se narušava. Povećava se koncentracija molekula i, posljedično, gustina pare. Ovo se nastavlja sve dok se gustina pare ne poveća toliko da proces kondenzacije uravnoteži proces isparavanja. Kao rezultat, prema formuli p =nkT pritisak zasićene pare raste ne samo zbog povećanja temperature, već i zbog povećanja koncentracije molekula (gustine) pare. U ovom slučaju glavnu ulogu u povećanju pritiska zasićene pare igra povećanje koncentracije molekula pare, a ne povećanje njene temperature.
Glavna razlika u ponašanju idealnog gasa i zasićene pare je da kada se promeni temperatura pare u zatvorenoj posudi (ili kada se zapremina pare promeni na konstantnoj temperaturi), masa pare se menja. Tečnost se delimično pretvara u paru ili, obrnuto, para se delimično kondenzuje. OD idealan gas ništa slično se ne dešava.
Kada sva tečnost ispari, para će, daljim zagrevanjem, prestati da bude zasićena i njen pritisak pri konstantnoj zapremini će porasti u direktnoj proporciji sa apsolutnom temperaturom u skladu sa Čarlsovim zakonom (vidi sliku 6.5, deo BC).
Eksperimentalno dobijene izoterme realnog gasa opisuju stanje gasa, ravnotežu između gasa i tečnosti i tečno stanje. Mogu se koristiti za praćenje zavisnosti pritiska zasićene pare o temperaturi.
§ 6.4. kritična temperatura. Kritična situacija
Supstanca je možda unutra tečno stanje ne na bilo kojoj temperaturi. Postoji granica.
Kritična temperatura
Na dovoljno visokim temperaturama, horizontalni presjek izoterme stvarnog plina (vidi sliku 6.4) postaje vrlo kratak i na određenoj temperaturi pretvara se u tačku (na slici 6.4 - tačka TO). Ova temperatura se naziva kritična. Kritična temperatura je temperatura na kojoj se razlikuju fizička svojstva između tečnosti i pare u dinamičkoj ravnoteži sa njom. Svaka tvar ima svoju kritičnu temperaturu. Na primjer, kritična temperatura za ugljični dioksid CO 2 je t to = 31 °S, a za vodu - t to = 374 °S.
Kritična situacija
Stanje koje odgovara tački DO, u koji se horizontalni presjek izoterme pretvara na temperaturi T = T to , naziva se kritično stanje (kritična tačka). Pritisak i zapremina u ovom stanju nazivaju se kritičnim. Kritični pritisak za ugljični dioksid je 7,4 10 6 Pa (73 atm), a za vodu 2,2 10 7 Pa (218 atm). U kritičnom stanju, tečnost ima maksimalnu zapreminu, a zasićena para- maksimalni pritisak.
Zavisnost pritiska zasićene pare o temperaturi. Stanje zasićene pare približno je opisano jednadžbom stanja idealnog gasa (3.4), a njegov pritisak je približno određen formulom
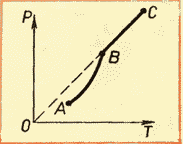
Kako temperatura raste, raste i pritisak. Pošto pritisak zasićene pare ne zavisi od zapremine, zavisi samo od temperature.
Međutim, eksperimentalno utvrđena ovisnost nije direktno proporcionalna, kao u idealnom plinu pri konstantnoj zapremini. Sa povećanjem temperature, pritisak zasićene pare raste brže od pritiska idealnog gasa (slika 52, presek krive AB).
To se dešava iz sljedećeg razloga. Kada se tečnost zagreje parom u zatvorenoj posudi, deo tečnosti se pretvara u paru. Kao rezultat toga, prema formuli (5.1), tlak pare se povećava ne samo zbog povećanja temperature, već i zbog povećanja koncentracije molekula (gustine) pare. Glavna razlika u ponašanju idealnog gasa i zasićene pare je ta da kada se promeni temperatura pare u zatvorenoj posudi (ili kada se promeni zapremina na konstantna temperatura) masa pare se mijenja. Tečnost se delimično pretvara u paru ili, obrnuto, para se delimično kondenzuje. Ništa slično se ne dešava sa idealnim gasom.
Kada sva tečnost ispari, para će, daljim zagrevanjem, prestati da bude zasićena i njen pritisak pri konstantnoj zapremini će porasti direktno proporcionalno apsolutna temperatura(Odjeljak BC na slici 52).
Kipuće. Ovisnost pritiska zasićene pare o temperaturi objašnjava zašto tačka ključanja tečnosti zavisi od pritiska. Prilikom ključanja u cijeloj zapremini tečnosti formiraju se brzo rastući mjehurići pare, koji isplivaju na površinu. Očigledno, mjehur pare može rasti kada tlak zasićene pare unutar njega malo premaši tlak u tekućini, što je zbir tlaka zraka na površini tekućine (vanjskog tlaka) i hidrostatskog tlaka stupca tekućine.
Vrenje počinje na temperaturi na kojoj je pritisak pare zasićenja u mjehurićima jednak pritisku u tekućini.
Što je veći vanjski pritisak, to je viša tačka ključanja. Dakle, pri pritisku u parnom kotlu koji dostiže Pa, voda ne ključa ni na temperaturi od 200°C. U medicinskim ustanovama, ključanje vode u hermetički zatvorenim posudama - autoklavima (Sl. 53) - takođe se dešava pri povišenom pritisku. Zbog toga je tačka ključanja mnogo viša od 100°C. Autoklavi se koriste za sterilizaciju hirurških instrumenata, zavoja itd.
Obrnuto, smanjenjem pritiska snižavamo tačku ključanja. Ispumpavanjem vazduha i vodene pare iz tikvice, možete učiniti da voda proključa na sobnoj temperaturi (Sl. 54). Prilikom penjanja na planine Atmosferski pritisak smanjuje se. Zbog toga se temperatura ključanja smanjuje. Na visokom


7134 m (Lenjinov vrh na Pamiru) pritisak je približno jednak Pa (300 mm Hg). Tačka ključanja vode je oko 70 °C. U ovim uslovima nemoguće je kuvati, na primer, meso.
Razlika u tačkama ključanja tečnosti određena je razlikom u njihovom pritisku zasićene pare. Što je veći pritisak zasićene pare, to je niža tačka ključanja odgovarajuće tečnosti, jer na nižim temperaturama pritisak zasićene pare postaje jednak atmosferskom pritisku. Na primjer, na 100 ° C, pritisak zasićene vodene pare je (760 mm Hg), a pare žive samo 117 Pa (0,88 mm Hg). Živa ključa na 357°C pri normalnom pritisku.
kritična temperatura. Sa povećanjem temperature, istovremeno sa povećanjem pritiska zasićene pare, povećava se i njena gustina. Gustoća tekućine u ravnoteži sa svojom parom, naprotiv, opada zbog širenja tekućine pri zagrijavanju. Ako na jednoj slici nacrtamo krivulje za zavisnost gustine tečnosti i njene pare od temperature, tada će za tečnost kriva pasti naniže, a za paru ići nagore (slika 55).
Na određenoj temperaturi, koja se naziva kritična temperatura, obje krive se spajaju, odnosno gustina tekućine postaje jednaka gustini pare.

Kritična temperatura je temperatura na kojoj nestaju razlike u fizičkim svojstvima između tekućine i njene zasićene pare.
Na kritičnoj temperaturi, gustina (i pritisak) zasićene pare postaje maksimalna, a gustina tečnosti u ravnoteži sa parom postaje minimalna. Specifična toplota isparavanje se smanjuje s povećanjem temperature i postaje nula na kritičnoj temperaturi.
Svaka tvar ima svoju kritičnu temperaturu. Na primjer, kritična temperatura vode, dok tečni ugljični monoksid (IV)






