Molekularna fizika. Zasićeni i nezasićeni parovi. Postrojenja za paru i kondenzat pare preduzeća
U tabeli su prikazana termofizička svojstva vodene pare na liniji zasićenja u zavisnosti od temperature. Svojstva pare su data u tabeli u temperaturnom opsegu od 0,01 do 370°C.
Svaka temperatura odgovara pritisku pri kojem je vodena para u stanju zasićenja. Na primjer, pri temperaturi vodene pare od 200°C, njen pritisak će biti 1,555 MPa, ili oko 15,3 atm.
Specifični toplotni kapacitet pare, toplotna provodljivost i njeno povećanje sa porastom temperature. Povećava se i gustina vodene pare. Vodena para postaje vruća, teška i viskozna, sa visokim specifičnim toplotnim kapacitetom, što pozitivno utiče na izbor pare kao nosača toplote u nekim vrstama izmenjivača toplote.
Na primjer, prema tabeli, specifična toplota vodena para Cp na temperaturi od 20°C jednaka je 1877 J/(kg deg), a kada se zagreje na 370°C, toplotni kapacitet pare raste na vrednost od 56520 J/(kg deg).
Tabela daje sljedeća termofizička svojstva vodene pare na liniji zasićenja:
- pritisak pare na određenoj temperaturi str. 10 -5, Pa;
- gustina pare ρ″ , kg/m 3;
- specifična (masena) entalpija h″, kJ/kg;
- toplota isparavanja r, kJ/kg;
- specifični toplotni kapacitet pare Cp, kJ/(kg deg);
- koeficijent toplotne provodljivosti λ 10 2, W/(m stepeni);
- termička difuzivnost a 10 6, m2/s;
- dinamički viskozitet μ 10 6, Pa s;
- kinematička viskoznost v 10 6, m2/s;
- Prandtl broj Pr.
Specifična toplota isparavanja, entalpija, toplotna difuzivnost i kinematička viskoznost vodene pare opadaju sa povećanjem temperature. Dinamički viskozitet i Prandtlov broj pare se u ovom slučaju povećavaju.
Budi pazljiv! Toplotna provodljivost u tabeli data je na stepen 10 2 . Ne zaboravite podijeliti sa 100! Na primjer, toplotna provodljivost pare na temperaturi od 100°C je 0,02372 W/(m deg).
Toplotna provodljivost vodene pare pri različitim temperaturama i pritiscima
U tabeli su prikazane vrijednosti toplinske provodljivosti vode i pare na temperaturama od 0 do 700°C i tlaku od 0,1 do 500 atm. Jedinica toplotne provodljivosti je W/(m deg).
Crta ispod vrijednosti u tabeli označava fazni prijelaz vode u paru, odnosno brojevi ispod crte odnose se na paru, a iznad nje na vodu. Prema tabeli, može se vidjeti da vrijednost koeficijenta i vodene pare raste sa povećanjem pritiska.
Napomena: toplotna provodljivost u tabeli data je na stepen 10 3 . Ne zaboravite podijeliti sa 1000!
Toplotna provodljivost vodene pare na visokim temperaturama
U tabeli su prikazane vrijednosti toplinske provodljivosti disocirane vodene pare u W/(m deg) na temperaturama od 1400 do 6000 K i pritiscima od 0,1 do 100 atm.
Prema tabeli, toplotna provodljivost vodene pare na visoke temperature značajno raste u području od 3000...5000 K. Pri visokim pritiscima, maksimalni koeficijent toplotne provodljivosti se postiže na višim temperaturama.
Budi pazljiv! Toplotna provodljivost u tabeli data je na stepen 10 3 . Ne zaboravite podijeliti sa 1000!
Tema „Zasićeni parovi. Vlažnost ”za školarce je prilično komplikovana. U nastavi se tome posvećuje malo pažnje, a razmatrani fenomeni međufazne interakcije tekućina-para su neobični.
Osnova za rješavanje navedenih problema je ideja da se tekućina i njena zasićena para nalaze u stanju dinamičke ravnoteže, kada su brzine isparavanja i kondenzacije iste. Pritisak i koncentracija molekula zasićena para zavisi samo od njegove temperature. Također, da biste izračunali karakteristike zasićene pare, možete koristiti Mendeleev-Claiperon jednadžbu.
Obično na ispitu takvi zadaci su rijetki. Međutim, zadaci su vrlo zanimljivi i omogućavaju vam da osjetite razlike između ponašanja idealnih gasova i zasićene pare. Po našem mišljenju, nakon razumijevanja njihovog rješenja, više nećete imati poteškoća u razumijevanju ove teme.
Zadatak broj 1. Pritisak, broj molekula zasićene pare u zatvorenoj posudi (dio A, osnovni nivo)
Rješenje:
Tipična situacija: u zatvorenoj zapremini para i tečnost su u ravnoteži. Čak i bez direktne naznake u tekstu problema, jasno je da je para zasićena. Temperatura se ne mijenja, što znači da je koncentracija molekula pare konstantna, a broj i masa molekula proporcionalni volumenu. Ako se volumen smanji za 3 puta, broj molekula će se također smanjiti za 3 puta.
Odgovor broj 4.
Zadatak broj 2. Pritisak, masa, koncentracija zasićenih molekula pare u zatvorenoj posudi (dio A, osnovni nivo)

Zapravo, isti problem u drugoj formulaciji.
Zadatak broj 3. Očitavanja psihrometra (dio A, polazna linija)

Rješenje:
Zadatak je zapravo laboratorijski rad da biste izmjerili vlažnost psihrometrom, trebate samo predvidjeti očitavanje vlažnog termometra.
Da bismo to riješili, očitamo očitavanja termometara: suho - 23, mokro -16 stepeni Celzijusa. Prema tabeli utvrđujemo da to odgovara vlažnosti od 48%. Ako se vlažnost poveća za 7% (do 55%), tada (nalazimo ga u istoj liniji tabele, lijevo) razlika u očitanjima termometara će postati 6 stepeni. Dakle, mokro će pokazati 23-6=17 stepeni. Odgovor broj 3.
Zadatak broj 4. Pritisak zasićene pare u zatvorenoj posudi (dio A, povišeni nivo)

Rješenje:
U zatvorenoj zapremini para i tečnost su u ravnoteži, pa je para zasićena. Kako se volumen povećava, voda će ispariti, a para će ostati zasićena što je duže moguće. Očigledno je da će sva voda ispariti i para će ostati zasićena sve dok se volumen ne udvostruči (pošto je masa tekućine u početku jednaka masi pare). U tom slučaju pritisak se ne mijenja.
Daljnjim povećanjem zapremine pare će prestati da bude zasićeno, njeni parametri se mogu opisati kao izotermni proces. Povećanje volumena za još 2 puta dovest će do dvostrukog smanjenja tlaka.
Ukupno, s povećanjem zapremine za 4 puta u ovom sistemu, pritisak će se smanjiti za 2 puta.
Odgovor broj 2.
U opciji br. 2 probnog testiranja postojao je inverzni problem, ali se on mogao riješiti samo znajući da na 100 stepeni Celzijusa, pritisak pare je 100 kPa (1 atm), koji se koristi u rješavanju zadatka br. 6. Ovu vrijednost tlaka je lako zapamtiti, znajući da ključanje tekućine počinje na temperaturi na kojoj tlak njene zasićene pare postaje jednak vanjskom tlaku.
Zadatak broj 5. Ovisnost pritiska o zapremini za zasićene i nezasićene pare(dio C, napredni nivo)

Zadatak broj 6. Nivo vode u zatvorenoj cijevi sa zasićenim parama (dio C, povišeni nivo)
Široka staklena cijev duga oko pola metra, zatvorena na jednom kraju, potpuno se napuni vodom i postavi okomito sa otvorenim krajem prema dolje, uranjajući dno cijevi nekoliko centimetara u posudu s vodom. Na sobnoj temperaturi cijev ostaje potpuno napunjena vodom. Voda u bazenu se polako zagrijava. Gdje će se postaviti nivo vode u cijevi kada voda u bazenu počne ključati? Objasnite svoj odgovor koristeći fizičke zakone.
Rješenje.
Na sobnoj temperaturi voda zauzima cijeli volumen cijevi i ne izlijeva se iz nje, jer je pritisak zasićene vodene pare na sobnoj temperaturi vrlo nizak i samo će se iznad vode pojaviti „toričelijanska praznina“ ispunjena zasićenom vodenom parom. ako je visina vodenog stuba oko 10 metara.
Kako temperatura vode raste, pritisak njene zasićene pare raste sve dok na tački ključanja ne postane jednak vanjskom atmosferskom pritisku.
Kada se temperatura približi tački ključanja, iznad vode će se pojaviti područje ispunjeno zasićenom vodenom parom. Kako temperatura dalje raste, nivo vode u cijevi će se smanjivati. Na tački ključanja, pritisak zasićene vodene pare u cijevi je jednak i atmosferski pritisak, pa će nivo vode u cijevi i u bazenu biti isti.
Zadatak broj 7. Masa zasićene pare (dio A, osnovna linija)

Rješenje:
Problem se lako rješava primjenom Mendelejev-Claiperonove jednadžbe, s obzirom da je tlak zasićene pare na datoj temperaturi jednak atmosferskom
Tokom isparavanja, istovremeno s prijelazom molekula iz tekućine u paru, događa se i obrnuti proces. Nasumično se krećući iznad površine tečnosti, neki od molekula koji su je napustili vraćaju se ponovo u tečnost.
Pritisak zasićene pare.
Kada se zasićena para komprimuje, čija se temperatura održava konstantnom, ravnoteža će prvo početi da se narušava: gustina pare će se povećati, i kao rezultat toga, više molekula će preći iz gasa u tečnost nego iz tečnosti u gas; ovo će se nastaviti sve dok koncentracija pare u novom volumenu ne postane ista, što odgovara koncentraciji zasićene pare na datoj temperaturi (i ravnoteža se uspostavi). To se objašnjava činjenicom da broj molekula koji izlaze iz tekućine u jedinici vremena ovisi samo o temperaturi.
Dakle, koncentracija zasićenih molekula pare na konstantna temperatura ne zavisi od njegove zapremine.
Pošto je pritisak gasa proporcionalan koncentraciji njegovih molekula, pritisak zasićene pare ne zavisi od zapremine koju zauzima. Pritisak p 0, na kojoj je tečnost u ravnoteži sa svojom parom, naziva se pritisak zasićene pare.
Kada se zasićena para komprimuje, većina se pretvara u tečno stanje. Tečnost zauzima manji volumen od para iste mase. Kao rezultat, volumen pare pri konstantnoj gustoći se smanjuje.
Zavisnost pritiska zasićene pare o temperaturi.
Za idealan gas, linearna zavisnost pritisak u odnosu na temperaturu na konstantan volumen. Nanosi se na zasićenu paru pod pritiskom p 0 ova zavisnost se izražava jednakošću:
p 0 =nkT.
Pošto pritisak zasićene pare ne zavisi od zapremine, onda, dakle, zavisi samo od temperature.
Eksperimentalno utvrđena zavisnost p 0 (T) različito od zavisnosti ( p 0 =nkT) za idealan gas.
Sa povećanjem temperature, pritisak zasićene pare raste brže od pritiska idealnog gasa (presek krive AB na slici). Ovo postaje posebno očigledno ako kroz tačku povučemo izohoru A(isprekidana linija). To se događa jer kada se tečnost zagrije, dio se pretvara u paru, a gustina pare se povećava. Dakle, prema formuli ( p 0 =nkT), pritisak zasićene pare raste ne samo kao rezultat povećanja temperature tekućine, već i zbog povećanja koncentracije molekula (gustine) pare. Glavna razlika u ponašanju idealnog plina i zasićene pare je promjena mase pare s promjenom temperature pri konstantnoj zapremini (u zatvorenoj posudi) ili s promjenom zapremine pri konstantnoj temperaturi. Ništa slično se ne može dogoditi s idealnim plinom (molekularno-kinetička teorija idealnog plina ne predviđa fazni prelaz gas u tečnost).
Nakon isparavanja sve tečnosti, ponašanje pare će odgovarati ponašanju idealnog gasa (odeljak Ned krivulja na gornjoj slici).
nezasićena para.
Ako u prostoru koji sadrži paru tečnosti može doći do daljeg isparavanja te tečnosti, tada je para u tom prostoru nezasićeni.
Para koja nije u ravnoteži sa svojom tekućinom naziva se nezasićena.
Nezasićena para se jednostavnom kompresijom može pretvoriti u tečnost. Jednom kada ova transformacija započne, para u ravnoteži sa tečnošću postaje zasićena.
Stranica 1 od 5
7.1. Tabela 8 daje pritisak vodene pare koja zasićuje prostor na različite temperature. Kako napraviti tabelu od ovih podataka m mase vodene pare u zapremini V = 1 m 3 zrak zasićen vodenom parom na različitim temperaturama Na primjer, riješite problem na temperaturi t\u003d 50 ° C.
7.2. Odrediti gustinu p i zasićenu vodenu paru na temperaturi t=50°C.

7.3. Koliko puta veća gustina str i zasićenu vodenu paru na temperaturi t= 16°C manje gustine str vode.

7.4. Koliko je različitih gustoća p i 1 zasićene vodene pare na temperaturi t 1 = 200 ° C veća od gustine p n2 zasićena vodena para na temperaturi t 1 \u003d 100 ° C?

7.5. Šta je masa m vodena para sadržana u zapremini V\u003d 1m 3 zraka u ljetnom danu na temperaturi od t \u003d 30 ° C i relativnoj vlažnosti w = 0,75 ?

7.6. U zatvorenom prostoru V= 1 m 3 relativna vlažnost zrak w = 0,6 na temperaturi t\u003d 20 ° C. Kolika je masa d m voda još uvijek mora ispariti iz ove zapremine da bi vodena para postala zasićena?

7.7. Sobna temperatura / g = 18 °C, relativna vlažnost co = 0,5 . U metalni kotlić se sipa hladna voda, kolika je temperatura tz vode, na kojoj će kotlić prestati da se zamagljuje?


7.8. Nađi broj n molekule zasićene vodene pare sadržane u jedinici zapremine na temperaturi t 1 = 30 °C.

7.9. Masa m=0,5 g vodene pare zauzima zapreminu V 1\u003d 10 l na temperaturi od t \u003d 50 ° C, kolika je relativna vlažnost w? Koja će masa dm pare biti kondenzovana ako se zapremina izotermno smanji sa V 1 na V 2 \u003d V 1 / 2?


7.10. Komora za oblake zapremine K = 1 litar sadrži vazduh zasićen vodenom parom. Početna temperatura komora r = 20 °C. Kada se klip pomeri, zapremina komore se povećava na
V 2 = 1.25k, . Ekspanzija se smatra adijabatskom, a adijabatski eksponent je 1,4. Naći: a) pritisak vodene pare prije širenja; b) težina m 1 vodena para u komori prije ekspanzije; c) gustina p 1 vodene pare prije ekspanzije; d) temperatura t2 para nakon ekspanzije (zanemarite promjene temperature zbog oslobađanja topline tokom kondenzacije pare); e) masa dm kondenzovana para; f) gustina p2 vodena para
nakon kondenzacije; g) stepen prezasićenosti, tj. omjer gustine vodene pare nakon ekspanzije (ali prije kondenzacije) i gustine vodene pare koja zasićuje prostor na temperaturi utvrđenoj nakon kondenzacije


7.11. Odrediti specifičnu zapreminu v vode u tečnom i parnom stanju u normalnim uslovima.
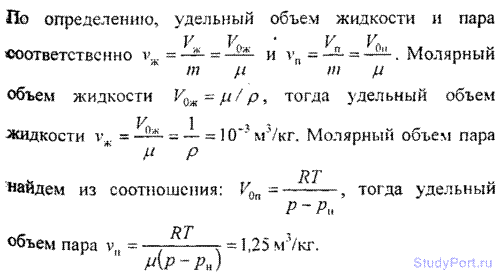
7.12. Koristeći prvi zakon termodinamike i podatke u tabeli 7 i 8, naći specifičnu toplotu isparavanja r vode na t = 200 °C. Za vodu, kritična temperatura T to= 647 K, kritični pritisak str= 22 MPa. Provjerite ispravnost dobivenog rezultata prema tabeli 9.
7.13. Koliki dio topline isparavanja vode na temperaturi od t = 100 ° C ide na povećanje unutrašnja energija sistemi?

7.14. Specifična toplina isparavanja benzena (C 6 H 6) na temperaturi t = 77 ° C jednaka je r = 398 kJ/kg. Naći promjenu unutrašnje energije d W prilikom isparavanja mase dm = 20 g benzena.

7.15. Koristeći Clausius-Clapeyronovu jednačinu i podatke u tabeli 8, pronađite specifičnu toplinu isparavanja r
vode na temperaturi t = 5 °C. Provjerite ispravnost dobivenog rezultata prema tabeli 9.


7.16. Pritisak zasićene žive pare na temperaturama t 1 = 100 ° C i t 2 = 120 ° C su p 1 = 37,3 Pa i p 2 = 101,3 Pa.
Nađi sredinu specifična toplota isparavanje r žive u određenom temperaturnom opsegu.


7.17. Tačka ključanja benzena (C 6 H 6) pri tlaku p = 0,1 MPa je t k = 80,2 ° C. Pronađite tlak str zasićena para benzena na temperaturi t = 15,6° C. Prosječna vrijednost specifične topline isparavanja benzena u ovom temperaturnom opsegu uzima se jednakom r = 0,4 MJ/kg.

7.18. Pritisak zasićene pare etil alkohola (C 2 H 5 OH) na temperaturama t 1 = 40 ° C i t 2 = 60 ° C su jednaki
p 1 =17,7 kPa i p 2 =67,9 kPa. Naći promjenu entropije dS tokom isparavanja mase d m = 1 G etil alkohola na temperaturi t\u003d 50 ° C.

7.19. Promjena entropije tijekom isparavanja količine dv = 1 mol neke tekućine na temperaturi od t 1 = 50 ° C je dS = 133J / K. Pritisak zasićene pare na temperaturi t 1 = 50 °C je p 1 = 12,33 kPa. Za koliko se mijenja tlak zasićene pare tekućine s promjenom temperature od t 1 = 50° C do t1\u003d 51 0 C?


7.20. Do koje granice pritiska str može li se posuda evakuirati korištenjem živine difuzijske pumpe koja radi bez hvatača žive ako je temperatura vodenog omotača pumpe t = 15°C? Pritisak zasićene živine pare na temperaturi t 0 = 0 ° C je p0\u003d 0,021 Pa, prosječna vrijednost specifične topline isparavanja žive u ovom temperaturnom rasponu uzima se jednakom r = 10.08 MJ/kt.
DEFINICIJA
vodena para- ovo je gasovitom stanju vode.
Nema boju, ukus, miris. Voda je najčešća supstanca u prirodi. Osim što postoji kao gas, može biti i u tečnom ili čvrstom (led) stanju, od kojih je svako određeno temperaturom i pritiskom (slika 1).
Rice. 1. Dijagram stanja vode.
AO kriva odgovara ravnoteži u sistemu led-para, DO - ravnoteži u prehlađenom sistemu vodena para, OC kriva - ravnoteži u sistemu vodena para, a OB kriva - ravnoteži u sistemu vodena para. sistem ledena voda. U tački O, sve krive se sijeku. Ova tačka se zove trostruki bod i odgovara ravnoteži u sistemu led-voda-para.
Empirijska formula vodene pare poklapa se sa empirijskom formulom vode i ima oblik 2 O. Kao što je poznato, molekulska težina molekula jednaka je zbroju relativne atomske mase atomi koji čine molekul (vrijednosti relativnih atomskih masa preuzete iz periodnog sistema D.I. Mendeljejeva su zaokružene na cijele brojeve).
Mr(H 2 O) = 2×Ar(H) + Ar(O);
Mr(H 2 O) = 2 × 1 + 16 = 2 + 16 \u003d 18.
Molarna masa (M) je masa 1 mola supstance. Lako je pokazati da su numeričke vrijednosti molarne mase M i relativne molekulske mase M r jednake, međutim, prva vrijednost ima dimenziju [M] = g/mol, a druga je bezdimenzionalna:
M = N A × m (1 molekul) = N A × M r × 1 a.m.u. = (N A ×1 amu) × M r = × M r .
To znači da molarna masa vodena para je 18 g/mol.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Koliko je grama cinka reagovalo sa hlorovodoničnom kiselinom ako je nastalo 0,5 g gasovitog vodonika? |
| Rješenje | Zapisujemo jednadžbu reakcije za interakciju cinka sa hlorovodoničnom kiselinom: Zn + 2HCl \u003d ZnCl 2 + H 2. Nađimo molarnu masu molekularnog vodonika (vrijednost relativne atomske mase, preuzeta iz periodnog sistema D.I. Mendeljejeva, zaokružit će se na cijeli broj). Poznato je da je M \u003d Mr, što znači (H 2) = 2 × Ar (H) = 2 × 1 = 2 g / mol. Izračunajte količinu vodonika: n(H)=m(H)/ M(H); n (H) = 0,5 / 2 = 1 mol. Prema jednadžbi reakcije n (H 2) : n (Zn) \u003d 1: 1, što znači da je n (Zn) = 1 mol. Nađimo molarnu masu cinka (vrijednost relativne atomske mase, uzeta iz periodnog sistema D.I. Mendeljejeva, zaokružena na cijeli broj). Poznato je da je M = Mr, što znači (Zn) = 65 g/mol. Odredite masu cinka: m(Zn) = n (Zn) × M (Zn); m(Zn) = 1 × 65 = 65 g. |
| Odgovori | Masa cinka je 65 g. |
PRIMJER 2
| Vježbajte | Koja je masa bakrovog (II) oksida potrebna da se dobije 128 g bakra iz njega kada se redukuje vodonikom? |
| Rješenje | Zapisujemo jednačinu za redukciju bakar (II) oksida vodonikom: CuO + H 2 \u003d Cu + H 2 O. Nađimo molarnu masu bakra (vrijednost relativne atomske mase, preuzeta iz periodnog sistema D.I. Mendeljejeva, zaokružena na cijeli broj). Poznato je da je M = Mr, što znači (Cu) = 64 g/mol. Izračunajte količinu bakrene supstance: n(Cu)= m(Cu)/ M(Cu); n (Cu) \u003d 128/ 64 \u003d 2 mol. Prema jednadžbi reakcije n(Cu) :n(CuO) = 1:1, dakle n(CuO) = 2 mol. Nađimo molarnu masu bakar (II) oksida (vrijednosti relativnih atomskih masa preuzete iz periodnog sistema D.I. Mendeljejeva su zaokružene na cijele brojeve). Kao što je poznato, molarna masa molekula jednaka je zbroju relativnih atomskih masa atoma koji čine molekul (M = Mr): M(CuO) = Ar(Cu) + Ar(O) = 64 + 16 = 80 g/mol. Odredimo masu bakrovog oksida (II): m(CuO) = n(CuO) × M(CuO); m(CuO) = 2 × 80 \u003d 160 g. |
| Odgovori | Masa bakar (II) oksida je 160 g |






