Površinski napon vode
Glavni dio.
Razumjeti osnovna svojstva i obrasce tečno stanje tvari, potrebno je uzeti u obzir sljedeće aspekte:
Struktura tečnosti. Kretanje molekula tečnosti.
Tečnost je nešto što može da teče.
U rasporedu tečnih čestica primećuje se takozvani poredak kratkog dometa. To znači da je u odnosu na bilo koju česticu uređena lokacija njenih najbližih susjeda.
Međutim, kako se neko udaljava od date čestice, raspored ostalih čestica u odnosu na nju postaje sve manje uređen i vrlo brzo red u rasporedu čestica potpuno nestaje.
Molekuli tekućine kreću se mnogo slobodnije od čvrstih molekula, iako ne tako slobodno kao molekuli plina.
Svaki molekul tečnosti se neko vreme kreće ovamo i tamo, ne udaljujući se, međutim, od svojih suseda. Ali s vremena na vrijeme molekul tekućine izbije iz svog okruženja i odlazi na drugo mjesto, ulazeći u novo okruženje, gdje opet neko vrijeme čini pokrete slične oscilacijama. Značajne zasluge u razvoju niza problema u teoriji tečnog stanja pripadaju sovjetskom naučniku Ya. I. Frenkelu.
Prema Frenkelu, toplotno kretanje u tečnostima ima sledeći karakter. Svaki molekul neko vrijeme oscilira oko određene ravnotežne pozicije. S vremena na vrijeme, molekul mijenja svoje mjesto ravnoteže, skačući na novu poziciju, odvojenu od prethodne udaljenosti reda veličine samih molekula. Odnosno, molekuli se samo polako kreću unutar tečnosti, zadržavajući se deo vremena u blizini određenih mesta.Tako je kretanje molekula tečnosti nešto poput mešavine kretanja u čvrstom stanju i u gasu: oscilirajuće kretanje na jednom mjestu zamjenjuje se slobodnim prijelazom s jednog mjesta na drugo.
Pritisak tečnosti
Svakodnevno iskustvo nas uči da tekućine djeluju poznatim silama na površinu čvrstih tijela u dodiru s njima. Ove sile se nazivaju sile pritiska fluida.
Prekrivajući prstom otvor otvorene slavine, osjećamo snagu pritiska tečnosti na prst. Bol u uhu kod plivača nakon ronjenja velika dubina, uzrokovano silama pritiska vode na bubna opna uho. Dubinski termometri moraju biti veoma jaki da ih pritisak vode ne može zgnječiti.
Pritisak u tekućini nastaje zbog promjene njenog volumena - kompresije. U odnosu na promenu zapremine, tečnosti imaju elastičnost. Sile elastičnosti u fluidu su sile pritiska. Dakle, ako fluid djeluje silama pritiska na tijela u dodiru s njom, to znači da je sabijena. Budući da se gustina supstance povećava tokom kompresije, može se reći da tečnosti imaju elastičnost u odnosu na promenu gustine.
Pritisak u tečnosti je okomit na bilo koju površinu koja se nalazi u tečnosti. Pritisak u tečnosti na dubini h jednak je zbiru pritiska na površini i vrednosti proporcionalne dubini:
Zbog činjenice da tekućine mogu prenijeti statički pritisak, praktički ne manji od svoje gustine, mogu se koristiti u uređajima koji daju dobitak u čvrstoći: hidrauličnoj presi.
Arhimedov zakon
Na površinu čvrstog tijela uronjenog u tekućinu djeluju sile pritiska. Pošto pritisak raste sa dubinom, sile pritiska prema gore na dnu fluida su veće od sila koje se spuštaju na vrh, i možemo očekivati da će rezultanta sila pritiska biti nagore. Rezultirajuća sila pritiska na tijelo uronjeno u tekućinu naziva se sila potpore tekućine.
Ako je tijelo uronjeno u tekućinu prepušteno samo sebi, ono će potonuti, ostati u ravnoteži ili isplivati na površinu tekućine, ovisno o tome da li je potporna sila manja od sile gravitacije koja djeluje na tijelo, jednaka to ili veće od njega.
Arhimedov princip kaže da je tijelo u fluidu izloženo sili uzgona koja je jednaka težini istisnutog fluida. Telo uronjeno u tečnost podleže sili uzgona (koja se zove Arhimedova sila)
![]()
gdje je ρ gustina tečnosti (gasa), ubrzanje slobodan pad, a V- zapremina potopljenog tijela (ili dio zapremine tijela ispod površine).
Ako je tijelo uronjeno u tekućinu okačeno na vagu, tada vaga pokazuje razliku između težine tijela u zraku i težine istisnute tekućine. Stoga se Arhimedovom zakonu ponekad daje sljedeća formulacija: tijelo uronjeno u tečnost gubi na svojoj težini onoliko koliko teži tečnost koju istisne.
Zanimljivo je primijetiti takvu eksperimentalnu činjenicu da je unutar druge tekućine veće specifična gravitacija, tečnost prema Arhimedovom zakonu "gubi" svoju težinu i poprima svoj prirodni, sferni oblik.
Isparavanje
U površinskom sloju i blizu površine tečnosti deluju sile koje obezbeđuju postojanje površine i ne dozvoljavaju molekulima da napuste zapreminu tečnosti. Zbog termičkog kretanja, neki od molekula imaju dovoljno velike brzine da savladaju sile koje drže molekule u tekućini i napuste tekućinu. Ova pojava se zove isparavanje. Uočava se na bilo kojoj temperaturi, ali njegov intenzitet raste s porastom temperature.
Ako se molekuli koji su napustili tečnost uklone iz prostora blizu površine tečnosti, tada će na kraju sva tečnost ispariti. Ako se molekuli koji su napustili tečnost ne uklone, formiraju paru. Molekuli pare koji su pali u područje blizu površine tečnosti uvlače se u tečnost silama privlačenja. Ovaj proces se naziva kondenzacija.
Dakle, ako se molekuli ne uklone, brzina isparavanja se smanjuje s vremenom. Daljnjim povećanjem gustine pare dolazi se do situacije da će broj molekula koji napuštaju tečnost u određenom vremenu biti jednak broju molekula koji se u isto vreme vraćaju u tečnost. Dolazi do stanja dinamičke ravnoteže. Para u stanju dinamičke ravnoteže s tekućinom naziva se zasićena.
Kako temperatura raste, gustina i pritisak zasićene pare se povećavaju. Što je temperatura viša, to više molekuli tečnosti imaju energiju dovoljnu za isparavanje, a gustina pare mora biti veća da bi kondenzacija bila jednaka isparavanju.
Kipuće
Kada se tečnost zagreje na temperaturu na kojoj je pritisak zasićene pare jednak vanjskom pritisku, uspostavlja se ravnoteža između tečnosti i njenog zasićena para. Kada se tečnosti prenese dodatna količina toplote, odgovarajuća masa tečnosti se odmah pretvara u paru. Ovaj proces se zove ključanje.
Vrenje je intenzivno isparavanje tečnosti, koje se dešava ne samo sa površine, već u celom njenom volumenu, unutar nastalih mjehurića pare. Da bi prešli iz tečnosti u paru, molekuli moraju steći energiju potrebnu da savladaju privlačne sile koje ih drže u tečnosti. Na primjer, da bi se ispario 1 g vode na temperaturi od 100 ° C i tlaku koji odgovara atmosferskom tlaku na nivou mora, potrebno je potrošiti 2258 J, od čega 1880 odlazi na odvajanje molekula od tekućine, a ostatak odlazi da radi na povećanju zapremine koju zauzima sistem, protiv sila atmosferski pritisak(1 g vodene pare na 100°C i normalnom pritisku zauzima zapreminu od 1,673 cm 3, dok je 1 g vode pod istim uslovima samo 1,04 cm 3).
Tačka ključanja je temperatura na kojoj tlak pare postaje jednak vanjskom pritisku. Kako pritisak raste, tačka ključanja se povećava, a kako se pritisak smanjuje, ona se smanjuje.
Zbog promjene pritiska u tečnosti sa visinom njenog stuba, ključanje se nastavlja raznim nivoima u tečnosti se dešava, strogo govoreći, na različitim temperaturama. Samo određena temperatura zasićena para iznad površine kipuće tečnosti. Njegova temperatura je određena samo vanjskim pritiskom. Na ovu temperaturu se misli kada se govori o tački ključanja.
Tačke ključanja različitih tekućina međusobno su vrlo različite, a to se široko koristi u tehnologiji, na primjer, u destilaciji naftnih derivata.
Količina topline koja se mora unijeti da bi se određena količina tekućine izotermno pretvorila u paru, pri vanjskom pritisku jednakom pritisku njenih zasićenih para, naziva se latentna toplina isparavanja. Obično se ova vrijednost odnosi na jedan gram ili jedan mol. Količina topline potrebna za izotermno isparavanje mola tekućine naziva se molarna latentna toplina isparavanja. Ako se ova vrijednost podijeli s molekulskom težinom, onda specifična latentna toplota isparavanje.
Površinski napon tečnosti
Svojstvo tečnosti da svoju površinu svede na minimum naziva se površinska napetost. Površinska napetost je fenomen molekularnog pritiska na tečnost, uzrokovan privlačenjem molekula površinskog sloja na molekule unutar tečnosti. Na površini tekućine, molekuli doživljavaju sile koje nisu simetrične. Na molekul unutar tečnosti, u prosjeku, sila privlačenja, kohezije, djeluje u prosjeku jednoliko sa svih strana. Ako se površina tekućine poveća, tada će se molekuli kretati protiv djelovanja sila zadržavanja. Dakle, sila koja teži skraćivanju površine tekućine djeluje u suprotnom smjeru od vanjske vlačne sile na površini. Ova sila se naziva sila površinskog napona i izračunava se po formuli:
Koeficijent površinske napetosti ()
Dužina granice površine tekućine
Imajte na umu da lako isparljive tekućine (eter, alkohol) imaju nižu površinsku napetost od neisparljivih tekućina (živa). Površinski napon tečnog vodonika i, posebno, tečnog helijuma je veoma nizak. U tečnim metalima, površinska napetost je, naprotiv, vrlo visoka. Razlika u površinskom naponu tečnosti objašnjava se razlikom u kohezionim silama različitih molekula.
Mjerenja površinskog napona tekućine pokazuju da površinska napetost ne ovisi samo o prirodi tekućine, već i o njenoj temperaturi: s porastom temperature, razlika u gustoći tekućine opada, a samim tim i koeficijent površinski napon - opada.
Zbog površinske napetosti, bilo koji volumen tekućine teži smanjenju površine, čime se smanjuje potencijalna energija. Površinska napetost je jedna od elastičnih sila odgovornih za kretanje talasa na vodi. U ispupčenjima, površinska gravitacija i površinska napetost povlače čestice vode prema dolje, težeći da površina ponovo bude glatka.
Tečni filmovi
Svi znaju kako je lako izvući pjenu iz vode sa sapunom. Pjena je skup mjehurića zraka ograničenih najtanjim filmom tekućine. Od tečnosti koja stvara pjenu lako se može dobiti poseban film.
Ovi filmovi su veoma interesantni. Mogu biti izuzetno tanke: u najtanjim dijelovima njihova debljina ne prelazi stohiljaditi dio milimetra. Uprkos svojoj mršavosti, ponekad su veoma stabilne. Sapunski film se može rastegnuti i deformirati, a mlaz vode može teći kroz film sapuna bez da ga uništi.
Kako se može objasniti stabilnost filmova? Neophodan uslov za formiranje filma je dodavanje u čistu tečnost u njemu rastvorljivih supstanci, štoviše, onih koje uvelike smanjuju površinsku napetost
U prirodi i tehnologiji obično se ne susrećemo sa pojedinačnim filmovima, već sa kolekcijom filmova - penom. Često možete vidjeti u potocima, gdje mali potoci padaju u mirnu vodu, obilno stvaranje pjene. U ovom slučaju, sposobnost vode da se pjeni povezana je s prisutnošću u vodi posebne organske tvari koja se oslobađa iz korijena biljaka. U građevinskoj opremi koriste se materijali koji imaju ćelijsku strukturu, kao što je pjena. Takvi materijali su jeftini, lagani, ne provode dobro toplinu i zvuk i dovoljno su jaki. Za njihovu proizvodnju otopinama od kojih se formiraju građevinski materijali dodaju se tvari koje potiču pjenjenje.
vlaženje
Male kapljice žive stavljene na staklenu ploču poprimaju sferni oblik. To je rezultat molekularnih sila koje teže smanjenju površine tekućine. Živa postavljena na površinu čvrste tvari ne formira uvijek okrugle kapljice. Širi se preko pocinčane ploče, a ukupna površina kapi će se nesumnjivo povećati.
Kap anilina je također sferna samo kada ne dodiruje stijenku staklene posude. Čim dodirne zid, odmah se zalijepi za staklo, protežući se uz njega i dobivajući veliku zajedničku površinu.
To se objašnjava činjenicom da u slučaju kontakta s čvrstim tijelom, sile adhezije molekula tekućine s molekulima čvrstog tijela počinju igrati značajnu ulogu. Ponašanje tekućine ovisit će o tome što je veće: adhezija između tekućih molekula ili adhezija molekula tekućine na čvrsti molekul. U slučaju žive i stakla, kohezivne sile između žive i staklenih molekula su male u poređenju sa silama kohezije između molekula žive, a živa se skuplja u kapi.
Takva tečnost se zove nekvašenje solidan. U slučaju žive i cinka, kohezivne sile između molekula tečnosti i čvrste supstance premašuju kohezione sile koje deluju između molekula tečnosti, a tečnost se širi preko čvrste supstance. U ovom slučaju, tečnost se zove vlaženje solidan.
Iz ovoga proizilazi da, govoreći o površini tečnosti, treba imati u vidu ne samo površinu na kojoj tečnost graniči sa vazduhom, već i površinu koja graniči sa drugim tečnostima ili sa čvrstim telom.
U zavisnosti od toga da li tečnost vlaži zidove posude ili ne, oblik površine tečnosti na mestu kontakta sa čvrstim zidom i gasom ima ovaj ili onaj oblik. U slučaju nekvašenja, oblik površine tekućine na rubu je okrugao, konveksan. U slučaju vlaženja, tečnost na ivici poprima konkavni oblik.
Kapilarni fenomeni
U životu se često suočavamo sa tijelima probijenim mnogim malim kanalićima (papir, pređa, koža, razni Građevinski materijali, tlo, drvo). Dolazeći u kontakt sa vodom ili drugim tečnostima, takva tela ih često apsorbuju. Ovo je osnova za djelovanje peškira pri sušenju ruku, djelovanje fitilja u petrolejskoj lampi itd. Slične pojave se mogu uočiti i u uskim staklenim cijevima. Uske cijevi se nazivaju kapilarne ili dlake.
Kada se takva cijev jednim krajem uroni u široku posudu u široku posudu, događa se sljedeće: ako tečnost pokvasi stijenke cijevi, tada će se ona podići iznad nivoa tečnosti u posudi i, osim toga, više, to je cijev uža; ako tečnost ne vlaži zidove, tada je, naprotiv, nivo tečnosti u cevi niži nego u širokoj posudi. Promena visine nivoa tečnosti u uskim cevima ili prazninama naziva se kapilarnost. U širem smislu, pod kapilarnim fenomenima se podrazumijevaju sve pojave zbog postojanja površinske napetosti.
Visina podizanja tečnosti u kapilarnim cevima zavisi od radijusa kanala u cevi, površinskog napona i gustine tečnosti. Između tečnosti u kapilari i u širokoj posudi uspostavlja se takva razlika nivoa h tako da hidrostatički pritisak rgh uravnotežuje kapilarni pritisak:
gdje je s površinski napon tečnosti
R je radijus kapilare.
Visina uspona tečnosti u kapilari proporcionalna je njenoj površinskoj napetosti i obrnuto proporcionalna poluprečniku kapilarnog kanala i gustini tečnosti (Jurinov zakon)
Odgovori na pitanja
1. Šta je površinski napon i u kojim jedinicama se mjeri? Koji su razlozi njegovog nastanka?
Površinska napetost je termodinamička karakteristika međuprostora između dvije faze u ravnoteži, određena radom reverzibilnog izotermokinetičkog formiranja jedinične površine ovog interfejsa, pod uslovom da ostane temperatura, zapremina sistema i hemijski potencijali svih komponenti u obje faze. konstantan.
Površinski napon ima dvostruko fizičko značenje – energijsko (termodinamičko) i silu (mehaničko). Energetska (termodinamička) definicija: površinski napon je specifičan rad povećanja površine kada je istegnuta, pod uslovom da je temperatura konstantna. Definicija sile (mehaničke): Površinska napetost je sila koja djeluje po jedinici dužine linije koja ograničava površinu tekućine.
Sila površinskog napona usmjerena je tangencijalno na površinu tekućine, okomita na dio konture na koju djeluje i proporcionalna je dužini ovog presjeka. Koeficijent proporcionalnosti - sila po jedinici dužine konture - naziva se koeficijent površinske napetosti. Mjeri se u njutnima po metru. Ali ispravnije je površinski napon definirati kao energiju (J) po jedinici površinskog loma (m²). U ovom slučaju pojavljuje se jasno fizičko značenje pojma površinske napetosti.
Izmjereno u J/m2.
2. Kako površinski napon zavisi od prirode supstance koja formira površinu?
Površinski napon zavisi od prirode tečnosti, tj. na sile privlačenja između molekula date tečnosti i na temperaturu (površinska napetost opada sa povećanjem temperature).
3. Kako i zašto površinski napon zavisi od temperature? Koja je kritična tačka ključanja?
Kako temperatura raste, površinska napetost opada i jednaka je nuli na kritičnoj temperaturi. Najpoznatiju empirijsku zavisnost površinske napetosti od temperature predložio je Lorand Eötvös, takozvano Eötvösovo pravilo (eng. Eö tvö s pravila). Trenutno je dobiven zaključak o teorijskoj ovisnosti površinske napetosti od temperature u području do kritičnih temperatura, što potvrđuje Eötvösovo pravilo.
4. Koje metode se koriste za određivanje površinskog napona tečnosti i čvrstih materija? Koja je osnova za mjerenje površinskog napona tečnosti metodom najvećeg pritiska vazdušnog mehura?
Metode za određivanje površinske napetosti dijele se na statičke i dinamičke. U statičkim metodama, površinski napon se određuje na formiranoj površini koja je u ravnoteži. Dinamičke metode su povezane s uništavanjem površinskog sloja. U slučaju mjerenja površinskog napona otopina (posebno polimera ili surfaktanata) treba koristiti statičke metode. U nekim slučajevima, ravnoteža na površini može nastupiti u roku od nekoliko sati (na primjer, u slučaju koncentriranih otopina polimera visokog viskoziteta). Dinamičke metode se mogu primijeniti za određivanje ravnotežne površinske napetosti i dinamičke površinske napetosti. Na primjer, za otopinu sapuna nakon miješanja, površinski napon je 58 mJ / m², a nakon taloženja - 35 mJ / m². To jest, površinski napon se mijenja. Sve dok se ravnoteža ne uspostavi, ona će biti dinamična.
Statičke metode:
Metoda kapilarnog podizanja
Wilhelmy metoda
metoda sjedećeg pada
Metoda za određivanje po obliku viseće kapi.
Metoda rotacionog pada
Dinamičke metode:
Du Nouy metoda (metoda kidanja prstena).
Stalagmometrijska ili metoda brojanja kapljica.
Metoda maksimalnog pritiska mjehurića.
Metoda oscilirajućeg mlaza
Metoda stojećeg talasa
Metoda putujućeg talasa
5. Šta se naziva adsorpcija i kako se kvantitativno karakteriše? Napišite osnovnu Gibbsovu adsorpcijsku jednačinu i definirajte višak adsorpcije (D).
Adsorpcija - povećanje koncentracije otopljene tvari na granici dvije faze (čvrsta faza - tekućina, kondenzirana faza - plin) zbog nekompenziranih sila međumolekulske interakcije pri razdvajanju faza. Adsorpcija je poseban slučaj sorpcije, proces, obrnuto od adsorpcije - desorpcija.
Fizička adsorpcija je spontani proces koji ide sa smanjenjem slobodne površinske energije i opisan je Gibbsovom jednačinom: G i = - (dσ/dμ i) t, gdje je G i višak komponente i u površinskom sloju u odnosu na njegova ravnotežna koncentracija u fazi rasute; σ - površinski napon; μ i - hemijski potencijal i-te komponente; T je temperatura. Fizička adsorpcija iz otopina može biti pozitivna (u kojoj se otopljena tvar apsorbira) ili negativna (u kojoj se apsorbira otapalo). Pozitivno adsorbirajuće tvari koje uzrokuju smanjenje površinske napetosti nazivaju se površinski aktivnim (surfaktanti), a negativno - površinski neaktivnim (SIV).
Vrijednost Gibbsovog viška adsorpcije izračunata je po formuli:
G= [( With-With R)V]/m
gdje je G Gibbsov višak adsorpcije, mmol/g; With– početna koncentracija dimetilamina, mmol/dm3; With R– ravnotežna koncentracija dimetilamina, mmol/dm3; V je zapremina ispitne otopine, dm 3 ; m je masa uzorka adsorbenta, g.
6. Koje supstance se nazivaju površinski aktivnim, kakva je struktura njihovih molekula?
Surfaktanti ( surfaktant) - hemijska jedinjenja koja, koncentrišući se na granicu termodinamičkih faza, uzrokuju smanjenje površinske napetosti.
Glavna kvantitativna karakteristika surfaktanata je površinska aktivnost - sposobnost tvari da smanji površinsku napetost na granici faze - ovo je derivat površinske napetosti u odnosu na koncentraciju surfaktanta jer C teži nuli. Međutim, surfaktanti imaju granicu rastvorljivosti (tzv kritična koncentracijamicelizacija ili CMC), čijim se postizanjem, kada se u otopinu doda surfaktant, koncentracija na granici faza ostaje konstantna, ali istovremeno dolazi do samoorganizacije molekula surfaktanta u rasutom rastvoru (formiranje ili agregacija micela ). Kao rezultat ove agregacije nastaju takozvane micele. Posebnost formiranja micela je zamućenost otopine surfaktanta. Vodeni rastvori surfaktanata, tokom formiranja micela, takođe dobijaju plavičastu nijansu (želatinozna nijansa) zbog prelamanja svetlosti micela.
Po pravilu surfaktanti su organska jedinjenja koja imaju amfifilnistruktura, odnosno njihove molekule sadrže polarni dio, hidrofilnu komponentu (funkcionalne grupe -OH, -COOH, -SOOOH, -O- itd., ili češće njihove soli -ONa, -COONa, -SOOONa i sl. .) i nepolarni (ugljikovodični) dio, hidrofobna komponenta. Primjer surfaktanta je obični sapun (mješavina natrijevih soli masnih karboksilnih kiselina -oleat, natrijum stearat itd.) i SMS (sintetski deterdženti), kao i alkoholi, karboksilne kiseline, amini itd.
Odgovori na pitanja
1. Definirajte pojmove: adsorpcija, adsorbent, adsorbat, adsorbat.
Adsorpcija (lat. ad- na, u; sorbeo- apsorbiram) - povećanje koncentracije otopljene tvari na granici dvije faze (čvrsta faza-tečnost, kondenzovana faza - gas) zbog nekompenzovanih sila međumolekulske interakcije pri razdvajanju faza. Adsorpcija je poseban slučaj sorpcije, obrnuti proces adsorpcije - desorpcija.
Adsorbenti su visoko dispergirani prirodni ili umjetni materijali s velikom specifičnom površinom, na kojoj se tvari adsorbiraju iz plinova ili tekućina u dodiru s njima. Adsorbenti se koriste u gas maskama, kao nosači katalizatora, za prečišćavanje gasova, alkohola, ulja, za odvajanje alkohola, u preradi nafte, i u medicini za apsorpciju gasova i otrova.
Apsorbovana supstanca, koja je još uvek u zapremini faze, naziva se adsorbent, apsorbirano - adsorbat.
2. Koje su karakteristike adsorpcije na granici čvrstog i tečnog?
Tokom adsorpcije na granici čvrsta-tečnost, višak adsorbovane supstance postaje funkcija molarne koncentracije rastvora.Adsorpcija iz rastvora ima značajne razlike od adsorpcije gasa. To je zbog sljedećih razloga:
ne samo da se otopljena tvar može adsorbirati na adsorbentu, već i sam rastvarač. Što je bolja adsorpcija rastvarača, to će biti teže adsorbovati rastvor;
rastvarač može rastvoriti adsorbens. Što otapalo bolje otapa adsorbent, to je teže adsorpcija na njemu;
brzina adsorpcije iz rastvora zavisi od brzine difuzije. Kao rezultat iscrpljivanja ekstrahirane tvari u slojevima vode u blizini adsorbenta, daljnja adsorpcija je određena brzinom difuzije apsorbirane tvari do adsorbenta. Kao što je poznato, difuzija u tekućinama je prilično spor proces, pa se za ubrzavanje adsorpcije pribjegava miješanju otopine.
Ove tri karakteristike unose značajne greške u izotermu adsorpcije.
Pravilo poravnanja polariteta (M.A. Rebinder): na polarnim adsorbentima najbolje se adsorbiraju polarni adsorbati iz nepolarnih rastvarača, a na nepolarnim adsorbentima, nepolarni adsorbati iz polarnih rastvarača se najbolje adsorbiraju.
Apsorpcija otopljene tvari iz otopine ovisi o njenoj strukturi.
3. Koja je specifična površina, koje metode njenog određivanja poznajete?
Specifična površina je prosječna karakteristika dimenzija unutrašnjih šupljina (kanala, pora) poroznog tijela ili čestica usitnjene faze dispergovanog sistema.
Specifična površina se izražava kao omjer ukupne površine poroznog ili raspršenog tijela u datom mediju i njegove zapremine ili mase. Specifična površina je proporcionalna disperznosti ili, što je isto, obrnuto proporcionalna veličini čestica dispergirane faze.
Specifična površina se najčešće određuje količinom inertnog plina adsorbiranog u materijalu i propusnošću zraka sloja praha ili poroznog materijala. Metode adsorpcije daju najpouzdanije podatke.
Za određivanje specifične površine i raspodjele pora duž polumjera poroznih tijela prema BET teoriji metodom sorpcije azota na temperaturi tečnog azota, italijanska kompanija Carlo Erba proizvela je Sorptomatic uređaj (vrijeme mjerenja je približno jedan uzorak po dan).
Prvo, razmotrimo posebna svojstva koja molekuli prizemnog sloja tekućine imaju u usporedbi s molekulima u masi.
Rice. 1. Razlika između molekula pripovršinskog sloja i molekula u masi tekućine
Posmatrajmo dva molekula A i B. Molekul A je unutar tečnosti, molekul B je na njenoj površini (slika 1). Molekul A je ravnomjerno okružen drugim molekulima tekućine, pa su sile koje djeluju na molekul A od molekula koji padaju u sferu međumolekulske interakcije kompenzirane, ili je njihova rezultanta nula.
Šta se dešava sa molekulom B, koja se nalazi na površini tečnosti? Podsjetimo da je koncentracija molekula plina iznad tekućine mnogo manja od koncentracije tekućih molekula. Molekul B je s jedne strane okružen molekulima tekućine, a s druge strane vrlo razrijeđenim molekulima plina. Pošto na njega djeluje mnogo više molekula sa strane tekućine, rezultanta svih međumolekularnih sila bit će usmjerena unutar tekućine.
Dakle, da bi molekul iz dubine tečnosti ušao površinski sloj, morate raditi protiv nekompenziranih međumolekularnih sila.
Zapamtite da je posao promjena. potencijalna energija uzeti sa znakom minus.
To znači da molekuli pripovršinskog sloja, u poređenju sa molekulima unutar tečnosti, imaju višak potencijalne energije.
Ovaj višak energije je komponenta unutrašnje energije fluida i naziva se površinska energija. Označava se kao i mjeri se, kao i svaka druga energija, u džulima.
Očigledno, što je veća površina tekućine, to je više takvih molekula koje imaju višak potencijalne energije, a time i veća površinska energija. Ova činjenica se može zapisati kao sljedeći odnos:
,
gdje je površina, a je faktor proporcionalnosti, koji ćemo nazvati površinski napon, ovaj koeficijent karakterizira jednu ili drugu tekućinu. Zapišimo rigoroznu definiciju ove količine.
Površinski napon tečnosti (koeficijent površinskog napona tečnosti) je fizička količina, koji karakteriše datu tečnost i jednak je omjeru površinske energije i površine tečnosti
Koeficijent površinske napetosti mjeri se u njutnima podijeljen sa metrom.
Razmotrimo o čemu ovisi koeficijent površinskog napona tekućine. Za početak, podsjetimo da koeficijent površinske napetosti karakterizira specifičnu energiju interakcije molekula, što znači da će faktori koji mijenjaju ovu energiju promijeniti i koeficijent površinske napetosti tekućine.
Dakle, koeficijent površinske napetosti zavisi od:
1. Priroda tečnosti (za "isparljive" tečnosti, kao što su etar, alkohol i benzin, površinska napetost je manja od one "nehlapljivih" - vode, žive i tečnih metala).
2. Temperatura (što je temperatura viša, to je niža površinska napetost).
3. Prisutnost surfaktanata koji smanjuju površinski napon (tenzida), kao što su sapun ili prašak za pranje.
4. Svojstva gasa koji se nalazi u blizini tečnosti.
Imajte na umu da koeficijent površinske napetosti ne ovisi o površini, jer je za jedan pojedinačni molekul blizu površine apsolutno nevažno koliko je istih molekula u blizini. Obratite pažnju na tabelu koja pokazuje koeficijente površinskog napona razne supstance, na temperaturi:
Tabela 1. Koeficijenti površinskog napona tečnosti na granici sa vazduhom, at
Dakle, molekuli prizemnog sloja imaju višak potencijalne energije u odnosu na molekule u masi tečnosti. U toku mehanike se pokazalo da svaki sistem teži minimumu potencijalne energije. Na primjer, tijelo bačeno sa određene visine ima tendenciju pada. Osim toga, mnogo ugodnije se osjećate ležeći, jer se u ovom slučaju centar mase vašeg tijela nalazi što je moguće niže. Do čega vodi želja da se smanji njena potencijalna energija u slučaju tečnosti? Pošto površinska energija zavisi od površine, to znači da je energetski nepovoljno da bilo koja tečnost ima veliku površinu. Drugim riječima, u slobodnom stanju, tekućina će nastojati da minimizira svoju površinu.
To je lako provjeriti eksperimentiranjem sa filmom od sapuna. Ako se žičani okvir umoči u otopinu sapuna, tada se na njemu formira film sapuna, a film poprima takav oblik da je njegova površina minimalna (slika 2).


Rice. 2. Figure iz rastvora sapuna
Možete provjeriti postojanje sila površinske napetosti jednostavnim eksperimentom. Ako se konac veže za žičani prsten na dva mjesta, i to tako da je dužina konca nešto veća od dužine tetive koji spaja mjesta pričvršćivanja konca, a žičani prsten umočimo u sapun rastvora (slika 3a), film sapuna će stegnuti celu površinu prstena i konac će leći na foliji od sapuna. Ako je sada film slomljen na jednoj strani konca, film sapuna koji ostane na drugoj strani konca će se skupiti i istegnuti konac (slika 3b).

Rice. 3. Eksperimentirajte za otkrivanje sila površinskog napona
Zašto se to dogodilo? Činjenica je da otopina sapuna koja ostaje na vrhu, odnosno tekućina, ima tendenciju da smanji svoju površinu. Tako se konac povlači prema gore.
Dakle, uvjereni smo u postojanje sile površinskog napona. Sada ćemo naučiti kako to izračunati. Da bismo to učinili, napravimo misaoni eksperiment. Spustimo žičani okvir čija je jedna strana pokretna u rastvor sapuna (slika 4). Razvući ćemo film sapuna, djelujući silom na pokretnu stranu okvira. Dakle, na prečku djeluju tri sile - vanjska sila i dvije sile površinske napetosti koje djeluju duž svake površine filma. Koristeći drugi Newtonov zakon, možemo to napisati
![]()
Rice. 4. Proračun sile površinskog napona
Ako je pod uticajem spoljna sila prečka će se pomaknuti na udaljenost, tada će ova vanjska sila obaviti posao
Naravno, zbog izvođenja ovog posla povećat će se površina filma, što znači da će se povećati i površinska energija, koju možemo odrediti kroz koeficijent površinske napetosti:
Promjena površine, pak, može se odrediti na sljedeći način:
gdje je dužina pokretnog dijela žičanog okvira. S obzirom na ovo, možemo zapisati da je rad vanjske sile jednak
Izjednačavajući prave dijelove u (*) i (**), dobijamo izraz za silu površinskog napona:
Dakle, koeficijent površinske napetosti je numerički jednaka snazi površinski napon, koji djeluje po jedinici dužine linije koja ograničava površinu
Dakle, još jednom smo vidjeli da tekućina teži da poprimi takav oblik da je njena površina minimalna. Može se pokazati da će za dati volumen površina biti minimalna za sferu. Dakle, ako na tekućinu ne djeluju druge sile ili je njihovo djelovanje malo, fluid će težiti da poprimi sferni oblik. Tako će se, na primjer, voda ponašati u bestežinskom stanju (slika 5) ili mehurići od sapunice (slika 6).

Rice. 5. Voda bez gravitacije

Rice. 6. Mjehurići od sapuna
Prisustvo sila površinskog napona takođe može objasniti zašto metalna igla "leži" na površini vode (slika 7). Igla, koja je pažljivo postavljena na površinu, deformira je, čime se povećava površina ove površine. Tako nastaje sila površinske napetosti koja teži da smanji takvu promjenu površine. Rezultirajuća sila površinske napetosti će biti usmjerena prema gore i kompenzirat će silu gravitacije.
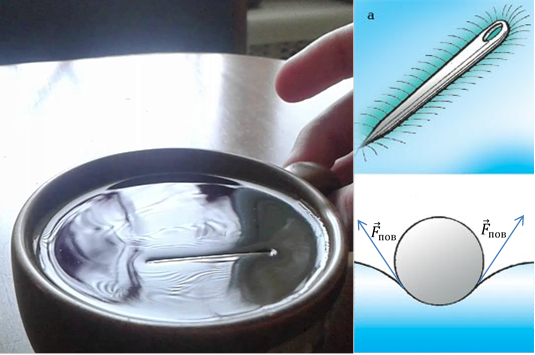
Rice. 7. Igla na površini vode
Na isti način može se objasniti i princip rada pipete. Kapljica, na koju djeluje sila gravitacije, povlači se prema dolje, čime se povećava njena površina. Prirodno se javljaju sile površinskog napona čija je rezultanta suprotna od smjera gravitacije i koje ne dozvoljavaju da se kapljica rastegne (slika 8). Kada pritisnete gumeni poklopac pipete, stvarate dodatni pritisak koji pomaže kod gravitacije, uzrokujući pad kapljice.
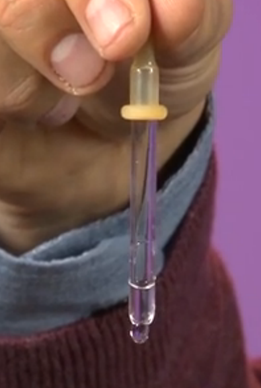
Rice. 8. Kako pipeta radi
Uzmimo još jedan primjer iz Svakodnevni život. Ako kist umočite u čašu vode, dlačice će se zapuhati. Ako sada izvadite ovu četku iz vode, primijetit ćete da su sve dlačice zalijepljene jedna za drugu. To je zbog činjenice da će površina vode koja prianja na četku tada biti minimalna.
I još jedan primjer. Ako želite izgraditi dvorac od suhog pijeska, malo je vjerovatno da ćete uspjeti, jer će se pijesak raspasti pod utjecajem gravitacije. Međutim, ako navlažite pijesak, on će zadržati svoj oblik zbog površinske napetosti vode između zrna pijeska.
Na kraju, napominjemo da teorija površinske napetosti pomaže u pronalaženju lijepih i jednostavnih analogija pri rješavanju složenijih problema. fizički zadaci. Na primjer, kada trebate izgraditi laganu i istovremeno jaku strukturu, fizika onoga što se događa u mjehurićima od sapunice dolazi u pomoć. I bilo je moguće izgraditi prvi adekvatan model atomskog jezgra upoređivanjem atomsko jezgro kap napunjene tečnosti.
Bibliografija
- G. Ya. Myakishev, B. B. Bukhovtsev, N. N. Sotsky. "Fizika 10". - M.: Obrazovanje, 2008.
- Ya. E. Geguzin "Mjehurići", Kvant biblioteka. - M.: Nauka, 1985.
- B. M. Yavorsky, A. A. Pinsky "Osnove fizike", tom 1.
- G. S. Landsberg "Elementarni udžbenik fizike" tom 1.
- Nkj.ru ().
- Youtube.com().
- Youtube.com().
- Youtube.com().
Zadaća
- Nakon što riješite zadatke za ovu lekciju, moći ćete se pripremiti za pitanja 7,8,9 GIA i pitanja A8, A9, A10 Jedinstvenog državnog ispita.
- Gelfgat I.M., Nenashev I.Yu. „Fizika. Zbirka zadataka 10. razreda "5.34, 5.43, 5.44, 5.47 ()
- Na osnovu zadatka 5.47 odrediti koeficijent površinskog napona vode i otopine sapuna.
Lista pitanja i odgovora
Pitanje: Zašto se površinski napon mijenja s temperaturom?
odgovor: Kako temperatura raste, molekuli tekućine počinju se kretati brže, te stoga molekuli lakše savladavaju potencijalne sile privlačenja. To dovodi do smanjenja sila površinske napetosti, koje su potencijalne sile koje vezuju molekule blizu površinskog sloja tekućine.
Pitanje: Da li koeficijent površinskog napona zavisi od gustine tečnosti?
odgovor: Da, ima, jer energija molekula prizemnog sloja tečnosti zavisi od gustine tečnosti.
Pitanje: Koji su načini za određivanje koeficijenta površinskog napona tečnosti?
odgovor: AT školski kurs proučavati dva načina za određivanje koeficijenta površinskog napona tečnosti. Prvi je metoda kidanja žice, njen princip je opisan u zadatku 5.44 iz zadaća, drugi je metoda brojanja kapljica opisana u problemu 5.47.
Pitanje: Zašto se mjehurići od sapunice sruše nakon nekog vremena?
odgovor:Činjenica je da nakon nekog vremena, pod djelovanjem gravitacije, mjehur postaje deblji na dnu nego na vrhu, a zatim, pod utjecajem isparavanja, u nekom trenutku propada. To rezultira da cijeli balon izgleda kao balon, ruši pod djelovanjem nekompenziranih sila površinskog napona.
Molekuli tečnosti nalaze se veoma blizu jedan drugom, tako da sile privlačenja dostižu značajnu vrednost. Svaki molekul doživljava privlačnost od susjednih molekula.
Ako je molekul unutar tečnosti (slika 16), tada je rezultanta sila koje na njega djeluju je nula. Situacija je drugačija ako se molekul nalazi u površinskom sloju tečnosti. Gustoća pare (ili plina) s kojom tečnost graniči višestruko je manja od gustoće tekućine, pa će rezultanta sila koje djeluju na dio molekula pare također biti mnogo manja od rezultante sila djelujući na dio molekula tekućine. Kao rezultat toga, svaki molekul koji se nalazi u površinskom sloju će biti pod utjecajem sile usmjerene unutar tekućine.
Rice. 16. Pojava sila površinskog napona
Kada molekul pređe iz dubine tečnosti u površinski sloj, iznad molekule se vrši negativan rad silama koje deluju na nju u ovom sloju. Gde kinetička energija molekula se smanjuje, pretvarajući se u potencijal. Dakle, molekuli u površinskom sloju imaju dodatnu potencijalnu energiju. Površinski sloj u cjelini ima dodatnu energiju koja ulazi sastavni dio in unutrašnja energija tečnosti.
Prisustvo ove dodatne energije uzrokuje tečnost da smanji svoju površinu. Tečnost se ponaša kao da je zatvorena u elastičnom rastegnutom filmu koji ima tendenciju skupljanja. U stvari, nema filma, površinski sloj se sastoji od istih molekula kao i cijela tekućina.
Mentalno izdvojimo dio na površini tekućine omeđen zatvorenom konturom dužine l. Tendencija ovog presjeka da se skuplja dovodi do činjenice da će djelovati na ostatak površine silama tangencijalnim na površinu. Ove sile se nazivaju sile površinskog napona. Za kvantifikacija površinske sile uvode vrijednost koja se naziva koeficijent površinske napetosti (ili površinski napon).
Koeficijent površinske napetosti (α) je skalarna fizička veličina jednaka omjeru modula sile površinskog napona F, djelujući na granici površinskog sloja s dužinom l, do ove dužine:
 (33)
(33)
Kako bi se promijenila površina površinskog sloja na konstantna temperatura po iznosu dS, posao treba obaviti
δA = αdS, (34)
gdje je α koeficijent površinskog napona.
Prilikom promjene područja od S1 prije S2 rad će biti jednak:
A = α(S2 – S1). (35)
Pri obavljanju rada A energija površinskog sloja se mijenja za iznos ΔW.
A= ΔW.= α(S2 – S1) = αdS.
![]() (36)
(36)
Dimenzija α:
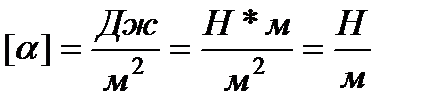 .
.
Stoga se može dati još jedna definicija koeficijenta površinskog napona.
Koeficijent površinske napetosti je skalarna fizička veličina jednaka omjeru promjene potencijalne energije površinskog sloja i promjene površine ovog sloja.
Koeficijent površinskog napona zavisi od hemijski sastav tečnost i njena temperatura. Kako temperatura raste, α se smanjuje i nestaje na kritičnoj temperaturi.
Površinska napetost značajno zavisi od nečistoća prisutnih u tečnostima. Tvari koje smanjuju površinski napon tečnosti nazivaju se surfaktanti. Sapun je najpoznatiji surfaktant za vodu. Značajno smanjuje njenu površinsku napetost (otprilike sa 7,5*10 -2 na 4,5*10 -2 N/m). Što se tiče vode, etri, alkoholi, ulje itd. su površinski aktivni. Sa molekularne tačke gledišta, uticaj surfaktanata objašnjava se činjenicom da su sile privlačenja između molekula tečnosti veće od sila privlačenja između molekula tečnosti i nečistoće. Molekuli tekućine u površinskom sloju uvlače se u tekućine s većom silom od molekula nečistoća. Kao rezultat toga, molekuli tekućine se kreću iz površinskog sloja duboko u njega, a molekuli surfaktanta se istiskuju na površinu.
Surfaktanti se koriste kao sredstva za vlaženje, flotacijski reagensi, sredstva za pjenjenje, disperzanti - reduktori tvrdoće, aditivi za plastifikaciju, modifikatori kristalizacije itd.
Sve što je rečeno o posebnim uslovima pod kojima se nalaze molekuli površinskog sloja u potpunosti se odnosi i na čvrste materije. Stoga, čvrste tvari, kao i tekućine, imaju površinsku napetost.
Kada se razmatraju fenomeni na interfejsu raznim okruženjima treba imati na umu da površinska energija tečnosti ili čvrste materije ne zavisi samo od svojstava date tečnosti ili čvrste materije, već i od svojstava supstance sa kojom se graniče. Strogo govoreći, potrebno je uzeti u obzir ukupnu površinsku energiju α 12 dviju supstanci koje graniče jedna s drugom. Samo ako je jedna supstanca gasovita, ne reaguje hemijski sa drugom supstancom i malo se otapa u njoj, možemo jednostavno govoriti o površinskoj energiji (ili koeficijentu površinske napetosti) drugog tečnog ili čvrstog tela.

Rice. 17. Granica tečnosti, gasa i čvrstog tela
Ako se tri tvari istovremeno graniče jedna s drugom: čvrsta, tečna i plinovita (slika 17), tada cijeli sistem poprima konfiguraciju koja odgovara minimumu ukupne potencijalne energije (površinski, u polju gravitacije, itd.) . Konkretno, kontura duž koje se graniče sve tri tvari nalazi se na površini čvrstog tijela na način da je zbroj projekcija svih sila površinskog napona primijenjenih na svaki element konture na smjer u kojem se nalazi element konture. može da se kreće (tj. u pravcu tangente na površinu čvrstog tela) bila jednaka nuli. Od sl. 17 slijedi da je uvjet ravnoteže za konturni element s dužinom Δl biće napisano kako slijedi:
Δlα TG = Δlα TG + Δlα TG cosθ (37)
gdje α TG, α TG i α ZhG su koeficijenti površinskog napona na granicama: čvrsto - gas, čvrsto - tečnost i tečnost - gas.
Ugao θ mjeren unutar tečnosti između tangenti na površinu čvrstog tela i na površinu tečnosti naziva se kontaktni ugao. Prema (37)
 . (38)
. (38)
Kontaktni ugao je određen izrazom (38) samo pod uslovom da
 . (39)
. (39)
Ako (39) nije zadovoljeno, tj. |α TG – α TG | > α ZhG, ne može se uspostaviti ravnoteža za bilo koju vrijednost θ. Ovo se dešava u dva slučaja.
1) α TG > α TG + α FG. Koliko god da je ugao θ mali, sila α TG je veća od druge dve (Sl. 18, a). U ovom slučaju, tekućina se neograničeno širi po površini čvrstog tijela - postoji potpuno vlaženje. Zamjena površinskog čvrstog - plina sa dvije površine, čvrsto - tekućina i tekućina - plin, pokazuje se energetski povoljnom. Kod potpunog vlaženja kontaktni ugao je nula.
2) α TG > α TG + α FG. Bez obzira koliko je ugao θ blizak π, sila α TL je veća od druge dvije (slika 18,b). Zamjena površine čvrsto-tečnost sa dvije površine, čvrsto-gas i tekući-gas, pokazuje se energetski povoljnom. Sa potpunim nekvašenjem, kontaktni ugao je jednak π .

Rice. 18. Potpuno vlaženje i potpuno nekvašenje
Ako je uslov (39) ispunjen, kontaktni ugao može ispasti oštar ili tup, ovisno o odnosu između α TG i α TG. Ako je α TG > α TG, onda je cosθ > 0 i ugao θ je oštar (slika 19a). U tom slučaju dolazi do djelomičnog vlaženja. Ako je α TG< α ТЖ, то cosθ < 0, и угол θ - тупой (рис. 19,б). В этом случае имеет место частичное несмачивание.

Fig.19. Djelomično vlaženje i djelomično nekvašenje
Površinski napon vode jedno je od najzanimljivijih svojstava vode.
Evo definicije ovog pojma iz kompetentnog izvora.
Površinski napon je...
Velika medicinska enciklopedija
Površinska napetost (P. n.) je sila privlačenja kojom svaki dio površinskog filma (slobodne površine tekućine ili bilo koje površine između dvije faze) djeluje na susjedne dijelove površine. Unutrašnji pritisak i P. n. Površinski sloj tečnosti ponaša se kao elastična rastegnuta membrana. Prema ideji koju je razvio pog. arr. Laplace (Laplace), ovo svojstvo tekućih površina ovisi o „molekularnim silama privlačenja, koje se brzo smanjuju s rastojanjem. Unutar homogene tekućine, sile koje djeluju na svaki molekul iz molekula koji ga okružuju međusobno su uravnotežene. Ali blizu površine, rezultanta sila molekularne privlačnosti je usmjerena prema unutra; ima tendenciju da uvuče površinske molekule u glavninu tečnosti. Kao rezultat, cijeli površinski sloj, poput elastičnog rastegnutog filma, vrši vrlo značajan pritisak na unutrašnju masu tekućine u smjeru normalnom na površinu. Prema proračunima, ovaj "unutrašnji pritisak", pod kojim se nalazi čitava masa tečnosti, dostiže nekoliko hiljada atmosfera. Povećava se na konveksnoj površini, a smanjuje na konkavnoj. Zbog težnje slobodne energije ka minimumu, svaka tekućina teži da poprimi oblik u kojem njena površina - mjesto djelovanja površinskih sila - ima najmanju moguću vrijednost. Što je veća površina tečnosti, veća je površina koju zauzima njen površinski film, veća je količina slobodne površinske energije koja se oslobađa tokom njene kontrakcije. Napetost kojom svaki dio kontraktivnog površinskog filma djeluje na susjedne dijelove (u smjeru paralelnom sa slobodnom površinom) naziva se napetost napetosti. Za razliku od elastične napetosti elastičnog istegnutog tijela, P. n. ne slabi kako se površinski film sabija. … Površinska napetost jednaka je radu koji se mora izvršiti da bi se slobodna površina tečnosti povećala za jedan. P. n. posmatrano na granici tečnosti sa gasom (također sa sopstvenom parom), sa drugom tečnošću koja se ne meša, ili sa čvrstim telom. Na isti način, čvrsto tijelo ima P. n. na granici sa gasovima i tečnostima. Za razliku od P. n., izrezana tekućina (ili čvrsto tijelo) na svojoj slobodnoj površini, koja graniči s plinovitim medijem, ima napetost na unutrašnjoj granici dvije tekuće (ili tekuće i čvrste) faze, prikladno je označiti poseban termin usvojen u njemačkoj literaturi termin "granična napetost" (Grenzflachenspannung). Ako se rastvori u tečnosti, snižava se P. n., dakle slobodna energija smanjuje se ne samo smanjenjem veličine granične površine, već i adsorpcijom: površinski aktivna (ili kapilarno aktivna) tvar se skuplja u povećanoj koncentraciji u površinskom sloju ...
…Velika medicinska enciklopedija. 1970
Sve navedeno može se sažeti na ovaj način - molekule koji se nalaze na površini bilo koje tekućine, uključujući vodu, privlače ostatak molekula unutar tekućine, uslijed čega nastaje površinska napetost. Naglašavamo da se radi o pojednostavljenom razumijevanju ove imovine.
Površinski napon vode
Za bolje razumijevanje ove osobine, predstavljamo nekoliko manifestacija površinske napetosti vode u stvarnom životu:
- Kada vidimo kako voda kaplje sa vrha slavine i ne teče, to je površinski napon vode;
- Kada kišna kap u letu poprimi zaobljen, blago izduženi oblik, to je površinski napon vode;
- Kada voda na vodootpornoj površini poprimi sferni oblik, to je površinski napon vode;
- Mreškanje koje nastaje kada vjetar duva na površini vodenih tijela također je manifestacija površinske napetosti vode;
- Voda u svemiru zbog površinske napetosti poprima sferni oblik;
- Insekt vodoskok ostaje na površini vode zahvaljujući upravo ovom svojstvu vode;
- Ako se igla pažljivo stavi na površinu vode, ona će plutati;
- Ako se tečnosti različite gustine i boje naizmjenično sipaju u čašu, vidjet ćemo da se ne miješaju;
- Iridescentni mjehurići sapuna također su divna manifestacija površinske napetosti.
Koeficijent površinske napetosti
Politehnički terminološki rječnik
Koeficijent površinske napetosti je linearna sila površinske napetosti na površini tekućine ili na granici između dvije tekućine koje se ne miješaju.
Politehnička terminološka rječnik. Sastavili: V. Butakov, I. Fagradyants. 2014
U nastavku dajemo vrijednosti koeficijenta površinskog napona (C.T.S.) za različite tekućine na temperaturi od 20°C:
- K. p. n. aceton - 0,0233 Njutn/metar;
- K. p. n. benzen - 0,0289 Njutn/metar;
- K. p. n. destilovana voda - 0,0727 Njutn/metar;
- K. p. n. glicerin - 0,0657 Njutn/metar;
- K. p. n. kerozin - 0,0289 Njutn/metar;
- K. p. n. živa - 0,4650 Njutn/metar;
- K. p. n. etilni alkohol - 0,0223 Njutn/metar;
- K. p. n. etar - 0,0171 Njutn/metar.
Koeficijent površinskog napona vode
Koeficijent površinskog napona zavisi od temperature tečnosti. Predstavimo njegove vrijednosti za razne temperature vode.
- Na temperaturi od 0 ° C - 75,64 σ, 10 -3 Newton / metar;
- Na temperaturi od 10 ° C - 74,22 σ, 10 -3 Newton / metar;
- Na temperaturi od 20 ° C - 72,25 σ, 10 -3 Newton / metar;
- Na temperaturi od 30°C - 71,18 σ, 10 -3 Newton/metar;
- Na temperaturi od 40 ° C - 69,56 σ, 10 -3 Newton / metar;
- Na temperaturi od 50 ° C - 67,91 σ, 10 -3 Newton / metar;
- Na temperaturi od 60 ° C - 66,18 σ, 10 -3 Newton / metar;
- Na temperaturi od 70 ° C - 64,42 σ, 10 -3 Newton / metar;
- Na temperaturi od 80 ° C - 62,61 σ, 10 -3 Newton / metar;
- Na temperaturi od 90°C - 60,75 σ, 10 -3 Newton/metar;
- Na temperaturi od 100°C - 58,85 σ, 10 -3 Newton/metar.






