Nezasićene i zasićene pare
Isparavanje i kondenzacija.
Dobro zatvorena bočica parfema može stajati jako dugo, a količina parfema u njoj se neće promijeniti. Ako bocu ostavite otvorenu, onda ćete, nakon što je pogledate nakon dovoljno dugog vremena, vidjeti da u njoj nema tekućine. Tečnost u kojoj su rastvorene aromatične supstance je isparila.
Ali kako se ovaj fenomen može objasniti?
Molekuli u tečnosti kreću se nasumično. Što je temperatura tečnosti viša, veća je kinetička energija molekula. Prosječna vrijednost kinetičke energije molekula na datoj temperaturi ima određenu vrijednost. Svaki molekul ima kinetičku energiju od ovog trenutka može biti manje ili više od prosjeka. U nekom trenutku, kinetička energija pojedinačnih molekula može postati tolika da će moći da izlete iz tečnosti, savladavajući privlačne sile drugih molekula. Ovo je procesisparavanje.
Molekul koji izlazi učestvuje u nasumičnom toplotnom kretanju gasa. Nasumično se kreće, može se trajno udaljiti od površine tečnosti u otvorenom sudu, ali se može i ponovo vratiti u tečnost. Takav proces se zovekondenzacije.
Ako strujanje vazduha iznad posude odnese formirane pare tečnosti, tada tečnost brže isparava, jer molekul pare ima smanjenu sposobnost da se vrati u tečnost. Što je temperatura tečnosti viša, to je veći broj molekula koji je dovoljan da izađe iz tečnosti kinetička energijašto je brže isparavanje.
Tokom isparavanja, brži molekuli napuštaju tečnost, pa se prosječna kinetička energija molekula tekućine smanjuje. To znači da dolazi do smanjenja temperature tečnosti. Nakon što navlažite ruku nekom tečnošću koja brzo isparava (benzin ili aceton), odmah ćete osjetiti snažno hlađenje vlažnog područja. Hlađenje će se povećati ako duvate u ruku.
Ako tekućini uskratite mogućnost da ispari, tada će se njeno hlađenje odvijati mnogo sporije. Zapamtite koliko dugo se hladi masna supa. Sloj masti na njegovoj površini sprečava oslobađanje brzih molekula vode.
Zasićena para.
Ako je posuda s tekućinom čvrsto zatvorena, tada će se njen pad uskoro zaustaviti. Pri konstantnoj temperaturi, sistem tečnost - para će doći u stanje termičke ravnoteže, i ostaće u njemu proizvoljno dugo vremena. Istovremeno sa procesom isparavanja dolazi i do kondenzacije, oba procesa se u prosjeku međusobno kompenziraju.
U prvom trenutku, nakon što se tečnost ulije u posudu i zatvori, tečnost će ispariti i gustina pare iznad nje će se povećati. Međutim, u isto vrijeme će se povećati i broj molekula koji se vraćaju u tekućinu. Što je veća gustina pare, to više njegovi molekuli se vraćaju u tečnost. Kao rezultat toga, u zatvorenoj posudi na konstantnoj temperaturi, dinamičan(mobilni) balans između tečnosti i pare, tj. broj molekula koji napuštaju površinu tečnosti je u proseku jednak broju molekula pare koji se vraćaju u tečnost u isto vreme
Para u dinamičkoj ravnoteži sa svojom tečnošću naziva se zasićena para .
Iznad slobodne površine tekućine uvijek se nalaze pare te tekućine koje nastaju isparavanjem. Ako prostor iznad slobodne površine tekućine nije ograničen nikakvim zidovima, molekule ili atomi isparene tvari, čineći haotično toplinsko kretanje, udaljavaju se od površine tekućine. Uklanjanje čestica pare s površine tekućine olakšava fenomen difuzije, kao i prirodna ili umjetna konvekcija zračnih slojeva. Koncentracija čestica pare pri konstantna temperatura u ovim uslovima može varirati u širokom rasponu, kako u pravcu smanjenja tako i u pravcu povećanja. Takvi parovi se nazivaju nezasićeni.
Drugačija slika se uočava ako postoji ograničen prostor iznad slobodne površine tečnosti. Da li je ispunjen bilo kojim drugim gasovitim materijama, osim parama tečnosti koja isparava, ili ne, nije bitno. Važno je napomenuti da se proces isparavanja u zatvoreni prostor može odvijati samo do određene granice. Što je veća koncentracija molekula ili atoma tvari koja isparava u stanju pare, to će biti veći pritisak ovih para na konstantnoj temperaturi. U ovom slučaju, sve veći broj molekula ili atoma može se vratiti kroz slobodnu površinu natrag u tekućinu. Ako je količina prostora koja se daje pari dovoljno mala, a tekućina dovoljno velika, može se uspostaviti dinamička ravnoteža: broj čestica koje izlaze iz tekućine u jedinici vremena jednak je broju čestica koje se vraćaju u tekućinu u istom vremenskom intervalu. U tom slučaju će konstantna masa pare biti iznad tečnosti, a veća koncentracija njenih čestica u ovim uslovima ne može se postići. Takva para se naziva zasićena.
Pritisak pare zasićenja neke supstance na datoj temperaturi može imati jednu - jedinu definitivnu vrednost.
Smanjenje volumena prostora koji se daje zasićenoj pari date tvari na konstantnoj temperaturi dovodi do kondenzacije dijela pare u tekućinu, budući da koncentracija njenih čestica ne može preći određenu vrijednost. Ova izotermna kompresija zasićene pare razlikuje se od kompresije nezasićenih para, koje se ponašaju kao obične idealnih gasova. Boyle-Mariotteov zakon, dakle, ne vrijedi za zasićene pare.
Gay–Lussacov zakon se također ne primjenjuje na zasićene pare, budući da je volumen koji im se daje nezavisan od temperature.
Nije primjenjivo na zasićenu paru i Charlesov zakon. Sa porastom temperature idealnih gasova ili nezasićene pare u izohornom procesu raste prosječna kinetička energija njihovih čestica, što dovodi do češćih sudara međusobno i sa stijenkama posude, tj. do povećanja pritiska.
Moguće je sa sigurnošću govoriti da data zatvorena posuda sadrži upravo zasićenu paru neke supstance samo ako posuda sadrži tu supstancu u tečno stanje a masa njegove tečne faze se ne menja.
Na primjer, pred nas stavljaju zatvorenu staklenu posudu i traže da bez mjerenja utvrdimo da li sadrži zasićenu ili nezasićenu vodenu paru.
Da biste odgovorili na ovo pitanje, morate pričekati nekoliko minuta kako bi sadržaj posude imao vremena da dođe u termodinamičku ravnotežu s okolnim zrakom. To je uzrokovano činjenicom da ne znamo na koju temperaturu je posuda dovedena iz prostorije, a promjena temperature pare pri konstantnom volumenu može dovesti paru iz nezasićenog stanja u zasićeno i obrnuto. . Ako nakon uspostavljanja ravnoteže nema kondenzacije vode na unutrašnjim stijenkama posude, moramo reći da na temperaturi na kojoj se vrši promatranje posuda sadrži nezasićenu paru. Ako se kapljice vode pojave na zidovima posude, para je zasićena.
Vodena para u vazduhu
Zemljina atmosfera uvijek sadrži vodenu paru. S njihovim prisustvom treba vrlo često računati. Posebno se mora precizno procijeniti vlažnost zraka u zatvorenim ili slabo ventiliranim prostorijama, komorama za sušenje itd.
Za kvantifikacija Sadržaj vodene pare u zraku koristi dvije vrijednosti - apsolutnu vlažnost (f) i relativnu vlažnost (B).
Apsolutna vlažnost se zove fizička količina, mjereno masom vodene pare sadržane u jednom kubnom metru zraka. Na ovaj način, apsolutna vlažnost poklapa se s dimenzijom gustoće, ali u praksi obično koriste jedinicu - 1 g / m 3.
Ova posljednja okolnost je zbog činjenice da se apsolutna vlažnost zraka f, izražena u g/m 3, malo razlikuje u brojčanoj vrijednosti od parcijalni pritisak vodena para p pod istim uslovima, mereno u milimetrima žive.
Procentualni odnos parcijalnog pritiska p vodene pare u vazduhu prema pritisku zasićene vodene pare p n.p. na datoj temperaturi naziva se relativna vlažnost:
Prilikom izračunavanja relativna vlažnost prema ovoj formuli, pritisak p i p n.s. moraju se mjeriti u istim jedinicama. Obično se ne mjere u paskalima, već u milimetrima žive. Vrijednost p n.s se utvrđuje iz tabela.
Temperatura na kojoj zrak postaje zasićen vodenom parom tokom hlađenja naziva se tačka rose.
OSNOVE PRIJENOSA TOPLOTE
Prijenos topline je nauka koja proučava obrasce procesa prijenosa topline između tijela i raspodjelu topline unutar jednog tijela. Proučavanje zakona prenosa toplote neophodno je za kontrolu tokova toplote koji se javljaju skoro svuda u radnim procesima mašina, motora, aparata itd.
U teoriji prijenosa topline razmatraju se dva glavna pitanja:
I. Određivanje količine toplote koja se prenosi sa jednog tela na drugo ili sa jednog dela tela na drugi pod datim uslovima.
II. Određivanje temperature u različitim dijelovima tijela uključenim u proces prijenosa topline.
Neophodan i dovoljan uslov za prenos toplote je temperaturna razlika.
Toplota se prenosi na tri načina: kondukcijom, konvekcijom i zračenjem.
Toplotna provodljivost je proces distribucije toplotne energije direktnim kontaktom pojedinih delova tela sa različitim temperaturama.
Konvekcija je proces prijenosa energije pri pomicanju volumena tekućine ili plina u prostoru iz područja s jednom temperaturom u područje s različitom temperaturom.
Zračenje (prijenos topline zračenja) je proces prijenosa energije elektromagnetnim valovima. Prijenos topline zračenjem je dvostruka transformacija energije: toplije tijelo zrači energiju u obliku elektromagnetskih oscilacija, drugo manje zagrijano tijelo apsorbira energiju i zagrijava se.
Obično se razmjena toplote između tijela odvija na sva tri načina istovremeno. Njihova kombinacija može biti najrazličitija. U ovom slučaju, jedna metoda može prevladati nad drugom, ovisno o uvjetima pod kojima se odvija prijenos topline.
Međutim, pri proučavanju procesa prijenosa topline treba jasno razlikovati i posebno razmotriti različite metode prijenosa topline (toplotna provodljivost, konvekcija i zračenje), budući da se pokoravaju različitim zakonima.
Procesi prijenosa topline u uređajima za toplinsku tehniku mogu se odvijati iu stacionarnom (stacionarnom) i nestacionarnom (nestacionarnom) načinu rada. Stacionarni (stalni) termički režim je režim u kojem temperatura u bilo kojoj tački tijela ne ovisi o vremenu. Stacionarnom režimu uvek prethodi nestacionarni režim.
Procesi koji se odvijaju u uslovima nestacionarnih termičkih uslova (procesi grejanja i hlađenja) su veoma složeni i njihovo razmatranje nije uključeno u program ovog predmeta. Stoga se ovdje razmatraju samo stacionarni procesi prijenosa topline.
TOPLOTNA PROVODNOST
Osnovni koncepti
Toplotna provodljivost je molekularni prijenos topline u unutrašnjosti kontinuum zbog prisustva temperaturne razlike.
Ovaj način prijenosa topline odvija se uglavnom u čvrstim tvarima unutar jednog tijela i između dva tijela kada dođu u dodir jedno s drugim. Toplotna provodljivost se takođe može izvesti kroz sloj tečnosti ili gasa. Međutim, gasovi i tečnosti, sa izuzetkom rastopljenih metala, su veoma loši provodnici toplote.
temperaturno polje. Proces provođenja toplote, kao i druge vrste prenosa toplote, odvija se samo pod uslovom da temperatura nije ista na različitim tačkama tela. Kao što znate, temperatura je parametar stanja tijela i karakterizira stupanj njegovog zagrijavanja. Skup temperaturnih vrijednosti u svim tačkama razmatranog prostora u datom trenutku naziva se temperaturno polje. Matematički, temperaturno polje se izražava kao funkcija koordinata
Površina u svim tačkama čija je temperatura ista naziva se izotermna.
Jer dvije osobe ne mogu biti u istoj tački u prostoru u isto vrijeme. različite temperature, tada se različite izotermne površine nikada ne seku. Svi oni ili završavaju na površini tijela, ili su u cijelosti smješteni unutar njega.
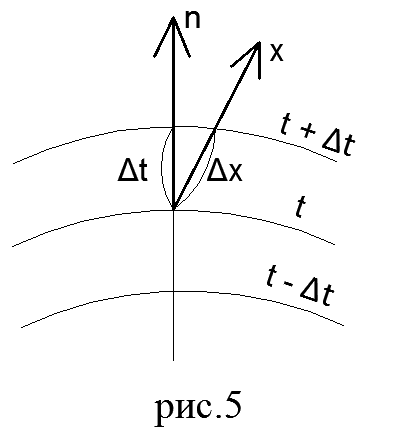 Fourierov zakon. Toplotni tok je količina toplote Q koja u jedinici vremena prolazi kroz proizvoljnu površinu. Vektor toplotnog toka je uvijek usmjeren u smjeru opadanja temperature.
Fourierov zakon. Toplotni tok je količina toplote Q koja u jedinici vremena prolazi kroz proizvoljnu površinu. Vektor toplotnog toka je uvijek usmjeren u smjeru opadanja temperature.
Kvantitativno, intenzitet prenosa toplote karakteriše gustina toplotnog toka q.
Gustoća toplotnog toka ili specifični toplotni tok je količina toplote koja prolazi kroz jedinicu površine F u jedinici vremena τ:
Relacija (51) izražava osnovni zakon toplotne provodljivosti i naziva se Fourierov zakon.
Znak minus na desnoj strani relacije (51) znači da su vektori toplotnog toka i temperaturnog gradijenta usmjereni u suprotnim smjerovima.
Koeficijent proporcionalnosti λ u izrazu (51) je fizički parametar supstance, nazvan koeficijent toplotne provodljivosti. Karakterizira sposobnost tvari da provodi toplinu.
Dimenzija koeficijenta toplotne provodljivosti određuje se iz izraza (51):
Posljedično, vrijednost koeficijenta toplinske provodljivosti numerički je jednaka specifičnom protoku topline kroz zid jedinične debljine pri temperaturnoj razlici od 1 °C. Što je veći λ, to je tvar bolji provodnik topline.
Metali su dobri provodnici toplote; suvi, mirni vazduh je loš provodnik toplote. Lagani porozni materijali ne provode dobro toplinu, jer su im pore ispunjene zrakom. Materijali čija je toplotna provodljivost manja od 0,2 W/(m-deg) nazivaju se toplotnoizolacionim. Voda ima slabu toplotnu provodljivost, međutim, toplotna provodljivost mokrog materijala naglo raste u poređenju sa toplotnom provodljivošću u suvom stanju. To je zbog činjenice da voda provodi toplinu 20-25 puta bolje od zraka. Stoga, punjenje pora tijela vodom naglo smanjuje njegova svojstva toplinske izolacije.
Eksperimentalno se utvrđuje vrijednost koeficijenta toplinske provodljivosti λ za svako tijelo. Rezultati su sažeti u tabelama koje se koriste u proračunima.
Toplotna provodljivost zida
Ravni jednoslojni zidovi do a. Na slici 6 prikazan je ravan jednoslojni zid debljine δ od homogenog materijala (cigla, metal, drvo ili bilo koji drugi).
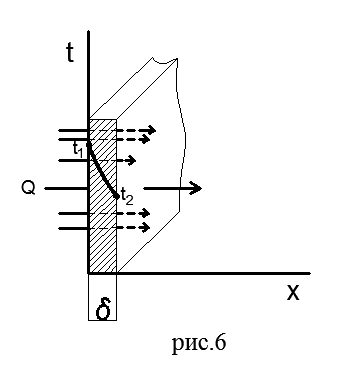 Pretpostavimo da koeficijent toplotne provodljivosti materijala λ ne zavisi od temperature. Na vanjskim površinama zida održavaju se stalne temperature t 1 >t 2; temperatura se mijenja samo u smjeru x ose, koja je okomita na ravan zida, tj. temperaturno polje je jednodimenzionalno, a temperaturni gradijent je jednak dt/dx.
Pretpostavimo da koeficijent toplotne provodljivosti materijala λ ne zavisi od temperature. Na vanjskim površinama zida održavaju se stalne temperature t 1 >t 2; temperatura se mijenja samo u smjeru x ose, koja je okomita na ravan zida, tj. temperaturno polje je jednodimenzionalno, a temperaturni gradijent je jednak dt/dx.
Nađimo gustinu toplotnog toka koji prolazi kroz dati zid i ustanovimo prirodu promjene temperature duž debljine zida.
Odaberimo unutar zida elementarni sloj debljine dx omeđen sa dvije izotermne površine. Fourierova jednadžba za ovaj sloj ima oblik
Nakon integracije
Iz ove jednačine se može odrediti gustina toplotnog toka koji prolazi kroz razmatrani zid. Stavljajući u jednačinu (53) x=δ, dobijamo t= t2, gdje
| | (54) |
Gustoća toplotnog toka u ravnom zidu direktno je proporcionalna koeficijentu toplotne provodljivosti λ, temperaturnoj razlici () i obrnuto proporcionalna debljini zida δ. Treba imati na umu da se protok toplote ne određuje apsolutnom vrednošću temperatura, već njihovom razlikom – temperaturnom razlikom.Jednačina (54) je formula za proračun toplotne provodljivosti ravnog zida. Povezuje četiri veličine q, λ, δ i :
Odnos debljine zida i koeficijenta toplotne provodljivosti δ/λ naziva se toplotni otpor zida.
Jednadžba (55) pokazuje da je specifični toplinski tok direktno proporcionalan temperaturnoj razlici i obrnuto proporcionalan toplinskom otporu zida. Zaista, što je veći nazivnik razlomka u jednačini (55), tj. δ/λ, to je niža gustina toplotnog toka q. Posljedično, s povećanjem debljine stijenke δ ili sa smanjenjem toplinske provodljivosti λ, gustina toplinskog toka q opada.
Odredivši gustinu toplotnog fluksa po formuli (54), možemo odrediti ukupnu količinu toplote Q u džulima koju je površina F prenijela kroz ravan zid za vrijeme τ:
Ova jednačina je jednačina prave linije. Dakle, pri konstantnoj vrijednosti koeficijenta toplinske provodljivosti, temperatura se linearno mijenja po debljini homogenog zida. U slučajevima kada toplinska provodljivost ovisi o temperaturi, ona je varijabla i formule za proračun su nešto složenije.
Ravni sendvič zid
U praksi veliki značaj ima proces prijenosa topline kroz ravan zid, koji se sastoji od nekoliko slojeva materijala različite toplinske provodljivosti. Tako je, na primjer, metalni zid parnog kotla, prekriven šljakom izvana, a kamenac iznutra, troslojni zid.
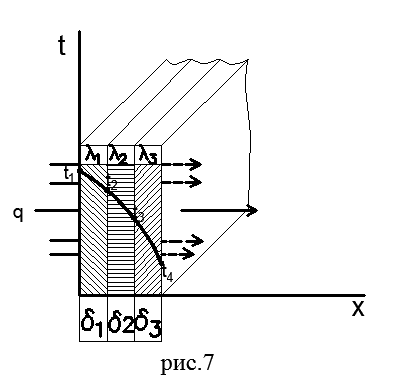 Razmotrimo proces prenosa toplote toplotnom provodljivošću kroz ravan troslojni zid (slika 7). Svi slojevi takvog zida tijesno su jedni uz druge. Debljine slojeva su označene δ 1, δ 2 i δ 3, a koeficijenti toplinske provodljivosti svakog materijala su λ 1, λ 2 i λ 3 respektivno. Poznate su i temperature vanjskih površina t l i t 4. Temperature t 2 i t 3 su nepoznate.
Razmotrimo proces prenosa toplote toplotnom provodljivošću kroz ravan troslojni zid (slika 7). Svi slojevi takvog zida tijesno su jedni uz druge. Debljine slojeva su označene δ 1, δ 2 i δ 3, a koeficijenti toplinske provodljivosti svakog materijala su λ 1, λ 2 i λ 3 respektivno. Poznate su i temperature vanjskih površina t l i t 4. Temperature t 2 i t 3 su nepoznate.
Proces prenosa toplote toplotnom provodljivošću kroz višeslojni zid razmatra se u stacionarnom režimu, stoga je specifični toplotni tok q koji prolazi kroz svaki sloj zida konstantne veličine i isti za sve slojeve, ali na svom putu savladava lokalni toplinski otpor δ/λ svakog sloja zida. Stoga, na osnovu formule (54) za svaki sloj možemo napisati:
Zbrajanjem lijevog i desnog dijela jednakosti (58) dobijamo ukupnu temperaturnu razliku koja se sastoji od zbira temperaturnih promjena u svakom sloju:
Iz jednačine (59) slijedi da je ukupni toplinski otpor višeslojnog zida jednak zbroju toplinskih otpora svakog sloja:
Koristeći formule (58) i (59), mogu se dobiti vrijednosti nepoznatih temperatura t2 i t3:
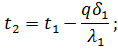
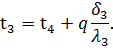 |
Raspodjela temperature u svakom sloju zida na λ-const podliježe linearnom zakonu, što se vidi iz jednakosti (58). Za višeslojni zid u cjelini, temperaturna kriva je isprekidana linija (na slici 7).
Formule dobivene za višeslojni zid mogu se koristiti pod uvjetom da postoji dobar toplinski kontakt između slojeva. Ako se između slojeva pojavi barem mali zračni jaz, tada će se toplinski otpor značajno povećati, jer je toplinska provodljivost zraka vrlo niska:
[λ B03D = 0,023 W/(m stepeni)].
Ako je prisustvo takvog sloja neizbježno, onda se u proračunima smatra jednim od slojeva višeslojnog zida.
konvektivni prenos toplote. Konvektivni prijenos topline je izmjena topline između čvrstog tijela i tekućine (ili plina), praćena i provođenjem topline i konvekcijom.
Fenomen toplotne provodljivosti u tečnosti, kao iu čvrstom telu, u potpunosti je određen svojstvima same tečnosti, posebno koeficijentom toplotne provodljivosti i temperaturnim gradijentom.
U konvekciji, prijenos topline je neraskidivo povezan s prijenosom fluida. To komplicira proces, jer prijenos tekućine ovisi o prirodi i prirodi nastanka njenog kretanja, fizička svojstva tečnosti, oblici i veličine površina čvrsto telo itd.
Razmotrimo slučaj tečnosti koja teče u blizini čvrstog zida, čija je temperatura niža (ili viša) od temperature zida. Izmjena toplote se odvija između tečnosti i zida. Prijenos topline sa zida na tekućinu (ili obrnuto) nazivat će se prijenosom topline. Newton je pokazao da je količina topline Q koju međusobno razmjenjuju u jedinici vremena zid koji ima temperaturu T st i tekućina koja ima temperaturu T W direktno proporcionalna temperaturnoj razlici T st - T W i površini kontakta S:
Q \u003d αS (T st - T bunar) (60)
gdje je α koeficijent prolaza topline, koji pokazuje koliko se toplina tečnost i zid razmjenjuju u toku jedne sekunde, ako je temperaturna razlika između njih 1 K, a površina koju tečnost ispere iznosi 1 m 2. U SI, jedinica koeficijenta prijenosa topline je W / (m 2 K). Koeficijent prolaza toplote α zavisi od mnogih faktora, a prvenstveno od prirode kretanja fluida.
Turbulentno i laminarno strujanje fluida odgovara različitoj prirodi prijenosa topline. Pri laminarnom kretanju toplota se širi u smjeru okomitom na kretanje čestica fluida, kao iu čvrstom tijelu, odnosno provođenjem toplote. Pošto je koeficijent toplotne provodljivosti tečnosti mali, toplota se tokom laminarnog strujanja distribuira u pravcu okomitom na tok, veoma slabo. Tokom turbulentnog kretanja, slojevi fluida (manje ili više zagrejani) se mešaju, a razmena toplote između fluida i zida u ovim uslovima je intenzivnija nego u laminarnom toku. U graničnom sloju tekućine (blizu zidova cijevi) toplina se prenosi samo vođenjem topline. Prema tome, granični sloj predstavlja veliki otpor protoku toplote i u njemu se javlja najveći gubitak temperaturne razlike.
Pored prirode kretanja, koeficijent prolaza toplote zavisi od svojstava tečnosti i čvrste materije, temperature tečnosti itd. Stoga je prilično teško teoretski odrediti koeficijent prolaza toplote. Na osnovu velike količine eksperimentalnog materijala pronađene su sljedeće vrijednosti koeficijenata prijenosa topline [u W/(m 2 K)] za različite slučajeve konvektivnog prijenosa topline:
U osnovi, konvektivni prijenos topline nastaje uz uzdužno prisilno strujanje tekućine, na primjer, prijenos topline između zidova cijevi i tekućine koja teče kroz nju; poprečni prinudni tok, na primjer, prijenos topline tijekom tečnog pranja poprečnog snopa cijevi; slobodno kretanje, na primjer, izmjena topline između tekućine i vertikalne površine koju pere; promijeniti stanje agregacije, na primjer, izmjena topline između površine i tekućine, uslijed čega tekućina ključa ili se njene pare kondenziraju.
Prenos toplote zračenja. Prijenos topline zračenja je proces prijenosa topline s jednog tijela na drugo u obliku energije zračenja. U toplotnoj tehnici na visokim temperaturama prenos toplote zračenjem je od najveće važnosti. Stoga moderne jedinice za toplinsku tehniku, dizajnirane za visoke temperature, maksimalno iskorištavaju ovu vrstu prijenosa topline.
![]() Svako tijelo čija se temperatura razlikuje od apsolutne nule zrači elektromagnetnim valovima. Njihova energija je u stanju da apsorbuje, reflektuje i prođe kroz sebe bilo koje drugo telo. Zauzvrat, ovo telo takođe zrači energiju, koja zajedno sa reflektovanom i prenošenom energijom pada na okolna tela (uključujući i prvo telo) i ponovo se apsorbuje, odbija od njih itd. Od svih elektromagnetnih zraka, infracrveno ima najveći toplotni efekat.i vidljive zrake talasne dužine 0,4-40 mikrona. Ove zrake se nazivaju toplotnim zracima.
Svako tijelo čija se temperatura razlikuje od apsolutne nule zrači elektromagnetnim valovima. Njihova energija je u stanju da apsorbuje, reflektuje i prođe kroz sebe bilo koje drugo telo. Zauzvrat, ovo telo takođe zrači energiju, koja zajedno sa reflektovanom i prenošenom energijom pada na okolna tela (uključujući i prvo telo) i ponovo se apsorbuje, odbija od njih itd. Od svih elektromagnetnih zraka, infracrveno ima najveći toplotni efekat.i vidljive zrake talasne dužine 0,4-40 mikrona. Ove zrake se nazivaju toplotnim zracima.
Kao rezultat apsorpcije i emisije energije zračenja od strane tijela, dolazi do izmjene topline između njih.
Količina topline koju tijelo apsorbira kao rezultat zračnog prijenosa topline jednaka je razlici između energije koja pada na njega i koju ono zrači. Takva razlika je različita od nule ako su temperature tijela koja učestvuju u međusobnoj razmjeni energije zračenja različite. Ako je temperatura tela ista, onda je ceo sistem u dinamičkoj toplotnoj ravnoteži. Ali čak i u ovom slučaju, tijela i dalje zrače i apsorbiraju energiju zračenja.
Energija koju emituje jedinična površina tijela u jedinici vremena naziva se njegova emisivnost. Jedinica emisivnosti je W/m a.
Ako Q 0 energija padne na telo u jedinici vremena (slika 8), Q R se reflektuje, Q D prolazi kroz njega, Q A se apsorbuje od njega, tada
| (61) |
gdje je Q A /Q 0 \u003d A apsorpcijski kapacitet tijela; Q R /Q o = R - refleksivnost tijela; Q D /Q 0 \u003d D je propusnost tijela.
Ako je A = 1, onda je R = D = 0, tj. sva upadna energija se potpuno apsorbira. U ovom slučaju se kaže da je tijelo potpuno crno. Ako je R = 1, tada je A=D = 0 i upadni ugao zraka jednak je kutu refleksije. U ovom slučaju, tijelo je apsolutno zrcalno, a ako je refleksija difuzna (ujednačena u svim smjerovima), ona je apsolutno bijela. Ako je D = 1, tada je A=R= 0 i tijelo je apsolutno prozirno. U prirodi ne postoje ni apsolutno crna, ni apsolutno bijela, ni apsolutno prozirna tijela. Prava tijela mogu se samo donekle približiti jednoj od ovih vrsta tijela.
Kapacitet apsorpcije različitih tijela je različit; Štaviše, isto tijelo različito apsorbira energiju razne dužine talasi. Međutim, postoje tijela za koja, u određenom rasponu valnih dužina, apsorpcija malo zavisi od valne dužine. Takva tijela se obično nazivaju sivim tijelima za dati opseg talasnih dužina. Praksa pokazuje da se u odnosu na opseg talasnih dužina koji se koriste u toplotnoj tehnici, mnoga tela mogu smatrati sivim.
Energija koju emituje jedinična površina crnog tijela u jedinici vremena proporcionalna je četvrtom stepenu apsolutna temperatura(Stefan-Boltzmann zakon):
E 0 \u003d σ "0 T A, gdje je σ" 0 konstanta zračenja potpuno crnog tijela:
σ "0 \u003d 5,67-10-8 W / (m 2 - K 4).
Ovaj zakon se često piše u formi
gdje je emisivnost potpuno crnog tijela; \u003d 5,67 W / (m 2 K 4).
Mnogi zakoni zračenja utvrđeni za crno tijelo su od velike važnosti za toplinsku tehniku. Dakle, šupljina peći kotlovskog postrojenja može se smatrati modelom potpuno crnog tijela (slika 9). U odnosu na takav model, zakoni zračenja crnog tijela su ispunjeni sa velikom preciznošću. Međutim, ove zakone treba koristiti s oprezom u odnosu na termičke instalacije. Na primjer, za sivo tijelo Stefan-Boltzmannov zakon ima oblik sličan formuli (62):
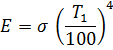 | (63) |
gdje se omjer / naziva stepenom emisivnosti ε (ε je veći, što se tijelo koje se razmatra više razlikuje od apsolutno crne boje, tabela 4).
Formula (63) se koristi za određivanje emisivnosti peći, površine sloja gorućeg goriva itd. Ista formula se koristi kada se uzme u obzir toplota koja se prenosi zračenjem u komori za sagorevanje, kao i elementima kotlovska jedinica.
Tijela koja ispunjavaju unutrašnjost peći kontinuirano zrače i apsorbiraju energiju. Međutim, sistem ovih tijela nije u stanju termičke ravnoteže, jer su njihove temperature različite: u savremenim kotlovima temperatura cijevi kroz koje prolaze voda i para je mnogo niža od temperature prostora peći i unutrašnjeg prostora. površine peći. U ovim uslovima, emisiona sposobnost cevi je mnogo manja
Tabela 4
emisivnost peći i njenih zidova. Stoga se izmjena topline zračenjem koje prolazi između njih provodi uglavnom u smjeru prijenosa energije iz peći na površinu cijevi.
Tokom razmjene topline zračenja između dvije paralelne površine sa stupnjevima emisivnosti ε 3 i ε 2 koje imaju temperature T 1 i T 2 , respektivno, količina energije koju razmjenjuju određuje se formulom
Ako su tijela između kojih se odvija radijativna izmjena topline ograničena površinama i S 1 i S 2 locirani jedno unutar drugog, tada se smanjeni koeficijent zračenja određuje formulom
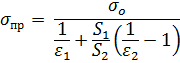 | (66) |
Prijenos topline
Izmjena topline između toplog i hladnog medija kroz razdvojni čvrsti zid jedan je od najvažnijih i najčešće korištenih procesa u inženjerstvu. Na primjer, dobivanje pare zadanih parametara u kotlovskim jedinicama temelji se na procesu prijenosa topline s jednog rashladnog sredstva na drugo. U brojnim uređajima za izmjenu topline koji se koriste u bilo kojoj industriji, glavni radni proces je proces izmjene topline između nosača topline. Ovaj prijenos topline naziva se prijenos topline.
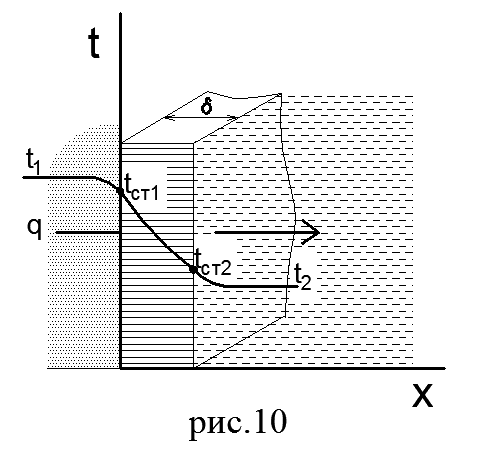
Na primjer, razmotrite jednoslojni zid (slika 10) čija je debljina jednaka δ. Koeficijent toplotne provodljivosti materijala zida jednak je λ. Temperature medija koji peru zid lijevo i desno su poznate i jednake su t 1 i t 2 . Prihvatamo da je t 1 >t 2 . Tada će temperature zidnih površina biti t st1 > /t st2. Potrebno je odrediti toplinski tok q koji prolazi kroz zid od grijaćeg medija do grijanog.
Budući da se razmatrani proces prijenosa topline odvija u stacionarnom režimu, toplina koju zidu daje prvi nosač topline (vrući) prenosi se kroz njega na drugi nosač topline (hladni). Koristeći formulu (54), možemo napisati:
Zbrajanjem ovih jednakosti dobijamo ukupnu temperaturnu razliku:
Imenitelj jednakosti (68) je zbir toplotnih otpora koji se sastoji od toplotnog otpora toplotne provodljivosti δ/λ i dva otpora toplotnog prenosa toplote l/α 1 i 1/α 2 .
Uvodimo notaciju
Vrijednost k se naziva koeficijent prolaska topline.
Recipročna vrijednost koeficijenta prijenosa topline naziva se ukupni toplinski otpor prijenosu topline:
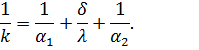 | (71) |
Teorija molekularne kinetike omogućava ne samo razumijevanje zašto supstanca može biti u plinovitom, tekućem i čvrstom stanju, već i objasniti proces prijelaza tvari iz jednog stanja u drugo.
Isparavanje i kondenzacija. Količina vode ili bilo koje druge tekućine u otvorenoj posudi postepeno se smanjuje. Dolazi do isparavanja tečnosti, čiji je mehanizam opisan u toku fizike VII razreda. Tokom haotičnog kretanja, neki molekuli dobijaju tako veliku kinetičku energiju da napuštaju tečnost, savladavajući sile privlačenja od ostalih molekula.
Istovremeno s isparavanjem, događa se i obrnuti proces - prijelaz dijela nasumično pokretnih molekula pare u tekućinu. Ovaj proces se naziva kondenzacija. Ako je posuda otvorena, onda se molekuli koji su napustili tekućinu možda neće vratiti
tečnost. U tim slučajevima, isparavanje se ne kompenzira kondenzacijom i količina tekućine se smanjuje. Kada protok vazduha preko posude odnese formirane pare, tečnost brže isparava, jer molekul pare ima manje mogućnosti da se ponovo vrati u tečnost.
Zasićena para. Ako je posuda s tekućinom čvrsto zatvorena, tada će se njen pad uskoro zaustaviti. Pri konstantnoj temperaturi, sistem "tečnost - para" će doći u stanje termičke ravnoteže i ostaće u njemu proizvoljno dugo vremena.
U prvom trenutku, nakon što se tečnost ulije u posudu i zatvori, ona će ispariti i gustina pare iznad tečnosti će se povećati. Međutim, u isto vrijeme će se povećati broj molekula koji se vraćaju u tekućinu. Što je veća gustina pare, veći je broj molekula pare vraćenih u tečnost. Kao rezultat toga, u zatvorenoj posudi na konstantnoj temperaturi, na kraju će se uspostaviti dinamička (pokretna) ravnoteža između tekućine i pare. Broj molekula koji napuštaju površinu tečnosti biće jednak broju molekula pare koji se vraćaju u tečnost u isto vreme. Istovremeno sa procesom isparavanja dolazi do kondenzacije, a oba procesa se u prosjeku međusobno kompenziraju.
Para u dinamičkoj ravnoteži sa svojom tekućinom naziva se zasićena para. Ovaj naziv naglašava da dati volumen pri datoj temperaturi ne može sadržavati više pare.
Ako se zrak iz posude s tekućinom prethodno ispumpa, tada će iznad površine tekućine biti samo zasićena para.
Pritisak zasićene pare.Šta će se dogoditi sa zasićenom parom ako se smanji zapremina koju zauzima, na primjer komprimiranjem pare u ravnoteži s tekućinom u cilindru ispod klipa, održavajući temperaturu sadržaja cilindra konstantnom?
Kada se para komprimuje, ravnoteža će početi da se narušava. U prvom trenutku, gustoća pare se malo povećava i više molekula počinje prelaziti iz plina u tekućinu nego iz tekućine u plin. To se nastavlja sve dok se ponovo ne uspostave ravnoteža i gustoća, pa stoga koncentracija molekula ne poprima istu vrijednost. Koncentracija molekula zasićene pare je stoga nezavisna od zapremine pri konstantnoj temperaturi.
Pošto je pritisak proporcionalan koncentraciji u skladu sa formulom, onda iz nezavisnosti koncentracije (ili gustine) zasićene pare od zapremine sledi nezavisnost pritiska zasićene pare od zapremine koju zauzima.
Pritisak pare neovisan o zapremini pri kojem je tečnost u ravnoteži sa svojom parom naziva se pritisak pare zasićenja.
Kada se zasićena para komprimuje, sve više i više prelazi u tečno stanje. Tečnost određene mase zauzima manji volumen od para iste mase. Kao rezultat, volumen pare pri konstantnoj gustoći se smanjuje.
Reči "gas" i "para" koristili smo mnogo puta. Ne postoji fundamentalna razlika između plina i pare, a ove riječi su općenito ekvivalentne. Ali navikli smo na određeni, relativno mali temperaturni raspon okruženje. Riječ "gas" se obično primjenjuje na one tvari čiji je tlak pare zasićenja na uobičajenim temperaturama iznad atmosferskog (na primjer, ugljični dioksid). Naprotiv, govore o pari kada je, na sobnoj temperaturi, pritisak zasićene pare manji od atmosferskog pritiska i supstanca je stabilnija u tekućem stanju (na primer, vodena para).
Nezavisnost pritiska zasićene pare od zapremine utvrđena je brojnim eksperimentima na izotermnoj kompresiji pare u ravnoteži sa svojom tečnošću. Neka supstanca u velikim količinama bude unutra gasovitom stanju. Kako se izotermna kompresija povećava, povećava se njena gustoća i pritisak (presjek izoterme AB na slici 51). Kada se postigne pritisak, para počinje da se kondenzuje. Dalje, kada se zasićena para komprimuje, pritisak se ne menja sve dok se sva para ne pretvori u tečnost (prava linija BC na slici 51). Nakon toga, pritisak tokom kompresije počinje naglo rasti (segment krivulje, jer su tekućine malo kompresibilne.
Kriva prikazana na slici 51 naziva se izoterma realnog gasa.






