Atomdaki enerji geçişleri
el yazması olarak
Fizik
Ders Notları
(Bölüm 7. atom fiziği. lazerler)
Yön 230400 öğrencileri için
« Bilgi sistemi ve teknolojileri"
Elektronik eğitim kaynağı
Derleyen: Fizik ve Matematik Bilimleri Adayı, Doçent V.V. Konovalenko
04.09.2013 Tarihli 1 Sayılı Tutanak
atom fiziği
Hidrojen atomu.
Hatırlamak Sabit bir çekirdek ve onun etrafında hareket eden bir elektrondan oluşan sisteme hidrojen benzeri atom veya hidrojen benzeri iyon denir.
Elektronun hareket ettiği alan merkezi simetriktir. Bu nedenle, bu durumda Schrödingenr denklemi çözülürken küresel bir koordinat sistemi kullanılır: Yüklü bir çekirdeğin merkezi alanındaki bir elektron için Schrödingenr denklemi şu şekildedir:
 (35.1)
(35.1)
Laplace operatörünü küresel koordinatlarda bu denklemde yerine koyarsak, şunu elde ederiz:
Çözümler (35.2) tatmin edici standart koşullar, herhangi bir pozitif için elde edilir E ve ayrık negatif değerler için:
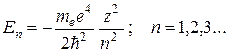 (35.3)
(35.3)
Pozitif enerji değerleri, çekirdeğe yakın uçan ve sonsuza giden bir elektrona karşılık gelir. Böyle bir elektron çekirdeğe bağlı değildir, bir atom (veya iyon) oluşturmaz ve ilgi çekici değildir.
Çekirdeğe bağlı bir elektron, negatif enerji değerlerine (35.3) karşılık gelir. Bu değerlerin Bohr teorisinde elde edilen değerlere karşılık geldiği vurgulanmalıdır, ancak Kuantum mekaniği bunlar Schrödinger denkleminin bir sonucudur ve postülalar şeklinde ek varsayımlar gerekli değildir.
Schrödinger denkleminin özfonksiyonları üç tamsayı parametresi içerir: n,l,m:
![]()
n- denir Ana kuantum sayısı ve (35.3)'teki enerji seviyesi sayısı ile örtüşür.
ben ve m – azimut ve manyetik kuantum sayıları Modülü ve açısal momentumun belirli bir yönde izdüşümünü belirleyen .
Yalnızca değerler için standart koşulları sağlayan çözümler elde edilir. ben aşırı değil . Bu nedenle, belirli bir n, azimut kuantum sayısı benönemli olabilir
![]() (35.4)
(35.4)
verilen için ben manyetik kuantum sayısı m farklı değerler alabilir:
(35.5)
Bir hidrojen atomundaki bir elektronun elektron enerjisi sadece n ana kuantum sayısı(bkz. (35.3)), bu nedenle, her bir enerji seviyesi, değerlerde farklılık gösteren birkaç özfonksiyona karşılık gelir. ben ve m. Böylece, bir hidrojen atomu aynı enerjiye sahip olabilir, farklı dalga fonksiyonları tarafından tanımlanan durumlarda bulunur. Bu durumda enerji durumları denir dejenere , ve belirli bir enerjiye karşılık gelen farklı durumların sayısı karşılık gelen enerji seviyesinin dejenerasyonunun çokluğu.
yozlaşma çokluğu enerji seviyeleri hidrojenin hesaplanması kolaydır. Her biri n sayı değerleri ben 2'ye karşılık gelir ben+ 1 değer m. Böylece, dejenerasyon çokluğu aşağıdaki formülle hesaplanabilir:
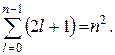
Azimut kuantum sayısının açısal momentumun değerini ve azimut kuantum sayısının farklı değerlerine sahip bir hidrojen atomundaki bir elektronun durumlarını belirlediğini hatırlayın. ben açısal momentumun büyüklüğünde farklılık gösterir. bir durumda bir elektron
ben= 0 – aranans -elektron ( sşart);
ben= 1 - aradıp -elektron (p durumu)
ben= 2- denird -elektron (d durumu)
ben= 3 - aradıf -elektron (f durumu), vb.
Elektronun bulunduğu durumu belirlerken, ana kuantum sayısının değeri alınır. n kuantum sayısının sembolünden önce belirtin ben. Bu nedenle, bir elektron n= 3 ben = 1 sembolleri 3 ile gösterilir p.
Çünkü ben< n aşağıdaki durumlar mümkündür:
2s 2p
3s 3p 3d
4s 4p 4d 4f vb.
Bohr'un teorisinde olduğu gibi, kuantum mekaniği, bir elektron bir seviyeden diğerine hareket ettiğinde ışığın yayıldığını ve emildiğini varsayar. Ancak fotonun sahip olduğu kendi açısal momentumu yaklaşık olarak eşittir Bu nedenle, bir foton yayıldığında veya soğurulduğunda, bir atomun açısal momentumu şu şekilde değişmelidir: seçim kuralı azimut kuantum sayısı için:
Açıkçası, bu kural açısal momentumun korunumu yasasının bir sonucudur.
Hidrojen atomunun enerji seviyelerinin diyagramı.
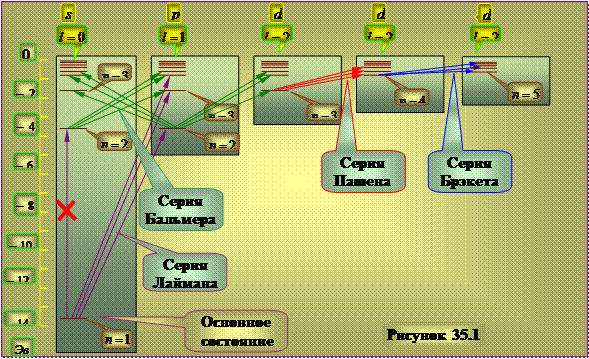 |
Seçim kuralı etkisi(35.6), enerji seviyeleri arasındaki tüm geçişlerin gerçekte gerçekleştirilemeyeceği gerçeğine yol açar. Örneğin durum 2'den geçiş günah 1s seçim kuralıyla çeliştiği için olamaz. Bu bağlamda, bir hidrojen atomundaki bir elektronun enerji seviyelerinin şeması, Şekil 35.1'de gösterildiği gibi temsil edilebilir.
1s durumu, hidrojen atomunun temel durumudur. hidrojen atomunun en düşük enerjiye sahip olduğu yer. Bir atom tarafından emildiğinde, bir foton tamamen yok olur ve bölünemez olduğu için enerjisini atoma aktarır. Absorpsiyon atomu genellikle temel haldedir, bu nedenle bir hidrojen atomunun absorpsiyon spektrumu geçişlere karşılık gelen çizgilerden oluşmalıdır 1 s-np, deneysel sonuçlarla tam bir uyum içindedir.
Hidrojen atomunda elektron
Hidrojen atomu için Schrödinger denkleminin özfonksiyonları, biri yalnızca r, ve diğeri köşelerden J ve j.
Çarpan gerçek, - hayali. Fonksiyon, açısal momentum kare operatörünün bir özfonksiyonudur. İçin s-bir elektronun durumları (yani, sıfıra eşit bir açısal momentum ile), bu fonksiyon bir sabittir ve -formun fonksiyonları sadece r.
hacim öğesi dV küresel koordinat sistemi şu şekilde temsil edilebilir:
![]()
nerede d W = katı açının elemanıdır.
olasılık dP bir elementte elektron bulma dV
(35.7)'nin katı açısı 4 üzerinden integralini almak p, ince küresel bir yarıçap katmanında bir elektron bulma olasılığını buluyoruz r ve kalınlık doktor:.
![]() (35.9)
(35.9)
Y'nin normalize edildiği varsayıldığından, (35.9)'daki integral bire eşittir ve
![]() (35.10)
(35.10)
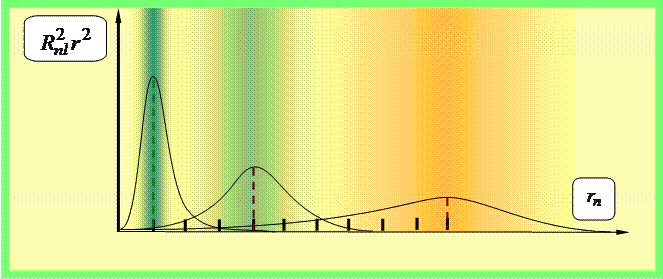
(35.9)'dan şu sonuç çıkar: çekirdekten r uzaklıkta bir elektron bulmanın olasılık yoğunluğu ,
Uzun dikey çizgiler, karşılık gelen Bohr yörüngelerinin yarıçaplarını gösterir.
Şekil 35.1
spektrum alkali metaller
Bu spektrumlar, hidrojen atomunun emisyon spektrumuna benzer, ancak yalnızca niteliksel olarak. Birkaç dizi çizgi gözlemlenir ve bunların en yoğun olanı deneysel olarak gözlemlenen özelliklere göre adlandırılır:
keskin(keskin) - Bu dizinin çizgileri çok net ve dar görünüyordu.
ev(ana) - bu serinin çizgileri, atomların temel duruma geçişine karşılık geldiklerini gösteren absorpsiyon ve emisyon spektrumlarında da gözlendi;
bulanık(yaygın) - bu dizinin çizgileri bulanık, bulanık görünüyordu;
ana(temel) - bu dizinin çizgileri, hidrojen atomunun bir dizi çizgisine benziyordu.
düşünüldüğü tespit edildi çizgi dizisi, dış (valans) veya optik elektronun geçişleriyle ilişkilidir. .
Belirtilen çizgilerin emisyonuna karşılık gelen enerji seviyeleri sistemi sodyum atomu için yaklaşık olarak şekil 35.3'te gösterilen forma sahiptir.
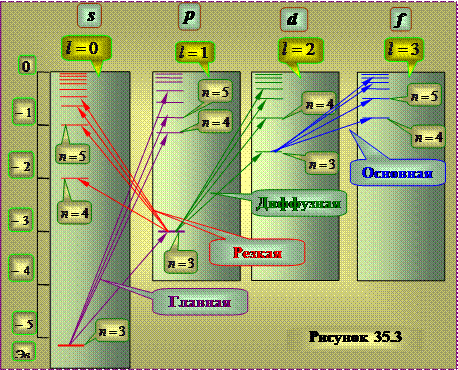 Hidrojen atomunun aksine, durumun enerjisinin sadece n kuantum sayısının değerine değil, aynı zamanda terim dizilerinin sayısına da bağlı olduğu ortaya çıkıyor.
Hidrojen atomunda olduğu gibi terim dizisi, azimut kuantum sayısının farklı değerlerine karşılık gelir. ben.
Hidrojen atomunun aksine, durumun enerjisinin sadece n kuantum sayısının değerine değil, aynı zamanda terim dizilerinin sayısına da bağlı olduğu ortaya çıkıyor.
Hidrojen atomunda olduğu gibi terim dizisi, azimut kuantum sayısının farklı değerlerine karşılık gelir. ben.
Bu sonuçlar, kuantum mekaniksel hesaplamaların sonuçlarına - hareket eden bir elektron için Schrödinger denkleminin çözümüne - karşılık gelir. merkezi simetrik olmayan Coulomb alan. Alkali metal atomlarındaki çekirdeğin alanı, atomların iç elektron kabuklarının elektronları tarafından kısmen taranır. Bu durumda, alan küresel simetriyi korur, ancak Coulomb yasasından farklı bir yasaya göre çekirdeğe olan mesafeden değişir. Böyle bir alanda, bir elektronun enerjisinin kuantum sayısına bağlı olduğu ortaya çıkar: dejenerasyon kaldırıldı azimut kuantum sayısı . Yine de, Temel olarak, enerji şunlara bağlıdır: Ana kuantum sayısı n.
Bunu belirledi optik elektronun çıkarılmasından sonra alkali atomların atomik tortusunun açısal momentumu sıfırdır . Bu nedenle, azimut kuantum sayısı Ortaya çıkan açısal momentumun L atom ile çakışır azimut kuantum sayısı değerlik elektron. Bir atom uyarıldığında (yani, minimum enerjili bir durumdan daha yüksek enerjili bir duruma bazı eylemlerle aktarıldığında) ve ışık yaydığında sadece durum değişir değerlik elektronu , bu nedenle, bir atomun seviyelerinin şeması, bir değerlik elektronunun denkleminin şemasıyla aynıdır.
Seviye sütunlarına karşılık gelen terimler, enerji seviyesi diyagramında sembollerle gösterilebilir. nS, nP, nD ve nF. Daha sonra frekanslar spektral çizgiler, son ve ilk durumların terimleri arasındaki farka eşit, aşağıdaki biçimde temsil edilebilir: uyarılmış durumlar kesinlikle durağan kabul edilemez. Zaman ve enerjinin kanonik olarak eşlenik büyüklükler olması nedeniyle, belirsizlik ilişkisi enerji seviyelerinin sonlu genişliğini Г belirler:
Yalnızca temel durum kendiliğinden geçişlere izin vermez ve enerjisi kesin olarak tanımlanmış bir değere sahiptir.
Sonlu Г ile uyumlu olarak, yayılan fotonların frekans aralığı
İçin görülebilir ışık karşılık gelen ![]() BT sözde doğal çizgi genişliği
.
BT sözde doğal çizgi genişliği
.
Atomların termal hareketi, spektral çizgilerin Doppler genişlemesine yol açar. Bu durumda, bir sıcaklıkta dalga boyuna sahip radyasyon için T\u003d 1000 K, değer elde edildi ![]() , spektral çizgilerin doğal genişliğinden birçok kez daha büyüktür.
, spektral çizgilerin doğal genişliğinden birçok kez daha büyüktür.
(6)'dan aşağıdaki gibi hidrojen atomunun enerjisi sadece ana kuantum sayısı ile belirlenir. n. en düşük enerji seviyesi E 1 , karşılık gelen n \u003d 1, bir atomun mümkün olan minimum enerjisine karşılık gelir ve ana enerji olarak adlandırılır. Diğer tüm enerji seviyeleri E n (E n > E 1 , n= 2,3,..) uyarılmış olarak adlandırılır. U(r) potansiyel enerjisinin çekirdeğe olan uzaklığına bağımlılığının bir grafiği ile hidrojen atomunun enerji seviyelerinin diyagramı, Şek. 2. Negatif enerji değerleri için (E<0) движение электрона является связанным. По мере роста главного квантового числа n уровни располагаются теснее и при n→ ∞ E ∞ =0.
Pozitif enerji değerleri için, bir elektronun hareketi serbesttir, sürekli spektrum bölgesi E> 0 (Şekil 2'de gölgeli) iyonize bir atoma karşılık gelir. Hidrojen atomunun iyonlaşma enerjisi

Hidrojen atomunun enerji seviyelerinin şeması (Şekil 2a) ve geçişler
aralarında (Şekil 2b). [E] - eV.
Enerji ayar noktası, hariç E 1 , kuantum sayılarının değerlerinde farklılık gösteren atomun birkaç farklı durumuna karşılık gelir ben ve m. Koşullu olarak değerler ben= 0, 1, 2,… Latin harfleriyle gösterilir s, p, d, f,… Ana kuantum sayısının değeri, yörünge kuantum sayısının belirtilmesinden önceki bir sayı ile gösterilir. Örneğin, durumdaki elektronlar n= 1 ve ben= 0, durumda 1s ile gösterilir n= 2 ve ben\u003d 0, 1 - sırasıyla 2s ve 2p; İle birlikte n=3 - 3s, 3p, 3d, vb.
Kuantum sayılarının farklı değerlerini hesaba katmak n ve ben genel olarak kabul edilen, şekil l'de gösterilen enerji seviyelerinin görüntüsünün diyagramıdır. 3.

Hidrojen atomunun enerji seviyelerinin şeması ve yörünge kuantum sayısını dikkate alarak aralarındaki geçişler ben.
Bir atom tarafından ışığın emisyonu ve absorpsiyonu, bir elektron bir enerji seviyesinden diğerine geçtiğinde meydana gelir ve yayılan (absorbe edilen) kuantumun enerjisi şuna eşittir:
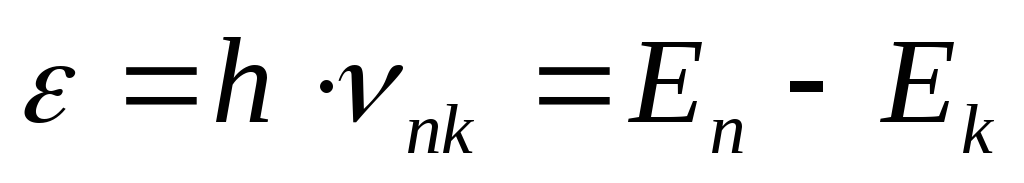 (18) nerede n,
k
sırasıyla enerji seviyelerinin (durumların) sayılarıdır, ν, geçişin elektromanyetik radyasyonunun frekansıdır n→
k.
Işığın emisyonu (soğurulması) sürecinde, yalnızca yörünge ve manyetik kuantum sayılarındaki değişikliklerin koşullar tarafından belirlendiği bu tür geçişler meydana gelebilir:
(18) nerede n,
k
sırasıyla enerji seviyelerinin (durumların) sayılarıdır, ν, geçişin elektromanyetik radyasyonunun frekansıdır n→
k.
Işığın emisyonu (soğurulması) sürecinde, yalnızca yörünge ve manyetik kuantum sayılarındaki değişikliklerin koşullar tarafından belirlendiği bu tür geçişler meydana gelebilir:
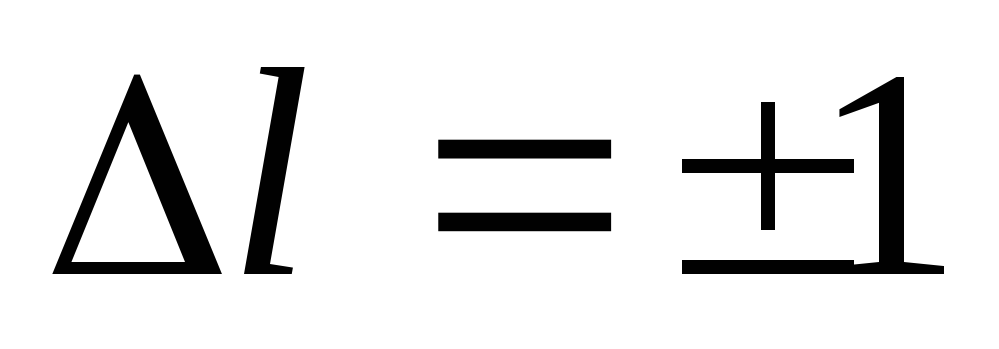 (19)
(19)
 (20)
(20)
(19) ve (20) formüllerine, bir atomdaki olası elektron geçişlerinin sayısını sınırlayan seçim kuralları denir.
(6) dikkate alındığında, hidrojen atomunun (Z = 1) durağan durumdan geçişi sırasındaki radyasyon frekansı n kararlı bir duruma k daha az enerji ile:
 (21)
(21)
Neresi k, n-tüm sayılar; k < n.
Çünkü  , daha sonra formül (21) karşılık gelen geçişlerin dalga boylarını belirleyerek şu şekli alır:
, daha sonra formül (21) karşılık gelen geçişlerin dalga boylarını belirleyerek şu şekli alır:
 (22)
(22)
Burada R, Rydberg sabiti eşittir
 (23)
(23)
(21) ve (22) ifadelerinden, verilen için k ve değişen değerler n (n >k) spektral çizgiler gruplar veya seriler oluşturur. Hidrojen atomunun emisyon spektrumunda, (22)'den aşağıdaki gibi, dalga boyları formüllerle bulunan aşağıdaki seriler ayırt edilir:
Lyman serisi (spektrumun ultraviyole bölgesi):
 , nerede n=2,3,4,…
(24)
, nerede n=2,3,4,…
(24)
 (24a)
(24a)
Balmer serisi (görünür spektrum):
 , nerede n=
3,4,5,…
(25)
, nerede n=
3,4,5,…
(25)
Paschen serisi (kızılötesi spektrum):
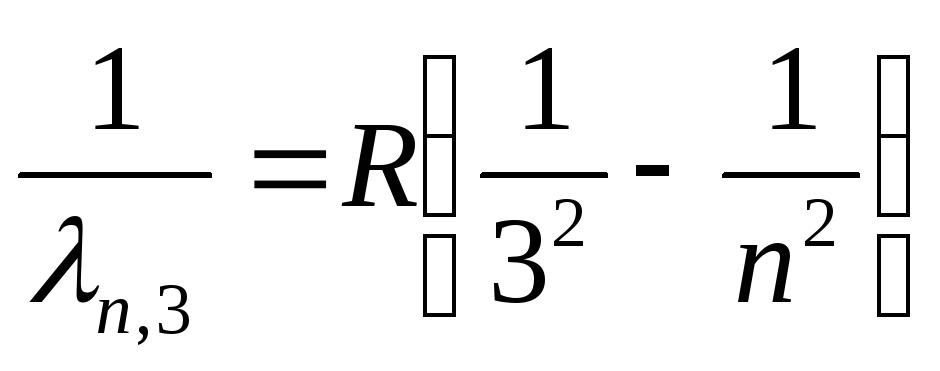 , nerede n=
4,5,6,…
(26)
, nerede n=
4,5,6,…
(26)
Braket Serisi (Uzak Kızılötesi):
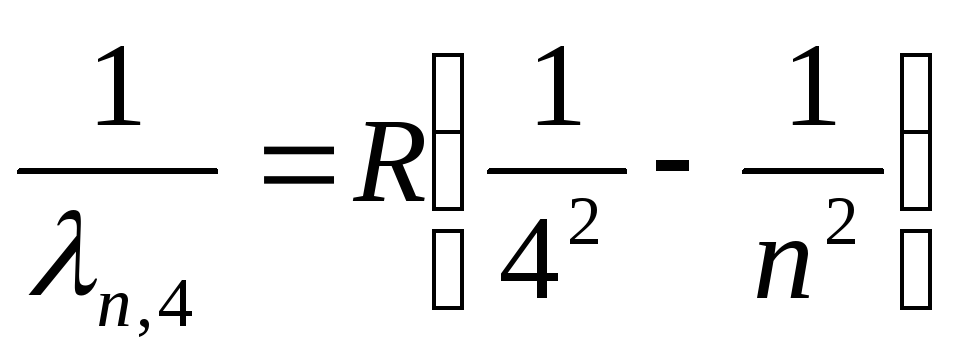 , nerede n=5,6,7,…
(27)
, nerede n=5,6,7,…
(27)
Seçim kurallarına (19) göre formüller (24a)-(27a), hidrojen atomundaki indirgenmiş serilerin spektral çizgilerinin yayıldığı geçiş sırasında elektronun durumlarını belirler. Lyman ve Balmer serileri için Şekil 2'de gösterilmiştir. 3 tamamen.
Hidrojen atomunun spektral çizgilerinin dalga boylarını (frekanslarını) hesaplamak için kuantum mekaniğinde teorik olarak elde edilen (21)-(22) formüllerinin, daha önce ampirik olarak genelleştirme yoluyla elde edilen genelleştirilmiş Balmer formülü (1) ile örtüştüğüne dikkat edilmelidir. deneysel veri.
hidrojen atomu
Hidrojen atomu
hidrojen atomu- pozitif yüklü bir çekirdek - bir proton ve negatif yüklü bir elektrondan oluşan bağlı bir sistem.
Bir atomun boyutu, boyutuna göre belirlenir elektron kabuğu≈ 10 -8 cm.
Bir elektronun bağlı durumlarının enerjileri, Schrödinger denkleminin V(r) = -e 2 /r potansiyeli ile çözülmesiyle elde edilir ve bağıntı ile belirlenir.
burada n, bir hidrojen atomundaki bir elektronun çeşitli durumlarının enerjilerini belirleyen ana kuantum sayısıdır (n = 1, 2, 3…), R, Rydberg sabitidir
(R = 1.0974 10 5 cm -1).
Ana kuantum sayısı n olan her seviye, kuantum sayıları l = 0, 1, 2, ..., (n-1) bakımından farklılık gösteren n duruma karşılık gelir. Enerji seviyelerindeki böyle bir yozlaşma sadece Coulomb alanı için tipiktir. Ek olarak, bu l-dejenere durumların her biri, manyetik sayıda (2l + 1)-kat dejeneredir.
m = ±l, ±(l-1),...±1, 0. Böylece durağanlığın dejenerasyonunun toplam çokluğu kuantum hali asal kuantum sayısı n ile verilir.
Bu düşünce, elektronun spininin sıfır olması koşuluyla geçerlidir. Elektronun spini s = 1/2 olduğundan, elektronun toplam açısal momentumu şu şekilde belirlenecektir: vektör toplamı yörünge ve dönüş anları
=
+
.
Bir elektronun dönüşü s = 1/2 olduğundan, toplam açısal momentumu J yalnızca yarı tamsayı olabilir.
Belirli bir yörünge momentumu l değeri için, hidrojen atomunda toplam momentum = + = l + 1/2 değerlerinde farklılık gösteren iki durum mümkündür ve
j = l - s = l - 1/2. Bu iki değer, yörünge ve spin vektörlerinin karşılıklı yönelimlerinde farklılık gösterir. Bir protonun Coulomb alanındaki l + 1/2 ve l - 1/2 durumlarındaki bir elektronun enerjileri biraz farklıdır ve durumların enerjisindeki dejenerasyon kaldırılır. Bu ek etkileşime spin-yörünge etkileşimi denir. Dejenerasyonun ortadan kaldırılması dikkate alındığında, hidrojen atomunun düşük seviyeli durumlarının spektrumu zenginleşir ve enerji seviyelerinde ince bir bölünme meydana gelir. Spin-yörünge bölünmesini hesaba katmadan iki düşük hidrojen seviyesi yerine (ana 1'ler ve ilk uyarılmış 2s2p (Şekil 1, a)) dönüş yörüngesi bölünmesine izin vererek, bunlardan dördü vardır (Şekil 1). 1, b). Bu seviyelerin kuantum özellikleri tabloda verilmiştir. j = l + 1/2 değeri büyük olan seviye, enerji olarak j = l - 1/2 olan seviyeden daha yüksek yer almaktadır. Farklı l değerlerine sahip ancak aynı nj değerine sahip durumlar hala dejeneredir. Örneğin, 2s 1/2 ve 2p 1/2 .
En düşük seviyedeki bir elektronun kuantum özellikleri
hidrojen atomunun halleri
| n | ben | s | j = l ± s | seviye tanımı |
| 1 | 0 | 1/2 | 1/2 | 1s 1/2 |
| 2 | 0 1 |
1/2 1/2 |
1/2 1/2, 3/2 |
2s 1/2 2p 1/2, 2p 3/2 |
| 3 | 0 1 2 |
1/2 1/2 1/2 |
1/2 1/2, 3/2 3/2, 5/2 |
3s 1/2 3p 1/2 , 3p 3/2 3 boyutlu 1/2 , 3 boyutlu 3/2 |
Kesin çözümden göreceli denklem Spin s = 1/2 olan bir elektron için Dirac, hidrojen atomunun seviyelerinin enerjisinin n ve j kuantum sayılarına bağımlılığını takip eder.
 ,
,
burada α = 1/137 ince yapı sabitidir. E nj'deki düzeltme kuantum sayısı l'ye bağlı değildir. Bu nedenle, aynı j ve farklı l'ye sahip durumların enerjileri eşit olmalıdır. Belirli bir n için δE j+1,j düzeylerinin hassas bölünmesi, bağıntı ile belirlenir.
Seviyenin n = 2 ile bölünmesi ≈ 4.5·10 -5 eV'dir.
Hidrojen atomunun çekirdeği - proton - ayrıca kendi momentine sahiptir - spin s = 1/2. Bu aynı zamanda elektronun proton ile etkileşimini de biraz değiştirir, çünkü protonun spininin varlığından kaynaklanan manyetik momentinin ek bir etkileşimi vardır. manyetik alan elektron. Bu etkileşimin büyüklüğü, protonun spin momentinin ve elektronun toplam momentinin karşılıklı yönelimine bağlıdır. Böylece, değeri ince bölünmeden çok daha küçük olduğu için, aşırı ince olarak adlandırılan başka bir atomik seviye bölünmesi türü ortaya çıkar. Temel durum için zaten aşırı ince bölme gözlemlenecek
(n = 1, l = 0). Hidrojenin temel durumunun aşırı ince bölünmesinin iki alt seviyesi arasındaki geçiş, dalga boyu λ = 21 cm olan radyasyona yol açar (radyasyon frekansı 1420 MHz). Bu radyasyonun yardımıyla, Evrendeki yıldızlararası hidrojen genellikle kaydedilir.
n = 2'den n = ∞'ye kadar olan durumlar uyarılmış durumlar olarak adlandırılır. Uyarma enerjisi E ex (ilk n i durumundan n f son durumuna geçmesi için sisteme bildirilmesi gereken enerji) ilişkiden belirlenir.

n = 1'den n = ∞'ye kadar olan tüm durumlar, negatif enerjileri olduğu için bağlı durumlardır. n sonsuza yaklaştıkça, durumların enerjileri birbirine yaklaşır ve komşu devletlerin enerjilerindeki fark o kadar küçük olur ki bölünmüş seviyeler birleşir ve seviyelerin ayrık spektrumu sürekli (sürekli) bir hale dönüşür. Bir elektronun enerjisi pozitif olduğunda (E > 0) sistem serbest hale gelir ve elektron serbest hale gelir. Serbest elektronun enerji spektrumu süreklidir.
n = 2, 3, … ∞ durumlarından n = 1 durumuna geçişler Lyman serisini oluşturur. n = 3, 4, … ∞ durumundan n = 2 durumuna geçişler Balmer serileridir. Negatif enerjili durumlar arası geçişler (E< 0) приводят
к образованию дискретного спектра переходов, в то время как переходы между
состояниями с E >0 ve E ile belirtir< 0 дают непрерывный спектр переходов.
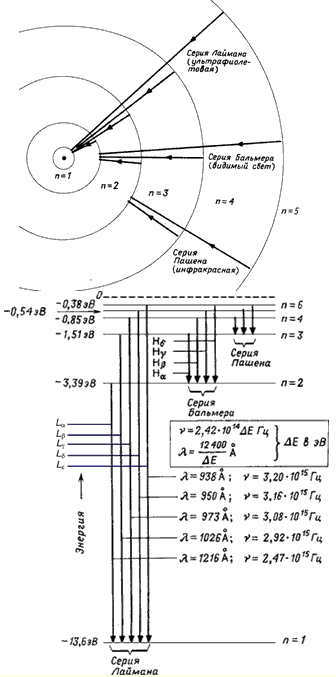
Pirinç. 2. Hidrojen atomunun seviyelerinin şeması.
Dirac denkleminin tam çözümüne göre, kuantum sayısı n = 1, 2, 3,... ile aynı değere ve toplam momentumun aynı değerine sahip enerji seviyeleri
j = 1/2, 3/2,... kuantum sayısı l'nin değerinden bağımsız olarak enerjide eşleşmelidir. 1947'de W. Lamb ve R. Riserford, hidrojen atomundaki 2s 1/2 ve 2p 1/2 seviyelerinde bir kayma keşfettiler. Bu seviye kayması denir kuzu vardiyası
. Kuzu kaymasının ana nedeni ışınımsal düzeltmelerden kaynaklanmaktadır:
- Bağlı bir elektron tarafından sanal fotonların emisyonu.
- Vakum polarizasyonu - vakumda elektron-pozitron çiftlerinin doğuşu.
Bu iki düzeltme, 2s 1/2 ve 2p 1/2 seviyelerinin (ΔE = 4.5·10 -6 eV) gözlemlenen Kuzu kaymasını tam olarak açıklamaktadır.
Uzayda belirli bir noktada dV hacmindeki bir elektronu bulma olasılığı dw şu şekilde verilir:
dw = |ψ(x, y, z)|2 dV = |R nl (r)Y lm (θ,φ)| 2 r 2 sinθdθdφdr =
= |R nl (r)| 2 r 2 |Y lm (θ,φ)| 2 sinθdθdφdr,
radyal olasılığa ayrışır ||R nl (r)| 2 oda 2 | 2 r 2 dr ve açısal - |Y lm (θ,φ)| 2 dΩ. Bu olasılıkların dağılımları Şekil 2'de verilmiştir. 3-5.
Belirli bir elementin atomlarının daha düşük enerji seviyeleri şemasının şekilde gösterilen forma sahip olduğunu ve atomların enerjili bir durumda olduğunu varsayalım.Bu tür durgun atomlardan biriyle çarpışan bir elektron, aşağıdaki gibi bir miktar ek enerji aldı. çarpışmanın bir sonucudur. Atomla çarpışmadan sonra elektronun momentumunun eşit olduğu ortaya çıktı Çarpışmadan önce elektronun kinetik enerjisini belirleyin. Bir elektronla çarpışmada bir atomun ışık yayma olasılığı ihmal edilir. Geri tepme etkisini görmezden gelin.
Çözüm.
p elektron, kinetik enerjisiyle bağıntı yoluyla veya nerede m elektronun kütlesidir.
Sonuç olarak,
Misafir 18.05.2012 17:00
Lütfen elektronun neden E(0) durumuna geçtiğini ve neden bu enerjiyi (3,5 eV) elektronun enerjisine eklediğimizi açıklayın?
Misafir
Tünaydın!
Bohr'un varsayımlarına göre, bir atom yalnızca kesin olarak tanımlanmış durumlarda var olabilir. Bir atom ve bir elektron çarpıştığında, enerjinin korunumu yasası yerine getirilmiş olur. Duruma göre elektronun enerjisi arttı, yani atomun enerjisinin azalması gerekiyordu. Atom birinci enerji seviyesinde olduğu için enerjisini azaltmanın tek yolu sıfır seviyesine gitmektir. Bu durumda enerjisi azalır Koşullara göre radyasyon olasılığı ihmal edilebileceğinden ve çekirdeğin geri tepmesinin kinetik enerjisinin değeri küçüklüğü nedeniyle ihmal edilebileceğinden, tüm bu enerjinin olduğu sonucuna varıyoruz. elektrona aktarılır.
canlı 22.03.2016 07:54
Merhaba!
Fizikte 3045 numaralı problemde birkaç soru var:
1) Sistemin dolaylı olarak 2 elektrona atıfta bulunduğunu doğru anlıyor muyum? Biri çekirdeğin merkezi kuvvetleri alanındadır. İkincisi - atomun yanından uçan ve şartlı olarak çekirdekle asla etkileşime girmeyen, ancak "atomik" elektronla - sadece momentum aktarımı anında mı?
2) İlk sorunun cevabı "evet" ise, o zaman "atomun enerji seviyeleri" şeması - bunlar bağlı, "atomik" elektronun izin verilen enerji seviyeleri midir?
3) Gelen elektronun E seviyesinde (sonsuz) veya daha yüksek olduğu doğru mu?
4) E-posta ile etkileşime giren geçen bir elektron. atomda yakalanmadı mı? Daha da fazla enerjiyle uçup gidiyor mu?
5) Geçen bir elektronun (kinetik vb.) atoma yaklaştığı andaki enerjisine ne tür bir enerji atfedilebilir?
Bu soruları cevapladıktan sonra problemde bir hata olup olmadığına karar verebileceğim. Buraya yazdığım için üzgünüm, Çin'de VK'ya erişimle ilgili sorunlar var.
Anton
1) Hayır, sorun bir atom ve bir serbest elektronla ilgili.
2) Bu problemde atomun elektronlarının ve çekirdeğinin atomun enerji seviyelerine katkılarını dikkate almak gerekli değildir. Bir atom, belirli bir enerji spektrumuna sahip tek bir nesne olarak kabul edilir.
3) Serbest elektron bir atomun parçası değildir, enerjisini bir atomun enerji seviyeleri diyagramına yerleştirmek doğru değildir (enerjisi yan yana gösterilebilir). Bir serbest elektronun olası kinetik enerji spektrumu hakkında konuşursak, o zaman süreklidir (ayrık değil): Bu problemde kinetik enerjiçarpışmadan önceki serbest elektron 1.45 eV ve sonrasında 4.95 eV idi.
4) Elektron, atomla bir bütün olarak etkileşir ve ondan bir miktar enerji alır.
5) Kinetik.
Belirli bir elementin atomlarının düşük enerji seviyeleri şemasının şekilde gösterilen forma sahip olduğunu ve atomların enerjili bir durumda olduğunu varsayalım.Bu atomlardan biriyle çarpışan bir elektron, sonuç olarak bir miktar ek enerji aldı. çarpışmanın. Elektronun çarpışmadan önceki kinetik enerjisi, atomla çarpışmadan sonra elektronun momentumunu belirle'ye eşittir. Bir elektronla çarpışma sırasında bir atomun ışık yayma olasılığı ihmal edilir; çarpışmadan önce atom hareketsiz olarak kabul edilir.
Çözüm.
Eğer bir atomla çarpışmada elektron enerji kazanmışsa, atom duruma geçmiştir.Sonuç olarak, çarpışmadan sonra elektronun kinetik enerjisi, çarpışmadan önceki elektronun enerjisine eşit olmuştur; buradan: Dürtü p elektronun kinetik enerjisi ile ilişkisi şu şekildedir: m elektronun kütlesidir.
Sonuç olarak,
Cevap:
Şekil, bir atomun enerji seviyelerini gösterir ve bir seviyeden diğerine geçişler sırasında yayılan ve emilen fotonların dalga boylarını gösterir. Eğer seviyeden seviyeye geçiş sırasında yayılan fotonların dalga boyu nedir?
Çözüm.
Bir enerji seviyesinden diğerine geçiş sırasında bir atom tarafından yayılan veya soğurulan bir fotonun frekansı, bu seviyeler arasındaki enerji farkı ile orantılıdır. Bu nedenle elimizde:
Buradan (çünkü):
Şekil, bir atomun elektron kabuğunun enerji seviyelerini gösterir ve bir seviyeden diğerine geçişler sırasında yayılan ve emilen fotonların frekanslarını gösterir. Eğer seviyeden seviyeye geçiş sırasında soğurulan fotonların dalga boyu nedir?
Çözüm.
Bir enerji seviyesinden diğerine geçiş sırasında bir atom tarafından yayılan veya soğurulan bir fotonun frekansı, bu seviyeler arasındaki enerji farkı ile orantılıdır:
Bu nedenle şunu yazıyoruz: Buradan:
Cevap:
Şekil, bir atomun birkaç enerji seviyesini gösterir ve bir seviyeden diğerine geçişler sırasında yayılan ve emilen fotonların dalga boylarını gösterir.
Bu seviyeler arasındaki geçişler sırasında yayılan fotonlar için minimum dalga boyunun, if değeri nedir?
Çözüm.
Minimum dalga boyu, fotonun maksimum frekansına ve enerjisine karşılık gelir. yani ve
Bir enerji seviyesinden diğerine geçiş sırasında bir atom tarafından yayılan veya soğurulan bir fotonun frekansı, bu iki seviye arasındaki enerji farkı ile orantılıdır. Bu yüzden
Bir hidrojen atomundaki bir elektronun enerji seviyeleri, nerede formülü ile verilir. Bir atom durumdan duruma geçerken, atom bir foton yayar. Fotokatodun yüzeyinde bir foton, bir fotoelektronu devre dışı bırakır. Fotokatodun yüzey malzemesi için fotoelektrik etkinin kırmızı sınırına karşılık gelen ışığın dalga boyu, Fotoelektronun mümkün olan maksimum kinetik enerjisi nedir?
Çözüm.
Bohr'un varsayımlarına göre, bir atom daha düşük enerji seviyelerine geçtiğinde ışık yayılır, fotonlar ise ilk ve son durumların enerjileri arasındaki farka eşit bir enerji taşır. Böylece, yayılan fotonun bir enerjisi vardı.
Kaynak: Fizikte Birleşik Devlet Sınavı 06/06/2013. ana dalga. Sibirya. Seçenek 1.
EV nerede. Bir atom durumdan duruma geçerken, atom bir foton yayar. Bu foton, fotokatodun yüzeyine ulaştığında bir fotoelektronu devre dışı bırakır. Fotokatot yüzeyinin malzemesi için fotoelektrik etkinin kırmızı sınırına karşılık gelen ışık frekansı, Hz. Bir fotoelektronun mümkün olan maksimum momentumu nedir?
Çözüm.
Fotoelektrik etki denklemine göre, yayılan fotoelektronların maksimum kinetik enerjisi, foton enerjisi ve iş fonksiyonu ile ilişki ile ilişkilidir.
Kaynak: Fizikte Birleşik Devlet Sınavı 06/06/2013. ana dalga. Sibirya. Seçenek 2.
Bir hidrojen atomundaki bir elektronun enerji seviyeleri, formül eV ile verilir, burada . Bir atom durumdan duruma geçerken, atom bir foton yayar. Bu foton, fotokatodun yüzeyine ulaştığında bir fotoelektronu devre dışı bırakır. Fotokatodun yüzey malzemesi için fotoelektrik etkinin kırmızı sınırına karşılık gelen ışığın dalga boyu, Fotoelektron momentumunun mümkün olan maksimum modülü nedir?
Çözüm.
Bohr'un varsayımlarına göre, bir atom daha düşük enerji seviyelerine geçtiğinde ışık yayılır, fotonlar ise ilk ve son durumların enerjileri arasındaki farka eşit bir enerji taşır. Böylece, yayılan fotonun bir enerjisi vardı.
Fotoelektrik etki denklemine göre, yayılan fotoelektronların maksimum kinetik enerjisi, foton enerjisi ve iş fonksiyonu ile ilişki ile ilişkilidir.
İş fonksiyonu, aşağıdaki ilişki ile kırmızı sınırın dalga boyu ile ilgilidir:
Böylece, bir fotoelektronun mümkün olan maksimum momentumu
Kaynak: Fizikte Birleşik Devlet Sınavı 06/06/2013. ana dalga. Sibirya. Seçenek 3.
Enerji düzeyleri & `
nerede . Bir atom durumdan duruma geçerken, atom bir foton yayar. Bu foton, fotokatodun yüzeyine ulaştığında bir fotoelektronu devre dışı bırakır. Fotokatot yüzeyinin malzemesi için fotoelektrik etkinin kırmızı sınırına karşılık gelen ışık frekansı, Hz. Bir fotoelektronun mümkün olan maksimum kinetik enerjisi nedir?
Çözüm.
Bohr'un varsayımlarına göre, bir atom daha düşük enerji seviyelerine geçtiğinde ışık yayılır, fotonlar ise ilk ve son durumların enerjileri arasındaki farka eşit bir enerji taşır. Böylece, yayılan fotonun bir enerjisi vardı.
Fotoelektrik etki denklemine göre, yayılan fotoelektronların maksimum kinetik enerjisi, foton enerjisi ve iş fonksiyonu ile ilişki ile ilişkilidir.
İş fonksiyonu, ilişki ile kırmızı sınırın frekansı ile ilgilidir:
Böylece, bir fotoelektronun mümkün olan maksimum kinetik enerjisi,






