Moleküler fizik. kaynayan sıvı
Sıvının kapalı bir kabın hacminin bir kısmını kaplamasına izin verin. Herhangi bir sıcaklıkta, sıvının içinde, komşu moleküllerle bağları kırabilen ve sıvıdan uçabilen yeterince enerjik moleküller vardır. Nasıl daha fazla sıcaklık ve rüzgar varlığında daha hızlı buharlaşma meydana gelir. Aynı zamanda, kabın içindeki hacmin geri kalanını kaplayan buharda, her zaman sıvıya geri dönen ve geri uçamayan moleküller olacaktır. Böylece, bu kapta, her zaman birbiriyle yarışan iki işlem gerçekleşir - buharlaşma ve ters yoğuşma. Sıvıdan ayrılan moleküllerin sayısı geri dönen moleküllerin sayısına eşit olduğunda, sıvı ve gaz fazlar arasında dinamik bir denge oluşur, buharın doygunluğa ulaştığını söylerler.
Buhar denir doymamış basıncı, belirli bir sıcaklıktaki doyma basıncından düşükse.
Basınç doymuş buhar büyük ölçüde sıcaklığa bağlıdır: ne kadar yüksekse, o kadar
daha fazla molekül sıvıyı terk etmek için yeterli enerjiye sahiptir, bu nedenle doymuş buhar yoğunluğunun da artması gerekir.
nkT. Sıvının buharı ile dengede olduğu p0 buhar basıncına doymuş buhar basıncı denir.
Doymuş buhar basıncı, yalnızca sıvının sıcaklığındaki bir artış nedeniyle değil, aynı zamanda buhar moleküllerinin konsantrasyonundaki bir artış nedeniyle de artar.
AB - sıcaklıktaki artıştan basınç artar
BC - tüm sıvı buharlaştığında, basınç sabit hacim
mutlak sıcaklıkla doğru orantılı olarak artar
Kaynamak.
Sıvının sıcaklığı arttıkça buharlaşma hızı artar, sıvı kaynamaya başlar. Kaynarken, sıvının hacmi boyunca hızla büyüyen ve yüzeye çıkan buhar kabarcıkları oluşur. Bir sıvının kaynama noktası sabit kalır. Bunun nedeni, sıvıya verilen tüm enerjinin onu buhara dönüştürmek için harcanmasıdır.
Çözünmüş gazlar, sıvının içinde her zaman mevcuttur, bunlar sıvı içinde asılı kalan toz parçacıklarının yanı sıra kabın tabanında ve duvarlarında salınır. Baloncukların içindeki sıvı buharlar doymuştur. Artan sıcaklıkla birlikte basınç doymuş buharlar artar ve kabarcıkların boyutu artar. Kaldırma kuvvetinin etkisi altında yüzerler. Sıvının üst katmanlarının sıcaklığı daha düşükse, buhar bu katmanlarda kabarcıklarda yoğuşur. Basınç hızla düşer ve kabarcıklar çöker. Çöküş o kadar hızlıdır ki, balonun duvarları çarpışarak patlamaya benzer bir şey üretir. Bu mikro patlamaların çoğu karakteristik bir gürültü yaratır. Sıvı yeterince ısındığında kabarcıklar çökmeyi bırakır ve yüzeye çıkar. Sıvı kaynayacak. Kaynamadan önce, su ısıtıcısı neredeyse ses çıkarmıyor.
Doymuş buhar basıncının sıcaklığa bağlılığı, bir sıvının kaynama noktasının neden yüzeyindeki basınca bağlı olduğunu açıklar. İçindeki doymuş buharın basıncı, sıvının yüzeyindeki hava basıncı (dış basınç) ile sıvı sütununun hidrostatik basıncının toplamı olan sıvıdaki basıncı biraz aştığında bir buhar kabarcığı büyüyebilir. Kaynama, kabarcıklardaki doymuş buhar basıncının sıvıdaki basınca eşit olduğu bir sıcaklıkta başlar. Dış basınç ne kadar yüksek olursa, kaynama noktası o kadar yüksek olur ve bunun tersi, dış basıncı düşürür, kaynama noktası düşer.
Her sıvının, doymuş buhar basıncına bağlı olan kendi kaynama noktası vardır. Doymuş buhar basıncı ne kadar yüksek olursa, karşılık gelen sıvının kaynama noktası o kadar düşük olur, çünkü daha düşük sıcaklıklarda doymuş buhar basıncı atmosfer basıncına eşit olur.
Kritik sıcaklık, farklılıkların oluştuğu sıcaklıktır. fiziki ozellikleri sıvı ile arasında doymuş buhar.
Kritik sıcaklık kavramı, D. I. Mendeleev tarafından tanıtıldı. Kritik sıcaklıkta, doymuş buharın yoğunluğu ve basıncı maksimum olur ve buharla denge halindeki sıvının yoğunluğu minimum olur. Kritik sıcaklığın özel önemi, kritik sıcaklığın üzerindeki bir sıcaklıkta, basınç olmaksızın bir gazın sıvıya dönüştürülememesi gerçeğinde yatmaktadır. Kritik sıcaklığın altındaki bir gaz, doymamış buhardır.
İstatistiksel mekanik, bazı modellere dayanarak, sadece maddenin gaz halindeki özelliklerini değil, aynı zamanda maddenin bir halden diğerine geçiş süreçlerini de açıklamayı mümkün kılar. faz dönüşümleri gaz-sıvı, sıvı-katı vb.
Bir termodinamik sistemin fazları ve bileşenleri. Bir maddenin fazı, diğer parçalardan arayüzlerle ayrılan makroskopik homojen kısmıdır. Örneğin kapalı bir kapta belli bir miktar suyun üzerinde hava ve su buharı karışımı bulunur. Bu, iki fazdan oluşan iki fazlı bir sistemdir: sıvı (su) ve gaz (hava ve su buharı karışımı). Kapta hava olmasaydı, sistemin hala iki fazı olurdu - sıvı (su) ve gaz (su buharı), böylece tek bileşenli bir sistemde bir maddenin fazlara ayrılması da mümkündür ve değil sadece farklı maddelerin karışımında.
Suya alkol eklenirse, sistemdeki faz sayısı değişmez, çünkü alkol suda seyreltildiğinde fiziksel olarak homojen bir sıvı oluşur. Suya bitkisel yağ eklerseniz, iki sıvı fazlı bir sistem elde edersiniz - yağ ve su.
Faz sayısını sayarken, belirli bir fazın tek bir yerde yoğunlaşması veya diğer fazlar ile birbirinden ayrılmış birkaç parçadan oluşması önemli değildir. Böylece havadaki sis damlacıkları onunla iki fazlı bir sistem oluşturur. Çok bileşenli bir sistem olan bir gaz karışımı her zaman tek fazlı bir sistem oluşturur.
Faz dönüşümleri. Değişiklikler, faz dönüşümlerine örnek teşkil edebilir. toplama durumu maddeler. Agrega halleri, maddenin katı, sıvı ve gaz halleri olarak anlaşılır. Bazen plazma, bir maddenin dördüncü kümelenme hali olarak izole edilir. Maddenin katı ve sıvı hallerine yoğuşmuş denir.
Buharlaşma veya buharlaşma, bir maddenin yoğunlaştırılmış bir halden gaz haline geçmesidir. Ters geçişe yoğuşma denir. Katı halden sıvı hale geçişe erime, ters geçişe katılaşma veya kristalleşme denir.
Aynı maddenin katı hali birkaç kristal modifikasyonda gerçekleştirilebilir. Değişiklikleri birbirine çevirmek de bir örnek verir. faz geçişi.
Faz dengesi. Farklı fazlar hangi koşullar altında dengede olabilir? Mekanik denge için, temas eden fazların sınırının zıt taraflarındaki basınç aynı olmalıdır. Termal denge için fazlar aynı sıcaklığa sahip olmalıdır.
Fazların dengesi her zaman dinamik bir dengedir, çünkü kaotik termal hareket yapan moleküller sürekli olarak bir fazdan diğerine sınırdan geçer ve geri döner. Ancak bu akışlar birbirini iptal eder.
Buharlaşma ve yoğunlaşma. Faz dönüşümlerinin en basit örneklerinden birini - bir sıvının buharlaşmasını ve bir buharın yoğunlaşmasını - daha ayrıntılı olarak ele alalım.
Açık bir kaba dökülen sıvı miktarı giderek azalır. Bu durumda, ağırlıklı olarak hızlı moleküller, kinetik enerjisi yüzeye yakın katmandaki diğer sıvı moleküllerden gelen çekim güçlerinin üstesinden gelmek için yeterli olan sıvıyı terk eder. Sonuç olarak içsel enerji sıvı azalır ve ona ısı getirmezseniz buharlaşma sürecinde sıcaklığı düşer.
Buharlaşma ile eş zamanlı olarak, yoğuşmanın tersi de gerçekleşir, yani bazı moleküllerin buhardan sıvıya dönüşü. Açık bir kapta, buharlaşma genellikle yoğuşma ile telafi edilmez ve sıvı miktarı azalır.
Kap sıkıca kapatılırsa dinamik denge kısa sürede kurulacak ve sıvı seviyesi değişmeyecektir. Buhar,
sıvısıyla dinamik dengede olana doymuş denir. feribot. İsim, belirli bir sıcaklıkta belirli bir hacmin daha fazla buhar içeremeyeceğini vurgular.
Sıvı yüzeyinin üzerinde başka gazların veya buharların bulunması, buhar oluşumunu etkilemez. Belirli bir maddenin maksimum buhar basıncı, yani maksimum kısmi basıncı, karşılık gelen sıvının doymuş buhar basıncına eşittir ve diğer gazların varlığına bağlı değildir.
Doymuş buhar basıncı. Kabı kapatan pistonu hareket ettirerek sıvının üzerindeki buhar hacmini kademeli olarak azaltacağız. Bu durumda, maddenin bir kısmı gaz halinden sıvıya geçecek, ancak önceki sıcaklık korunursa buhar basıncı değişmeyecektir. Bu, doymuş buhar basıncının yalnızca sıcaklığa bağlı olduğu anlamına gelir. Böyle bir deneysel gerçek, istatistiksel mekanik kavramları temelinde niteliksel olarak açıklanabilir.
Birim alan sınırından sıvıdan kaçan moleküllerin sayısı, sıvının üzerinde ne kadar buhar olduğuna bağlı değildir. Dinamik dengede, giden ve gelen moleküllerin sayısı aynıdır. Bu, bir birim yüzeyden sıvıya giren molekül sayısının buharın kapladığı hacme bağlı olmadığı anlamına gelir. Belirli bir sıcaklıktaki bu sayı, buhar moleküllerinin konsantrasyonu tarafından belirlendiğinden, konsantrasyon ve dolayısıyla basınç hacme bağlı değildir, sadece sıcaklık tarafından belirlenir. Her madde için, belirli bir sıcaklıktaki doymuş buhar basıncının kendi iyi tanımlanmış değeri vardır.
Sıcaklık arttıkça doymuş buhar basıncı, buhar basıncından daha hızlı yükselir. Ideal gaz. Bunun nedeni, artan sıcaklıkla birlikte doymuş buhar basıncının yalnızca ortalama artıştan dolayı artması değildir. kinetik enerji moleküller, aynı zamanda maddenin bir kısmının sıvı fazdan gaz faza geçişinden dolayı molekül konsantrasyonundaki, yani buhar yoğunluğundaki artıştan dolayı. Doymuş buhar moleküllerinin derişimindeki artıştır. Asıl sebep sıcaklıkla basıncın artması.
Kapalı bir kaptaki tüm sıvı buharlaştığında, daha fazla ısıtıldığında buharın doygunluğu sona erecek ve ideal bir gazda olduğu gibi sabit hacimdeki basıncı termodinamik sıcaklıkla orantılı olarak artacaktır.
Kaynamak. Açık bir kapta sıcaklık arttıkça sıvının buharlaşma hızı artar. Son olarak, belirli bir sıcaklıkta sıvı kaynamaya başlar: hacmi boyunca hızla büyüyen buhar kabarcıkları oluşur ve yüzeye yükselir. Bu, kaynama sırasında bir sıvının buharlaşmasının yalnızca açık yüzeyinden değil, aynı zamanda kabarcıkların içinde de meydana geldiği anlamına gelir. İçlerindeki buharlaşma nedeniyle kabarcıkların büyümesinin, yalnızca kabarcık içindeki basıncın olduğu bir sıcaklıkta mümkün olduğu açıktır, yani.
doymuş buhar basıncı, belirli bir derinlikte sıvı basıncına eşit olur. Bu nedenle, bir sıvının kaynama noktası dış basınca bağlıdır. Deniz seviyesinden 7 km yükseklikte suyun kaynama noktası yaklaşık 70 °C'dir. Aksine, yüksek basıncın korunduğu hermetik olarak kapatılmış otoklavlarda kaynama noktası 100 °C'den çok daha yüksektir.
Karışmayan sıvıların sınırında kaynama ilginç özelliklere sahiptir. Aşağıdaki basit deneyle gösterilebilirler. Bir cam kaba belirli miktarda karbon tetraklorür dökülür ve üzerine bir kat su dökülür. Normal atmosferik basınçta su 100°C'de ve karbon tetraklorür 100°C'de kaynar.
Kaynama, kabarcığın oluştuğu derinlikte doymuş buharın basıncı sıvının basıncına eşit olduğunda meydana gelir. Akışkan basıncı şunlardan oluşur: atmosferik basınç ve sıvı kolonun hidrostatik basıncı. Kaptaki sıvı kolonunun yüksekliği birkaç santimetre ise, o zaman hidrostatik basınç normal atmosferik basıncın birkaç binde biri kadardır ve göz ardı edilebilir. Bir sıvının doymuş buhar basıncı, sıcaklığı ile belirlenir. Suda kabarcıklar sadece su buharı içerir; 100 °C'de doymuş su buharının basıncı normal atmosfer basıncına eşittir. Karbon tetraklorürde, kabarcıklar sadece buhar içerir ve doymuş buhar basıncı, atmosfer basıncına eşittir.
Bu sıvılar arasındaki arayüzde, kabarcıklar hem buhar hem de su buharı içerir. Dalton yasasına göre bu kabarcıklardaki basınç, su buharının kısmi basınçlarının toplamına eşittir ve bu nedenle, daha düşük bir sıcaklıkta sınırda bulunan kabarcıklarda atmosferik basınca eşit bir basınç oluşur. sıcaklıkta kaynama arayüzeyde başlar. Deneyim, bunun bir sıcaklıkta olduğunu göstermektedir.Bu sıcaklık, doymuş su buharlarının basıncına bağımlılık tablolarından ve basınçların toplamının atmosferik olana eşit olduğu sıcaklıktan böyle bir sıcaklık seçilerek deneyim olmadan oluşturulabilir. Su buharı basıncı 192 mm Hg olduğunda. Art., ve buhar basıncı mm Hg. Sanat. Bu rakamları kullanarak, arayüzde oluşan her kabarcıkta su moleküllerinden neredeyse üç kat daha fazla molekül olacağı sonucuna varabiliriz. Ve bir karbon tetraklorür molekülünün kütlesi, bir su molekülünün kütlesinin dokuz katı olduğundan, buharlaşması, suyun buharlaşmasından neredeyse 25 kat daha hızlı gerçekleşir. sırasında sınır tabakasında kaynama gözlemlenmesi
bir süre sonra alt tabakanın üst su tabakasından çok daha hızlı kaynadığı görülebilir.
Buharlaştırma merkezleri. Kaynama işlemi için, sıvıda - buharlaşma merkezlerinin rolünü oynayan gaz fazının çekirdeklerinde - homojensizliklerin olması gerekir. Genellikle, sıvı içinde, kabın tabanındaki ve duvarlarındaki kabarcıklar ve sıvı içinde asılı kalan toz parçacıkları tarafından salınan çözünmüş gazlar bulunur. Isıtıldığında, bu kabarcıklar hem gazların çözünürlüğünün sıcaklıkla azalması hem de içlerindeki sıvının buharlaşması nedeniyle artar. Hacmi artan baloncuklar, Arşimet kaldırma kuvvetinin etkisi altında yüzer. Sıvının üst katmanlarının sıcaklığı daha düşükse, buharın yoğunlaşması nedeniyle içlerindeki basınç keskin bir şekilde düşer ve kabarcıklar karakteristik bir sesle "çöker". Tüm sıvı kaynama noktasına kadar ısındığında, kabarcıklar çökmeyi durdurur ve yüzeye çıkar: tüm sıvı kaynar.
aşırı ısıtılmış sıvı Sıvı, belirli bir basınçta kaynama noktasını aşan bir sıcaklığa kadar ısıtılabilir. Bunu yapmak için, çözünmüş gazlardan ve mekanik safsızlıklardan iyice temizlenmelidir. Böyle bir sıvıda pratik olarak hiçbir buharlaşma merkezi yoktur ve sıcaklık, kaynama noktasından belirgin şekilde yüksek olduğunda bile kaynama başlamaz. Böyle bir sıvıya aşırı ısıtılmış denir. Bu kararsız bir durumdur. Aşırı ısıtılmış bir sıvı, içinde buharlaşma merkezleri göründüğünde şiddetli bir şekilde kaynar.
Aşırı ısıtılmış bir sıvının hızlı kaynama olgusu, yüksek enerjili parçacıkları tespit etmek için modern bir cihaz olan bir kabarcık odasında kullanılır. Yüklü bir parçacığın içinden geçişi kızgın sıvı parçacık yolu boyunca kaynama merkezlerinin çekirdeklerinin oluşumuna yol açar. Embriyoların üzerinde oluşan baloncuklar, bir milimetre büyüklüğündeki fraksiyonlara ulaşır ve atımlı bir ışık kaynağı ile yan aydınlatma altında fotoğraflanabilir.
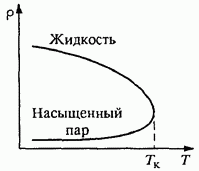
Pirinç. 80. Bir sıvının yoğunluğunun ve doymuş buharının sıcaklığa bağlılığı Kabarcık odalarındaki izlerin incelenmesi, birçok yeni temel parçacığı keşfetmeyi ve araştırmayı mümkün kıldı.
Kritik sıcaklık. Sıcaklıktaki bir artışla, doymuş buharın yoğunluğundaki bir artışla eş zamanlı olarak, ısıl genleşmesi nedeniyle sıvının yoğunluğunda bir azalma meydana gelir. Bir grafikte, bir sıvının yoğunluğunun ve doymuş buharının sıcaklığa bağımlılıklarını gösteriyorsak, o zaman kritik olarak adlandırılan belirli bir Tk sıcaklığında, her iki eğri birleşir (Şekil 80): yoğunluk
sıvı, doymuş buharın yoğunluğuna eşit hale gelir. Kritik sıcaklıkta, fark sadece yoğunlukta değil, aynı zamanda sıvı ve doymuş buharın diğer tüm fiziksel özelliklerinde de kaybolur.
Kritik sıcaklık kavramı, D. I. Mendeleev tarafından tanıtıldı. Her maddenin kendi kritik sıcaklığı vardır. Örneğin, su için 374.15 ° C ve karbon monoksit için yaklaşık 31 ° C'dir.
Gaz ve buhar arasındaki fark. Kritik bir sıcaklığın varlığı, gaz ve buhar arasında ayrım yapmayı mümkün kılar. Bir gaz, yalnızca kritik sıcaklığın altındaki bir sıcaklıkta sıkıştırma yoluyla sıvı hale dönüştürülebilir. Bu nedenle, kritik sıcaklığın altındaki bir sıcaklıkta gaz halindeki bir maddeye buhar denir.
Bu nedenle, buhar ve gaz arasında temel bir fark yoktur. Bu ayrım koşulludur ve oldukça dar bir sıcaklık aralığında yaşamaya alışkın olduğumuz için mantıklıdır. Bu nedenle, bir gaza genellikle normal sıcaklıklarda doymuş buhar basıncı atmosfer basıncından daha yüksek olan (örneğin, karbondioksit) bir madde denir. Aksine, "buhar" terimi, oda sıcaklığında bir maddenin doymuş buhar basıncı atmosfer basıncından (örneğin su buharı) daha düşük olduğunda kullanılır.
Buharlaşma ve yoğuşma ısısı. Buharlaşma ve yoğuşma gibi faz geçişlerine her zaman ısının emilmesi veya salınması eşlik eder. Bir maddenin şeklini değiştirmek için verilmesi gereken ısı miktarıdır. sıvı hal gaz halinde Sabit sıcaklık Ve sabit basınç, buharlaşma ısısı (veya buharlaşma ısısı) olarak adlandırılır. Buhar, aynı koşullar altında bir sıvıya yoğunlaştığında aynı miktarda ısı açığa çıkar. Ayırt etmek özısı buharlaşma (kilogram başına joule olarak ölçülür) ve molar (mol başına joule olarak ölçülür).
Buharlaşma ısısı sıcaklığa bağlıdır. Artan sıcaklıkla azalır ve kritik sıcaklıkta kaybolur.
Buharlaşma ısısı özel durum faz geçiş ısısı. Başka bir örnek, erime sırasında emilen ve kristalleşme sırasında salınan füzyon ısısıdır.
Hava nemi. Geniş açık su yüzeyine rağmen dünya atmosferindeki su buharı doymuş değildir. Havadaki su buharı içeriği, hava nemi ile karakterize edilir. Biyosferin durumu, insan refahı, teknik cihazların performansı, binaların ve sanat eserlerinin güvenliği büyük ölçüde havanın nemine bağlıdır.
Nem, bazen mutlak nem olarak adlandırılan su buharının kısmi basıncı ile ölçülür. Ancak, değer mutlak nem bu koşullar altında su buharının doygunluktan ne kadar uzak olduğunu yargılamamıza henüz izin vermiyor. Ancak suyun açık yüzeylerden buharlaşma yoğunluğu buna bağlıdır. Su buharı durumunun doygunluğa yakınlığını karakterize etmek için bağıl nem verilir.
Bağıl nem, belirli bir sıcaklıkta havada bulunan su buharının kısmi basıncının, o sıcaklıktaki doymuş buhar basıncına oranıdır. Bağıl nem genellikle yüzde olarak ifade edilir:
![]()
Hava sıcaklığı, içinde sabit bir su buharı içeriği ile (yani sabit bir mutlak nemde) düşürülürse, bağıl nem artacak ve belirli bir sıcaklıkta ulaşacak, yani buhar doymuş hale gelecektir. Havadaki buharın doygun hale geldiği bu sıcaklığa çiğlenme noktası denir. Hava çiy noktasına kadar soğuduğunda, su buharı yoğunlaşmaya başlar. Bu, sis ve çiy oluşumunda kendini gösterir.
Hava nemi ölçümü. Hava nemini ölçmek için higrometreler ve psikrometreler kullanılır. Bir yoğuşma higrometresinin eylemi, çiğlenme noktasının ölçülmesine, yani soğutulmuş yüzeyin buğulandığı andaki sıcaklığının ölçülmesine dayanır. Çiylenme noktası ve hava sıcaklığı bilinerek, özel tablolar kullanılarak su buharı kısmi basıncı ve bağıl nem belirlenebilir.
Psikrometrenin etkisi, su buharlaşma yoğunluğunun havanın bağıl nemine bağlılığına dayanır. Biri kuru, diğeri ise ucu suya batırılmış nemli bir beze sarılmış iki termometreden oluşur. Kuru ve ıslak termometre okumaları arasındaki farka göre, özel tablolar kullanılarak hava nemi belirlenir.
Yüzey gerilimi. Birkaç fazdan oluşan bir termodinamik sistemde her zaman arayüzler vardır. Sistemin bir dizi özelliği bu fazlar arası sınırlarla ilişkilidir ve şimdi bunları tartışacağız.
Sıvı fazda, çevredeki moleküllerden bir maddenin moleküllerine çekici kuvvetler etki eder. Molekül sıvının derinliklerinde ve yüzeyden uzaklaştırıldığında, bu kuvvetler her yöne etki eder ve ortalama olarak dengelenir. Molekül yüzeye yakınsa, o zaman diğer moleküllerin onun üzerindeki etkisi içe doğru yönelmiş bir bileşke kuvvetin ortaya çıkmasına neden olur.
sıvılar. Sıvının serbest yüzeyini artırmak için bazı moleküllerin hacimden yüzey katmanı ve bunun için biraz çalışmanız gerekiyor. Bu nedenle, bir sıvı yüzeyinin varlığı ek enerji ile ilişkilidir.
Yüzey enerjisi, bitişik fazlardaki moleküller arası etkileşimlerdeki belirgin fark nedeniyle, yüzey katmanındaki moleküllerin potansiyel enerjisinin fazlar içindeki moleküllerin enerjisine kıyasla (yani sınırdan uzak bir hacimdeki) fazlalığıdır.
Güç yüzey gerilimi. Yüzey gerilimi kuvveti, arayüz boyunca, örneğin bir sıvının yüzeyi boyunca, bu yüzeyi sınırlayan çizgiye (gerçek veya zihinsel) dik olarak etki eden kuvvettir. Bir yüzey gerilimi kuvvetinin varlığı, aşağıdaki basit deneylerle doğrulanabilir.
Bir sabun filminin kullanıldığı deneyler en açıklayıcıdır. Bir tel çerçeveyi sabunlu bir çözeltiye batırarak elde edilen bir sabun filminin üzerine bir iplik ilmeği geçirelim (Şekil 81). İlmeğin içindeki sabun filmi bozulmadığı sürece ilmek kendisine verilen şekli korur (Şekil 81a). İlmeğin içindeki film delinirse iplik daire şeklini alır (Şek. 816). Bu şekil, çerçeve üzerinde kalan filmin minimum alanını ve dolayısıyla yüzey enerjisinin minimum değerini sağlar.
Pirinç. 81. Sabun filmi döngüsü
Yüzey gerilimi nedeniyle, yokluğunda sıvı dış kuvvetler bir top şeklini alır, yani belirli bir hacim için minimum bir yüzeye ve buna bağlı olarak da minimum yüzey enerjisine sahiptir. Bu ağırlıksızlıkta, örneğin kokpitte olur. uzay gemisi, bir bardağa su dökmenin imkansız olduğu ve ne zaman serbest düşüş yağmur damlaları
yüzey enerjisi. Nicel olarak, yüzey gerilimi a, yüzey tabakasının sınırına etki eden yüzey gerilimi kuvvetinin modülünün sınırın uzunluğuna oranı veya aynı olan, yüzey enerjisinin yüzey alanına oranı ile karakterize edilir:
![]()
Düz bir sıvı yüzeyi durumunda, yüzey gerilimi kuvveti yüzeyin ne kadar "gerildiğine" bağlı değildir. Açıkçası, böyle bir yüzey için "esneme" kavramı
Hiç mantıklı değil: Hacimden yüzey tabakasına giderek daha fazla molekül çekerek yüzey alanını artırmak için, bir lastik filmin gerilmesinin aksine, sabit bir kuvvet uygulamak gerekir, çünkü alan olarak artan yüzey tabakası özelliklerini değiştirmez.
Formül (2)'deki c'nin iki tanımının denkliğine yol açan, yüzey gerilimi kuvvetlerinin bu özelliğidir.
Aslında, sabun filmini x uzunluğuyla sınırlayan jumper'ı hareket ettirirken yapılan iş (Şekil 82), filmin bir tarafının yüzey alanındaki artışa eşittir. Bu iş, filmin yüzey enerjisinin artışına eşittir.
ıslatma Sıvı moleküllerin katı moleküllerle etkileşimi nedeniyle, yüzeye yakın sıvının serbest yüzeyinin eğrilmesine yol açan bir olgu olan ıslanma meydana gelir. sağlam vücut.
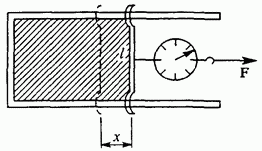
Pirinç. 82. Filmin yüzeyindeki artışla işin hesaplanması üzerine
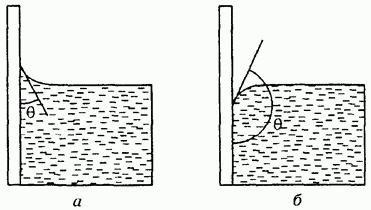
Pirinç. 83. Islanma (a) ve ıslanmama (b) durumunda temas açısı
Bir sıvı ve bir katının molekülleri arasındaki etkileşim kuvveti, sıvının kendi molekülleri arasındaki etkileşim kuvvetinden büyükse, o zaman sıvının katı yüzeyi ıslattığı söylenir. Bu durumda, sıvının yüzeyine teğet düzlem ile katı cismin yüzeyi arasındaki temas açısı veya ıslanma açısı olarak adlandırılan açı dar olacaktır (Şekil 83a). Aksi takdirde açı geniş olacaktır (Şek. 836). Tam ıslanma ile tamamen ıslanmama Örneğin, su temiz camı ıslatır ve parafin kaplı bir yüzeyi ıslatmaz.
Islatma ve ıslatmama birçok iyi bilinen olguyu açıklar. Gazyağının bir lambanın fitilinden yukarı yükselmesi, bir havluyla kurulanabilmesi tamamen ıslanmadan kaynaklanan olaylara örnektir. Aksine, ince bir yağ tabakasıyla kaplı çelik bir iğnenin suyun yüzeyinde yüzmesi, yemeklerin yanmadığı teflon tencere ve tavalar, uzun ince bacaklar üzerinde suda koşan su sayacı böcekleri - tüm bunlarda durumlarda ıslanmama ile karşı karşıyayız.
kılcal fenomenler. Bir sıvının ıslanma olayı nedeniyle dar kılcal borularda yükselmesi veya alçalmasına kılcal olay denir (Şekil 84).
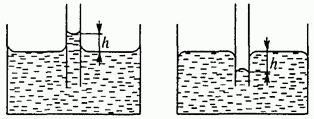
Pirinç. 84. Kılcal damarlardaki sıvı
Sıvının yükseldiği yükseklik (yarıçaplı kılcal borunun duvarlarını tamamen ıslatan yoğunluk, yükselen sıvı sütununun ağırlığını, sütunun üst çevresi boyunca etki eden yüzey gerilimi kuvvetine eşitleyerek bulunabilir:
![]()
kılcal basınç. Yüzey gerilimi kuvvetlerinin neden olduğu sıvı yüzeyinin eğriliği, sıvıda kılcal basınç adı verilen aşırı basınç görünümüne yol açar. Küresel bir yüzey söz konusu olduğunda, bu basınç, eğriliğinin yarıçapı ile Laplace formülü ile ilişkilidir:
Bu formül, kılcal borudaki sıvı sütununun tabanındaki fazla hidrostatik basıncın, sıvının serbest yüzeyinin eğriliğinden dolayı basınçtaki bir değişiklikle dengelenmesi gerektiğini hesaba katarsak, (3) kullanılarak kolayca elde edilebilir. .
Boşluktaki sıvı-cam arayüzünün tüm uzunluğu boyunca etki eden yüzey gerilimi kuvveti:
![]()
Bu yüksekliğin, çapı açıklığın genişliğine eşit olan kılcal damardaki yükseliş yüksekliğinin yarısı kadar olmasına dikkat edelim. Buna bağlı olarak, silindirik bir yüzey tarafından oluşturulan kılcal basınç değeri de küresel olanın yarısı kadardır.
kılcal dalgalar. Yerçekimi gibi yüzey gerilimi kuvvetleri, su yüzeyindeki dalgaların oluşumunda önemli bir rol oynar. Bu kuvvetlerin rolü, farklı uzunluklardaki dalgalar için farklıdır: yeterince kısa dalgalar için, sıvı yüzeyinin eğriliği büyük olduğunda, yüzey gerilimi kuvvetleri baskındır; uzun dalgalarda ise tam tersine bu kuvvetler ihmal edilebilir. Bu nedenle, su üzerindeki küçük dalgalanmalar esasen kılcal dalgalardır. Boyutsal düşünceler, kılcal dalgaların yayılma hızının yüzey gerilimi sıvısı a'nın yoğunluğuna ve K dalga boyuna bağımlılığının doğasını bulmayı kolaylaştırır. İfadeyi oluşturmak
![]()
ve karşılık gelen boyut eşitliğini yazarak, buluruz
Kesin dinamik teori, boyutsuz katsayı С için eşit bir değer verir.
Fazlar nedir ve bir termodinamik sistemin bileşenleri nelerdir?
Çok fazlı tek bileşenli sistemlere ve tek fazlı çok bileşenli sistemlere örnekler verin.
Hangi faz dönüşümlerini biliyorsunuz?
Farklı fazlar hangi koşullar altında dengede olabilir?
Doymuş buhar nedir? Basıncının neden hacme bağlı olmadığını açıklayınız.
Doymuş buharın basıncı neden artan sıcaklıkla ideal bir gazın basıncından daha hızlı artar?
Bir sıvının kaynama noktasının neden dış basınca bağlı olduğunu açıklayınız. Belirli bir basınçta, karışmayan sıvıların sınırındaki kaynama noktası neden her birinin kaynama noktasından daha düşüktür?
Bir hava pompasının çanağının altına bir bardak su konursa, hava hızla dışarı pompalandığında bardaktaki su kaynar. Sebebini açıkla.
Baloncuk odasının çalışma prensibi nedir?
Kritik sıcaklık nedir? Kritik sıcaklıkla ilgili "gaz" ve "buhar" kavramları arasındaki fark nasıldır?
Buharlaşma ısısının fiziksel yapısını açıklar. Kritik sıcaklıkta neden yok oluyor?
%100 bağıl nemde bir psikrometrede kuru ve ıslak termometre okumaları arasındaki fark nedir?
Bir sıvının hacminde ve yüzeyinde bulunan moleküllerin enerjilerindeki farkın nedeni nedir?
Serbestçe uçan bir yağmur damlası neden hafifçe düzleşirken, musluktan sarkan bir damla uzuyor?
Neden bir musluktan akan ince, sürekli dikey bir su akışı belli bir mesafede ayrı damlalara ayrılıyor?
Neden bir yüzücünün saçı suyun altında serbestçe akar ve yüzücü sudan çıkar çıkmaz hemen birbirine yapışır?
Yatay bir ahşap, cam veya alüminyum yüzey üzerinde bir su damlası nasıl bir şekil alır?
Sıcak bir tavadaki bir damla su, metalin yüzeyini ıslatmasına rağmen neden küresel şeklini koruyor?
Formül (3) türetilirken, sıvının kapilerin iç yüzeyini tamamen ıslattığı varsayımı nerede kullanılır?
Dar bir kılcal ve geniş bir tüpteki sıvı yüzeyinin şeklindeki farkı ne açıklar?
Bir sıvı bir kılcal boru içinde yüksekliğe yükseldiğinde, sıvı kolonunun kütlesi olduğu yerde yüzey gerilimi kuvvetleri iş yapar (bunu kanıtlayın). Ancak potansiyel enerji Bu sütun sadece eşittir Bu, enerjinin korunumu yasası ile nasıl uyuşur?
Kaynama, bir sıvının, belirli bir sıcaklıkta sıvının tüm hacmi boyunca buhar kabarcıklarının oluşmasıyla meydana gelen buhara yoğun bir geçişidir.
Sıvının herhangi bir sıcaklığında meydana gelen buharlaşmanın aksine, başka bir buharlaşma türü - kaynama - yalnızca tamamen belirli (belirli bir basınçta) sıcaklıkta - kaynama noktasında mümkündür.
Açık bir cam kapta su ısıtıldığında, sıcaklık arttıkça kabın duvarlarının ve tabanının küçük kabarcıklarla kaplandığı görülür. Tamamen ıslanmayan damar duvarlarının girintilerinde ve mikro çatlaklarında bulunan en küçük hava kabarcıklarının genişlemesi sonucu oluşurlar.
Baloncukların içindeki sıvı buharlar doymuştur. Sıcaklık arttıkça buhar basıncı artar ve kabarcıkların boyutu artar. Baloncukların hacmindeki artışla birlikte, onlara etki eden kaldırma (Arşimet) kuvveti de artar. Bu kuvvetin etkisi altında, en büyük kabarcıklar geminin duvarlarından ayrılır ve yükselir. Suyun üst katmanlarının henüz 100 ° C'ye ısınmak için zamanı olmadıysa, bu tür (daha soğuk) suda, kabarcıkların içindeki su buharının bir kısmı yoğunlaşır ve suya girer; baloncukların boyutu küçülür ve yerçekimi kuvveti tekrar düşmelerine neden olur. Burada tekrar artarlar ve tekrar yüzmeye başlarlar. Suyun içindeki kabarcıkların dönüşümlü olarak artması ve azalmasına, içinde karakteristik ses dalgalarının ortaya çıkması eşlik eder: kaynar su gürültülüdür.
Tüm su 100 ° C'ye kadar ısındığında, yükselen kabarcıklar artık küçülmez, su yüzeyinde patlayarak buharı dışarı atar. Karakteristik bir uğultu var - su kaynar.
Kaynama, kabarcıkların içindeki doymuş buharın basıncı, çevreleyen sıvının basıncına eşit olduğunda başlar.
Kaynama sırasında sıvının ve üzerindeki buharın sıcaklığı değişmez. Tüm sıvı kaynayana kadar değişmeden kalır. Bunun nedeni, sıvıya verilen tüm enerjinin onu buhara dönüştürmek için harcanmasıdır.
Bir sıvının kaynadığı sıcaklığa kaynama noktası denir.
Kaynama noktası, sıvının serbest yüzeyine uygulanan basınca bağlıdır. Bu, doymuş buhar basıncının sıcaklığa bağımlılığından kaynaklanmaktadır. Bir buhar kabarcığı, içindeki doymuş buharın basıncı, sıvı sütununun dış basıncı ile hidrostatik basıncının toplamı olan sıvıdaki basıncı biraz aştığı sürece büyür.
Dış basınç ne kadar büyük olursa, kaynama noktası da o kadar yüksek olur.
Hepimiz suyun 100°C'de kaynadığını biliyoruz. Ancak bunun sadece normal atmosfer basıncında (yaklaşık 101 kPa) geçerli olduğunu unutmamalıyız. Basınç arttıkça suyun kaynama noktası yükselir. Yani örneğin düdüklü tencerelerde yemek yaklaşık 200 kPa basınç altında pişirilir. Suyun kaynama noktası 120 °C'ye ulaşır. Bu sıcaklıktaki suda pişirme işlemi, normal kaynar suya göre çok daha hızlıdır. Bu, "düdüklü tencere" adını açıklar.
Tersine, dış basıncı azaltarak kaynama noktasını düşürürüz. Örneğin dağlık bölgelerde (3 km yükseklikte, basıncın 70 kPa olduğu yerlerde), su 90°C sıcaklıkta kaynar. Bu nedenle, bu tür kaynar su kullanan bu bölgelerin sakinleri, yemek pişirmek için ova sakinlerinden çok daha fazla zamana ihtiyaç duyar. Ve bu kaynar suda, örneğin bir tavuk yumurtasını pişirmek genellikle imkansızdır, çünkü 100 ° C'nin altındaki bir sıcaklıkta protein pıhtılaşmaz.
Her sıvının, doymuş buhar basıncına bağlı olan kendi kaynama noktası vardır. Doymuş buhar basıncı ne kadar yüksek olursa, karşılık gelen sıvının kaynama noktası o kadar düşük olur, çünkü daha düşük sıcaklıklarda doymuş buhar basıncı atmosfer basıncına eşit olur. Örneğin, 100 °C'lik bir kaynama noktasında, doymuş su buharının basıncı 101.325 Pa (760 mm Hg), cıva buharının ise sadece 117 Pa'dır (0.88 mm Hg). Cıva normal basınçta 357°C'de kaynar.
Kaynamak bir sıvıyı gaz (buhar) haline dönüştürme işlemidir. Sıvıda buhar kabarcıkları veya buhar boşlukları görünüyor. İçlerindeki sıvı buharlaştıkça kabarcıklar büyür. Baloncuklardaki buhar şuna dönüşür: gaz hali sıvının üzerinde.
Kaynama, suyun sıvı halinin yoğun bir şekilde buhara geçişi olarak anlaşılmaktadır. Geçiş, belirli bir sıcaklıkta sıvının hacmi boyunca buhar kabarcıklarının dönüşümünden oluşur.
Suyun herhangi bir sıcaklığında meydana gelen buharlaşmanın aksine, kaynama gibi buharlaşma ancak uygun sıcaklıkta mümkündür. Bu sıcaklığa kaynama noktası denir.
Suyu açık bir cam kapta ısıtırsanız, sıcaklık arttıkça suyun küçük kabarcıklarla kaplanmaya başladığını fark edeceksiniz. Bu tür kabarcıklar, kabın mikro çatlaklarında bulunan küçük hava kabarcıklarının genişlemesi nedeniyle oluşur.
Baloncukların içindeki buhar doymuştur. Sıcaklık arttıkça buhar basıncı artar. Sonuç olarak, baloncukların boyutu değişir. Baloncukların hacmi arttıkça onlara etki eden Arşimet kuvveti de artar. Böyle bir kuvvete maruz kaldığında, kabarcıklar suyun yüzeyine doğru yönelmeye başlar. Üst tabakanın kaynama noktasına, yani yüz santigrat dereceye kadar ısınması için zamanı yoksa, su buharının bir kısmı soğur ve aşağı iner. Baloncukların boyutu değişir ve yerçekimi kuvveti onları aşağı doğru zorlar. Daha sıcak su katmanlarına inerek tekrar yüzeye çıkmaya başlarlar. Baloncuklar büyüyüp küçüldükçe, suyun içinde kabarcıklar belirir. ses dalgaları. Bu nedenle kaynamaya başlayan su karakteristik bir ses çıkarır.
Tüm su 100 derecelik bir sıcaklığa ulaştıktan sonra yüzeye ulaşan kabarcıkların küçülmesi durur. Suyun yüzeyine çıkar çıkmaz patlamaya başlarlar. Su buharı sudan çıkmaya başlar. Su belirli bir ses çıkarır.
Kaynama anında sıvı ve buharın sıcaklığı değişmez. Tüm sıvı buharlaşana kadar bir durumda kalır. Bunun nedeni, tüm enerjinin suyu buhara dönüştürmek için harcanmasıdır.
Suyun kaynamaya başladığı sıcaklığa kaynama noktası denir.
Kaynama noktası doğrudan sıvının yüzeyine uygulanan basınca bağlıdır. Bu, doymuş buhar basıncının sıcaklığa bağımlılığı ile açıklanır. Buhar kabarcıkları büyümeye devam ediyor. Büyüme, içindeki doymuş buharın basıncı sıvının basıncını geçene kadar devam eder. Bu basınç, sıvının dış basıncı ile hidrostatik basıncının toplamıdır.
Dış basınç artarsa, kaynama noktası da artacaktır!
Her yetişkin, suyun yüz santigrat dereceye eşit bir sıcaklıkta kaynamaya başladığını bilir. Unutulmamalıdır ki bu kaynama noktası 101 kPa olan normal atmosfer basıncında olacaktır. Basınç artarsa kaynama noktası değişir.
Dış atmosferik basınçta bir azalma ile kaynama noktası düşecektir. Dağlarda su doksan derecede kaynar. Bu nedenle, bu bölgede yaşayan insanların yemek pişirmek için daha fazla zamana ihtiyacı vardır. Ovalarda yaşayanlar yemeklerini çok daha hızlı pişirebilecekler. Düşük bir kaynama noktasında, normal bir yumurtayı kaynatmak imkansızdır, çünkü sıcaklık 100 derecenin altındaysa protein pıhtılaşamaz.
Her sıvının, buharın doyma basıncına bağlı olan kendi kaynama noktası vardır. Buhar doyma basıncı arttıkça kaynama noktası düşer.
Kaynar su, birbirinden farklı dört farklı aşamadan oluşan oldukça karmaşık bir süreçtir:
- İlk aşamada, kabın dibinden küçük hava kabarcıkları yükselir ve kabın duvarlarında bir grup kabarcık belirir.
- Kaynamanın ikinci aşamasında kabarcıkların hacminde bir artış meydana gelir. Zamanla suda oluşan ve yüzeye doğru yönelen kabarcıkların sayısı artmaya başlar. Bu aşamada, su biraz fark edilir bir ses çıkarmaya başlar.
- Üçüncü aşamada, suyun hafif bir şekilde bulanıklaşmasına neden olan büyük bir kabarcık yükselişi başlar ve belirli bir süre sonra su "beyazlaşır". Bu hareket, içinden hızlı bir su akışının aktığı bir yayı andırır. Bu kaynamaya "beyaz anahtar" denir. Bu aşama oldukça kısadır. Ses ise bir arı sürüsünün çıkardığı sese benzer.
- Dördüncü aşamada, sıvının yoğun bir şekilde kaynaması meydana gelir. Suyun yüzeyinde patlamaya başlayan çok sayıda büyük kabarcık belirir. Birkaç dakika sonra su sıçramaya başlar. Sıçramaların görünümü, güçlü bir şekilde kaynamış suyu karakterize eder. Ses keskinleşir, tekdüzelik durur. Gürültü, birbirlerine uçan deli arıları anımsatıyor.