Gaz në të ngurtë. Struktura e trupave të ngurtë, të lëngët dhe të gaztë - Hipermarketi i njohurive
Vendosja e një rendi ideal në rregullimin e atomeve, d.m.th., formimi i një trupi të ngurtë, pengohet nga lëvizjet termike, tipar kryesor që është, siç e dimë, rastësi, çrregullim. Prandaj, në mënyrë që një substancë të jetë në gjendje të ngurtë, temperatura e saj duhet të jetë mjaft e ulët - aq e ulët sa energjia e lëvizjeve termike të jetë më e vogël se energji potenciale ndërveprimet e atomeve.
Një kristal plotësisht ideal, në të cilin të gjithë atomet janë në ekuilibër dhe kanë një energji minimale, trupi mund të jetë vetëm kur zero absolute. Në fakt, të gjitha substancat bëhen të ngurta në shumë më tepër temperaturat e larta. Përjashtimi i vetëm është heliumi, i cili mbetet i lëngshëm edhe në zero absolute, por kjo është për shkak të disa efekteve kuantike, të cilat do t'i diskutojmë shkurtimisht më poshtë.
Një substancë mund të ndryshojë nga një gjendje e lëngshme në një gjendje të ngurtë, si dhe nga një gjendje e gaztë. Në të dyja rastet, një tranzicion i tillë është një kalim nga një gjendje pa simetri në një gjendje në të cilën ekziston simetria (kjo, në çdo rast, i referohet rendit me rreze të gjatë që ekziston në kristale, por nuk ekziston në asnjë lëng ose substanca të gazta) . Prandaj, kalimi në gjendjen e ngurtë duhet të ndodhë papritur, d.m.th., në një temperaturë të caktuar, në ndryshim nga kalimi gaz-lëng, i cili, siç e dimë, gjithashtu mund të ndodhë vazhdimisht.
Konsideroni fillimisht transformimin e lëngut- të ngurta. Procesi i formimit të një trupi të ngurtë gjatë ftohjes së një lëngu është procesi i formimit të kristalit (kristalizimi), (dhe ndodh në një temperaturë të caktuar, temperaturën e kristalizimit ose ngurtësimit. Meqenëse energjia zvogëlohet gjatë një transformimi të tillë, është i shoqeruar me lirimin e energjise ne formen e nxehtesise latente te kristalizimit.Transformimi i kundert eshte duke shkrire - gjithashtu ndodh papritur ne te njejten temperature dhe shoqerohet me thithjen e energjise ne forme
nxehtësia e shkrirjes është e barabartë në madhësi me nxehtësinë e kristalizimit.
Kjo shihet qartë nga grafiku i temperaturës së ftohësit kundrejt kohës së treguar në Fig. 179 (lakorja a). Seksioni 1 i kurbës a jep rrjedhën e një uljeje monotone të temperaturës së lëngut për shkak të heqjes së nxehtësisë prej tij. Seksioni horizontal 2 tregon se në një temperaturë të caktuar, ulja e tij ndalon, pavarësisht se heqja e nxehtësisë vazhdon. Pas një kohe, temperatura fillon të ulet përsëri (seksioni 3). Temperatura që korrespondon me seksionin 2 është temperatura e kristalizimit. Nxehtësia e çliruar gjatë kristalizimit kompenson largimin e nxehtësisë nga substanca dhe për këtë arsye ulja e temperaturës ndalon përkohësisht. Pas përfundimit të procesit të kristalizimit, temperatura, tani e një trupi të ngurtë, përsëri fillon të ulet.
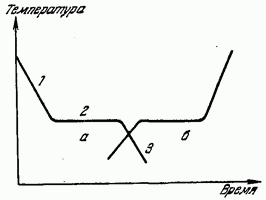
Një kurs i tillë i grafikut të uljes së temperaturës është tipik për trupa kristalorë. Gjatë ftohjes së lëngjeve që nuk kristalizohen (substanca amorfe), nxehtësi latente nuk bie në sy dhe kurba e ftohjes është një kurbë monotonike pa ndalur ftohjen.
Në procesin e kundërt të kalimit të një substance nga gjendje e ngurtë në lëng (shkrirje) në kurbën e ngrohjes, ka gjithashtu një ndalesë në rritjen e temperaturës, për shkak të thithjes së nxehtësisë latente të shkrirjes - nxehtësisë, për shkak të së cilës rrjeta kristalore shkatërrohet (lakorja në Fig. 179 ).
Për të filluar kristalizimin, është e nevojshme prania e një qendre ose qendrash kristalizimi. Qendra të tilla mund të jenë grumbullime të rastësishme të grimcave të lëngshme të ngjitura me njëra-tjetrën, me të cilat mund të bashkohen gjithnjë e më shumë grimca, derisa i gjithë lëngu të shndërrohet në një trup të ngurtë. Sidoqoftë, formimi i akumulimeve të tilla në vetë lëngun pengohet nga lëvizjet termike, të cilat i shkatërrojnë ato edhe para se të kenë kohë për të marrë ndonjë dimension të dukshëm. Kristalizimi lehtësohet shumë nëse grimca të ngurta mjaftueshëm të mëdha në formën e grimcave të pluhurit dhe trupave janë të pranishme në lëng që në fillim, të cilat bëhen qendra kristalizimi.
Formimi i qendrave të kristalizimit në vetë lëngun lehtësohet, natyrisht, me uljen e temperaturës. Prandaj, kristalizimi i një lëngu të pastër, pa formacione të huaja,
zakonisht fillon në një temperaturë disi më të ulët se temperatura e vërtetë e kristalizimit. Në kushte normale, në një lëng kristalizues ka shumë qendra kristalizimi, kështu që shumë kristale rriten së bashku në lëng, dhe substanca e ngurtësuar rezulton të jetë polikristalore.
Vetëm në kushte të veçanta, të cilat zakonisht janë të vështira për t'u siguruar, mund të merret një kristal i vetëm - një kristal i vetëm që rritet nga një qendër e vetme kristalizimi. Nëse, në këtë rast, sigurohen të njëjtat kushte për grumbullimin e grimcave për të gjitha drejtimet, atëherë kristali fitohet i fytyruar saktë sipas vetive të tij simetrike.
Tranzicioni lëng-ngurtë, si dhe transformimi i kundërt, është një tranzicion fazor, pasi gjendja e lëngshme dhe e ngurtë mund të konsiderohen si dy faza të një substance. Të dyja fazat në temperaturën e kristalizimit (shkrirjes) mund të vijnë në kontakt me njëra-tjetrën, duke qenë në ekuilibër (akulli, për shembull, mund të notojë në ujë pa u shkrirë), ashtu si një lëng dhe avulli i tij i ngopur mund të jenë në ekuilibër.
Ashtu si pika e vlimit varet nga presioni, temperatura e kristalizimit (dhe pika e tij ekuivalente e shkrirjes) varet gjithashtu nga presioni, zakonisht duke u rritur me rritjen e presionit. Ajo rritet sepse presioni i jashtëm i bashkon atomet dhe për të shkatërruar rrjetën kristalore gjatë shkrirjes, atomet duhet të largohen nga njëri-tjetri: më shumë presion kjo kërkon një energji më të madhe të lëvizjeve termike, d.m.th., një temperaturë më të lartë.
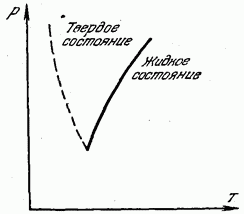
Në fig. 180 tregon një kurbë të temperaturës së shkrirjes (kristalizimit) kundrejt presionit. Kurba e ngurtë e ndan të gjithë rajonin në dy pjesë. Zona në të majtë të kurbës korrespondon me gjendjen e ngurtë, dhe zona në të djathtë të kurbës korrespondon me gjendjen e lëngshme. Çdo pikë që shtrihet në vetë lakoren e shkrirjes korrespondon me ekuilibrin e fazave të ngurta dhe të lëngshme: në këto presione dhe temperatura, substanca në gjendje të lëngët dhe të ngurtë është në ekuilibër, në kontakt me njëra-tjetrën dhe lëngu nuk ngurtësohet. dhe e ngurta nuk shkrihet.
Vija me pika në fig. 180 tregon lakoren e shkrirjes për ato pak substanca (bismut, antimoni, akull, germanium) në të cilat, gjatë ngurtësimit, vëllimi nuk zvogëlohet, por rritet. Të tillë
substancave, natyrisht, pika e shkrirjes zvogëlohet me rritjen e presionit.
Ndryshimi në pikën e shkrirjes lidhet me ndryshimin e presionit nga relacioni Clausius-Clapeyron:
![]()
Këtu është temperatura e shkrirjes (kristalizimit) dhe janë, përkatësisht, vëllimet molare të fazave të lëngëta dhe të ngurta dhe nxehtësia molare e shkrirjes.
Kjo formulë vlen edhe për tranzicione të tjera fazore. Në veçanti, për rastin e avullimit dhe kondensimit, formula Clausius-Clapeyron është nxjerrë në kapitullin. VII [shih (105.6)].
Nga formula Clapeyron-Clausius, shihet se shenja e ndryshimit të temperaturës së shkrirjes me ndryshimin e presionit përcaktohet nga cila nga dy vlerat, ose më shumë. Pjerrësia e kurbës varet gjithashtu nga vlera e nxehtësisë latente të tranzicionit; sa më e ulët të jetë temperatura, aq më pak ndryshon temperatura e shkrirjes me presion. Në tabelë. 20 tregon vlerat e nxehtësisë specifike (d.m.th., për njësi të masës) të shkrirjes për disa substanca.
Tabela 20 (shih skanimin) Nxehtësia specifike shkrirja për disa substanca
Ekuacioni Clausius-Clapeyron mund të shkruhet gjithashtu në këtë formë:
![]()
Ky ekuacion tregon se si presioni nën të cilin ndodhen të dy fazat e ekuilibrit ndryshon me temperaturën.
Një e ngurtë mund të formohet jo vetëm nga kristalizimi i një lëngu, por edhe nga kondensimi i një gazi (avulli) në një kristal, duke anashkaluar fazën e lëngshme. Në këtë rast, lëshohet edhe nxehtësia latente e tranzicionit, e cila, megjithatë, është gjithmonë më e madhe se nxehtësia latente e shkrirjes. Në fund të fundit, formimi i një trupi të ngurtë në një temperaturë dhe presion të caktuar mund të ndodhë si drejtpërdrejt nga gjendja e gaztë, ashtu edhe nga lëngëzimi paraprak, në të dyja
rastet, gjendjet fillestare dhe përfundimtare janë të njëjta. Do të thotë se ndryshimi energjetik i këtyre gjendjeve është i njëjtë. Ndërkohë, në rastin e dytë, së pari, nxehtësia latente e kondensimit çlirohet gjatë kalimit nga gjendja e gaztë në atë të lëngshme dhe së dyti, nxehtësia latente e kristalizimit gjatë kalimit nga gjendja e lëngshme në atë të ngurtë. Nga kjo rrjedh se nxehtësia latente në formimin e drejtpërdrejtë të një trupi të ngurtë nga faza e gaztë duhet të jetë e barabartë me shumën e nxehtësisë së kondensimit dhe kristalizimit nga lëngu. Kjo vlen vetëm për nxehtësinë e matur në pikën e shkrirjes. Në temperatura më të ulëta, nxehtësia e kondensimit nga gazi rritet.
Procesi i kundërt i avullimit të një trupi të ngurtë zakonisht quhet sublimim ose sublimim. Grimcat që avullojnë të një forme të ngurtë formojnë avull mbi të në të njëjtën mënyrë siç ndodh kur një lëng avullon. Në presione dhe temperatura të caktuara, avulli dhe solidi mund të jenë në ekuilibër. Avulli në ekuilibër me një të ngurtë quhet gjithashtu avull i ngopur. Si në rastin e një lëngu, elasticiteti avull i ngopur mbi një lëndë të ngurtë varet nga temperatura, duke u ulur me shpejtësi me uljen e temperaturës, kështu që për shumë lëndë të ngurta në temperatura të zakonshme presioni i avullit të ngopur është i papërfillshëm.
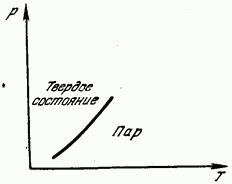
Në fig. 181 tregon lakoren e presionit të avullit të ngopur kundrejt temperaturës. Kjo kurbë është linja e ekuilibrit ndërmjet fazës së ngurtë dhe të gaztë. Rajoni në të majtë të kurbës korrespondon me gjendjen e ngurtë, në të djathtë të saj, me gjendjen e gaztë. Sublimimi, si dhe shkrirja, shoqërohet me shkatërrimin e grilës dhe kërkon shpenzimin e energjisë së nevojshme për këtë. Kjo energji manifestohet si nxehtësi latente e sublimimit (sublimimit), e barabartë, natyrisht, me nxehtësinë latente të kondensimit.Prandaj nxehtësia e sublimimit është e barabartë me shumën e nxehtësisë së shkrirjes dhe avullimit.
Shumica e substancave që mund të qëndrojnë në tre 
gjendjet: të lëngëta, të ngurta dhe të gazta. Këto gjendje quhen gjendje agregate.
 Një substancë kalon nga një gjendje në tjetrën kur nxehet ose ftohet, si dhe kur presioni ndryshon.
Një substancë kalon nga një gjendje në tjetrën kur nxehet ose ftohet, si dhe kur presioni ndryshon.
Ju tashmë e dini se nëse ngrohni ujin në pikën e vlimit, ai do të kthehet në avulli. Kjo do të thotë, do të shkojë në gjendje e gaztë. Ekziston një teori që shpjegon vetitë e të tre gjendjeve.
Quhet kinetike dhe bazohet në pohimin se grimcat lëvizin në përbërjen e materies.
Teoria kinetike.
 Shumica e hipotezave në shkencë nuk pranohen derisa të vërtetohen, por konsiderohen të vërteta vetëm sepse shpjegojnë disa fenomene. Shpjegoni vetitë e ngurtë, të lëngët dhe trupat e gaztë, bazuar në energjinë e grimcave që janë në përbërjen e tyre, jep teoria kinetike. Grimcat e një trupi të ngurtë janë të vendosura shumë afër njëra-tjetrës, janë të lidhura nga forca e tërheqjes dhe nuk mund të çlirohen. Ata luhaten vetëm rreth qendrës. Por sapo të fillojmë të ngrohim trupin, energjia e grimcave të tij do të fillojë të rritet. Kjo është kur ata mund të shkëputen nga njëri-tjetri. Lënda e ngurtë fillon të shkrihet dhe të rrjedhë. Grimcat e gazit kanë edhe më shumë energji dhe ndodhen në një distancë edhe më të madhe nga njëra-tjetra. Ngrohja ju lejon të rrisni energjinë e grimcave, ato lëvizin më shpejt dhe trupi kalon në një tjetër gjendja e grumbullimit.
Shumica e hipotezave në shkencë nuk pranohen derisa të vërtetohen, por konsiderohen të vërteta vetëm sepse shpjegojnë disa fenomene. Shpjegoni vetitë e ngurtë, të lëngët dhe trupat e gaztë, bazuar në energjinë e grimcave që janë në përbërjen e tyre, jep teoria kinetike. Grimcat e një trupi të ngurtë janë të vendosura shumë afër njëra-tjetrës, janë të lidhura nga forca e tërheqjes dhe nuk mund të çlirohen. Ata luhaten vetëm rreth qendrës. Por sapo të fillojmë të ngrohim trupin, energjia e grimcave të tij do të fillojë të rritet. Kjo është kur ata mund të shkëputen nga njëri-tjetri. Lënda e ngurtë fillon të shkrihet dhe të rrjedhë. Grimcat e gazit kanë edhe më shumë energji dhe ndodhen në një distancë edhe më të madhe nga njëra-tjetra. Ngrohja ju lejon të rrisni energjinë e grimcave, ato lëvizin më shpejt dhe trupi kalon në një tjetër gjendja e grumbullimit.
Lëvizja Browniane.
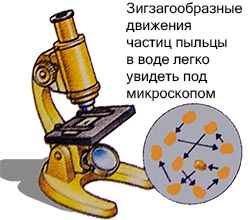 Biologu anglez Robert Brown në vitin 1927 ekzaminoi grimcat e polenit të vendosura në një lëng nën një mikroskop.
Biologu anglez Robert Brown në vitin 1927 ekzaminoi grimcat e polenit të vendosura në një lëng nën një mikroskop.
Ai vuri re se ata po lëviznin në një model zigzag, por ai nuk mund ta shpjegonte këtë.
Kjo lëvizje e rastësishme e molekulave quhet lëvizje browniane. Shpjegimi u dha më vonë nga Albert Einstein.
Ai deklaroi se grimcat e vendosura në një lëng lëvizin për shkak të përplasjes së molekulave gjithashtu lëvizëse, por të padukshme.
 Ndryshimi i shtetit.
Ndryshimi i shtetit.
Me rritjen e temperaturës, energjia e grimcave të trupit rritet dhe arrin pikën e shkrirjes.Pastaj ka një thyerje në lidhjet midis grimcave dhe trupi shkrihet.
Për shembull, parafina nga një qiri. Kur nxehet, rrjedh poshtë, ndërsa ftohet, ngurtësohet përsëri në gjendje të ngurtë.
Me ngrohje të mëtejshme, arrihet pika e vlimit dhe grimcat lirohen plotësisht nga lidhja e ndërsjellë dhe lëngu shndërrohet në avull.
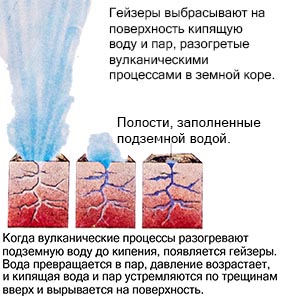 Një shembull është një gejzer, i cili, i nxehur nga proceset vullkanike, nxjerr ujë të valë dhe avull në sipërfaqe. Por kur ftohet, ndodh procesi i kundërt. Gazi kondensohet dhe bëhet një lëng, dhe lëngu, duke u ftohur më tej, ngrin, duke u kthyer në një të ngurtë.
Një shembull është një gejzer, i cili, i nxehur nga proceset vullkanike, nxjerr ujë të valë dhe avull në sipërfaqe. Por kur ftohet, ndodh procesi i kundërt. Gazi kondensohet dhe bëhet një lëng, dhe lëngu, duke u ftohur më tej, ngrin, duke u kthyer në një të ngurtë.
Dioksidi i karbonit mund të ndryshojë nga një gjendje e ngurtë në një gjendje të gaztë, duke anashkaluar gjendjen e lëngshme.
Mungesa e ujit në Mars shpjegohet me presionin e papërfillshëm atmosferik.
Uji aty menjëherë vlon dhe avullohet. Për substanca të ndryshme, kalimi në një gjendje tjetër ndodh në temperatura të ndryshme.
Ju gjithashtu mund të ndryshoni pikën e shkrirjes dhe vlimit duke shtuar pak papastërti në substancë ose duke ndryshuar presionin.
Presionin e atmosferës së tokës e quajmë presion atmosferik.
 |
 |
 Tensioni sipërfaqësor.
Tensioni sipërfaqësor.
Ju patë se si kalimtarët e ujit ecin me qetësi përgjatë sipërfaqes së rezervuarit.
Ata nuk zhyten dhe mund të lëvizin rreth sipërfaqes së ujit sa të duan.
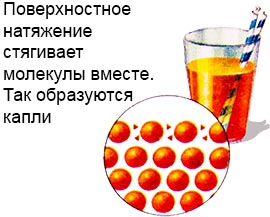 Kjo është e mundur sepse lëngu ka një shtresë tensioni sipërfaqësor.
Kjo është e mundur sepse lëngu ka një shtresë tensioni sipërfaqësor.
Molekulat e kësaj shtrese janë shumë më fort të lidhura sesa në thellësinë e lëngut.
Kjo krijon një lloj filmi në sipërfaqen e lëngut, dhe gjithashtu formon pika.
Dhe pesha e kalimtarit të ujit thjesht nuk mjafton për ta thyer atë.
Avullimi.
 Lëngu avullon vazhdimisht, edhe kur nuk nxehet. Kjo për faktin se energjia e molekulave në shtresën sipërfaqësore është shumë më e madhe dhe kjo lejon që molekulat të shkëputen nga sipërfaqja, domethënë të avullojnë.
Lëngu avullon vazhdimisht, edhe kur nuk nxehet. Kjo për faktin se energjia e molekulave në shtresën sipërfaqësore është shumë më e madhe dhe kjo lejon që molekulat të shkëputen nga sipërfaqja, domethënë të avullojnë.
Ndërsa avullohet, temperatura e lëngut zvogëlohet. Kjo është veçanërisht e vërtetë kur një person djersitet.
Pikat e ujit në lëkurë avullojnë dhe lëkura ftohet.
Gazrat.
 Një gaz është një substancë që nuk ka vëllim ose formë të caktuar. Sipas teorisë kinematike, energjia e molekulave të gazit është e mjaftueshme për të thyer lidhjet dhe, duke fluturuar larg, të mbushë të gjithë vëllimin rreth tyre.
Një gaz është një substancë që nuk ka vëllim ose formë të caktuar. Sipas teorisë kinematike, energjia e molekulave të gazit është e mjaftueshme për të thyer lidhjet dhe, duke fluturuar larg, të mbushë të gjithë vëllimin rreth tyre.
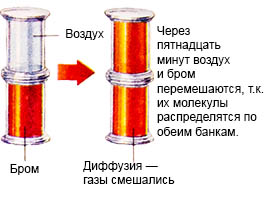
Ky proces quhet difuzion.
Sasia e presionit të gazit varet nga sa fort godasin molekulat e gazit në muret e enës. Nëse, pa ndryshuar temperaturën, vëllimi i gazit zvogëlohet duke zvogëluar vëllimin e enës, atëherë presioni i tij do të rritet, pasi molekulat e gazit do të godasin më shpesh muret e enës.Ose nëse pomponi një pjesë të re të gazit.
Kur nxehet, molekulat e gazit lëvizin më shpejt dhe më tej, gazi zgjerohet dhe bëhet më pak i dendur. Nëse, duke ngrohur një gaz, për të kufizuar vëllimin e tij, atëherë presioni do të fillojë të rritet.
 |
 |
Vëllimi, masa dhe dendësia.
Vëllimi është sasia e hapësirës që zë një trup i lëngshëm ose i ngurtë. Vëllimi matet në metra kub. Për të zbuluar vëllimin e lëngut, duhet ta derdhni në një enë matëse. Vëllimi i një trupi të fortë formën e saktë njihen nga vëllimi i lëngut të zhvendosur prej tij nga ena. Vëllimi i një trupi të ngurtë të formës së saktë - sipas formulës.
Në njërën anë të peshores vendosim trupin që do të peshohet, në anën tjetër - një trup me masë të njohur. Masa e një trupi të ngurtë, të lëngët ose të gaztë na tregon se sa lëndë përmban. Masa matet në kilogramë dhe gram. Është e nevojshme të kuptohet ndryshimi midis masës dhe peshës - madhësia e forcës gravitacionale që vepron në trup.
 |
 |
 Sipas densitetit, ne mund të gjykojmë se sa fort janë "të vendosura" grimcat që përbëjnë trupin. Për shembull, molekulat metalike janë më afër njëra-tjetrës se molekulat e letrës.
Sipas densitetit, ne mund të gjykojmë se sa fort janë "të vendosura" grimcat që përbëjnë trupin. Për shembull, molekulat metalike janë më afër njëra-tjetrës se molekulat e letrës.
Kjo do të thotë se dendësia e metalit është më e lartë. Dendësia llogaritet duke pjesëtuar masën e një trupi me vëllimin e tij dhe matet në kilogramë për metër kub (kg/m3).
Ekziston një pajisje për matjen e densitetit të një lëngu - një hidrometër. Në një lëng të dendur, ai noton afër sipërfaqes, pasi pesha e tij mund të zhvendosë vetëm një vëllim të vogël lëngu.
KOMBINOHET TË DOBISHME ME TË KËNDSHME!
 Ky eksperiment tregon efektin e forcës së tensionit sipërfaqësor. Hidhni kaun e pastër në një tigan dhe shtoni pak pluhur, si talk.
Ky eksperiment tregon efektin e forcës së tensionit sipërfaqësor. Hidhni kaun e pastër në një tigan dhe shtoni pak pluhur, si talk.
Pikoni sapun të lëngshëm në mes. Cfare po ndodh?
Sapuni shkatërron tensioni sipërfaqësor, d.m.th. forca tërheqëse ndërmjet molekulave. Molekulat e vendosura pranë mureve janë të lidhura më fort me njëra-tjetrën, kështu që i gjithë pluhuri në disk është mbledhur në anët.
Lëndët djegëse minerale në koren e tokës janë të përqendruara në formën e akumulimeve të karbonit (thëngjij dhe argjilë të ndryshëm) dhe hidrokarbure (depozita nafte dhe gazi). Në shkencë dhe praktikë, ideja është e vendosur në mënyrë të vendosur që akumulimet e hidrokarbureve me një peshë molekulare prej më shumë se 60 banojnë në koren e tokës në gjendje e lëngshme, dhe ato më të lehta - në gaz.
Sidoqoftë, shkencëtarët sovjetikë Akademik A. A. Trofimuk, Anëtar Korrespondent i Akademisë së Shkencave të BRSS N. V. Chersky, Doktor shkencat teknike F. A. Trebin, Yu. F. Makogon, kandidat i shkencave teknike, dhe V. G. Vasiliev, kandidat i gjeologjisë dhe mineralogjisë kushtet termodinamike kalojnë në koren e tokës në një gjendje të ngurtë dhe formojnë depozitime hidrat gazi, dhe me një përqendrim pakrahasueshëm më të lartë të gazit për njësi vëllimi të mjedisit poroz sesa në depozitat e zakonshme të gazit.
Gazi kalon në një gjendje të ngurtë në koren e tokës, duke u lidhur me ujin e formimit në presione hidrostatike dhe temperatura relativisht të ulëta - deri në +25 °. Studime eksperimentale tregoi se në të njëjtat presione, një depozitë hidrate gazi përmban disa herë më shumë gaz se një depozitim gazi me vëllim të barabartë konvencional, sepse një vëllim uji, kur kalon në gjendje hidratike, lidh deri në 220 vëllime gazi, ndërsa e zakonshme Tretshmëria e gazit në ujë nuk kalon dy deri në katër vëllime, dhe për akullin është edhe më e ulët.
Karakteristikat fizike të një rezervuari hidrat gazi janë shumë të ndryshme nga karakteristikat fizike të një rezervuari gazi konvencional. Përçueshmëria elektrike e një depozite të tillë është shumë më e ulët se ajo e një depozite konvencionale, gjë që bën të mundur zhvillimin e metodave të reja për interpretimin e karakteristikave gjeofizike për të identifikuar depozitat e hidrateve të gazit në koren e tokës, si dhe përdorimin e këtyre vetive për të krijuar të reja. proceset (ndarja e gazit, ruajtja e vëllimeve të mëdha të gazit në presione të ulëta etj.).
Procesi i formimit të një depozite hidrat gazi mund të shoqërohet me një ulje të ndjeshme të presionit të rezervuarit (nën hidrostatik), një reduktim të madhësisë së depozitës dhe në prani të hyrjes së gazit dhe ujit, një rritje të konsiderueshme të rezervave të gazit në depozitën.
Zonat e depozitave të hidrateve të gazit janë të përqendruara kryesisht në zonat e permafrostit dhe zonë e përbashkët, ku mund të gjenden depozita të tilla, është më shumë se 50% e territorit Bashkimi Sovjetik, rreth një e katërta e tokës së planetit tonë dhe më shumë se 90% e oqeaneve.
Një nga studiuesit, kreu i Departamentit të Gjeologjisë në Ministrinë e Industrisë së Gazit të BRSS, V. G. Vasiliev, tha: "Kjo është një rezervë e rëndësishme e gazit natyror që do të shumëfishojë burimet energjetike dhe kimike të vendit tonë. , supozohet se nën fundin e Oqeanit Botëror ka edhe depozita gazi në gjendje.Logjika e arsyetimit të shkencëtarëve është si vijon: fundi i oqeanit është nën presionin e ujit me një presion prej 300-500 atm, dhe në një presioni, temperaturat e ulëta të brendësisë Yakutiane nuk janë më të nevojshme për formimin e hidratit. Meqenëse oqeani mbulon pjesën më të madhe të planetit dhe ngrica e përhershme zë një pjesë të konsiderueshme të tokës, atëherë mund të supozohet se gjendja e ngurtë e gazit nuk është përjashtim, por rregull.
Në çfarë mënyre mund të nxirren hidratet nga nëntoka pa ndërtuar miniera? Studiuesit propozuan transferimin e metanit nga një gjendje e ngurtë në një gjendje të gaztë direkt në rezervuar, dhe më pas "përzgjedhja" e tij duke përdorur puse konvencionale. Ka disa mënyra për ta bërë këtë. Nëse presioni në pus zvogëlohet artificialisht ose temperatura në rezervuar rritet, kjo do të shkaktojë prishjen e hidratit dhe gazi i lirë do të ngrihet përmes tubave. Por më premtuesja, besojnë shkencëtarët, është të veprohet me ujin me një katalizator që përshpejton çlirimin e molekulave të gazit nga kapja e fortë e molekulave të ujit. Përqendrimi i gazit në rezervuar është shumë i lartë dhe kjo forcë titanike duhet të lirohet me kujdes.
A është e mundur sot të flitet për shfrytëzimin industrial të depozitave të hidratit të gazit? Anëtari korrespondues i Akademisë së Shkencave të BRSS N. V. Chersky i përgjigjet kësaj pyetjeje: "Shumë qindra mijëra metra kub gaz të nxjerrë nga formacionet e hidrateve të gazit të fushës Messoyakhskoye në Arktik," thotë ai, "kanë mbërritur tashmë në Minierat Norilsk. dhe Kombinati Metalurgjik. Kostoja e gazit është pothuajse e njëjtë Si zakonisht, tashmë janë zbuluar më shumë se 30 depozita të gazit të ngurtë. Shkencëtarët në Moskë, Novosibirsk dhe Yakutsk po punojnë për problemet e zhvillimit dhe përdorimit racional të tyre."
>>Struktura e trupave të ngurtë, të lëngët dhe të gaztë
Dërguar nga lexuesit nga faqet e internetit
biblioteka e fizikës, mësimet e fizikës, programi i fizikës, përmbledhjet e mësimeve të fizikës, tekstet e fizikës, detyrat e gatshme të shtëpisë
Përmbajtja e mësimit përmbledhje e mësimit mbështetja e prezantimit të mësimit në kuadër të metodave përshpejtuese teknologjitë ndërvepruese Praktikoni detyra dhe ushtrime seminare vetëekzaminimi, trajnime, raste, kërkime pyetje diskutimi për detyra shtëpie pyetje retorike nga nxënësit Ilustrime audio, videoklipe dhe multimedia fotografi, foto grafika, tabela, skema humori, anekdota, shaka, shëmbëlltyra komike, thënie, fjalëkryqe, citate Shtesa abstrakte artikuj patate të skuqura për krevat fëmijësh kureshtar tekste mësimore fjalorth bazë dhe plotësues i termave të tjera Përmirësimi i teksteve dhe mësimevekorrigjimi i gabimeve në tekstin shkollor përditësimi i një fragmenti në tekstin shkollor elementet e inovacionit në mësim duke zëvendësuar njohuritë e vjetruara me të reja Vetëm për mësuesit leksione perfekte plani kalendar për vitin udhëzime programet e diskutimit Mësime të integruaraGjendja e grumbullimit të një lënde zakonisht quhet aftësia e saj për të ruajtur formën dhe vëllimin e saj. Një veçori shtesë janë mënyrat në të cilat një substancë kalon nga një gjendje grumbullimi në një tjetër. Në bazë të kësaj dallohen tri gjendje grumbullimi: të ngurtë, të lëngët dhe të gaztë. Karakteristikat e tyre të dukshme janë si më poshtë:
Një trup i fortë ruan formën dhe vëllimin. Ai mund të kalojë si në një lëng duke shkrirë, ashtu edhe në një gaz direkt me sublimim.
- Lëng - ruan vëllimin, por jo formën, domethënë ka rrjedhshmëri. Lëngu i derdhur tenton të përhapet pafundësisht mbi sipërfaqen mbi të cilën derdhet. Një lëng mund të kalojë në një të ngurtë me anë të kristalizimit dhe në një gaz me avullim.
- Gaz - nuk ruan as formën, as vëllimin. Gazi jashtë çdo kontejneri tenton të zgjerohet pafundësisht në të gjitha drejtimet. Vetëm graviteti mund ta pengojë atë ta bëjë këtë, falë të cilit atmosfera e tokës nuk shpërndahet në hapësirë. Një gaz kalon në një lëng me anë të kondensimit, dhe drejtpërdrejt në një të ngurtë mund të kalojë përmes reshjeve.
Tranzicionet fazore
Kalimi i një substance nga një gjendje grumbullimi në një tjetër quhet kalim fazor, pasi sinonimi shkencor për gjendjen e grumbullimit është faza e materies. Për shembull, uji mund të ekzistojë në një fazë të ngurtë (akulli), të lëngët (ujë të zakonshëm) dhe të gaztë (avull).
Shembulli i ujit gjithashtu demonstron mirë sublimimin. Lavanderia e varur në oborr për t'u tharë në një ditë të ftohtë pa erë ngrin menjëherë, por pas një kohe rezulton të jetë e thatë: akulli sublimohet, duke u shndërruar drejtpërdrejt në avull uji.
Si rregull, kalimi fazor nga i ngurtë në të lëngët dhe gaz kërkon ngrohje, por temperatura e mediumit nuk rritet: energji termale shkon për të thyer lidhjet e brendshme në substancë. Kjo është e ashtuquajtura nxehtësi latente e tranzicionit fazor. Kur anasjelltas tranzicionet fazore(kondensimi, kristalizimi) lirohet kjo nxehtësi.
Kjo është arsyeja pse djegiet me avull janë kaq të rrezikshme. Kur bie në kontakt me lëkurën, ajo kondensohet. Nxehtësia latente e avullimit/kondensimit të ujit është shumë e lartë: në këtë drejtim, uji është një substancë anormale; Kjo është arsyeja pse jeta në Tokë është e mundur. Gjatë një djegie me avull, nxehtësia latente e kondensimit të ujit "përvëlon" vendin e djegur shumë thellë, dhe pasojat e një djegieje me avull janë shumë më të rënda sesa nga një flakë në të njëjtën zonë të trupit.
Pseudofazat
Rrjedhshmëria e fazës së lëngshme të një substance përcaktohet nga viskoziteti i saj, dhe viskoziteti përcaktohet nga natyra e lidhjeve të brendshme, të cilave i kushtohet seksioni tjetër. Viskoziteti i një lëngu mund të jetë shumë i lartë dhe një lëng i tillë mund të rrjedhë në mënyrë të padukshme në sy.
Shembulli klasik është qelqi. Nuk është një lëng i ngurtë, por shumë viskoz. Ju lutemi vini re se fletët e qelqit në magazina nuk ruhen kurrë të mbështetura në mënyrë të pjerrët pas murit. Brenda pak ditësh ato do të varen nën peshën e tyre dhe do të bëhen të papërdorshme.
Shembuj të tjerë të trupave pseudo të ngurtë janë katrani i këpucëve dhe bitumi i ndërtimit. Nëse harroni pjesën këndore të bitumit në çati, gjatë verës ajo do të përhapet në një tortë dhe do të ngjitet në bazë. Trupat pseudo të ngurtë mund të dallohen nga ata realë për nga natyra e shkrirjes: ato reale ose ruajnë formën e tyre derisa të përhapen menjëherë (bashkohen kur bashkohen), ose notojnë, duke lëshuar pellgje dhe përrenj (akulli). Dhe lëngjet shumë viskoze zbuten gradualisht, si e njëjta katran ose bitum.
Lëngjet jashtëzakonisht viskoze, rrjedhshmëria e të cilave nuk është e dukshme për shumë vite dhe dekada, janë plastikë. Aftësia e tyre e lartë për të ruajtur formën e tyre sigurohet nga pesha e madhe molekulare e polimereve, mijëra e miliona atome hidrogjeni.
Struktura e fazave të materies
Në fazën e gazit, molekulat ose atomet e një substance janë shumë larg njëra-tjetrës, shumë herë më e madhe se distanca ndërmjet tyre. Ata ndërveprojnë me njëri-tjetrin herë pas here dhe në mënyrë të parregullt, vetëm gjatë përplasjeve. Vetë ndërveprimi është elastik: ata u përplasën si topa të fortë dhe u shpërndanë menjëherë.
Në një lëng, molekulat/atomet vazhdimisht "ndiejnë" njëra-tjetrën për shkak të lidhjeve shumë të dobëta të natyrës kimike. Këto lidhje thyhen gjatë gjithë kohës dhe rivendosen menjëherë përsëri, molekulat e lëngut lëvizin vazhdimisht në lidhje me njëra-tjetrën, dhe për këtë arsye lëngu rrjedh. Por për ta kthyer atë në gaz, duhet të thyeni të gjitha lidhjet menjëherë dhe kjo kërkon shumë energji, prandaj lëngu ruan vëllimin e tij.
Në këtë drejtim, uji ndryshon nga substancat e tjera në atë që molekulat e tij në një lëng janë të lidhura me të ashtuquajturat lidhje hidrogjeni, të cilat janë mjaft të forta. Prandaj, uji mund të jetë një lëng në një temperaturë normale për jetën. Shumë substanca me një peshë molekulare dhjetëra e qindra herë më të madhe se ajo e ujit, në kushte normale, janë gazra, si të paktën gazi i zakonshëm shtëpiak.
Në një të ngurtë, të gjitha molekulat e tij janë fort në vend për shkak të fortë lidhjet kimike mes tyre, duke formuar një rrjetë kristali. Kristalet e formës së duhur kërkojnë kushte të veçanta për rritjen e tyre dhe për këtë arsye gjenden rrallë në natyrë. Shumica e trupave të ngurtë janë konglomerate të kristaleve të vegjël dhe të vegjël - kristalit, të lidhur fort nga forcat e natyrës mekanike dhe elektrike.
Nëse lexuesi ka parë, për shembull, një gjysmë bosht të plasaritur të një makine ose një grilë prej gize, atëherë kokrrat e kristaliteve në skrap janë të dukshme me një sy të thjeshtë. Dhe në fragmente të enëve prej porcelani të thyer ose faience, ato mund të vërehen nën një xham zmadhues.
Plazma
Fizikanët dallojnë gjithashtu gjendjen e katërt agregate të materies - plazmën. Në një plazmë, elektronet shkëputen nga bërthamat atomike, dhe është një përzierje e grimcave të ngarkuara elektrike. Plazma mund të jetë shumë e dendur. Për shembull, një centimetër kub plazma nga brendësia e yjeve xhuxh të bardhë peshon dhjetëra e qindra tonë.
Plazma është e izoluar në një gjendje të veçantë grumbullimi sepse ndërvepron në mënyrë aktive me fusha elektromagnetike sepse grimcat e tij janë të ngarkuara. AT hapesire e lire plazma tenton të zgjerohet, ftohet dhe kthehet në gaz. Por nën ndikimin e fushave elektromagnetike, ai mund të ruajë formën dhe vëllimin e tij jashtë enës, si një trup i ngurtë. Kjo veti e plazmës përdoret në reaktorët e energjisë termonukleare - prototipet e termocentraleve të së ardhmes.






