Struktura dhe vetitë energjetike të kristaleve të ngurta
Sipas aftësisë për të kryer elektricitet Të gjitha materialet e ngurta zakonisht ndahen në përçues, gjysmëpërçues dhe dielektrikë. A klasifikohen materialet përçuese si përçues? > 10 6 Ohm -1 cm -1; këto përfshijnë metale në të cilat përçueshmëri e lartë sigurohet nga një përqendrim i lartë i elektroneve përçuese. Në dielektrikët në temperaturën e dhomës, ka shumë pak elektrone, dhe përçueshmëria e tyre është e ulët?< 10 -10 Ом -1 см -1 . В промежуточную группу попадают полупроводники, которые могут иметь концентрацию электронов, близкую к нулю (тогда они являются диэлектриками) и близкую к концентрации электронов в металле (тогда они являются проводниками).
Metalet dhe gjysmëpërçuesit, përveç që kanë përçueshmëri të ndryshme elektrike, ndryshojnë edhe në varësinë e përçueshmërisë elektrike nga temperatura. Në metale, përçueshmëria elektrike, si rregull, zvogëlohet pothuajse në mënyrë lineare me rritjen e temperaturës. Në gjysmëpërçuesit, në të cilët nuk ka defekte dhe papastërti (ato zakonisht quhen të brendshme), me rritjen e temperaturës, përçueshmëria rritet afërsisht sipas një ligji eksponencial:
Për të marrë parasysh strukturën dhe vetitë e energjisë kristalore të ngurta, të cilat përfshijnë silikon dhe germanium (gjysmëpërçuesit që përdoren më gjerësisht për prodhimin e pajisjeve gjysmëpërçuese), së pari duhet t'i drejtoheni vetive energjetike të një atomi të vetëm.
Një atom përbëhet nga një bërthamë rreth së cilës lëvizin elektronet, duke krijuar një shtresë elektronike. Total ngarkesë negative balancat e elektroneve ngarkesë pozitive bërthama, kështu që në gjendje normale atomi është elektrikisht neutral. Sipas teoria kuantike, elektronet e një atomi mund të kenë vetëm vlera të përcaktuara rreptësisht të energjisë, të quajtura ato të lejuara. Këto vlera të energjisë quhen nivele të energjisë. Nivelet e energjisë së elektroneve ndahen nga njëri-tjetri me intervale të ndaluara. Duke lëvizur rreth bërthamës në orbita të caktuara, elektronet hiqen nga bërthama në distanca të ndryshme dhe, në përputhje me rrethanat, kanë vlera të ndryshme energjetike: sa më larg nga bërthama, aq më e madhe është energjia e elektronit dhe aq më e dobët lidhet me bërthamën.
elektronet e shtresës së jashtme guaskë elektronike quajtur valencë. Ata kanë energjinë më të lartë dhe janë më pak të lidhur me bërthamën. Grafikisht, spektri i energjisë i elektroneve në një atom të vetëm mund të përfaqësohet si një diagram energjie. Një shembull i një diagrami të tillë është paraqitur në Fig. 1.1, a. Vlerat e energjisë vizatohen përgjatë vertikale, dhe nivelet përkatëse të energjisë tregohen si vija horizontale. Në përputhje me parimin Pauli, jo më shumë se dy elektrone mund të jenë njëkohësisht në të njëjtin nivel energjetik, duke pasur drejtime të ndryshme rrotullimi rreth boshtit të tyre (rrotullimet e kundërta).
Nëse atomi është në gjendje normale dhe nuk thith energji nga jashtë, atëherë të gjitha nivelet më të ulëta të lejuara të energjisë janë të zëna nga elektronet; kalimi i një elektroni nga një nivel në tjetrin është i pamundur. Nivelet më të larta të lejuara mbeten të papushtuara nga elektronet dhe quhen të lira. Kalimi i një elektroni në një nivel më të lartë të energjisë së lirë, d.m.th. në një orbitë më të largët nga bërthama, është e mundur vetëm kur thith nga jashtë një pjesë (kuantike) të përcaktuar rreptësisht të energjisë (termike, dritë, elektrike, magnetike), e barabartë me diferencën në vlerat e energjisë së lirë. dhe nivelet e zëna nga ky elektron. Në këtë rast, atomi kalon në një gjendje të ngacmuar.
Gjendja e ngacmuar e një atomi është shumë e paqëndrueshme. Zgjat vetëm njëqind e milionta e sekondës dhe atomi kthehet në gjendjen e tij normale, e cila shoqërohet me kalimin e elektronit përsëri në nivelin e tij të mëparshëm të energjisë. Kalimi i një atomi nga një gjendje e ngacmuar në një gjendje normale shoqërohet me çlirimin e energjisë së tepërt në formën e një kuantike rrezatimi elektromagnetik.
Nëse elektroni merr një sasi të mjaftueshme të energjisë, ai shkëputet nga atomi, atomi jonizohet: ajo ndahet në një elektron të lirë dhe një jon pozitiv. Procesi i kundërt është bashkimi i një elektroni të lirë dhe jon pozitiv në një atom neutral - quhet rikombinim dhe shoqërohet me çlirimin e energjisë së tepërt në formën e një kuantike rrezatimi. Energjia e liruar është e barabartë me energjinë e shpenzuar më parë për jonizimin e atomit.
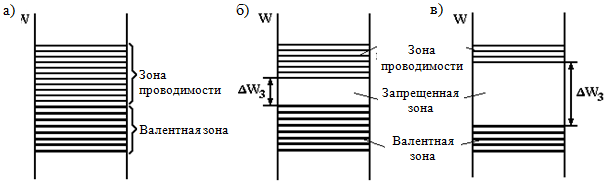
Gjatë formimit të kristaleve të një trupi të ngurtë, ndodh një ndërveprim midis atomeve, si rezultat i të cilit nivelet e lejuara të energjisë së atomeve individuale ndahen në nënnivele N, duke formuar zona energjetike (Fig. 1.1, b). Në këtë rast, si në një atom të vetëm, nuk mund të ketë më shumë se dy elektrone me rrotullime të kundërta në një nivel energjie (parimi Pauli ruhet). Meqenëse numri i nënniveleve (N) është i madh (në 1 cm 3 të një trupi të ngurtë ka rreth 10 22 - 10 23 atome), distanca e energjisë midis nënniveleve është shumë e vogël dhe elektroni është në gjendje të lëvizë nga nënniveli në nënnivel. nga fundi i zonës deri në tavan edhe me ndikime të vogla të jashtme të energjisë, d.m.th. ai sillet si njeri i lirë. Megjithatë, kjo është e vërtetë vetëm nëse nivelet e sipërme të energjisë në zonë nuk janë të zëna, d.m.th. zona nuk është e mbushur plotësisht.
Nivelet e energjisë së një atomi individual, të zënë nga elektronet në një temperaturë prej zero absolute (T = 0 K), formojnë zona të mbushura në kristal, pjesa e sipërme e të cilave, e zënë elektronet e valencës, quhet brezi i valencës.
Lejohen nivele më të larta të energjisë të një atomi që nuk është i zënë nga elektronet në
T = 0 K, formoni zona të lira në kristal. Brezi i lirë më afër brezit të valencës quhet brezi i përcjelljes, pasi elektronet që kanë arritur atje mund të lëvizin midis atomeve dhe të krijojnë një rrymë elektrike. Elektronet në zonën e mbushur nuk mund të lëvizin nën veprimin e fushës (dhe, në përputhje me rrethanat, fitojnë energji), pasi të gjitha nivelet e energjisë janë të zëna, dhe sipas parimit Pauli, një elektron nuk mund të lëvizë nga një gjendje e pushtuar në një gjendje të pushtuar. Prandaj, elektronet e një brezi valence të mbushur plotësisht nuk marrin pjesë në krijimin e përçueshmërisë elektrike.
Midis brezit të përcjelljes dhe brezit të valencës ekziston një hendek brezi Eg (ai matet në elektron volt (eV)), në të cilin, sipas ligjeve të mekanikës kuantike, elektronet nuk mund të jenë (ashtu siç nuk mund të kenë elektronet në një atom energjitë që nuk korrespondojnë me energjitë e predhave elektronike). Hendeku i brezit është parametri kryesor që përcakton vetitë elektrike trup i fortë.
Sipas natyrës së mbushjes së zonave me elektrone, të gjithë trupat mund të ndahen në dy grupe të mëdha:
- te grupi i parë përfshijnë trupat në të cilët një zonë e mbushur vetëm pjesërisht ndodhet mbi zonat e mbushura plotësisht (Fig. 1.2, a). Kjo zonë ndodh kur niveli atomik, nga e cila është formuar, nuk është e mbushur plotësisht në atom. Prania e një zone të mbushur vetëm pjesërisht është e natyrshme tek metalet. Metalet nuk kanë hendek brezi;
- te grupi i dytë përfshijnë trupat në të cilët zonat e lira ndodhen mbi zona të mbushura plotësisht (Fig. 1.2, b, c). Shembuj tipikë të trupave të tillë janë elementet kimike Grupi IV i tabelës periodike: karboni në modifikimin e diamantit, silikonit, germaniumit dhe kallajit gri, i cili ka strukturën e diamantit. Ky grup trupash përfshin shumë komponime kimike - oksidet metalike, nitridet, karbidet, halogjenët. metale alkali etj.
Sipas gjerësisë së zonës së ndaluar, trupat e grupit të dytë ndahen me kusht në dielektrikë dhe gjysmëpërçues. për të dielektrike përfshijnë trupa me një brez relativisht të gjerë. Për dielektrikët tipikë, E g > 3 eV. Kështu, për diamantin E g = 5,2 eV; për nitridin e borit E g = 4,6 eV; për A1 2 O 3 E g \u003d 7 eV, etj.
për të gjysmëpërçuesit përfshijnë trupa që kanë një hendek brezi relativisht të ngushtë (Fig. 1.2, b). Për gjysmëpërçuesit tipikë, Eg ? 1 eV, për shembull:
- për germanium E g = 0,72 eV;
- silikoni ka E g = 1,12 eV;
- për antimonid indium E g = 0,17 eV;
- për arsenidin e galiumit E g = 1,43 eV, etj.
Diagramet energjetike të metaleve, gjysmëpërçuesve dhe dielektrikëve në
T = 0 K janë paraqitur në Fig. 1.2. Në këto diagrame, brezi i valencës, i cili është i mbushur me elektrone, tregohet me vija të forta më të trasha, dhe brezi i përcjelljes, në të cilin nuk ka elektrone në këto kushte, me vija të holla.
Përgjigjet e kolokiumit №2 në fizikë.
Nivelet e energjisë së atomeve dhe molekulave. Kalimet kuantike në atome dhe molekula. Thithja dhe emetimi i energjisë nga atomet dhe molekulat, spektri i përthithjes dhe emetimit.
Nivelet e energjisë elektronike në një atom Elektronet në gjendje të pangacmuar mbushin energjinë më të ulët. nivelet, dhe nivelet e sipërme janë falas. Nëse një atom merr energji si rezultat i një përplasjeje me atome të tjera ose duke thithur një sasi drite, atëherë ai kalon në një gjendje të ngacmuar dhe çdo elektron i atomit shkon nga niveli më i ulët në një nga ato të sipërme. Pas një periudhe të shkurtër kohe, ai kthehet në nivelin më të ulët, duke lëshuar një sasi drite të një frekuence të caktuar.
Molekulat përbëhen nga atome që ndërveprojnë, lëvizja intramolekulare është më e ndërlikuar sesa intraatomike. Në një molekulë, përveç lëvizjes së elektroneve në lidhje me bërthamat, lëvizje lëkundëse atomet rreth pozicionit të tyre të ekuilibrit dhe lëvizjes rrotulluese të molekulës në tërësi. Lëvizja elektronike, vibruese dhe rrotulluese e një molekule korrespondon me tre lloje të niveleve të energjisë: Ngjala, Ekol, Heb. Energjia totale e molekulës është: E=Ngjala+Eur+Ecol. Sipas mekanikës kuantike, energjia vibruese dhe rrotulluese e molekulave, si dhe energjia elektronike, kanë karakter kuantik, d.m.th. ndryshojnë në mënyrë diskrete. Distanca midis niveleve të dridhjeve është shumë më e vogël se midis atyre elektronike. Prandaj, çdo nivel elektronik i një molekule ndahet në një numër nivelesh vibruese (nënnivele). Nga ana tjetër, çdo nivel vibrues i molekulës korrespondon me një numër nënnivele rrotulluese, distanca midis të cilave është edhe më e vogël se midis niveleve vibruese.
Energjia e palëvizshme. gjendja: asnjë energji nuk emetohet apo absorbohet. Në tranzicionet kuantike, atomet dhe molekulat kërcen nga një gjendje e palëvizshme në tjetrën, nga një niveli i energjisë një tjetër. Kjo është për shkak të tranzicionit energjetik të elektroneve.
Kur lëviz nga nivelet më të larta të energjisë në ato më të ulëta, një atom ose molekulë lëshon energji, përndryshe thithet. Një atom në gjendjen e tij bazë mund të thithë vetëm energji.
Energjia e emetuar nga atomet ose molekulat formon spektrin e emetimit dhe energjia e absorbuar formon spektrin e absorbimit.
Në kalimi i një elektroni në një atom energjia lirohet ose absorbohet në formën e një kuantike të rrezatimit EM. Spektrat e emetimit dhe përthithjes atomike janë të ngjashme me vijën.
Tranzicioni në molekula:
Si rezultat i faktit që nivelet elektronike në një molekulë ndahen në nënnivele vibruese dhe rrotulluese, numri i tranzicionet e energjisë rritet ndjeshëm në krahasim me atomet. Prandaj, spektrat molekularë bëhen më të ndërlikuar, ato kanë një karakter të vazhdueshëm.
∆E >>∆Epol.> ∆Eur.
∆Ee ~ 1-3 EV λ~ 0,5 μV
∆Epol. ~ 10 -2 -10 -1 EP λ~1-100mkV
∆Heb. ~ 10 3 -10 -5 V λ~100-1000mkV
thithjen e energjisë së një molekule
2- rrezatimi i energjisë së një atomi në një molekulë
Spektrat e ndriçimit, emetimit dhe absorbimit, rregulli i Stokes. Përdorimi i luminescencës në biofizikë dhe mjekësi.
Lumineshencë- rrezatimi, i cili është një tepricë mbi rrezatimin termik në një temperaturë të caktuar dhe që ka një periudhë t (10 -15) më të madhe se periudha e valës së dritës. Lumineshenca ndodh në çdo temperaturë. Substancat ndriçuese shkëlqejnë pa ngrohje. Nuk është kurrë e balancuar.
Sipas llojit të ngacmimit, luminescenca është:
1) Fotolumineshencë - ngacmim nga drita;
2) Elektrolumineshencë - ngacmim fushe elektrike;
3) Kimilumineshencë (ngacmim me anë të një reaksioni kimik).
Ndikimi i këtyre burimeve çon në ngacmimin e atomeve, molekulave ose joneve të substancës lumineshente. Rrezatimi ndodh si rezultat i kalimeve kuantike të grimcave të materies nga gjendjet e ngacmuara në tokë (ose më pak të ngacmuara)
Sipas kohëzgjatjes së shkëlqimit, fotolumineshenca ndahet në:
Fluoreshenca - shkëlqim afatshkurtër
Fosforeshenca - një shkëlqim relativisht i gjatë pas

Spektri i lumineshencës është i vazhdueshëm.
Karakteristikat themelore të lumineshencës.
1) rendimenti kuantik:
ζ= 100% N(emetim)/N(thithje),
ku N (rrezatimi) është numri i kuanteve që dhanë dritë,
N(absorb) – numri i kuanteve të absorbuara.
2) D është dendësia optike e kampionit.
D=lgI 0 /I λ =Esl, ku E është indeksi i përthithjes molekulare
3) D= f(λ ) është spektri i përthithjes
I λ = f(λ ) është spektri i emetimit
Rregulli i Stokes:
Spektri i absorbimit të një substance të caktuar zhvendoset në lidhje me spektrin e emetimit drejt gjatësive të valëve më të shkurtra.
Përdorimi i luminescencës në biofizikë dhe mjekësi:
Fotolumineshenca:
Zbulimi i fazës fillestare të prishjes së ushqimit
Renditja e preparateve farmakologjike
Diagnoza e disa sëmundjeve (shkëlqimi i flokëve, luspave, thonjve kur diagnostikohet dëmtimi i tyre nga një kërpudhat ose liken)
Në bazë të fotolumineshencës, janë krijuar burime drite, spektri i të cilave është më i ngjashëm me dritën e ditës sesa ai i llambave inkandeshente (llambat fluoreshente).
Kimilumineshencë - aplikim në diagnostifikim
Përdorimi i molekulave të veçanta fluoreshente të shtuara në sistemet e membranës nga jashtë. Molekula të tilla quhen sonda ose etiketa fluoreshente. Ndryshimi i tyre bën të mundur zbulimin e rirregullimeve konformacionale në proteinat në membrana.
emetim i induktuar. Popullata e kundërt e niveleve. Gjeneratorë kuantikë optikë (lazer). Vetitë rrezatimi lazer dhe përdorimi i tij në mjekësi.
emetim i stimuluarështë kalimi i detyruar i grimcës së ngacmuar në nivelin më të ulët. Në këtë rast, numri i kalimeve në sekondë varet nga numri i fotoneve që hyjnë në substancë gjatë së njëjtës kohë, d.m.th. nga intensiteti i dritës. Për më tepër, tranzicionet e detyruara do të përcaktohen nga popullsia e shteteve energjetike përkatëse. përmbysja e popullsisë- një gjendje e tillë e mjedisit në të cilën numri i grimcave në një nga nivelet e sipërme është më i madh se chm në nivelin më të ulët. Popullsia e kundërt e niveleve sigurohet nga fakti se elektronet mund të qëndrojnë në nivelin metastabil 10 -5 herë më shumë se në nivelin e ngacmuar.
Vv 1960 i pari gjenerator kuantik i gamës së dukshme të rrezatimit - lazer me rubin si lëndë pune. Krijon rrezatim pulsues me një gjatësi vale prej 694.3 nm.
Parimi i funksionimit të lazerit është i ngjashëm me luminescencën.
![]()
![]()
Al 2 O 3 + Cr 2 O 3 - rubin
Vetitë e rrezatimit lazer
Rrezatimi lazer është gjithmonë monokromatik
Polarizimi
Rrezet nuk ndryshojnë, rreptësisht paralele
Mund të merrni intensitet shumë të lartë.
Aplikimi me lazer:
Identifikimi i ADN-së dhe proteinave.
Oftalmologjia
Trajtimi i ulcerave trofike, tumoreve malinje
Lazerët që funksionojnë në mënyrë të vazhdueshme përdoren për operacione në organe të furnizuara me bollëk.
Rrezatimi me rreze X: karakteristik dhe bremsstrahlung; mekanizmi i rrezatimit, spektri i rrezeve X karakteristike dhe bremsstrahlung.
rrezatimi me rreze xështë një valë elektromagnetike në intervalin nga 80 deri në 10 -4 nm. Rrezatimi me rreze X me valë të gjatë mbivendoset nga rrezatimi UV me valë të shkurtër, rrezatimi γ i valës së shkurtër me valën e gjatë. Sipas metodës së ngacmimit, rrezatimi me rreze X ndahet në bremsstrahlung dhe karakteristik
frenimRe- rrezatimi.
Rrezatimi që ndodh kur një elektron ngadalësohet në materialin e anodës quhet rreze X bremsstrahlung. Kur elektronet ngadalësohen, vetëm një pjesë e energjisë shkon për të krijuar një foton, pjesa tjetër shpenzohet për ngrohjen e anodës. Meqenëse raporti midis këtyre pjesëve është i rastësishëm, kur një numër i madh elektronesh ngadalësohen, formohet një spektër i vazhdueshëm i rrezatimit me rreze x.
Spektri Bremsstrahlung: (1) - në tensione të ndryshme në tub me rreze x)
Fluksi i rrezeve X matet me formulën:
Ф=КUа-кIZ 2), ku U, I - tensioni dhe rryma në tubin me rreze X, Z - numri serik i substancës atomike të anodës, k=10 -9 V -1 - - koeficienti i proporcionalitetit.
Ф=- λ min ˜ ∫Ф λ d λ
Nëse temperatura e filamentit të katodës rritet, atëherë emetimi i elektroneve dhe rryma në tub do të rriten. Kjo do të rrisë numrin e fotoneve me rreze X të emetuara çdo sekondë. Por përbërja e tij spektrale nuk ndryshon.
2) Rrezatimi karakteristik me rreze x.
Rritja e tensionit në tubin me rreze X çon në faktin se në sfondin e një spektri të vazhdueshëm, shfaqet një linjë, e cila korrespondon me rrezatimin karakteristik të rrezeve X. Elektronet e përshpejtuara nga një tension i lartë depërtojnë thellë në atom dhe nxjerrin elektronet jashtë shtresave të tij të brendshme. Elektronet nga nivelet e sipërme kalojnë në vende të lira, si rezultat i të cilave emetohen fotone të rrezatimit karakteristik.
Spektri karakteristik i rrezeve X atomi nuk varet nga komponimi kimik në të cilin përfshihet ky atom. Spektri:
Ndërveprimi i rrezeve X me lëndën (shpërndarja koherente, efekti fotoelektrik, efekti Compton). Ligji i zbutjes së intensitetit të rrezeve X. Mbrojtja me rreze X.
Ndërveprimi i rrezatimit me rreze X me lëndën
1)
Shpërndarje koherente– shpërndarja e rrezeve X me gjatësi vale të gjatë Gjendja: hn hn 1 = hn 2, ku n është frekuenca. 2)
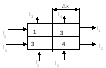
efekt fotoelektrik. hn≥A dhe. Në këtë rast, kuanti i rrezeve X absorbohet dhe elektroni shkëputet nga atomi. Elektroni i shkëputur fiton energjia kinetike. Nëse është i madh, atëherë elektroni mund të jonizojë atomet fqinje me përplasje. heqja e një elektroni - procesi i jonizimit hn \u003d Eion + m 0 v 2 / 2 3) Efekti Compton hn>>Ai. Në këtë rast, elektroni shkëputet nga atomi dhe fiton njëfarë energjie kinetike. Energjia e vetë fotonit zvogëlohet. Se. si rezultat i shpërndarjes jokoherente (efekti Compton), formohet rrezatimi sekondar i shpërndarë dhe ndodh jonizimi i atomeve të materies. hn \u003d Eion + mv 2 / 2 + hn Ligji i zbutjes së intensitetit të rrezeve X: Ix \u003d I 0 e -µx µ=µ p +µ p kontributi i çdo termi të procesit përcaktohet nga energjia e fotonit. efekt fotoelektrik Efekti Compton 6. Pajisja e tubit të rrezeve X dhe aparatit të rrezeve X. Ngurtësia dhe intensiteti i rrezatimit, rregullimi i tyre. Metoda për marrjen e rrezeve X. Përdorimi i rrezeve X në mjekësi. Pajisja e tubit me rreze X: Tubi është një balonë qelqi (ndoshta me vakum të lartë), me dy elektroda: një anodë dhe një katodë, në të cilën aplikohet një tension i lartë. Katoda është burimi i elektroneve. Anoda është një shufër metalike sipërfaqe e pjerrët në mënyrë që të drejtojë rrezet x që dalin në një kënd me boshtin e tubit. Nën veprimin e tensionit të lartë, elektronet e emetuara nga filamenti i nxehtë i katodës përshpejtohen në energji të lartë. Energjia kinetike e fituar nga një elektron është e barabartë me punën e forcave elektrike dhe është proporcionale me tensionin midis katodës dhe anodës. Rrezatimi me rreze X lind si rezultat i ngadalësimit intensiv të elektroneve të shpejta në materialin anodë pas përplasjes me atomet e tij (ndërveprim me një fushë elektrike bërthama atomike dhe elektronet). Uа-к≈100∙10 3 V λmin= hc/ eUa-k 1) Rrezet X me gjatësi vale të shkurtër zakonisht kanë një fuqi më të madhe depërtuese se ato me gjatësi vale të gjatë dhe quhen e fortë dhe e butë me valë të gjatë. Rrezatimi i butë absorbohet më fort nga materia. Rritja e tensionit në tubin me rreze x, ndryshon përbërjen spektrale të rrezatimit dhe rrit ngurtësinë. Marrja e rrezeve X. Nëse në rrugën e rrezeve X vendoset një trup johomogjen dhe përballë tij vendoset një ekran fluoreshent, atëherë ky trup, duke thithur ose zbutur rrezatimin, formon një hije në ekran. Nga natyra e kësaj hijeje, mund të gjykohet forma, dendësia, struktura dhe në shumë raste natyra e trupave. ato. një ndryshim i rëndësishëm në thithjen e rrezatimit me rreze x nga inde të ndryshme ju lejon të shihni imazhin e organeve të brendshme në projeksionin e hijes. µ1<µ2
I 2 < aplikimi i rrezatimit me rreze X në mjekësi: Diagnostifikimi me rreze X: 1) Fluoroskopia (tubi me rreze X ndodhet prapa pacientit. Para tij është vendosur një ekran fluoreshent. Në ekran vërehet një imazh hije (pozitiv)). 2) radiografia (objekti vendoset në një kasetë në të cilën futet një film me një emulsion të veçantë fotografik. Tubi i rrezeve X ndodhet sipër objektit. Radiografia që rezulton jep një imazh negativ, d.m.th të kundërtën në kontrast me foton. vërehet gjatë transmetimit.Në këtë metodë ka një qartësi më të madhe të imazhit Një variant premtues i kësaj metode është tomografia me rreze X dhe tomografia e kompjuterizuar). 3) Fluorografi 4) Terapia me rreze X - përdorimi i rrezeve X për të shkatërruar tumoret malinje. 7. Parimi i tomografisë me rreze X. Tomografi me rreze X. Pajisja e tij. Cilat janë ndryshimet kryesore midis një tomogrami me rreze x dhe një rreze x? 1) Rithithja μ - koeficienti i përthithjes, vetia e indeve 2) Ri-studimi Ia \u003d I 0 e -µ x 1 Iv \u003d I 0 e -µ2 x 2 Iv \u003d I 0 e -µ1x1 e -µ2x2 \u003d I 0 e - (µ1x1 + µ2x2) Qëllimi i diagnozës. Përcaktoni µ3 dhe ∆µ3 lnI1/I 0 = -(µ1+µ2)∆х lnI2/I 0 = -(µ3+µ4)∆х lnI3/I 0 = -(µ3+µ1)∆х lnI4/I 0 = -(µ4+µ2)∆х I 0 - set I1,I2,I3,I4 - i matur (i njohur) ∆x - grup (i njohur) gjeni µ1µ2µ3µ4 duke zgjidhur një sistem prej 4 ekuacionesh 2048∙2048= 4194304 Sistemi i teoremave të Radonit Nëse marr një numër të pafund imazhesh të një objekti, atëherë është e mundur ta rivendosni atë me çdo saktësi. Zgjidhje teknike. faza: matjet I1,I2,I3,I4… faza: ndërtimi i një imazhi Për secilën vlerë të µ, PC cakton ndriçimin (ngjyrën) e vet. 1 fetë - 1 sekondë Kontrasti ∆µ/µ=0,1% (nga 10%) Trashësia e shtresës - 1-2 mm Kufiri i rezolucionit 0.2 mm Me tomografi është e mundur të merret një imazh i trupit me rreze X me shtresa me detaje më pak se 2 mm. Kjo ju lejon të bëni dallimin midis lëndës gri dhe të bardhë të trurit dhe të shihni qeliza tumorale shumë të vogla. arsimimi 8. Llojet e rrezatimit jonizues. Veprimi i rrezatimit jonizues mbi materien. Dozat e absorbuara, ekspozimi dhe biologjike (ekuivalente), marrëdhënia ndërmjet tyre. Njësitë e dozave në sistemin SI dhe njësitë josistematike të përdorura në mjekësi. Në procesin e rrezatimit të fenomenit të radioaktivitetit, u zbuluan 3 lloje rrezesh të emetuara nga bërthamat radioaktive. Kalbja alfa konsiston në transformimin spontan të bërthamës me emetimin e grimcave α (bërthama e heliumit). A Z X → A-4 Z -2 Y+ 4 2 Gjatë kalbjes α, bërthama e bijës mund të formohet në një gjendje të ngacmuar. Në këtë rast, energjia e bërthamës së ngacmuar më së shpeshti lëshohet në formën e një -kuantike. Prandaj, zbërthimi alfa shoqërohet me rrezatim . beta prishje konsiston në shndërrimin spontan të bërthamës me emetimin e elektroneve (ose pozitroneve). A Z X→ A Z +1 Y + 0 -1 β +ν Ku ν është përcaktimi i grimcës antineutrino. Një elektron formohet si rezultat i transformimit intranuklear të një neutroni në një proton. Rrezatimi gama ka natyrë elektromagnetike dhe është një foton me gjatësi vale λ≤10 -10 m Rrezatimi i këtij lloji shoqëron jo vetëm -prishjen, por edhe reaksione bërthamore më komplekse. Ndërveprimi me materien: Një grimcë e ngarkuar që kalon nëpër materie humbet energjinë e saj për shkak të zvarritjes së jonizimit. Në të njëjtën kohë, energjia e saj kinetike shpenzohet për ngacmimin dhe jonizimin e atomeve të mjedisit.Për të karakterizuar në mënyrë sasiore bashkëveprimin e një grimce të ngarkuar me një substancë, përdoren këto sasi: dendësia lineare e jonizimit, i, numri i çifteve të joneve të formuara për njësi shteg të grimcës: i=dn/dl fuqia ndaluese lineare e një substance (S) është energjia e humbur nga një grimcë e ngarkuar për njësi shteg: S=dE/dl diapazoni mesatar linear i një grimce jonizuese të ngarkuar (R) është distanca midis fillimit dhe fundit të diapazonit të grimcave në një substancë të caktuar. Karakteristikat karakteristike të bashkëveprimit të llojeve të ndryshme të rrezatimit me lëndën: Rrezatimi alfa: Ndërsa grimca alfa lëviz në mjedis, unë së pari rritet (me një ulje të shpejtësisë, koha që kalon pranë molekulës së mediumit rritet, kështu që probabiliteti i jonizimit rritet), dhe në fund të xhiros (x = R ) zvogëlohet ndjeshëm, gjë që shoqërohet me një ulje të shpejtësisë së lëvizjes. Kur energjia e grimcave bëhet më e vogël se energjia e nevojshme për jonizimin, formimi i joneve ndalon. Grafiku i varësisë së densitetit linear të jonizimit nga shtegu i përshkuar nga grimca alfa në mjedis: Jonizimi dhe ngacmimi janë procese parësore. Dytësore: rritja e shpejtësisë së lëvizjes termike molekulare, rrezatimi karakteristik me rreze X, radiolumineshenca, proceset kimike. Rrezatimi beta. Shkakton jonizimin, ngacmimin, rrezatimin me rreze X (kur elektronet ngadalësohen), rrezatimi karakteristik Cherenkov, kur shpejtësia e një elektroni në një mjedis tejkalon shpejtësinë e dritës në këtë medium. Rrezatimi gama shkakton një jonizimi të lehtë primar, shpërndarje koherente dhe jokoherente, një efekt fotoelektrik jonizues, formimin e çifteve elektron-pozitron, reaksione fotonukleare për shkak të bashkëveprimit të një kuantike me një bërthamë. Doza e absorbuar (D)
-
një vlerë e barabartë me raportin e energjisë ∆E të transferuar në elementin e substancës së rrezatuar me masën m të këtij elementi: D=∆E /m. Në C, njësia e dozës së absorbuar është gri (Gy). 1 Gy i korrespondon dozës së rrezatimit në të cilën energjia e rrezatimit jonizues prej 1 J bartet në substancën e rrezatuar që peshon 1 kg Njësi josistematike 1rad=10 -2 Gy Doza e ekspozimit rrezatimi (X) karakterizon efektin jonizues të rrezeve X dhe rrezatimit γ në ajrin që rrethon trupin e rrezatuar. Njësia SI e dozës së ekspozimit është C/kg. Njësia SI e dozës së ekspozimit është C/kg. 1C/kg korrespondon me dozën e ekspozimit të rrezatimit foton, në të cilin, si rezultat i jonizimit të 1 kg ajri të thatë (n.c.), formohen jone me ngarkesë 1C të secilës shenjë. Njësia e normës së dozës së ekspozimit është 1A/kg dhe njësia jashtë sistemit është 1R/s. Meqenëse doza e rrezatimit është proporcionale me rrezatimin jonizues të rënë, duhet të ketë një marrëdhënie proporcionale midis dozave të rrezatuara dhe të ekspozimit: D=fХ, ku f është një koeficient i caktuar kalimi në varësi të substancës së rrezatuar dhe energjisë së fotonit. Doza ekuivalente - (N) përdoret për të vlerësuar efektin e rrezatimit jonizues në objektet biologjike; ka të njëjtin dimension me dozën e rrezatimit të absorbuar, por emri është i ndryshëm. Në SI: Sievert [Sv], 1Sv=1J/kg Njësia jashtë sistemit: 1ber=10 -2 Sv. Ekziston një lidhje midis ekspozimit dhe dozave të absorbuara: H=KD, ku K është faktori i cilësisë (tregon sa herë efektiviteti i veprimit biologjik të këtij lloji rrezatimi është më i madh se ai i rrezatimit foton, me të njëjtën dozë rrezatimi në inde). 9. norma e dozës. Marrëdhënia midis shkallës së dozës së ekspozimit dhe aktivitetit të një preparati radioaktiv. Norma e dozësështë vlera që përcakton dozën e marrë nga objekti për njësi të kohës. Me efekt uniform të rrezatimit, shpejtësia e dozës N numerikisht është e barabartë me raportin e dozës D me kohën t, gjatë së cilës ka vepruar rrezatimi jonizues: N=D/t. Njësia e shkallës së dozës së rrezatimit është gri (Gy), e cila korrespondon me dozën e rrezatimit në të cilën energjia e rrezatimit jonizues prej 1J transferohet në një substancë të rrezatuar që peshon 1 kg; Shpejtësia e dozës së rrezatimit shprehet në Gy/sek. Njësia josistematike e dozës së rrezatimit është rad (1 rad=10 -2 Gy=100erg/g), fuqia e tij është rad për sekondë. Doza e ekspozimit të rrezatimit (X) karakterizon efektin jonizues të rrezeve X dhe rrezatimit γ në ajrin që rrethon trupin e rrezatuar. Njësia SI e dozës së ekspozimit është C/kg. 1C/kg korrespondon me dozën e ekspozimit të rrezatimit foton, në të cilin, si rezultat i jonizimit të 1 kg ajri të thatë (n.c.), formohen jone me ngarkesë 1C të secilës shenjë. Njësia e normës së dozës së ekspozimit është 1A/kg dhe njësia jashtë sistemit është 1R/s. Meqenëse doza e rrezatimit është proporcionale me rrezatimin jonizues të rënë, duhet të ketë një marrëdhënie proporcionale midis dozave të rrezatuara dhe të ekspozimit: D=fХ, ku f është një koeficient i caktuar kalimi në varësi të substancës së rrezatuar dhe energjisë së fotonit. Për ujin dhe indet e buta të njeriut, f=1, pra, doza e rrezatimit në rad është numerikisht e barabartë me dozën korresponduese të ekspozimit në rentgen. Marrëdhënia midis shkallës së dozës së ekspozimit dhe aktivitetit të preparatit radioaktiv: Nga burimi, γ-fotonet fluturojnë në të gjitha drejtimet. Numri i këtyre fotoneve që depërtojnë 1 m 2 të sipërfaqes së një sfere të caktuar në 1 s është proporcional me aktivitetin A dhe në përpjesëtim të zhdrejtë me sipërfaqen e sferës (4πr 2) / Shkalla e dozës së ekspozimit (X / t) në vëllimi V varet nga numri i fotoneve, pasi janë ata që shkaktojnë jonizimin: X /t=k γ A/r 2 Ku k γ - që është tipike për radionuklidin e dhënë. 10. Ligji i zbërthimit radioaktiv (përfundim). Grafik ligjor. radioaktiviteti artificial. Etiketuar metoda e atomit, aplikimi në mjekësi. zbërthimi radioaktivështë një fenomen statistikor. Lërini bërthamat dN të prishen në një interval të shkurtër kohor dt. Ky numër është proporcional me intervalin kohor dt, si dhe me numrin e përgjithshëm N të bërthamave radioaktive: dN=-λNdt, ku λ është konstanta e zbërthimit, e cila është proporcionale me probabilitetin e zbërthimit të një bërthame radioaktive t, e cila është e ndryshme për bërthama të ndryshme radioaktive, zvogëlohet me kalimin e kohës. Ne integrojmë shprehjen që rezulton dhe marrim lnN/N 0 =-λt. N= N 0 e - λt . Ky është ligji bazë i zbërthimit radioaktiv: për një periudhë të barabartë kohore, i njëjti fraksion i numrit fillestar të bërthamave prishet. Proceset e zbërthimit radioaktiv për dy substanca λ1>λ2. Detyra numër 1.
Cilat pjesë të një qelize bimore janë të dukshme nën një mikroskop të shkollës së lehtë?
1. Ribozomet 2. Mitokondri 3. Muri qelizor 4. Membrana plazmatike Shpjegim: pjesë të mëdha të qelizave janë të dukshme nën një mikroskop drite. Nga ato të paraqitura, një organelë kaq e madhe është muri qelizor (është mjaft i trashë), dhe membrana plazmatike është e vështirë të izolohet vizualisht (me një rritje të vogël) nga muri qelizor. Përgjigja e saktë është 3. Detyra numër 2.
Një fragment i një molekule të ADN-së, i përbërë nga 12 nukleotide, ruan informacione rreth
1. 4 aminoacide në një molekulë proteine 2. 16 nukleotide të një molekule tARN 3. 12 aminoacide molekula mARN 4. 24 nukleotide molekula rARN Shpjegim: Tre nukleotide të një molekule të ADN-së kodojnë për një aminoacid (kjo strukturë quhet treshe), kështu që 12 nukleotide të ADN-së kodojnë 4 aminoacide në një molekulë proteine. Përgjigja e saktë është 1. Detyra numër 3.
Kalimi i elektroneve në një nivel më të lartë të energjisë ndodh në fazën e dritës në molekula
1. Klorofil 2. Uji 3. Glukoza 4. Dioksidi i karbonit Shpjegim: gjatë fotosintezës, është molekula e klorofilit që kalon në një gjendje të ngacmuar, pasi është nga pigmenti që zinxhiri i reaksioneve biokimike fillon gjatë fotosintezës. Përgjigja e saktë është 1. Detyra numër 4.
Gjatë zhvillimit individual të një kafshe, një organizëm shumëqelizor zhvillohet nga një zigot
1. Mejoza 2. Mitoza 3. Filogjene 4. Gametogjeneza Shpjegim: pas formimit të një zigoti, zigota fillon të ndahet pikërisht nga mitoza (ky është procesi i ndarjes së qelizave somatike), domethënë, nga një qelizë diploide formohen dy qeliza diploide: dy nga një qelizë, 4 nga dy, 8 nga katër, etj. Përgjigja e saktë është 2. Detyra numër 5.
E veçanta e riprodhimit aseksual është se nga zhvillohet një organizëm i ri
1. Gametë mashkullore 2. Vezë e pafertilizuar 3. Zigotet me një grup të dyfishtë kromozomesh 4. Qelizë somatike me një grup të dyfishtë kromozomesh Shpjegim: riprodhimi aseksual nuk shoqërohet me qelizat germinale, prandaj, nga opsionet e paraqitura të përgjigjes, riprodhimi aseksual është i mundur vetëm kur organizmi zhvillohet nga një qelizë somatike me një grup të dyfishtë kromozomesh. Me riprodhimin vegjetativ fitohet një organizëm bijë, identik me prindin. Përgjigja e saktë është 4. Detyra numër 6.
Përcaktoni modelin e mbarështimit nëse dihet se kur një domate me fruta të rrumbullakët, gjenotipi i së cilës nuk dihet, kryqëzohet me një domate në formë dardhe (tipar recesiv), 50% e pasardhësve kanë fruta në formë dardhe. 1. AA x aa 2. Aa x aa 3. Aa x Aa 4. AA x AA Shpjegim: 50% e pasardhësve do të kenë fruta në formë dardhe vetëm nëse një heterozigot kryqëzohet me një homozigot për një tipar recesiv - Aa x aa. Përgjigja e saktë është 2. Detyra numër 7.
Divergjenca e pavarur e kromozomeve homologe në mejozë është shkaku i ndryshueshmërisë
1. Gjenomik 2. Kombinative 3. Kromozomale 4. Citoplazmike Shpjegim: ndryshueshmëria kombinuese - ndryshueshmëria që ndodh kur gjenet prindërore rikombinohen. Arsyet mund të jenë shkelje në: kalimi në metafazën e mejozës, divergjenca e kromozomeve në mejozë, shkrirja e qelizave germinale. Përgjigja e saktë është 2. Detyra numër 8.
N.I. Vavilov, duke studiuar tiparet e trashëgimisë së tipareve të bimëve të kultivuara, vërtetoi ligjin 1. Seritë homologe në ndryshueshmërinë trashëgimore 2. Trashëgimia e pavarur e gjeneve jo alelike 3. Dominimi i hibrideve të gjeneratës së parë 4. Trashëgimia e lidhur me seksin Shpjegim: N.I. Vavilov formuloi ligjin e serive homologjike, i cili është si vijon: për shkak të ngjashmërisë së madhe të gjenotipeve të tyre (grupe pothuajse identike të gjeneve), speciet e lidhura ngushtë kanë ndryshueshmëri të ngjashme të mundshme trashëgimore (mutacione të ngjashme të gjeneve identike); me heqjen evolucionare-filogjenetike të grupeve të studiuara (taksat), për shkak të ndryshimeve gjenotipike të shfaqura, paralelizmi i ndryshueshmërisë trashëgimore bëhet më pak i plotë. Rrjedhimisht, baza e paralelizmave në ndryshueshmërinë trashëgimore janë mutacionet e gjeneve homologe dhe rajoneve gjenotipike në përfaqësuesit e taksave të ndryshme, domethënë ndryshueshmëria trashëgimore vërtet homologe. Megjithatë, edhe brenda së njëjtës specie, karakteret e jashtme të ngjashme mund të shkaktohen nga mutacione në gjene të ndryshme; mutacione të tilla paralele fenotipike të gjeneve të ndryshme, natyrisht, mund të ndodhin edhe në specie të ndryshme, por mjaft të lidhura ngushtë. Përgjigja e saktë është 1. Detyra numër 9.
Mbretëria e baktereve përfshin
1. Klamidomonas 2. E. coli 3. Infusoria-këpucë 4. Plazmodiumi i malaries Shpjegim: klamidomonas, shapka ciliate dhe plazmodiumi i malaries janë protozoa, dhe Escherichia coli ( Escherichia coli - bakteri. Përgjigja e saktë është 2. Detyra numër 10.
Zhardhok, llambë është
1. Organet e frymëmarrjes së tokës 2. Fidanet e modifikuara 3. Organet gjeneruese 4. Fidanet rudimentare Shpjegim: zhardhok dhe llamba (si dhe, për shembull, rizoma) janë fidane të modifikuara. Përgjigja e saktë është 2. Detyra numër 11.
Ferns, ndryshe nga bimët lulëzuar, riprodhohen nga
1. Mosmarrëveshje 2. Rrënjët 3. Rizoma 4. Lulëzimi Shpjegim: bimët me lule shumohen me fara, ndërsa fierët me spore. Përgjigja e saktë është 1. Detyra numër 12.
Çfarë klase kanë artropodët sy të thjeshtë dhe katër palë këmbë në këmbë?
1. Insektet 2. Cefalopodët 3. Butak 4. Arachnids Shpjegim: shikoni foton dhe nxirrni përfundimin se përgjigjja e saktë është 4. Detyra numër 13.
Një normë e lartë metabolike lejon zogjtë
1. Kujdesuni për pasardhësit 2. Vendosni vezët në fole 3. Hani ushqime bimore 4. Shpenzoni shumë energji gjatë fluturimit Shpjegim: një normë e lartë metabolike është një nga përshtatjet për fluturimin, ndaj zgjedhim të shpenzojmë shumë energji gjatë fluturimit. Përgjigja e saktë është 4. Detyra numër 14.
Nëse një person vuan nga anemia, atëherë në gjakun e tij, në krahasim me normën, përmbajtja e
1. Leukocitet 2. Qelizat e kuqe të gjakut 3. Trombocitet 4. Fibrinogjen Shpjegim: anemia (një emër tjetër - anemi) shprehet në një përmbajtje të reduktuar të qelizave të kuqe të gjakut - eritrociteve dhe / ose hemoglobinës. Simptomat e sëmundjes: marramendje, lodhje e shtuar etj. për shkak të furnizimit të pamjaftueshëm të qelizave me oksigjen. Përgjigja e saktë është 2. Detyra numër 15.
Ndarja kryesore e karbohidrateve komplekse në trupin e njeriut ndodh në
1. Zgavra e gojës nën veprimin e enzimës së pështymës 2. Zgavrat gastrike nën veprimin e enzimës pepsinë 3. Qelizat e mëlçisë që ruajnë glikogjenin 4. Qelizat e pankreasit që prodhojnë hormone Shpjegim: një enzimë e prodhuar në stomak dhe zgavrën me gojë - amilaza fillon zbërthimin e karbohidrateve komplekse - polimereve në zgavrën me gojë. Përgjigja e saktë është 1. Detyra numër 16.
Funksioni i shkatërrimit të mikroorganizmave të huaj në gjakun e njeriut kryhet nga
1. Neuronet 2. Qelizat e kuqe të gjakut 3. Qelizat epiteliale 4. Limfocitet Shpjegim: limfocitet janë qeliza imuniteti, domethënë ata luftojnë mikroorganizmat e huaj në gjakun e njeriut. Përgjigja e saktë është 4. Detyra numër 17.
Ndikimi i dritës së muzgut shndërrohet nga analizuesi vizual i njeriut në impulse nervore
1. Thjerrëza e syrit 2. Bëbëza e irisit 3. Shkopinj të retinës 4. Sklera e kokës së syrit Shpjegim: receptorët që perceptojnë sinjalet e dritës në muzg dhe errësirë janë shufrat e retinës. Prej tyre, sinjali transmetohet në sistemin nervor qendror. Përgjigja e saktë është 3. Detyra numër 18.
Thyerja e një gjymtyre të thyer
1. Redukton gjakderdhjen 2. Redukton edemën e gjymtyrëve 3. Parandalon depërtimin e mikroorganizmave në vendin e thyerjes 4. Parandalon zhvendosjen e kockave të thyera Shpjegim: një splint vendoset në gjymtyrën e thyer për të parandaluar zhvendosjen e kockave. Përgjigja e saktë është 4. Detyra numër 19.
Roli krijues i seleksionimit natyror manifestohet në
1. Forcimi i luftës intraspecifike 2. Zhvillimi i habitateve të reja nga organizmat 3. Shfaqja e mutacioneve të reja 4. Shfaqja e specieve të reja Shpjegim: seleksionimi natyror është një nga forcat lëvizëse të evolucionit. Qëllimi i evolucionit është krijimi i specieve më të përshtatura në kushte të caktuara, prandaj roli krijues i seleksionimit natyror manifestohet edhe në krijimin e specieve të reja. Përgjigja e saktë është 4. Detyra numër 20.
Në shkencën moderne biologjike, një popullsi konsiderohet të jetë
1. Tërësia e organizmave të një mbretërie 2. Individët që formojnë një zinxhir ushqimor 3. Individë të llojeve të ndryshme që formojnë një biocenozë 4. Individë të së njëjtës specie që jetojnë në të njëjtin territor Shpjegim: popullatë - një grup individësh të së njëjtës specie që jetojnë në të njëjtin territor dhe ndërthuren lirisht. Përgjigja e saktë është 4. Detyra numër 21.
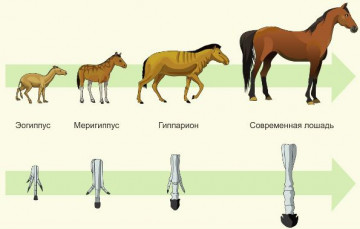
Seria filogjenetike e kalit dëshmon për (rreth)
1. Kthyeshmëria e procesit të evolucionit 2. Kthimi i rregullt në format stërgjyshore 3. Ngjashmëria e zhvillimit postembrional të organizmave 4. Zhvillimi historik i pamjes moderne Shpjegim: Merrni parasysh serinë filogjenetike të kalit. Siç mund të shihet nga fotografia, seria filogjenetike e një specie është një gjurmim i fazave të zhvillimit të tij historik. Përgjigja e saktë është 4. Detyra numër 22.
Cili nga shembujt e mëposhtëm ilustron marrëdhënien konkurruese midis organizmave?
1. Ketri - qukapiku 2. Lisi - kërpudha e bardhë 3. Lopë - shirit demi 4. Tashmë - një bretkocë Detyra numër 23.
Si rezultat i marrëdhënieve biotike afatgjatë, vihet re grabitqar-pre në biocenozën natyrore
1. Rritje e parregulluar e numrit të grabitqarëve 2. Luhatje e rregullt në bollëkun e të dy grupeve të organizmave 3. Akumulimi i aleleve mutant në grupin e gjeneve të viktimave 4. Manifestimi i tipareve dominuese në një popullatë grabitqarësh Shpjegim: me një marrëdhënie afatgjatë grabitqar-pre, ruhet një numër konstant i këtyre dy specieve, por për shkak të ndryshimeve në kushtet mjedisore, ndodhin valët e popullsisë dhe ato shuhen gradualisht nga qëndrueshmëria e këtij sistemi (d.m.th., një sistem i tillë është mjaft e qëndrueshme). Përgjigja e saktë është 2. Detyra numër 24.
Falë materies së gjallë në biosferë, qarkullimi i substancave
1. Hap 2. Përfshin shumë elementë kimikë 3. Rrit diversitetin e agrocenozave në Tokë 4. Siguron akumulimin e gazeve inerte në atmosferë Shpjegim: falë organizmave të gjallë (dhe veçanërisht mikroorganizmave), në natyrë ekzistojnë cikle të shumë elementeve (dhe substancave komplekse - dioksidi i karbonit, uji), si: karboni, hidrogjeni, oksigjeni, squfuri dhe shumë të tjera. të tjerët dhe madje edhe hekuri. Përgjigja e saktë është 2. Detyra numër 25.
A janë të sakta pohimet e mëposhtme për format e seleksionimit natyror?
A. Përzgjedhja stabilizuese manifestohet në kushtet e një ndryshimi të papritur të përbërjes gjinore të popullatës.
B. Përzgjedhja e drejtimit të mjetit kontribuon në një rritje të numrit të individëve me një vlerë mesatare të tiparit.
1. Vetëm A është e vërtetë 2. Vetëm B është e vërtetë 3. Të dy gjykimet janë të sakta 4. Të dy gjykimet janë të gabuara Shpjegim: përzgjedhja stabilizuese funksionon vetëm në kushte konstante mjedisore dhe ruan individët me një vlerë mesatare të tiparit, A - e pasaktë. Përzgjedhja e drejtimit mban individët me devijime nga vlera mesatare e tiparit, B - e pasaktë. Përgjigja e saktë është 4. Detyra numër 26.
Gjatë spermatogjenezës
1. Formohen qelizat seksuale mashkullore 2. Formohen qelizat somatike 3. Përgjysmimi i numrit të kromozomeve 4. Formohen katër gamete 5. Formohet një vezë 6. Formohen qeliza me një grup kromozomesh diploid Shpjegim: spermatogjeneza - procesi i formimit të qelizave germinale mashkullore, ndërsa nga qeliza pararendëse (diploide) formohen katër qeliza germinale haploide (domethënë grupi kromozomik përgjysmohet). Përgjigja e saktë është 1, 3, 4. Detyra numër 27.
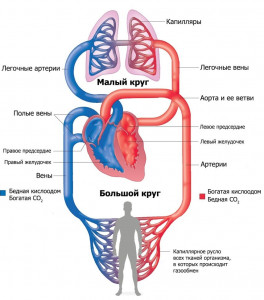
Qarkullimi sistemik në trupin e njeriut
1. Fillon në barkushen e majtë 2. E ka origjinën në barkushen e djathtë 3. I ngopur me oksigjen në alveolat e mushkërive 4. Furnizon organet dhe indet me oksigjen dhe lëndë ushqyese 5. Përfundon në atriumin e djathtë 6. Sjell gjak në anën e majtë të zemrës Shpjegim: Merrni parasysh qarkullimin sistemik. Siç shihet nga figura, një rreth i madh e ka origjinën në barkushen e majtë dhe çon gjakun (oksigjen, hormone, etj.) në të gjitha qelizat e trupit, dhe dioksidi i karbonit e merr atë nga qelizat dhe e çon përsëri në zemër. domethënë, në atriumin e djathtë. Përgjigja e saktë është 1, 4, 5. Detyra numër 28.
Proceset që çojnë në formimin e specieve të reja në natyrë përfshijnë
1. Ndarja e qelizave mitotike 2. Procesi i mutacionit i ngjashëm me kërcimin 3. Ndryshueshmëria e modifikimit 4. Izolimi gjeografik 5. Riprodhimi aseksual i individëve 6. Përzgjedhja natyrore Shpjegim: mutacione të ndryshme çojnë në formimin e specieve të reja (kjo paraprihet nga grumbullimi dhe shpërndarja e tyre në të gjithë popullatën), izolimi gjeografik (në mungesë të riprodhimit me individë të popullatave të tjera mund të shfaqet një specie e re) dhe seleksionimi natyror është një proces i drejtuar gjatë të cilit më të përshtaturit mbijetojnë një organizëm dhe, më pas, formohet një specie që është përshtatur maksimalisht me kushtet e dhëna mjedisore. Përgjigja e saktë është 2, 4, 6. Detyra numër 29.
Vendosni një korrespondencë midis karakteristikave të ushqimit autotrofik dhe llojit të tij.
Lloji karakteristik i të ushqyerit autotrofik A. Përdoret energjia e oksidimit 1. Fotosinteza substancat inorganike 2. Kemosinteza B. Burimi i energjisë - rrezet e diellit B. Kryhet në qelizat bimore D. Ndodh oksidimi i amoniakut D. Oksigjeni lëshohet në atmosferë Shpjegim: fotosinteza është procesi i shndërrimit të energjisë së Diellit në energji të lidhjeve kimike, që kryhet nga fototrofet. Kemosinteza është procesi i shndërrimit të substancave inorganike në substanca organike duke përdorur energjinë e oksidimit të përbërjeve kimike. Prandaj, fotosinteza i referohet: burimi i energjisë është rrezet e diellit, procesi ndodh në qelizat bimore dhe lëshimi i oksigjenit në atmosferë. Dy dispozitat e mbetura i referohen kemosintezës. Përgjigja e saktë është 21121. Detyra numër 30.
Vendosni një korrespodencë midis karakteristikës dhe mbretërisë së organizmave.
Mbretëria karakteristike e organizmave A. Muri qelizor përmban kitinë 1. Kërpudha B. Lloji i të ushqyerit autotrofik 2. Bimët B. Formoni substanca organike nga inorganike D. Lënda ushqyese rezervë është niseshteja. D. Në sistemet natyrore janë dekompozues E. Trupi përbëhet nga miceli Shpjegim: përbërja e murit qelizor të kërpudhave përfshin kitin, ato janë heterotrofe (d.m.th., ata konsumojnë substanca organike të gatshme) dhe dekompozues (zbërthejnë substancat organike në ato inorganike), trupi i tyre përbëhet nga miceli. Bimët janë autotrofe (nga substancat inorganike formojnë substanca organike, niseshteja është substanca rezervë. Përgjigja e saktë është 122211. Detyra numër 31.
Vendosni një korrespondencë midis shenjës së rregullimit të funksioneve në trupin e njeriut dhe mekanizmit të tij.
Shenja Mekanizmi i rregullimit A. Kryhet nga sistemi endokrin 1. Nervoz B. Hormonet e përhapura 2. Humorale B. Dorëzuar në organe me anë të gjakut D. Shpejtësia e ekspozimit është shumë e lartë D. Bazuar në dukuritë bioelektrike Shpjegim: rregullimi nervor - rregullimi me ndihmën e sistemit nervor, domethënë kryhet përgjatë proceseve të qelizave nervore (me ndihmën e impulseve elektrike), shpejtësia e një rregullimi të tillë është shumë e lartë. Rregullimi humoral (hormonal) - rregullimi me ndihmën e substancave biologjikisht aktive - hormone që u dërgohen organeve nga gjaku dhe prodhohen nga gjëndrat e sistemit endokrin. Përgjigja e saktë është 22211. Detyra numër 32.
Vendosni një korrespodencë midis llojit të organizmave dhe drejtimit të evolucionit që është karakteristik për të.
Speciet Drejtimi i evolucionit A. Miu gri 1. Progresi biologjik B. Leopardi i borës 2. Regresioni biologjik B. Tigri Amur G. Bar gruri zvarritës Kali i D. Przewalski E. luleradhiqe e zakonshme Shpjegim: progresi biologjik - një rritje në aftësinë fizike të individëve, e shoqëruar me një rritje të numrit, zgjerimin e gamës dhe ndryshueshmërinë ndërspecifike. Regresioni biologjik - një rënie në aftësinë fizike të individëve, e shoqëruar me një ulje të numrit, një rënie në gamë dhe zhdukje të mëtejshme të specieve. Zvogëlimi i numrit është tipik për leopardin e borës, tigrin Amur dhe kalin Przewalski. Përgjigja e saktë është 122121. Detyra numër 33.
Tregoni sekuencën e proceseve të speciacionit gjeografik.
1. Shpërndarja e një tipari në një popullatë 2. Shfaqja e mutacioneve në kushtet e reja të jetesës 3. Izolimi hapësinor i popullatave 4. Përzgjedhja e individëve me modifikime të dobishme 5. Formimi i një specie të re Shpjegim: speciacioni fillon me izolim, në kushte të tilla fillojnë të shfaqen mutacione, ndër të cilat zgjidhen vetëm ato të dobishme, pastaj këto mutacione të dobishme përhapen në të gjithë individët e popullatës. Speciacioni gjeografik përfundon, gjë që është logjike, me formimin e një specie të re. Përgjigja e saktë është 32415. Detyra numër 34.
Cili është qëllimi i përdorimit të kërpudhave maja në pjekjen e bukës dhe produkteve të bukës? Çfarë procesi zhvillohet? Shpjegim: gjatë pjekjes së bukës përdoret maja, pasi majaja kryen fermentim (frymëmarrje pa oksigjen), duke lëshuar dioksid karboni, i cili ndihmon në ngritjen e brumit (në brumë formohen flluska), i cili më pas i jep brumit shkëlqim. Detyra numër 35.
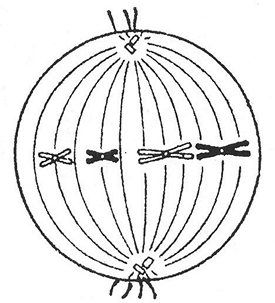
Çfarë ndarje dhe çfarë faze është paraqitur në figurë? Tregoni grupin e kromozomeve (n), numrin e molekulave (s) të ADN-së në këtë periudhë. Arsyetoni përgjigjen. Shpjegim: në figurë, çiftet e kromozomeve homologe janë rreshtuar në ekuatorin e qelizës dhe janë gati për të devijuar (d.m.th., kjo është periudha para anafazës 1), dhe para anafazës 1, metafaza 1. Kjo do të thotë se diploidi vendoset në qeliza është 2n (pasi shohim çifte kromozomesh), dhe numri i molekulave të ADN-së - 4c, pasi secili kromozom përbëhet nga dy kromatide (d.m.th., dy molekula ADN). Detyra numër 36.
Gjeni gabimet në tekstin e dhënë. Tregoni numrin e fjalive në të cilat janë bërë gabime, korrigjoni ato.
1. Mitokondritë dhe plastidet janë organele me dy membrana. 2. Pigmentet fotosensitive ndodhen në membranën e brendshme të mitokondrive dhe plastideve. 3. Ndryshe nga plastidet, mitokondritë përmbajnë molekulën e tyre rrethore të acidit nukleik. 4. Procesi i fotosintezës zhvillohet në kloroplaste. 5. Funksioni kryesor i mitokondrive është sinteza e lipideve qelizore. Shpjegim: 2 - nuk ka pigmente në membranën mitokondriale (pasi ato nuk kryejnë procesin e fotosintezës). 3 - plastidet përmbajnë gjithashtu acidin e tyre nukleik. 5 - funksioni kryesor i mitokondrive është sinteza e ATP (molekula e energjisë universale), dhe jo lipidet. Detyra numër 37.
Si është rregullimi neurohumoral i ndarjes së lëngut gastrik në trupin e njeriut? Shpjegoni përgjigjen. Shpjegim: rregullimi nervor kryhet në dy mënyra: 1. Me ndihmën e reflekseve të kushtëzuara: me shikimin e një limoni (apo ushqimit në përgjithësi) ose zhurmës së tenxhereve në gojë fillon të lëshohet pështyma, pra trupi. përgatitet për të ngrënë duke çliruar enzima. 2. Me acarim të receptorëve të zgavrës së gojës dhe stomakut, pra me ndihmën e reflekseve të pakushtëzuara. Rregullimi i humorit kryhet vetëm kur lëndët ushqyese hyjnë në gjak gjatë përthithjes. Hormonet fillojnë të çlirohen dhe të barten në qelizat e trupit. Detyra numër 38.
Specifikoni cilat kritere të tipit tregohen në tekst.
Të gjithë individët e specieve të hardhucave të shkathëta kanë të njëjtin kariotip. Tek meshkujt e hardhucës së shpejtë, ngjyra e trupit është e gjelbër, ndërsa tek femrat është kafe. Këto kafshë janë më të shumta në zonat tropikale dhe subtropikale të globit. Shpjegim: përshkrimi i kariotipit - kriteri gjenetik. Përshkrimi i ngjyrës së trupit (dhe dallimeve midis femrave dhe meshkujve) është një kriter morfologjik. Përshkrimi i gamës së specieve është një kriter gjeografik. Detyra numër 39.
tARN me antikodon CCA, GUU dhe GAA u përfshinë në mënyrë të njëpasnjëshme në sintezën e proteinave. Përcaktoni përbërjen e molekulave të ADN-së dhe mARN-së. Shpjegim: Le të fillojmë të shkruajmë përbërjen e molekulave në rend të kundërt, pra fillimisht tARN, pastaj mARN dhe në fund ADN. tARN: CCA GUU GAA mRNA: GGU CAA CUU ADN: CCA GTT GAA Detyra numër 40.
Për një femër me kreshtë (A) jeshile (B), u krye një kryq analizues, tek pasardhësit u morën katër klasa fenotipike. Pasardhësit me kreshtë që rezultuan u kryqëzuan mes tyre. A është e mundur të lindësh pasardhës pa kreshtë në këtë kalim? Nëse po, çfarë gjinie do të jetë, çfarë fenotipi? Tek kanarinat, prania e një kreshti varet nga një gjen autosomik, ngjyra e pendës (jeshile ose kafe) varet nga një gjen i lidhur me kromozomin X. Seksi heterogametik tek zogjtë është femër. Shpjegim:
Kryqi i parë: R: AaHVU x aaHvHv G: AHV, AHV, AU, AU X AHV F1: АаХВХв - mashkull i gjelbër me kreshtë ааХВХв - mashkull jeshil pa kreshtë AaHvU - femër me kreshtë kafe Ne kryqëzojmë një mashkull dhe një femër me një kreshtë: R: AaHVHv x AaHvU G: AHV, AHV, AHV, AHV x AHV, AU, AHV, AU F2: marrim 16 gjenotipe, ndër të cilat mund të dallohen vetëm 4 fenotipe. Fenotipet e individëve pa kreshtë: Femrat: ааХВУ - femër jeshile pa kreshtë ааХвУ - femër kafe pa kreshtë Meshkujt: ааХВХв - mashkull jeshil pa kreshtë ааХвХв - mashkull kafe pa kreshtë. Nëse molekula e një lënde është në gjendje të pangacmuar, atëherë elektronet janë të vendosura në nivelin më të ulët të energjisë. Në këtë rast, guaska elektronike e molekulës është në gjendjen e vetme, d.m.th., në një gjendje të tillë kur të gjithë elektronet janë çiftuar dhe momenti total i rrotullimit është i barabartë me zero. Kjo gjendje quhet gjendja e vetme e tokës, dhe niveli në të cilin ndodhen elektronet në këtë kohë quhet niveli i energjisë tokësore. Le ta shënojmë S 0 (Fig. 1). Le të shqyrtojmë tranzicionet elektronike në molekula duke përdorur shembullin e tranzicioneve elektronike në një molekulë tirozine. Nëse molekulat thithin kuantet e dritës, atëherë elektronet e predhave të jashtme të molekulave kalojnë në një nivel më të lartë energjie S 2 * (tranzicioni 1 në Fig. 1). Në këtë rast, lëvozhgat e elektroneve mbeten në gjendjen e vetme, megjithëse molekula ngacmohet. Vlera e energjisë së kuantit të përthithur është e barabartë me diferencën midis dy niveleve të energjisë midis të cilave ndodh kalimi i elektronit: thithjen e hv \u003d E 2 - E 0 (8) Kështu, kalimi i një elektroni nga niveli kryesor i njëfishtë në nivelin e njëshe të ngacmuar do të korrespondojë me thithjen e dritës, e cila shkruhet shkurtimisht: S 0 -> S * Nëse një molekulë mund të thithë dritën e një gjatësi vale të ndryshme, atëherë elektroni nuk do të shkojë më në nivelin S 2 *, por në një nivel tjetër që korrespondon me energjinë e kuantit të absorbuar. Nëse energjia e kësaj kuantike është më e vogël, atëherë niveli i energjisë do të jetë nën S 2 * (në Fig. 1, ky është niveli S 1 * dhe tranzicioni 2). Një molekulë mund të ketë disa nivele të tilla të ngacmuara të vetme. Secili prej tyre në spektrin e absorbimit do të korrespondojë me densitetin maksimal optik. Në fig. 1 tregon vetëm nivelet elektronike të molekulës dhe nuk tregon nënnivelet vibruese dhe rrotulluese. Nëse molekulat do të kishin vetëm nivele elektronike, atëherë numri i tranzicioneve të energjisë do të ishte i kufizuar dhe spektri molekular do të kishte karakter linja, dhe substancat do të kishin një selektivitet të lartë përthithjeje. Në fakt, për shkak të ndarjes së niveleve elektronike në nënnivele vibruese dhe rrotulluese, numri i kalimeve të energjisë së molekulave rritet ndjeshëm dhe spektrat molekularë janë të vazhdueshëm. Në këtë rast, kalimet elektronike më të mundshme në spektrin e përthithjes korrespondojnë me maksimumin. Përveç kësaj, ndërveprimi i molekulave me një tretës, natyra e të cilit është e ndryshme për molekula të ndryshme, ka një rëndësi të madhe në shfaqjen e spektrave të vazhdueshëm të molekulave. Molekulat nuk mund të qëndrojnë në një gjendje të ngacmuar për një kohë të gjatë; zakonisht kohëzgjatja e periudhës derisa molekula është në gjendje të ngacmuar nuk i kalon 10 -8 s. Energjia elektronike e një molekule të ngacmuar mund të shpenzohet si rezultat i disa proceseve: mund të transferohet në një molekulë tjetër - migrimi i energjisë; mund të përdoret për të rritur energjinë vibruese (termike) të molekulës. Në të gjitha këto raste, elektroni ose kthehet në nivelin e energjisë së tokës S 0 ose shkon në një nivel që shtrihet nën nivelin e dhënë të ngacmuar. Shigjetat me pika 5 në fig. 1 përshkruan tranzicione elektronike jo-rrezatuese, të shoqëruara nga shpërdorimi i energjisë në nxehtësi. Përveç proceseve të sipërpërmendura, mund të ndodhë edhe ndriçimi i molekulave, i cili shoqëron kalimin e tyre në një gjendje të pangacmuar. Pastaj elektronet kthehen në nivelin e energjisë së tokës. Procesi i lumineshencës së molekulave, i cili shoqëron kalimin e elektroneve nga nivelet e ngacmuara në nivelin e tokës, quhet lumineshencë. Lumineshenca ndahet në dy lloje: fluoreshencë dhe fosforeshencë (pas shkëlqim). Kalimi i elektroneve nga nivelet e ngacmuara në nivelin e tokës fillon gjithmonë me kalimin e elektroneve nga nivelet e sipërme të ngacmuara në nivelin më të ulët të ngacmuar. Këto janë tranzicione Në këtë rast, kuantet nuk emetohen dhe energjia elektronike e molekulës shndërrohet në nxehtësi. Ky proces i humbjes së energjisë ndodh shumë shpejt - në 10 -13 - 10 -12 s. Faza tjetër e tranzicionit të elektroneve është kalimi nga niveli më i ulët i ngacmuar S 0 * në nivelin e tokës S 0 . Në këtë rast, një kuant lumineshence do të emetohet. Meqenëse një pjesë e energjisë së ruajtur gjatë përthithjes së dritës u shpërdorua në nxehtësi, energjia e kuantit të lumineshencës do të jetë gjithmonë më e vogël se energjia e kuantit të absorbuar. Do të jetë më pak nga sasia e energjisë E nxehtësia e shpenzuar në nxehtësi: hv lum = hv thith - E nxehtësi (9) Prandaj, drita e emetuar do të ketë një frekuencë më të ulët dhe gjatësi vale më të madhe se drita e përthithur. Kjo marrëdhënie quhet ligji i Stokes: gjatësia e valës së dritës së emetuar gjatë lumineshencës është gjithmonë më e madhe se gjatësia e valës së dritës që e ka shkaktuar atë: λ lum > λ para. Ky model është një pasqyrim i ligjit të dytë të termodinamikës, sipas të cilit kalimi i energjisë nga një formë në tjetrën shoqërohet me shpërndarjen e energjisë në nxehtësi. Intensiteti i lumineshencës vlerësohet duke përdorur një koncept të veçantë - rendimentin kuantik. Rendimenti kuantik i luminescencës φ kuptohet si raporti i numrit të kuanteve të lumineshencës n me numrin e kuanteve të përthithur N: Meqenëse luminescenca vërehet gjithmonë gjatë kalimit të elektroneve nga niveli më i ulët i ngacmuar në atë tokësor, intensiteti i luminescencës nuk do të varet nga niveli në të cilin elektroni është hedhur më parë gjatë përthithjes së kuantit. Kjo dispozitë quhet ligji i Vavilov: rendimenti kuantik (probabiliteti) i lumineshencës nuk varet nga gjatësia e valës së dritës që shkaktoi luminescencën. Shkëlqimi, i cili vërehet gjatë kalimit të një elektroni nga niveli më i ulët i ngacmuar i njëshe në tokën S 0 * -> S 0, quhet fluoreshencë. Meqenëse jetëgjatësia e molekulave në një gjendje të ngacmuar është 10 -9 - 10 -8 s, fluoreshenca vërehet vetëm drejtpërdrejt gjatë ndriçimit të objektit. Megjithatë, prej kohësh është zbuluar se shumë substanca (veçanërisht në temperatura të ulëta) vazhdojnë të shkëlqejnë intensivisht edhe pasi drita është fikur. Ky shkëlqim është për shkak të kalimit të elektroneve nga i ashtuquajturi niveli i trefishtë. Ne kemi përmendur tashmë gjendjen e trefishtë të predhave elektronike, në të cilën ka dy elektrone të paçiftuar. Niveli i trefishtë (T në Fig. 1) ndodhet disi nën nivelin më të ulët të eksituar të njëshe S 0 * . Niveli i trefishtë është i ndaluar - një elektron nuk mund të arrijë këtu nga niveli i tokës (kalimet S 0 -> T nuk kanë gjasa). Një elektron mund të hyjë në nivelin e trefishtë nga një nivel i ngacmuar teke; atëherë e gjithë rruga e tij do të jetë S 0 -> S * -> T. Elektroni shpenzon një pjesë të energjisë në nxehtësi dhe kalon nga niveli i vetëm i ngacmuar më i ulët në nivelin e trefishtë. Gjatë këtij tranzicioni, spin-i i elektronit është i kundërt, si rezultat i të cilit dy elektrone bëhen të paçiftëzuara dhe molekula shndërrohet në një biradikale. Jetëgjatësia e një molekule në gjendjen e trefishtë varion nga 10 -3 s në disa sekonda. Meqenëse në gjendjen e trefishtë molekula ka dy elektrone të paçiftëzuara, ajo ka një aktivitet të lartë kimik dhe mund të hyjë në ndërveprim kimik. Përveç kësaj, një elektron mund të lëvizë nga niveli i trefishtë në nivelin e tokës, dhe energjia e çliruar në këtë rast ose shpërndahet në nxehtësi ose emetohet në formën e një kuantike lumineshence. Ndriçimi që shoqëron kalimin e elektroneve nga niveli i trefishtë në nivelin e tokës T -> S 0 (tranzicioni 4 në figurën 1) quhet fosforeshencë. Meqenëse niveli i trefishtë është nën nivelin e njëshe të ngacmuar, gjatësia e valës së dritës së emetuar gjatë fosforeshencës është edhe më e gjatë se ajo e emetuar gjatë fluoreshencës. Nëse gjatësia e valës së dritës së emetuar gjatë lumineshencës vizatohet përgjatë një boshti, dhe intensiteti i luminescencës vizatohet përgjatë boshtit tjetër, atëherë marrim kurbën e spektrit të lumineshencës. Spektrat e lumineshencës ndahen në spektrat e fluoreshencës dhe spektrat e fosforeshencës. Në fig. 1a tregon spektrat e përthithjes dhe lumineshencës së tirozinës. Niveli S 0 - niveli kryesor i molekulës së tirozinës - me kusht ka një energji të barabartë me zero. Pastaj kalimi i një elektroni S 0 -> S 2 * me thithjen e dritës kërkon një energji prej 5,7 eV (elektron volt). Ky kalim do të korrespondojë me një maksimum në spektrin e absorbimit në një gjatësi vale prej 217 nm. Një tjetër tranzicion elektronik gjatë përthithjes së një kuantike S 0 -> S 1 * korrespondon me një ruajtje energjie prej 4,5 eV dhe në spektrin e absorbimit korrespondon me një maksimum në λ = 275 nm. Fluoreshenca ndodh kur një elektron kthehet nga niveli i vetëm i ngacmuar më i ulët në nivelin e tokës. Në këtë rast, kuanti i emetuar ka një energji prej 4.1 eV. Kjo energji është më e vogël se energjia e fotoneve të zhytur (5.7 dhe 4.5 eV). Ky kalim korrespondon me një maksimum në spektrin e fluoreshencës në λ = 304 nm. Meqenëse gjatësia e valës së dritës së emetuar gjatë fluoreshencës është më e gjatë se gjatësia e valës së dritës së përthithur, spektri i fluoreshencës zhvendoset djathtas në shkallën e gjatësisë së valës në lidhje me spektrin e absorbimit. Fosforeshenca i përgjigjet kalimit T -> S 0 . Në këtë rast, një kuant me një energji prej 3.2 eV lëshohet. Ky kalim në spektrin e fosforeshencës korrespondon me një maksimum në λ = 387 nm. Spektri i fosforeshencës zhvendoset edhe më shumë djathtas në shkallën e gjatësisë së valës sesa spektri i fluoreshencës. Spektrat e lumineshencës, si spektrat e përthithjes, merren duke përdorur spektrofotometra. Këta spektrofotometra kanë një dizajn paksa të ndryshëm nga ato të diskutuara më sipër. Në veçanti, ato përmbajnë një numër filtrash të dritës. Në bazë të të dhënave të lumineshencës, mund të gjykohet madhësia e kuanteve të energjisë të ruajtura në një molekulë. Së bashku me të dhënat për kuantet e energjisë së absorbuar, kjo bën të mundur llogaritjen e vendndodhjes së niveleve të energjisë së molekulës. Bazuar në metodën lumineshente, mund të gjykohet jetëgjatësia e molekulave në një gjendje të ngacmuar - nga shkalla e shfaqjes dhe zhdukjes së luminescencës. Bazuar në intensitetin e lumineshencës, mund të nxirren përfundime në lidhje me proceset e humbjes së energjisë nga një molekulë. Së fundi, me ndihmën e metodës lumineshente është shumë i përshtatshëm për të hetuar gjendjen e materies; edhe ndryshimi i lehtë i tij (grumbullimi, formimi i kompleksit, ndryshimi i pH, etj.) ndikon në vetitë lumineshente. Interpretimi i informacionit të dhënë nga spektri kryhet duke përdorur teorinë e atomit. Prandaj, ne kujtojmë shkurtimisht disa veti të atomeve dhe rrezatimin e tyre. Një atom është një sistem i një bërthame dhe elektronesh të mbajtur së bashku nga tërheqja elektrostatike. Energjia e një atomi (më saktë, shtresa e tij elektronike) mund të ketë vetëm vlera të caktuara, të cilat quhen kushtet, ose nivelet. Gjendja më e ulët e energjisë quhet kryesore, pjesa tjetër - i emocionuar. Skema e niveleve të energjisë së atomit të hidrogjenit është paraqitur në fig. 4, ku çdo vizë përfaqëson një nivel (ai i poshtëm përfaqëson atë kryesor). Distancat e niveleve nga gjendja bazë janë proporcionale me energjinë e atomit të matur nga energjia e gjendjes bazë. Një atom mund të ndryshojë energjinë e tij duke kaluar nga një gjendje në tjetrën. Kjo është zakonisht për shkak të një ndryshimi në lëvizjen e elektronit më të jashtëm. Kalimet nga e fundit nivele të larta në ato më të ulëta mund të ndodhin spontanisht, pa ndikim të jashtëm, dhe ndryshimi në energji emetohet me një "pjesë" të rrezatimit të dritës, e quajtur kuantike. Frekuenca e dritës së emetuar është proporcionale me energjinë kuantike. Meqenëse ndryshimet e përcaktuara rreptësisht në energji korrespondojnë me tranzicione të ndryshme, atomi lëshon kuanta vetëm me frekuenca të caktuara, të cilat krijojnë linja individuale në spektër. Kalimet "lart", d.m.th., nga nivelet më të ulëta në ato të sipërme, nuk mund të ndodhin spontanisht; zbatimi i tyre kërkon një burim të jashtëm energjie (për shembull, kuante të frekuencës së duhur). Një proces i tillë quhet marr persiper. Numri i niveleve të energjisë së një atomi është i pafund; ato kondensohen në një kufi që i përgjigjet energjisë në të cilën elektroni ndahet plotësisht nga atomi. Bashkësia e vijave të formuara gjatë kalimeve në një nivel të caktuar nga të gjitha më të lartat quhet seri spektrale. Pra, hidrogjeni ka një seri Lyman që korrespondon me kalimet në nivelin e parë, një seri Balmer të formuar gjatë kalimeve në nivelin e dytë, etj. Meqenëse niveli i parë është shumë larg nga të tjerët, kalimet në të shoqërohen me një ndryshim të madh të energjisë. , dhe kuantet e serisë Lyman shtrihen në rajonin e largët ultravjollcë. Për shembull, linja L α ;, e formuar gjatë kalimit nga niveli i dytë në të parën, ka një gjatësi vale prej 1216Å 1, ndërsa pjesa violet e spektrit korrespondon me një gjatësi vale prej rreth 4000 Å. Linjat e serisë Balmer - H α (6563 Å), H β (4861 Å) dhe të tjera, shtrihen në pjesën e dukshme të spektrit. Pjesa tjetër e serisë së hidrogjenit ndodhet në rajonin infra të kuqe. Nivelet e energjisë së elementeve të tjerë janë më komplekse. Për t'i përfaqësuar ato, duhet të vizatoni më shumë se një kolonë, si në Fig. 4, por disa, me një kufi të sipërm të përbashkët. 1 (Å (angstrom) - një njësi matëse e gjatësive të valëve në spektroskopi, e barabartë me 10 -8 cm.) Në shumicën e atomeve, nivelet e energjisë ndahen në disa të ndara ngushtë nënnivele. Prandaj, linjat shpesh përbëhen nga dy ose tre komponentë ose më shumë, si rezultat i të cilave ato quhen dyshe, treshe, etj., ose në përgjithësi - shumëfishta. Vijat e vetme quhen beqare. Në atomet komplekse, ndarja e nivelit mund të jetë shumë e fortë. Nivelet e atomit të hidrogjenit gjithashtu përbëhen nga dy nënnivele, por energjitë e tyre janë praktikisht të njëjta. Duke krahasuar spektrin dhe skemën e nivelit të një atomi të çdo elementi, mund të vërehet se linjat e vëzhguara nuk korrespondojnë me të gjitha tranzicionet; disa tranzicione nuk ndodhin fare. Kalime të tilla quhen e ndaluar. E lejuar tranzicionet korrespondojnë me marrëdhënie të përcaktuara rreptësisht midis niveleve të energjisë, të quajtura rregullat e përzgjedhjes. Duhet të theksohet se tranzicionet që shkelin rregullat e përzgjedhjes nuk janë absolutisht të ndaluara: në kushte të caktuara, linjat përkatëse ende mund të respektohen. "Shkalla" e ndalimit karakterizohet më së miri nga koha që duhet të kalojë, mesatarisht, derisa një atom të mund të bëjë spontanisht një tranzicion të caktuar. Për një tranzicion të lejuar, kjo kohë është zakonisht 10 -7 - 10 -8 sekonda. Por në rregull për të bërë një tranzicion të ndaluar, atomi duhet të jetë në gjendjen e sipërme shumë më gjatë - nga 10 -3 sek në disa ditë ose më shumë, në varësi të shkallës së frenimit. Nëse nuk ka kalime të lejuara "poshtë" nga një nivel i caktuar, atëherë atomi në kushte të caktuara mund të qëndrojë aty për një kohë relativisht të gjatë.Nivele të tilla quhen metastabile. Për shumicën e elementeve dhe joneve të tyre, nivelet e ulëta afër nivelit të tokës janë metastabile. Vijat e ndaluara zakonisht tregohen me simbolin e elementit në kllapa katrore, me një numër romak që tregon shkallën e jonizimit. Për shembull, [OH] nënkupton linjën e ndaluar të oksigjenit të jonizuar, a - linjën e ndaluar të oksigjenit të jonizuar dyfish. Linjat e lejuara nuk kanë kllapa katrore. Në mënyrë që një atom të lëshojë një kuantike, ai duhet të jetë në një nga nivelet e ngacmuara, d.m.th., duhet t'i jepet një energji që korrespondon me ndryshimin midis energjive të nivelit në shqyrtim dhe atij fillestar. Kjo energji mund t'i jepet një atomi ose kur thith një kuant ose kur përplaset me një grimcë tjetër, kryesisht një elektron. Në këtë rast, energjia e elektronit duhet të jetë më e madhe se energjia e tranzicionit përkatës. Energjia mesatare e grimcave është proporcionale me temperaturë absolute gazit. Megjithatë, edhe nëse energjia mesatare është e pamjaftueshme për ngacmim, gjithmonë ka elektrone në gaz me energjinë e kërkuar, por numri i tyre zvogëlohet me shpejtësi me rritjen e energjisë. Prandaj, numri i ngacmimeve të një niveli, energjia e të cilit është dukshëm më e lartë se energjia mesatare do të jetë relativisht i vogël 1 . 1 (Frekuenca e ngacmimit varet jo vetëm nga numri i elektroneve, energjia e të cilëve është më e madhe se pragu i ngacmimit, por edhe nga vetitë e vetë atomit, më saktë, nga probabiliteti i ngacmimit të një niveli të caktuar të atomit nga një elektron i shpejtë.) Ndikimi i një joni ose një atomi neutral gjithashtu mund ta transferojë atomin në një gjendje të ngacmuar, por për këtë energjia e jonit duhet të jetë qindra ose mijëra herë më e madhe se energjia e nivelit, sepse një grimcë e rëndë gjithmonë transferon vetëm një një pjesë shumë e vogël e energjisë së tij në një elektron të lehtë të një atomi. Prandaj, ngacmimi nga grimcat e rënda zakonisht nuk ka rëndësi në kushte astrofizike, me përjashtim të rasteve kur niveli i energjisë është jashtëzakonisht i vogël. Nëse një elektron përplaset me një atom të ngacmuar, ky i fundit mund të transferojë energjinë e tij tek ai. Pastaj atomi do të shkojë në një gjendje më të ulët pa emetuar një kuant, dhe elektroni që përplaset do të kërcejë me energji të shtuar. Një proces i tillë quhet goditje e llojit të dytë, ndryshe nga procesi i ngacmimit të një atomi gjatë një përplasjeje ( hitet e llojit të parë). Ndikimet e llojit të dytë janë thelbësore në gazet e dendura, ku intervali kohor ndërmjet përplasjeve të atomeve është më i vogël se jeta e një atomi në një gjendje të ngacmuar. Në këtë rast, atomet përplasen para se të kenë kohë për të rrezatuar, kështu që ndikimet e llojit të dytë e zbehin ndjeshëm rrezatimin. Për nivelet metastabile, nga të cilat nuk lejohen kalime "poshtë" dhe ku, për rrjedhojë, atomi qëndron shumë më gjatë, ndikimet e llojit të dytë mund të jenë gjithashtu të rëndësishme në densitet të ulët. Kjo është arsyeja pse ne nuk vëzhgojmë linja që korrespondojnë me tranzicionet e ndaluara në laborator: ngacmimi zakonisht përfundon me një ndikim të rendit të dytë, dhe jo me rrezatim. Në një gaz shumë të rrallë, intervali midis përplasjeve mund të bëhet i krahasueshëm me jetëgjatësinë brenda gjendje metastabile, dhe vijat e ndaluara do të shfaqen. Siç do të shihet më poshtë, janë këto kushte që realizohen në mjegullnaja. Nëse një elektron fiton më shumë energji se kufiri i termave, ai do të shkëputet nga atomi. Një proces i tillë quhet jonizimi. Jonizimi i një atomi mund të ndodhë si kur një kuant absorbohet dhe kur ai përplaset me një elektron të shpejtë. Një elektron i lirë që nuk është i lidhur me një atom mund të ketë ndonjë energji. Prandaj, ndryshe nga kalimet brenda një atomi, ku kuantet e vetëm një frekuence të caktuar mund të absorbohen, jonizimi mund të prodhohet nga çdo kuant, energjia e të cilit është më e madhe se ajo e nevojshme për kalimin nga niveli fillestar në energjinë e jonizimit. Për shembull, një atom hidrogjeni i vendosur në nivelin e parë mund të thithë çdo kuant, gjatësia e valës së të cilit është më e vogël se 912 A, dhe nga niveli i dytë - një kuant me gjatësi vale më të vogël se 3646 A. Nëse energjia kuantike është më e madhe se sa duhet për të shkëputur një elektron, atëherë energjia e tepërt kalon në energjinë kinetike të elektronit të nxjerrë. Jonizimi i ndikimit është i mundur vetëm nëse energjia e elektronit ndikues është më e madhe se ajo e nevojshme për shkëputje. Sa më e lartë të jetë temperatura e gazit, aq më shumë elektronet kanë energjinë e nevojshme, sa më shpesh të ndodhin jonizime dhe aq më i madh, duke qenë të barabarta gjërat e tjera, proporcioni i atomeve të jonizuar. Një grimcë e rëndë mund të jonizojë një atom vetëm me energji të larta, shumë më të larta se energjia e jonizimit. Nëse gazi ka një temperaturë shumë të lartë ose është në një fushë të fortë rrezatimi, atëherë para se të ketë kohë për të kapur elektronin prapa, një elektron i dytë, i tretë, etj., Mund të shkëputet prej tij. në mënyrë të përsëritur atomet e jonizuara. Megjithatë, shkëputja e çdo elektroni pasues kërkon gjithnjë e më shumë energji, pasi ngarkesa e jonit rritet. Prandaj, jonizimi i shumëfishtë kërkon një temperaturë shumë të lartë të gazit ose burimit të rrezatimit jonizues. Procesi i kundërt i jonizimit quhet rikombinim. Ai përfaqëson kapjen e një elektroni nga një jon. Një elektron mund të kapet nga një atom në çdo nivel. Prandaj, një atom i formuar si rezultat i rikombinimit mund të jetë ose i ngacmuar ose i pangacmuar. Gjatë rikombinimit, duhet të lirohet një energji e barabartë me diferencën midis energjive të një elektroni të lirë dhe të lidhur, zakonisht në formën e një kuantike. Nëse një elektron me energji të ulët rikombinohet, atëherë frekuenca e kuantit është afër kufirit të serisë së nivelit përkatës. Sa më e madhe të jetë energjia e elektronit të rikombinuar, aq më e madhe është frekuenca e kuantit të emetuar. Meqenëse elektronet e lira mund të kenë çdo energji, spektri i emetuar gjatë rikombinimeve ka formën e një brezi të vazhdueshëm, duke filluar menjëherë pas kufirit të serisë dhe duke u shtrirë, duke u dobësuar gradualisht, drejt frekuencave më të larta. Një spektër i tillë quhet vazhdimësi. Dobësimi i shkëlqimit shkaktohet nga fakti se fraksioni i elektroneve të shpejta zvogëlohet gjithmonë me rritjen e energjisë. Sa më e lartë të jetë temperatura e gazit, aq më e madhe është energjia mesatare e rikombinimit të elektroneve dhe aq më ngadalë zvogëlohet intensiteti përtej kufirit të serisë. Ne kemi thënë tashmë më lart se një atom është i aftë të lëshojë dritë jo vetëm gjatë rikombinimit, por edhe gjatë kalimit nga një nivel energjie në tjetrin. Rezulton se një elektron i lirë, që lëviz në fushën elektrike të një joni, është gjithashtu i aftë të lëshojë rrezatim. Një elektron i lirë lëviz në fushën e një joni përgjatë një orbite hiperbolike dhe orbita të ndryshme korrespondojnë me energji të ndryshme. Ashtu si një kuant emetohet ose përthithet gjatë kalimit të një elektroni të lidhur në një atom nga një orbitë eliptike në tjetrën, një kuant mund të emetohet ose absorbohet kur një elektron kalon nga një orbitë hiperbolike në tjetrën. Një proces i tillë i quajtur një tranzicion i lirë në të lirë. Meqenëse energjia e të dy orbitave mund të ketë çdo vlerë, emetimi dhe thithja gjatë tranzicioneve pa pagesë ndodhin në një spektër të vazhdueshëm. Ndryshimi i energjisë gjatë tranzicioneve pa pagesë është zakonisht një fraksion i vogël plot energji elektron, kështu që energjia e fotoneve të emetuara është më e vogël se energjia mesatare e elektroneve. Kur jo shumë temperaturë të lartë Rrezatimi i gazit pa gaz është i përqendruar në rajonin e valëve të gjata - nga rrezet infra të kuqe në valët e radios. Deri tani kemi folur për emetimin dhe thithjen e dritës nga atomet individuale. Në realitet, rrezatimi nga një shtresë e tërë gazi vërehet gjithmonë. Nëse shtresa e gazit është transparente në të gjitha frekuencat, rrezatimi i atomeve individuale thjesht do të përmblidhet. Ai do të përbëhet nga linja të ndritshme në sfondin e një spektri të vazhdueshëm më pak të ndritshëm të formuar gjatë rikombinimeve në nivele të ndryshme dhe tranzicione pa pagesë. Por nëse rritni trashësinë e shtresës së gazit, atëherë një pjesë e rrezatimit do të absorbohet prej saj. Para së gjithash, kuantet që formojnë linjat do të absorbohen, dhe për këtë arsye linjat do të jenë më pak të kundërta në sfondin e spektrit të vazhdueshëm. Nëse shtresa homogjene është praktikisht e errët në të gjitha frekuencat, atëherë linjat do të zhduken. Rrezatimi do të ketë një spektër të vazhdueshëm në varësi vetëm të temperaturës, dhe intensiteti maksimal në këtë spektër do të zhvendoset drejt valëve të shkurtra me rritjen e temperaturës së shtresës së gazit. Në të njëjtën kohë, sasia totale e energjisë e emetuar nga një sipërfaqe njësi do të rritet. Rrezatimi i yjeve është i ndërlikuar nga fakti se shtresa nuk është homogjene - temperatura dhe dendësia e saj rriten me thellësinë. Prandaj, ka vija të errëta në spektrin e yjeve, dhe kursi i përgjithshëm i intensitetit në të nuk përkon me spektrin e një shtrese të errët gazi.

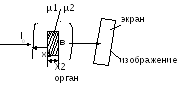

faqet totale: 6
ku v abs. - frekuenca e dritës së përthithur, E 2 dhe E 0 - energjia e niveleve ndërmjet të cilave kryhet kalimi.
ku v lum është frekuenca e dritës së emetuar gjatë lumineshencës. Faqe
3
faqet totale: 6






