Fenomenele de suprafață sunt exemple. Vezi ce sunt „fenomenele de suprafață” în alte dicționare
FENOMENE DE SURFACE
FENOMENE DE SURFACE
Fenomene cauzate de exces energie gratisîn stratul limită - energia de suprafață, creșterea activității și orientarea moleculelor stratului de suprafață, caracteristicile structurii și compoziției sale. P. i. sunt determinate și de faptul că chimia. și fizice efectele corpurilor apar în primul rând în straturile de suprafață. Principal P. i. asociat cu o scădere a energiei de suprafață proporțională cu suprafața. Astfel, formarea formelor de echilibru de picături lichide sau bule de gaz, precum și cristale în timpul creșterii lor, este determinată de energia liberă minimă la DC. volum. P. I., care rezultă din acțiunea combinată a forțelor moleculare ( tensiune de suprafata si umezire) si ext. forțe (gravitația) și care provoacă curbura interfețelor lichide, numite. evenimente capilare.
P. i. în televizor. corpurile au loc în primul rând pe exterior. suprafata corpului. Acestea includ: aderență (coeziune), (aderență), frecare. Din condițiile energiei minime de suprafață liberă a cristalului, pe decomp. ale căror fețe tensiunea este diferită, matematic sunt derivate toate formele posibile de cristalin. poliedre studiate în geom. cristalografie.
P. i. are loc în interior. suprafeţe care se dezvoltă pe baza defectelor cristaline. grătare. Orice distrugere a televizorului. corpul, asociat cu depășirea forței sale, este în esență P. I., deoarece se exprimă în formarea unei noi interfețe. Formarea și dezvoltarea nucleelor unei noi faze într-un mediu inițial omogen situat în stare metastabilă, este determinată și de P. I. (asociată cu aceasta este o creștere a solubilității picăturilor mici și a cristalelor și o creștere a presiunii deasupra acestora abur saturat; (vezi ECUAȚIA KELVIN)).
Mijloace. grupa P.I. constituie fenomene de adsorbție, la care substanța chimică se modifică. compoziția stratului de suprafață (vezi ADSORPIE). Acest grup de fenomene este alăturat de dec. cazuri de activat și chimic. adsorbție, transformându-se în chimie de suprafață. reacții cu formarea unui strat superficial de substanță chimică. conexiuni. Aceasta include dif. Topochem. (de exemplu, formarea de oglinzi metalice pe suprafețe în timpul reducerii metalului dintr-o soluție a sărurilor sale, formarea depunerilor pe suprafețele de încălzire etc.). Formarea straturilor-acoperiri monomoleculare de chimisorbție este o metodă eficientă de modificare a luminii de suprafață monomoleculară din organism și a naturii efectului acesteia asupra mediu inconjurator. Straturile de adsorbție pot crește dramatic stabilitatea emulsiilor, spumei, suspensiilor, ceea ce este asociat, în limită, cu structural și mecanic. sfinții acestor straturi (înalt, elasticitate și rezistență).
Caracteristicile mișcării termice în straturile de suprafață duc la dig. împrăștierea luminii de către suprafețe. Alte grupe de fenomene includ: emisia termoionică, apariția unor potențiale salturi și formarea unui dublu strat electric pe interfață. Aceste P. I. asociat cu adsorbția ionilor și a moleculelor dipol. P. i. afectează termodinamica. echilibrul fazelor numai în cazul unei suprafeţe foarte dezvoltate a separării lor în sisteme coloidale. Viteza proceselor de transfer de căldură și de transfer de masă - dizolvare, condensare, chimie eterogenă. procese (de exemplu, coroziune) - sunt determinate de magnitudinea și St. tu a interfeței și, prin urmare, puternic dependente de dig. natura și structura acestei suprafețe. Straturile de adsorbție pot chema creaturi. schimbare, încetinind procesele de schimb interfacial. Deci, monostraturi din anumite substanțe active de suprafață, de exemplu. alcoolul cetilic de la suprafața apei poate încetini semnificativ evaporarea acesteia. La fel este încetinirea proceselor de coroziune sub acțiunea straturi de suprafață inhibitori sau pelicule protectoare de oxizi etc chimice. compuși pe suprafața metalului.
P. i. determinați caracteristicile condițiilor la limită în timpul mișcării interfețelor (picături, bule și jeturi de lichid, descompunerea în picături, capilară). Elefanții de adsorbție provoacă amortizarea undelor capilare din cauza apariției unor diferențe locale de tensiune superficială, adică modificări ale hidrodinamicii limită. conditii.
P. i. determina durabilitatea materialelor si structurilor intr-un mediu dat. Nu numai dizolvarea și coroziunea, dar chiar și coroziunea reversibilă provoacă ameliorarea deformărilor și distrugerea solidelor. corpuri, reducând munca de formare a suprafețelor noi. Mici impurități adsorbite în interior, formând un monomol. straturi pe interfețe, vă permit să controlați multe. Sf. tu materiale. Studiul straturilor de suprafață monomoleculară conduce la noi metode de studiere a moleculelor și de determinare a dimensiunilor acestora. P. i. determina procesele de meteorizare a rocilor și formarea solului, evaporarea și condensarea umidității, precum și multe altele. procese în organismele vii. La folosirea lui P. I. a fondat multe tehnologice procese (ungere, umectare, flotare etc.).
Dicţionar enciclopedic fizic. - M.: Enciclopedia Sovietică. . 1983 .
FENOMENE DE SURFACE
-
fenomene, adsorbție, apariția energiei de suprafață, tensiune superficială, electrice de suprafață. Straturile de suprafață sunt neomogene la scara dimensiunilor moleculare și sunt anizotrope indiferent de starea de agregare a fazelor; ele diferă de fazele vrac ale fizicului. proprietățile (densitatea, vâscozitatea, cristalele și cavitățile sunt microscopice. În prezența tranzițiilor de fază bidimensionale pe suprafață, precum și la intersecția suprafețelor, se formează linii de interfaza - analogi unidimensionali ai suprafețelor interfaciale, fenomene liniare sunt asociat cu existența căreia.O regiune liniară neomogenă este un analog unidimensional al stratului de suprafață și are o tensiune liniară, energie liberă liniară etc. Potențialele termodinamice liniare la distanță diferă de cele de suprafață doar prin aceea că se referă la o unitate de lungime (măsurată în J/m).Fenomenele liniare sunt semnificative numai pentru obiecte foarte mici (nuclee de faze bidimensionale, . P.).
Regularitățile lui P. I. sunt descrise de legea lui Laplace și ecuația lui Young (vezi. umezire), precum și ur-Niemadsorbția Gibbs generalizată:
unde este munca de formare a unei unități de suprafață prin tăiere (vezi. tensiune de suprafata),- bate entropia (vezi Energia de suprafață),- tensor de tensiune superficială, - tensor unitar, - tensor deformatii(simbolul „:” înseamnă produsul scalar al tensoarelor),- potenţiale chimice
molecule (sau potențiale electrochimice ale ionilor), G i- adsorbția lor, însumarea se realizează pe toate componentele, pentru care este posibil un echilibru între faza în vrac și stratul de suprafață. Pentru suprafețe lichide - tensiune superficială și deformare. membru lipsește. Ur-țiunea de adsorbție a lui Gibbs stabilește comunicarea între cele mai importante P. I. - adsorbția și activitatea de suprafață (vezi surfactanți).
Influența semnificativă o are P. I. proprietățile macrosistemelor. Acest lucru se datorează creșterii suprafeței în astfel de sisteme, fenomene capilare. Într-un sistem eterogen cu doar suprafețe curbate, cel regula fazei Gibbsîn clasicul lui presiunea de fixare a filmelor subțiri, care (cu semnul ei) contribuie la stabilitatea sistemelor dispersate (se definește ca diferența dintre presiunea exterioară asupra peliculei și presiunea în faza vrac, compusă din componentele peliculei în același timp temperatura si valorile chimice ca in film.Un grup important de polarizari este alcatuit din fenomene de electrosuprafata: de suprafata, electrice de suprafata, de emisie etc.Toate acestea sunt asociate cu formarea la interfata dublu strat electric ca urmare a emisiei sau specifice. Către P. I. raporta coeziune, aderență, umezirea, lubrifierea și spălarea, frecarea, impregnarea corpurilor poroase. P. i. afectează (de exemplu, reducerea puterii de adsorbție - efect Rehbinder). P. i. joacă un rol important în procesele de fază. viteza de transfer de căldură și masă între ele. Permeabilitatea straturilor de suprafață și a filmelor, asociată cu structura lor moleculară, provoacă fenomene membranare, care sunt deosebit de importante în biol. sisteme. Lit.: Rusanov A.I., Echilibrul de fază și fenomenele de suprafață, L., 1967; Adameon A., Chimie Fizica suprafete, DAR. I. Rusanov.
Enciclopedie fizică. În 5 volume. - M.: Enciclopedia Sovietică. Redactor-șef A. M. Prokhorov. 1988 .
Vedeți ce înseamnă „FENOMENE DE SURFACE” în alte dicționare:
Enciclopedia modernă
Fenomene de suprafață- FENOMENE DE SUPRAFAŢA, datorate fizice deosebite şi proprietăți chimice straturi subțiri de materie la limita corpurilor (medii, faze). Cel mai important fenomen de suprafață este adsorbția. Determinați rezistența și durabilitatea materialelor. Cu o suprafata... Dicţionar Enciclopedic Ilustrat
Un grup de fenomene datorate faptului că forțele de interacțiune dintre particulele care alcătuiesc corpul nu sunt compensate la suprafața acestuia. Fenomenele de suprafață includ tensiunea superficială, fenomenele capilare, activitatea de suprafață... Dicţionar enciclopedic mare
fenomene de suprafaţă- - fizică fenomene chimice, datorită distribuției neuniforme a moleculelor de solvent și solut în apropierea interfeței. Chimie generală: manual / A. V. Zholnin ... Termeni chimici
FENOMENE DE SURFACE- fenomene care apar în stratul de suprafață, la interfețele dintre medii și cauzate de creșterea activității și orientării moleculelor stratului de suprafață, caracteristici ale structurii și compoziției acestuia, precum și chimice. și fizice interactiuni in... Marea Enciclopedie Politehnică
Fiz. chimic. fenomene care se datorează proprietăților speciale (comparativ cu vrac) ale straturilor superficiale ale lichidelor și solidelor. Naib. sv comun și important în aceste straturi este excesul de svob. energia F \u003d sS, unde s este tensiunea de suprafață (interfacială), pentru ... ... Enciclopedia chimică
Fenomene de suprafață un ansamblu de fenomene datorate proprietăților speciale ale straturilor subțiri de materie la interfața fazelor. Fenomenele de suprafață includ procese care au loc la interfață, în suprafața interfeței ... ... Wikipedia
Exprimarea proprietăților speciale ale straturilor de suprafață, adică straturi subțiri de materie la interfața dintre corpuri (medii, faze). Aceste proprietăți se datorează excesului de energie liberă (vezi Energie liberă) a stratului de suprafață, caracteristicilor sale ... ... Marea Enciclopedie Sovietică
Suprafaţă– interfață între două medii de contact
Fenomene de suprafață- un ansamblu de fenomene datorate proprietăților fizice și chimice la limita dintre substanțele învecinate.
Adică acestea sunt fenomenele care apar la suprafață, datorită energiei de suprafață.
Straturile subterane de material sunt considerate ca un subsistem sistem comun material deformabil.
Suprafață specifică: S bătăi = S/V
Fenomenele de suprafață includ:
2) fenomene capilare(fenomene de suprafață la limita unui lichid cu un alt mediu, asociate cu curbura suprafeței sale)
Funcția Laplace (formula pentru presiunea capilară) P = σ(dS/dV)
3) adeziune(caracterizează aderența unei substanțe dintr-o fază la o altă fază) și coeziune(adeziunea unor părți ale aceluiași corp omogen (lichid sau solid))
4) frecare
5) fenomene de adsorbţie şi desorbţie
Ecuația de adsorbție Gibbs: Γ = -(∂σ/∂μ) T
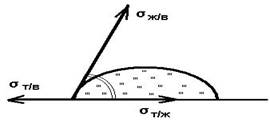
6) umezire(un fenomen de suprafață observat atunci când un lichid intră în contact cu un corp solid în prezența unei a treia faze, a unui gaz (vapor) sau a altui lichid care este nemiscibil cu prima. Caracteristică umectare - prezența liniilor de contact din trei faze (linii de umectare).
Principalele caracteristici termodinamice ale umezării sunt unghiul de umectare de echilibru q 0 , lucrul de aderență W a , căldura de umectare q W . Unghiul de contact de echilibru al umezirii este determinat de înclinarea suprafeței lichidului (de exemplu, picături) față de suprafața corpului solid umezit de acesta; vârful colțului este pe linia de umectare. Unghiul de contact de echilibru este determinat de ecuația Young:
cosq 0 \u003d (s s -s sl) / s sl,
unde s s și respectiv s sl -. energia de suprafață specifică a unui solid la limita cu un gaz și în contact cu un lichid de umectare, s l este tensiunea superficială a lichidului.
Termodinamica suprafeței:
fenomenele de suprafață sunt de obicei clasificate în conformitate cu ecuația combinată a primei și a doua legi ale termodinamicii.
Această ecuație se scrie astfel:
Unde σdS – energie de suprafață[J/m^2=N/m]
Energia de suprafață - energie concentrată la interfață, exces față de energia din volum. Substante cristaline se caracterizează prin anizotropie a energiei de suprafaţă: cea mai mică energie de suprafaţă o posedă feţele cu cea mai mare densitate particule.
Tensiune de suprafata: σ = (dG/dS) T , p , ni
Adică, tensiunea superficială este o caracteristică termodinamică a interfeței dintre două faze aflate în echilibru, determinată de munca de formare izotermocinetică reversibilă a unei unități de suprafață a acestei interfețe, cu condiția ca temperatura, volumul sistemului și potențialele chimice ale tuturor componentele din ambele faze rămân constante.
Tendința energiei de suprafață la minim provoacă o curbură a suprafeței lichidului. Prin urmare, putem presupune existența unei legături între energia de suprafață și formă.
Proprietăți electronice suprafete diferă de cele în vrac, în special prin prezența electronicelor stări de suprafață. Funcțiile de undă corespunzătoare ale electronilor se degradează exponențial cu distanța de la suprafață.
Obiectele mici (cel puțin într-o dimensiune) legate de straturile de suprafață, cum ar fi peliculele și filamentele subțiri, fantele și porii înguste, picăturile, cristalele și cavitățile de dimensiuni microscopice au și ele proprietăți deosebite. Studiul filmelor subțiri și al straturilor monomoleculare oferă informații despre natura interacțiunii intermoleculare și structura moleculelor.
Dacă există bidimensionale tranziții de fază, precum și atunci când suprafețele se intersectează, se formează linii interfațiale - analogi unidimensionali ai suprafețelor interfaciale, a căror existență este asociată cu fenomene liniare. O regiune liniară neomogenă este un analog unidimensional al unui strat de suprafață și are tensiune liniară, energie liberă liniară etc. Liniară specifică potențiale termodinamice diferă de cele de suprafață doar prin aceea că se referă la o unitate de lungime (măsurată în J/m). Fenomenele liniare sunt semnificative doar pentru obiectele foarte mici (nuclee de faze bidimensionale, micropicături umezite etc.).
Fenomene de adsorbție și desorbție
În adsorbția gazelor pe solide, descrierea interacțiunii dintre adsorbat și moleculele de adsorbant este o problemă foarte complexă, deoarece natura interacțiunii lor, care determină natura adsorbției, poate fi diferită. Prin urmare, problema este de obicei simplificată luând în considerare două cazuri extreme, când adsorbția este cauzată de forțe fizice sau chimice - respectiv, adsorbția fizică și chimică.
adsorbție fizică apare din cauza interacțiunilor van der Waals. Se caracterizează prin reversibilitate și o scădere a adsorbției odată cu creșterea temperaturii, adică. exotermicitatea, iar efectul termic al adsorbției fizice este de obicei apropiat de căldura de lichefiere a adsorbatului (10 – 80 kJ/mol). Aceasta este, de exemplu, adsorbția gazelor inerte pe cărbune.
Adsorbția chimică(chimisorbția) se realizează de interacțiune chimică molecule adsorbante și adsorbate. Chimisorbția este de obicei ireversibilă; adsorbția chimică, spre deosebire de adsorbția fizică, este localizată; moleculele de adsorbat nu se pot deplasa pe suprafața adsorbantului. Întrucât chimisorbția este proces chimic, necesitând o energie de activare de ordinul 40 - 120 kJ/mol, o creștere a temperaturii contribuie la apariția acesteia. Un exemplu de adsorbție chimică este adsorbția oxigenului pe wolfram sau argint la temperaturi ridicate.
Fenomenele de adsorbție fizică și chimică se disting clar în cazuri foarte rare. Opțiunile intermediare sunt de obicei efectuate, atunci când cea mai mare parte a substanței adsorbite se leagă relativ slab și doar o mică parte este ferm legată. De exemplu, oxigenul pe metale sau hidrogenul pe nichel la temperaturi scăzute sunt adsorbite conform legilor adsorbției fizice, dar pe măsură ce temperatura crește, începe să aibă loc adsorbția chimică. Odată cu creșterea temperaturii, creșterea adsorbției chimice de la o anumită temperatură începe să se suprapună cu scăderea adsorbției fizice, astfel încât dependența de temperatură a adsorbției în acest caz are un minim clar definit.
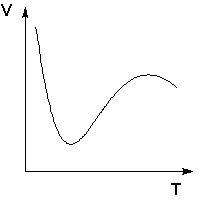
Dependența de temperatură a volumului de hidrogen adsorbit de nichel
Tipuri de adsorbție:
Teoria lui Langmuir a adsorbției monomoleculare
Teoria adsorbției monomoleculare, care a fost dezvoltată de chimistul american I. Langmuir, se bazează pe următoarele prevederi.
1) Adsorbția este localizată și este cauzată de forțe apropiate de cele chimice.
2) Adsorbția are loc nu pe întreaga suprafață a adsorbantului, ci pe centrii activi, care sunt proeminențe sau depresiuni pe suprafața adsorbantului, caracterizate prin prezența așa-numitului. valențe libere. Centrele active sunt considerate independente (adică un centru activ nu afectează capacitatea de adsorbție a altora) și identice.
3) Fiecare centru activ este capabil să interacționeze cu o singură moleculă de adsorbat; ca urmare, la suprafață se poate forma un singur strat de molecule adsorbite.
4) Procesul de adsorbție este reversibil și de echilibru - molecula adsorbită este reținută de centrul activ pentru o perioadă de timp, după care este desorbită; astfel, după un timp, se stabilește un echilibru dinamic între procesele de adsorbție și desorbție.
Izoterma de adsorbție monomoleculară
În starea de echilibru, viteza de adsorbție este egală cu viteza de desorbție. Rata de desorbție este direct proporțională cu proporția de centri activi ocupați (x), iar rata de adsorbție este direct proporțională cu produsul dintre concentrația de adsorbat și fracția de centri activi liberi (1 – x):
Împărțind numărătorul și numitorul părții drepte a ecuației la k A , obținem:

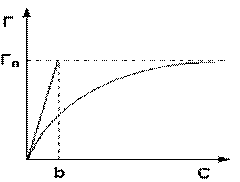
Valoarea maximă posibilă a adsorbției T o se realizează cu condiția ca toți centrii activi să fie ocupați de molecule de adsorbat, adică. x = 1. De aici rezultă că x = r / r o.
Ecuația este o izotermă de adsorbție monomoleculară care leagă valoarea de adsorbție G de concentrația de adsorbat C. Aici b este o valoare constantă pentru o anumită pereche adsorbant-adsorbat (raportul dintre constantele de desorbție și viteza de adsorbție), numeric egal cu concentrația de adsorbat, la care sunt ocupate jumătate din centrele active. Graficul izotermei de adsorbție Langmuir este prezentat în fig. Constanta b poate fi determinată grafic prin trasarea unei tangente la izoterma de adsorbție în punctul C = 0.
Când se descrie procesul de adsorbție a gazelor în ecuație, concentrația poate fi înlocuită cu o valoare proporțională presiune parțială gaz:
Teoria lui Langmuir a adsorbției monomoleculare este aplicabilă pentru a descrie unele procese de adsorbție a gazelor și substanțelor dizolvate la presiuni (concentrații) scăzute ale adsorbatului.
Teoria lui Polanyi a adsorbției polimoleculare
În practică, adesea (în special în adsorbția vaporilor) există așa-numitele. Izoterme de adsorbție în formă de S, a căror formă indică posibila interacțiune a moleculelor adsorbite cu adsorbatul, pornind de la o anumită valoare a presiunii.

Izoterma de adsorbție polimoleculară
Pentru a descrie astfel de izoterme de adsorbție, M. Polyany a propus o teorie a adsorbției polimoleculare bazată pe următoarele prevederi principale:
1. Adsorbția este cauzată de forțe pur fizice.
2. Suprafața adsorbantului este omogenă, adică. nu există centre activi pe el; forțele de adsorbție formează un câmp de forță continuu lângă suprafața adsorbantului.
3. Forțele de adsorbție acționează la distanță, mai mare molecule de adsorbat. Cu alte cuvinte, există un anumit volum de adsorbție lângă suprafața adsorbantului, care este umplut cu molecule de adsorbat în timpul adsorbției.
Caracteristici ale structurii atomice a stratului de suprafață:
Specificul structurii atomice de lângă suprafața solidelor se manifestă în așa-numita relaxare și reconstrucție a suprafeței. În timpul relaxării, structura planurilor atomice paralele cu suprafețele rămâne aceeași ca în vrac, dar distanțele interplanare din apropierea suprafeței se modifică. În timpul reconstrucției, simetria rețelei în regiunea apropiată de suprafață diferă brusc de cea în vrac. Acest fenomen este caracteristic în primul rând pentru cristalele cu o legătură covalentă (de exemplu, Si și Ge). Datorită naturii foarte anizotrope a interacțiunii covalente, încălcarea periodicității rețelei în timpul formării suprafeței implică o rearanjare radicală a geometriei legăturilor interatomice în apropierea suprafeței. De asemenea, a fost găsită o reconstrucție a suprafeței unui număr de metale de tranziție și nobile.
Relaxare la suprafață - modificarea stratului aproape de suprafață al cristalului, în care structura atomică a stratului superior rămâne aceeași cu cea a planurilor atomice corespunzătoare din volum, dar distanța dintre primul și al doilea strat sau poziția lor reciprocă diferă de cei din volum.
Relaxarea este împărțită în normalși lateral, numită și paralelă sau tangențială. Relaxarea normală corespunde cazului în care structura atomică a stratului superior este aceeași ca în vrac, dar distanța dintre stratul superior și cel de-al doilea diferă de distanța dintre planurile din vrac (Fig. a). În forma sa pură, la metale se observă relaxare normală. În cele mai multe cazuri, există o scădere a distanței primului strat intermediar; pentru straturi mai adânci, abaterea de la valoarea în vrac a distanței dintre straturi scade odată cu adâncimea. Uneori există și o deplasare uniformă a stratului superior paralel cu suprafața (fig. b); în acest caz se vorbeşte de relaxare paralelă sau tangenţială. Se observă în principal pe planuri cu indice mare, cu o concentrație scăzută de atomi.
Fenomene de suprafață
Fenomene de suprafață- un ansamblu de fenomene datorate proprietăților speciale ale straturilor subțiri de materie la interfața fazelor. Fenomenele de suprafață includ procese care au loc la limita de fază, în stratul de suprafață interfacial și care rezultă din interacțiunea fazelor conjugate.
Fenomenele de suprafață se datorează faptului că în straturile de suprafață de la limitele de interfază datorită compoziție diferităși structura fazelor de contact și, în consecință, datorită diferenței în legăturile atomilor de suprafață și moleculelor din partea diferitelor faze, există un câmp nesaturat de forțe interatomice, intermoleculare. Ca urmare, atomii și moleculele din straturile de suprafață formează o structură specială, iar substanța capătă o stare specială care diferă de starea sa în volumul fazelor prin diferite proprietăți. Fenomenele de suprafață sunt studiate prin chimia coloidă.
Clasificarea fenomenelor de suprafață
Fenomenele de suprafață sunt de obicei clasificate în conformitate cu ecuația combinată a primei și a doua legi ale termodinamicii, care include principalele tipuri de energie. Pentru orice sistem eterogen, acesta poate fi scris sub următoarea formă:
Această ecuație arată creșterea energiei Gibbs prin suma algebrică a incrementelor altor tipuri de energie. Este evident că energia de suprafață este capabilă să se transforme în următoarele tipuri de energie:
- Energia Gibbs
- energie chimica
- energie mecanică
- Energie electrica
Transformarea energiei de suprafață într-unul dintre tipurile de energie enumerate corespunde anumitor fenomene de suprafață, cum ar fi modificarea reactivității cu modificarea dispersiei, aderenței și umezirii, capilarității, adsorbției, fenomenelor electrice.
Semnificația fenomenelor de suprafață
Fenomenele de suprafață sunt larg răspândite în ingineria chimică. Aproape orice producție chimică realizate folosind sisteme dispersate și fenomene de suprafață. De regulă, toate procesele eterogene din tehnologia chimică sunt efectuate la suprafata maxima contact de fază. Pentru a face acest lucru, sistemele de materie sunt transferate în starea de suspensii, pulberi, emulsii, ceață, praf. Procesele de măcinare a materiilor prime și a produselor intermediare, îmbogățirea se desfășoară în sisteme dispersate, un rol semnificativ în ele îl joacă fenomene precum umezirea, capilaritatea, adsorbția, sedimentarea, coagularea. Adsorbanții și catalizatorii poroși sunt utilizați pe scară largă în tehnologia chimică. sistem dispersat cu un mediu de dispersie solid.
Regularitățile cursului fenomenelor de suprafață, în special formarea structurii, servesc baza teoretica obţinerea de materiale cu proprietăţile dorite: ceramică, cimenturi, vitro-ceramice, adsorbanţi, catalizatori, polimeri, pulberi, medicamente etc.
Literatură
Frolov Yu. G. Bine chimia coloidală. - SRL TID „Alianța”, 2004. - 464 p. - ISBN 5-98535-003-7
Fundația Wikimedia. 2010 .
Vedeți ce este „Fenomene de suprafață” în alte dicționare:
Fenomene cauzate de un exces de energie liberă în stratul limită al energiei de suprafață, creșterea activității și orientarea moleculelor stratului de suprafață, caracteristicile structurii și compoziției acestuia. P. i. sunt determinate și de faptul că chimia. și fizice vz… … Enciclopedia fizică
Enciclopedia modernă
Fenomene de suprafață- FENOMENE DE SUPRAFAȚA se datorează proprietăților fizice și chimice speciale ale straturilor subțiri de materie la limita corpurilor (medii, faze). Cel mai important fenomen de suprafață este adsorbția. Determinați rezistența și durabilitatea materialelor. Cu o suprafata... Dicţionar Enciclopedic Ilustrat
Un grup de fenomene datorate faptului că forțele de interacțiune dintre particulele care alcătuiesc corpul nu sunt compensate la suprafața acestuia. Fenomenele de suprafață includ tensiunea superficială, fenomenele capilare, activitatea de suprafață... Dicţionar enciclopedic mare
fenomene de suprafaţă- - fenomene fizico-chimice cauzate de distribuția neuniformă a moleculelor de solvenți și soluți în apropierea interfeței. Chimie generală: manual / A. V. Zholnin ... Termeni chimici
FENOMENE DE SURFACE- fenomene care apar în stratul de suprafață, la interfețele dintre medii și cauzate de creșterea activității și orientării moleculelor stratului de suprafață, caracteristici ale structurii și compoziției acestuia, precum și chimice. și fizice interactiuni in... Marea Enciclopedie Politehnică
Fiz. chimic. fenomene care se datorează proprietăților speciale (comparativ cu vrac) ale straturilor superficiale ale lichidelor și solidelor. Naib. sv comun și important în aceste straturi este excesul de svob. energia F \u003d sS, unde s este tensiunea de suprafață (interfacială), pentru ... ... Enciclopedia chimică
Exprimarea proprietăților speciale ale straturilor de suprafață, adică straturi subțiri de materie la interfața dintre corpuri (medii, faze). Aceste proprietăți se datorează excesului de energie liberă (vezi Energie liberă) a stratului de suprafață, caracteristicilor sale ... ... Marea Enciclopedie Sovietică
Un grup de fenomene datorate faptului că forțele de interacțiune dintre particulele care alcătuiesc corpul nu sunt compensate la suprafața acestuia. Fenomenele de suprafață includ tensiunea superficială, fenomenele capilare, activitatea de suprafață, ... ... Dicţionar enciclopedic
FENOMENE DE SURFACE- un ansamblu de fenomene asociate proprietăților speciale ale straturilor de suprafață la limita dintre corpurile în contact. Fenomenele de suprafață se datorează prezenței energiei de suprafață. Fenomenele de suprafață includ tensiunea superficială, ...... Dicţionar metalurgic
Cărți
- Chimie Fizica. Fenomene de suprafață și sisteme dispersate. Manual, A. G. Morachevsky. Chimie Fizica. Fenomene de suprafață și sisteme dispersate: Uch. indemnizație, ed. a II-a, șters. ISBN:978-5-81141-857-2…
Fenomene de suprafață- un ansamblu de fenomene datorate proprietăților speciale ale straturilor subțiri de materie la interfața fazelor. Fenomenele de suprafață includ procese care au loc la limita de fază, în stratul de suprafață interfacial și care rezultă din interacțiunea fazelor conjugate.
Fenomenele de suprafață se datorează faptului că în straturile de suprafață de la limitele interfazelor, datorită compoziției și structurii diferite a fazelor de contact și, în consecință, datorită diferenței de legături ale atomilor și moleculelor de suprafață din diferite faze, există un câmp nesaturat de forțe interatomice, intermoleculare. Ca urmare, atomii și moleculele din straturile de suprafață formează o structură specială, iar substanța capătă o stare specială care diferă de starea sa în volumul fazelor prin diferite proprietăți. Fenomenele de suprafață sunt studiate prin chimia coloidă.
Clasificarea fenomenelor de suprafață
Fenomenele de suprafață sunt de obicei clasificate în conformitate cu ecuația combinată a primei și a doua legi ale termodinamicii, care include principalele tipuri de energie. Pentru orice sistem eterogen, acesta poate fi scris sub următoarea formă:
re G = - S d T + V re P + σ re s _ + Σ μ i re n i + φ d q (\displaystyle dG=-SdT+VdP+(\subliniat (\sigma ds))+\Sigma \mu _(i)dn_ (i)+\varphi dq)Această ecuație arată creșterea energiei Gibbs prin suma algebrică a incrementelor altor tipuri de energie. Este evident că energia de suprafață este capabilă să se transforme în următoarele tipuri de energie:
- Energia Gibbs
- energie chimica
- energie mecanică
- Energie electrica
Transformarea energiei de suprafață într-unul dintre tipurile de energie enumerate corespunde anumitor fenomene de suprafață, cum ar fi modificarea reactivității cu modificarea dispersiei, aderenței și umezirii, capilarității, adsorbției, fenomenelor electrice.
Semnificația fenomenelor de suprafață
Fenomenele de suprafață sunt larg răspândite în ingineria chimică. Aproape orice producție chimică se realizează folosind sisteme dispersate și fenomene de suprafață. De regulă, toate procesele eterogene din tehnologia chimică sunt efectuate la suprafața maximă de contact a fazei. Pentru a face acest lucru, sistemele de materie sunt transferate în starea de suspensii, pulberi, emulsii, ceață, praf. Procesele de măcinare a materiilor prime și a produselor intermediare, îmbogățirea se desfășoară în sisteme dispersate, un rol semnificativ în ele îl joacă fenomene precum umezirea, capilaritatea, adsorbția, sedimentarea, coagularea. Adsorbanții și catalizatorii poroși, care sunt un sistem dispersat cu un mediu de dispersie solid, sunt utilizați pe scară largă în tehnologia chimică.
Modelele fenomenelor de suprafață, în special formarea structurii, servesc ca bază teoretică pentru obținerea materialelor cu proprietățile dorite: ceramică, ciment, vitroceramică, adsorbanți, catalizatori, polimeri, pulberi, medicamente etc.
Fenomene pe suprafețele apei
Există un contrast distinct între simplitatea interfeței ulei-apă la inspecția vizuală și complexitatea acesteia la nivel scară microscopică ro , care se manifestă în structura moleculară a limitei și în dinamica legăturilor sale de hidrogen. O cantitate imensă de muncă, începând cu Poisson și Maxwell, a fost dedicată studiului structurii apei și reactivității sale la interfață, cu toate acestea, din cauza scandalului poliapă, subiectul structurii apei a cunoscut o scădere a activității științifice.
Fenomenele de suprafață la interfața ulei-apă stau la baza unui număr de procese chimice, fizice și biologice importante, inclusiv formarea micelelor și a membranei, plierea proteinelor, separarea chimică, recuperarea uleiului, formarea nanoparticulelor și polimerizare la interfață ro.
Structura apei în contact cu suprafețele hidrofobe „extinse” care apar la interfață, cum ar fi o emulsie de hexan, este foarte diferită de aceea înveliș de hidratare ro substanțe dizolvate simple precum metanul. Într-o soluție omogenă de metan, moleculele coajă de apă orientat tangențial la sfera moleculei de metan; în timp ce într-o emulsie de hexan, aproximativ 25% din moleculele de apă de suprafață pierd o legătură de hidrogen, iar grupările libere rezultate Oh pătrunde în micela hexan. Conform ipotezei chimiștilor Y. Chon și R. A. Markus, prezența grupurilor libere Oh este motivul pentru care unii reacții organice pe suprafețele apei ro sunt accelerate de sute de ori.
Vezi si
Note
Literatură
- Frolov Yu. G. Curs de chimie coloidală. - SRL TID „Alianța”, 2004. - 464 p. - ISBN 5-98535-003-7.
- Chaplin, M. Structurarea apei la suprafețele coloidale // Chimia suprafețelor în știința biomedicală și a mediului: [Engleză ] / J. P. Blitz, V. M. Gun'ko (eds.). - Springer Olanda, 2006. - P. 1-10. - DOI:10.1007/1-4020-4741-X_1 .
- Jung, Y.
Procesele care au loc la interfață sunt numite fenomene de suprafață. Motivul fenomenelor de suprafață este starea specială a moleculelor din straturile direct adiacente interfeței, deoarece aceste straturi sunt diferite de straturi interioare proprietățile lor fizice și chimice (energie specifică, densitate, vâscozitate, conductivitate electrică, compoziție). Mai mult, cu cât specificul este mai mare energia sistemului, cu cât proprietățile diferă mai puternice și cu atât influența fenomenelor de suprafață este mai puternică asupra comportării sistemului în ansamblu.
Presiunea moleculară. Starea energetică a moleculelor de substanță în volumul fazei și în stratul de suprafață nu este aceeași. Moleculele situate în volumul fazei experimentează aceeași atracție (și repulsie) din partea moleculelor care o înconjoară și, prin urmare, rezultanta forțelor moleculare este zero. De exemplu, o moleculă lichidă în punctul A. Pe o moleculă (punctul B) situată la limita de fază, din diferite (adiacente)
mai mult decât forţele de atracţie ale fazei gazoase. Dacă atracția din moleculele de gaz poate fi neglijată, atunci forța de atracție a suprafeței molecule lichide, ocupând o suprafață de 1 m 2 , de către moleculele straturilor adânci este egală cu presiunea internă (moleculară) a lichidului, adică forța de atracție dintre moleculele unui lichid dintr-un volum. Mărimea presiunii interne a lichidului este foarte mare și depinde de polaritatea lichidului. Cu cât substanțele sunt mai polare și cu cât atracția moleculelor lor este mai mare, cu atât presiunea internă este mai mare. De exemplu, pentru apă 14800 atm. Și pentru benzen - 3800 atm.
tensiune de suprafata. Energie de suprafață liberă. Pentru a crește suprafața lichidului (adică, transferul de materie din volumul fazei la stratul de suprafață), este necesar să depășiți forța presiunii interne și să lucrați. Această muncă este cu atât mai mare, cu atât suprafața creată este mai mare și tensiunea superficială este mai mare. Tensiunea unilaterală a stratului de suprafață al moleculelor se numește tensiune superficială ( σ ). Este o expresie a forțelor de coeziune dintre moleculele unei substanțe date într-o stare dată.
Energia cheltuită pentru crearea suprafeței va fi folosită pentru a crește energia moleculelor pentru a le scoate din adâncimea fazei la suprafață. Excesul de energie al moleculelor de suprafață în comparație cu energia moleculelor interne pe unitatea de suprafață se numește energie de suprafață liberă: F= σ . S (măsurat în J/m2 sau erg/cm2). Așa cum se vede
din formula, tensiunea superficiala este numeric egala cu munca de formare a unei unitati de suprafata sau energie libera specifica: . Este exprimarea energiei tensiune de suprafata. Definirea forței tensiune superficială: aceasta este o forță care acționează pe o suprafață tangențial cu aceasta și care urmărește să reducă suprafața liberă a corpului până la cele mai mici limite. În acest caz, se măsoară în N/m.
Conform legii II a termodinamicii, energia de suprafață liberă a sistemului tinde spontan spre minim. Aceasta înseamnă că energia de suprafață liberă poate fi redusă prin reducerea suprafeței sau prin reducerea tensiunii superficiale. O scădere a suprafeței sub acțiunea forțelor de presiune moleculară este posibilă numai pentru lichide, deoarece forțele de coeziune ale moleculelor sale nu sunt prea mari. Prin urmare, picăturile mici se contopesc în altele mai mari, iar picăturile lichide din aerosoli, ceață și emulsii au o formă sferică.
O scădere a energiei de suprafață liberă datorită scăderii tensiunii superficiale este inerentă atât lichidelor, cât și solidelor. Tensiunea superficială poate scădea datorită acumulării pe suprafața moleculelor unei alte substanțe, în special a unui surfactant. Aceste molecule, prin atracția lor, compensează parțial retragerea moleculelor de suprafață ale unei faze date în interiorul volumului, iar sistemul devine mai stabil.
Energia de suprafață liberă și tensiunea superficială depind de temperatură, natura fazelor, natura și concentrația substanțelor dizolvate.
Odată cu creșterea temperaturii, tensiunea superficială scade, deoarece atractia reciproca a moleculelor scade. În punctul critic, tensiunea superficială ajunge la zero, deoarece în acest caz, diferențele și limita de fază dispar.
O creștere a presiunii reduce tensiunea superficială doar în sistemul „gaz-lichid”, deoarece in acelasi timp, gazul se apropie de lichid din punct de vedere al proprietatilor fizico-chimice.
De asemenea, trebuie remarcat faptul că poate fi măsurată doar tensiunea superficială a lichidelor. Pentru solide, acest lucru este imposibil, deoarece este imposibil să se întindă artificial suprafața unui corp solid din cauza distrugerii acestuia. Tensiunea superficială a solidelor este determinată prin calcul. Pentru a măsura tensiunea superficială a lichidelor, metode statice (metode de ridicare capilară, picături culcate sau suspendate), metode semi-statice (metoda presiunii maxime a bulei de gaz, metoda ruperii inelului, metoda stalagmometrică (metoda de se folosesc picături de cântărire sau numărare) Dintre acestea, simplă și suficientă metoda stalagmometrică este exactă, pe baza faptului că în momentul separării sub acțiunea gravitației de la capătul capilarului, o picătură de lichid, greutatea acestuia este practic egal cu puterea tensiune superficială aplicată pe circumferința capilarului.
Pentru soluțiile diluate, a căror densitate diferă puțin de densitatea apei, tensiunea superficială poate fi calculată folosind ecuația (mJ / m 2): ![]() .
.
aderenta si coeziunea. Fenomenele de suprafață sunt importante în farmacie, deoarece majoritatea medicamentelor - pulberi, tablete, emulsii, suspensii, aerosoli, unguente etc. sunt sisteme dispersate. În producția de medicamente, se întâlnesc adesea fenomene precum adsorbția, umezirea și aderența.
Atractia care apare intre doua corpuri diferite (solide sau lichide) atunci cand acestea vin in contact se numeste aderenta (din latinescul adhaesio atractie, aderenta). Caracterizează forța de aderență a substanțelor diferite și se măsoară prin munca depusă la separarea moleculelor unei faze de moleculele altei faze (măsurată în J/m 2). Această muncă este calculată conform ecuației Dupre-Young: W A \u003d σ well-g (1 + cosӨ). Acțiunea adezivilor, lianților, acoperirilor se bazează pe fenomenele de aderență. Afectează dezintegrarea tabletelor, rezistența cochiliilor, dizolvarea formelor de dozare solide și este utilizat pentru a caracteriza materialele utilizate în chirurgie și stomatologie.
Aderența moleculelor, atomilor, ionilor omogene, care include toate tipurile de atracție intermoleculară, interatomică și interionică într-o fază, se numește coeziune (lat. „legătură”). Caracterizează rezistența unei substanțe și este măsurată prin munca necesară pentru a rupe substanța (depășirea forțelor de coeziune dintre molecule) și a crea două noi unități de suprafețe. Valoarea aderenței este numeric egală cu dublul valorii tensiunii superficiale: W cog. = 2σ.
Concepte de bază ale proceselor de adsorbție. Solid sau lichid, pe suprafața căruia are loc adsorbția, se numește adsorbant, iar substanța adsorbită se numește adsorbat sau adsorbat. Procesul de acumulare spontană a unei substanțe la interfață se numește adsorbție (D). Se exprimă prin cantitatea de substanță adsorbită de o unitate de suprafață sau masă (mol/m2, mol/g). Adsorbția, care se realizează sub acțiunea forțelor van der Waals și a legăturilor de hidrogen, se numește fizic. Adsorbția, care se bazează pe apariție legaturi covalenteîntre moleculele adsorbante și adsorbante se numește chimic sau chimisorbția. Adsorbția fizică este un proces reversibil și este însoțită de desorbție (eliberarea suprafeței de substanța adsorbită). Între adsorbție și desorbție se stabilește un echilibru dinamic, a cărui poziție depinde de temperatură. O creștere a temperaturii scade adsorbția fizică și îmbunătățește adsorbția chimică. Desorbția se realizează prin distrugerea adsorbantului, o schimbare a temperaturii și o scădere a forțelor de interacțiune de adsorbție. Acesta din urmă este utilizat pe scară largă sub formă de eluție. Eluția este o schimbare a fazei adiacente adsorbantului, de exemplu, o soluție, pentru a desorbi substanța. În timpul eluării, substanța adsorbită este deplasată de adsorbant de către moleculele unui nou solvent sau ca urmare a scăderii afinității de adsorbție a substanțelor dizolvate într-o soluție nouă (cel mai adesea prin modificarea încărcăturii adsorbantului și a moleculelor de adsorbant datorită o modificare a pH-ului sau a tăriei ionice a soluției).
O trăsătură caracteristică a adsorbției este selectivitatea (specificitatea). Aceasta înseamnă că fiecare adsorbant adsorb una sau mai multe substanțe specifice. Selectivitatea adsorbției implică o coincidență aleatorie în distribuția densității electronice a moleculelor de adsorbant și adsorbant în funcție de tipul „key-lock”, adică. afinitatea chimică între adsorbant și adsorbant.






