Procesi prijenosa mase: ekstrakcija, ekstrakcija
Klasifikacija procesa prijenosa mase.
Procesi prijenosa mase, u kojima se polazni i finalni proizvodi razmjenjuju, organiziraju se tako da se u kontroliranom obliku dobiju proizvodi koji se nalaze u sirovinama u malim koncentracijama. Ovi procesi se izvode u aparatima za prijenos mase.
Procesi prijenosa mase klasificirani su prema tri glavne karakteristike: stanju agregacije tvari, načinu kontakta faza i prirodi njihove interakcije.
Klasifikacija procesa prijenosa mase prema stanju agregacije kontaktnih faza na slici (1).
Možete zamisliti šest različitih kombinacija od tri moguće faze u dvije: gas - tečnost, gas - čvrsta materija, tečnost - tečnost, tečnost - čvrsta, gas - gas, čvrsta - čvrsta. Posljednje dvije kombinacije se praktički ne koriste u uređajima za prijenos mase.
Kada su dvije odvojive komponente istovremeno sadržane u plinovitom i
tečne faze, njihovo odvajanje je moguće u procesima destilacije (destilacije) i rektifikacije.
Destilacija (destilacija) - razdvajanje tekućih smjesa na frakcije koje se razlikuju po sastavu.
Rektifikacija je metoda odvajanja tečnih smjesa koje se sastoje od više komponenti.Rektifikacija se zasniva na ponovljenom isparavanju tekućine i kondenzaciji njenih para ili na jednom isparavanju smjese nakon čega slijedi višestepena kondenzacija komponenti.Rektifikacija se koristi npr. , u industriji alkohola za dobivanje rektificiranog alkohola. Dakle, ako se otopina etil alkohola u vodi djelomično ispari, tada će koncentracija alkohola u parnoj fazi biti veća nego u preostaloj tekućini i nego u izvornoj otopini. Ako se nakon toga para kondenzira, dobiće se dvije tekućine s različitim koncentracijama alkohola u sebi. Ponavljanjem ovog procesa mogu se dobiti sve veće koncentracije alkohola, tj. sve veći stepen razdvajanja komponenti.
(Sl.1) Klasifikacija procesa prenosa mase prema stanju agregacije radnih tela: G-gas; Zh - tekućina; TV.t - čvrsto tijelo.
U slučaju kada je komponenta rastvorljiva u svakoj od faza, koje su same jedna u drugoj nerastvorljive, proces prelaska komponente iz gasovite u tečnu fazu naziva se apsorpcija (volumetrijska apsorpcija), a obrnuti proces se zove desorpcija. Na primjer, ako se mješavina amonijaka i zraka dovede u kontakt s vodom, dio amonijaka će prijeći u vodu (voda apsorbira amonijak) i zrak će se djelomično očistiti od njega. U obrnutom procesu, kada vodena otopina amonijaka dođe u kontakt sa zrakom, dio amonijaka će prijeći u potonji - doći će do procesa desorpcije.
Ako se prilikom prelaska jedne od komponenti iz faze u fazu u jednoj od njih količina tečnosti (rastvarača) smanji (poveća), ovaj proces se naziva sušenje (ovlaživanje). Na primer, kada mleko dođe u kontakt sa vrućim vazduhom, voda prelazi u vazduh. Istovremeno, mlijeko se suši i zrak se vlaži.
Prelazak iz čvrstog u gasovito stanje bez prolaska kroz tečnu fazu naziva se sublimacija. U posebnom slučaju kada su i gas i čvrsta supstanca samo nosioci tečnosti koja se nalazi u porama i na površini čvrste supstance, njen prelazak u paru kada se dovodi toplota naziva se sušenje ili sušenje zamrzavanjem. Konkretno, kod povrća se vlaga u tečnom ili parovitom stanju prenosi na površinu, a zatim se uklanja sa površine, tj. tipičan proces sušenja. Obrnuti proces - prelazak komponenti smjese iz plinovite faze u čvrstu - naziva se procesom adsorpcije (površinske apsorpcije) ili procesom jonske izmjene.Primjer adsorpcije je prodiranje čestica vodene pare. iz njegove mešavine sa vazduhom u granule silika gela i njihovo zadržavanje u njegovim porama; dok se vazduh suši.
Ako je plinovita faza mješavina nekoliko komponenti koje se adsorbiraju u različitom stupnju adsorbentom, moguće je odvojiti smjesu frakcijskom adsorpcijom.
Prilikom razdvajanja u sistemu tečnost-tečnost, dve tečnosti nerastvorljive jedna u drugoj se dovode u kontakt, od kojih svaka u različitoj meri rastvara odvojenu komponentu. Primjer: razdvajanje etil alkohola i izobutanola dovođenjem njihove smjese u kontakt sa vodom. U tom slučaju izobutanol aktivno prelazi u vodu. Ako se nakon toga vodena otopina izobutanola odvoji od njegove smjese s etil alkoholom, u kojoj je količina izobutanola značajno smanjena, onda se postupak može ponoviti novim kontaktom odvojene mješavine izobutanola i alkohola sa slatkom vodom i izobutanolom. iz njega se može dobiti veća koncentracija. Ovaj proces se zove tečna ekstrakcija.
Posebno čiste supstance se dobijaju procesima frakcione kristalizacije. Kristali koji su ispali iz otopine i imaju manju količinu zagađivača od izvorne otopine rastvaraju se u čisti rastvarač i ponovo kristaliziraju iz otopine. U ovom slučaju dio zagađivača se ponovo izdvaja.
Ako su obe faze u sistemu tečnost-čvrsta materija neutralne supstance, a odvojena komponenta prelazi iz čvrste u tečnost, proces razdvajanja se naziva ekstrakcija u čvrstom sistemu. tjelesnu tečnost. Primjer ovog procesa je prelazak soka iz cvekle u vodu.
Obrnuti proces prelaska supstance iz tečne faze na površinu čvrste materije odvija se u procesima adsorpcije i druge razmene, a zapreminski - u procesima reverzne ekstrakcije.Primer adsorpcije je prečišćavanje vode od nečistoća. kada se prođe kroz mlaznicu s aktivnim ugljenom koja adsorbira ove nečistoće. Primjer povratne ekstrakcije bi bilo soljenje mesa ili ribe.
Prema načinu faznog kontakta procesi prijenosa mase dijele se na procese sa direktnim faznim kontaktom, kontaktom kroz membrane i bez vidljive fazne granice.Ako se između faza ugrađuju membrane, tada proces razdvajanja spada u oblast membranskih tehnologija.
Prema prirodi interakcije faza, procesi i aparati prijenosa mase dijele se na periodične i kontinuirane. Osim toga, u kontinuiranim procesima moguće je organizirati jednosmjerno, protustrujno, poprečno i kombinirano kretanje komponenti.U zavisnosti od specifične organizacije procesa, različite promjene u koncentracijama supstanci uključenih u mogući su procesi po dužini aparata iu vremenu. Njihova raznolikost se povećava kombinovanjem procesa.
Proračuni aparata za prijenos mase
Inženjerski proračuni aparata za prijenos mase koriste fenomenološke ovisnosti. Oni široko koriste empirijske koeficijente povezanosti između pokretačka snaga proces i reakcije na njega bez dubokog prodiranja u fizičku ili hemijsku suštinu pojava. Pokretačka snaga procesa prijenosa mase je razlika u koncentracijama.
Koncentracija otopine (smjese). Relativna količina date komponente u otopini naziva se njena koncentracija. Otopine s visokom koncentracijom otopljene tvari nazivaju se koncentrirane, a one s niskom koncentracijom nazivaju se razrijeđene.
Najčešće se koriste sljedeći načini izražavanja koncentracija:
Masa - broj jedinica mase rastvorene supstance u 100 jedinica mase rastvora. Na primjer, 15% otopina natrijum hlorida je rastvor, od kojih 100 g sadrži 15 g natrijum hlorida i 85 g vode;
volumetrijski molar - broj molova otopljene tvari po jedinici volumena otopine;
molarna masa - broj molova otopljene tvari u 1000 g rastvarača;
relativni mol (molni udio) - omjer broja molova dotične tvari i ukupnog broja molova svih tvari u otopini.
Proces prijenosa mase će se zaustaviti čim se postigne ravnotežna koncentracija u sistemu.
Fazni balans Glavni uslov za ravnotežu procesa u aparatu za prenos mase je ravnoteža faza. Kada stanje tvari odstupi od ravnoteže, na primjer, kao rezultat promjene termodinamičkih parametara, ostvaruje se prolazni proces uspostavljanja ravnoteže (Le Chatelierov princip).
Stanje ravnoteže poštuje Gibbsovo fazno pravilo, o kojem se govori u uvodu, prema kojem je broj stupnjeva slobode S ravnotežnog termodinamičkog sistema, na koji djeluju samo temperatura i tlak od vanjskih faktora, jednak broju komponenti K minus broj faza F plus dva:
S=K-F +2.
Broj stupnjeva slobode, kao što je poznato, je broj nezavisnih varijabli (temperatura, tlak, koncentracija), za čije vrijednosti je moguća termodinamička ravnoteža. Na primer, u sistemu koji se sastoji samo od vodene pare (broj komponenti K = 1, broj F = 1), imamo S = 1-1 + 2 = 2. Dva parametra ovog sistema, na primer, temperatura i pritisak, može varirati u širokom rasponu bez narušavanja ravnoteže, tj. bez formiranja nove faze. Ako se u istom sistemu pojavi nova faza - tečnost, tada će broj faza postati jednak F=2, a zatim S=1-2+2=1. U ovom sistemu, u stanju ravnoteže, samo jedan parametar, na primer, temperatura, može da se menja nezavisno. Pritisak će tada biti postavljen na nivo koji odgovara podešenoj temperaturi. To će se dogoditi ili zbog dodatnog isparavanja pare iz tečnosti, ili kao rezultat kondenzacije dijela pare.Takav sistem se naziva vlažnim zasićena para. Ako se u istom sistemu pojavi treća faza - čvrsto tijelo (led), tada je F=3, S=0. U tom slučaju sistemu je lišena svaka sloboda, odnosno može se realizovati samo pri jednoj strogo fiksnoj vrijednosti od pritisak i temperatura - na odgovarajućim kritičnim parametrima trostruki bod na dijagramu stanja vodene pare.
U višekomponentnim sistemima, osim temperature i pritiska, mijenjaju se i koncentracije komponenti. Za binarnu mešavinu voda - alkohol imamo K=2, S=2-2=2, tj. ravnotežni uslovi se mogu ostvariti proizvoljnom promjenom dva parametra. Pri atmosferskom pritisku ti parametri mogu biti temperatura i koncentracija jedne ili dvije komponente, ili tlak i koncentracija jedne od komponenti. Ravnotežna stanja binarnog sistema predstavljena su kao zavisnost koncentracije jedne komponente od koncentracije druge, kada su pritisak i temperatura smeše zavisni parametri, a takođe i kao zavisnost koncentracije jedne komponente i koncentracije druga komponenta povezana s njim, na proizvoljnoj temperaturi.
Izobarski dijagram, u koordinatama, ima dvije krive - krivu ključanja i krivu kondenzacije. Izoterma na njoj odgovara koncentraciji kipuće tekućine i koncentraciji kondenzata iz pare kompozicije. Količina parne i tečne faze obrnuto je proporcionalna odnosu segmenata. Tačka na dijagramu odgovara pregrijana para temperaturni sastav.
Jednačine materijalnog bilansa. Jednačina radne linije.
Razmotrimo ravnotežu materijala u aparatu za prijenos mase na primjeru protustrujnog aparata visine H, koji je postavljen vertikalno i gdje se dvije faze komponenti kreću jedna prema drugoj.
Odozgo, m 2H kg/s tečnosti sa početnom koncentracijom druge komponente C 2H ulazi u aparat, a m 2H kg/s tečnosti sa konačnom koncentracijom C 2K se uklanja odozdo. Odozdo ulazi m 1H kg/s gasa sa početnom koncentracijom prve komponente C 1H, a odozgo se uklanja m 1K kg/s gasa sa konačnom koncentracijom C 1K.
Zanemarujući gubitke u stacionarnim uslovima, možemo zapisati jednačine materijalnih bilansa:
m 2H + m 1H = m 2K + m 1K;
m 2H C 2H + m 1H C 1H = m 2K C 2K + m 1K C 1K .
m 2 C 2 + m 1H C 1H = m 2K C 2K + m 1 C 1.
Posljednja jednačina naziva se jednačina radne linije procesa. Uspostavlja odnos između koncentracija željene komponente u svim dijelovima aparata. Ovo je jednadžba prave linije sa nagibom
m 2 / m 1.
Jednačina radne linije prikazana je kao prava linija AB, a ravnotežne linije za procese prelaska iz gasovite faze u tečnu i iz tečne u gasovitu su 0 (E) G - F i 0 (E) F - G. Prema relativnom položaju radne i ravnotežne linije može se suditi o smjeru prijelaza tvari. Ako je radna linija iznad linije ravnoteže, tada je koncentracija prve komponente u gasu veća od ravnotežne, a u tečnosti je niža od ravnotežne, tj. C 11> (C 11 *) g - f; Od 21< (С 21 *) г _ ж.
U tom slučaju, komponenta će preći iz plinovite faze u tekućinu.
Koeficijent prijenosa mase. Pokretačka sila u procesu prijenosa mase je razlika u koncentracijama u jezgru strujanja i na granici faze AC, a reakcija sistema je protok mase prenesene tvari. Njihov odnos u fenomenološkoj zavisnosti je predstavljen kao:
DM = ? C.
Gdje? - konstantno.
Prilikom računanja uređaja iz konstante? dodijeliti faktor koji karakterizira sam uređaj. Ovo je površina prijenosa mase F. Tada ćemo imati:
DM=? C? F; ? F=?.
Trajno? naziva se koeficijent prijenosa mase. Za difuzijske aparate za proizvodnju šećerne repe
? \u003d 1,5 - 10- 7 ... 8,5 10- 6 m / s.
Zavisnosti kriterijuma.
Prandtlov kriterij u difuzijskim procesima karakterizira razliku u profilima brzine i koncentracije u njima, što nastaje zbog činjenice da procesi koncentracijske relaksacije izostaju u procesima uspostavljanja brzina protoka u aparatima. 5 kašnjenje može biti prilično značajno. Specifični tipovi kriterijskih jednačina prijenosa mase (dati kao primjer):
Nu D \u003d 3,8- 10 -4 Re l, 38 Pr D
izračunati koeficijent prijenosa mase iz čestica biljnog materijala;
0,0066 Re Pr 0,5
za izračunavanje koeficijenta prijenosa mase u koloni koja se navodnjava filmom pri Re W = 4...80.
BROJ PRENOSNIH JEDINICA
Razmotrimo proces prenošenja ekstrahirane komponente prve faze u drugu. Faze su označene prvom znamenkom indeksa pri koncentraciji C. Na ulazu u aparat, koji odgovara tački A, koncentracija supstance u prva faza je C 1n.
Na grafu, linija AB, koja je jednačina C 1 =f(C 2), je radna linija procesa. Radna linija procesa uspostavlja odnos između koncentracija komponente, koja se koristi za izračunavanje procesa, u bilo kojoj sekciji aparata.
Kriva C 1 = f (C 2) je ravnotežna linija, ravnotežno stanje svake koncentracije bilo koje komponente u prvoj fazi (na primjer, alkohola u plinskoj fazi) odgovara strogo definiranoj koncentraciji iste komponente u 2. faza (na primjer, alkohol u drugoj tečnoj fazi). Svaka temperatura i pritisak imaju svoju krivu ravnoteže.
Ako pretpostavimo da prva faza koja ulazi u aparat dolazi u ravnotežu u prvoj fazi sa 2. fazom koja se povlači, tada će koncentracija prve faze biti jednaka C 12
itd...................
Tehnološki procesi, čija je brzina protoka određena brzinom prijenosa tvari iz jedne faze u drugu, nazivaju se prijenosom mase, a aparati u kojima se ti procesi odvijaju su aparati za razmjenu mase .
Procesi prijenosa mase zauzimaju posebno mjesto među hemijskim i tehnološkim procesima.
U većini proizvodnih pogona hemijske industrije aparati za prijenos mase i reakcije povezani su prema sljedećoj shemi
(Sl. 4.1).
Rice. 4.1. Šema tehnološkog procesa sa aparatom za prijenos mase
Sirovina ulazi u reaktor, gdje se djelimično pretvara u produkte reakcije, budući da hemijske reakcije da biste dobili ciljne proizvode ne nastavljajte do kraja. Smjesa produkta reakcije i sirovina koje napuštaju reaktor, a ne sudjeluju u reakciji, šalje se u opremu za odvajanje masenog prijenosa. U opremi se smjesa razdvaja na produkte reakcije i neizreagovane sirovine, koje se vraćaju u reaktor, a produkti reakcije se stavljaju na dalju obradu.
Iz toga slijedi da postoji bliska tehnološka veza između reakcijskih i aparata za odvajanje. Zakon ove veze je: što je manje opterećenje reakcionog aparata, tj. što je niža konverzija sirovine u produkte reakcije, to je veće opterećenje aparata za separaciju, i obrnuto.
Optimalna kombinacija opterećenja na reakcijskom i separacijskom aparatu osigurava minimalne troškove proizvodnje. Dakle, osnova hemijske proizvodnje - reaktor - radi optimalno samo u kombinaciji sa optimalno funkcionalnim aparatom za odvajanje. U tom smislu, rad aparata za razmjenu mase u kemijskoj industriji nije ništa manje važan od rada samog reaktora.
U aparatu za odvajanje mogu se izvesti različiti procesi. Glavni i najvažniji od njih su apsorpcija, rektifikacija, ekstrakcija, kristalizacija, adsorpcija, sušenje, procesi jonske izmjene i membransko odvajanje.
Apsorpcija je proces separacije zasnovan na selektivnoj apsorpciji gasova ili para tečnim apsorbentima - adsorbentima. Ovaj proces se koristi u mnogim industrijama u kojima je potrebno izdvojiti bilo koju tvar ili kompleks tvari iz mješavine plinova. Tokom procesa apsorpcije prijelaz tvari ili grupe tvari iz plinovite (parne) faze u tekućinu desorpcija.
ispravljanje naziva proces odvajanja mješavine tekućina koje imaju razne temperature ključanja pri odgovarajućem pritisku, u čiste ili obogaćene komponente kao rezultat protivstrujnog kretanja tokova pare i tečnosti. Proces ima veliki značaj u onim industrijama koje zahtijevaju djelomično ili potpuno odvajanje tekućih homogenih smjesa na čiste komponente ili njihove grupe. Tokom procesa ispravljanja, prijelaz tvari ili grupe tvari iz tekuće faze u paru i obrnuto.
Ekstrakcija naziva se proces separacije koji se zasniva na ekstrakciji tvari ili grupe tvari otopljenih u jednoj tekućini drugom tekućinom koja se ne miješa ili se samo djelomično miješa s prvom. Proces se koristi kada otopljenu tvar ili grupu supstanci treba ekstrahirati iz otopine. U ovom procesu postoji prelazak supstance iz jedne tečne faze u drugu tečnu fazu.
Adsorpcija je proces odvajanja koji se temelji na selektivnoj apsorpciji plinova, para ili tvari otopljenih u tekućinama pomoću čvrstog poroznog apsorbera - adsorbenta koji može apsorbirati jednu ili više tvari iz njihove smjese . Proces se koristi u onim industrijama gdje je potrebno izdvojiti jednu ili drugu tvar iz mješavine plinova, para ili otopljenih tvari. U ovom procesu supstance prelaze iz gasovite ili tečne faze u čvrstu. Obrnuti proces se zove desorpcija.
Proces jonske izmjene je proces ekstrakcije supstance iz rastvora, zasnovan na sposobnosti nekih čvrste materije(jonski izmjenjivači) za zamjenu svojih mobilnih jona za jone ekstrahirane tvari. Proces se koristi za ekstrakciju tvari iz otopina. , imaju nisku koncentraciju. U ovom procesu supstance prelaze iz tečne faze u čvrstu.
sušenje nazvan proces uklanjanja vlage iz čvrstih vlažnih materijala isparavanjem. Proces je neophodan za one industrije u kojima se vlažne prirodne tvari moraju dehidrirati prije prerade ili gotove tvari u posljednjoj fazi proizvodnje. U ovom procesu postoji prijelaz vlage iz čvrstog vlažnog materijala u paru ili plinovitu fazu.
Kristalizacija nazvan proces odvajanja, zasnovan na odvajanju supstance u obliku čvrste faze (kristala) od tečne faze. Proces se odvija u onim slučajevima kada je potrebno dobiti supstance visoke čistoće. U ovom procesu postoji prelazak supstance iz tečne faze u čvrstu fazu. Obrnuti proces - rastvaranje.
Membransko odvajanje temelji se na sposobnosti određenih tankih filmova (polupropusnih membrana) da propuštaju neke tvari, a zadržavaju druge. U ovom procesu supstance prolaze kroz polupropusnu membranu iz originalne tečnosti ili gasa u tečnu ili gasovitu fazu iza membrane.
Tehnološki procesi čiji je protok određen brzinom prijenosa tvari (mase) iz jedne faze u drugu nazivaju se prijenosom mase, a aparatura za izvođenje ovih procesa aparatom za prijenos mase.
Klasifikacija procesa prijenosa mase
U prehrambenoj tehnologiji uglavnom se koriste sljedeći procesi prijenosa mase: između plina (para) i tekućine, plina i krute, te između dvije tekuće faze.
Ispravljanje– razdvajanje tečne mješavine, koja se sastoji od komponenti različite isparljivosti, na čiste ili obogaćene komponente kao rezultat protustrujne interakcije tokova pare i tekućine. Rektifikacija se koristi u proizvodnji etilnog alkohola i odvajanju eteričnih ulja. Tokom destilacije i rektifikacije, neke supstance prelaze iz tečnosti u paru, druge iz pare u tečnost.
Apsorpcija- selektivna apsorpcija gasova ili para tečnim apsorbentima - apsorbentima.
Proces se koristi u proizvodnji gaziranih voda, piva i nekih vrsta vina, sulfatizaciji mošta i soka od grožđa radi sprečavanja fermentacije, zasićenja soka od cvekle sa stvaranjem nerastvorljivog kalcijum karbonata.
Adsorpcija- selektivna apsorpcija gasova, para ili supstanci rastvorenih u tečnostima površinom čvrstog apsorbera - adsorbenta.
Postupak se koristi za bistrenje vina, prečišćavanje vodeno-alkoholnih rastvora od boja i drugih nečistoća, za obezbojavanje sokova i sirupa u proizvodnji šećera.
Obrnuti proces - desorpcija- provodi se nakon adsorpcije i često se koristi za regeneraciju apsorbirane tvari iz apsorbera.
Sušenje- uklanjanje vlage iz vlažnih materijala isparavanjem. Ovaj proces se koristi u svim granama prehrambene industrije, gdje se vlažne prirodne tvari prije obrade moraju dehidrirati, odnosno dehidrirati gotov proizvod. Tokom procesa sušenja, vlaga se pretvara u paru ili gas.
Kristalizacija- proces odvajanja čvrste faze u obliku kristala od rastvora ili taline.
Proces se koristi u proizvodnji šećera i kristalne glukoze, limunske kiseline, natrijevog glukanata. U procesu kristalizacije, tvar se pomiče na površinu kristala i prelazi iz njega tečno stanje u kristalno. Obrnuti proces - prijelaz čvrste kristalne faze u otopinu naziva se otapanjem.
Osnovni koncepti
Prijelaz tvari (ili više tvari) iz jedne faze u drugu kroz njihovu granicu u smjeru postizanja ravnoteže naziva se transfer mase, ili transfer mase.
Prijelaz tvari iz faze u faznu granicu ili u obrnuti smjer, tj. unutar jedne faze, naziva se transfer mase.
U većini slučajeva, tri supstance su uključene u prenos mase: distribuciona supstanca (ili supstance) koja čini prvu fazu; agent za distribuciju (ili agenti) koji čine drugu fazu; distributivna supstanca (ili supstance) koja prelazi iz jedne faze u drugu.
Nazovimo prvu fazu G (gasna faza) , sekunda L (tečna faza) i distribuiranu supstancu M. Budući da su svi razmatrani procesi prijenosa mase reverzibilni, distribuirana supstanca može preći iz faze G in L i obrnuto, ovisno o koncentraciji ove tvari u fazama distribucije.
Pretpostavimo da je supstanca koja se distribuira u početku samo u fazi G i ima koncentraciju. U fazi L
u početnom trenutku nema distribuirane supstance, a samim tim ni njene koncentracije u ovoj fazi 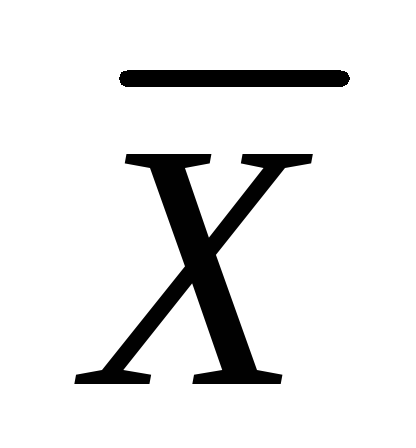 = 0.
= 0.
Ako se faze distribucije dovode u kontakt, dolazi do prijenosa distribuirane tvari iz faze G u fazi L, a u potonjem će se naći određena koncentracija distribuirane supstance 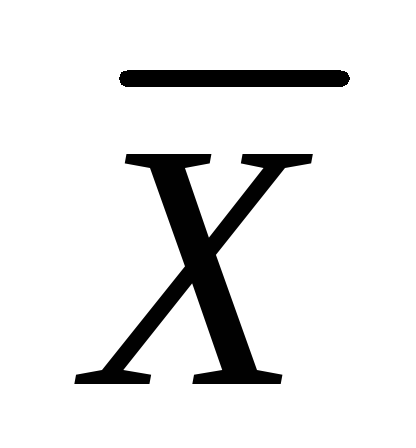 > 0. Od pojave materije M u fazi L počinje i njegov obrnuti prijelaz u fazu G, ali do određenog trenutka broj čestica M, prolazeći u jedinici vremena kroz jedinicu kontaktne površine iz faze G u fazi L, veći od broja čestica koje prolaze iz faze L in G; krajnji rezultat procesa je tranzicija M van faze G u fazi L.
> 0. Od pojave materije M u fazi L počinje i njegov obrnuti prijelaz u fazu G, ali do određenog trenutka broj čestica M, prolazeći u jedinici vremena kroz jedinicu kontaktne površine iz faze G u fazi L, veći od broja čestica koje prolaze iz faze L in G; krajnji rezultat procesa je tranzicija M van faze G u fazi L.
Nakon određenog vremenskog perioda, brzina prelaska distribuirane supstance iz faze G u fazi L i obrnuto postati isti. Takvo stanje se zove ravnoteža . U stanju ravnoteže, u svakom konkretnom slučaju, postoji striktno definisan odnos između koncentracija distribuirane supstance, koje se u ravnoteži sistema nazivaju uravnotežen . Ravnotežne koncentracije su veoma važne za određivanje brzine protoka procesa.
Stranica 1
Procese prijenosa mase karakterizira slobodna fazna sučelja, koja se značajno mijenja od interakcije tokova - stohastička priroda procesa. Obračun stohastičke komponente omogućava određivanje distribucije koncentracija komponenti duž dužine kontaktne zone, što utiče na geometrijske parametre aparata.
Procesi prijenosa mase u dvofaznim sistemima plin-tečnost imaju široku primjenu u industriji nafte i plina. Takvi procesi su odvajanje i stabilizacija nafte i kondenzata, obrada apsorpcionih gasova i regeneracija glikola. Stacionarni modeli Ovi procesi su izgrađeni prema jednom koncept dijagramu, čija je pojednostavljena verzija razmatrana u ovom paragrafu.
Procesi prijenosa mase (rektifikacija, apsorpcija, ekstrakcija itd.) spadaju među energetski i metalno najzahtjevnije: više od 50% energije se troši na njihovu implementaciju, oko 15% ukupne mase opreme tehnološke linije. kolonski aparat.
Procesi prijenosa mase se po pravilu odvijaju izvan ovih uređaja u komunikacijama instalacija i teku spontano, a njihova efikasnost je određena slučajnim parametrima kretanja emulzije. U ovim uvjetima, značajan broj kapljica s ne-rearl-thiottymtt brongttymum školjkama ulazi u aparat za taloženje, povećavajući efikasnost njegovog rada.
Procesi prijenosa mase - otapanje, kristalizacija, sušenje, destilacija, rektifikacija, apsorpcija, ekstrakcija, desorpcija, koji su prijenos tvari unutar faze ili između faza, uzrokovan gradijentom njezinih koncentracija i koji se odvija bez promjene hemijski sastav. Da biste to učinili, poslužite: kristalizatore, sušare, destilatore, ispravljače, apsorbere, ekstraktore, desorbere.
Procesi prenosa mase koji se široko koriste za prečišćavanje supstanci i odvajanje smeša su veoma raznovrsni. Oni se razlikuju stanje agregacije interakcije faza, priroda njihovog kretanja u aparatu, prisutnost paralelnih procesa prijenosa topline. To je razlog za širok izbor uređaja za prijenos mase koji se koriste u praksi. Do određene mjere razlikuju se i metode njihovog izračunavanja. Ovo poglavlje govori o najčešćim procesima prijenosa mase: apsorpciji, desorpciji i ekstrakciji tekućine u protustrujnim kolonama, kontinuiranoj destilaciji binarnih i višekomponentnih sistema, periodičnoj adsorpciji i aparaturi sa fiksnim slojem sorbenta.
Procesi prijenosa mase povezani su s prijelazom tvari iz jedne faze u drugu kao rezultat difuzije.
Procesi prijenosa mase često se kombiniraju s mehaničkim i hidromehaničkim procesima. Na primjer, potpuno ili djelomično frakciono otapanje čvrstih proizvoda kombinira se s drobljenjem. Takva kombinacija značajno ubrzava proces rastvaranja, a u slučaju frakcijske otopine omogućava značajno povećanje stepena ekstrakcije ciljnih komponenti iz sirovine.
Procesi prijenosa mase se po pravilu odvijaju izvan ovih uređaja u komunikacijama instalacija i teku spontano, a njihova efikasnost je određena slučajnim parametrima kretanja emulzije. U tim uslovima značajan broj kapljica sa nerazrušenim oklopnim školjkama ulazi u opremu za taloženje, smanjujući njenu efikasnost. Sekcija za izmjenu mase formirača kapi dizajnirana je da izvrši efikasan prijenos mase između globula vode u formaciji i kapljica vode koje sadrže demulgator (s vjerovatnoćom od 0 999 ili više) pod uvjetima koji osiguravaju postojanje kapljica date veličina u toku.
Ministarstvo obrazovanja i nauke Ruske Federacije
Država obrazovne ustanove viši
stručno obrazovanje
„Država Volgograd Technical University»
TEST
po disciplini: Procesi i uređaji
Student Abramov Sergej Ivanovič
Grupa EZK-379k
Provjerio rad ________________________________
Volgograd 2012
Pitanje broj 1 Opšte karakteristike i klasifikacija procesi prenosa mase
Pitanje br. 30 Šema apsorpcije sa recirkulacijom tečnosti i gasa
Bibliografija
1.Opće karakteristike i klasifikacija procesa prijenosa mase Procesi prijenosa mase su procesi u kojima glavnu ulogu igra prijenos tvari iz jedne faze u drugu. Pokretačka snaga ovih procesa je razlika hemijski potencijali. Kao i kod svakog drugog procesa, pokretačka snaga prenos mase karakteriše stepen odstupanja sistema od stanja dinamičke ravnoteže. Unutar ove faze, supstanca se prenosi iz tačke sa višom u tačku sa nižom koncentracijom. Zbog toga se u inženjerskim proračunima pokretačka sila obično izražava približno kroz razliku koncentracije, što uvelike pojednostavljuje proračune procesa prijenosa mase. Procesi prijenosa mase se široko koriste u industriji: za odvajanje tečnih i gasovitih homogenih smeša, da ih koncentriše za zaštitu životne sredine prirodno okruženje(prvenstveno za čišćenje Otpadne vode i otpadnih gasova). Klasifikacija i opšte karakteristike. Najrašireniji su sljedeći procesi prijenosa mase: Apsorpcija Destilacija i rektifikacija Ekstrakcija (tečnost) Adsorpcija Jonska izmjena Otapanje i ekstrakcija iz čvrstih materija Kristalizacija Membranski procesi U svim gore navedenim procesima uobičajena stvar je prijelaz tvari (ili tvari) iz jedne faze u drugu. Proces prijelaza tvari (ili više tvari) iz jedne faze u drugu u smjeru postizanja ravnoteže naziva se prijenos mase. Prenos materije unutar faze - od faze do granice faze ili obrnuto - od međufaze do faze - naziva se prenos mase (po analogiji sa procesom prenosa toplote unutar faze - prenos toplote). Procesi prijenosa mase su obično reverzibilni. Štaviše, smjer prijelaza tvari određen je koncentracijama tvari u fazama i ravnotežnim uvjetima. Glavna kinetička jednačina procesa prijenosa mase je jednačina prijenosa mase, koja se zasniva na općim kinetičkim zakonima kemijskih i tehnoloških procesa. Brzina procesa [u kg/(m2 c)] jednaka je pokretačkoj sili Δ, podijeljeno otporom R: dM/dF = Δ/ R, gdje je dM količina tvari koja je prešla iz jedne faze u drugu u jedinici vremena; dF - površina kontakta faze. Označavajući 1/R = K, dobijamo osnovnu jednačinu prijenosa mase dM =K Δ dF Koeficijent K - koeficijent prijenosa mase (po analogiji s procesom prijenosa topline) karakterizira brzinu procesa prijenosa tvari iz jedne faze u drugu. Dimenzija koeficijenta prijenosa mase: [K]= = [kg/s Δ· m2] tj. koeficijent prijenosa mase K pokazuje koliko distribuirane tvari prođe iz faze u fazu u jedinici vremena kroz jedinicu kontaktne površine faze s pokretačkom silom jednakom jedinici. Dimenzija pokretačke sile Δ može biti različita, a od toga zavisi i dimenzija K. Obično se jednadžba prijenosa mase koristi za određivanje kontaktne površine faza F, a na osnovu te površine i dimenzije aparata za prijenos mase. M / (K Δ)
Procesi prijenosa mase dijele se na: prijenos mase u sistemima sa slobodnom faznom granicom (gas-tečnost, para-tečnost, tečnost-tečnost); prenos mase u sistemima sa fiksnom faznom kontaktnom površinom (sistemi gas - čvrsta materija, para - čvrsta materija, tečnost - čvrsta materija); prijenos mase kroz polupropusne pregrade (membrane). Procesi koje karakteriše slobodna fazna granica uključuju tako široko korišćene procese u tehnologiji kao što su apsorpcija, desorpcija, destilacija i rektifikacija, te tečna ekstrakcija. U ovim procesima granica faznog kontakta je obično pokretna, veličina kontaktne površine faza zavisi od hidrodinamičke situacije, što značajno razlikuje mehanizam prenosa mase u sistemima sa slobodnom faznom granicom od mehanizma prenosa za sisteme sa čvrstom fazom. Procesi prijenosa mase sa slobodnom faznom granicom podijeljeni su u dvije grupe prema principu učešća faza u prijenosu mase. I grupa - procesi u kojima učestvuju najmanje 3 supstance: 1) distribuciona supstanca (ili supstance) koje čine 1. fazu Fu (na primer, kada se amonijak apsorbuje vodom iz mešavine amonijaka i vazduha, vazduh ne učestvuje direktno u masovnom transferu); 2) sredstvo za distribuciju (ili supstance) koje čine 2. fazu Fx (voda u ovaj primjer); 3) distribuirana supstanca M, koja prelazi iz jedne faze u drugu (apsorpcija, desorpcija, procesi ekstrakcije). I grupa procesa (destilacija i rektifikacija) su procesi u kojima tvari koje čine faze učestvuju u procesima prijenosa mase i ne mogu se smatrati nosiocima distribuirane tvari. Smjer procesa, njegova pokretačka snaga zavise od odnosa radne i ravnotežne koncentracije. Koncentracije faza koje učestvuju u procesima prijenosa mase mogu imati različite dimenzije (kg/kg, kmol/m3, itd.). Obično se sastav faza izražava u masenim ili molskim udjelima, relativnim ili volumnim koncentracijama. Br. Koncentracija Oznaka koncentracije komponente A U tečnoj fazi u gasovitoj (parnoj) fazi ), kg A/kg VHU5Zapreminska molarna koncentracija, kmol A/m3 (A+V)ShSu6Zapreminska masena koncentracija, kg A/m3 (A +V)ShSu Odnos između sastava faza u ravnoteži: y* = f(x) gdje je y* ravnotežni relativni molski udio ciljne komponente u gasnoj (parnoj) fazi Grafikon ove zavisnosti je ravnotežna linija. y* = mr x, gdje je mr = y*/x koeficijent raspodjele Koeficijent raspodjele je omjer sastava faza u ravnoteži. Koeficijent raspodjele -tg α- nagib linije ravnoteže tanα=m R Materijalni bilansi procesa prijenosa mase zavise od načina na koji se oni izvode. Razlikovati pojedinačnu, kontinuiranu i stepenastu interakciju faza. U aparatima za kontinualni prijenos mase, proces se može odvijati s kontinuiranim faznim kontaktom (na primjer, u apsorpcionim aparatima tipa filma, koji su u suštini izmjenjivač topline s ljuskom i cijevi, duž unutrašnjih površina cijevi čiji tečni film teče , a gas se kreće prema ovoj tečnosti). U ovom slučaju, koncentracije distribuirane supstance u fazama se monotono mijenjaju. Fig.1. O pripremi materijalnog bilansa sa kontinuiranim kontaktom faza u uslovima suprotnog toka (a) i toka unapred (b) Uz kontinuiranu protivstruju, koja se najčešće koristi u tehnici (slika 1, a), materijalna ravnoteža za proizvoljni dio aparata sa beskonačno malom putanjom izražava se sljedećim relacijama: un> uk - molski udio komponente u gasnoj fazi hk> hn - molni udio komponente u tečnoj fazi M g \u003d G (un- uk) - molarni protok komponente koja je prošla iz gasne faze M W = L(xk-xn) - molarni protok komponente koja je prešla u tečnu fazu. Budući da ista komponenta prelazi iz plinovite faze u tekućinu, tada M g = M f (un-UK) = L(xk-xn) (7.8) Za proizvoljni dio aparata, u kojem su trenutni sastavi ciljne komponente X i Y, jednadžba materijalnog bilansa za gornji dio aparata: (un-y) = L(xk-x) Uz malu promjenu vrijednosti G i L po visini aparata Omjer se naziva jednačina radne linije (jednačina linije radnih koncentracija) kontinuiranog protustrujnog procesa prijenosa mase. Izražava odnos između sastava faza u interakciji u proizvoljnom dijelu aparata. Sa L/G = konst. radna linija je ravna. Ako je L/G ≠ const., tada radna linija odstupa od prave. Postoje dvije vrste prijenosa mase u toku - molekularni i konvektivni. Molekularna difuzija je prijelaz distribuirane tvari u stacionarni medij iz unutrašnjim slojevima ove (prve) faze na sučelje i, prošavši ga, distribuciju po čitavom volumenu druge faze, koja je u kontaktu sa prvom. To je posljedica toplinskog kretanja molekula (jona, atoma), kojem se opiru sile unutrašnjeg trenja. Molekularna difuzija je opisana Fickovim prvim zakonom: dM= -DdFd τ ds /dp Za cijelu difuzijsku površinu F, Fikov prvi zakon je izražen kao M = -D Fτ ds /dp gdje je D koeficijent molekularne difuzije; F - površina normalna na smjer difuzije; ds/dp je gradijent koncentracije supstance po jedinici dužine puta n difuzne supstance; znak minus je povezan sa smanjenjem gradijenta koncentracije ds/dp duž dužine puta difuzije. Koeficijent molekularne difuzije D zavisi od prirode difuzne supstance. Dakle, nije povezan s dinamikom procesa i karakterizira sposobnost tvari da prodre u bilo koji medij. Nađimo njegovu dimenziju iz izraza: [D]= [m2/s], odakle slijedi da koeficijent molekularne difuzije D pokazuje koliko tvari difundira u jedinici vremena kroz jediničnu površinu pri gradijentu koncentracije jednakom jedan. Koeficijent molekularne difuzije D je analogan termalnoj difuzivnosti α.
D vrijednosti se nalaze u referentnim knjigama ili se izračunavaju. Koeficijent difuzije zavisi od temperature (povećava se sa povećanjem temperature), a za gasove - od pritiska (sa povećanjem pritiska, D g opada). Za gasni medij D g ≈ 1 cm2/s, za kondenzovanu (tečnu) sredinu h ≈ 1 s/dan, odakle sledi molekularna difuzija u tečnostima, a još više u čvrste materije- proces je veoma spor. Konvektivni transfer (konvektivna difuzija) karakteriše kretanje (transfer) materije pokretnim česticama strujanja u uslovima turbulentnog faznog kretanja. Konvektivni prijenos tvari pod djelovanjem turbulentnih pulsacija ponekad se naziva turbulentna difuzija. Konvektivni prijenos mase je proces prijenosa tvari tijekom kretanja tekućine ili plina. Ovaj proces se odvija kao da mehanički - teku makrovolumenske čestice tečnosti ili gasa. Prijenos mase, kao i konvekcija, dijeli se na prirodni i prisilni, odnosno prisilni. Kod prirodnog prijenosa mase, kretanje tekućine nastaje zbog razlike u gustoći u različite tačke tečnost, a kada je prisiljena - zbog utroška energije za kretanje toka izvana, pomoću pumpe, miješalice itd. Očigledno je da je prirodni prijenos mase spor proces i rijedak u tehnologiji, ali je često prateći proces prisilnog prijenosa mase. Po analogiji sa Newtonovim empirijskim zakonom hlađenja (ili jednačinom prijenosa topline), jednačina prijenosa mase ima sljedeći oblik: M = β (hgr - x) dFdτ gdje je β koeficijent proporcionalnosti-koeficijent prijenosa mase. Uz stabilan proces za cijelu površinu F prijenosa mase pri τ = 1 s, jednačina ima oblik M = β F (hgr-x). Za Fu fazu, jednačina prijenosa mase će biti slična jednačini M = β F (hgr-h), ali uz odgovarajuću zamjenu koncentracija. Dimenzija koeficijenta prijenosa mase: [β] = [M / F (y-ugl)] = [m / s]. Koeficijent prijenosa mase, za razliku od koeficijenta prijenosa mase, karakterizira brzinu prijenosa materije unutar faze konvekcijom i molekularna difuzija istovremeno. 2. Šema apsorpcije sa recirkulacijom tečnosti i gasa APSORPCIJA gasova (lat. Absorptio, od absorbeo-apsorbovati), volumetrijska apsorpcija gasova i para<#"30" src="doc_zip3.jpg" />
gde je R°2 - pritisak<#"34" src="doc_zip4.jpg" />
gdje je KH Henrijev koeficijent koji se mijenja s temperaturom. Ako se apsorpcija vrši pod pritiskom, ali x * 2 -> 0, rastvorljivost gasa se može izračunati pomoću jednadžbe Kričevskog - Kazarnovskog: gdje je Kf - koeficijent. fizička rastvorljivost, jednaka KH pri x2 -> 0 i P -> -> 0; f*2 - isparljivost gasa; -parcijalni molarni volumen rastvorenog gasa u tečnoj fazi pri beskonačnom razblaženju; R je univerzalna plinska konstanta; Po1 pritisak zasićene pare <#"20" src="doc_zip7.jpg" />(0,05-0,1) molarne frakcije (razrijeđeni rastvori), zatim at niske pritiske Sečenovljeva jednačina vrijedi: gdje je A1,2-koeficijent, neovisno o sastavu otopine, apsorpcija Rice. 1. Zavisnost rastvorljivosti x2* nekih gasova<#"27" src="doc_zip10.jpg" />
gdje je toplinski efekat rastvaranja apsorpcije gasa. Ako se rastvor zagreje tokom apsorpcije, . Kako se temperatura mijenja, ona obično ili ostaje konstantna ili se neznatno mijenja. Rastvorljivost plina u miješanom otapalu (koji sadrži komponente niskog polariteta) može se procijeniti iz relacije: gdje je KN.si, KN.N- Henry koeficijent odn. za gas u mešavini rastvarača i za rastvore ovog gasa u čistim komponentama rastvarača; - koeficijent aktivnosti komponenti rastvarača (molni udjeli se odnose na mješavinu rastvarača bez otopljenog plina). Neki podaci o rastvorljivosti gasova<#"18" src="doc_zip17.jpg" />i Lennard-Jonesapsorpcioni potencijal Ovi parametri se mogu koristiti za aproksimaciju rastvorljivosti gasova<#"32" src="doc_zip19.jpg" />
gdje je rastvorljivost u 1 m3 gasa, svedena na normalne uslove (20 °C, 0,1 MPa) po 1 m3 apsorbenta; kv - Boltzmannova konstanta; P0, T0 - pritisak<#"31" src="doc_zip21.jpg" /> Ispod su vrijednosti parametara Lennard-Jones potencijala (u K) za plinove<#"24" src="doc_zip23.jpg" />i tečnosti: Toplotni efekat rastvaranja gasa AH se linearno menja sa povećanjem; odnosno rastvorljivost slabo rastvorljivih gasova<#"21" src="doc_zip27.jpg" />, uglavnom He, Ne, H2, N2, CO, Ar, O2 i NO, raste sa porastom temperature (osim vodenih rastvora), a rastvorljivost visoko rastvorljivih gasova<#"21" src="doc_zip28.jpg" />smanjuje. Tipični primjeri za beskonačno razrijeđene otopine prikazani su na sl. 2. Rastvorljivost gasova kao što su H2S, COS, SO2, HC1, NH3, C12 je obično mnogo veća od one izračunate jednačinom (1), zbog specifične interakcije sa molekulima rastvarača. Kod kemijske apsorpcije, apsorpcijski kapacitet apsorbenta (kapacitet koji odgovara graničnoj količini plina koji se apsorbira jedinicom volumena apsorpcije) i više nego kod fizičke apsorpcije U ireverzibilnoj reakciji (na primjer, kada se CO2 apsorbira od strane NaOH rastvori sa stvaranjem Na2CO3), ravnotežni pritisak gasa iznad rastvora je nula sve dok u rastvoru ima neizreagovanog apsorbenta, a kapacitet apsorpcije je određen stehiometrijom reakcije. Uz reverzibilnu reakciju, pritisak<#"30" src="doc_zip30.jpg" /> proces prijenosa mase apsorpcija tečni plin gde je Kx = ASKfKP konstanta ravnoteže sistema gas-tečnost; Kp je konstanta ravnoteže reakcije; - ravnotežni stepen konverzije apsorbenta; x1 - početna koncentracija apsorbenta; h je broj molova produkta reakcije po 1 molu izreagovanog gasa; j je broj molova apsorbenta koji je stupio u interakciju sa 1 molom otopljenog gasa; A5-koeficijent u zavisnosti od stehiometrije. Faktor ubrzanja apsorpcije može biti prilično velik. Dakle, u slučaju apsorpcije CO2 u nabijenoj koloni pri istim opterećenjima u pogledu faza, temperature i pritiska, korištenjem 2 N. vodeni rastvor KOH (15% K se nalazi u rastvoru u obliku karbonata), možete dobiti u poređenju sa fizičkim apsorpcija CO2 vodom. Hipotetički idealan rastvarač bez otpora prijenosa tekućine i beskonačne reaktivnosti bi obezbijedio Povećati i (ponekad i nekoliko puta) može nastati pod utjecajem površinske konvekcije uzrokovane lokalnim gradijentima površinski napon, koji u nekim slučajevima nastaju kao rezultat prijenosa mase, posebno uz istovremeni prijenos. tok reakcija (na primjer, tokom apsorpcije CO2 vodenim rastvorima monoetanolamina). Ovo treba uzeti u obzir pri odabiru novih hemisorbenata. Značenje ako reakcija dovodi do pojave površinske konvekcije, treba je odrediti na osnovu koeficijenta prijenosa mase tokom fizičke apsorpcije, koji se nalazi u uvjetima izlaganja procesu konvektivnih mikroprotoka u blizini granice faze. Prilikom izračunavanja brzine apsorpcije često se koristi koeficijent prijenosa mase, određen hipotetičkim. površinske kompozicije i, stoga, hipotetički. pokretačke snage. Obično se pretpostavlja da je koeficijent prijenosa mase, koji se odnosi na koncentraciju u plinu, Kg [kmol / (m2 * MPa * s)] posljedica pokretačke sile (y2-y*2), gdje je y*2 molarni udio apsorbirane komponente u plinu, koji odgovara ravnoteži s tekućinom prosječnog volumetrijskog sastava x2; y2 je prosječni volumetrijski sastav plina u datom dijelu apsorpcionog aparata. tada dobijamo: Slično tome, možete pronaći pokretačku silu (x * 2 - x2) i koeficijent prijenosa mase Kzh. Iz izraza (2) i (3) slijedi: gdje je m = (y2,gr - y*2)/(x2,gr - x2) nagib linije ravnoteže u rasponu koncentracija od x2, y2 do x2,gr, y2,gr. Izraz (4) je napisan za lokalni koeficijent prijenosa mase i pokazuje da ovaj koeficijent ovisi o nagibu ravnotežne linije. Najprikladnije je izračunati koeficijent prijenosa mase pomoću jednačine (4) u slučajevima kada nagib ravnotežne linije ostaje gotovo konstantan u području radne koncentracije. Kod krivulje ravnotežne linije potrebno je uzeti u obzir ovisnost m o koncentraciji. Apsorpcija se vrši u uređajima za prijenos mase, zvanim apsorberi, pločasti, pakirani (zastarjeli naziv scrubbers), film, rotacijski film i sprej. Šema tokova materijala u apsorberu prikazana je na sl. 3. Odnos između koncentracija apsorbovane komponente u gasu y2 i u tečnosti u bilo kom horizontalnom preseku aparata nalazi se iz jednačine materijalnog bilansa (tzv. jednačina radne linije). Općenito, ova jednačina ima oblik: gdje su L i G brzine protoka tečnosti i apsorpcija gasa. Kada se fazni volumeni malo mijenjaju tokom apsorpcije, radna linija je prava linija: Ovdje indeks "n" označava donji dio protustrujnog apsorbera ili desorberapsorpcije. Toplotni efekti apsorpcije mogu imati značajan uticaj na tok radnih i ravnotežnih [y* = f(x*2)] linija. Tok radne linije može jako zavisiti od intenziteta isparavanja rastvarača (posebno tokom desorpcije). Ako je apsorpcija praćena značajnim oslobađanjem topline, a količina apsorbiranog materijala je dovoljno velika, rastvarač može postati vrlo vruć kada prolazi kroz kolonu. Primeri - sušenje na vazduhu sa koncentrovanom H2SO4, otapanje<#"416" src="doc_zip42.jpg" /> Rice. 3. Šema tokova materijala u apsorberu i hladnoće radnog i ravnotežnog vodova (a-sa protivtokom, 6-sa predtokom): NN-radni vod; OS-ravnotežna linija; i - pokretačka sila odn. u gasnoj fazi do vrha i odozdo. presjecima aosoroera iu gasnoj i tečnoj fazi na pozornici. U nedostatku vanjskog dovoda ili odvođenja topline, pri istim temperaturama plina i tekućine i bez uzimanja u obzir isparavanja i kondenzacije apsorbenta i topline rastvaranja drugih plinova<#"24" src="doc_zip45.jpg" />, gdje je Cp toplinski kapacitet otopine, je promjena koncentracije plina u razmatranom dijelu. Obično se pretpostavlja da je temperatura tečnosti na granici i u zapremini ista. Budući da se najveća koncentracija otopljenog plina i, shodno tome, najveće oslobađanje topline uočava u blizini kontaktne površine faze, temperatura međufazne površine, koja određuje pravu ravnotežu, često se značajno razlikuje od temperature volumena tekućine. Razvijaju se metode za obračun ove pojave. Lokalne brzine prijenosa mase mogu se koristiti za izračunavanje površine prijenosa mase F potrebne za postizanje željene promjene u sastavu plina u apsorberu [vidi ref. jednadžba (3)1 zajedno sa jednadžbom materijalnog bilansa za apsorbiranu komponentu. Sa konstantnim koeficijentom prijenosa mase duž visine aparata: gdje je G molarna masena brzina plina, kmol/(m2*s); R-ukupan broj jedinice prenosa u gasnoj fazi: Ovaj važan parametar zavisi samo od tehnološkog načina procesa, određen je položajem radne i ravnotežne linije i pokazuje kako utiče apsorpciona pokretačka sila.<#"21" src="doc_zip50.jpg" />. Sa povećanjem se smanjuju dimenzije aparata, ali se povećava potrošnja energije i stepen rastvaranja slabo rastvorljivih komponenti gasne mešavine, što dovodi ili do njihovog gubitka i kontaminacije ekstrahovanog gasa, ili do dodatnih troškova za odvajanje. rastvorenih gasova. Prilikom proračuna apsorbera, posebno diska, često se koristi koncept efikasnosti pozornice, odnosno stepena približavanja ravnoteži. Ova vrijednost se može definirati kao omjer stvarno ostvarene promjene sastava i promjene koja bi se dogodila kada je ravnoteža postignuta: gdje indeks "in" označava vrh. dio apsorpcije protustrujnog aparata Ovo je postignuto u mnogim vrstama stepenastih kontaktnih uređaja. To znači da je u materijalnoj analizi takvih uređaja legitimno koristiti koncept ravnotežnog stupnja. Izračunavanjem broja teoretskih ploča i poznavanjem efikasnosti stepena, moguće je odrediti broj stvarnih stupnjeva potrebnih za obezbjeđivanje datog stepena razdvajanja. Osnove tehnologije apsorpcionih procesa. Apsorpcija se često izvodi u obliku ciklusa apsorpcije-desorpcije (ciklički proces), međutim, korak desorpcije<#"159" src="doc_zip56.jpg" /> Rice. 4. Šematski dijagram ciklusa apsorpcije-desorpcije: 1 - apsorber; 2-pumpa; 3-desorber; 4 - frižider; 5-izmjenjivač topline; 6-bojler; 7 - kondenzator. Phys. apsorpcija se obično vrši na temperaturi okruženje(20-40°C) ili na niskim temperaturama, jer rastvorljivost visoko rastvorljivih gasova<#"38" src="doc_zip57.jpg" />
gdje je stepen aproksimacije ravnoteži na izlazu plina iz apsorbera, ovisno o brzini procesa apsorpcije. Uglavnom: gdje je G2 količina apsorpcije ekstrahovanog plina U ireverzibilnoj reakciji, minimalna količina cirkulirajućeg apsorbera se određuje iz stehiometrijska jednačina reakcije i pronađite. Odnos protoka tečnosti i gasa određen je jednadžbom: Kod procesa otvorene petlje, obično, kod procesa cirkulacije - x2, u x2, p (koncentracija gasa u regenerisanom rastvoru). U najjednostavnijem slučaju (za i) imamo: . Ako je rastvorljivost opisana Henrijevim zakonom, onda.U ovom slučaju, količina cirkulišućeg apsorbenta ne zavisi od količine ekstrahovanog gasa Apsorpcija Kada se ravnoteža postigne na izlazu apsorbera Važan procesni parametar je tzv. faktor apsorpcije: koji je pri punoj ekstrakciji gasa 1. Ovaj faktor je jednak odnosu uglova nagiba radne i ravnotežne linije, koji izražavaju zavisnost stvarne i ravnotežne koncentracije ekstrahovane komponente u gasnoj fazi od njene koncentracije u tečnosti , odnosno. Parametar A istovremeno karakteriše višak količine cirkulišućeg apsorbenta u odnosu na minimum potreban za potpunu ekstrakciju rastvorljivog gasa-apsorpcije. Način desorpcije<#"18" src="doc_zip71.jpg" />određuje se iz stanja ravnoteže na izlazu apsorbera (sa protivstrujom). Minimalna moguća koncentracija gasa u istom rastvoru tokom desorpcije<#"30" src="doc_zip73.jpg" />,
gdje je R i Rpar - ukupni pritisak<#"20" src="doc_zip74.jpg" />nalaze se iz uvjeta usklađenosti s jednadžbom (5) ne samo na izlazu otopine iz desorbera, već iu bilo kojem njegovom dijelu. Gornji dio protustrujnog aparata, gdje gas izlazi iz generatora, često je ograničavajući. Tada je = G2F*, gdje je F* = r*para/p2*(t,x2,v) - omjer tlaka pare<#"28" src="doc_zip76.jpg" />,
gdje je zbir pritisaka otopljenih gasova. Način desorpcije<#"29" src="doc_zip78.jpg" />
Izgradnja radne linije tokom desorpcije<#"160" src="doc_zip79.jpg" /> Rice. 5. Ravnotežna (/) i radna (2, 3) linija e.sorpcije<#"64" src="doc_zip80.jpg" />
gdje su i termalni efekti odn. isparavanje i desorpcija upijanja; - temperaturna razlika između regenerisanog i zasićenog rastvora na hladnom kraju apsorpcionog izmenjivača toplote. Desorpcijski pritisak<#"59" src="doc_zip84.jpg" />
tada Qrel raste sa porastom temperature. Inače, Qotd se smanjuje, a pri datoj brzini toplotnog toka, sa povećanjem pritiska desorpcije, regeneracija se ne pogoršava, ali se, međutim, poboljšava do određene granice određene termohemijskom stabilnošću apsorbenta i povećanjem Q opterećenja. Troškovi energije za desorpciju gasa Bibliografija 1. Kafarov V. V., Osnove prijenosa mase, 3. izd., M., 1979. 2. Rudobashta S. P., Prijenos mase u sistemima sa čvrstom fazom, M., 1980. Sherwood T.K., Pigford R., Wilkie C., Mass transfer, trans. sa engleskog, M., 1982 Planovsky A.N., Nikolaev P.I., Procesi i aparati hemijske i petrohemijske tehnologije, 3. izdanje, M., 1987. Brownshtein B. I., Shchegolev V. V., Hidrodinamika, prijenos mase i topline u aparatima na stupovima, L., 1988. Ramm V. M., Apsorpcija gasova, 2. izdanje, M., 1976. Prečišćavanje procesnih gasova, apsorpcija, priredila T.A. Semenova I. L. Laites, 2. izdanje, M., 1977. Kafarov V.V. - Osnove prijenosa mase, 3. izd. M.: postdiplomske škole, 1979. 439s. Sherwood T., Pigford R., Wilkie C., Mass transfer, trans. s engleskog, M., 1981. Kasatkin A.G. Osnovni procesi i aparati hemijske tehnologije. - M: Hemija, 1971 - 832s. Ioffe I.L. Projektovanje procesa i aparata hemijske tehnologije: udžbenik za tehničke škole. - L: Hemija, 1991 - 352s. Aleksandrov I.A. Rektifikacioni i apsorpcioni aparati - M.: Hemija, 1978 - 277s. Dytnersky Yu.I. Procesi i aparati hemijske tehnologije. - M.: Hemija 1995 - 368s. Za pripremu ovog rada korišteni su materijali sa stranice http://www.xumuk.ru/.