Hemijski potencijal supstance. Hemijski potencijal
Prilikom promjene broja čestica u sistemu potrebno je opisati i svojstva otvoreni sistemi(sa promjenjivim brojem čestica).
X. p. m i
i th komponenta višekomponentnog sistema jednaka je parcijalnom izvodu bilo koje termodinamičke. potencijali prema broju (broju čestica) ove komponente na post. vrijednosti preostale termodinamike. varijable koje određuju ovu termodinamiku. potencijal, npr. m i = (dF/dN i) T,V,N (F-slobodna energija, T-temp-ra, V- volumen, ji). Dakle, u sistemima sa naizmeničnim broj čestica u izrazu za diferencijal, na primjer. dF, dodajte vrijednost:
![]()
gdje R- pritisak, S-entropija. Naib. samo X. p. je povezan sa termodinamikom. potencijal G(cm. Gibbsova energija):. Za jednokomponentni sistem X. n. m = G/N,
tj. je Gibbsova energija po čestici. Zbog aditivnosti G, pored pritiska i temperature-ry, X. p. zavisi samo od koncentracije otd. komponente, ali ne i na broj čestica u svakoj komponenti. U najjednostavnijem slučaju idealnih gasova m i zavisi samo od koncentracije i-ta komponenta:
gdje je ukupan broj čestica, m ~ i-X. n. čist i th
komponenta. Često vrijednosti m i pogodan za upotrebu kao nezavisna termodinamička. umjesto toga varijable N i. U varijablama T, V, m i stanje sistema karakteriše termodinamičko. potencijal
![]()
X. p. je termodinamički. parametar u Gibbsova velika kanonska distribucija za AC sisteme broj čestica. Kao normalizaciona konstanta X. p. je uključen u distribucije Boltzmanna, Bose-Einsteina i Fermija-Diraka za čestice idealnih gasova(cm. statistička fizika U sistemima na koje je primenljiva statistika Bolcmanna ili Bose-Ajnštajna, X. p. je uvek negativan. Za Fermi gas X. p. na nultoj temperaturi je pozitivan i određuje granicu Fermi energija(cm. Fermijeva površina)i temperatura degeneracije. Ako a
ukupan broj čestica u sistemu nije fiksan, već se mora odrediti iz termodinamičkog stanja. ravnoteža, kao što je za fononi in čvrsto telo ili za fotoni u slučaju toplotne ravnoteže, tada se ravnoteža karakteriše jednakošću sa nulom X. p.
Koncept xp nam omogućava da formulišemo uslove termodinamička ravnoteža. Jedan od uslova je da X. p. bilo koje komponente bude isti u dekomp. fazama i na različitim mjestima jedne faze. To je zbog mogućnosti preraspodjele čestica, što dovodi do poravnanja X. p. Za sisteme u prostorno nehomogenom ekst. ravnotežno polje to znači
![]()
gdje m i 0 - X. p. u nedostatku polja, U i (r)-potencijal energija čestica i komponenta u ekst. polje. Za gas u gravitacionom polju, ovaj uslov dovodi do barometrije filter za gas. U slučaju punjenja čestice u električnoj. vrijednost polja (npr. u poluvodičima) m i pozvao elektrohemijski potencijal, ostavljajući naziv X. p. za m i 0 . Jednakost vrijednosti X.p. za čestice iste komponente koje se nalaze u različitim fazama određuje uslove ravnoteže za fazne prijelaze (
Termodinamika faznih prelaza. Definicije
Razmotrimo termodinamiku sistema u kojima fazni prelazi. Termodinamički sistem sa kojim se može razmjenjivati materija okruženje, zove se otvoren.
Termodinamički sistem se naziva homogena ili homogena, ako u svakom njegovom malom dijelu fizička svojstva tvari i intenzivni termodinamički parametri su isti ili se u prostoru kontinuirano mijenjaju.
Termodinamički sistemi u kojima se fizička svojstva tvari i intenzivni parametri naglo mijenjaju na nekim površinama unutar sistema nazivaju se heterogena. Primer heterogenog sistema je tečnost koja ključa.
Područja u heterogenom sistemu sa homogenim ili kontinuirano promjenjivim svojstvima i parametrima nazivaju se faze. U ravnoteži heterogenog sistema u odsustvu spoljašnjih polja, intenzivni parametri unutar svake faze su konstantni.
Ali ovi intenzivni parametri ne moraju biti isti u različitim fazama. Dakle, homogeni sistem je jednofazni.
Svaka od faza, u opštem slučaju, može biti homogena mešavina hemijski čistih supstanci, između kojih hemijske reakcije. Hemijski čiste supstance u smeši nazivaju se komponente. Faze u opštem slučaju mogu razmjenjivati ne samo energiju u obliku rada ili topline, već i materiju. Transformacija materije iz jednog faznog stanja u drugo naziva se fazni prelaz.
Neka je jednokomponentni jednofazni TD sistem otvoren, a kroz ljusku može prodrijeti samo supstanca koja čini sistem. I neka sistem bude u ravnoteži.
Promjena unutrašnja energija Takav sistem će se pojaviti ne samo zbog opskrbe toplinom i izvođenja rada na njemu, već i zbog promjene njegove mase. Supstanca koja prodire kroz ljusku nosi svoju inherentnu energiju. Zatim Gibbsove jednačine za svaku od četiri termodinamički potencijali(5.3) i (5.5) treba dopuniti još jednim članom proporcionalnim promjeni mase sistema, tj.
Vrijednost μ , određen parcijalnim derivatima
se zove hemijski potencijal i ima smisla mijenjati energiju termodinamičkog sistema kada se njegova masa promijeni za jedan, uz održavanje konstante jednog ili drugog para nezavisnih parametara sistema.
Nađimo vezu hemijskog potencijala sa drugim potencijalima sistema. Da biste to učinili, razmotrite četvrti izraz u (4.12). Gibbsova slobodna energija Φ, entropija S i jačinu sistema V pišemo kroz njihove specifične vrijednosti:
Zamjena Gibbsovog diferencijala slobodne energije njegovim izrazom ![]() i preuređivanjem termina dobijamo:
i preuređivanjem termina dobijamo:
Prema (4.5) for M= konst = 1 kg ![]() , odakle, s obzirom na proizvoljnost masenog diferencijala d M, mi nalazimo:
, odakle, s obzirom na proizvoljnost masenog diferencijala d M, mi nalazimo:
one. Hemijski potencijal supstance je njena specifična Gibbsova slobodna energija.
4.6. Uslovi za termodinamičku ravnotežu višefaznih sistema. Gibbsovo fazno pravilo
Razmislite jednokomponentni sistem, koji se sastoji od dvije faze koje međusobno djeluju. Neka je svaka od faza u svojoj unutrašnjoj ravnoteži, tj. svaki od njih karakterizira vlastiti skup parametara. Hajde da proučimo pitanje ravnoteže između faza. Da bismo to učinili, cijeli sistem zatvaramo u izolacijsku školjku (slika 4.1). Zatim, uz malu promenu stanja svake od faza (podsistema), za njih se mogu napisati termodinamički identiteti u skladu sa (4.1)
 (4.15)
(4.15)
Zbog aditivnosti velikih količina ![]() , zatvorenost sistema i reverzibilnost procesa, imamo
, zatvorenost sistema i reverzibilnost procesa, imamo
![]()
one. nakon sabiranja jednakosti (4.5) dobijamo:
Na osnovu proizvoljnosti diferencijala ![]() , faktori u zagradama na ovim diferencijalima moraju biti jednaki nuli, odakle dobijamo uslove termodinamičke ravnoteže željenog sistema:
, faktori u zagradama na ovim diferencijalima moraju biti jednaki nuli, odakle dobijamo uslove termodinamičke ravnoteže željenog sistema:
 (4.16)
(4.16)
Hemijski potencijal je, po definiciji, sam po sebi funkcija prirodnog para varijabli, tako da se stanje fazne ravnoteže može zapisati kao
Vrsta funkcija iz T i str u opštem slučaju je različit za svaku od faza, tako da uslov (4.17) nije identitet. Ovo je algebarska jednačina koja povezuje temperaturu i pritisak u ravnotežnom sistemu koji se sastoji od dve koegzistirajuće faze u interakciji između kojih se razmenjuju toplota, rad i materija.
Dakle, u dvofaznom jednokomponentnom sistemu, temperatura i pritisak su jedinstveno povezani. Zapremina sistema može poprimiti proizvoljnu vrijednost u zavisnosti od odnosa masa faza. Stanje ravnoteže dvofaznog sistema naziva se stanje zasićenja, a temperatura i pritisak jednaki za faze nazivaju se parametri zasićenja T s , str s .
Razmotrite ravnotežu trofazni jednokomponentni sistem. U ovom slučaju:
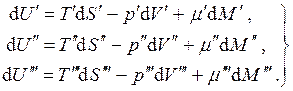 (4.18)
(4.18)
Ali za zatvoreni sistem:
uzimajući u obzir šta, dodavanjem jednačina (4.8), dobijamo:
Budući da su svi diferencijali ovdje nezavisni i njihove vrijednosti proizvoljne, nalazimo ravnotežne uslove:
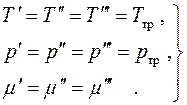 (4.19)
(4.19)
Hemijska ravnoteža, tj. jednakost hemijskih potencijala faza, može se napisati u obliku dvije algebarske jednadžbe
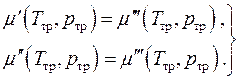 (4.20)
(4.20)
Ovo je sistem od dvije jednačine u dvije nepoznate. Ravnotežni jednokomponentni sistem može postojati istovremeno u tri faze samo pri strogo određenim vrijednostima tlaka i temperature. Ovo stanje sistema se zove trostruki poen.
Za ravnotežu četvorofazni jednokomponentni sistem:
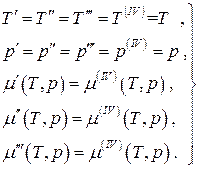 (4.21)
(4.21)
sistem od tri jednačine u dvije nepoznate. Takav sistem jednačina je nekonzistentan osim u slučaju kada su bilo koje dvije od njih proporcionalne jedna drugoj, tj. kada se dvije od četiri faze zapravo ne mogu razlikovati, a ovo će već biti trofazni sistem. Dakle, u ravnotežnom jednokomponentnom sistemu moguća je istovremena koegzistencija ne više od tri faze. Ako je ravnotežni termodinamički sistem višekomponentni, tada broj istovremeno koegzistirajućih faza može biti veći od tri, tj.
gdje n je broj komponenti sistema. Ovaj rezultat se zove Pravila Gibbsove faze.
PLAN PREDAVANJA:
1. Organizacioni dio predavanja: prima se izvještaj o spremnosti kadeta za nastavu, izostanci se evidentiraju u dnevnik (vrijeme 3-5 minuta).
2. Uvod u odjeljak "Prenos topline i mase".
Pitanja za predavanje:
mehanizmi prenosa toplote.
temperaturno polje.
temperaturni gradijent.
Osnovni zakon provođenja toplote.
· Koeficijent toplotne provodljivosti.
· Diferencijalna jednadžba provođenja toplote.
· Granični uslovi.
3. Zaključak.
Za naredni čas učenici moraju:
ZNATI: diferencijalna jednadžba toplotna provodljivost; određivanje koeficijenata toplote i toplotne difuzivnosti.
MOĆI: primjenjuju granične uslove pri rješavanju problema na Fourierovu jednačinu.
IMAJ ZASTUPNIKA: o mehanizmima prenosa toplote u tijelima različite strukture i agregatnog stanja.
4. Zadaci za samoobuku:
_____________/ profesor fizike i prenosa toplote, doktor fizike i matematike, P.V. Skripov
Predavanje je pregledano i odobreno na sjednici katedre
Protokol br. _______ od "_____" ______ 2011. godine
Šef Katedre za fiziku i prenos toplote
profesor, d.t.s. __________________ / N.M. Barbin
"_____"_____________ 2011
Slobodna energija sistema (Gibbsova energija G i Helmholtzove energije F) zavisi od spoljni uslovi:
Ova zavisnost je potpuna za najjednostavnije sisteme koji se sastoje od jedne komponente.
Termodinamički sistem se može sastojati od jedne ili više komponenti. Očigledno, vrijednost slobodne energije višekomponentnog sistema ovisit će i o vanjskim uvjetima ( T,R, ili V), te o prirodi i količini supstanci koje čine sistem, tj. slobodna energija, kao i svaka termodinamička funkcija, opsežno je svojstvo sistema. Ako se sastav sistema menja tokom vremena (tj. u sistemu se javlja hemijska reakcija), potrebno je uzeti u obzir uticaj promene sastava na vrednost slobodne energije sistema.
Razmotrimo termodinamički sistem koji se sastoji od k komponente. Neka n 1 , n 2 , …, n k- broj mladeža 1., 2., ..., k th komponente. Tada je Gibbsova slobodna energija funkcija sljedećih varijabli:
G = f(str, T, n 1 , n 2 , …, n k )
Razlikovati u odnosu na sve varijable:
 (2.1)
(2.1)
Hajde da uvedemo notaciju:
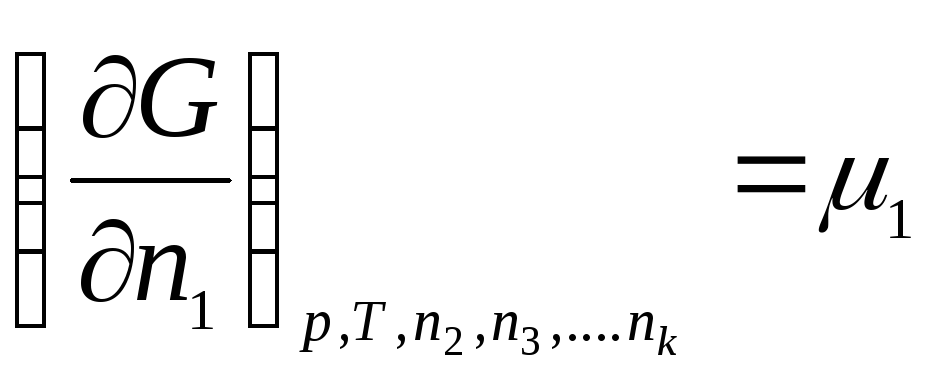
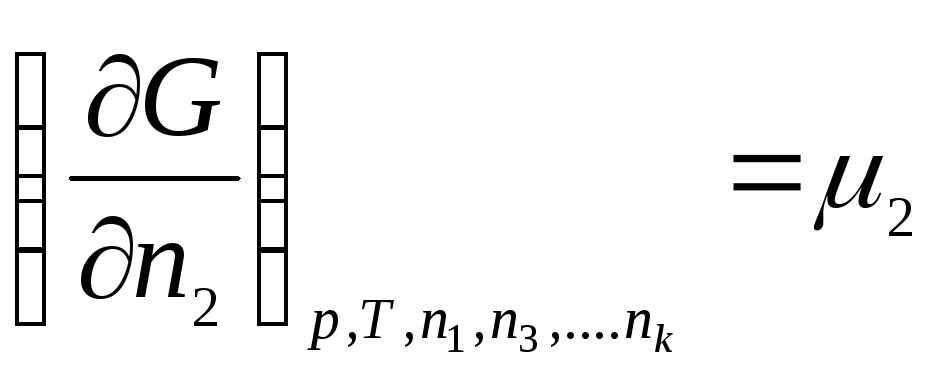
………………….
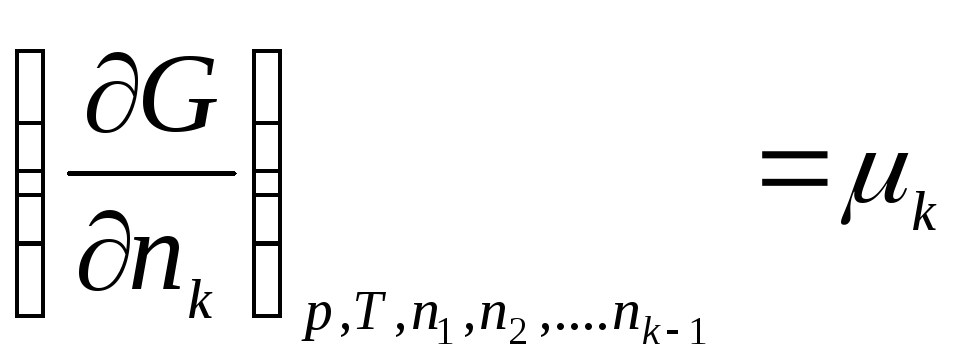 ,
,
gdje μ 1 , μ 2 , …, μ k– hemijski potencijali 1., 2., …, k te komponente, respektivno.
Uglavnom
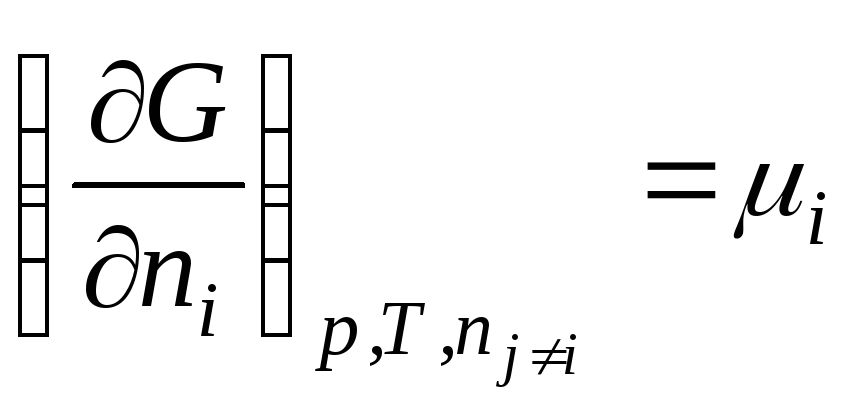 .
.
Dobijamo sličan izraz za Helmholtzovu slobodnu energiju:
F = f(V, T, n 1 , n 2 , …, n k )
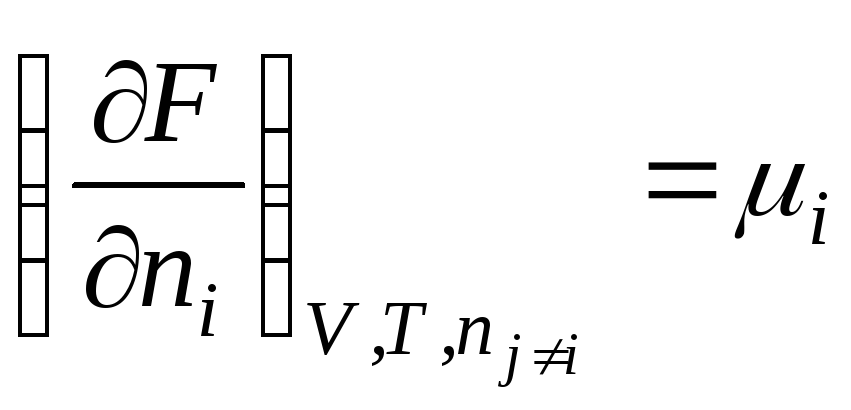 .
.
Na ovaj način, hemijski potencijal je parcijalni derivat slobodne energije u odnosu na broj molova i-ta komponenta sa konstantnošću odgovarajućih eksternih parametara i broja molova svih ostalih komponenti. Dakle, hemijski potencijal je parcijalna molarna Gibbsova energija (at R, T = konst):
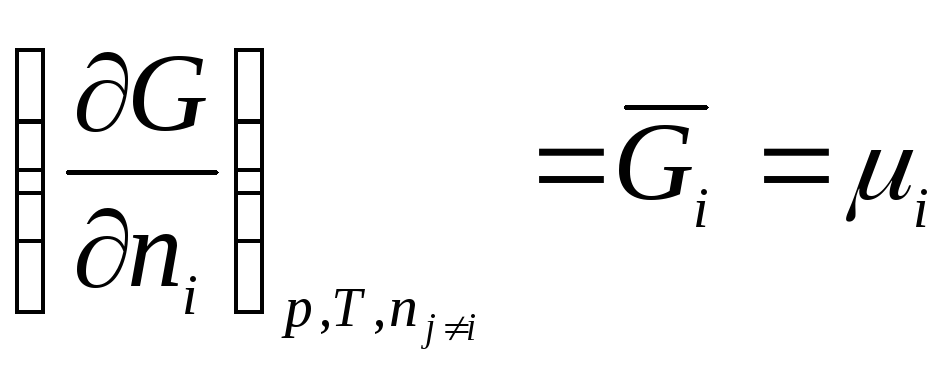 .
.
Besplatna energija jeste zajedničko vlasništvo sistema, hemijski potencijal karakteriše svojstva pojedinačne komponente uključene u sistem. Hemijski potencijal je intenzivno svojstvo sistema, jer ne zavisi od mase sistema.
At p, T =konst jednačina (2.1) ima oblik:
![]() .
(2.2)
.
(2.2)
U ovom slučaju, promjena Gibbsove energije, odnosno korisnog rada sistema, nastaje samo zbog promjene sastava sistema kao rezultat kemijske reakcije ili zbog razmjene materije između sistema. i okolina.
Jednačina (2.2) izražava odnos između opšteg svojstva sistema i osobina svake njegove komponente. Uz pretpostavku da je hemijski potencijal konstantna vrijednost, integriramo jednačinu (2.2):
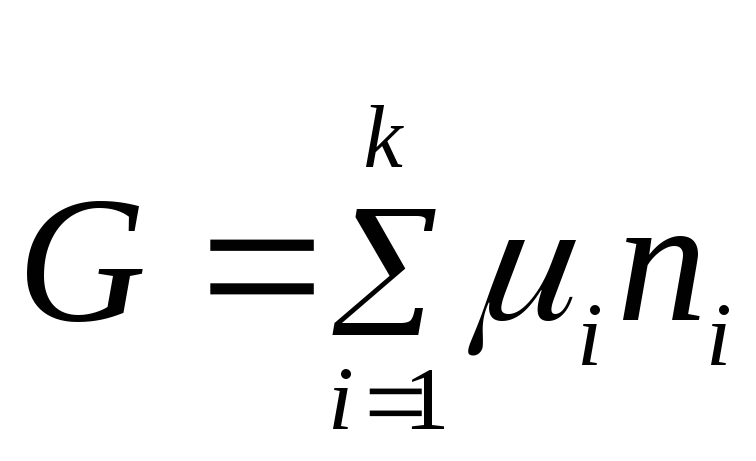 .
.
Konstanta integracije je nula jer ako je sve n i= 0, Gibbsova energija je također jednaka nuli.
Za pojedinačnu supstancu
 ,
,
one. hemijski potencijal pojedine supstance jednak je Gibsovoj molarnoj energiji.
U ravnoteži dG = 0 i jednačina (2.1) ima oblik:
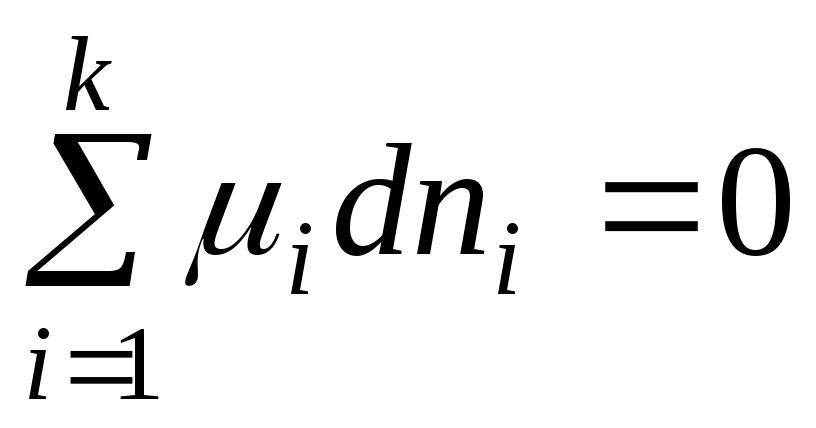 . (2.3)
. (2.3)
Rezultirajuća jednačina je opći uvjet ravnoteže u sistemu promjenjivog sastava pri R,T =konst.
Hemijski potencijal individualnog idealnog gasa.
Razmotrimo termodinamički sistem koji je idealan gas. Hemijski potencijal idealan gas jednako:
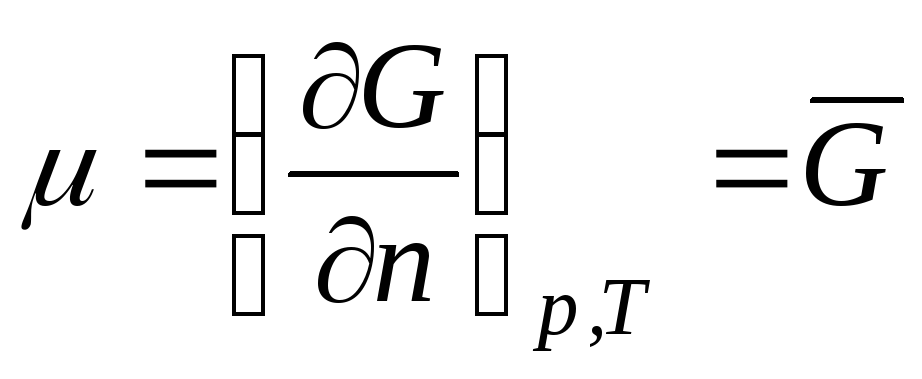 ,
,
gdje  je Gibbsova molarna energija (izobarični potencijal 1 mola idealnog plina).
je Gibbsova molarna energija (izobarični potencijal 1 mola idealnog plina).
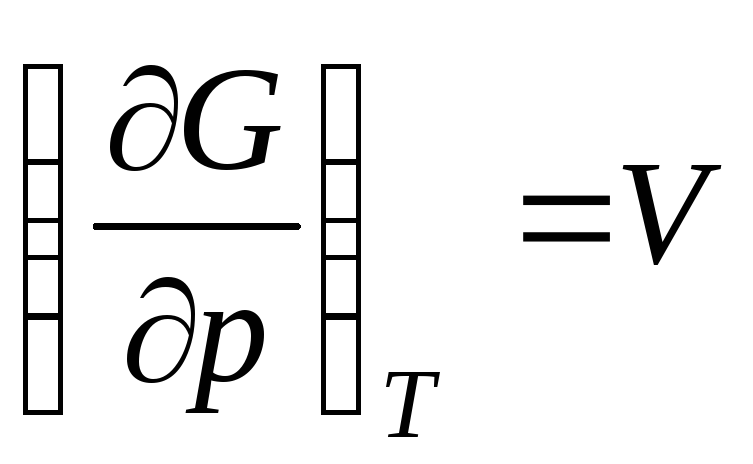 ,
,
onda 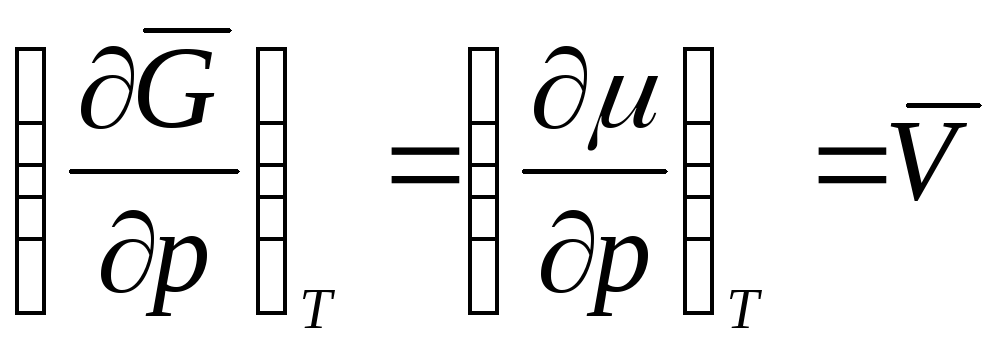 ,
,
gdje  je molarni volumen idealnog plina (volumen 1 mol plina).
je molarni volumen idealnog plina (volumen 1 mol plina).
Ako se proces izvodi na T =konst, parcijalni izvod se može zamijeniti ukupnim. Onda

Jednačina stanja za 1 mol idealnog gasa je:
 ;
;
 ,
,
![]()
Integrirajmo u intervalu od R 0 prije R:
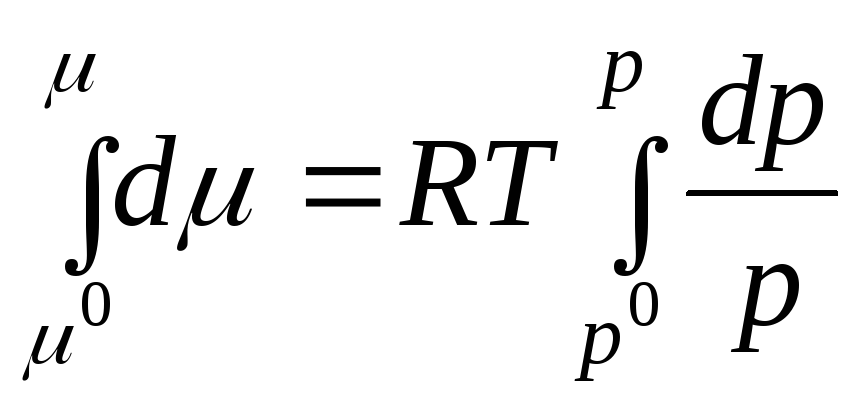
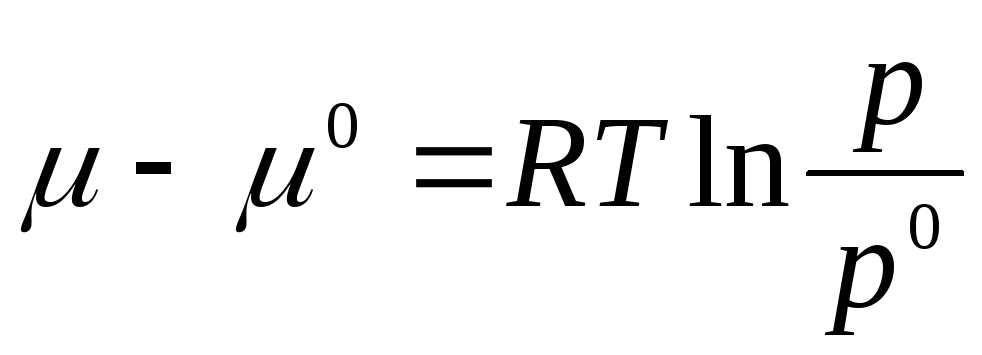
gdje μ 0 , R 0 je hemijski potencijal i pritisak idealnog gasa u standardnom stanju.
Standardno stanje se uzima kao stanje idealnog gasa pri R 0 = 1 atm.
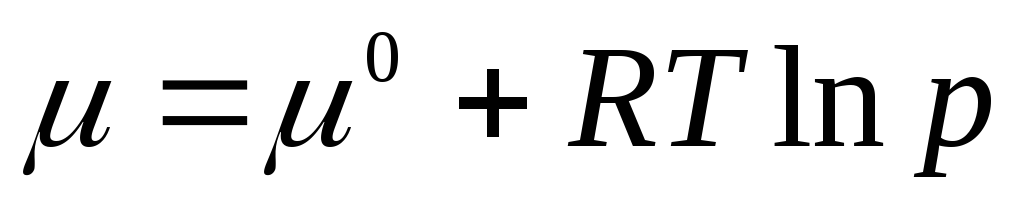 .
(2.3)
.
(2.3)
Standardni hemijski potencijal je hemijski potencijal pri pritisku gasa od 1 atm. Hemijski potencijal u standardnom stanju μ 0 zavisi samo od temperature i ne zavisi od pritiska, tj. μ 0 = f(T). Jednačina (2.3) pokazuje da je pod znakom logaritma bezdimenzionalna veličina jednaka omjeru tlaka R na standardni pritisak R 0 = 1 atm.
Zbog μ
=
 , može se napisati
, može se napisati
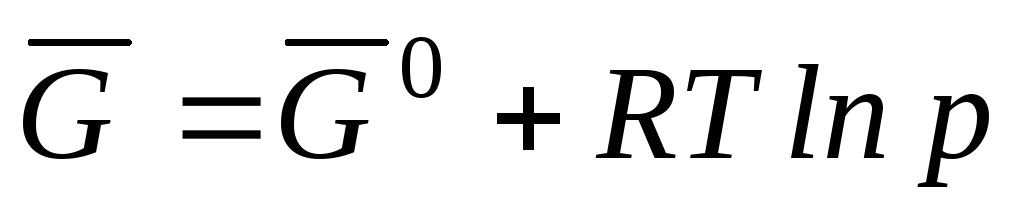
gdje  je Gibbsova standardna molarna energija.
je Gibbsova standardna molarna energija.
Hemijski potencijal komponente idealnih rastvora.
Ako je ukupan pritisak gasne mešavine mali, tada će svaki gas vršiti sopstveni pritisak, štaviše, kao da sam zauzima celu zapreminu. Ovaj pritisak se zove djelomično. Ukupni posmatrani pritisak R jednak je zbiru parcijalnih pritisaka svakog gasa (Daltonov zakon):
 .
.
Hemijski potencijal komponente idealne mješavine plina je:
 ,
,
gdje R i je parcijalni pritisak gasa.
Izražavanje parcijalnog pritiska gasa R i kroz ukupni pritisak i molski udio gasa x i, dobiti izraz za zavisnost hemijskog potencijala i-ta komponenta iz molskog udjela:
gdje  je hemijski potencijal idealnog gasa pri x i= 1 (tj. u pojedinačnom stanju) pri pritisku R i temperaturu T;
je hemijski potencijal idealnog gasa pri x i= 1 (tj. u pojedinačnom stanju) pri pritisku R i temperaturu T;
 zavisi i od temperature i pritiska.
zavisi i od temperature i pritiska.
Za idealna tečna rješenja primjenjiva jednačina
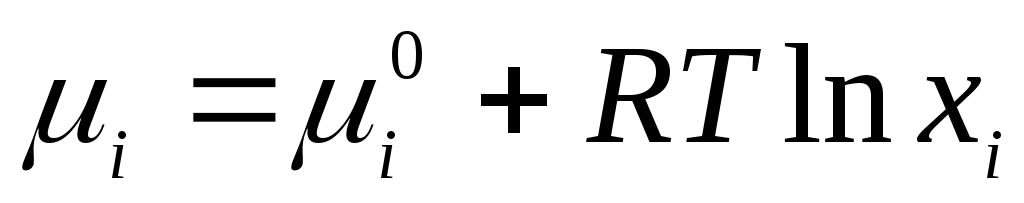 ,
,
gdje 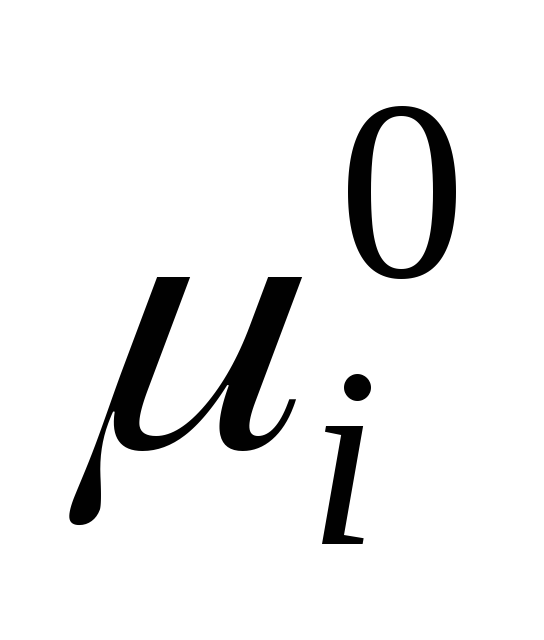 je standardni hemijski potencijal pojedinačne komponente u tečnom stanju (
je standardni hemijski potencijal pojedinačne komponente u tečnom stanju (  ) zavisi od temperature i pritiska; x i je molski udio komponente.
) zavisi od temperature i pritiska; x i je molski udio komponente.
Hemijski potencijal komponente realnih rastvora .
Za realna rješenja, sve razmatrane zavisnosti su neprimjenjive. Hemijski potencijal komponente pravo rešenje za gas izračunato pomoću Lewisove metode. U ovom slučaju, da bi se sačuvao oblik termodinamičkih jednačina, umjesto parcijalnog tlaka, oni uvode fiktivnu veličinu f i, koji se zove djelomična fugacity, ili volatilnost. Onda
![]() ,
,
gdje  je hemijski potencijal komponente prave gasne mešavine u standardnom stanju.
je hemijski potencijal komponente prave gasne mešavine u standardnom stanju.
Odnos volatilnosti prema parcijalni pritisak realno rješenje plina naziva se koeficijent isparljivosti:
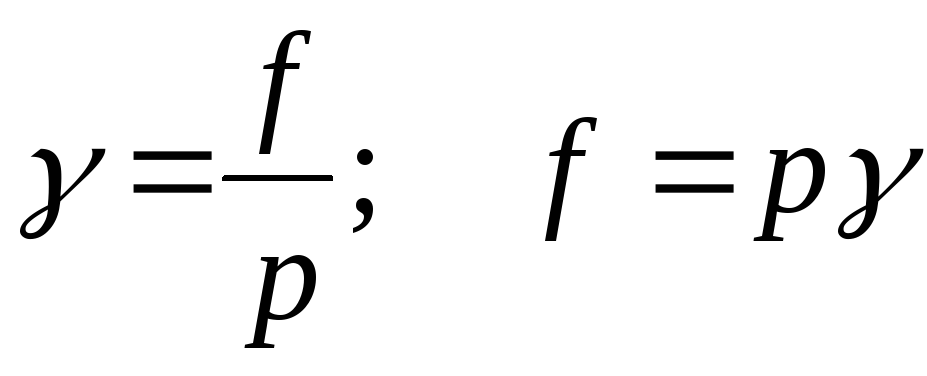 ;
;
Slično, za tečna stvarna rješenja stvarna koncentracija se zamjenjuje odgovarajućom fiktivnom vrijednošću – djelatnošću a i :
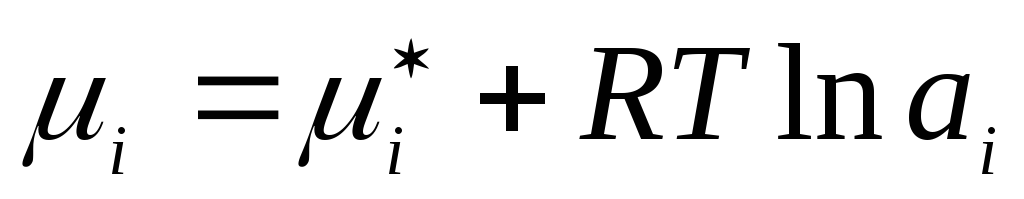 ,
,
gdje  je hemijski potencijal komponente prave tečne otopine u standardnom stanju.
je hemijski potencijal komponente prave tečne otopine u standardnom stanju.
Aktivnost je povezana sa koncentracijom preko koeficijenta aktivnosti:
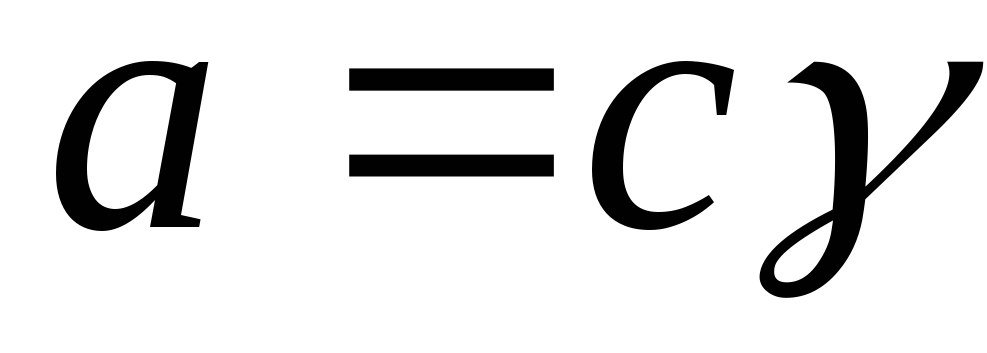 ,
,
gdje je γ i koeficijent aktivnosti.
Ovisno o načinu izražavanja koncentracije otopine, razlikuju se racionalni, molarni i molarni koeficijenti aktivnosti:

Koeficijent aktivnosti ovisi o koncentraciji otopine. U beskonačno razblaženim rastvorima γ → 1, a i i f i → c i i str i respektivno.
Prepišimo jednačinu za hemijski potencijal u obliku
 ,
,
dakle, termodinamička aktivnost je rad prijenosa 1 mol i komponentu od standardnog rješenja do datog realnog rješenja.
Postoje dva glavna načina izbora standardno stanje- simetrično i asimetrično.
simetričan način. Za otapalo i otopljenu tvar bira se isto standardno stanje - stanje čiste komponente na temperaturi otopine. Zatim u standardnom stanju x i = 1, a i = 1i γ i = 1. Ova metoda se češće koristi za neelektrolitne otopine.
asimetričan način. Za otapalo i otopljenu tvar se bira drugačije standardno stanje. Za rastvarač - kao u simetričnoj metodi: x i → 1, a i → 1i γ i → 1. Za rastvor standardno stanje je stanje materije u beskonačno razblaženom rastvoru: x i → 0, a i → x i i γ i → 1. Metoda se najčešće koristi u termodinamici otopina elektrolita.






