Atomun yapısı. Rutherford'un deneyimi. Orta Çağ'da doğa bilimlerinin gelişim tarihi
Atomun gezegensel modeli 1910'da E. Rutherford tarafından önerildi. Atomun yapısıyla ilgili ilk çalışmalar onun tarafından alfa parçacıklarının yardımıyla yapılmıştır. Rutherford, saçılma deneylerinde elde edilen sonuçlara dayanarak, tüm pozitif yük atom, merkezindeki küçük bir çekirdekte yoğunlaşmıştır. Öte yandan, negatif yüklü elektronlar hacminin geri kalanı boyunca dağıtılır.
küçük bir arka plan
Atomların varlığına dair ilk parlak tahmin, eski Yunan bilim adamı Demokritos tarafından yapıldı. O zamandan beri, bileşimleri etrafımızdaki tüm maddeleri veren atomların varlığı fikri bilim adamlarının hayal gücünden çıkmadı. Zaman zaman çeşitli temsilcileri ona yaklaştı, ancak daha önce erken XIX Yüzyıllar boyunca inşa edilmeleri, deneysel verilerle desteklenmeyen sadece hipotezlerdi.
Son olarak, 1804'te, atomun gezegensel modelinin ortaya çıkmasından yüz yıldan fazla bir süre önce, İngiliz bilim adamı John Dalton, varlığına dair kanıt sağladı ve ilk olarak atom ağırlığı kavramını tanıttı. nicel özellik. Kendinden öncekiler gibi, atomları, daha küçük parçacıklara bölünemeyen katı toplar gibi, maddenin en küçük parçaları olarak hayal etti.
Elektronun keşfi ve atomun ilk modeli
Neredeyse bir yüzyıl geçti, sonunda geç XIX yüzyılda İngiliz J. J. Thomson, negatif yüklü elektron olan ilk atom altı parçacığı da keşfetti. Atomlar elektriksel olarak nötr olduğundan, Thomson, elektronların hacmi boyunca dağılmış pozitif yüklü bir çekirdekten oluşması gerektiğini düşündü. Çeşitli deneysel sonuçlara dayanarak, 1898'de, bazen "bir pudingdeki erik" olarak adlandırılan atom modelini önerdi, çünkü içindeki atom, içine elektronların gömülü olduğu bir miktar pozitif yüklü sıvı ile dolu bir küre olarak temsil edildi. erik pudingin içine. Böyle bir küresel modelin yarıçapı yaklaşık 10 -8 cm idi Sıvının toplam pozitif yükü, aşağıdaki şekilde gösterildiği gibi elektronların negatif yükleriyle simetrik ve düzgün bir şekilde dengelenir.
Bu model, bir madde ısıtıldığında ışık yaymaya başladığını tatmin edici bir şekilde açıkladı. Bu, bir atomun ne olduğunu anlamaya yönelik ilk girişim olmasına rağmen, daha sonra Rutherford ve diğerleri tarafından yapılan deneylerin sonuçlarını karşılamadı. Thomson, 1911'de, modelinin deneylerde gözlemlenen α-ışınlarının saçılmasının nasıl ve neden oluştuğunu yanıtlayamadığı konusunda hemfikirdi. Bu nedenle, terk edildi ve yerini daha mükemmel bir gezegen atom modeli aldı.
Zaten atom nasıl düzenlenir?
Ernest Rutherford, radyoaktivite fenomeni hakkında bir açıklama yaptı ve bu da onu Nobel Ödülü Ancak bilime en önemli katkısı daha sonra, tıpkı Güneş'in gezegenlerin yörüngeleriyle çevrili olması gibi, atomun elektron yörüngeleriyle çevrili yoğun bir çekirdekten oluştuğunu saptamasıyla geldi. 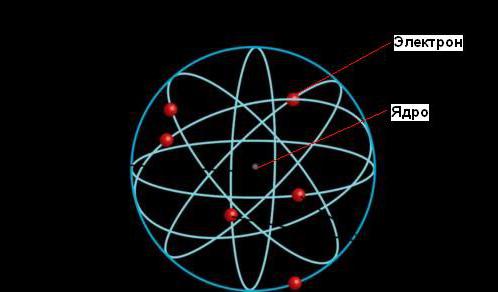
Bir atomun gezegensel modeline göre, kütlesinin çoğu (tüm atomun boyutuna kıyasla) küçük bir çekirdekte yoğunlaşmıştır. Elektronlar çekirdeğin etrafında inanılmaz hızlarda hareket ederler, ancak atomların hacminin çoğu boşluktur.
Çekirdeğin boyutu o kadar küçüktür ki, çapı bir atomunkinden 100.000 kat daha küçüktür. Çekirdeğin çapı Rutherford tarafından atomun büyüklüğünün aksine 10-13 cm olarak tahmin edildi - 10-8 cm Çekirdeğin dışında, elektronlar onun etrafında yüksek hızlarda dönerek elektrostatik kuvvetleri dengeleyen merkezkaç kuvvetleriyle sonuçlanır. protonlar ve elektronlar arasındaki çekim.
Rutherford'un deneyleri
Atomun gezegen modeli, 1911'de, yapısı hakkında bazı temel bilgileri elde etmeyi mümkün kılan altın folyo ile yapılan ünlü deneyden sonra ortaya çıktı. Rutherford'un atom çekirdeğinin keşfine giden yolu iyi örnek bilimde yaratıcılığın rolü. Araştırması 1899 gibi erken bir tarihte, belirli elementlerin her şeye nüfuz edebilen pozitif yüklü parçacıklar yaydığını keşfettiğinde başladı. Bu parçacıklara alfa (α) parçacıkları adını verdi (şimdi bunların helyum çekirdeği olduğunu biliyoruz). Tüm iyi bilim adamları gibi Rutherford da meraklıydı. Alfa parçacıklarının bir atomun yapısını bulmak için kullanılıp kullanılamayacağını merak etti. Rutherford, çok ince bir altın folyo tabakasına bir alfa parçacıkları demeti yöneltmeye karar verdi. 0.00004 cm kadar ince levhalar üretebildiği için altını seçti.Altın bir levhanın arkasına, alfa parçacıkları çarptığında parlayan bir ekran yerleştirdi. Folyodan geçtikten sonra alfa parçacıklarını tespit etmek için kullanıldı. Ekrandaki küçük bir yarık, alfa parçacık ışınının kaynaktan çıktıktan sonra folyoya ulaşmasına izin verdi. Bir kısmı folyodan geçip aynı yönde hareket etmeye devam etmeli, diğer kısmı folyodan sekip altına yansımalı. keskin köşeler. Aşağıdaki resimde deneyin şemasını görebilirsiniz. 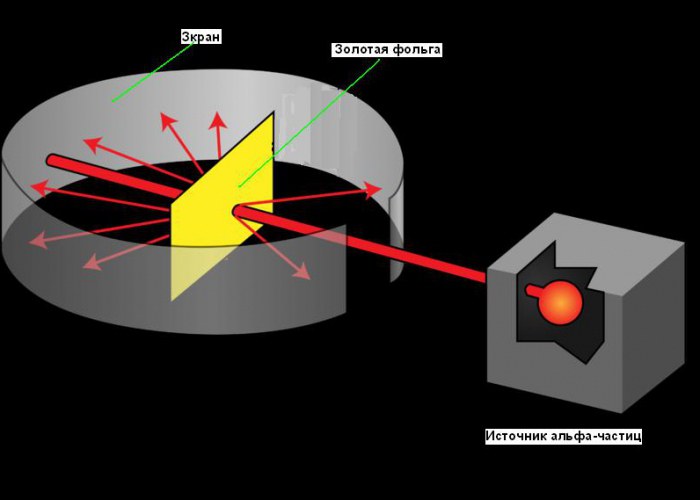
Rutherford'un deneyinde ne oldu?
J. J. Thomson'ın atom modeline dayanarak, Rutherford, altın atomlarının tüm hacmini dolduran katı pozitif yüklü bölgelerin, folyodan geçerken tüm alfa parçacıklarının yörüngelerini saptıracağını veya bükeceğini varsayıyordu.
Bununla birlikte, alfa parçacıklarının büyük çoğunluğu sanki orada değilmiş gibi altın folyodan geçti. Boş uzaydan geçiyor gibiydiler. Sadece birkaçı başlangıçta zannedildiği gibi doğru yoldan sapar. Aşağıda, saçılma açısına karşı ilgili yönde saçılan parçacıkların sayısının bir grafiği verilmiştir. 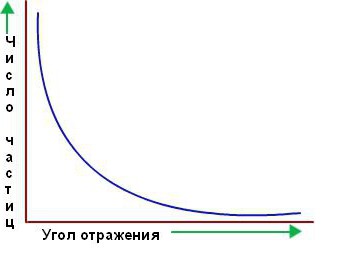
Şaşırtıcı bir şekilde, parçacıkların küçük bir yüzdesi, bir arkalıktan sıçrayan bir basketbol topu gibi folyodan geri sekti. Rutherford, bu sapmaların alfa parçacıkları ile atomun pozitif yüklü bileşenleri arasındaki doğrudan çarpışmanın sonucu olduğunu fark etti.
Çekirdek merkez sahne alır
Folyodan yansıyan alfa parçacıklarının ihmal edilebilir yüzdesine dayanarak, tüm pozitif yükün ve atomun neredeyse tüm kütlesinin küçük bir alanda yoğunlaştığı ve atomun geri kalanının çoğunlukla boş uzay olduğu sonucuna varabiliriz. Rutherford, konsantre pozitif yük alanını çekirdek olarak adlandırdı. Proton olarak adlandırdığı pozitif yüklü parçacıklar içerdiğini tahmin etti ve çok geçmeden keşfetti. Rutherford tarafsızlığın varlığını öngördü atomik parçacıklar, nötronlar olarak adlandırıldı, ancak onları tespit edemedi. Ancak, öğrencisi James Chadwick onları birkaç yıl sonra keşfetti. Aşağıdaki şekil, bir uranyum atomunun çekirdeğinin yapısını göstermektedir. 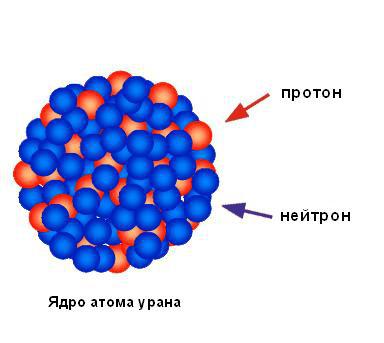
Atomlar, negatif yüklü son derece hafif parçacıklar-etraflarında dönen elektronlarla çevrili pozitif yüklü ağır çekirdeklerden oluşur ve öyle hızlarda mekanik merkezkaç kuvvetleri çekirdeğe olan elektrostatik çekimlerini dengeler ve bu bağlamda atomun kararlılığı iddia edilir.
Bu modelin dezavantajları
Rutherford'un ana fikri, küçük bir atom çekirdeği fikriyle ilgiliydi. Elektronların yörüngeleri hakkındaki varsayım tamamen varsayımdı. Elektronların çekirdeğin etrafında nerede ve nasıl döndüğünü tam olarak bilmiyordu. Bu nedenle, Rutherford'un gezegen modeli elektronların yörüngelerdeki dağılımını açıklamaz.
Ek olarak, Rutherford atomunun kararlılığı ancak elektronların kinetik enerji kaybı olmadan yörüngelerde sürekli hareketi ile mümkün olmuştur. Ancak elektrodinamik hesaplamalar, hız vektörünün yönündeki bir değişiklik ve buna karşılık gelen bir ivmenin ortaya çıkmasıyla birlikte herhangi bir eğrisel yörünge boyunca elektronların hareketine, kaçınılmaz olarak elektromanyetik enerji emisyonunun eşlik ettiğini göstermiştir. Bu durumda, enerjinin korunumu yasasına göre, elektronun kinetik enerjisi çok hızlı bir şekilde radyasyona harcanmalı ve aşağıdaki şekilde şematik olarak gösterildiği gibi çekirdeğe düşmelidir. 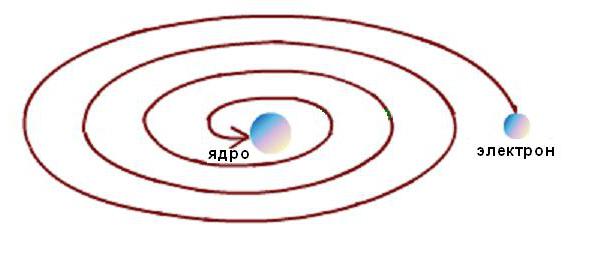 Ancak bu olmaz, çünkü atomlar kararlı oluşumlardır. Fenomenin modeli ile deneysel veriler arasında tipik bir bilimsel çelişki ortaya çıktı.
Ancak bu olmaz, çünkü atomlar kararlı oluşumlardır. Fenomenin modeli ile deneysel veriler arasında tipik bir bilimsel çelişki ortaya çıktı.
Rutherford'dan Niels Bohr'a
Atom tarihinde bir sonraki büyük adım, 1913'te Danimarkalı bilim adamı Niels Bohr'un daha ayrıntılı bir atom modelinin tanımını yayınlamasıyla geldi. Elektronların olabileceği yerleri daha net belirledi. Daha sonra bilim adamları daha sofistike atomik tasarımlar geliştirecek olsa da, Bohr'un atomun gezegensel modeli temelde doğruydu ve çoğu bugün hala kabul ediliyor. Birçok faydalı uygulaması vardı, örneğin, çeşitli kimyasal elementlerin özelliklerini, radyasyon spektrumlarının doğasını ve atomun yapısını açıklamak için kullanılır. Gezegen modeli ve Bohr modeli, fizikte yeni bir yönün - mikro dünyanın fiziğinin - ortaya çıkışına işaret eden en önemli kilometre taşlarıydı. Bohr, atomun yapısını anlamamıza katkılarından dolayı 1922 Nobel Fizik Ödülü'nü aldı.
Bohr atom modeline ne gibi yenilikler getirdi?
Bohr henüz genç bir adamken, İngiltere'de Rutherford'un laboratuvarında çalıştı. Rutherford'un modelinde elektron kavramı yeterince geliştirilmediği için Bohr onlara odaklandı. Sonuç olarak, atomun gezegen modeli önemli ölçüde geliştirildi. Bohr'un 1913'te yayınlanan "Atomların ve Moleküllerin Yapısı Üzerine" adlı makalesinde formüle ettiği önermeleri şöyledir:
1. Elektronlar, çekirdeğin etrafında, sahip oldukları enerji miktarına göre belirlenen, yalnızca ondan sabit mesafelerde hareket edebilirler. Bu sabit seviyelere enerji seviyeleri veya elektron kabukları adını verdi. Bohr onları, her birinin merkezinde bir çekirdek bulunan eşmerkezli küreler olarak tasavvur etti. Bu durumda, daha düşük enerjili elektronlar, çekirdeğe daha yakın olan daha düşük seviyelerde bulunacaktır. Daha fazla enerjiye sahip olanlar daha fazla bulunacaktır. yüksek seviyeler, çekirdekten uzak.
2. Bir elektron bir miktar (belirli bir seviye için oldukça kesin) miktarda enerji emerse, bir sonraki, daha yüksek enerji seviyesine atlayacaktır. Tersine, aynı miktarda enerji kaybederse, orijinal seviyesine geri dönecektir. Ancak, bir elektron iki enerji seviyesinde var olamaz.
Bu fikir bir şekil ile gösterilmiştir. 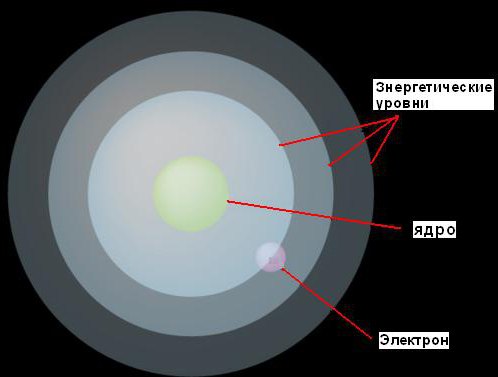
Elektronlar için enerji kısımları
Atomun Bohr modeli aslında iki farklı fikrin birleşimidir: Rutherford'un elektronların çekirdeğin etrafında döndüğü atom modeli (esas olarak atomun Bohr-Rutherford gezegen modeli) ve Max Planck'ın maddenin enerjisini niceleme fikri, 1901'de yayınlandı. Kuantum (çoğul - kuanta), bir madde tarafından emilebilen veya yayılabilen minimum enerji miktarıdır. Enerji miktarı için bir tür ayrıklaştırma adımıdır.
Enerji suya benzetilirse ve onu maddeye bir bardak şeklinde eklemek isterseniz, sürekli bir akıntıya su dökemezsiniz. Bunun yerine, bir çay kaşığı gibi küçük miktarlarda ekleyebilirsiniz. Bohr, eğer elektronlar yalnızca sabit miktarda enerji emebiliyor veya kaybedebiliyorsa, o zaman enerjilerini yalnızca bu sabit miktarlarla değiştirmeleri gerektiğine inanıyordu. Böylece sadece sabit yer işgal edebilirler. enerji seviyeleri enerjilerinin nicelenmiş artışlarına karşılık gelen çekirdeğin etrafında.
Böylece Bohr modelinden atomun yapısının ne olduğunu açıklamak için kuantum bir yaklaşım geliştirir. Gezegen modeli ve Bohr modeli, klasik fizikten, atom fiziği de dahil olmak üzere mikro kozmos fiziğinde ana araç olan kuantum fiziğine bir tür adımdı.
1903'te İngiliz bilim adamı Thomson, şaka olarak "kuru üzümlü çörek" olarak adlandırılan bir atom modeli önerdi. Ona göre atom, içinde kuru üzüm gibi negatif yüklü elektronların serpiştirildiği, düzgün pozitif yüklü bir küredir.
Bununla birlikte, atomla ilgili daha ileri çalışmalar, bu teorinin savunulamaz olduğunu gösterdi. Ve birkaç yıl sonra, başka bir İngiliz fizikçi Rutherford, bir dizi deney yaptı. Sonuçlara dayanarak, atomun yapısı hakkında hala dünya çapında tanınan bir hipotez kurdu.
Rutherford'un deneyimi: atom modelinin önerisi
Rutherford, deneylerinde, ince altın folyodan bir alfa parçacıkları demeti geçirdi. Altın, plastisitesi için seçildi, bu da neredeyse bir molekül kalınlığında çok ince bir folyo oluşturmayı mümkün kıldı. Folyonun arkasında, üzerine düşen alfa parçacıkları tarafından bombardıman edildiğinde aydınlanan özel bir ekran vardı. Thomson'ın teorisine göre, alfa parçacıkları engellenmeden folyodan geçmeli ve yanlara biraz sapmış olmalıdır. Ancak bazı parçacıkların bu şekilde davrandığı ve çok küçük bir kısmının geri sektiği ortaya çıktı. bir şeye çarpıyormuş gibi.
Yani, atomun içinde, alfa parçacıklarının sıçradığı katı ve küçük bir şey olduğu bulundu. O zaman Rutherford, atomun yapısının gezegensel bir modelini önerdi. Rutherford'un gezegensel atom modeli, hem kendi deneylerinin hem de meslektaşlarının sonuçlarını açıkladı. Bu teorinin bazı yönleri bilimin bazı çok dar alanlarındaki uygulama ile hala aynı fikirde olmasa da, bugüne kadar daha iyi bir model önerilmemiştir. Ama temel olarak, atomun gezegensel modeli, hepsinden daha kullanışlıdır. Bu model nedir?
Atomun yapısının gezegen modeli
Adından da anlaşılacağı gibi, bir atom bir gezegene benzetilir. Bu durumda, gezegen bir atomun çekirdeğidir. Ve elektronlar, tıpkı uyduların gezegenin etrafında dönmesi gibi, çekirdeğin etrafında oldukça büyük bir mesafede dönerler. Sadece elektronların dönüş hızı, en hızlı uydunun dönüş hızından yüzbinlerce kat daha fazladır. Bu nedenle, dönüşü sırasında elektron, çekirdeğin yüzeyinin üzerinde olduğu gibi bir bulut oluşturur. Ve mevcut elektron yükleri, diğer elektronların diğer çekirdeklerin etrafında oluşturduğu aynı yükleri iter. Bu nedenle, atomlar "birbirine yapışmaz", ancak birbirlerinden belirli bir mesafede bulunurlar.
Ve parçacıkların çarpışmasından bahsettiğimizde, birbirlerine yeterince yaklaştıklarını kastediyoruz. uzun mesafe ve yüklerinin alanları tarafından püskürtülür. Doğrudan temas yoktur. Maddedeki parçacıklar genellikle birbirinden çok uzaktadır. Herhangi bir şekilde herhangi bir cismin parçacıklarını birlikte patlatmak mümkün olsaydı, milyarlarca kez azalırdı. Dünya bir elmadan daha küçük olurdu. Bu nedenle, herhangi bir maddenin ana hacmi, kulağa garip gelse de, elektronik etkileşim kuvvetleri tarafından belli bir mesafede tutulan yüklü parçacıkların bulunduğu bir boşluk tarafından işgal edilir.
Çalışmalarınızda yardıma mı ihtiyacınız var?
Önceki konu: Radyoaktivite: alfa, beta, gama radyasyonuSonraki konu: Atom Çekirdeği: Nükleer Yük
2.5. Rutherford'un deneyleri. atomun Rutherford modeli
A. Rutherford'un deneyleri
1911'de Rutherford, atom çekirdeğinin varlığını kanıtlayan olağanüstü öneme sahip deneyler yaptı. Atomu incelemek için Rutherford, radyum, polonyum ve diğer bazı elementlerin bozunması sırasında ortaya çıkan a-parçacıklarının yardımıyla araştırmasını (bombardıman) kullandı. Rutherford ve işbirlikçileri, 1909'daki daha önceki deneylerde bile, α-parçacıklarının modülünde elektron yükünün iki katına eşit bir pozitif yüke sahip olduğunu buldular. q =+2e, ve bir helyum atomunun kütlesiyle çakışan bir kütle, yani.
m a\u003d 6,62 10 -27 kg,
ki bu bir elektronun kütlesinin yaklaşık 7300 katıdır. Daha sonra α parçacıklarının helyum atomlarının çekirdeği olduğu bulundu. Bu parçacıklarla Rutherford, ağır elementlerin atomlarını bombaladı. Elektronlar küçük kütlelerinden dolayı α-parçacığının yörüngesini değiştiremezler. Saçılmaları (hareket yönünü değiştirmeleri) ancak atomun pozitif yüklü kısmından kaynaklanabilir. Böylece, α-parçacıklarının saçılmasından, pozitif yükün dağılımının doğası ve dolayısıyla atomun içindeki kütle belirlenebilir.
Polonyum tarafından yayılan α parçacıklarının 1,6-107 m/s hızla uçtuğu biliniyordu. Polonyum, boyunca dar bir kanalın delindiği bir kurşun kasanın içine yerleştirildi. Kanaldan ve açıklıktan geçen α-parçacık ışını folyo üzerine geldi. Altın folyo son derece ince yapılabilir - 4-10 -7 m kalınlığında (400 altın atomu; bu sayı altının kütlesi, yoğunluğu ve molar kütlesi bilinerek tahmin edilebilir). Folyodan sonra, α-parçacıkları çinko sülfür ile kaplanmış yarı saydam bir ekrana çarptı. Her parçacığın ekranla çarpışmasına, mikroskop altında gözlenen floresan nedeniyle bir ışık parlaması (parıldama) eşlik etti.
Cihazın içinde iyi bir vakumla (böylece hava moleküllerinden parçacıkların saçılması yoktu), folyo yokluğunda, ince bir α-parçacık demetinin neden olduğu sintilasyonlardan ekranda parlak bir daire belirdi. Işın yoluna bir folyo yerleştirildiğinde, α-parçacıklarının büyük çoğunluğu hala orijinal yönlerinden sapmadı, yani folyodan sanki boşlukmuş gibi geçtiler. Ancak yolunu değiştiren ve hatta geri dönen alfa parçacıkları vardı.
Rutherford'un öğrencileri ve işbirlikçileri olan Marsden ve Geiger, bir milyondan fazla parıldama saydılar ve yaklaşık 2.000 alfa parçacığından birinin 90°'den büyük açılardan ve bir tanesinin 8.000 ila 180° arasında saptığını belirlediler. Bu sonucu atomun diğer modellerine, özellikle Thomson'a dayanarak açıklamak imkansızdı.
Hesaplamalar, atom boyunca dağıtıldığında, pozitif bir yükün (elektronları hesaba katmadan bile), bir α parçacığını geri atabilecek kadar yoğun bir elektrik alanı oluşturamayacağını göstermektedir. Düzgün yüklü bir topun elektrik alan şiddeti topun yüzeyinde maksimumdur ve merkeze yaklaştıkça sıfıra düşer. α-parçacıklarının geniş açılarda saçılması, sanki atomun tüm pozitif yükü çekirdeğinde yoğunlaşmış gibi gerçekleşir - atomun tüm hacmine kıyasla çok küçük bir hacim kaplayan bir bölge.
α-parçacıklarının çekirdeğe çarpma ve onları geniş açılardan saptırma olasılığı çok küçüktür, bu nedenle α-parçacıklarının çoğunluğu için folyo yok gibi görünmektedir.
Rutherford teorik olarak bir çekirdeğin Coulomb elektrik alanındaki a-parçacıklarının saçılması sorununu düşündü ve sayıyı belirlemeyi mümkün kılan bir formül elde etti. N belirli bir saçılma folyosunun atomlarının çekirdeğinde bulunan temel pozitif yükler +e. Deneyler göstermiştir ki, sayı N D. I. Mendeleev'in periyodik sistemindeki elementin sıra sayısına eşit, yani N=Z(altın için Z= 79).
Böylece, Rutherford'un bir atomun çekirdeğindeki pozitif bir yükün konsantrasyonu hakkındaki hipotezi, periyodik elementler sistemindeki bir elementin sıra sayısının fiziksel anlamını belirlemeyi mümkün kıldı. Nötr atom da içermelidir Z elektronlar. Bir atomdaki çeşitli yöntemlerle belirlenen elektron sayısının çekirdekteki temel pozitif yüklerin sayısıyla çakışması önemlidir. Bu, atomun nükleer modelinin geçerliliğinin bir testi olarak hizmet etti.
B. Rutherford'un atomun nükleer modeli
α-parçacıklarının altın folyo ile saçılması üzerine deneylerin sonuçlarını özetleyen Rutherford, şunları belirledi:
♦ atomlar doğaları gereği α-parçacıklarına karşı büyük ölçüde şeffaftır;
♦ α-parçacıklarının büyük açılardaki sapmaları, ancak atomun içinde çok küçük bir hacimde yoğunlaşmış büyük bir kütle ile ilişkili pozitif bir yük tarafından oluşturulan çok güçlü bir elektrik alanı varsa mümkündür.
Bu deneyleri açıklamak için Rutherford, atomun nükleer bir modelini önerdi: atom çekirdeğinde (10 -15 -10 -14 m doğrusal boyutları olan bölgeler) tüm pozitif yükü ve atomun neredeyse tüm kütlesi (% 99.9). konsantre olurlar. ~10 -10 m doğrusal boyutları olan bir bölgede çekirdeğin etrafında (atomun boyutları moleküler-kinetik teoride tahmin edilir), negatif yüklü elektronlar, kütlesi kütlenin sadece %0,1'i olan kapalı yörüngelerde hareket eder. çekirdeğin. Sonuç olarak, elektronlar çekirdeğe 10.000 ila 100.000 çap arasında bir mesafede bulunur, yani atomun ana kısmı boş alandır.
Rutherford'un nükleer atom modeli güneş sistemine benzer: sistemin merkezinde "güneş" - çekirdek ve çevresinde "gezegenler" - elektronlar yörüngelerde hareket eder, bu nedenle bu model denir gezegensel. Elektronlar çekirdeğe düşmez çünkü çekirdek ile elektronlar arasındaki elektriksel çekim kuvvetleri, elektronların çekirdeğin etrafında dönmesinden kaynaklanan merkezkaç kuvvetleriyle dengelenir.
1914'te, atomun gezegensel modelinin yaratılmasından üç yıl sonra, Rutherford çekirdekteki pozitif yükleri araştırdı. Hidrojen atomlarını elektronlarla bombalayarak, nötr atomların pozitif yüklü parçacıklara dönüştüğünü buldu. Hidrojen atomunun bir elektronu olduğu için, Rutherford bir atomun çekirdeğinin temel pozitif yük +e taşıyan bir parçacık olduğuna karar verdi. Bu parçacığı çağırdı proton.
Gezegen modeli, α-parçacıklarının saçılması üzerine yapılan deneylerle iyi bir uyum içindedir, ancak atomun kararlılığını açıklayamaz. Örneğin, bir proton çekirdeği ve bir hızla hareket eden bir elektron içeren bir hidrojen atomu modelini düşünün. v yarıçaplı dairesel bir yörüngede çekirdeğin etrafında r. Elektron çekirdeğe sarmal şeklinde dönmeli ve çekirdeğin etrafındaki dönüş frekansı (dolayısıyla yaydığı elektromanyetik dalgaların frekansı) sürekli değişmeli, yani atom kararsız ve elektromanyetik radyasyonu sürekli bir spektruma sahip olmalıdır. .
Aslında, ortaya çıkıyor:
a) atom kararlıdır;
b) bir atom sadece belirli koşullar altında enerji yayar;
c) Bir atomun radyasyonu, yapısı tarafından belirlenen bir çizgi spektrumuna sahiptir.
Böylece, atomun gezegensel modeline klasik elektrodinamiğin uygulanması, deneysel gerçeklerle tam bir çelişkiye yol açtı. Ortaya çıkan zorlukların üstesinden gelmek, niteliksel olarak yeni bir sistemin yaratılmasını gerektiriyordu. kuantum- atom teorisi. Bununla birlikte, tutarsızlığına rağmen, gezegen modeli hala atomun yaklaşık ve basitleştirilmiş bir resmi olarak kabul edilmektedir.
Atomun gezegensel modeli
Bir atomun gezegensel modeli: çekirdek (kırmızı) ve elektronlar (yeşil)
Atomun gezegensel modeli, veya Rutherford modeli, - Ernest Rutherford tarafından alfa parçacık saçılımı ile yapılan bir deney sonucunda önerilen atomun yapısının tarihsel modeli. Bu modele göre atom, atomun neredeyse tüm kütlesinin yoğunlaştığı, elektronların hareket ettiği, tıpkı gezegenlerin güneşin etrafında hareket ettiği gibi, pozitif yüklü küçük bir çekirdekten oluşur. Atomun gezegensel modeli, elektronların hareketinin kuantum niteliğinde olduğu ve klasik mekanik yasaları tarafından tanımlanmadığı gerçeğini dikkate alarak, atomun yapısı hakkındaki modern fikirlere karşılık gelir. Tarihsel olarak, Rutherford'un gezegen modeli, negatif yüklü elektronların pozitif yüklü bir atomun içine yerleştirildiğini varsayan Joseph John Thomson'ın "erik pudingi modeli"ni başardı.
Rutherford, 1911'de liderliğinde gerçekleştirilen alfa parçacıklarının altın folyo üzerine saçılması üzerine bir deneyden yola çıkarak atomun yapısı için yeni bir model önerdi. Bu saçılmada, beklenmedik şekilde çok sayıda alfa parçacığı geniş açılarla saçıldı, bu da saçılma merkezinin küçük boyutlara sahip olduğunu ve önemli miktarda enerjinin içinde yoğunlaştığını gösterdi. elektrik şarjı. Rutherford'un hesaplamaları, pozitif veya negatif yüklü bir saçılma merkezinin, o zamanlar zaten bilinen ve yaklaşık 10-10 m olduğu tahmin edilen bir atomun boyutundan en az 3000 kat daha küçük olması gerektiğini gösterdi. o zaman ve kütleleri ve yükleri belirlenirse, daha sonra çekirdek olarak adlandırılan saçılma merkezi, elektronların zıt yüküne sahip olmalıdır. Rutherford, yük miktarını atom numarasına bağlamadı. Bu sonuca daha sonra varıldı. Ve Rutherford'un kendisi, yükün atom kütlesiyle orantılı olduğunu öne sürdü.
Gezegensel modelin dezavantajı, klasik fizik yasalarıyla uyumsuzluğuydu. Elektronlar Güneş'in etrafındaki bir gezegen gibi çekirdeğin etrafında hareket ederse, hareketleri hızlanır ve bu nedenle klasik elektrodinamik yasalarına göre elektromanyetik dalgalar yaymalı, enerji kaybetmeli ve çekirdeğe düşmelidir. Gezegensel modelin geliştirilmesindeki bir sonraki adım, klasik elektron hareketi yasalarından farklı olarak diğerlerini öne süren Bohr modeliydi. Elektrodinamiğin çelişkileri tamamen kuantum mekaniğini çözebildi.
Wikimedia Vakfı. 2010 .
Diğer sözlüklerde "Atomun Gezegensel Modeli" nin ne olduğunu görün:
atomun gezegensel modeli- planetinis atomo modellerinin durumu T sritis fizika atitikmenys: angl. gezegen atom modeli vok. Planetenmodell des Atoms, n rusya. atomun gezegensel modeli, f pranc. modele planétaire de l'atome, m … Fizikos terminų žodynas
Hidrojen benzeri bir atomun Bohr modeli (Z, çekirdeğin yüküdür), burada negatif yüklü elektron atom kabuğu, küçük, pozitif yüklü atom çekirdeği... Vikipedi
Model (Fransızca modèle, İtalyan modello, Latince modül ölçü, ölçü, numune, normdan), 1) seri veya toplu çoğaltma için standart (standart) olarak hizmet eden bir numune (M. araba, M. giysi vb.) .) ), ayrıca herhangi birinin türü, markası ... ...
I Model (Model) Walter (24 Ocak 1891, Gentin, Doğu Prusya, 21 Nisan 1945, Duisburg yakınlarında), Nazi Alman General Mareşal (1944). 1909'dan beri orduda, 1914 18'in 1. Dünya Savaşı'na katıldı. Kasım 1940'tan itibaren 3. tanka komuta etti ... ... Büyük Sovyet Ansiklopedisi
Bir atom, pozitif yüklü bir çekirdek ve onun etrafında dönen negatif yüklü parçacıklardan oluşur - elektron kabuğunu oluşturan elektronlar.
Elektron yüklerinin toplamı, çekirdeğin pozitif yüküne mutlak değerde eşittir, bu nedenle atom bir bütün olarak elektriksel olarak nötr bir sistemdir. Bir atomun boyutu, boyutuna göre belirlenir elektron kabuğu ve 10-8 cm mertebesinde bir değer oluşturur.
Bir atomun kabuğundaki elektronlar katmanlar halinde düzenlenmiştir. Elektron katmanlarının sayısı seri numarasına eşittir kimyasal element periyodik element sisteminde D.I. Mendeleyev.
Çekirdeğe en yakın olan ilk katman K'de ikiden fazla elektron dönmez. Bir sonraki katmanda L - 8'den fazla değil, M katmanında - 18'den fazla değil ve dördüncü katmanda N - 32'den fazla elektron yok. Böylece, en büyük sayı bu katmanların elektronları, Z = 2n2 katman numarasının karesinin iki katına eşittir. Sonraki katmanlarda, bu kural ihlal edilir ve elektron sayısı şunlar olabilir: beşinci katmanda O - 1'den 29'a, altıncı katmanda P - 1'den 9'a ve ek (son) katmanda Q - artık yok 2 elektrondan daha fazla.
Her atom, yalnızca enerjisinin kesin olarak tanımlanmış bir değerine karşılık gelen belirli ayrık enerji durumlarında bulunur.
Bir atomun bir enerji durumundan diğerine geçişine, enerjinin emilmesi veya yayılması eşlik eder. Normal durumunda, bir atom ışıma yapmaz.
Elektronlardan biri dışarıdan bir parçacıkla çarpışırken bir miktar ek enerji alırsa, yeni enerjisinin karşılık geldiği katmanın daha uzak bir yörüngesine gidecektir. Bu durumda atom uyarılmış bir duruma girer ve ardından dış katmanın elektronlarından biri boş yere atlar. Kısa bir süre sonra (10-8 s mertebesinde), atom yayarken normal durumuna döner. görülebilir ışık, ultraviyole veya x-ışını radyasyonu.
Bir atomun elektronu büyük bir enerji alırsa, o zaman atomdan tamamen atılır (çıkarılır). Bu işleme iyonizasyon denir.
Bir atomun çekirdeği, pozitif yüklü parçacıklardan (protonlar) ve yüksüz nötr parçacıklardan (nötronlar) oluşur. Bu parçacıkların her ikisine de genellikle nükleon denir.
Bir proton, kütlesi mр = 1.6726 olan maddi bir parçacıktır. 10-24 yıl = 1.007275 amu Pozitif yük 1e+'ya eşittir. Nötronun kütlesi (mn = 1.008665 amu) protonun kütlesinden sadece % 0.14 daha büyük olduğundan, bu fark genellikle hesaplamalarda dikkate alınmaz ve nötronun kütlesi pratik olarak protonun kütlesine eşit kabul edilir. .
Çekirdeğin boyutları çok küçüktür: 10-12-10-13 cm (çekirdek bir atomdan 100.000 kat daha küçüktür). Çekirdeğin küçük boyutuna rağmen, atomun kütlesinin %99,95'i içinde yoğunlaşmıştır. Bunun ışığında, nükleer maddenin yoğunluğu çok yüksektir ve yaklaşık 1017 kg/m3'tür.
Temel birimlerde ifade edilen çekirdeğin yükü, D.I.'nin periyodik sistemindeki elementin sıra sayısına sayısal olarak eşittir. Mendeleyev. Bu, belirli bir atomun çekirdeğindeki proton sayısını, Z elementinin sıra sayısıyla belirlemeyi mümkün kılar.
Bir atomun çekirdeğindeki toplam nükleon sayısı, A kütle numarası ile belirlenebilir. Kütle numarası, elementin tam birimlere yuvarlanmış atom ağırlığıdır. Çekirdekteki proton sayısı sayısal olarak Z elementinin sıra sayısına eşit olduğundan, nötron sayısı farka eşittir. kütle Numarası A ve seri numarası Z, yani. N \u003d A - Z. Örneğin, helyum Z \u003d 2 ve A \u003d 4'e sahiptir, bu, bir helyum atomunun çekirdeğinde iki proton ve iki nötron olduğu anlamına gelir.
Böylece, elementin D.I.'nin periyodik element sistemindeki yeri. Mendeleev ve atom ağırlığı, sadece atomun yapısını değil, aynı zamanda çekirdeğinin yapısını da ortaya koymaktadır.
Proton ve nötron sayıları verilen atomlara nüklid denir.
Element tablosundaki atom ağırlığının değeri hemen hemen her zaman kesirli bir sayı olarak ifade edilir. Bunun nedeni, hemen hemen her elementin aslında bu elementin aynı elektrik yüküne sahip birkaç çeşidinden oluşmasıdır. farklı kütle, yani çekirdekte aynı sayıda proton, ancak farklı sayıda nötron. Bir atomun çekirdeğinde aynı sayıda protona sahip, ancak farklı sayıda nötron içeren kimyasal element çeşitlerine izotop denir.
Belirli bir elementin tüm izotopları, periyodik sistemin element tablosunun bir hücresine yerleştirilir. Bir elementin atom ağırlığının kesirli değeri, bu durumda bu elementin tüm izotoplarının atom ağırlığının ortalama değerini yansıtır. Şu anda, 300'den fazla olmayan (çekirdekleri uzun bir süre boyunca değişime uğramayan) 1500'den fazla izotop bilinmektedir, geri kalanı radyoaktiftir (çekirdekleri zamanla bozunur).
Atom yapısının gezegensel modeli ilk olarak J. Perrin tarafından, elektronların yörüngesel hareketi ile gözlemlenen özellikleri açıklamaya çalışarak önerildi. Ama V. Vin bunun savunulamaz olduğunu düşündü. İlk olarak, klasik elektrodinamiğe göre dönme sırasında bir elektron sürekli olarak enerji yaymalı ve sonunda çekirdeğe düşmelidir. İkinci olarak, sürekli enerji kaybı nedeniyle, bir atomun radyasyonu sürekli bir spektruma sahip olmalıdır ve bir çizgi spektrumu gözlenir.
a - parçacıklarının ince altın ve diğer metal levhalardan geçişi üzerine deneyler, E. Rutherford'un çalışanları E. Marsden ve H. Geiger (1908) tarafından gerçekleştirildi.
Neredeyse tüm parçacıkların plakadan serbestçe geçtiğini ve sadece 1/10.000'inin 150 °'ye kadar güçlü bir sapma yaşadığını buldular. Thomson'ın modeli bunu açıklayamadı, ancak eski asistanı Rutherford, sapmaların kesri hakkında tahminlerde bulundu ve bir gezegen modeline geldi: pozitif yük, 10-15 mertebesinde bir hacimde yoğunlaştı. önemli ağırlık ile.
Atomdaki elektronların yörüngelerinin sabitlenmesi göz önüne alındığında, Thomson 1913'te atom yapısının gezegensel bir modeline de ulaştı.
Ancak böyle bir atomun kararlılığı sorununu Coulomb yasasını kullanarak çözerek, yalnızca bir elektron için kararlı bir yörünge buldu. Ne Thomson ne de Rutherford, radyoaktif bozunma sırasında a parçacıklarının emisyonunu açıklayamadı - elektronların da atomun merkezinde olması gerektiği ortaya çıktı?!
M. Sklodowska-Curie de bundan bahsetti. Rutherford bunu kabul etti, ancak Coulomb itmesinin çekirdeği parçalamaması için çekirdekleri elektronlara yapıştırma işlevini atamak zorunda kaldı. Bu modeller, deneylerle tutarlı nicel sonuçlar elde edilmesine izin vermedi. 1913 yılında Rutherford'un modeliyle ilgili bazı deneysel verilere ağırlık verildi. radyoaktif olaylar. Asistanı G. Moseley frekansı ölçtü spektral çizgiler Periyodik sistemin bir dizi atomu ve “atomdan atoma geçiş sırasında düzenli olarak artan atomun doğasında belirli bir karakteristik değer olduğunu buldu. Bu miktar, iç çekirdeğin yükünden başka bir şey olamaz” [Cit. göre: 5, s. 194].
Gezegen modeli temelinde atomun yapısıyla ilgili bir teorinin inşası, birçok çelişkiyle karşılaştı.
İlk başta, Danimarkalı fizikçi N. Bohr, madde içinde hareket ederken yüklü parçacıkların yavaşlaması sorununa klasik mekanik ve elektrodinamik uygulamaya çalıştı, ancak belirli bir elektron enerjisi değeri için yörüngenin keyfi parametrelerini atfetmek mümkün oldu. (veya sıklık), paradokslara yol açtı.
Rutherford'un atom yapısının gezegensel modelinin Maxwell'in elektrodinamiği ile uyumsuz olduğu ortaya çıktı.
Şubat 1913'te, yıldızların spektrumlarının J. Nicholson tarafından yorumlanması üzerine makaleler yayınlandı. Planck'ın fikrini atomlara kadar genişleterek, elektronun momentumunun izdüşümlerini nicelleştirmeyi önerdi. Elektron gruplarının döndüğü, dolaşım frekansına eşit bir frekansta elektromanyetik dalgalar yayan ayrı yörüngelere sahip bir atom bu şekilde ortaya çıktı. Böyle bir model, oldukça heyecanlı atomlar için uygundu ve Nicholson, atom modeline dayalı olarak yıldızların ve bulutsuların tayfındaki bazı özellikleri açıkladı - pozitif yüklü bir çekirdeğin etrafında dönen bir elektron halkası fikri.
Atom, her şeyden önce, emisyon spektrumuyla karakterize edildi. Spektral frekanslarla, halka düzlemine dik elektronların özel olarak varsayılan mekanik titreşimlerinin frekanslarını bağladı.






