formula kristalizacije. Stvrdnjavanje kristalnih tijela
Prijelaz tvari iz čvrstog u tekuće stanje naziva se topljenjem, a prijelaz iz tečno stanje u čvrstu - skrućivanjem ili kristalizacijom.
Prilikom topljenja solidan rastojanja između čestica koje formiraju kristalnu rešetku se povećavaju, a sama rešetka se uništava. To znači da se tokom procesa topljenja molekula potencijalna energija supstance. Dakle, topljenje tvari ne može se dogoditi spontano, jer se energija mora potrošiti na ovaj proces.
Tokom kristalizacije, čestice se približavaju jedna drugoj, što formira rešetku, a njihova potencijalna energija se smanjuje. Stoga se kristalizacija može dogoditi samo kada tečnost preda svoju energiju nekim vanjskim tijelima.
Dakle, jedinica mase tečna supstanca ima više unutrašnja energija od jedinice mase iste supstance u čvrstom stanju, čak i ako je njihova temperatura ista.
Područje u kojem je materija homogena u svim fizičkim i hemijska svojstva, naziva se faza stanja ove supstance. Imajte na umu da čvrsta i tečna faza supstance na istoj temperaturi mogu ostati u ravnoteži proizvoljno dugo ako čvrsta faza ne može primiti energiju, a tečna faza je ne može odati. Na primjer, led može dugo plutati u vodi ako je temperatura svih okolnih tijela ista i jednaka 0°C.
Neka postoji samo čvrsta faza materije, koja prima energiju od drugih tijela. Tada će se u početku povećati i molekularni potencijal i molekularne kinetičke energije ove tvari, jer će se rastojanja između čestica u kristalnoj rešetki i brzina njihovog kretanja povećati. Tada će na određenoj temperaturi početi uništavanje kristalne rešetke. Dok se cijela tvar ne otopi, njena temperatura ostaje nepromijenjena, a sva energija koju primi tvar ide samo na rad na prevladavanju sila molekularne kohezije. Kada ostane samo tečna faza, tada će se, nastavljajući primati energiju, već zagrijati, odnosno njena molekularna kinetička energija će početi rasti.
Ako tečna faza preda svoju energiju okolnim tijelima, tada će se svi opisani procesi ponoviti obrnutim redoslijedom.
Na sl. 12.1 prikazuje grafikone promjena temperature tvari tokom topljenja i skrućivanja. Segment (slika 12.1, a) izražava količinu toplote koju prima supstanca kada se zagreje u čvrstom stanju (od T do segmenta tokom topljenja i segmenta - kada se zagreje u tečnom stanju. Segment Q (slika 12.1, b) izražava količinu toplote koju odaje supstanca kada se ohladi u tekućem stanju (od do), rezana - pri skrućivanju i reza - kada se ohladi u čvrstom stanju. Iskustvo pokazuje da do topljenja i skrućivanja određene supstance dolazi pri iste temperature, koja se ne mijenja sve dok čvrsta i tečna faza supstance koegzistiraju. Ova temperatura se naziva tačka topljenja.
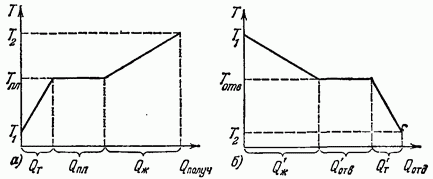
Imajte na umu da tokom topljenja i skrućivanja tvari uvijek postoji oštra granica između čvrste i tekuće faze.
Kao što iskustvo pokazuje, procesi topljenja i očvršćavanja se ne primjećuju u amorfnim tvarima. Kada se zagreju, postepeno omekšaju, a kada se ohlade, postepeno se zgusnu. Temperatura amorfnih supstanci u ovim slučajevima se kontinuirano mijenja, a ne postoji granica između čvrste i tekuće faze, jer njihova cijela masa ima ujednačen izgled.
Dakle, topljenje i kristalizacija se mogu posmatrati samo u kristalna tela.
U kristalnom, kao i iz jednog kristalnog stanja u drugo (rekristalizacija ili sekundarna kristalizacija); prva vrsta. Kristalizacija iz tekuće ili plinovite faze je egzotermni proces u kojem se oslobađa toplina fazni prelaz, ili toplota kristalizacije; dok je promjena u većini slučajeva [u J / (mol. K)]: for jednostavne supstance 5-12, za neorganska jedinjenja 20-30, za organska jedinjenja 40-60. Rekristalizacija se može nastaviti oslobađanjem ili apsorpcijom topline. U industriji i laboratoriji. U praksi se kristalizacija koristi za dobijanje proizvoda sa datim sastavom, sadržajem nečistoća, veličinom, oblikom i nedostatkom (vidi... Kristali), kao i za frakciono razdvajanje smeša, uzgoj monokristala itd.
Fizičke i hemijske osnove procesa. Uvjeti pod kojima je moguća kristalizacija određuju se tipom. Da bi se kristalizacija odvijala konačnom brzinom, početna faza mora biti prehlađena (pregrijana), prezasićena kristalizirajućom supstancom ili uvedena u vanjsku fazu. polje koje smanjuje rastvorljivost faze kristalizacije. U prehlađenoj (pregrijanoj) ili prezasićenoj fazi nastaju kristalizacijski centri koji se pretvaraju u kristale i rastu, po pravilu mijenjajući oblik, sadržaj nečistoća i nesavršenost. Centri kristalizacije pojavljuju se homogeno u zapremini početne faze i heterogeno na površinama stranih čvrstih čestica (primarna nukleacija), kao i blizu površine prethodno formirane nove faze (sekundarna nukleacija). Ukupan broj centre kristalizacije koji su nastali u jedinici zapremine rastvora ili za 1 s, ili ukupan intenzitet njihovog primarnog i sekundarnog formiranja, nalazi se po formuli:
gdje je a kinetički koeficijent primarne nukleacije, koji se razmatra u okviru kinetička teorija formiranje nove faze; R -
. T je temperatura kristalizacije; y - specifična površina slobodna energija kristali; V t - molarni volumen nove faze; Dm = DHS i S = (T 0 -7) / T 0 za taline, am \u003d RT1n (S + 1) i S = (c-c 0) / c 0 za otopine; DH-entalpija kristalizacije; c - kristalizirajuća supstanca; T 0 i c 0 - respektivno. temperatura supstance i zasićenog rastvora; E akt - prelaz iz sredine u centre kristalizacije; I at - intenzitet sekundarne nukleacije u zapremini početne faze. Za mjerenje a, E akt i I watt, utvrđena je ovisnost intenziteta formiranja kristalizacijskih centara o temperaturi, prezasićenosti i koncentraciji stranih čvrstih čestica.
Vrijednost I i prolazi kroz jedan ili nekristalizacijski maksimum (slika 1) sa povećanjem prehlađenja (supersaturacija) i raste sa meh. uticaji (miješanje,
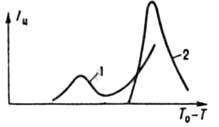
Rice. I Zavisnost brzine nukleacije od prehlađenja InSb: I talina mase 16 g je pregrijana u kvarcnom lončiću za 15 K iznad temperature tokom 9 min, a zatim ohlađena brzinom od 1°/min; 2 isto, na 55 K tokom 20 s pod uticajem . Tokom rasta, kristalizirajuća supstanca se prvo adsorbuje na površini formiranog kristala, a zatim se ugrađuje u njegovu kristalnu rešetku: sa jakim superhlađenjem, izjednačena je na bilo kom delu površine (normalan rast), sa slabim prehlađenjem, u slojevima tangencijalno na stepenicama formiranim spiralnim ili dvodimenzionalnim jezgrima (rast po sloj). Ako je prehlađenje ispod određene vrijednosti, to se naziva granica morfološke stabilnosti, normalno rastući kristal ponavlja oblik (obično zaobljen) termičkog ili koncentracijskog polja oko sebe, a kristal koji raste sloj po sloj ima oblik poliedar. Kada se ova granica prekorači, rastu kristali nalik stablu (dendriti). Kvantitativno, rast karakterizira linearna brzina jednaka brzini kretanja njihove površine u smjeru normalnom na nju. U industriji se koristi efektivna linearna stopa rasta (povećanje polumjera kugle za 1 s, čiji je volumen jednak volumenu kristala): I eff = bS n exp (E p / RT) , gdje je b koeficijent kinetičkog rasta (10 -5 -10 -14 m/s), n-parametar rasta (obično 1-3), E p - rast (10-150 kJ/mol). Parametri b, n i E p se nalaze mjerenjem I eff at različite temperature i prezasićenje rastvora ili prehlađenje taline. Sa povećanjem prehlađenja, I eff prolazi kroz maksimum sličan I m .
Brzina rasta može biti ograničena masom i okolinom (odnosno, načinom rasta vanjske difuzije i izmjene topline), brzina hemijska interakcija kristalizirajuća komponenta sa drugim komponentama medija (eksterni kinetički režim) ili procesi na površini (adsorpciono-kinetički režim). U eksternom kinetičkom modu, I eff raste s povećanjem koncentracije reagensa i . u načinu eksterne difuzije i izmjene topline - s povećanjem intenziteta miješanja, u adsorpciono-kinetičkom načinu - s povećanjem površinskih defekata i smanjenjem koncentracije surfaktanata.
Pri visokim stopama rasta, kristali dobijaju značajan broj neravnotežnih defekata (praznine, dislokacije, itd.). Kada se prekorači granica morfološke stabilnosti, trodimenzionalne inkluzije medijuma, zazidane između grana dendrita (okluzija), ulaze u volumen. Zbog okluzije, sastav se približava sastavu medija što je više I eff. Tokom svog rasta, kristali hvataju sve nečistoće prisutne u mediju, a zarobljena nečistoća zavisi od brzine rasta. Ako dođe do kristalizacije u rastvoru i kristali nastave da kontaktiraju medij nakon završetka rasta, tada se neravnotežna zarobljena nečistoća izbacuje iz medijuma, a njihova struktura se poboljšava (strukturna rekristalizacija). Istovremeno se u miješanom mediju pojavljuju dodatni strukturni defekti prilikom međusobnog sudara i sa zidovima kalupa. Zbog toga se u sistemu postepeno uspostavlja stacionarna neispravnost kristala, koja zavisi od intenziteta mešanja. In naib. U uobičajenom slučaju formiranja mnoštva tokom kristalizacije (masovna kristalizacija), istaložena faza je polidisperzna, što je zbog neistovremenosti nukleacije i fluktuacija u njihovom rastu. Mali kristali su topljiviji od velikih; stoga, sa smanjenjem prezasićenosti, dolazi trenutak kada medij, koji ostaje prezasićen u odnosu na potonje, postaje

Rice. 2. Funkcija raspodjele veličine (uobičajeno r i najvjerovatnije r A) tokom izotermne (298 K) periodične kristalizacije iz vodenog rastvora u kristalizatoru sa mešalicom (Re=10 4 broj): 1 BaSO 4 , početno prezasićenje S 0 =500 . r A =7,6 µm; 2 - K 2 SO 4 , soljenje metanolom (1.1) r A = 1 µm; t vrijeme obrade.
Od ovog trenutka počinje njihovo otapanje i rast velikih (Oswaldovo sazrijevanje), zbog čega se prosječna veličina povećava, a njihov broj smanjuje. U isto vrijeme, u miješanom mediju, kristali se raspadaju tokom sudara i nakon nekog vremena dobijaju stacionarnu disperziju, determiniranu intenzitetom mehaničkog djelovanja. Main količine, karakteristika masene kristalizacije - funkcija raspodjele veličine f(r,t)=dN/dr , gdje je N broj kristala čija je veličina manja od trenutne veličine r, po jedinici volumena u trenutku t. Ova funkcija često ima zvonolik izgled (slika 2); njegova uzlazna grana je osjetljiva uglavnom na nukleaciju, rast, cijepanje i otapanje (tokom sazrijevanja) kristala, silazna je osjetljiva na rast i formiranje njihovih agregata. Ako standardna devijacija veličine od prosjeka ne prelazi polovicu, poziva se ova druga, spomenuta funkcija. uska, ako je veća - široka. Promjena funkcije f(r,t) pri kristalizaciji opisuje se jednadžbom:

gdje je a koeficijent fluktuacije brzine rasta kristala; D do i v do - odn. koeficijent difuzije i brzina kretanja u mediju; I ar i I p - respektivno. intenzitet formiranja date veličine zbog adhezije manjih čestica i cijepanja kristala.
Sistem jednadžbi materijalnog i toplotnog bilansa, jednačine (2), kao i jednačine koje povezuju veličinu i brzinu rasta sa njihovim oblikom, nedostatkom i sadržajem nečistoća, osnova su za modeliranje i proračun kristalizacije mase i izbor optimalnih uslova za njenu implementacija. Masovna kristalizacija se vrši periodično ili kontinuirano. Tokom periodične kristalizacije, rastopljeni ili zasićeni rastvor (para) se hladi, rastvarač se isparava, dodaju se sredstva za soljenje (vidi dole) ili se delovi reagensa koji formiraju proizvodne kristale mešaju. U kontinuiranoj kristalizaciji, tokovi taline, prezasićene otopine ili reagensa se uvode u kristalizator i kristalni proizvod se kontinuirano povlači.
Sa periodičnim proces, brzina kristalizacije, određena formulom:
![]() ,
,
gdje je r i V - odn. gustina čvrste faze i zapremina sistema, prvo polako raste (period indukcije), a zatim naglo raste kao rezultat istovremenog povećanja r i f i, prošavši kroz maksimum, opada (slika 3) zbog smanjenja I eff. Tokom perioda indukcije i povećanja brzine kristalizacije, u sistemu dominira nukleacija i rast kristala, u periodu smanjenja brzine, njihovog rasta, agregacije i cijepanja, a zatim Oswaldovog sazrevanja i strukturne rekristalizacije. Period indukcije se skraćuje pod uticajem faktora koji ubrzavaju nukleaciju i rast kristala. Dakle, kada se hlađenje topi, ovaj period se prvo smanjuje sa povećanjem intenziteta hlađenja, a zatim
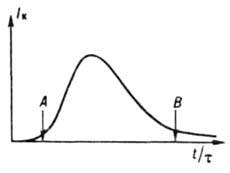
Rice. 3. Tipična promjena u brzini periodične kristalizacije: t - vrijeme procesa; t je trajanje perioda indukcije; A je trenutak pojave nove faze; B - početak faze strukturne rekristalizacije i Oswaldovog zrenja se povećava zbog ekstremne zavisnosti brzine nukleacije i rasta od prehlađenja; ako je brzina hlađenja dovoljno visoka, talina se stvrdnjava dok ostaje amorfna (vidi Sl. staklasto stanje). Da bi se smanjio period indukcije, sistemu se dodaju kristali proizvoda (semena), koji rastu, što dovodi do povećanja brzine kristalizacije. Pri niskim prehlađenjima (supersaturacijama) jezgre se uopće ne pojavljuju, a sjeme uneseno u sistem u obliku monokristala može prerasti u monokristal, a u obliku praha u tzv. monodisperzni proizvod sa uska funkcija f(r, t).
Uz kontinuiranu kristalizaciju, funkcija f(r, t) u uporedivim uslovima je širi nego kod periodične kristalizacije, što se objašnjava širenjem vremena zadržavanja u kontinuiranim kristalizatorima. Da bi se ova funkcija suzila, mod kristalizacije se približava idealnom modu pomaka, da bi se proširio - idealnom modu (vidi Sl. Struktura navoja). Pri niskoj prezasićenosti sistema, kontinuirana kristalizacija je stabilna na fluktuacije u eksternom. uslovi; pri visokoj prezasićenosti, njegova vrijednost i veličina fluktuiraju tokom kristalizacije.
In chem. i srodnim industrijama, kao iu laboratorijama, uglavnom se koristi kristalizacija iz talina i rastvora, rjeđe - kristalizacija iz parnih i čvrstih faza. Kristalizacija iz taline koristi se uglavnom za učvršćivanje rastopljenih tvari i, osim toga, za njihovo frakcijsko odvajanje i. Stvrdnjavanje tvari u obliku odljevaka (blokova) vrši se u posebnim oblicima. U maloj proizvodnji (na primjer, reagensi), obično se koriste odvojeni kalupi određene veličine ili konfiguracije, u kojima se talina hladi prirodnom izmjenom topline sa okruženje; u industrijama velikih kapaciteta (naftalin i dr.), kristalizacija se vrši u sekcionim, cevastim, transporternim i drugim kristalizatorima sa ugrađenim kalupima, prinudno hlađenim vodom, tečnim NH 3, freonima itd.
Za dobivanje proizvoda u obliku tankih ploča ili ljuskica koriste se kontinuirano djelujući trakasti, valjkasti i diskovi kalupi, gdje se sušenje odvija mnogo intenzivnije nego u kalupima. U kalupu za vrpcu (slika 4), početno topljenje
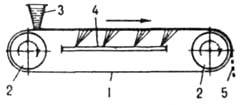
Rice. 4. Kalup trake: 1 traka; 2 pogonska bubnja; 3 rezervoara za hranjenje; 4 uređaj za hlađenje; 5, osušeni proizvod se u tankom sloju nanosi na pokretnu metalnu traku, na kojoj se hladi dok se potpuno ne očvrsne. U aparatu za valjak (sl. 5) proizvod kristalizira na vanjskoj površini rotirajućeg šupljeg bubnja (valjka) ohlađenog iznutra, djelomično uronjenog u kupku taline; kristali se uklanjaju iz bubnja fiksnim nožem. Kod disk uređaja proizvodi se stvrdnjavaju na površini rotirajućih diskova hlađenih iznutra.

Rice. 5. Kalup za valjak: 1 bubanj; 2 kupatila; 3 noža; 4 cijevi za dovod rashladnog sredstva; 5 mlaznica; 6 topiti; 7 osušeni proizvod.
Prilikom pripreme proizvoda za granulaciju, talina se raspršuje direktno u plinoviti tok rashladnog sredstva, uglavnom u zrak (proizvodnja amonijum nitrata, uree, itd.), ili u tekućinu, na primjer vodu ili ulje (plastika, proizvodnja sumpora, itd.) u šupljim kulama ili aparati sa fluidiziranim slojem, gdje kristaliziraju male kapljice
Kristalizacija iz rastvora se uglavnom koristi za izdvajanje vrednih komponenti iz rastvora, kao i za njihovo koncentrisanje i prečišćavanje supstanci od nečistoća. Supstance čija rastvorljivost jako zavisi od temperature (npr. KNO 3 u vodi) kristališu hlađenjem vrućih rastvora, dok se početna količina rastvarača sadržana u matičnoj tečnosti ne menja u sistemu (izohidrična kristalizacija). U maloj proizvodnji koriste se kapacitivni šaržni kalupi, opremljeni hlađenim omotačem. U takvim uređajima otopina se hladi uz kontinuirano miješanje prema određenom programu. Da biste spriječili intenzivnu inkrustaciju rashladnih površina, temperaturna razlika između otopine i rashladnog sredstva ne bi trebala biti veća od 8-10°C. U velikoj proizvodnji u pravilu se koriste strugači, vijčani, disk, bubanj i rotacijski kalupi kontinuiranog djelovanja. Strugači se obično sastoje od nekristalizirajućih cevastih sekcija povezanih u seriju, od kojih svaki ima osovinu sa strugačima i koji su opremljeni zajedničkim ili pojedinačnim rashladnim plaštem. Kada se osovina okreće, strugači čiste unutrašnjost. površina ohlađenih cijevi se taloži na njima i doprinosi transportu rezultirajuće zgusnute suspenzije od sekcije do sekcije. U vijčanim kalupima otopina se miješa i pomiče pomoću punih ili remenskih vijaka.
Kalupi za diskove su opremljeni fiksnim ili rotirajućim diskovima. U prvom slučaju (sl. 6) duž ose aparata za čišćenje površina diskova od taloženih kristala nalazi se pogonsko vratilo sa strugačima; početna otopina se ubacuje u kalup odozgo, a rezultirajuća suspenzija uzastopno prolazi u prostoru između ohlađenih diskova i ispušta se kroz donji spoj. U drugom slučaju, osovina sa diskovima se postavlja unutar korita ili horizontalne cilindrične posude; kristali se uklanjaju sa površine diskova fiksnim strugačima.

Glavni element kalupa za bubanj je šuplji bubanj sa potpornim zavojima, postavljen pod uglom od 15° prema horizontalnoj osi i koji se okreće frekvencijom od 5-20 min -1. Otopina, hlađena vodenom košuljicom ili zrakom (koji se ventilatorom pumpa kroz unutrašnju šupljinu bubnja), ulazi s jednog njegovog kraja, a suspenzija se ispušta s drugog.
Viskozne otopine (na primjer, masne kiseline) često se hlade u rotacionim kristalizatorima - cilindričnim aparatima, unutar kojih se velika brzina rotor sa noževima se okreće. Potonji se pod djelovanjem centrifugalne sile pritiskaju na unutrašnju površinu kalupa, čisteći ga od natopljenih kristala. Otopina se obično dovodi u aparat pod pozitivnim pritiskom. Da bi se produžilo vrijeme zadržavanja u kristalizatoru otopine i njegovo veće prehlađenje, nekoliko uređaja je povezano u seriju.
Prilikom upotrebe strugača, pužnih, rotacionih i ponekad diskova kalupa često se formiraju mali kristali (0,1-0,15 mm), što dovodi do povećanja zgrušavanja i adsorpcione kontaminacije proizvoda, a također pogoršava njegovu filtrabilnost. Zbog toga se u cilju uvećanja proizvoda, nakon navedenih aparata, ugrađuju tzv. kristalni rastvarači, u kojima se koncentrirana suspenzija drži na laganom hlađenju, što dovodi do rasta do 2-3 mm.
Za dobijanje krupnozrnih homogenih proizvoda, često se koriste kristalizatori sa fluidizovanim slojem (slika 7). Inicijalna otopina se zajedno sa cirkulirajućom bistrenom matičnom tekućinom upumpava u izmjenjivač topline, gdje se, kao rezultat hlađenja, otopina prezasićena i kroz cirkulacijsku cijev ulazi u donji dio rastvarača kristala, u kojem se kristali nalaze. se drže u suspenziji uzlaznim tokom rastvora. Kristalizacija se odvija uglavnom na gotovim kristalizacijskim centrima, dok se veliki kristali talože na dno aparata, odakle se uklanjaju u obliku zgusnute suspenzije. Bistrena matična tečnost se deli na dva dela: jedan se uklanja iz gornjeg dela aparata, a drugi se dovodi u recirkulaciju.

Rice. 7. Kristalizator u fluidiziranom sloju: I pumpa: 2 izmjenjivača topline: 3 cirkulacijske cijevi; 4 kristalni rastvarač.
U velikom broju slučajeva kristalizacija rastvora se vrši direktnim mešanjem sa tečnim, gasovitim i isparavajućim rashladnim sredstvima u aparatima za mešanje, mjehuriće, raspršivanje i druge. Ako se rastvorljivost tvari malo mijenja s temperaturom (na primjer, NaCl u vodi), kristalizacija se provodi djelomičnim ili gotovo potpunim isparavanjem rastvarača isparavanjem zasićene otopine na skoro konstantna temperatura(izotermna kristalizacija). Po dizajnu, kristalizatori isparivača u velikoj meri podsećaju na isparivače i mogu imati unutrašnje ili spoljašnje (slika 8) grejne komore. U takvom kristalizatoru, početni i cirkulirajući rastvori, prolazeći kroz komoru, zagrijavaju se do tačke ključanja. Rezultirajuća smjesa para-tečnost ulazi u separator, gdje se para odvaja od otopine. Kristali taloženi u separatoru, zajedno s matičnom tekućinom, šalju se u poseban aparat, u kojem se odvajaju od njega i uklanjaju u obliku koncentrirane suspenzije;
Rice. 8. Isparavajuće kristalitne planine: 1 daljinska komora za grijanje: 2 separator: 3 cijev za cirkulaciju; 4 kristalni separator.
Rice. 9. Vakum kristalizator: 1 - separator: 2 - cirkulaciona cijev: 3 barometrijska cijev; 4 vodeni pečat
bistrena matična tečnost se vraća u komoru. Kako bi se spriječilo stvaranje inkrustacije (prljanja) grijaćih površina, otopina mora cirkulirati u kalupu dovoljno velikom brzinom (do 3 m/s), što se često postiže upotrebom aksijalnih pumpi.
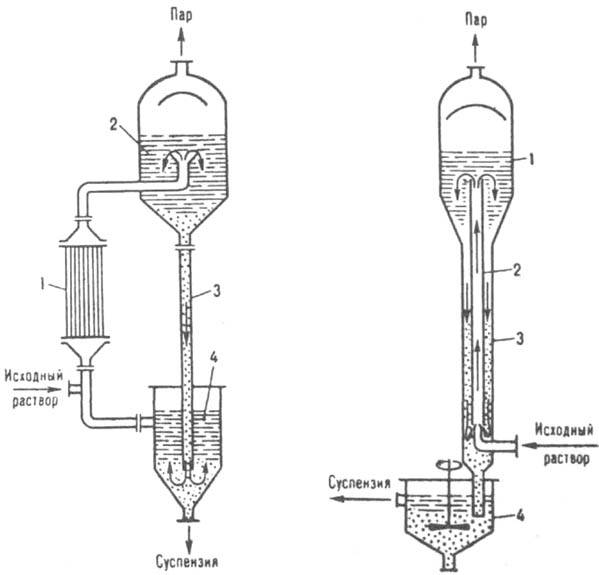
Uz istovremeno hlađenje i isparavanje rastvarača, kristalizacija se vrši u serijskim ili kontinuiranim vakuum kristalizatorima, uz prisilnu ili prirodnu cirkulaciju otopine. Rastvor se hladi zbog adijabatskog isparavanja dijela rastvarača kada se u takvom aparatu stvori određeni vakuum. Količina isparenog rastvarača je obično 8-10% ukupne mase rastvora. U kristalizatoru sa prirodnom cirkulacijom (Sl. 9), početna otopina se dovodi u donji dio cirkulacijske cijevi i zajedno sa cirkulirajućom suspenzijom se diže prema gore, gdje ključa kao rezultat smanjenja tlaka. Dobijene pare prolaze kroz separator i ulaze u barometarski kondenzator. Prezasićeni rastvor i istaloženi kristali se kreću niz barometarsku cev, odakle se kristali zajedno sa delom matične tečnosti ispuštaju u hidraulični zaptivač. Za održavanje vakuuma koriste se vakuum pumpe ili parni mlazni injektori. U velikoj proizvodnji široko se koriste postrojenja za vakuumsku kristalizaciju s više posuda sa 4-24 kućišta, u kojima se dubina razrjeđivanja postepeno povećava od prvog do posljednjeg kućišta. Vakumski kristalizatori su efikasniji i ekonomičniji od kristalizatora uparivača.
Neke tvari se mogu kristalizirati soljenjem. Prilikom izolacije anorganskih spojeva koriste se organske tvari (na primjer, Na 2 SO 4 se kristalizira dodavanjem metanola, etanola ili NH 3 u njegovu vodenu otopinu) ili sadrže isti ion sa spojem koji se izoluje (na primjer, kristalizira se FeSO 4 iz rastvora za jetkanje dodavanjem koncentrovanog H 2 SO4); prilikom odabira org. jedinjenja - voda, vodeni rastvori neorganskih soli itd. Unošenje organskih supstanci u rastvor kao sredstava za soljenje obično povećava cenu procesa zbog složenosti njihove regeneracije. Kristalizacija u parnoj fazi omogućava kristalizaciju supstanci sa visokom parcijalni pritisak pare iznad čvrste faze i sposobne da direktno pređu iz gasovitog stanja u kristalno (na primer, jod, ftalni anhidrid). Takva kristalizacija se koristi za izolaciju vrijednih komponenti iz mješavine para i plina, dobivanje aerosola, taloženje tankih kristalnih slojeva na površini različitih tijela (na primjer, u proizvodnji poluvodičkih materijala) itd. Kristalizacija amorfne čvrste faze i prekristalizacija se po pravilu odvijaju na temperaturama bliskim temperaturama kristaliziranih tvari. U ovom slučaju, kao rezultat procesa toplinske difuzije, dolazi do promjene primarne kristalne strukture tvari ili dolazi do nukleacije i rasta iz amorfne faze. Takva kristalizacija se koristi za dobijanje supstanci i materijala sa datom kristalnom strukturom ili stepenom kristalnosti (termoplastični polimeri, staklo, itd.). Lit.: Mullin, JW Crystallization, trans. sa engleskog, M., 1965; Magusevič LN Kristalizacija iz rastvora u hemijskoj industriji, M., 1968; Bamfort A V, Industrijska kristalizacija, per. sa engleskog, M., 1969; Ponomarenko VG Tkachenko kristalizacija P., Kurlyand Yu. A., Kristalizacija u fluidiziranom sloju. kristalizacija, 1972; Melikhov I.V., Merkulova M.S. Kokristalizacija, M.. 1975; Gelperin N. I., Nosov G. A., Osnove tehnologije kristalizacije taline, M., 1975; Kidyarov B.I., Kinetika obrazovanja
SOLIDIFIKACIJA KRISTALNIH TIJELA
Kako temperatura pada, tvar može prijeći iz tekućeg u čvrsto stanje.
Ovaj proces se naziva stvrdnjavanje ili kristalizacija.
Prilikom skrućivanja tvari oslobađa se ista količina topline koja se apsorbira tokom njenog topljenja.

Proračunske formule za količinu toplote tokom topljenja i kristalizacije su iste.

Temperature topljenja i očvršćavanja iste tvari, ako se tlak ne mijenja, su iste.
Tokom procesa kristalizacije, temperatura tvari se ne mijenja, a može istovremeno postojati iu tekućem i u čvrstom stanju.
POGLEDAJTE POLICU KNJIGA!
WOW, ZANIMLJIVI FENOMENI!
Led u boji?
Ako u plastičnu čašu s vodom dodate malo boje ili listova čaja, promiješajte i, primivši rastvor boje, zamotajte čašu odozgo i stavite je na hladno, tada će se od dna do površine početi stvarati sloj leda. Međutim, nemojte očekivati da ćete dobiti obojeni led!

Tamo gdje je počelo smrzavanje vode, bit će apsolutno proziran sloj leda. Njegov gornji dio bit će obojen, pa čak i jači od originalnog rješenja. Ako je koncentracija boje bila vrlo visoka, tada na površini leda može ostati lokva njene otopine.
Činjenica je da prozirni svježi led nastaje u otopinama boje i soli. rastući kristali istiskuju sve strane atome i molekule nečistoća ,
pokušavajući izgraditi savršenu mrežu što je duže moguće. Tek kada nečistoće nemaju kamo otići, led ih počinje ugrađivati u svoju strukturu ili ih ostavlja u obliku kapsula s koncentriranom tekućinom. Stoga je morski led svjež, a i najprljavije lokve su prekrivene prozirnim i čistim ledom.
Na kojoj temperaturi se voda smrzava?
Uvek na nula stepeni?
Ali ako se prokuvana voda sipa u apsolutno čistu i suvu čašu i stavi van prozora na mraz na temperaturi od minus 2-5 stepeni C, pokrije čistim staklom i zaštiti od direktne sunčeve svetlosti, tada se za nekoliko sati sadržaj posude. staklo će se ohladiti ispod nule, ali ostaće tečno.
Ako zatim otvorite čašu i bacite komad leda ili snijega ili čak samo prašinu u vodu, tada će se bukvalno pred vašim očima voda odmah smrznuti, nicajući u cijelom volumenu dugim kristalima.
Zašto? Transformacija tekućine u kristal se događa prvenstveno na nečistoćama i nehomogenostima - česticama prašine, mjehurićima zraka, nepravilnostima na zidovima posude. U čistom
voda nema centre kristalizacije, a može super kul, zadržavanje tečnosti. Na taj način je bilo moguće dovesti temperaturu vode na minus 70°C.
Kako se to dešava u prirodi?
U kasnu jesen, vrlo čiste rijeke i potoci počinju da se smrzavaju sa dna. Kroz sloj bistre vode jasno se vidi da su alge i naplavine na dnu obrasle labavim ledenim omotačem. U nekom trenutku, ovaj led na dnu izbija, a površina vode se odmah ispostavlja da je vezana ledenom korom.
Temperatura gornjih slojeva vode je niža od dubokih, a čini se da smrzavanje počinje s površine. Međutim, čista voda nerado se smrzava, a led se prije svega formira tamo gdje se nalazi suspenzija mulja i čvrsta površina - blizu dna.
Spužvaste mase se često pojavljuju nizvodno od vodopada i preljeva brana. unutrašnji led, raste u pjenastoj vodi. Izdižući se na površinu, ponekad začepi cijeli kanal, formirajući takozvani zazhory, koji čak može pregraditi rijeku.
Zašto je led lakši od vode?
Unutar leda ima mnogo pora i praznina ispunjenih vazduhom, ali to nije razlog,
što može objasniti činjenicu da je led lakši od vode. Led i bez mikroskopskih pora
i dalje ima gustinu manju od gustine vode. Sve je u karakteristikama unutrašnja struktura led. U kristalu leda, molekuli vode nalaze se na čvorovima kristalne rešetke tako da svaki ima četiri "susjeda".
Voda nema kristalna struktura, a molekuli u tečnosti su bliže jedan drugom,
nego u kristalu, tj. voda je gušća od leda.
Prvo, kada se led topi, oslobođeni molekuli i dalje zadržavaju strukturu kristalne rešetke, a gustoća vode ostaje niska, ali postepeno se kristalna rešetka uništava, a gustoća vode se povećava.
Na temperaturi od + 4°C, gustoća vode dostiže maksimum, a zatim, s povećanjem temperature, počinje opadati zbog povećanja brzine toplinskog kretanja molekula.
Kako se lokva zamrzava?
Kada se ohladi, gornji slojevi vode postaju gušći i tonu prema dolje. Njihovo mjesto zauzima gušća voda. Ovo miješanje se nastavlja sve dok temperatura vode ne padne.
do +4 stepena Celzijusa. Na ovoj temperaturi, gustina vode je maksimalna.
Daljnjim smanjenjem temperature gornji slojevi vode već mogu biti komprimirani,
i postepeno hlađenje na 0 stepeni, voda počinje da se smrzava.

U jesen je noćna i dnevna temperatura vazduha veoma različita, pa se led u slojevima smrzava.
Donja površina leda na lokvi koja se smrzava vrlo je slična poprečnoj rez stabla:
vidljivo koncentrična prstenovi. Širina ledenih prstenova može se koristiti za procjenu vremena. Obično lokva
počinje da se smrzava s rubova, tk. manja je dubina. Površina formiranih prstenova se smanjuje s približavanjem centru.
ZANIMLJIVO!
Da se u cijevima podzemnog dijela zgrada voda često smrzava ne u mrazu, već u otopljenju!
To je zbog loše toplotne provodljivosti tla. Toplota putuje zemljom tako sporo
da se minimalna temperatura u tlu javlja kasnije nego na površini zemlje. Što dublje
što više kasni. Često, tokom mraza, tlo nema vremena da se ohladi,
a tek kada na zemlji nastupi otopljenje, mrazovi dopiru do zemlje.
Da ga, smrzavajući se u začepljenoj boci, voda razbije. Šta se dešava sa čašom ako u njoj zamrznete vodu? Voda će se, smrzavajući, proširiti ne samo prema gore, već i sa strane, a staklo će se skupiti. Ovo će i dalje dovesti do uništenja stakla!
DA LI STE ZNALI?
Poznat je slučaj kada se sadržaj boce narzana dobro ohlađen u zamrzivaču, otvoren vrelog ljetnog dana, momentalno pretvorio u komad leda.
Zanimljivo se ponaša metalno "liveno gvožđe", koje se tokom kristalizacije širi. To mu omogućava da se koristi kao materijal za umjetničko livenje tankih čipkastih rešetki i malih stolnih skulptura. Uostalom, kada se učvršćuje, širi, lijevano željezo ispunjava sve, čak i najsuptilnije detalje forme.
Na Kubanu se zimi pripremaju jaka pića - "zamrzavaju". Da biste to učinili, vino se izlaže mrazu. Prije svega, voda se smrzava, a ostaje koncentrirana otopina alkohola. Isuši se i radnja se ponavlja dok se ne postigne željena čvrstoća. Što je veća koncentracija alkohola, to je niža tačka smrzavanja.
Najviše tuča, popravljen od strane ljudi, pao u Kanzasu, SAD.
Njegova težina je bila skoro 700 grama.
Kiseonik u gasovitom stanju na temperaturi od minus 183 stepena C prelazi u tečnost,
a na temperaturi od minus 218,6 stepeni C, čvrsti kiseonik se dobija iz tečnog kiseonika.

U stara vremena ljudi su koristili led za čuvanje hrane. Carl von Linde stvorio je prvi kućni hladnjak sa parnim strojem koji je pumpao freon kroz cijevi. Iza frižidera se gas u cevima kondenzovao i pretvorio u tečnost. Unutar frižidera, tečni freon je ispario i njegova temperatura je naglo pala, hladeći odeljak frižidera. Tek 1923. švedski pronalazači Balzen von Platen i Carl Muntens stvorili su prvi električni frižider, u kojem se freon pretvara iz tečnosti u gas i uzima toplotu iz vazduha u frižideru.
OVO JE DA!
Nekoliko komada suvi led, napušten u zapaljeni benzin, ugasiti vatru.
Postoji led koji bi opekao prste ako bi se mogao dodirnuti. Dobija se pod vrlo visokim pritiskom, pri kojem voda prelazi u čvrstom stanju na temperaturama znatno iznad 0 stepeni Celzijusa.
Kako temperatura pada, tvar može prijeći iz tekućeg u čvrsto stanje.
Ovaj proces se naziva skrućivanjem ili kristalizacijom.
Prilikom skrućivanja tvari oslobađa se ista količina topline koja se apsorbira tokom njenog topljenja.

Proračunske formule za količinu toplote tokom topljenja i kristalizacije su iste.

Temperature topljenja i očvršćavanja iste tvari, ako se tlak ne mijenja, su iste.
Tokom procesa kristalizacije, temperatura tvari se ne mijenja, a može istovremeno postojati iu tekućem i u čvrstom stanju.
POGLEDAJTE POLICU KNJIGA
ZANIMLJIVO O KRISTALIZACIJI
Led u boji?
Ako plastičnoj čaši s vodom dodate malo boje ili listova čaja, promiješajte je i, nakon što ste dobili obojenu otopinu, omotajte čašu na vrh i izložite je mrazu, tada će se od dna početi formirati sloj leda do površine. Međutim, nemojte očekivati da ćete dobiti obojeni led!

Tamo gdje je počelo smrzavanje vode, bit će apsolutno proziran sloj leda. Njegov gornji dio bit će obojen, pa čak i jači od originalnog rješenja. Ako je koncentracija boje bila vrlo visoka, tada na površini leda može ostati lokva njene otopine.
Činjenica je da prozirni svježi led nastaje u otopinama boje i soli. rastući kristali istiskuju sve strane atome i molekule nečistoća, pokušavajući izgraditi savršenu rešetku dok je to moguće. Tek kada nečistoće nemaju kamo otići, led ih počinje ugrađivati u svoju strukturu ili ih ostavlja u obliku kapsula s koncentriranom tekućinom. Stoga je morski led svjež, a i najprljavije lokve su prekrivene prozirnim i čistim ledom.
Na kojoj temperaturi se voda smrzava?
Je li uvijek na nula stepeni?
Ali ako se prokuvana voda sipa u apsolutno čistu i suvu čašu i stavi van prozora na mraz na temperaturi od minus 2-5 stepeni C, pokrije čistim staklom i zaštiti od direktne sunčeve svetlosti, tada se za nekoliko sati sadržaj posude. staklo će se ohladiti ispod nule, ali će ostati tečno.
Ako zatim otvorite čašu i bacite komad leda ili snijega ili čak samo prašinu u vodu, tada će se bukvalno pred vašim očima voda odmah smrznuti, nicajući u cijelom volumenu dugim kristalima.
Zašto?
Transformacija tekućine u kristal se događa prvenstveno na nečistoćama i nehomogenostima - česticama prašine, mjehurićima zraka, nepravilnostima na zidovima posude. Čista voda nema centre kristalizacije i može biti prehlađena dok ostaje tečna. Na taj način je bilo moguće dovesti temperaturu vode na minus 70°C.
Kako se to dešava u prirodi?
U kasnu jesen, vrlo čiste rijeke i potoci počinju da se smrzavaju sa dna. Kroz sloj bistre vode jasno se vidi da su alge i naplavine na dnu obrasle labavim ledenim omotačem. U nekom trenutku, ovaj led na dnu izbija, a površina vode se odmah ispostavlja da je vezana ledenom korom.
Temperatura gornjih slojeva vode je niža od dubokih, a čini se da smrzavanje počinje s površine. Međutim, čista voda nerado se smrzava, a led se prije svega formira tamo gdje se nalazi suspenzija mulja i čvrsta površina - blizu dna.
Nizvodno od vodopada i preljeva brana, često postoji spužvasta masa leda u vodi koja raste u uzburkanoj vodi. Izdižući se na površinu, ponekad začepi cijeli kanal, formirajući takozvani zazhory, koji čak može pregraditi rijeku.
Zašto je led lakši od vode?
Unutar leda ima mnogo pora i praznina ispunjenih vazduhom, ali to nije razlog koji može objasniti činjenicu da je led lakši od vode. Led i bez mikroskopskih pora
i dalje ima gustinu manju od gustine vode. Sve se svodi na karakteristike unutrašnje strukture leda. U kristalu leda, molekuli vode nalaze se na čvorovima kristalne rešetke tako da svaki ima četiri "susjeda".
Voda, s druge strane, nema kristalnu strukturu, a molekuli u tečnosti se nalaze bliže nego u kristalu, tj. voda je gušća od leda.
Prvo, kada se led topi, oslobođeni molekuli i dalje zadržavaju strukturu kristalne rešetke, a gustoća vode ostaje niska, ali postepeno se kristalna rešetka uništava, a gustoća vode se povećava.
Na temperaturi od + 4°C, gustoća vode dostiže maksimum, a zatim, s povećanjem temperature, počinje opadati zbog povećanja brzine toplinskog kretanja molekula.
Kako se lokva zamrzava?
Kada se ohladi, gornji slojevi vode postaju gušći i tonu prema dolje. Njihovo mjesto zauzima gušća voda. Takvo miješanje se događa sve dok temperatura vode ne padne na +4 stepena Celzijusa. Na ovoj temperaturi, gustina vode je maksimalna.
Daljnjim smanjenjem temperature gornji slojevi vode se već mogu još više skupiti, a postupno hladeći se na 0 stepeni, voda počinje da se smrzava.

U jesen je noćna i dnevna temperatura vazduha veoma različita, pa se led u slojevima smrzava.
Donja površina leda na lokvi koja se smrzava vrlo je slična poprečnom presjeku debla:
vidljivi su koncentrični prstenovi. Širina ledenih prstenova može se koristiti za procjenu vremena. Obično se lokva počinje smrzavati s rubova, jer. manja je dubina. Površina formiranih prstenova se smanjuje s približavanjem centru.
ZANIMLJIVO
Da se u cijevima podzemnog dijela zgrada voda često smrzava ne u mrazu, već u otopljenju!
To je zbog loše toplotne provodljivosti tla. Toplota prolazi kroz zemlju tako sporo da se minimalna temperatura u tlu javlja kasnije nego na površini zemlje. Što je dublje, to je kasnije. Često, tokom mrazeva, tlo nema vremena da se ohladi, a tek kada na tlu nastupi otapanje, mraz dopire do tla.
Da ga, smrzavajući se u začepljenoj boci, voda razbije. Šta se dešava sa čašom ako u njoj zamrznete vodu? Voda će se, smrzavajući, proširiti ne samo prema gore, već i sa strane, a staklo će se skupiti. Ovo će i dalje dovesti do uništenja stakla!
DA LI STE ZNALI
Poznat je slučaj kada se sadržaj boce narzana dobro ohlađen u zamrzivaču, otvoren vrelog ljetnog dana, momentalno pretvorio u komad leda.
Zanimljivo se ponaša metalno "liveno gvožđe", koje se tokom kristalizacije širi. To mu omogućava da se koristi kao materijal za umjetničko livenje tankih čipkastih rešetki i malih stolnih skulptura. Zaista, kada se učvršćuje, širi, lijevano željezo ispunjava sve, čak i najosjetljivije detalje forme.
Na Kubanu se zimi pripremaju jaka pića - "zamrzavaju". Da biste to učinili, vino se izlaže mrazu. Prije svega, voda se smrzava, a ostaje koncentrirana otopina alkohola. Isuši se i radnja se ponavlja dok se ne postigne željena čvrstoća. Što je veća koncentracija alkohola, to je niža tačka smrzavanja.
Najveća tuča koju su ljudi zabilježili pala je u Kanzasu, SAD. Njegova težina je bila skoro 700 grama.
Kiseonik u gasovitom stanju na temperaturi od minus 183 stepena C prelazi u tečnost, a na temperaturi od minus 218,6 stepeni C iz tečnosti se dobija čvrst kiseonik






