Osnovni termodinamički potencijali. Termodinamički potencijali
TERMODINAMIČKI POTENCIJALI- funkcije određenog termodinamičkog skupa. parametara, što vam omogućava da pronađete sve termodinamičke. karakteristike sistema u funkciji ovih parametara. Svi P. t. su međusobno povezani: za bilo koji od njih, uz pomoć diferencijacije s obzirom na njegove parametre, mogu se pronaći svi ostali potencijali.
Metodu P. t. razvio je J. W. Gibbs (J. W. Gibbs) 1874. godine i predstavlja osnovu svih termodinamika, uključujući teoriju višekomponentnih, višefaznih i heterogenih sistema, kao i termodinamiku. teorija fazni prelazi. Postojanje P. t. je posljedica 1. i 2. principa. Statistički fizika omogućava izračunavanje P. t. na osnovu koncepta strukture materije kao sistema veliki brojčestice u interakciji.
Unutrašnja energija
U(S, V, N) je P. t. u slučaju kada stanje sistema karakteriše entropija S, volumen V i broj čestica N, što je tipično za jednokomponentne izotropne tekućine i plinove. U pozvao takođe izohorno-adijabatski. potencijal. Puni diferencijal U jednako:
Ovdje su nezavisne varijable tri ekstenzivne (proporcionalne) V) vrijednosti 5, V, N, a zavisne su intenzivne (konačne u termodinamičkoj granici) veličine koje su s njim povezane - temperatura T, pritisak r i hemijski potencijal Od uslova da U je totalni diferencijal, iz toga slijedi da su zavisne varijable T, r, moraju biti parcijalni derivati od U:
Drugi derivat U po zapremini daje adijabatski koeficijent. elastičnost:
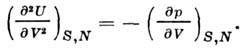
Toplotni kapacitet na DC volumen je
![]()
Međutim, ovo nije jedini mogući izbor nezavisnih varijabli koje određuju P. t. One se mogu odabrati pomoću četiri dekomp. načina, kada su jedan termički i dva mehanička nezavisni. vrijednosti: S, V, N; S, p, N; T, V, N; T, p, N. Da bismo jednu od nezavisnih varijabli zamijenili njenim konjugatom u ukupnom diferencijalu tipa (1), moramo izvršiti Legendre transformacija, tj. oduzeti proizvod dvije konjugirane varijable.
To. može se dobiti entalpija H(S, p, N) (Gibbsova termička funkcija, sadržaj topline, izohorni - izotermni potencijal sa nezavisnim varijablama S, p, N):
odakle to sledi
Znanje H omogućava vam da pronađete toplinski kapacitet na DC. pritisak
Besplatna energija
F(T,V,N)(Helmholcova energija, sadržaj toplote, izobarično-izotermni potencijal u varijablama T, V, N) se može dobiti korištenjem Legendreove transformacije varijabli S, V, N to T, V, N:
gdje
Drugi derivati F prema V p G dati toplinski kapacitet na DC. izotermni volumen. koeficijent pritisak
i izohorni koeficijent. pritisak
Posljednja relacija se zasniva na nezavisnosti druge mješovite derivacije P. t. od reda diferencijacije. Ista metoda se može koristiti za pronalaženje razlike između i :
i odnos između adijabatskih. i izotermni koeficijent kompresija:
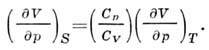
Gibbsova energija (izobarni - izotermni potencijal u varijablama T, p, N) povezan je Legendreovom transformacijom sa P. t. U, H, Ž:
gdje
Proporcionalnost G broj čestica čini ga vrlo pogodnim za primjenu, posebno u teoriji fazni prelazi. Drugi derivati G dati toplotni kapacitet na post. pritisak
![]()
i izotermni koeficijent kompresija
Iz jednačina (3), (5), (6), (8) slijedi da je P. t. U, H, F, G povezan :
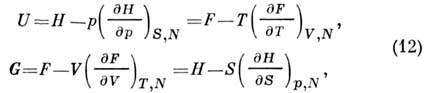
to-rye se koristi za izgradnju sekcije. P. t. prema ex-perim. termalni podaci. i kalorija. ur-niyah država. Granični uslovi neophodni za to su dati prelaskom do granice do idealnog gasa i Nernstova teorema, što to utvrđuje S=0 u granicama T Oh i tako U=F i G - H.
Za nezatvorene sisteme, za koje N nije fiksno, zgodno je odabrati P. t. u varijablama T, V, koji nije dobio poseban naziv i obično se označava ![]()
Njegov totalni diferencijal
Svi P. t. povezani su s raznim Gibbsove distribucije. P. t.
povezan sa velikim kanonom. Gibbsova distribucija prema odnosu
gdje - statistički integral preko faznih varijabli i sume preko N u slučaju klasike mehanika ili particiona funkcija on kvantna stanja. P. t. F(T, V, N) je povezan sa kanonskim Gibbs ansambl:
gdje je statistika. integralni u klasici slučaj i statistički količina u kvantu. P. t. H povezan sa izobarično-izotermnim. ansambl Gibbs, koji je predložio S. A. Boguslavsky (1922). P. t. / 7 je povezan s mikrokanonskim. Gibbsova distribucija putem entropije:
gdje Ž(U, V, N) - statistika. težina, to-ry je faktor normalizacije za mikrokanonsku. Gibbsova distribucija. Ukupna entropijska razlika je
što je ekvivalentno jednačini (1).
Statistički integrali ili statistike. sume se u principu mogu izračunati na osnovu Hamiltonove f-cije u klasičnom. slučaj ili Hamiltonov operator u kvantnom slučaju za sistem velikog broja čestica u interakciji i tako dalje. izračunati P. t. statističkim metodama. mehanika.
Pored navedenih P. t. koriste se i drugi npr. Massieux funkcije - F(T, V, N) IT, Planckove funkcije - ![]() U opštem slučaju, kada se sistem sa datom entropijom opisuje termodinamikom parametri i njihovi povezani termodinamički parametri. snage
U opštem slučaju, kada se sistem sa datom entropijom opisuje termodinamikom parametri i njihovi povezani termodinamički parametri. snage ![]()

i slično za sisteme sa fiksnim energije.
Za polarizabilne medije, P. t. ovisi o električnim vektorima. i magn. indukcija D
i AT
. Metoda P. t. omogućava vam da pronađete tenzore električnog. i magn. propusnost. U izotropnom slučaju, dielektrik propusnost se određuje iz jednačina

Upotreba P. t. metode je posebno efikasna u slučaju kada postoje veze između parametara, na primjer. proučavati termodinamičke uslove. ravnoteža heterogenog sistema koji se sastoji od susednih faza i dekomp. komponenta. U ovom slučaju, ako je moguće zanemariti eksterno sile i površinske pojave, up. energija svake faze je ![]() gdje je broj čestica komponente i u fazi k. Dakle, za svaku od faza
gdje je broj čestica komponente i u fazi k. Dakle, za svaku od faza
(- hemijski potencijal komponente i u fazi k). P. t. U je minimalan pod uslovom da ukupan broj čestica svake komponente, ukupna entropija i zapremina svake faze ostanu konstantni.
Metoda P. t. vam omogućava da istražite stabilnost termodinamike. ravnoteža sistema s obzirom na male varijacije njegove termodinamike. parametri. Ravnotežu karakteriše maks. vrijednost entropije ili minimum njenog P. t. (unutrašnja energija, entalpija, slobodna energija, Gibbsova energija), koja odgovara nezavisnim termodinamičkim eksperimentalnim uvjetima. varijable.
Dakle, sa nezavisnim S, V, N za ravnotežu, neophodno je da postoji minimalni int. energije, tj. sa malim varijacijama i sa konstantnošću S, V, N. Dakle, kao neophodan uslov za ravnotežu, konstantnost pritiska i temperature svih faza i jednakost hemikalije. potencijali koegzistirajućih faza. Međutim, za termodinamiku održivost nije dovoljna. Iz uslova minimalnosti P. t. slijedi pozitivnost druge varijacije: > 0. Ovo dovodi do uslova termodinamike. održivost, npr. do smanjenja pritiska sa povećanjem zapremine i pozitivnog toplotnog kapaciteta na DC. volumen. Metoda P. t. omogućava postavljanje za višefazne i višekomponentne sisteme Gibbsovo fazno pravilo, prema kojem broj faza koje koegzistiraju u ravnoteži ne prelazi broj nezavisnih komponenti za više od dvije. Ovo pravilo proizilazi iz činjenice da broj nezavisnih parametara ne može biti veći od broja jednačina za njihovo određivanje u faznoj ravnoteži.
Za izgradnju termodinamike teorije, koje bi uzele u obzir površinske pojave, u varijacijama P. t. treba uzeti u obzir članove proporcionalne varijacijama površine kontaktnih faza. Ovi termini su proporcionalni površinski napon s, što ima smisla varijacije. derivat bilo kojeg od P. t. u odnosu na površinu.
P. metoda je također primjenjiva na kontinuirane prostorno nehomogene medije. U ovom slučaju, P. t. su termodinamički funkcionalni. varijabilne i termodinamičke. jednakosti imaju oblik jednačina u funkcionalnim derivatima.
Lit.: Vaals I.D. you der, Konstamm F., Kurs termostatike, dio 1. Opći termostat, trans. iz njemačkog, M., 1936; Munster A., Hemijska termodinamika, trans. iz njemačkog, M., 1971; Gibbs J. B., Termodinamika. Statistička mehanika, trans. sa engleskog, M., 1982; Novikov I.I., Termodinamika, M., 1984. D. N. Zubarev.
Svi proračuni u termodinamici temelje se na korištenju funkcija stanja koje se nazivaju termodinamički potencijali. Svaki skup nezavisnih parametara ima svoj termodinamički potencijal. Promjene potencijala koje se javljaju tokom bilo kojeg procesa određuju ili rad sistole ili toplinu koju sistem prima.
Kada razmatramo termodinamičke potencijale, koristićemo relaciju (103.22), prikazujući je u obliku
Znak jednakosti se odnosi na reverzibilne procese, znak nejednakosti - na nereverzibilne procese.
Termodinamički potencijali su funkcije stanja. Stoga je prirast bilo kojeg od potencijala jednak ukupnom diferencijalu funkcije kojom je izražen. Ukupni diferencijal funkcije varijabli i y određen je izrazom
![]()
Dakle, ako u toku transformacija dobijemo izraz oblika za prirast određene vrijednosti
može se tvrditi da je ova veličina funkcija parametara , a funkcije su parcijalni derivati funkcije
Unutrašnja energija. Već smo upoznati sa jednim od termodinamičkih potencijala. Ovo je unutrašnja energija sistema. Prvi zakonski izraz za reverzibilni proces može se predstaviti kao
![]() (109.4)
(109.4)
Poređenje sa (109.2) pokazuje da varijable S i V djeluju kao takozvane prirodne varijable za potencijal V. Iz (109.3) slijedi da
![]()
Iz relacije sledi da u slučaju - kada telo ne razmenjuje toplotu sa spoljašnje okruženje, rad koji je obavio jednak je
![]()
ili u integralnom obliku:
Dakle, u nedostatku razmjene topline sa vanjskim okruženjem, rad je jednak smanjenju unutrašnje energije tijela.
Dakle, - toplotni kapacitet pri konstantnoj zapremini je jednak
![]() (109.8)
(109.8)
Besplatna energija. Prema (109.4), rad proizveden toplotom sa reverzibilnim izotermni proces, može se predstaviti kao
Državna funkcija
![]() (109.10)
(109.10)
zove se slobodna energija tela.
U skladu sa formulama "(109.9) i (109.10) u reverzibilnom izotermnom procesu, rad je jednak smanjenju slobodne energije tijela:
![]()
Poređenje sa formulom (109.6) pokazuje da u izotermnim procesima slobodna energija igra istu ulogu kao i unutrašnja energija u adijabatskim procesima.
Imajte na umu da formula (109.6) vrijedi i za reverzibilne i za ireverzibilne procese. Formula (109.12) vrijedi samo za reverzibilne procese. Sa ireverzibilnim procesima (vidi). Zamjenom ove nejednakosti u relaciju, lako je dobiti da za ireverzibilne izotermne procese
Dakle, gubitak slobodne energije određuje gornju granicu količine rada koji sistem može obaviti u izotermnom procesu.
Uzmimo diferencijal funkcije (109.10). Uzimajući u obzir (109.4) dobijamo:
Iz poređenja sa (109.2) zaključujemo da su prirodne varijable za slobodnu energiju T i V. U skladu sa (109.3)
Zamenimo: u (109.1) dQ kroz i podelimo rezultujuću relaciju sa ( - vremenom). Kao rezultat, dobijamo
![]()
Ako temperatura i zapremina ostanu konstantni, tada se relacija (109.16) može pretvoriti u oblik
Iz ove formule slijedi da je nepovratan proces koji se odvija pri konstantnoj temperaturi i volumenu praćen smanjenjem slobodne energije tijela. Kada se postigne ravnoteža, F prestaje da se menja tokom vremena. Na ovaj način; pri konstantama T i V, stanje ravnoteže je stanje za koje je slobodna energija minimalna.
Entalpija. Ako se proces „događa pri konstantnom pritisku, tada se količina toplote koju tijelo primi može predstaviti na sljedeći način:
Državna funkcija
![]()
nazvana entalpija ili toplotna funkcija.
Iz (109.18) i (109.19) proizilazi da je količina toplote koju tijelo primi tokom izobatskog procesa jednaka
ili u integralnom obliku
![]()
Dakle, u slučaju kada pritisak ostane konstantan, količina toplote koju primi tijelo jednaka je prirastu entalpije. Diferenciranje izraza (109.19) s obzirom na (109.4) daje
Odavde zaključujemo. entalpija je termodinamički potencijal u varijablama.Njegovi parcijalni derivati su
![]()
Ako temperatura i pritisak ostanu konstantni, relacija (109.16) se može zapisati kao:
Iz ove formule slijedi da je ireverzibilni proces koji se odvija pri konstantnoj temperaturi i pritisku praćen smanjenjem termodinamičkog Gibbsovog potencijala. Kada se postigne ravnoteža, G prestaje da se menja tokom vremena. Dakle, pri konstanti T i ravnotežnom stanju je stanje za koje je termodinamički Gibbsov potencijal minimalan (usp. (109.17)).
U tabeli. 109.1 prikazuje osnovna svojstva termodinamičkih potencijala.
Tabela 109.1

Predavanje na temu: “Termodinamički potencijali”
1. Grupa potencijala “E F G H” koja ima dimenziju energije.
2. Ovisnost termodinamičkih potencijala o broju čestica. Entropija kao termodinamički potencijal.
3. Termodinamički potencijali višekomponentnih sistema.
4. Praktična implementacija metode termodinamičkih potencijala (na primjeru problema hemijske ravnoteže).
Jedna od glavnih metoda moderne termodinamike je metoda termodinamičkih potencijala. Ova metoda je nastala najvećim dijelom zahvaljujući korištenju potencijala u klasičnoj mehanici, gdje je njegova promjena bila povezana s obavljenim radom, a sam potencijal je energetska karakteristika termodinamičkog sistema. Istorijski gledano, prvobitno uvedeni termodinamički potencijali imali su i dimenziju energije, što je odredilo njihov naziv.
U pomenutu grupu spadaju sledeći sistemi:
Unutrašnja energija;
Slobodna energija ili Helmholtzov potencijal;
Gibbsov termodinamički potencijal;
Entalpija.
Potencijal unutrašnje energije je prikazan u prethodnoj temi. To implicira potencijalnost preostalih količina.
Diferencijali termodinamičkih potencijala imaju oblik:
Iz relacija (3.1) može se vidjeti da odgovarajući termodinamički potencijali karakteriziraju isti termodinamički sistem različitim metodama.... opisi (metode postavljanja stanja termodinamičkog sistema). Dakle, adijabatski izolovani sistem, opisano u varijablama, zgodno je koristiti unutrašnju energiju kao termodinamički potencijal.Tada se parametri sistema, termodinamički konjugirani sa potencijalima, određuju iz relacija:
Ako se "sistem u termostatu" dat varijablama koristi kao metoda opisa, najpogodnije je koristiti slobodnu energiju kao potencijal. Shodno tome, za sistemske parametre dobijamo:
Zatim ćemo odabrati model „sistema ispod klipa“ kao način njegovog opisivanja. U tim slučajevima funkcije stanja formiraju skup (), a kao termodinamički potencijal koristi se Gibbsov potencijal G. Tada se parametri sistema određuju iz izraza:
A u slučaju "adijabatskog sistema preko klipa", dato funkcijama stanje, ulogu termodinamičkog potencijala igra entalpija H. Tada parametri sistema imaju oblik:
Pošto relacije (3.1) definiraju kompletni diferencijali termodinamičkih potencijala, možemo izjednačiti njihove druge derivate.
Na primjer, s obzirom na to
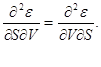
dobijamo
Slično, za preostale parametre sistema koji se odnose na termodinamički potencijal pišemo:
Slični identiteti se mogu napisati i za druge skupove parametara termodinamičkog stanja sistema na osnovu potencijalnosti odgovarajućih termodinamičkih funkcija.
Dakle, za “sistem u termostatu” sa potencijalom imamo:
Za sistem „iznad klipa“ sa Gibsovim potencijalom važiće jednakosti:
I, konačno, za sistem sa adijabatskim klipom sa potencijalom H, dobijamo:
Jednakosti oblika (3.6) - (3.9) nazivaju se termodinamički identiteti i u nizu slučajeva se pokazuju pogodnim za praktične proračune.
Upotreba termodinamičkih potencijala olakšava određivanje rada sistema i termičkog efekta.
Dakle, relacije (3.1) impliciraju:
Iz prvog dijela jednakosti slijedi poznati stav da se rad toplinski izoliranog sistema () odvija zbog smanjenja njegove unutrašnje energije. Druga jednakost znači da je slobodna energija onaj dio unutrašnje energije, koji se u izotermnom procesu u potpunosti pretvara u rad (odnosno, "preostali" dio unutrašnje energije se ponekad naziva vezanom energijom).
Količina toplote se može predstaviti kao:
Iz posljednje jednakosti jasno je zašto se entalpija naziva i sadržajem topline. Pri gorenju i dr hemijske reakcije nastaje pri konstantnom pritisku (), količina oslobođene topline jednaka je promjeni entalpije.
Izraz (3.11), uzimajući u obzir drugi zakon termodinamike (2.7), omogućava nam da odredimo toplotni kapacitet:
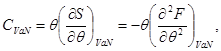

Svi termodinamički potencijali energetskog tipa imaju svojstvo aditivnosti. Stoga možemo napisati:
Lako je vidjeti da Gibbsov potencijal sadrži samo jedan aditivni parametar, tj. Gibbsov specifični potencijal ne zavisi od. Tada iz (3.4) slijedi:
To jest, hemijski potencijal je specifičan Gibbsov potencijal, a jednakost se dešava
Termodinamički potencijali (3.1) su međusobno povezani direktnim odnosima, koji omogućavaju prijelaz s jednog potencijala na drugi. Na primjer, izrazimo sve termodinamičke potencijale u terminima unutrašnje energije.
Pritom smo dobili sve termodinamičke potencijale kao funkcije od (). Da biste ih izrazili u drugim varijablama, koristite proceduru re….
Neka je pritisak dat u varijablama ():
Zapišimo zadnji izraz kao jednačinu stanja, tj. pronađite obrazac
Lako je vidjeti da ako je stanje dato u varijablama (), onda je termodinamički potencijal unutrašnja energija. Na osnovu (3.2) nalazimo
Uzimajući u obzir (3.18) kao jednačinu za S, nalazimo njeno rješenje:
Zamjenom (3.19) u (3.17) dobijamo
Odnosno, sa varijabli () smo prešli na varijable ().
Druga grupa termodinamičkih potencijala nastaje ako se, pored prethodno razmotrenih, kao termodinamičke varijable uključi i hemijski potencijal. Potencijali druge grupe takođe imaju dimenziju energije i mogu se povezati sa potencijalima prve grupe relacijama:
Prema tome, potencijalni diferencijali (3.21) imaju oblik:
Kao i za termodinamičke potencijale prve grupe, za potencijale (3.21) se mogu konstruisati termodinamički identiteti, naći izrazi za parametre termodinamičkog sistema itd.
Razmotrimo karakteristične relacije za “omega potencijal”, koji izražava kvazi-slobodnu energiju i koji se u praksi najčešće koristi među ostalim potencijalima grupe (3.22).
Potencijal je dat u varijablama () koje opisuju termodinamički sistem sa zamišljenim zidovima. Sistemski parametri u ovom slučaju određeni su iz relacija:
Termodinamički identiteti koji slijede iz potencijalnosti imaju oblik:
Zanimljiva su aditivna svojstva termodinamičkih potencijala druge grupe. Pošto u ovom slučaju broj čestica nije među parametrima sistema, zapremina se koristi kao aditivni parametar. Tada za potencijal dobijamo:
Ovdje - specifični potencijal po 1. Uzimajući u obzir (3.23), dobijamo:
Prema tome, (3.26)
Validnost (3.26) se takođe može dokazati na osnovu (3.15):
Potencijal se također može koristiti za pretvaranje termodinamičkih funkcija zapisanih u obliku u formu. Za ovo, relacija (3.23) za N:
dozvoljeno u pogledu:
Ne samo energetske karakteristike sistema, već i sve druge veličine uključene u relaciju (3.1) mogu djelovati kao termodinamički potencijali. Kao važan primjer, razmotrite entropiju kao termodinamički potencijal. Početna diferencijalna relacija za entropiju slijedi iz generalizirane notacije I i II principa termodinamike:
Dakle, entropija je termodinamički potencijal za sistem dat parametrima. Ostali sistemski parametri izgledaju ovako:
Rješavanjem prve od relacija (3.28), prijelaz s varijabli na varijable je relativno moguć.
Aditivna svojstva entropije dovode do poznatih relacija:
Pređimo na određivanje termodinamičkih potencijala na osnovu zadatih makroskopskih stanja termodinamičkog sistema. Da bismo pojednostavili proračune, pretpostavljamo odsustvo vanjskih polja (). Ovo ne smanjuje općenitost rezultata, budući da se dodatni sistemi jednostavno pojavljuju u rezultirajućim izrazima za .
Kao primjer, pronađimo izraze za slobodnu energiju, koristeći jednačinu stanja, kaloričnu jednačinu stanja i ponašanje sistema pri kao početne. Uzimajući u obzir (3.3) i (3.12), nalazimo:
Integrirajmo drugu jednačinu sistema (3.30) uzimajući u obzir granični uvjet na:
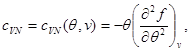
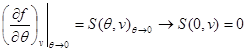

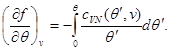
Tada sistem (3.30) poprima oblik:
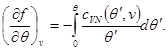
Rješenje sistema (3.31) omogućava pronalaženje specifične slobodne energije u obliku
Porijeklo specifične slobodne energije može se naći i iz uslova na:
Tada (3.32) poprima oblik:
a izraz za cjelokupnu slobodnu energiju sistema, do aditivne konstante, ima oblik:
Tada je reakcija sistema na uključivanje eksternog polja data dodatnom jednadžbom stanja, koja u zavisnosti od skupa varijabli stanja ima oblik:
Tada se promjena odgovarajućeg termodinamičkog potencijala povezana s uključivanjem nule od nule do određuje iz izraza:
Dakle, postavljanje termodinamičkog potencijala u makroskopskoj teoriji moguće je samo na osnovu korištenja date jednačine termodinamička stanja, koja se, pak, i sama dobijaju na osnovu postavljanja termodinamičkih potencijala. Prekini ovo" začarani krug” moguće je samo na osnovu mikroskopske teorije, u kojoj je stanje sistema dato na osnovu funkcija distribucije, uzimajući u obzir statističke karakteristike.
Uopštimo dobijene rezultate na slučaj višekomponentnih sistema. Ova generalizacija se provodi zamjenom parametra skupom. Pogledajmo konkretne primjere.
Pretpostavimo to termodinamičko stanje sistem je zadan parametrima, tj. razmatramo sistem u termostatu, koji se sastoji od nekoliko komponenti, broj čestica u kojima je jednak Slobodna energija, koja je u ovom opisu termodinamički potencijal, ima oblik:
Aditivni parametar u (3.37) nije broj čestica, već zapremina sistema V. Tada se gustina sistema označava sa . Funkcija je neaditivna funkcija neaditivnih argumenata. Ovo je prilično zgodno, jer kada je sistem podijeljen na dijelove, funkcija se ne mijenja za svaki dio.
Zatim, za parametre termodinamičkog sistema možemo napisati:
S obzirom da imamo
Za hemijski potencijal pojedine komponente pišemo:
Postoje i drugi načini da se uzmu u obzir aditivna svojstva slobodne energije. Hajde da uvedemo relativne gustine broja čestica svake od komponenti:

nezavisno od zapremine sistema V. Ovde - ukupan brojčestice u sistemu. Onda
Izraz za hemijski potencijal u ovom slučaju ima složeniji oblik:
Izračunajte derivate od i i zamijenite ih u posljednji izraz:
Izraz za pritisak će, naprotiv, biti pojednostavljen:
Slične relacije se mogu dobiti i za Gibbsov potencijal. Dakle, ako je volumen zadan kao aditivni parametar, tada, uzimajući u obzir (3.37) i (3.38), pišemo:
isti izraz se može dobiti iz (3.yu), koji u slučaju mnogih čestica ima oblik:
Zamjenom izraza (3.39) u (3.45) nalazimo:
što se potpuno poklapa sa (3.44).
Da bi se prešlo na tradicionalno Gibbsovo snimanje potencijala (preko varijabli stanja ()) potrebno je riješiti jednačinu (3.38):
Što se tiče volumena V i zamijenimo rezultat u (3.44) ili (3.45):
Ako je ukupan broj čestica u sistemu N dat kao aditivni parametar, tada Gibbsov potencijal, uzimajući u obzir (3.42), poprima sljedeći oblik:
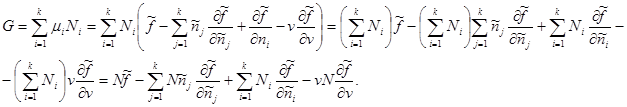
Znajući vrstu specifičnih vrijednosti: , dobijamo:
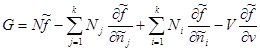
U posljednjem izrazu, sumiranje je završeno j zamijeniti zbrajanjem preko i. Tada drugi i treći član zbirom daju nulu. Tada za Gibbsov potencijal konačno dobijamo:
Ista relacija se može dobiti i na drugi način (iz (3.41) i (3.43)):
Tada za hemijski potencijal svake od komponenti dobijamo:
U derivaciji (3.48), transformacije slične onima korištenim u derivaciji (3.42) izvedene su korištenjem imaginarnih zidova. Parametri stanja sistema čine skup ().
Ulogu termodinamičkog potencijala igra potencijal koji ima oblik:
Kao što se vidi iz (3.49), jedini aditivni parametar u ovom slučaju je zapremina sistema V.
Odredimo neke termodinamičke parametre takvog sistema. Broj čestica u ovom slučaju određuje se iz relacije:
Za besplatnu energiju F i Gibbsov potencijal G može se napisati:
Dakle, relacije za termodinamičke potencijale i parametre u slučaju višekomponentnih sistema su modifikovane samo zbog potrebe da se uzme u obzir broj čestica (ili hemijskih potencijala) svake komponente. U isto vrijeme, sama ideja metode termodinamičkih potencijala i proračuna na temelju nje ostaje nepromijenjena.
Kao primjer korištenja metode termodinamičkih potencijala, razmotrimo problem kemijske ravnoteže. Nađimo uslove hemijske ravnoteže u mešavini tri supstance koje ulaze u reakciju. Uz to, pretpostavljamo da su početni produkti reakcije razrijeđeni plinovi (ovo nam omogućava da zanemarimo međumolekularnu međusobnu proizvodnju), a sistem održava konstantna temperatura i pritisak, (ovakav proces je najlakše implementirati u praksi, pa se u industrijskim postrojenjima za hemijsku reakciju stvara uslov konstantnosti pritiska i temperature).
Uslov ravnoteže termodinamičkog sistema, u zavisnosti od načina na koji je opisan, određen je maksimalnom entropijom sistema ili minimalnom energijom sistema (za više detalja, videti Termodinamiku Bazarova). Tada možemo dobiti sledeće uslove ravnoteže za sistem:
1. Stanje ravnoteže adijabatski izolovanog termodinamičkog sistema, dato parametrima (), karakteriše entropijski maksimum:
Drugi izraz u (3.53a) karakterizira stabilnost ravnotežnog stanja.
2. Stanje ravnoteže izohorno-izotermnog sistema, dato parametrima (), karakteriše minimum slobodne energije. Uslov ravnoteže u ovom slučaju ima oblik:
3. Ravnotežu izobarično-izotermnog sistema, datu parametrima (), karakterišu uslovi:
4. Za sistem u termostatu sa promenljivim brojem čestica, definisanim parametrima (), ravnotežni uslovi karakterišu potencijalni minimumi:
Okrenimo se upotrebi hemijske ravnoteže u našem slučaju.
U opštem slučaju, jednačina hemijske reakcije se piše kao:
Evo simbola hemijske supstance, - takozvani stehiometrijski brojevi. Dakle za reakciju
Pošto su pritisak i temperatura izabrani kao parametri sistema za koje se pretpostavlja da su konstantni. Zgodno je Gibbsov potencijal smatrati stanjem termodinamičkog potencijala G. Tada će se uvjet ravnoteže za sistem sastojati u zahtjevu za konstantnost potencijala G:
Pošto razmatramo trokomponentni sistem, postavili smo Osim toga, uzimajući u obzir (3.54), možemo napisati jednadžbu ravnoteže za broj čestica ():
Uvodeći hemijske potencijale za svaku od komponenti: i uzimajući u obzir date pretpostavke, nalazimo:
Jednačinu (3.57) prvi je dobio Gibbs 1876. godine. i je željena jednačina hemijske ravnoteže. Lako je vidjeti, upoređujući (3.57) i (3.54), da se jednačina hemijske ravnoteže dobija iz jednačine hemijske reakcije jednostavnom zamjenom simbola supstanci koje reaguju njihovim hemijskim potencijalima. Ova tehnika se također može koristiti kada se piše jednadžba kemijske ravnoteže za proizvoljnu reakciju.
U opštem slučaju, rješenje jednačine (3.57), čak i za tri komponente, je dovoljno opterećeno. To je prije svega zbog činjenice da je vrlo teško dobiti eksplicitne izraze za hemijski potencijal čak i za jednokomponentni sistem. Drugo, relativne koncentracije i nisu male količine. To jest, nemoguće je izvršiti proširenje serije na njima. Ovo dodatno komplikuje problem rješavanja jednadžbe kemijske ravnoteže.
Fizički uočene poteškoće se objašnjavaju potrebom da se uzme u obzir restrukturiranje elektronske školjke atoma koji reaguju. To dovodi do određenih poteškoća u mikroskopskom opisu, što utječe i na makroskopski pristup.
Pošto smo se dogovorili da se ograničimo na proučavanje razrjeđivanja plina, možemo koristiti model idealan gas. Pretpostavljamo da su sve komponente koje reaguju idealni gasovi koji ispunjavaju ukupnu zapreminu i stvaraju pritisak str. U ovom slučaju, svaka interakcija (osim hemijskih reakcija) između komponenti gasne mešavine može se zanemariti. To nam omogućava da pretpostavimo da je hemijski potencijal i-ta komponenta zavisi samo od parametara iste komponente.
ovdje - parcijalni pritisak i-ta komponenta, i:
Uzimajući u obzir (3.58), uslov ravnoteže za trokomponentni sistem (3.57) ima oblik:
Za dalju analizu koristimo jednadžbu stanja idealnog gasa, koju zapisujemo u obliku:
Ovdje, kao i prije, označavamo termodinamičku temperaturu. Tada zapis poznat iz škole ima oblik: , što je zapisano u (3.60).
Tada za svaku komponentu smjese dobijamo:
Odredimo oblik izraza za hemijski potencijal idealnog gasa. Kao što slijedi iz (2.22), hemijski potencijal ima oblik:
Uzimajući u obzir jednačinu (3.60), koja se može zapisati u obliku, problem određivanja hemijskog potencijala se svodi na određivanje specifične entropije i specifične unutrašnje energije.
Sistem jednadžbi za specifičnu entropiju slijedi iz termodinamičkih identiteta (3.8) i izraza toplinskog kapaciteta (3.12):
Uzimajući u obzir jednadžbu stanja (3.60) i prelazeći na specifične karakteristike, imamo:
Rješenje (3.63) ima oblik:
Sistem jednadžbi za specifičnu unutrašnju energiju idealnog gasa sledi iz (2.23):
Rješenje ovog sistema se može napisati kao:
Zamjenom (3.64) - (3.65) u (3.66) i uzimajući u obzir jednadžbu stanja idealnog plina, dobivamo:
Za mješavinu idealnih plinova, izraz (3.66) ima oblik:
Zamjenom (3.67) u (3.59) dobivamo:
Izvodeći transformacije, pišemo:

Izvodeći potenciranje u posljednjem izrazu, imamo:
Relacija (3.68) se naziva zakonom akcije mase. Vrijednost je funkcija samo temperature i naziva se komponentom kemijske reakcije.
Dakle, hemijska ravnoteža i pravac hemijske reakcije su određeni veličinom pritiska i temperature.
Termodinamički potencijali, Schuka, str.36
Termodinamički potencijali, Schuka, str.36
Za izolovane sisteme, ovaj odnos je ekvivalentan klasičnoj formulaciji da entropija nikada ne može da se smanji. Ovaj zaključak je izveo nobelovac I. R. Prigozhy, analizirajući otvoreni sistemi. Takođe je unapredio princip da neravnoteža može poslužiti kao izvor reda.
Treći početak termodinamika opisuje stanje sistema blizu apsolutne nule. U skladu sa trećim zakonom termodinamike, on postavlja referentnu tačku entropije i fiksira je za bilo koji sistem. At T 0 nestaje koeficijent toplinskog širenja, toplinski kapacitet bilo kojeg procesa. Ovo nam omogućava da zaključimo da kada apsolutna nula temperature, svaka promjena stanja se dešava bez promjene entropije. Ova izjava se zove teorema nobelovca V. G. Nernsta, ili treći zakon termodinamike.
Treći zakon termodinamike kaže :
apsolutna nula je u osnovi nedostižna jer at T = 0 i S = 0.
Kad bi postojalo tijelo s temperaturom jednakom nuli, tada bi bilo moguće izgraditi vječni motor druge vrste, što je u suprotnosti s drugim zakonom termodinamike.
Modifikacija trećeg zakona termodinamike radi izračunavanja hemijske ravnoteže u sistemu koju je na ovaj način formulisao nobelovac M. Planck.
Plankov postulat : na temperaturi apsolutne nule, entropija poprima vrijednost S 0 , nezavisno od pritiska, stanja agregacije i drugih karakteristika supstance. Ova vrijednost se može postaviti na nulu, iliS 0 = 0.
Prema statističkoj teoriji, vrijednost entropije se izražava kao S = ln, gdje je je Boltzmannova konstanta, – statistička težina, odnosno termodinamička vjerovatnoća makrostanja. Naziva se i -potencijalom. Pod statističkom težinom podrazumevamo broj mikrostanja uz pomoć kojih se realizuje dato makrostanje. Entropija idealnog kristala pri T = 0 K, podložno = 1, ili u slučaju kada se makrostanje može realizovati jednim mikrostanjem, jednako je nuli. U svim ostalim slučajevima, vrijednost entropije na apsolutnoj nuli mora biti veća od nule.
3.3. Termodinamički potencijali
Termodinamički potencijali su funkcije određenih skupova termodinamičkih parametara, što vam omogućava da pronađete sve termodinamičke karakteristike sistema kao funkciju tih istih parametara.
Termodinamički potencijali u potpunosti određuju termodinamičko stanje sistema, a bilo koji sistemski parametri mogu se izračunati diferencijacijom i integracijom.
Glavni termodinamički potencijali uključuju sljedeće funkcije .
1. Unutrašnja energija U, što je funkcija nezavisnih varijabli:
entropija S,
volumen V,
broj čestica N,
generalizovane koordinate x i
ili U = U(S, V, N, x i).
2. Helmholtzova slobodna energija F je funkcija temperature T, volumen V, broj čestica N, generalizirana koordinata x i tako F = F(T, V, N, x t).
3. Gibbsov termodinamički potencijal G = G(T, str, N, x i).
4. Entalpija H =H(S, P, N, x i).
5. Termodinamički potencijal , za koji su nezavisne varijable temperatura T, volumen V, hemijski potencijal x, = (T, V, N, x i).
Postoje klasični odnosi između termodinamičkih potencijala:
U = F + TS = H – PV,
F = U – TS = H – TS – PV,
H = U + PV = F + TS + PV,
G = U – TS + PV = F + PV = H – TS,
= U – TS – V = F – N = H – TS – N, (3.12)
U = G + TS – PV = + TS + N,
F = G – PV = + N,
H = G + TS = + TS + N,
G = + PV + N,
= G – PV – N.
Postojanje termodinamičkih potencijala posledica su prvog i drugog zakona termodinamike i pokazuju da unutrašnja energija sistema U zavisi samo od stanja sistema. Unutrašnja energija sistema zavisi od punog skupa makroskopskih parametara, ali ne zavisi od načina na koji se to stanje postiže. Unutrašnju energiju zapisujemo u diferencijalnom obliku
dU = TdS– PdV– X i dx i + dN,
T = ( U/ S) V, N, x= const ,
P = –( U/ V) S, N, x= const ,
= ( U/ N) S, N, x= const .
Slično se može pisati
dF = – SdT–PdV – X t dx t + dN,
dH= TdS+VdP– X t dx t + dN,
dG= – SdT+VdP – X i dx i + dN,
d = – SdT–PdV – X t dx t – Ndn,
S = – ( F/ T) V ; P = –( F/ V) T ; T = ( U/ S) V ; V = ( U/ P) T ;
S = – ( G/ T) P ; V = ( G/ P) S ; T = ( H/ S;); P = – ( U/ V) S
S = – ( F/ T); N = – ( F/); = ( F/ N); X = – ( U/ x).
Ove jednačine vrijede za ravnotežne procese. Obratimo pažnju na termodinamički izobarično-izotermni potencijal G, pozvao Gibbsova besplatna energija,
G = U – TS + PV = H –TS, (3.13)
i izohorno-izotermni potencijal
F = U – TS, (3.14)
koja se zove Helmholtzova slobodna energija.
U hemijskim reakcijama koje se odvijaju pri konstantnom pritisku i temperaturi,
G = U – TS + PV = N, (3.15)
gdje je hemijski potencijal.
Pod hemijskim potencijalom neke komponente sistema i razumjet ćemo parcijalni izvod bilo kojeg termodinamičkog potencijala u odnosu na količinu ove komponente pri konstantnim vrijednostima ostalih termodinamičkih varijabli.
Hemijski potencijal također se može definirati kao veličina koja određuje promjenu energije sistema kada se doda jedna čestica supstance, npr.
i = ( U/ N) S , V= trošak , ili G = i N i .
Iz posljednje jednačine slijedi da je = G/ N i , odnosno je Gibbsova energija po čestici. Hemijski potencijal se mjeri u J/mol.
Omega potencijal se izražava kroz veliku particionu funkciju Z kako
= – T ln Z, (3.16)
Gdje je [sumiranje završeno N i k(N)]:
Z= exp[( N – E k (N))/T].






