Primjeri su površinski fenomeni. Pogledajte šta su "površinski fenomeni" u drugim rječnicima
POVRŠINSKI FENOMENI
POVRŠINSKI FENOMENI
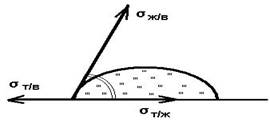
Fenomeni uzrokovani ekscesom slobodna energija u graničnom sloju - površinska energija, povećana aktivnost i orijentacija molekula površinskog sloja, karakteristike njegove strukture i sastava. P. i. određuju se i činjenicom da hem. i fizički efekti tijela se javljaju prvenstveno u površinskim slojevima. Main P. i. povezano sa smanjenjem površinske energije proporcionalno površini. Dakle, formiranje ravnotežnih oblika tečnih kapi ili mehurića gasa, kao i kristala tokom njihovog rasta, određeno je minimalnom slobodnom energijom na DC. volumen. P. I., koji nastaje kombinovanim djelovanjem molekularnih sila ( površinski napon i vlaženje) i ekst. sile (gravitacije) i izazivaju zakrivljenost sučelja tečnosti, tzv. kapilarni događaji.
P. i. u tv. tijela odvijaju prvenstveno na vanjskim. površine tijela. Tu spadaju: adhezija (kohezija), (adhezija), trenje. Iz uslova minimalne slobodne površinske energije kristala, na dekomp. lica čija je napetost različita, matematički se izvode svi mogući oblici kristala. poliedri proučavani u geom. kristalografija.
P. i. odvijaju iznutra. površine koje se razvijaju na osnovu kristalnih defekata. rešetke. Svako uništavanje TV-a. tijelo, povezano sa savladavanjem svoje snage, u suštini je P. I., budući da se izražava u formiranju novog interfejsa. Formiranje i razvoj jezgara nove faze u prvobitno homogenom mediju koji se nalazi u metastabilno stanje, utvrđuje i P. I. (s tim u vezi je povećanje rastvorljivosti malih kapi i kristala i povećanje pritiska iznad njih zasićena para; (vidi KELVINOVA JEDNAČINA)).
Sredstva. grupa P. I. predstavljaju adsorpcione pojave, pri kojima se hemikalija mijenja. sastav površinskog sloja (vidi ADSORPCIJA). Ovoj grupi fenomena pridružuje se dec. slučajevima aktiviranih i kem. adsorpciju, pretvarajući se u površinsku hemiju. reakcije sa formiranjem površinskog sloja hemikalije. veze. Ovo uključuje diff. Topochem. (na primjer, formiranje metalnih ogledala na površinama tokom redukcije metala iz otopine njegovih soli, stvaranje kamenca na grijaćim površinama, itd.). Služi formiranje hemisorpcijskih monomolekularnih slojeva-prevlaka efikasan metod promjene monomolekularnih površinskih svojstava u tijelu i prirode njihovog djelovanja na okruženje. Adsorpcijski slojevi mogu dramatično povećati stabilnost emulzija, pjena, suspenzija, što je u krajnjoj liniji povezano sa strukturnom i mehaničkom. sveci ovih slojeva (visoki, elastični i čvrsti).
Karakteristike termičkog kretanja u površinskim slojevima vode do pristaništa. rasipanje svetlosti po površinama. Ostala grupa fenomena uključuje: termoionsku emisiju, pojavu potencijalnih skokova i formiranje dvostrukog električnog sloja na međuprostoru. Ovi P. I. povezana sa adsorpcijom jona i dipolnih molekula. P. i. utiču na termodinamiku. ravnoteža faza samo u slučaju veoma razvijene površine njihovog razdvajanja u koloidnim sistemima. Brzine prijenosa topline i procesi prijenosa mase - otapanje, kondenzacija, heterogena hem. procesi (npr. korozija) - određuju se veličinom i St. vi interfejsa i stoga oštro zavise od pristaništa. priroda i struktura ove površine. Adsorpcijski slojevi mogu prizvati stvorenja. promjena, usporavajući procese međufazne razmjene. Dakle, monoslojevi određenih površinski aktivnih supstanci, na primjer. cetil alkohol na površini vode može značajno usporiti njeno isparavanje. Isto je i usporavanje procesa korozije pod dejstvom površinskih slojeva inhibitori ili zaštitni filmovi od oksida itd. spojeva na površini metala.
P. i. određuju karakteristike graničnih uslova pri kretanju interfejsa (kapi, mehurići i mlazovi tečnosti, raspadanje na kapi, kapilara). Adsorpcijski slonovi uzrokuju prigušivanje kapilarnih valova zbog pojave lokalnih razlika u površinskom naponu, odnosno promjena u graničnoj hidrodinamici. uslovima.
P. i. određuju trajnost materijala i konstrukcija u datom okruženju. Ne samo otapanje i korozija, već čak i reverzibilna korozija, uzrokuju ublažavanje deformacija i uništavanje čvrstih materija. tijela, smanjujući rad formiranja novih površina. Male nečistoće se adsorbuju u-u, formirajući monomol. slojeva na interfejsima, omogućavaju vam da kontrolišete mnoge. Sv. ti materijali. Proučavanje monomolekularnih površinskih slojeva dovodi do novih metoda za proučavanje molekula i određivanje njihove veličine. P. i. određuju procese trošenja stijena i formiranja tla, isparavanja i kondenzacije vlage, kao i mnoge druge. procesa u živim organizmima. O upotrebi P. I. osnovao mnoge tehnološke procesi (podmazivanje, vlaženje, flotacija, itd.).
Fizički enciklopedijski rječnik. - M.: Sovjetska enciklopedija. . 1983 .
POVRŠINSKI FENOMENI
-
pojave, adsorpcija, pojava površinske energije, površinski napon, površinska električna. Površinski slojevi su heterogeni na skali molekularnih dimenzija i anizotropni su bez obzira na stanje agregacije faza; razlikuju se od masivnih faza fizičke. svojstva (gustina, viskoznost, kristali i šupljine su mikroskopski. U prisustvu dvodimenzionalnih faznih prelaza na površini, kao i na preseku površina, formiraju se međufazne linije - jednodimenzionalni analozi međufaznih površina, linearne pojave su povezana sa postojanjem kojih.Nehomogena linearna oblast je jednodimenzionalni analog površinskog sloja i ima linearnu napetost, linearnu slobodnu energiju itd. Udaljeni linearni termodinamički potencijali razlikuju se od površinskih samo po tome što se odnose na jediničnu dužinu (mjereno u J/m). Linearni fenomeni su značajni samo za vrlo male objekte (jezgra dvodimenzionalnih faza, . P.).
Pravilnosti P. I. opisani su Laplaceovim zakonom i Youngovom jednačinom (vidi. vlaženje), kao i generalizovana Gibbs ur-Niemadsorpcija:
gdje je rad formiranja površinske jedinice rezanjem (vidi. površinski napon),- otkucaji entropija (vidi Površinska energija),- tenzor površinskog napona, - jedinični tenzor, - tenzor deformacije(simbol ":" znači skalarni proizvod tenzora),- hemijski potencijali
molekule (ili elektrohemijski potencijali jona), G i- njihova adsorpcija, sumiranje se vrši po svim komponentama, za koje je moguća ravnoteža između faze u masi i površinskog sloja. Za tečne površine - površinski napon i deformacija. član nedostaje. Ur-cija Gibbsove adsorpcije uspostavlja komunikaciju između najvažnijih P. I. - adsorpcija i površinska aktivnost (vidi tenzidi).
Značajan uticaj imaju P. I. svojstva makrosistema. To je zbog povećanja površine u takvim sistemima, kapilarnih fenomena. U heterogenom sistemu sa samo zakrivljenim površinama, Gibbsovo fazno pravilo u svom klasiku pritisak klina tankih filmova, koji (ako je njegov predznak pozitivan) doprinosi stabilnosti disperznih sistema (definiše se kao razlika između spoljašnjeg pritiska na foliju i pritiska u masnoj fazi, sastavljenog od komponenti filma na iste temperaturne i hemijske vrijednosti kao u filmu.Važna grupa P.I. su elektropovršinski fenomeni: površinski, površinski električni, emisioni itd. Svi su povezani sa formiranjem na međuprostoru dvostruki električni sloj kao rezultat emisije ili specifične. Za P. I. odnose kohezija, adhezija, vlaženje, podmazivanje i pranje, trenje, impregnacija poroznih tijela. P. i. uticaj (npr. smanjenje jačine adsorpcije - Rehbinderov efekat). P. i. igraju važnu ulogu u faznim procesima. brzina prijenosa topline i mase između njih. Propustljivost površinskih slojeva i filmova, povezana s njihovom molekularnom strukturom, uzrokuje membranske pojave, koje su posebno važne u biol. sistemima. Lit.: Rusanov A.I., Fazna ravnoteža i površinski fenomeni, L., 1967; Adameon A., Fizička hemija površine, ALI. I. Rusanov.
Fizička enciklopedija. U 5 tomova. - M.: Sovjetska enciklopedija. Glavni i odgovorni urednik A. M. Prokhorov. 1988 .
Pogledajte šta je "POVRŠINSKI FENOMENI" u drugim rječnicima:
Moderna enciklopedija
Površinski fenomeni- POVRŠINSKE POJAVE, zbog posebnih fizičkih i hemijska svojstva tanki slojevi materije na granici tijela (mediji, faze). Najvažniji površinski fenomen je adsorpcija. Odredite snagu i trajnost materijala. Sa površinom... Ilustrovani enciklopedijski rječnik
Grupa fenomena zbog činjenice da se sile interakcije između čestica koje čine tijelo ne kompenziraju na njegovoj površini. Površinski fenomeni uključuju površinski napon, kapilarne pojave, površinsku aktivnost… Veliki enciklopedijski rječnik
površinske pojave- - fizičko-hemijske pojave uzrokovane neravnomjernom raspodjelom molekula rastvarača i otopljene tvari u blizini međupovršine. opšta hemija: udžbenik / A. V. Zholnin ... Hemijski termini
POVRŠINSKI FENOMENI- pojave koje se javljaju u površinskom sloju, na granici između medija i uzrokovane povećanom aktivnošću i orijentacijom molekula površinskog sloja, osobinama njegove strukture i sastava, kao i hemijskim. i fizički interakcije u... Velika politehnička enciklopedija
Phys. chem. pojave koje nastaju zbog posebnih (u poređenju sa zapreminskim) svojstava površinskih slojeva tečnosti i čvrstih tela. Naib. uobičajen i važan sv u ovim slojevima je višak svob. energija F \u003d sS, gdje je s površinska (međufazna) napetost, za ... ... Chemical Encyclopedia
Površinski fenomeni skup fenomena zbog posebnih svojstava tankih slojeva materije na granici faza. Površinski fenomeni uključuju procese koji se dešavaju na međufaznoj površini, u međufaznoj površini ... ... Wikipedia
Izražavanje posebnih svojstava površinskih slojeva, odnosno tankih slojeva materije na granici između tijela (medija, faza). Ova svojstva su posljedica viška slobodne energije (vidi Slobodna energija) površinskog sloja, njegovih karakteristika ... ... Velika sovjetska enciklopedija
Površina– interfejs između dva kontaktna medija
Površinski fenomeni- skup pojava zbog fizičkih i hemijskih svojstava na granici između susjednih supstanci.
Odnosno, to su pojave koje se dešavaju na površini, zbog površinske energije.
Podpovršinski slojevi materijala smatraju se podsistemom zajednički sistem deformabilnog materijala.
Specifična površina: S otkucaji = S/V
Površinski fenomeni uključuju:
2) kapilarne pojave(površinske pojave na granici tečnosti sa drugim medijem, povezane sa zakrivljenošću njene površine)
Laplaceova funkcija (formula za kapilarni pritisak) P = σ(dS/dV)
3) adhezija(karakterizira prianjanje tvari jedne faze na drugu fazu) i kohezija(adhezija delova istog homogenog tela (tečnog ili čvrstog))
4) trenje
5) fenomeni adsorpcije i desorpcije
Gibbsova adsorpciona jednadžba: Γ = -(∂σ/∂μ) T
6) vlaženje(površinski fenomen koji se opaža kada tečnost dođe u kontakt sa čvrstim telom u prisustvu treće faze, gasa (pare) ili druge tečnosti koja se ne meša sa prvom. Feature vlaženje - prisustvo kontaktnih linija od tri faze (vodovi vlaženja).
Glavne termodinamičke karakteristike vlaženja su ravnotežni ugao vlaženja q 0 , rad adhezije W a , toplota vlaženja q W . Ravnotežni kontaktni ugao vlaženja određen je nagibom površine tečnosti (npr. kapi) prema površini čvrstog tela koje vlaži; vrh ugla je na liniji vlaženja. Ravnotežni kontaktni ugao određen je Youngovom jednadžbom:
cosq 0 \u003d (s s -s sl) / s sl,
gdje je s s i s sl - respektivno. specifična površinska energija čvrste tvari na granici s plinom iu kontaktu s tekućinom koja vlaže, s l je površinski napon tekućine.
Termodinamika površine:
površinske pojave se obično klasifikuju u skladu sa kombinovanom jednadžbom prvog i drugog zakona termodinamike.
Ova jednačina se piše kao:
gdje σdS – površinska energija[J/m^2=N/m]
Površinska energija - energija koncentrisana na interfejsu, višak u poređenju sa energijom u zapremini. Kristalne supstance karakterizira anizotropija površinske energije: najnižu površinsku energiju posjeduju lica sa najveća gustinačestice.
Površinski napon: σ = (dG/dS) T , p , ni
Odnosno, površinski napon je termodinamička karakteristika granice između dvije faze u ravnoteži, određena radom reverzibilnog izotermokinetičkog formiranja jedinične površine ovog interfejsa, pod uslovom da temperatura, zapremina sistema i hemijski potencijali svih komponente u obje faze ostaju konstantne.
Težnja površinske energije na minimum uzrokuje zakrivljenost površine tečnosti. Stoga možemo pretpostaviti postojanje veze između površinske energije i oblika.
Elektronska svojstva površine razlikuju se od rasutih, posebno po prisutnosti elektronskih površinska stanja. Odgovarajuće valne funkcije elektrona opadaju eksponencijalno s udaljenosti od površine.
Posebna svojstva imaju i mali (barem u jednoj dimenziji) objekti vezani za površinske slojeve, kao što su tanki filmovi i filamenti, uski prorezi i pore, kapi, kristali i šupljine mikroskopskih dimenzija. Proučavanje tankih filmova i monomolekularnih slojeva daje informacije o prirodi međumolekularne interakcije i strukturi molekula.
Ako postoje dvodimenzionalni fazni prelazi, a i kada se površine ukrštaju, formiraju se međufazne linije - jednodimenzionalni analozi međufaznih površina, čije je postojanje povezano s linearnim pojavama. Nehomogena linearna oblast je jednodimenzionalni analog površinskog sloja i ima linearnu napetost, linearnu slobodnu energiju itd. Specifična linearna termodinamički potencijali razlikuju se od površinskih samo po tome što se odnose na jedinicu dužine (mjereno u J/m). Linearne pojave su značajne samo za vrlo male objekte (jezgra dvodimenzionalnih faza, vlaženje mikrokapljica itd.).
Pojave adsorpcije i desorpcije
Kada se plinovi adsorbiraju na čvrstim tvarima, opis interakcije između molekula adsorbata i adsorbenta je vrlo složen problem, jer priroda njihove interakcije, koja određuje prirodu adsorpcije, može biti različita. Stoga se problem obično pojednostavljuje razmatranjem dva ekstremna slučaja, kada je adsorpcija uzrokovana fizičkim ili hemijskim silama – odnosno fizičke i hemijske adsorpcije.
fizička adsorpcija nastaje zbog van der Waalsovih interakcija. Karakterizira ga reverzibilnost i smanjenje adsorpcije s povećanjem temperature, tj. egzotermnost, a toplotni efekat fizičke adsorpcije je obično blizak toploti ukapljivanja adsorbata (10 – 80 kJ/mol). Takva je, na primjer, adsorpcija inertnih plinova na ugalj.
Hemijska adsorpcija(hemisorpciju) vrši hemijska interakcija molekule adsorbenta i adsorbata. Hemisorpcija je obično nepovratna; kemijska adsorpcija, za razliku od fizičke adsorpcije, je lokalizirana; molekule adsorbata ne mogu se kretati po površini adsorbenta. Pošto je hemisorpcija hemijski proces, koji zahtijeva energiju aktivacije reda 40 - 120 kJ / mol, povećanje temperature doprinosi njegovom nastanku. Primjer kemijske adsorpcije je adsorpcija kisika na volframu ili srebru na visokim temperaturama.
Fenomeni fizičke i hemijske adsorpcije jasno se razlikuju u vrlo rijetkim slučajevima. Međuvarijante se obično izvode kada se najveći dio adsorbirane tvari veže relativno slabo, a samo mali dio je čvrsto vezan. Na primjer, kisik na metalima ili vodik na nikal na niskim temperaturama se adsorbiraju u skladu sa zakonima fizičke adsorpcije, ali kako temperatura raste, počinje se javljati kemijska adsorpcija. Kako temperatura raste, povećanje hemijske adsorpcije sa određene temperature počinje da se preklapa sa smanjenjem fizičke adsorpcije, tako da temperaturna zavisnost adsorpcije u ovom slučaju ima jasno definisan minimum.
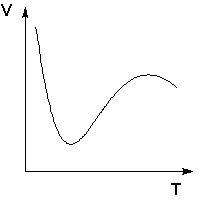
Temperaturna zavisnost zapremine vodonika adsorbovanog niklom
Vrste adsorpcije:
Langmuirova teorija monomolekularne adsorpcije
Teorija monomolekularne adsorpcije, koju je razvio američki hemičar I. Langmuir, zasniva se na sljedećim odredbama.
1) Adsorpcija je lokalizovana i uzrokovana je silama bliskim hemijskim.
2) Adsorpcija se ne dešava na celoj površini adsorbenta, već na aktivnim centrima, koji su izbočine ili udubljenja na površini adsorbenta, koje karakteriše prisustvo tzv. slobodne valencije. Aktivni centri se smatraju nezavisnim (tj. jedan aktivni centar ne utiče na kapacitet adsorpcije drugih) i identičnim.
3) Svaki aktivni centar je u stanju da interaguje sa samo jednim molekulom adsorbata; kao rezultat, na površini se može formirati samo jedan sloj adsorbiranih molekula.
4) Proces adsorpcije je reverzibilan i ravnotežan – adsorbovani molekul se zadržava u aktivnom centru neko vreme, nakon čega se desorbuje; tako se nakon nekog vremena uspostavlja dinamička ravnoteža između procesa adsorpcije i desorpcije.
Monomolekularna izoterma adsorpcije
U stanju ravnoteže, brzina adsorpcije je jednaka brzini desorpcije. Brzina desorpcije je direktno proporcionalna udjelu zauzetih aktivnih centara (x), a brzina adsorpcije je direktno proporcionalna umnošku koncentracije adsorbata i udjela slobodnih aktivnih centara (1 – x):
Podijelimo brojilac i imenilac desne strane jednačine sa k A , dobićemo:

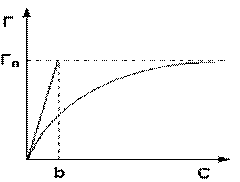
Maksimalna moguća vrijednost adsorpcije T o postiže se pod uslovom da su svi aktivni centri zauzeti molekulima adsorbata, tj. x = 1. Otuda slijedi da je x = r / r o.
Jednačina je monomolekularna izoterma adsorpcije koja povezuje adsorpcionu vrijednost G sa koncentracijom adsorbata C. Ovdje je b neka konstantna vrijednost za dati par adsorbent-adsorbat (omjer konstanti desorpcije i brzine adsorpcije), numerički jednaka koncentraciji adsorbata, u kojima je zauzeta polovina aktivnih centara. Grafikon Langmuirove izoterme adsorpcije prikazan je na sl. Konstanta b se može odrediti grafički povlačenjem tangente na izotermu adsorpcije u tački C = 0.
Kada se opisuje proces adsorpcije gasova u jednačini, koncentracija se može zameniti proporcionalnom vrednošću parcijalni pritisak plin:
Langmuirova teorija monomolekularne adsorpcije je primjenjiva za opisivanje nekih procesa adsorpcije plinova i otopljenih tvari pri niskim pritiscima (koncentracijama) adsorbata.
Polanyijeva teorija polimolekularne adsorpcije
U praksi se često (posebno u adsorpciji para) javljaju tzv. Izoterme adsorpcije u obliku slova S, čiji oblik ukazuje na moguću interakciju adsorbiranih molekula sa adsorbatom, počevši od određene vrijednosti pritiska.

Polimolekularna izoterma adsorpcije
Da bi opisao takve adsorpcijske izoterme, M. Polyany je predložio teoriju polimolekularne adsorpcije zasnovanu na sljedećim glavnim odredbama:
1. Adsorpcija je uzrokovana čisto fizičkim silama.
2. Površina adsorbenta je homogena, tj. na njemu nema aktivnih centara; adsorpcione sile formiraju neprekidno polje sila blizu površine adsorbenta.
3. Adsorpcijske sile djeluju na daljinu, veći molekule adsorbata. Drugim riječima, postoji određena adsorpciona zapremina blizu površine adsorbenta, koja je tokom adsorpcije ispunjena molekulima adsorbata.
Karakteristike atomske strukture površinskog sloja:
Specifičnost strukture atoma u blizini površine čvrstih tijela očituje se u takozvanoj površinskoj relaksaciji i rekonstrukciji. Tokom relaksacije, struktura atomskih ravnina paralelnih s površinama ostaje ista kao u masi, ali se međuplanarne udaljenosti u blizini površine mijenjaju. Tokom rekonstrukcije, simetrija rešetke u području blizu površine oštro se razlikuje od one u masi. Ova pojava je karakteristična prvenstveno za kristale sa kovalentnom vezom (npr. Si i Ge). Zbog izrazito anizotropne prirode kovalentne interakcije, kršenje periodičnosti rešetke tokom formiranja površine povlači za sobom radikalno preuređenje geometrije međuatomskih veza u blizini površine. Pronađena je i rekonstrukcija površine niza prelaznih i plemenitih metala.
Površinska relaksacija - modifikacija pripovršinskog sloja kristala, u kojoj atomska struktura gornjeg sloja ostaje ista kao i kod odgovarajućih atomskih ravni u zapremini, ali se udaljenost između prvog i drugog sloja ili njihov međusobni položaj razlikuje od one u volumenu.
Opuštanje se dijeli na normalno i bočno, koji se naziva i paralelnim ili tangencijalnim. Normalna relaksacija odgovara slučaju kada je atomska struktura gornjeg sloja ista kao u masi, ali se udaljenost između gornjeg i drugog sloja razlikuje od udaljenosti između ravnina u masi (sl. a). U svom čistom obliku, normalna relaksacija se opaža u metalima. U većini slučajeva dolazi do smanjenja prve međuslojne udaljenosti; za dublje slojeve, odstupanje od ukupne vrijednosti međuslojne udaljenosti opada sa dubinom. Ponekad postoji i jednolično pomeranje gornjeg sloja paralelno sa površinom (slika b); u ovom slučaju se govori o paralelnoj ili tangencijalnoj relaksaciji. Uočava se uglavnom na ravninama visokog indeksa sa niskom koncentracijom atoma.
Površinski fenomeni
Površinski fenomeni- skup fenomena zbog posebnih svojstava tankih slojeva materije na granici faza. Površinski fenomeni uključuju procese koji se odvijaju na granici faza, u međufaznom površinskom sloju i koji su rezultat interakcije konjugiranih faza.
Površinski fenomeni nastaju zbog činjenice da u površinskim slojevima na međufaznim granicama zbog različit sastav i strukturu kontaktnih faza i, shodno tome, zbog razlike u vezama površinskih atoma i molekula sa strane različitih faza, postoji nezasićeno polje međuatomskih, međumolekularnih sila. Kao rezultat toga, atomi i molekuli u površinskim slojevima formiraju posebnu strukturu, a tvar poprima posebno stanje koje se razlikuje od svog stanja u volumenu faza po različitim svojstvima. Površinske pojave se proučavaju koloidnom hemijom.
Klasifikacija površinskih pojava
Površinski fenomeni se obično klasifikuju u skladu sa kombinovanom jednačinom prvog i drugog zakona termodinamike, koja uključuje glavne vrste energije. Za bilo koji heterogeni sistem, može se napisati u sljedećem obliku:
Ova jednadžba pokazuje povećanje Gibbsove energije kroz algebarski zbir prirasta drugih vrsta energije. Očigledno je da se površinska energija može transformirati u sljedeće vrste energije:
- Gibbsova energija
- hemijsku energiju
- mehanička energija
- Električna energija
Transformacija površinske energije u jednu od navedenih vrsta energije odgovara određenim površinskim pojavama, kao što su promjena reaktivnosti s promjenom disperzije, adhezije i vlaženja, kapilarnost, adsorpcija, električni fenomeni.
Značaj površinskih fenomena
Površinski fenomeni su široko rasprostranjeni u hemijskom inženjerstvu. Skoro bilo koji hemijska proizvodnja izvedeno korišćenjem disperzovanih sistema i površinskih pojava. U pravilu se svi heterogeni procesi u hemijskoj tehnologiji odvijaju na maksimalna površina fazni kontakt. Da bi se to postiglo, sistemi materije se prenose u stanje suspenzija, prahova, emulzija, magle, prašine. Procesi mljevenja sirovina i poluproizvoda, obogaćivanje se odvijaju u dispergiranim sistemima, a značajnu ulogu u njima imaju fenomeni kao što su vlaženje, kapilarnost, adsorpcija, sedimentacija, koagulacija. Porozni adsorbenti i katalizatori se široko koriste u hemijskoj tehnologiji. disperzovanog sistema sa čvrstim disperzionim medijem.
Služe zakonitosti toka površinskih pojava, posebno formiranja strukture teorijska osnova dobijanje materijala sa željenim svojstvima: keramika, cementi, staklokeramika, sorbenti, katalizatori, polimeri, prahovi, lekovi itd.
Književnost
Frolov Yu. G. Pa koloidna hemija. - DOO TID "Savez", 2004. - 464 str. - ISBN 5-98535-003-7
Wikimedia fondacija. 2010 .
Pogledajte šta je "površinski fenomen" u drugim rječnicima:
Pojave uzrokovane viškom slobodne energije u graničnom sloju površinske energije, povećanom aktivnošću i orijentacijom molekula površinskog sloja, karakteristikama njegove strukture i sastava. P. i. određuju se i činjenicom da hem. i fizički vz… … Physical Encyclopedia
Moderna enciklopedija
Površinski fenomeni- POVRŠINSKE POJAVE nastaju zbog posebnih fizičkih i hemijskih svojstava tankih slojeva materije na granici tela (mediji, faze). Najvažniji površinski fenomen je adsorpcija. Odredite snagu i trajnost materijala. Sa površinom... Ilustrovani enciklopedijski rječnik
Grupa fenomena zbog činjenice da se sile interakcije između čestica koje čine tijelo ne kompenziraju na njegovoj površini. Površinski fenomeni uključuju površinski napon, kapilarne pojave, površinsku aktivnost… Veliki enciklopedijski rječnik
površinske pojave- - fizičko-hemijske pojave uzrokovane neravnomjernom raspodjelom molekula rastvarača i otopljene tvari u blizini međupovršine. Opća hemija: udžbenik / A. V. Zholnin ... Hemijski termini
POVRŠINSKI FENOMENI- pojave koje se javljaju u površinskom sloju, na granici između medija i uzrokovane povećanom aktivnošću i orijentacijom molekula površinskog sloja, osobinama njegove strukture i sastava, kao i hemijskim. i fizički interakcije u... Velika politehnička enciklopedija
Phys. chem. pojave koje nastaju zbog posebnih (u poređenju sa zapreminskim) svojstava površinskih slojeva tečnosti i čvrstih tela. Naib. uobičajen i važan sv u ovim slojevima je višak svob. energija F \u003d sS, gdje je s površinska (međufazna) napetost, za ... ... Chemical Encyclopedia
Izražavanje posebnih svojstava površinskih slojeva, odnosno tankih slojeva materije na granici između tijela (medija, faza). Ova svojstva su posljedica viška slobodne energije (vidi Slobodna energija) površinskog sloja, njegovih karakteristika ... ... Velika sovjetska enciklopedija
Grupa fenomena zbog činjenice da se sile interakcije između čestica koje čine tijelo ne kompenziraju na njegovoj površini. Površinski fenomeni uključuju površinski napon, kapilarne pojave, površinsku aktivnost, ... ... enciklopedijski rječnik
POVRŠINSKI FENOMENI- skup pojava povezanih sa posebnim svojstvima površinskih slojeva na granici između susjednih tijela. Površinski fenomeni nastaju zbog prisustva površinske energije. Površinski fenomeni uključuju površinski napon, ... ... Metalurški rječnik
Knjige
- Fizička hemija. Površinski fenomeni i disperzni sistemi. Udžbenik, A. G. Morachevsky. Fizička hemija. Površinski fenomeni i disperzni sistemi: Uč. dodatak, 2. izd., obrisano. ISBN:978-5-81141-857-2…
Površinski fenomeni- skup fenomena zbog posebnih svojstava tankih slojeva materije na granici faza. Površinski fenomeni uključuju procese koji se odvijaju na granici faza, u međufaznom površinskom sloju i koji su rezultat interakcije konjugiranih faza.
Površinski fenomeni nastaju zbog činjenice da u površinskim slojevima na međufaznim granicama, zbog različitog sastava i strukture kontaktnih faza i, shodno tome, zbog razlike u vezama površinskih atoma i molekula sa strane različitih faza , postoji nezasićeno polje međuatomskih, intermolekularnih sila. Kao rezultat toga, atomi i molekuli u površinskim slojevima formiraju posebnu strukturu, a tvar poprima posebno stanje koje se razlikuje od svog stanja u volumenu faza po različitim svojstvima. Površinske pojave se proučavaju koloidnom hemijom.
Klasifikacija površinskih pojava
Površinski fenomeni se obično klasifikuju u skladu sa kombinovanom jednačinom prvog i drugog zakona termodinamike, koja uključuje glavne vrste energije. Za bilo koji heterogeni sistem, može se napisati u sljedećem obliku:
d G = − S d T + V d P + σ d s _ + Σ μ i d n i + φ d q (\displaystyle dG=-SdT+VdP+(\podvučeno (\sigma ds))+\Sigma \mu _(i)dn_ (i)+\varphi dq)Ova jednadžba pokazuje povećanje Gibbsove energije kroz algebarski zbir prirasta drugih vrsta energije. Očigledno je da se površinska energija može transformirati u sljedeće vrste energije:
- Gibbsova energija
- hemijsku energiju
- mehanička energija
- Električna energija
Transformacija površinske energije u jednu od navedenih vrsta energije odgovara određenim površinskim pojavama, kao što su promjena reaktivnosti s promjenom disperzije, adhezije i vlaženja, kapilarnost, adsorpcija, električni fenomeni.
Značaj površinskih fenomena
Površinski fenomeni su široko rasprostranjeni u hemijskom inženjerstvu. Gotovo svaka hemijska proizvodnja se odvija korištenjem dispergiranih sistema i površinskih pojava. U pravilu se svi heterogeni procesi u hemijskoj tehnologiji odvijaju na maksimalnoj kontaktnoj površini faza. Da bi se to postiglo, sistemi materije se prenose u stanje suspenzija, prahova, emulzija, magle, prašine. Procesi mljevenja sirovina i poluproizvoda, obogaćivanje se odvijaju u dispergiranim sistemima, a značajnu ulogu u njima imaju fenomeni kao što su vlaženje, kapilarnost, adsorpcija, sedimentacija, koagulacija. Porozni adsorbenti i katalizatori, koji su dispergovani sistem sa čvrstim disperzijskim medijumom, imaju široku primenu u hemijskoj tehnologiji.
Obrasci površinskih pojava, posebno formiranja strukture, služe kao teorijska osnova za dobijanje materijala sa željenim svojstvima: keramike, cementa, staklokeramike, sorbenata, katalizatora, polimera, prahova, lekova itd.
Pojave na vodenim površinama
Postoji jasan kontrast između jednostavnosti interfejsa ulje-voda pri vizuelnoj inspekciji i njegove složenosti na nivou mikroskopska skala hr , što se očituje u molekularnoj strukturi granice i u dinamici njenih vodikovih veza. Ogroman rad, počevši od Poissona i Maxwella, bio je posvećen proučavanju strukture vode i njene reaktivnosti na granici, međutim, zbog polivodnog skandala, tema strukture vode doživjela je pad u naučne aktivnosti.
Površinski fenomeni na granici ulje-voda leže u osnovi brojnih važnih hemijskih, fizičkih i bioloških procesa, uključujući formiranje micela i membrane, savijanje proteina, hemijsko odvajanje, obnavljanje ulja, formiranje nanočestica i polimerizacija na interfejsu en.
Struktura vode u kontaktu sa "proširenim" hidrofobnim površinama koje se javljaju na međuprostoru, kao što je heksanska emulzija, veoma se razlikuje od one hidratantna školjka u jednostavnim rastvorima kao što je metan. U homogenom rastvoru metana, molekuli vodena školjka orijentisan tangencijalno na sferu molekula metana; dok u emulziji heksana, oko 25% molekula površinske vode gubi jednu vodikovu vezu, a rezultirajuće slobodne grupe Oh prodiru u micelu heksana. Prema hipotezi hemičara Y. Chona i R. A. Markusa, prisustvo slobodnih grupa Oh je razlog zašto neki organske reakcije na vodenim površinama en su ubrzane stotine puta.
vidi takođe
Bilješke
Književnost
- Frolov Yu. G. Kurs koloidne hemije. - DOO TID "Savez", 2004. - 464 str. - ISBN 5-98535-003-7.
- Čaplin, M. Strukturiranje vode na koloidnim površinama // Surface Chemistry in Biomedical and Environmental Science: [engleski ] / J. P. Blitz, V. M. Gun'ko (ur.). - Springer Holandija, 2006. - P. 1-10. - DOI:10.1007/1-4020-4741-X_1 .
- Jung, Y.
Procesi koji se odvijaju na granici se nazivaju površinski fenomeni. Razlog površinskih pojava je posebno stanje molekula u slojevima koji se nalaze neposredno uz međupovršinu, jer ovi slojevi se razlikuju od unutrašnjim slojevima njihova fizička i hemijska svojstva (specifična energija, gustina, viskozitet, električna provodljivost, sastav). Štaviše, što je veća specifičnost sistemska energija, što se jače razlikuju svojstva i jači je uticaj površinskih pojava na ponašanje sistema u celini.
Molekularni pritisak. Energetsko stanje molekula supstance u zapremini faze i u površinskom sloju nije isto. Molekuli koji se nalaze u zapremini faze doživljavaju isto privlačenje (i odbijanje) od molekula koji ga okružuju, pa je stoga rezultanta molekularnih sila nula. Na primjer, molekul tekućine u tački A. Na molekuli (tačka B) koja se nalazi na granici faze, iz različitih (susjednih)
više od privlačnih sila gasne faze. Ako se privlačenje od molekula plina može zanemariti, tada je sila privlačenja površine molekule tečnosti, koji zauzima površinu od 1 m 2 , od strane molekula dubokih slojeva jednak je unutrašnjem (molekularnom) pritisku tečnosti, tj. sila privlačenja između molekula tečnosti u zapremini. Veličina unutrašnjeg pritiska tečnosti je veoma velika i zavisi od polariteta tečnosti. Što su supstance polarnije i što je veća privlačnost njihovih molekula, to je veći unutrašnji pritisak. Na primjer, za vodu 14800 atm., A za benzen - 3800 atm.
površinski napon. Slobodna površinska energija. Da bi se povećala površina tečnosti (tj. prelazak materije iz zapremine faze u površinski sloj), potrebno je savladati silu unutrašnjeg pritiska i izvršiti rad. Ovaj rad je veći, što je veća površina stvorene površine i veća je površinska napetost. Jednostrana napetost površinskog sloja molekula naziva se površinska napetost ( σ ). To je izraz kohezivnih sila između molekula date supstance u datom stanju.
Energija utrošena na stvaranje površine koristit će se za povećanje energije molekula kako bi se izvukli iz dubine faze na površinu. Višak energije površinskih molekula u odnosu na energiju unutrašnjih molekula po jedinici površine naziva se slobodna površinska energija: F= σ . S (mjereno u J / m 2 ili erg / cm 2). Kao što se vidi
iz formule, površinska napetost je numerički jednaka radu formiranja jedinične površine ili specifične slobodne energije: . TO JE izražavanje energije površinski napon. Definicija sile površinska napetost: to je sila koja djeluje na površinu tangencijalno na nju i nastoji da smanji slobodnu površinu tijela na najmanju granicu. U ovom slučaju se mjeri u N/m.
Prema II zakonu termodinamike, slobodna površinska energija sistema spontano teži minimumu. To znači da se slobodna površinska energija može smanjiti smanjenjem površine ili smanjenjem površinske napetosti. Smanjenje površine pod dejstvom sila molekularnog pritiska moguće je samo za tečnosti, jer kohezivne sile njegovih molekula nisu prevelike. Zbog toga se male kapi spajaju u veće, a kapljice tekućine u aerosolima, magli i emulzijama imaju sferni oblik.
Smanjenje slobodne površinske energije zbog smanjenja površinske napetosti svojstveno je i tekućinama i čvrstim tvarima. Površinska napetost može se smanjiti zbog nakupljanja na površini molekula druge tvari, posebno surfaktanta. Ovi molekuli svojom privlačnošću djelimično kompenzuju povlačenje površinskih molekula date faze u unutrašnjost zapremine i sistem postaje stabilniji.
Slobodna površinska energija i površinska napetost ovise o temperaturi, prirodi faza, prirodi i koncentraciji otopljenih tvari.
Sa povećanjem temperature, površinski napon opada, jer smanjuje se međusobna privlačnost molekula. Na kritičnoj tački površinski napon dostiže nulu, jer u ovom slučaju nestaju razlike i fazna granica.
Povećanje pritiska smanjuje površinski napon samo u sistemu "gas-tečnost", jer u isto vrijeme, gas se približava tečnosti u pogledu fizičko-hemijskih svojstava.
Također treba napomenuti da samo tekućine mogu mjeriti površinsku napetost. Za čvrste materije to je nemoguće, jer nemoguće je umjetno rastegnuti površinu čvrstog tijela zbog njegovog uništenja. Površinski napon čvrstih tijela određuje se proračunom. Za mjerenje površinskog napona tekućina, statičke (metode kapilarnog uspona, ležećih ili visećih kapi), polustatičke metode (metoda maksimalnog pritiska mjehurića plina, metoda kidanja prstena, stalagmometrijska metoda (metoda vaganje ili brojanje kapi).Od njih je jednostavna i dovoljna tačna stalagmometrijska metoda koja se zasniva na činjenici da je u trenutku odvajanja pod dejstvom gravitacije sa kraja kapilare tečne kapi njena težina praktično jednaka snazi površinski napon primijenjen na obim kapilare.
Za razrijeđene otopine čija se gustina malo razlikuje od gustine vode, površinski napon se može izračunati pomoću jednadžbe (mJ / m 2): ![]() .
.
adhezija i kohezija. Površinski fenomeni su važni u farmaciji, jer većina lijekova - prašci, tablete, emulzije, suspenzije, aerosoli, masti itd. su dispergovani sistemi. U proizvodnji lijekova često se mora suočiti s pojavama kao što su adsorpcija, vlaženje i adhezija.
Privlačenje koje se javlja između dva različita (čvrsta ili tečna) tijela kada dođu u kontakt naziva se adhezija (od latinskog adhaesio privlačenje, prianjanje). Karakterizira silu prianjanja različitih supstanci i mjeri se radom utrošenim na odvajanje molekula jedne faze od molekula druge faze (mjereno u J/m 2). Ovaj rad se izračunava prema Dupre-Youngovoj jednadžbi: W A \u003d σ well-g (1 + cosɨ). Djelovanje ljepila, veziva, premaza zasniva se na fenomenu prianjanja. Utječe na raspadanje tableta, čvrstoću ljuski, otapanje čvrstih doznih oblika, a koristi se za karakterizaciju materijala koji se koriste u kirurgiji i stomatologiji.
Adhezija homogenih molekula, atoma, jona, koja uključuje sve vrste intermolekularnog, interatomskog i interionskog privlačenja unutar jedne faze, naziva se kohezija (lat. „veza“). Karakterizira snagu supstance i mjeri se radom potrebnim da se supstanca razbije (prevaziđe kohezivne sile između molekula) i stvori dvije nove jedinice površina. Vrijednost adhezije je numerički jednaka dvostrukoj vrijednosti površinskog napona: W coh. = 2σ.
Osnovni koncepti adsorpcionih procesa. Solid ili tekućina, na čijoj površini dolazi do adsorpcije, naziva se adsorbent, a adsorbirana tvar se naziva adsorbat ili adsorbat. Proces spontane akumulacije supstance na međuprostoru naziva se adsorpcija (D). Izražava se količinom tvari adsorbirane jedinicom površine ili mase (mol/m2, mol/g). Adsorpcija, koja se odvija pod dejstvom van der Waalsovih sila i vodikovih veza, naziva se fizički. Adsorpcija, koja se zasniva na pojavi kovalentne veze između adsorbenta i molekula adsorbenta naziva se hemijski ili hemisorpcija. Fizička adsorpcija je reverzibilan proces i prati je desorpcija (oslobađanje površine od adsorbovane supstance). Između adsorpcije i desorpcije uspostavlja se dinamička ravnoteža čiji položaj zavisi od temperature. Povećanje temperature smanjuje fizičku adsorpciju i povećava hemijsku adsorpciju. Desorpcija se provodi uništavanjem adsorbenta, promjenom temperature i smanjenjem sila adsorpcijske interakcije. Potonji se široko koristi u obliku eluiranja. Elucija je promjena faze u blizini adsorbenta, na primjer, otopine, kako bi se supstanca desorbirala. Tijekom eluiranja, adsorbirana supstanca se istiskuje iz adsorbenta molekulima novog otapala ili kao rezultat smanjenja afiniteta adsorpcije tvarima otopljenim u novoj otopini (najčešće promjenom naboja adsorbenta i molekula adsorbenta zbog promjena pH ili jonske snage otopine).
Karakteristična karakteristika adsorpcije je njena selektivnost (specifičnost). To znači da svaki adsorbent adsorbuje jednu ili više specifičnih supstanci. Selektivnost adsorpcije podrazumijeva slučajnu podudarnost u raspodjeli elektronske gustine molekula adsorbenta i adsorbenta prema tipu „ključ – brava“, tj. hemijski afinitet između adsorbenta i adsorbenta.






