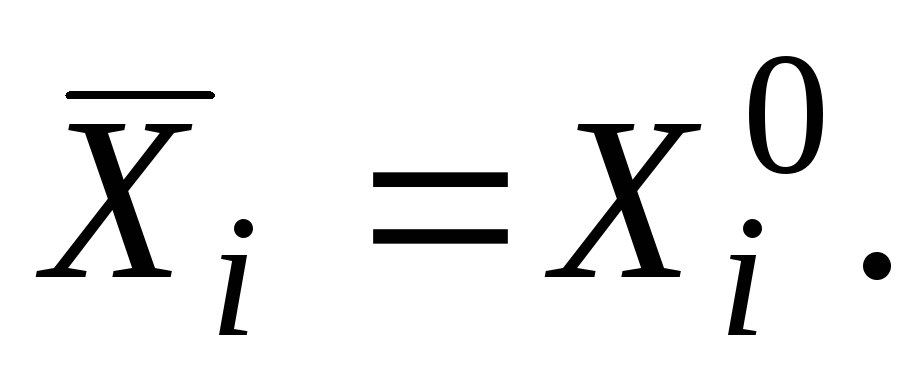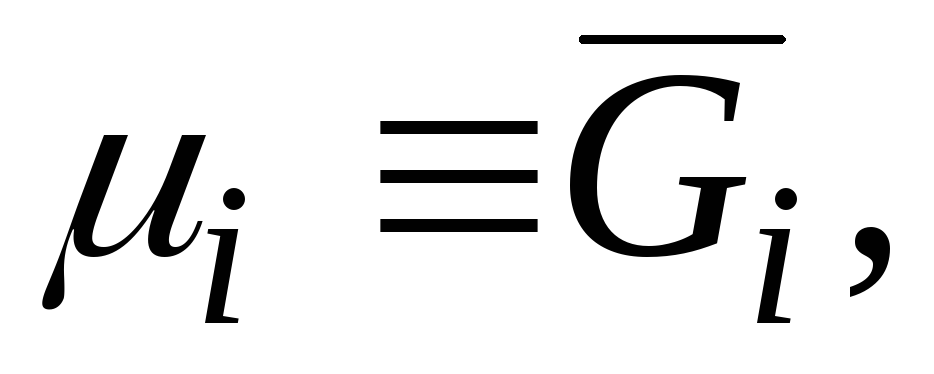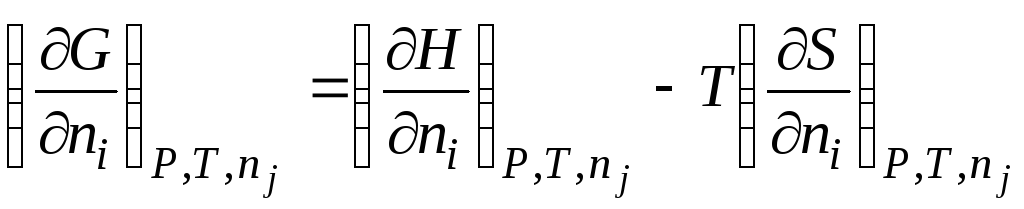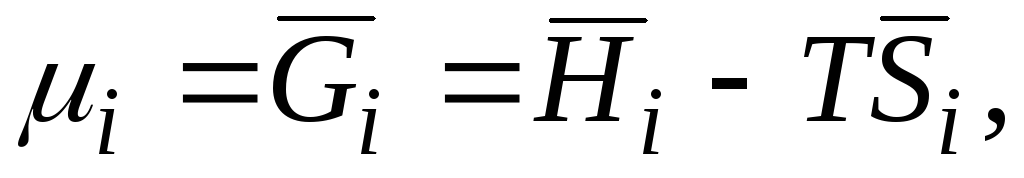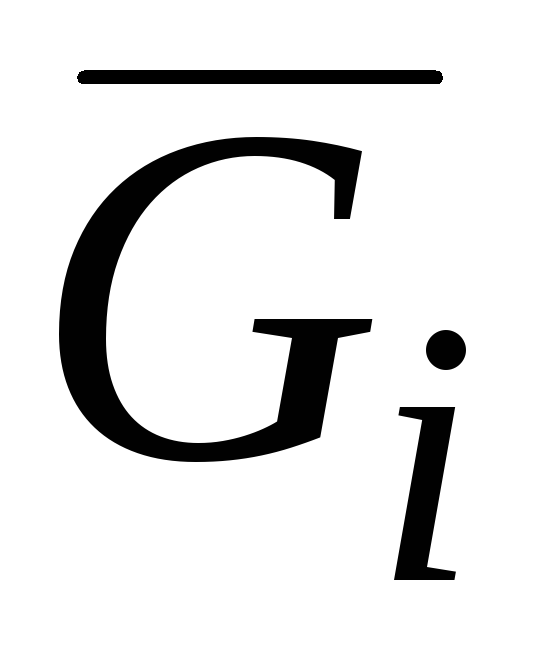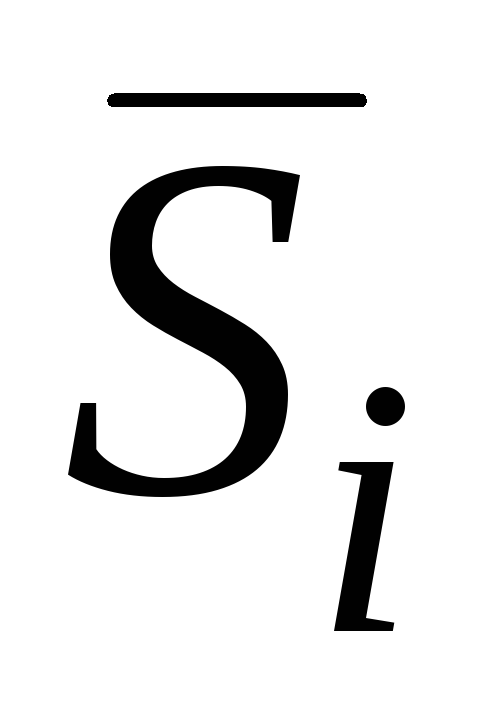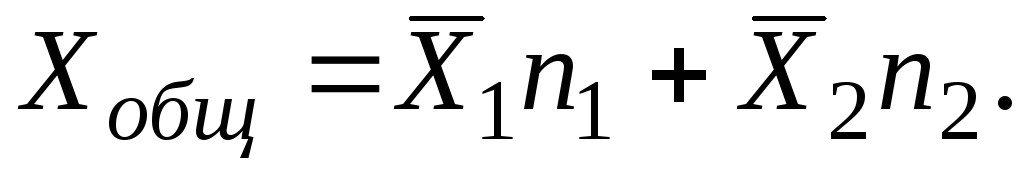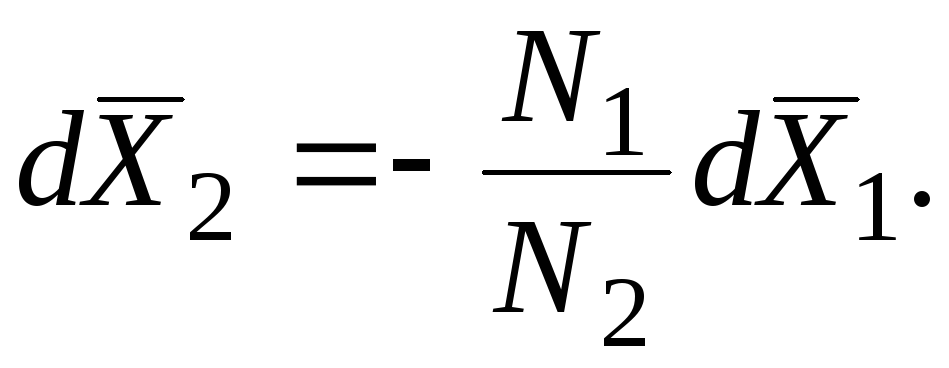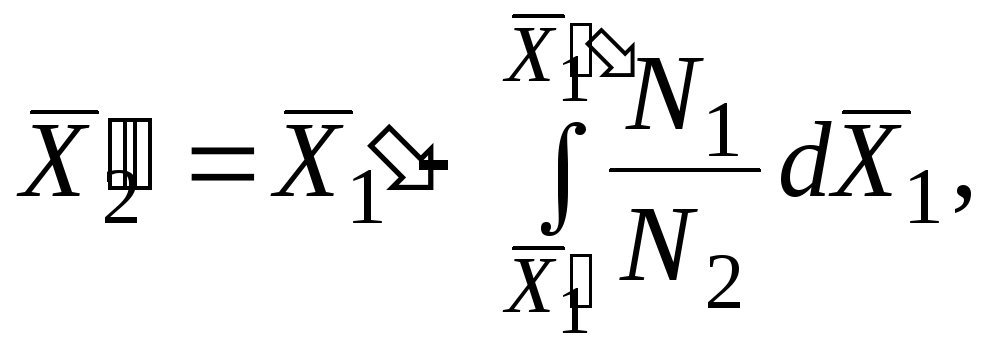Vazifalarga misollar. Fizik kimyo
Keng ko'lamli xususiyatlar materiya miqdoriga mutanosib. Bularga, masalan, hajm, massa, ichki energiya, entropiya. Demak, ikkita bir xil metallning ichki energiyasi bitta bo'lakning energiyasidan ikki baravar ko'p. Tizimning ekstensiv xususiyatlari qo'shimcha ravishda uning tarkibiy qismlarining keng xususiyatlaridan iborat. Harorat va bosim kabi moddalar miqdoriga bog'liq bo'lmagan xususiyatlar deyiladi shiddatli. Eritmalar uchun intensiv xususiyatlar tarkibi bilan belgilanadi. Masalan, eritma ustidagi har qanday komponentning bug 'bosimi uning konsentratsiyasiga bog'liq. Tizimning turli qismlarida intensiv xususiyatlarning qiymatlari tenglashishga intiladi. Intensiv miqdorni o'lchash uning o'zgarishi har doim qandaydir ekstensiv miqdorning o'zgarishi bilan birga bo'lishiga asoslanadi. Shunday qilib, haroratni o'lchash uchun moddaning hajmining o'zgarishi, masalan, simob ishlatiladi, ya'ni. keng ko'lamli mulk.
G. Lyuis komponentning qisman molyar qiymatini chaqirdi gi ba'zi ekstensiv miqdorning qisman hosilasi gi mollar soni bo'yicha n i Eritmaning bu komponenti doimiy bosim, harorat va qolgan komponentlarning mol raqamlari:
gi = (∂g/∂n i) p.T.nj(j ≠ i) . (V.1)Ushbu ta'rif talab qiladigan shartlarga rioya qilish, masalan, ma'lum bir konsentratsiyali eritmaning juda katta hajmiga doimiy bo'lishini tasavvur qilsak erishish mumkin. R va T Har qanday komponentdan 1 mol qo'shiladi. Bunday holda, eritmaning konsentratsiyasi amalda o'zgarmaydi va eritmaning tegishli o'zgarishi qo'shilgan komponentning qisman molyar qiymati bo'ladi.
Masalan, qisman molyar hajm Vi, tenglama bilan aniqlanadi:
Vi = (∂V/∂n i) p.T.nj(j ≠ i) . (V.2)Agar eritma komponentlardan hajm o'zgarmagan holda hosil bo'lsa, unda komponentning qisman molyar hajmi uning molyar hajmiga teng ekanligi aniq bo'ladi, ya'ni. Vi = V
| 0 |
| i |
komponentlarning eritmasi, hajmning qo'shilishi kuzatiladi, ya'ni. u o'zgarmaydi, keyin, masalan, iborat ikkilik yechim uchun P Birinchi komponentning 1 mol va P Ikkinchidan 2 mol: V = n 1 V
| 0 |
| 1 |
| 0 |
| 2 |
| 0 |
| 1 |
| 0 |
| 2 |
Agar, masalan, eritma hosil qilishda entalpiya qo'shimcha bo'lsa, u holda D H= 0, va shuning uchun eritma issiqlik effektisiz hosil bo'ladi. Agar boshlang'ich moddalarning entalpiyasi ko'proq entalpiya eritma, eritma hosil bo'lganda, issiqlik chiqariladi. Aks holda, issiqlik so'riladi.
Qisman molyar miqdorlar orasida qisman molyar Gibbs energiyasi alohida ahamiyatga ega:
G i = (∂G/∂n i) p.T.nj(j ≠ i) (V.3)bobda ta'kidlanganidek. II, chaqirildi kimyoviy potentsial va m bilan belgilanadi.
Kimyoviy potentsial harorat va bosim bilan birga intensiv miqdordir. Shunday qilib, tizimning turli qismlarida harorat, bosim va barcha komponentlarning kimyoviy potentsiallarining tengligi issiqlik, mexanik va kimyoviy muvozanat shartlarini ifodalaydi. Qiymat G i = μ i moddaning ma'lum fazani tark etish tendentsiyasini aks ettiradi va uning tarqalishining o'lchovidir.
Keling, ikkita qo'shni bosqichni ko'rib chiqaylik - eritma va uning ustidagi bug '. Ushbu bosqichlarning har birida ma'lum bir komponent mavjud i. Muvozanat holatida G i yechim = G i bug '.
Agar, masalan, kimyoviy potentsial eritmada gaz fazasiga qaraganda ko'proq modda bor edi, keyin bu moddaning bug'lanishi sodir bo'ladi, bunda G i eritma kamayadi, a G i muvozanat o'rnatilgunga qadar par ortadi. Aks holda, komponentning o'tishi sodir bo'ladi i bug'dan eritmagacha.
Faraz qilaylik, bug 'fazasi xususiyatlarga ega ideal gazlar. Bu holda molekulalar o'rtasida o'zaro ta'sir bo'lmaganligi sababli, gaz komponentining qisman molyar Gibbs energiyasi yoki uning kimyoviy potentsiali sof komponentning molyar Gibbs energiyasiga teng. G i aralashmadagi qisman bosimiga teng bosimda, ya'ni. m i gaz = G i gaz = G i gaz. Shunday qilib, (II.28) tenglamaga muvofiq:
G i eritma = m i yechim = G i = G
odatda m + bilan belgilanadi RT ln pi(V.4)Qisman molyar qiymatlar eritmalarning xususiyatlarini tavsiflaydi. Eritmalardagi muvozanatlarni termodinamik hisoblashda ular mos funksiyalar bilan bir xil rol o'ynaydi. U, H, F, G, S va hokazo. sof moddalar o'rtasidagi reaktsiyalar bilan bog'liq hisob-kitoblarda. Shu munosabat bilan, qisman molyar qiymatlar jadvallarini tuzish maqsadga muvofiqdir.
Kirish
Mavzu 6. Yechimlar
Eritmalarni o'rganish fizik kimyoning muhim sohasidir, chunki tabiatda ham, texnologiyada ham biz doimo toza moddalar bilan emas, balki eritmalar bilan shug'ullanishimiz kerak. Misol uchun, zamonaviy texnologiyada vakuum va zonali eritish usullari bilan olingan eng sof metallar hali ham arzimas miqdorda (10-6%) aralashmalarni, asosan metalloidlarni o'z ichiga oladi va mohiyatan eritma hisoblanadi.
Tabiatda sodir bo'ladigan jarayonlarning aksariyati, shuningdek, turli xil texnologik jarayonlarning asosi suyuqlik fazasida sodir bo'ladi. Shunday qilib kimyoviy reaksiyalar temir va po'lat eritishda ular asosan eritmalarda uchraydi. Suyuq temir va po'lat eritmalardir turli elementlar temirda. Yuqori va po'lat eritish pechlarida ular suyuq cüruf - oksidlar eritmasi bilan o'zaro ta'sir qiladi.
Tuzlar, kislotalar va asoslarning suvdagi eritmalari gidrometallurgiyada rudalardan rangli metallarni olishda keng qo‘llaniladi.
Eritma ikki yoki undan ortiq tarkibiy qismlardan tashkil topgan o'zgaruvchan tarkibli bir hil, bir hil tizimdir. Eritmalar har qanday agregatsiya holatida bo'lishi mumkin - qattiq, suyuq yoki gazsimon. Ularning umumiy xususiyati bir fazali.
Eritmalar tabiati va tarkibiy qismlarining zarralari o'rtasidagi o'zaro ta'sir tabiati bo'yicha juda xilma-xildir. Masalan, ko'p miqdorda issiqlik chiqishi bilan hosil bo'lgan sulfat kislotaning suvdagi eritmasi aniq aniq kimyoviy o'zaro ta'sir bilan tavsiflanadi va suyultirilgan gazlar - argon va neon eritmasida - jismoniy kuchlar. Ko'pgina real eritmalarda zarralar orasidagi o'zaro ta'sirning tabiati shunchalik murakkabki, uning kimyoviy va fizik tomonlarini ajratib bo'lmaydi.
Eritmaning tarkibiy qismlari erituvchi (o'rta) va erituvchida molekulalar, atomlar yoki ionlar shaklida bir xilda tarqalgan eritma (yoki bir nechta moddalar) dir. Erituvchi deganda odatda eritma bilan bir xil agregatsiya holatida bo'lgan modda tushuniladi. Agar eritmani tashkil etuvchi moddalarning agregat holati bir xil bo'lsa, u holda bu tizimda erituvchi ustunlik qiladi. Masalan, shakarning 5% li suvdagi eritmasida ikkinchisi erituvchi, shakar esa erigan moddadir. Umuman olganda, "erituvchi" va "erigan" tushunchalari ma'lum darajada shartli. Misol uchun, konsentrlangan eritmalarda erigan va erituvchi o'rtasidagi farq unchalik aniq emas. Etil spirti va suvning 50% eritmasi uchun tushunchalar teng, 95% spirt va 5% suv bo'lgan eritma uchun ikkinchisi erigan moddadir. Shuning uchun suyultirilgan (konsentrlangan bo'lmagan) eritmalarga qo'llanganda "erituvchi" va "erigan" tushunchalaridan foydalanish kerak. Elektrolitlar eritmalari uchun suv juda kichik bo'lsa ham, har doim hal qiluvchi hisoblanadi.
Eritmaning tarkibi yoki uning konsentratsiyasi turli usullar bilan ifodalanadi. Eritma konsentratsiyasini mol fraktsiyalarida ifodalash eng qulaydir.
mol fraktsiyasi N i mollar sonining nisbati i modda ( n i) gacha umumiy soni ma'lum miqdordagi eritmadagi barcha komponentlarning mollari S n i:
Suvli eritmalarda konsentratsiya odatda 1 litr eritmadagi erigan moddaning mollari soni sifatida ifodalanadi - molyar konsentratsiya ( FROM m):
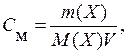 (6.2)
(6.2)
qayerda V- eritmaning hajmi, dm 3.
Biroq, molyar konsentratsiyadan foydalanish har doim ham qulay emas, chunki termal kengayish tufayli eritmaning konsentratsiyasi haroratga bog'liq. Shu munosabat bilan, molality ham tez-tez ishlatiladi. Molalite ( sm) 1000 g erituvchidagi erigan moddaning mollari soni:
 (6.3)
(6.3)
qayerda m 2 (X) erigan moddaning massasi, g; M(X) erigan moddaning molyar massasi, g/mol; m 1 - erituvchining massasi, g.
Suvli eritmalarda mol ulushi va molyarlik o'rtasida bog'liqlik mavjud
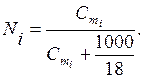 (6.4)
(6.4)
Eritmaga o'tgan modda eritmaning tarkibiy qismiga aylanadi, individualligini yo'qotadi.
Eritma xossalarini termodinamik kattaliklar bilan xarakterlash mumkin V, H, U, F, G va hokazo. Eritma tarkibiy qismlari molekulalari o'rtasidagi o'zaro ta'sir tufayli termodinamik xususiyatlarni uning tarkibidagi moddalarga emas, balki butun eritmaga tegishli bo'ladi. Shunday qilib, yechim aniq belgilangan, qulaylik bilan tavsiflanadi oddiy o'lchov hajmi, lekin unda alohida komponentlar qancha hajmlarni egallashini aniqlash mumkin emas.
Har qanday eritmada, masalan, sulfat kislotaning suvdagi eritmasida, sulfat kislota va suv molekulalarining energiyasi bilan bir qatorda, bu moddalar o'rtasida o'zaro ta'sir energiyasi mavjud bo'lib, u eritmani tavsiflaydi va uni hech biriga bog'lab bo'lmaydi. komponentlar. Biroq, bu komponent eritmaning u yoki bu xususiyatiga qanday nisbatda hissa qo'shishini tavsiflash hali ham muhimdir. Bunday xarakteristikaga qisman qiymat deyiladi.
G. Lyuis komponentning qisman molyar miqdorini qandaydir ekstensiv miqdorning qisman hosilasi deb atagan. g doimiy bosim, haroratda eritmaning ushbu komponentining mollari soniga va qolgan komponentlarning mollari soniga ko'ra:
![]() (6.5)
(6.5)
Ushbu ta'rif talab qiladigan shartlarga rioya qilish, masalan, ma'lum konsentratsiyali eritmaning juda katta hajmiga doimiy va T har qanday komponentdan 1 mol qo'shing. Bunday holda, eritmaning konsentratsiyasi amalda o'zgarmaydi va eritmaning tegishli o'zgarishi qo'shilgan komponentning qisman molyar qiymati bo'ladi.
Masalan, qisman molyar hajm tenglama bilan berilgan
![]() (6.6)
(6.6)
Agar eritma komponentlardan hajm o'zgarmagan holda hosil bo'lsa, unda qisman molyar hajm uning molyar hajmiga teng ekanligi aniq bo'ladi, ya'ni bu erda "nol" indeksi moddaning sof holatda ekanligini bildiradi. Molyar hajmdan farqli o'laroq, qisman molyar hajm salbiy qiymat bo'lishi mumkin, masalan, molekulyar o'zaro ta'sir tufayli, eritmaga komponent qo'shilganda, hajmning pasayishi sodir bo'lsa. Agar komponentlardan eritma hosil bo'lganda qo'shimchalar kuzatilsa, u holda, masalan, ikkilik eritma uchun n 1 birinchi komponentning mollari va n 2 ikkinchisining mollari:
![]() (6.7)
(6.7)
bu yerda va sof moddalarning mol ulushlari.
Shubhasiz, bu holda, eritma hosil bo'lganda
Agar, masalan, eritma hosil bo'lganda, entalpiya qo'shimchali bo'lsa, demak, eritma issiqlik effektisiz hosil bo'ladi. Agar boshlang'ich moddalarning entalpiyasi eritmaning entalpiyasidan katta bo'lsa, u holda eritma hosil bo'lganda issiqlik ajralib chiqadi. Aks holda, issiqlik so'riladi.
Qisman molyar miqdorlar orasida qisman molyar qiymat alohida ahamiyatga ega. erkin energiya
![]() (6.8)
(6.8)
Bu ko'pincha kimyoviy potentsial deb ham ataladi va belgilanadi
Kimyoviy potentsial harorat va bosim bilan birga intensiv miqdordir. Shunday qilib, tizimning turli qismlaridagi barcha komponentlarning haroratlari, bosimi va kimyoviy potentsiallarining tengligi issiqlik, mexanik va kimyoviy muvozanat shartlarini ifodalaydi (2.12-bo'limga qarang).
Qiymat moddaning ushbu fazani tark etish tendentsiyasini aks ettiradi va uning tarqalishining o'lchovidir. Keling, ikkita qo'shni bosqichni ko'rib chiqaylik - eritma va uning ustidagi bug '. Ushbu bosqichlarning har birida ma'lum bir komponent mavjud i. Muvozanat holatida
Agar, masalan, eritmadagi moddaning kimyoviy potentsiali gaz fazasidan kattaroq bo'lsa, u holda bu moddaning bug'lanishi sodir bo'ladi, bunda ![]() kamayadi va muvozanat o'rnatilguncha ortadi. Aks holda, komponentning o'tishi sodir bo'ladi i bug'dan eritmagacha.
kamayadi va muvozanat o'rnatilguncha ortadi. Aks holda, komponentning o'tishi sodir bo'ladi i bug'dan eritmagacha.
Qisman molyar qiymatlar eritmalarning xususiyatlarini tavsiflaydi. Eritmalardagi muvozanatlarni termodinamik hisoblashda ular mos keladigan funksiyalar bilan bir xil rol o'ynaydi ( U, H, F, G, S h.k.) sof moddalar orasidagi reaksiyalarga oid hisob-kitoblarda. Shu munosabat bilan qisman molyar miqdorlar jadvallarini tuzish maqsadga muvofiqdir. Berilgan komponentning qisman molyar qiymatini aniqlash uchun mos keladigan ekstensiv xususiyatning eritma tarkibiga doimiy bo'lgan bog'liqligini topish kerak. R jami, T va qolgan komponentlarning mollari soni va bu komponentning mollari soniga qarab farqlanadi. Ikkilik echimlar uchun bunday aniqlash odatda segment usuli yordamida grafik tarzda amalga oshiriladi. Buning uchun eritmaning bir mol xossasini hisoblang.
Eritmaning moli - bu har bir komponentning mollari soni uning mol ulushiga teng bo'lgan miqdor. Masalan, 0,1 mol uglerod va 0,9 mol temirni o'z ichiga olgan suyuq temirdagi bir mol uglerod eritmasi. Chunki atom massasi uglerod 12, temir esa 55,85 bo'lsa, bunday eritmaning bir molining massasi 12 × 0,1 + 55,85 × 0,9 = 51,465 g bo'ladi.
Yechim xossasi g, bir molga ishora qilib, indeks bilan belgilanadi. Masalan, bir mol eritmaning hajmi belgilanadi
Qisman molyar miqdorlarni aniqlashning grafik usuli shaklda ko'rsatilgan. 6.1. Birinchi va ikkinchi komponentlarning molyar kasrlari abscissa o'qi bo'ylab chizilgan ( N 1 va N 2). Nuqta O birinchi sof komponentga mos keladi; ayni paytda N 1= 1 va N 2= 0. Nuqta Taxminan 1 ikkinchi sof komponentga mos keladi; ayni paytda N 1= 0 va N 2= 1. Chiziqdagi har bir nuqta OO 1 ma'lum bir tarkibning eritmasiga mos keladi.
Bir mol eritmaning har qanday xossasining qiymati y o'qi bo'yicha chiziladi. AB egri chizig'i xossaning eritma tarkibiga bog'liqligini ifodalaydi. Agar eritma hosil bo`lish jarayonida uning xossasi qo`shimchali ravishda komponentlar xossalaridan tuzilgan bo`lsa, egri chiziq o`rniga bog`liqlik to`g`ri chiziq bilan ifodalanadi. OA va O 1 V segmentlari mos ravishda sof komponentlarning molyar xususiyatlarini ifodalaydi va
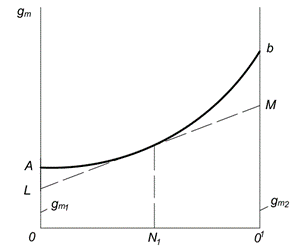
Guruch. 6.1. Qisman molyar qiymatlarni aniqlashning grafik usuli
Berilgan konsentratsiyali eritmadagi komponentlarning qisman molyar qiymatlarini topish uchun, masalan, tangens chizish kerak. LM egri chiziqqa AB OL va ordinata o'qlari ustidagi tangens bilan kesilgan Segmentdan tiklangan ordinataga mos keladigan nuqtada. taxminan 1 million, qisman miqdorlarga teng va
Yaxshi ishingizni bilimlar bazasiga yuborish oddiy. Quyidagi shakldan foydalaning
Talabalar, aspirantlar, bilimlar bazasidan o‘z o‘qishlarida va ishlarida foydalanayotgan yosh olimlar sizdan juda minnatdor bo‘lishadi.
http://www.allbest.ru/ saytida joylashgan
Kurs ishi
Qisman molyar miqdorlarni aniqlash
Kirish
2.1 Analitik usullar
2.2 Grafik usullar
3. Eksperimental qism
3.1 Asboblar va reaktivlar
4. Natijalar va muhokama
Xulosa
Adabiyotlar ro'yxati
Ilova
natijalar
Kirish
Tabiatda bir moddaning boshqa moddaning bir xil aralashmasi yoki bir nechta moddalar aralashmasi bo'lgan son-sanoqsiz tizimlar mavjud. Barcha tabiiy aralashmalarni ikki guruhga bo'lish mumkin:
1) komponentlar o'rtasida jismoniy interfeys mavjud bo'lgan aralashmalar. Bunday aralashmalar heterojen deyiladi. Geterogen tizimlar bir-biridan farq qiluvchi fazalardan iborat kimyoviy tarkibi va termodinamik xususiyatlar;
2) tarkibiy qismlar o'rtasida jismoniy interfeys mavjud bo'lmagan aralashmalar. Shuning uchun, ularning barcha qismlarida bunday tizimlar bir xil fizik va kimyoviy xususiyatlarga ega. Bunday tizimlar bir jinsli yoki eritmalar deb ataladi.
Eritma ikki yoki dan iborat bir hil sistemadir Ko'proq tarkibi doimiy ravishda ma'lum chegaralarda o'zgarishi mumkin bo'lgan komponentlar.
Eritmalar agregatsiyaning uchta holatida bo'lishi mumkin: gazsimon, suyuq va qattiq. Amalda u ko'pincha suyuq eritmalar bilan uchraydi. Suyuq eritmada erituvchi va erigan modda farqlanadi, garchi termodinamik nuqtai nazardan eritmaning barcha komponentlari ekvivalent bo'lsa ham. Erituvchi deganda eritmada ko'proq miqdorda mavjud bo'lgan modda tushuniladi. Ushbu maqolada suyuq eritmalar ko'rib chiqiladi.
Tuzilishi va jismoniy xususiyatlar suyuqliklar uni hosil qiluvchi zarrachalarning kimyoviy o'ziga xosligiga va ular orasidagi ta'sir qiluvchi kuchlarning tabiati va intensivligiga bog'liq. Suyuq tizimlarda ular paydo bo'ladi har xil turlari o'zaro ta'sirlar.
Tuzilishi bo'yicha suyuqlik holati oʻrtasida oraliq boʻladi qattiq holat kristall bo'ylab qat'iy belgilangan davriy tuzilishga ega va hech qanday tuzilishga ega bo'lmagan va zarrachalarning harakati tasodifiy bo'lgan gaz. Demak, suyuqlik, bir tomondan, ma'lum hajmning mavjudligi, ikkinchi tomondan, ma'lum bir shaklning yo'qligi bilan tavsiflanadi. Qattiqlashuv haroratiga yaqin suyuqlikda ichki strukturaning tartibliligi yanada aniqroq bo'ladi. Aksincha, suyuqlik qaynash nuqtasiga yaqinlashganda, buzilish nisbiy pozitsiya zarralar.
Suyuq eritmalar gazlarni, suyuqliklarni yoki eritish orqali olinishi mumkin qattiq moddalar tegishli suyuq erituvchida. Suyuq eritma hosil bo'lganda, erigan moddaga ma'lum bir tuzilishga ega bo'lgan suyuq erituvchi kiritilganda, erituvchiga qaraganda zarrachalarning boshqacha joylashishi bilan yangi struktura hosil bo'ladi. Bunday holda molekulalararo o'zaro ta'sir kuchlari o'zgaradi.
Suyuq eritmada o'zaro ta'sirdan tashqari, bir xil nomdagi molekulalar orasidagi o'zaro ta'sir qarama-qarshi nomdagi molekulalar orasida ham paydo bo'ladi. Molekulalarning o'zaro ta'siri ularning ionlarga parchalanishi bilan birga bo'lishi mumkin. Ionlarga parchalanish imkoniyati va darajasi erigan moddaning tabiati va erituvchining tabiati bilan belgilanadi. Ionlarga parchalanish dissotsilanish (ajralish) yoki ionlanish (ionlarning hosil bo'lishi) hodisasi bilan bog'liq. Shunday qilib, ionli birikmalar eritilganda dissotsiatsiya sodir bo'ladi.
Hosil bo'lgan ionlar va erituvchi molekulalari o'rtasidagi o'zaro ta'sir natijasida solvatlar (suvli eritmalarda - gidratlar) hosil bo'ladi. Ionni o'rab turgan erituvchi molekulalar to'plami solvat qobig'idir. Birlamchi va ikkilamchi solvatli qobiqlar mavjud. Birlamchi solvat qobig'i ionning eng yaqin erituvchi molekulalariga ta'siri natijasida hosil bo'lgan qobiq bo'lib, u mustaqil harakatini yo'qotadi va ion bilan birga harakat qiladi. Masalan, birlamchi solvatsiya qobig'i kvant mexanik hisob-kitoblariga ko'ra, har bir ionda 5 dan 7 gacha suv molekulalarini o'z ichiga oladi.
Molekulalar orasidagi o'zaro ta'sir ko'pincha boshqa, murakkabroq molekulalar - komplekslarning paydo bo'lishiga olib keladi.
Shunday qilib, echimlar juda ko'p murakkab tizimlar, bunda erigan modda alohida molekulalar yoki assotsiatsiyalar shaklida bo'lishi mumkin, bir nechta molekulalardan iborat yoki qisman yoki to'liq ionlarga ajraladi. Shu munosabat bilan eritmalar elektrolit bo'lmagan eritmalar va elektrolitlar eritmalariga bo'linadi.
Eritma issiqlikning chiqishi yoki yutilishi bilan birga keladi. Moddani eritganda, erigan modda va erituvchidagi molekulalar (atomlar yoki ionlar) o'rtasidagi aloqalar buziladi, bu energiya sarfi bilan bog'liq. Bir vaqtning o'zida hal qilish jarayoni davom etadi, ya'ni. erigan moddaning zarralari va erituvchi o'rtasida bog'lanish mavjud. Bunda energiya ajralib chiqadi. Eritmaning umumiy energiya ta'siri, chiqarilgan va so'rilgan energiya miqdorining nisbatiga qarab, ijobiy yoki salbiy bo'lishi mumkin.
Energiya ta'siridan tashqari, eritma aralash komponentlar hajmining o'zgarishi bilan birga keladi. Masalan, spirtni suvda eritganda, eritmaning hajmi solvatlar hosil bo'lishi sababli olingan moddalarning umumiy hajmiga nisbatan taxminan 3,5% ga kamayadi.
Eritilganda ba'zan eritma rangining o'zgarishi kuzatiladi.
Ushbu ishning maqsadi erishning integral va qisman molyar issiqliklarini aniqlashdir turli moddalar va integral erish issiqligining eritma tarkibiga bog'liqligi uchun interpolyatsiya tenglamasini chiqarish.
Ish vazifalari:
1) Kalorimetrik o'lchovlardan foydalanib, hosil bo'lgan eritmaning turli konsentratsiyalari uchun integral erish issiqligining qiymatlarini aniqlang;
3) erish issiqligining eritma tarkibiga bog’liqligini grafigini tuzing.
1. Qisman molyar kattaliklar va ularning eritmalar termodinamikasidagi ahamiyati
Qisman molyar kattaliklar - bu eritmalar xossalarining konsentratsiyaga bog'liqligini tavsiflash uchun ishlatiladigan termodinamik kattaliklar. M - h komponentlar sistemasi holatining qandaydir keng funksiyasi, ya'ni tizimning massasiga (hajm, ichki energiya, entalpiya, entropiya, Gibbs energiyasi, Gelmgolts energiyasi, issiqlik sig'imi va boshqalar) bog'liq bo'lgan xususiyat bo'lsin. . i-komponent uchun qisman molyar qiymati Z quyidagi munosabat bilan aniqlanadi:
bular. i at komponentining mollar soniga nisbatan M ning hosilasiga teng doimiy harorat T, bosim p va boshqa barcha komponentlarning mol raqamlari. Shunday qilib, qisman molyar hajm
bu erda V - tizimning hajmi; qisman molyar Gibbs energiyasi (kimyoviy potentsial)
Bu erda G - tizimning Gibbs energiyasi.
Qisman molyar qiymat T, p doimiyligi va boshqa barcha komponentlarning mollari soni sharoitida cheksiz ko'p miqdordagi eritmaga 1 mol i komponent qo'shilganda M qiymatining o'zgarishini tavsiflaydi. Agar komponentning x i molyar ulushi birga teng bo'lsa, u holda qisman molyar qiymati Z alohida modda uchun M m molyar qiymatiga aylanadi (masalan, komponentning qisman molyar hajmi molyar hajmga aylanadi). Z ning qiymati faqat i-komponentning tabiati bilan emas, balki butun tizimning xususiyatlari bilan ham belgilanadi, chunki i-komponentning molekulalari boshqa barcha molekulalar bilan o'zaro ta'sir qiladi; bilvosita, bu qiymat i-komponent kiritilganda tizim xususiyatlaridagi barcha o'zgarishlarni hisobga oladi.
Haqiqiy eritmada, umuman olganda, barcha qisman molyar miqdorlar tarkibga, bosimga va haroratga bog'liq. Agar eritma ideal bo'lsa, u holda berilgan T va p da qisman molyar hajm, ichki energiya, entalpiya va issiqlik sig'imi konsentratsiya oralig'ida doimiy bo'lib, sof komponentlarning mos keladigan molyar qiymatlariga to'g'ri keladi. Kimyoviy potentsial m i id va qisman molyar entropiya S i id sof moddaning tegishli molyar qiymatlari - Gibbs energiyasi va entropiyasi bilan quyidagi munosabatlarga bog'liq:
Bu erda R - gaz doimiysi.
Qisman molyar miqdorlarning T va p ga bog'liqligi mos keladigan keng xususiyatlar bilan bir xil termodinamik munosabatlar bilan belgilanadi. Shunday qilib, kimyoviy potentsial m i uchun Gibbs energiyasi uchun amal qiladigan munosabatlarga o'xshash munosabatlar amalga oshiriladi, xususan:
Butun tizim uchun M funktsiyasi komponentlarning qisman molyar qiymatlarining mos keladigan mollar soniga ko'paytirilgan yig'indisidir. Xususan, tizimning Gibbs energiyasi. Molar (maxsus) qiymat: . Qisman molyar miqdorlarni topish uchun M m ning molyar qiymatining T, p, x 1, ... , x n-1 ga bog’liqliklari qo’llaniladi:
Tizim holatining o'zgarishi bilan qisman molyar miqdorlarning o'zgarishi Gibbs-Dyuhem tenglamasi bilan o'zaro bog'liq bo'lib, u umumlashtirilgan shaklda quyidagicha yoziladi:
T da, p = const (izobarik-izotermik shartlar):
Ushbu tenglamaga ko'ra, ikkilik tizimda M 1 va M 2 qisman molyar miqdorlar tarkibi o'zgarganda qarama-qarshi yo'nalishda o'zgaradi. M 1 (x 1) va M 2 (x 1) egri chiziqlaridagi ekstremallar, agar mavjud bo'lsa, bir xil tarkibda kuzatiladi va turga qarama-qarshidir. Masalan, kimyoviy potentsiallar uchun
T uchun p = const
Ushbu nisbat qolgan komponentlarning kimyoviy potentsiallarining konsentratsiyaga bog'liqligi asosida eritma komponentining kimyoviy potentsialini hisoblash uchun ishlatiladi, shuningdek, kimyoviy potentsiallarning tarkibga, haroratga bog'liqligi bo'yicha eksperimental ma'lumotlarning termodinamik izchilligini tekshirish uchun ishlatiladi. va boshqalar.
2. Qisman molyar miqdorlarni aniqlash usullari
Qisman molyar qiymatlarni aniqlash uchun eritmaning umumiy ekstensiv xususiyatining uning tarkibiga bog'liqligi yoki tarkibiy qismlardan birining qisman molyar qiymatining eritma tarkibiga bog'liqligi zarur.
Qisman molyar miqdorlarni aniqlash usullari analitik va grafiklarga bo'linadi.
2.1 Analitik usullar
Agar eritmaning umumiy ekstensiv xossasining har bir komponentning mollari soniga bog'liqligi, masalan, interpolyatsiya tenglamasi ko'rinishida ma'lum bo'lsa, qisman molyar kattaliklar ekstensiv xususiyat uchun interpolyatsiya tenglamasini differensiallash yo'li bilan aniqlanadi. ushbu komponentning mollari soniga nisbatan.
Tegishli qiymatni hosil bo'lgan tenglamaga almashtirib, ma'lum bir tarkibli eritma uchun ushbu komponentning qisman molyar qiymatini hisoblang.
Bir qator hollarda fizik-kimyoviy usullar funktsiyalardan faqat bittasini topishga imkon beradi - . Masalan, uchuvchan bo'lmagan eritmalar eritmalarining bug' bosimidan faqat erituvchining qisman qiymatini topish mumkin. Agar bitta komponentning qisman molyar qiymatining eritma tarkibiga bog'liqligi ma'lum bo'lsa, ikkinchi komponentning qisman molyar qiymatini Gibbs-Dyuhem tenglamasi yordamida hisoblash mumkin.
Ikkilik eritma uchun erituvchining mol ulushi x 1, erigan moddaning mol ulushi x 2 yoki x ga teng.
Masalan, x qiymatlarining butun diapazonida ma'lum bo'lsin. Tenglamadan
quyidagicha:
X = 1 tarkibidan ixtiyoriy x = b qiymatiga integrallash qulay:
Bu sof ikkinchi komponentning molyar qiymati bo'lib, uni o'rganilayotgan eritmaning xossalaridan mustaqil ravishda o'lchash mumkin. Bunday holda, miqdorning (0) chegara qiymatini bilish kerak, ya'ni. x>1 uchun.
2.2 Grafik usullar
Grafik farqlash usuli
Eksperimental ma'lumotlarga ko'ra qisman molyar qiymatlarni aniqlash uchun eritmaning umumiy ekstensiv xususiyatining ma'lum bir komponentning mollari soniga bog'liqligi grafigi tuziladi.
Egri chiziqqa tangens burchagining har qanday nuqtadagi tangensi ushbu kompozitsiyaning eritmasida ushbu komponentning qisman molyar qiymatiga mos keladi, chunki
Bu usul tangenslarni chizishda yuzaga kelishi mumkin bo'lgan xatolar tufayli etarli darajada aniq emas va qisman molyar miqdorlardan faqat bittasini aniqlash imkonini beradi.
Segment usuli.
Segment usuli ikkilik eritmalarning qisman molyar qiymatlarini aniqlash uchun ishlatiladi. Z ekstensiv xossasining bir mol eritma uchun tarkibga bog‘liqligi tajriba yo‘li bilan aniqlanadi va Z - x koordinatalarida grafik chiziladi, bunda x ikkinchi komponentning mol ulushi. Grafik turi har qanday bo'lishi mumkin. Vazifa 0 ning barcha qiymatlari uchun va qiymatlarini topishdir? x? 1. Ta'rifdan = + = + . Tenglamada ikkita noma'lum narsa bor - va tajribadan ma'lum bo'lgan qiymat. Ta'rif uchun zarur bo'lgan va ikkinchi tenglama x ga nisbatan differensiallash orqali olinadi.
Oldingi tenglamalarni hisobga olgan holda, oxirgi ikki hadning yig'indisi 0 ga teng, keyin esa
Bog'liqlik grafigining sifatli tahlili shuni ko'rsatadiki, egri chiziqqa teginish bilan kesilgan segmentlar kerakli qiymatlar va. Abscissa bitta segment bo'lganligi sababli, nishabning tangensi segmentga teng va bu qiymatlar farqidir.
Har qanday kompozitsiyaning eritmasi uchun
va qiymatlarini eksperimental egri chiziqdan topish mumkin.
Bir komponentning qisman molyar qiymatini ikkinchi komponentning qisman molyar qiymatlarining ma'lum qiymatlaridan grafik tarzda aniqlash.
Tenglama
qisman molyar qiymatlarni grafik tarzda aniqlash uchun ishlatilishi mumkin. Qachon grafik integratsiya koordinatalarda grafik qurish uchun qulay. Keyin:
ga bog'liqlik egri chizig'i va abscissa o'qi bilan chegaralangan maydon bilan osongina aniqlanadi. Agar mustaqil manbalardan ma'lum bo'lsa, unda umumiy qiymatni topish mumkin
2.3 Integral erish issiqligining tarkibga interpolyatsiya bog'liqligini hosil qilish.
Eritmaning integral issiqligining erigan moddaning mollari soniga bog'liqligini empirik tenglama bilan ifodalaymiz.
bu yerda a,b,c empirik konstantalar. Keyin
Keling, koordinatalarda grafik tuzamiz, uning nuqtalarini ekstrapolyatsiya qilamiz. Y o'qi bo'yicha kesilgan segment b ga teng, tangensning egri nuqtaga qiyaligi tangensi 2c ga teng. Erigan moddaning ma'lum miqdordagi mollari n 2 bo'lgan eritma uchun integral erish issiqligini bilib, tenglamadan a doimiysini topamiz.
3. Eksperimental qism
3.1 Asboblar va reaktivlar
1. Kompyuterga ulangan ULC "Termostat" moduli.
2. 100 ml lik stakan.
5. NaNO 3 kimyoviy jihatdan toza.
7. NH 4 Cl kimyoviy jihatdan toza.
3.2 Kompyuter yordamida ULC boshqaruvi
1. Universal kontroller ulanadi shaxsiy kompyuter MAQOMOTI porti orqali maxsus ulanish kabeli orqali.
2. Tekshirish moslamasi yoqilganda, ULC "Kimyo" - elsms2.exe boshqaruv dasturini ishga tushirish kerak.
3. Ko'rsatilgan ishga tushirish oynasida ("ULC-ga xush kelibsiz") siz ULC bilan ishlash variantini tanlashingiz kerak - "Controller bilan ishlash" yoki "Ishni yuklash" va "Enter" tugmasini bosib ULC boshqaruv dasturiga kiring. . Vazifani yuklash ni tanlaganingizda, avval saqlangan laboratoriyani yuklashingiz mumkin.
5. Tajriba davomida harorat o'lchanadi, shuning uchun tegishli oynada o'lchov oralig'ini va o'lchovlar sonini belgilashingiz kerak.
6. O'lchov aralashtirish bilan amalga oshirilganligi sababli, aralashtirish intensivligini (masalan, 3) o'rnatish va "Stirrer" tugmasi bilan aralashtirgichni yoqish kerak.
7. Ish jarayonida bir nechta tajribalar o'tkazilishi mumkin, shuning uchun har bir tajriba uchun, masalan, namunaning og'irligini ko'rsatish kerak. (So'ngra grafikning yuqori o'ng burchagida namunaning og'irligi ko'rsatiladi.) Buning uchun "Qo'shimcha parametr" elementlari guruhida "Umumiy" bandini tanlang va "Qiymat" maydonida og'irlikni belgilang. namunadan. O'lcham "O'lchov" maydonida ko'rsatilgan.
8. O'lchov "O'lchov" tugmachasini yoqish orqali boshlanadi. Bunday holda, o'lchov holati oynasi paydo bo'ladi - "Kontrolör bilan ma'lumotlar almashinuvi".
9. O'lchov tuz eriganidan keyin, harorat o'zgarishi kichik va bir xil bo'lganda bajarilishi kerak. O'lchov "STOP" tugmasini bosish bilan yakunlanadi. Bunday holda, eksperimental ma'lumotlar avtomatik ravishda saqlanadi va o'rnatish boshqaruv rejimiga o'tadi. Quyidagi o'lchovlarni amalga oshirish uchun "Joriy holat" tugmasini bosish va paragraflarga muvofiq ishlarni bajarish kerak. 5 - 8.
3.3 Ishni qanday bajarish kerak
Eritilishning integral issiqliklarini aniqlash kalorimetr konstantasini aniqlashdan boshlanadi. Buning uchun 100 sm3 distillangan suv bilan to'ldirilgan stakan kalorimetrga joylashtiriladi va uning ichiga harorat sensori o'rnatilgan qopqoq bilan yopiladi. Qopqoqning teshigiga maxsus probirka solinadi, unga oldindan ma'lum erish issiqligi (NH 4 Cl) bo'lgan 2 g maydalangan tuz quyiladi. Kalorimetrik tajriba o'tkazing va haroratning o'zgarishini qayd eting. Keyin stakandan eritma quyiladi, stakan chayiladi, ichiga 100 ml distillangan suv quyiladi va kalorimetrga solinadi. Haroratning o'zgarishini fiksatsiya qilishda 2 g tekshirilgan tuzning erishini sarflang. Xuddi shunday 4, 6, 8, 10, 12, 16, 20 g o'rganilgan tuzni eritishni amalga oshiring.
4. Natijalar va muhokama
Qisman molyar erish issiqliklarini aniqlash issiqlik balansi tenglamasi bilan amalga oshiriladi:
qayerda va mos ravishda suv va tuzning massasi g;
c - hosil bo'lgan eritmaning issiqlik sig'imi, J / (HMA). Past konsentratsiyalarda eritmaning issiqlik sig'imi taxminan suvning issiqlik sig'imiga teng bo'lishi mumkin. Yuqori konsentratsiyalarda eritmaning issiqlik sig'imi mos yozuvlar ma'lumotlaridan aniqlanishi mumkin. Kalorimetr konstantasi quyidagi formula bilan aniqlanadi:
KCl ning qisman molyar issiqligini aniqlash:
NaCl ning qisman molyar issiqligini aniqlash:
NaNO 3 ning qisman molyar issiqligini aniqlash:
, (tajriba o'sha kuni o'tkazildi)
KNO 3 qisman molyar issiqlikni aniqlash:
Xulosa
Kalorimetrik o'lchovlar yordamida biz hosil bo'lgan eritmaning turli konsentratsiyalari uchun integral erish issiqliklarining qiymatini aniqladik, qisman erish issiqliklarini hisobladik, erish issiqligining eritma tarkibiga bog'liqligini chizdik.
Adabiyotlar ro'yxati
qisman molyar interpolyatsiya integrali
1. Stromberg A.G., Semchenko D.P. Fizik kimyo. - M.: Kimyo, 1999 yil.
2. Fizikaviy va kimyoviy miqdorlarning qisqacha ma'lumotnomasi / ed. A.A. Ravdel, A.M. Ponomereva. - L .: Kimyo, 1983 yil.
3. Fizik kimyo: I.A. Semioxin - Moskva, MDU nashriyoti, 2001 yil
4. Elektrolitlarning termodinamik xossalari: Vasilev V.P. - M. Kimyo 1982 yil.
5. Fizikaviy kimyo. Nazariy va amaliy qo'llanma: Nikolskiy B.P. - 1987 yil
6. Fizik kimyo asoslari: Gorshkov V.I. - 1993 yil
7. Qisqa kurs Fizik kimyo: Kochergin S.M. - 1978 yil
8. Fizik kimyo: Juxovitskiy A.A. - 1987 yil
9. Jismoniy va kolloid kimyo: Kuznetsov V.V. - 1968 yil
10. http://www.xumuk.ru
Ilova
natijalar
NH 4 Cl 2g (kalorimetr doimiy aniqlash) DT = -1,207
KCl 2g DT= -0,9746
KCl 4g DT= -2,333
KCl 6g DT= -2,851
KCl 8g DT = -3,843
KCl 10g DT= -4,738
KCl 12g DT= -5,706
KCl 16g DT = -7,459
KCl 20g DT= -9,314
NH 4 Cl 2g (kolorimetr konstantasini aniqlash) DT \u003d -1,098
NaCl 2g DT= -0,2461
NaCl 4g DT= -0,5072
NaCl 6g DT= -0,6789
NaCl 8g DT= -0,8499
NaCl 10g DT= -1,008
NaCl 12g DT= -1,125
NaCl 16g DT = -1,303
NaCl 20g DT= -1,397
NaNO 3 2g DT = -0,7792
NaNO 3 4g DT= -1,616
NaNO 3 6g DT = -2,333
NaNO 3 8g DT = -3,143
NaNO 3 10g DT= -3,745
NaNO 3 12g DT = -4,222
NaNO 3 16g DT = -5,253
NaNO 3 20g DT= -6,436
NH 4 Cl 2g (kolorimetr konstantasini aniqlash) DT \u003d -1,162
KNO 3 2g DT= -1,164
KNO 3 4g DT= -2,334
KNO 3 6g DT= -3,415
KNO 3 8g DT= -0,725
KNO 3 10g DT= -4,878
KNO 3 12g DT= -5,954
KNO 3 16g DT= -7,369
NH 4 Cl (kolorimetr konstantasini aniqlash) DT= -1,085
KNO 3 20g DT= -4,575
DH ning n i ga nisbatan diagrammasi (KCl)
DH ning n i ga nisbatan diagrammasi (NaCl)
DH ning n i ga nisbatan diagrammasi (NaNO 3)
DH ning n i ga nisbatan diagrammasi (KNO 3)
Allbest.ru saytida joylashgan
...Shunga o'xshash hujjatlar
Yechimlar nazariyasini rivojlantirishning asosiy yo'nalishlari. Termodinamik sharoitlar eritma hosil bo'lishi. Qisman molyar miqdorlarni aniqlash usullari. Raul qonuni, o'ta suyultirilgan va ideal bo'lmagan eritmalar. Azeotrop aralashmalar va Gibbs-Konovalov qonunlari.
kurs qog'ozi, 24/12/2014 qo'shilgan
Berilgan miqdordagi propanning to'liq yonishi uchun zarur bo'lgan havo hajmini aniqlash. Gess qonunining oqibatlaridan foydalanib, entalpiya, entropiya va Gibbs energiyasining o'zgarishini hisoblash. Ta'rif molyar massalar oksidlovchi va qaytaruvchi moddaning ekvivalentlari.
test, 02/08/2012 qo'shilgan
Eritma tarkibiy qismlarining qisman molyar xossalari haqidagi nazariy ma'lumotlarni ko'rib chiqish. Binar eritmada hajm, entropiya, entalpiya va issiqlik sig’imini aniqlash. Har xil konsentratsiyali tekshirilayotgan moddaning suvli eritmalarining massa zichligini hisoblash.
o'quv qo'llanma, 24/05/2012 qo'shilgan
Kislorodsiz oksidlovchi bilan eritmalardagi mis elektroddagi qisman katod va anodik reaktsiyalarning o'zaro bog'liqligi belgisi o'zgaruvchan polarizatsiya. Misning xlorid va sulfat muhitida anodda erishi. Kislotalangan sulfat muhitida erishi.
dissertatsiya, 12/13/2015 qo'shilgan
Litiy tetrafloroboratning propilen karbonatdagi suyultirilgan eritmalarining elektr o'tkazuvchanligini o'lchash. Cheklovchi molyar elektr o'tkazuvchanlik va assotsiatsiya konstantalarini hisoblash. Ta'rif miqdoriy xarakteristikalar ion-molekulyar o'zaro ta'sirlar.
muddatli ish, 28.10.2011 qo'shilgan
Polimer eritmalarini tayyorlash: polimerni eritish jarayoni; eritmalarni filtrlash va havosizlantirish. Polimer eritma plyonkalarini ishlab chiqarish bosqichlari. Plastifikatorlarga qo'yiladigan umumiy talablar. Kalıplama uchun eritma tayyorlash. Suyuq plyonka hosil bo'lishi.
muddatli ish, 01/04/2010 qo'shilgan
Ideal siljish reaktori. To'liq aralashtirish reaktori. SO oksidlanish tezligining o'zgarishi. Adiyabatik koeffitsient orqali harorat o'zgarishini hisoblash. Moddalarning muvozanat konsentrasiyalarini, muvozanat konstantalarini hisoblash. hisoblash qisman bosimlar.
muddatli ish, 2012-11-20 qo'shilgan
Eritmalarning ta'rifi, ularning turlariga qarab agregatsiya holati erituvchi, erigan moddaning zarrachalarining o'lchamiga ko'ra. Konsentratsiyani ifodalash usullari. Eruvchanlikka ta'sir qiluvchi omillar. eritish mexanizmi. Raul qonuni va uning natijasi.
taqdimot, 2013 yil 08/11 qo'shilgan
Monokristallarni o'stirish jarayonining muvozanat konstantasini hisoblash. Cd va Te komponentlarini sublimatsiya jarayoni. Komponentlarning qisman bug' bosimini hisoblash. Reaktorning sxematik diagrammasi va harorat taqsimoti. Komponentlarning oksidlanish ehtimolini baholash.
dissertatsiya, 12/11/2016 qo'shilgan
Xatolarni ifodalash usuliga, yuzaga kelish manbasiga va tajriba sharoitiga qarab tasniflash. Umumiy parametrlarni baholash va taqsimlash tasodifiy o'zgaruvchilar. Qo'pol xatolarni bartaraf etish usullari. Ikki xillikni taqqoslash.
Komponentlardan eritma hosil bo'lishi spontan jarayondir. Shuning uchun eritma hosil bo'lishining termodinamik sharti at P= const va T= const Gibbs energiyasining yo'qolishi D G < 0. Такой процесс будет протекать самопроизвольно до тех пор, пока в системе не установится равновесие: растворяемый компонент (т, ж, г) растворяемый компонент (раствор). При равновесии ΔG= 0. Istisno - termodinamik jihatdan beqaror o'ta to'yingan eritmalar. Termodinamika nuqtai nazaridan sof erigan moddaning (qattiq, suyuq, gazsimon) kimyoviy potentsiali shu moddaning eritmadagi kimyoviy potensialiga teng bo'lganda eritma to'yingan deb ataladi.
Eritma hosil bo'lganda Gibbs energiyasining kamayishi ham entalpiya, ham entropiya hissasiga bog'liq bo'lishi mumkin, chunki D G= Δ H– TΔ S.
Eritmalarga termodinamik yondashuvning o'ziga xos xususiyati shundaki, u eritmalardagi o'zaro ta'sirning molekulyar mexanizmi haqida g'oyalarni talab qilmaydi. Ushbu yondashuvdagi asosiy masala eritmalar xossalarining uning tarkibiy qismlarining tarkibi va xususiyatlariga bog'liqligini aniqlashdir. Bunday qaramlikni o'rnatish uchun qisman molyar miqdorlar qo'llaniladi.
§ 5.5. Qisman molyar miqdorlar
Miqdorini aniqlash mumkin bo'lgan ko'pgina xususiyatlarni keng va intensiv ikki guruhga bo'lish mumkin.
keng qamrovli xossalari moddalar miqdoriga mutanosibdir. Bularga, masalan, hajm ( V umumiy), massa, ichki energiya ( U umumiy), entropiya ( S umumiy), entalpiya ( H umumiy), Gibbs energiyasi ( G umumiy) va boshqalar.Demak, ikkita bir xil metall boʻlagining ichki energiyasi bir boʻlakning energiyasidan ikki barobar koʻp boʻladi.Tizimning ekstensiv xossalari uning tarkibiy qismlarining ekstensiv xossalaridan qoʻshimcha ravishda qoʻshiladi.
shiddatli moddaning miqdoriga bog'liq bo'lmagan xususiyatlar (masalan, harorat va bosim) deb ataladi. Eritmalar uchun intensiv xususiyatlar tarkibi bilan belgilanadi. Masalan, eritma ustidagi komponentning bug 'bosimi uning konsentratsiyasiga bog'liq.Tizimning turli qismlarida intensiv xususiyatlarning qiymatlari tenglashadi. Intensiv miqdorni o'lchash uning o'zgarishi har doim qandaydir ekstensiv miqdorning o'zgarishi bilan birga bo'lishiga asoslanadi. Shunday qilib, haroratni o'lchash uchun moddaning hajmining o'zgarishi, masalan, simob ishlatiladi, ya'ni. keng ko'lamli mulk.
Erituvchi va erigan moddadan tashkil topgan ikki komponentli eritmani ko'rib chiqing. Uning har qanday keng ko'lamli xususiyatlari X umumiy, mollar soniga bog'liq P 1 erituvchi, mol P 2 erigan modda, bosim R va harorat T:
Belgilamoq
|
|
Qisman molyar qiymat i-eritmaning uchinchi komponenti (  ) qandaydir ekstensiv miqdorning qisman hosilasi deyiladi ( X umumiy) ushbu komponentning mollari soni bo'yicha ( n i) da doimiy bosim, harorat va boshqa komponentlarning mollari soni.
) qandaydir ekstensiv miqdorning qisman hosilasi deyiladi ( X umumiy) ushbu komponentning mollari soni bo'yicha ( n i) da doimiy bosim, harorat va boshqa komponentlarning mollari soni.
Xuddi shu fikrni boshqa shaklda ham ifodalash mumkin: qisman molyar miqdor i-chi komponent - bir mol qo'shilganda eritmaning bu keng xususiyatining o'zgarishi i th komponent doimiy bosim va haroratda ko'p miqdorda eritma. Katta miqdordagi eritma bir mol qo'shilishi demakdir i th komponenti eritma tarkibini amalda o'zgartirmaydi.
Sof modda uchun qisman molyar qiymat sof moddaning xususiyatiga teng
|
|
bu erda "nol" indeksi moddaning sof holatda ekanligini bildiradi.
Eritmaning termodinamik xossalari G umumiy ,
H umumiy ,
S umumiy ,
V umumiy va boshqalar qisman molyar miqdorlarga mos keladi i--chi komponent:  qisman molyar Gibbs energiyasi;
qisman molyar Gibbs energiyasi; 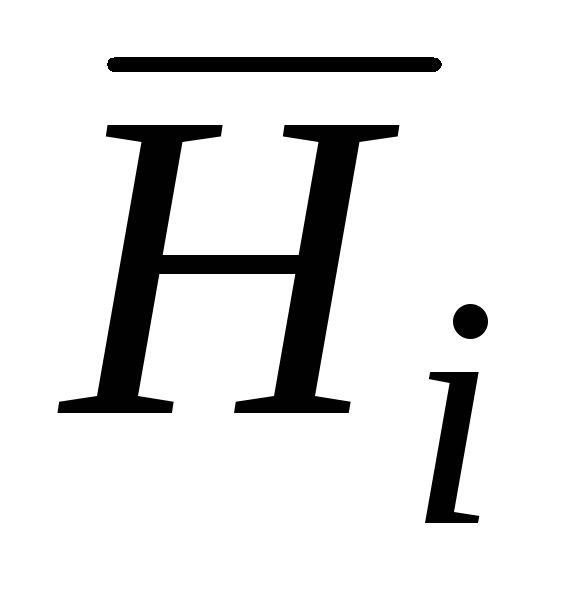 qisman molyar entalpiya hisoblanadi;
qisman molyar entalpiya hisoblanadi; 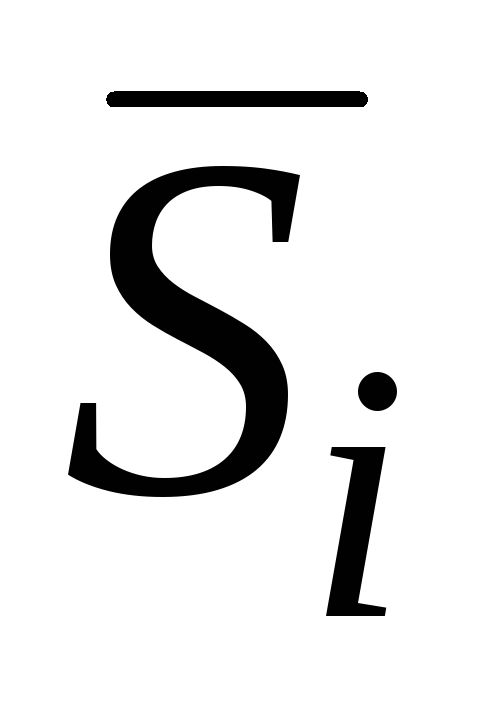 qisman molyar entropiya;
qisman molyar entropiya;  - qisman molyar hajm va boshqalar.
- qisman molyar hajm va boshqalar.
Qisman molyar miqdorlar orasida eng muhimi qisman molyar Gibbs energiyasidir 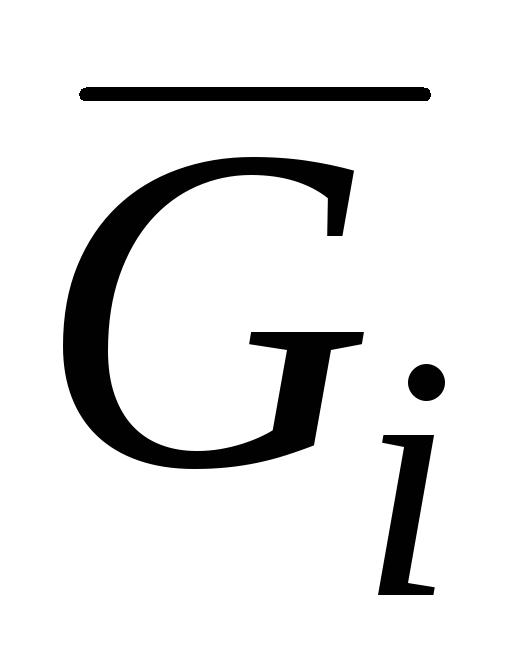 , bu kimyoviy potentsial bilan bir xil:
, bu kimyoviy potentsial bilan bir xil:
|
|
bu tenglamalarni taqqoslashdan kelib chiqadi (3.3) va (5.6) .
Qisman molyar miqdorlarning amaliy ahamiyati shundan iboratki, ular o'rtasida oddiy termodinamik kattaliklar o'rtasidagi kabi shakldagi bir xil termodinamik munosabatlar saqlanib qoladi.
Masalan, tenglamada Gibbs energiyasi bo'lsa () (G= H– TS) mol soniga nisbatan hosilani oling n i doimiylik bilan P, T va n j, olamiz
|
| |||||
|
μ i
|
kimyoviy potentsial i-chi komponent; qisman molyar Gibbs energiyasi i-chi komponent; qisman molyar entalpiya i-chi komponent; qisman molyar entropiya i-chi komponent. |
||||
Shunday qilib, qisman molyar miqdorlar yordamida eritmalarga sof modda uchun kimyoviy termodinamikaning butun matematik apparatini qo'llash mumkin. Bu termodinamik tenglamalar orqali eritmaning har qanday muvozanat xususiyatlarini ifodalash imkonini beradi, jumladan eritma ustidagi komponentlarning bug 'bosimi, muzlash haroratining pasayishi va eritmaning qaynash haroratining oshishi, moddalarning eruvchanligi, osmotik bosim, moddaning ikki aralashmaydigan erituvchilar o'rtasida taqsimlanishi va boshqalar.
Eritma tarkibiy qismlarining qisman molyar qiymatlari o'rtasidagi munosabatlarni olish uchun biz tenglamani birlashtiramiz. (5.7) eritmaning doimiy tarkibida. Bu holat har ikkala komponentning eritmaga kichik qismlarda va eritmaning tarkibi o'zgarmaydigan nisbatda qo'shilishini bildiradi (ya'ni, bir xil konsentratsiyali eritmaning oz miqdori qo'shiladi). Keyin qisman molyar miqdorlar doimiy bo'lib qoladi. Qayerda
|
|
Bu tenglamadagi integratsiya doimiysi nolga teng, chunki at P 1 = 0 va P 2 = 0 minomyot mulki X umumiy ham nolga teng.
Shunday qilib, har qanday keng ko'lamli xususiyatni har qanday eritma uchun komponentlarning xususiyatlaridan qo'shimchalar qo'shish orqali topish mumkin, agar molyar emas, balki qisman molyar qiymatlar qo'llanilsa.
Ammo, agar eritmaning miqdori ham, tarkibi ham bir vaqtning o'zida o'zgartirilsa, u holda xususiyatning o'zgarishi X umumiy tenglamani differensiallash orqali topish mumkin (5.10) :
Biz tenglamalarning ikkala tomonini ajratamiz (5.10) va (5.12) ustida P 1 + P 2. Sharti bilan; inobatga olgan holda
mos ravishda olamiz
eritma mol uning miqdori deb ataladi, bunda har bir komponentning mollari soni uning mol ulushiga teng.
ning yechimi uchun i Komponentlarni yig'ish hamma bo'yicha bajarilishi kerak i komponentlar:
Eritmaning keng xususiyatlarining o'zgarishini tavsiflovchi qisman molyar miqdorlar, xususiyatlarning o'zidan farqli o'laroq, ijobiy va salbiy bo'lishi mumkin. Agar eritma komponentlardan hajm o'zgarmagan holda hosil bo'lsa, unda komponentning qisman molyar hajmi uning molyar hajmiga teng ekanligi aniq. Agar kuchli molekulyar o'zaro ta'sir tufayli, eritmaga komponent qo'shilganda, hajmning pasayishi sodir bo'lsa, u holda qisman molyar hajm manfiy qiymat bo'ladi.
Ikkilik tizimlarning qisman molyar qiymatlari analitik va grafik usullar bilan aniqlanishi mumkin. Eng ko'p ishlatiladigan grafik usuli segmentlar. Buning uchun eksperimental ma'lumotlarga ko'ra, ekstensiv xususiyatning grafik bog'liqligi, masalan, eritmaning molyar hajmining kompozitsiyaga bog'liqligi quriladi (5.1-rasm).
Keyin, berilgan kompozitsiya bilan (masalan, nuqtada LEKIN) egri chiziqqa tangens chizamiz. Ushbu tangensning nuqtalardagi ordinat o'qlari bilan kesishishi DA va FROM qisman molyar miqdorlarning qiymatlarini beradi 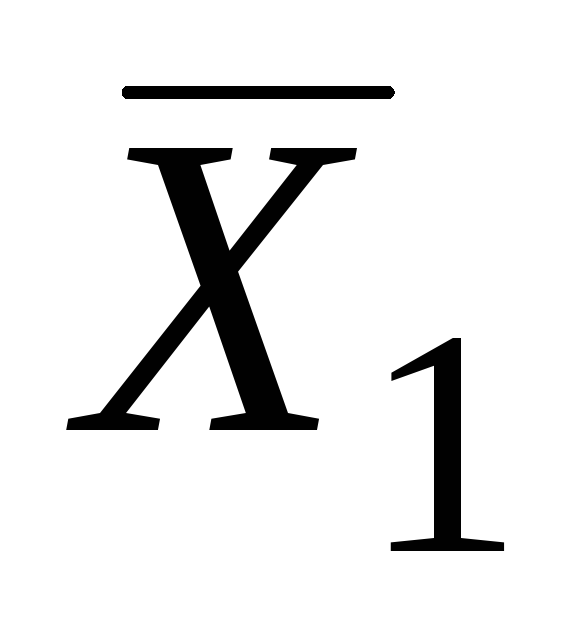 va
va 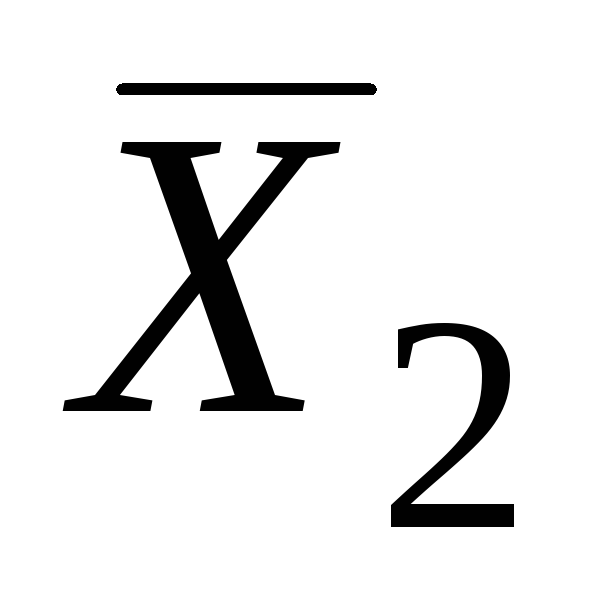 .
.
Qisman molyar qiymatlarni eritmaning xususiyatlariga bog'liqligidan ham aniqlash mumkin X doimiy harorat bosimida erigan komponentning mollari soni va erituvchi miqdori bo'yicha. Grafikdagi egri chiziqqa tangens qiyaligining tangensi X umumiy = f(n 2) qisman molyar qiymatga teng.

Bir komponentning qisman molyar qiymati tenglamadan hisoblanishi mumkin (5.14) , ikkinchisining qisman molyar kattaligini bilish:
|
Ushbu tenglamani integratsiyalashganda, biz olamiz
| ||||
|
|
tizimning turli tarkibi uchun qisman molyar qiymatlar. |
|||
Integralning qiymati koordinatalarda chizilgan grafikdan topiladi  .
.