Moddaning kimyoviy salohiyati. Kimyoviy salohiyat
Tizimdagi zarrachalar sonini o'zgartirganda va xususiyatlarini tavsiflash kerak ochiq tizimlar(zarrachalarning o'zgaruvchan soni bilan).
X. p. m i
i Ko'p komponentli tizimning th komponenti termodinamikdan istalganining qisman hosilasiga teng. postdagi ushbu komponentning soniga (zarrachalar soni) ko'ra potensiallar. qolgan termodinamik qiymatlari. bu termodinamikani aniqlaydigan o'zgaruvchilar. potentsial, masalan. m i = (dF/dN i) T, V, N (F-erkin energiya, T- temp-ra, V- hajm, ji). Shunday qilib, o'zgaruvchan tizimlarda differensial ifodadagi zarrachalar soni, masalan. dF, qiymatni qo'shing:
![]()
qayerda R- bosim, S- entropiya. Naib. faqat X. p. termodinamik bilan bog'liq. salohiyat G(sm. Gibbs energiyasi):. Bir komponentli tizim uchun X. n. m = G/N,
ya'ni zarrachaga Gibbs energiyasi. Qo'shimchalar tufayli G, bosim va harorat-rydan tashqari, X. p. faqat otd konsentratsiyasiga bog'liq. komponentlar, lekin har bir komponentdagi zarrachalar soni bo'yicha emas. Eng oddiy holatda ideal gazlar m i faqat konsentratsiyasiga bog'liq i--chi komponent:
bu yerda zarrachalarning umumiy soni, m ~ i-X. n. toza i th
komponent. Ko'pincha qiymatlar m i mustaqil termodinamik sifatida foydalanish uchun qulay. o'rniga o'zgaruvchilar N i. O'zgaruvchilarda T, V, m i sistemaning holati termodinamikani xarakterlaydi. salohiyat
![]()
X. p. termodinamik. parametr ichida Gibbsning katta kanonik taqsimoti AC tizimlari uchun zarrachalar soni. Normalizatsiya konstantasi sifatida X. p. zarralar uchun Boltsmann, Bose - Eynshteyn va Fermi - Dirak taqsimotlariga kiradi. ideal gazlar(sm. statistik fizika Boltsman yoki Bose-Eynshteyn statistikasi qo'llaniladigan tizimlarda X. p. har doim salbiy. Uchun Fermi gazi X. p. nol haroratda musbat va chegarani aniqlaydi Fermi energiyasi(sm. Fermi yuzasi) va degeneratsiya harorati. Agar a
tizimdagi zarrachalarning umumiy soni qat'iy emas, lekin termodinamik holatdan aniqlanishi kerak. uchun kabi muvozanat fononlar ichida qattiq tana yoki uchun fotonlar muvozanat termal bo'lsa, u holda muvozanat nolga tenglik bilan tavsiflanadi X. p.
X.p. tushunchasi shartlarni shakllantirishga imkon beradi termodinamik muvozanat. Shartlardan biri shundaki, har qanday komponentning X. p.si dekompatsiyada bir xil boʻladi. fazalar va bir fazaning turli joylarida. Bu zarrachalarning qayta taqsimlanishi ehtimoli bilan bog'liq bo'lib, X. p ni tenglashtirishga olib keladi.. Fazoviy bir hil bo'lmagan extdagi tizimlar uchun. muvozanat maydoni shuni bildiradi
![]()
qayerda m i 0 - X. p. maydon yo'qligida, U i (r)-potentsial zarrachalar energiyasi i th komponent ext. maydon. Gravitatsion maydondagi gaz uchun bu holat barometrga olib keladi gaz uchun filtr. Zaryadlangan taqdirda elektr zarralari. maydon (masalan, yarim o'tkazgichlarda) qiymati m i chaqirdi elektrokimyoviy salohiyat, m uchun X. p. nomini qoldirib i 0 . Turli fazalarda bo'lgan bir xil komponentning zarralari uchun X.p. qiymatlarining tengligi fazaviy o'tishlar uchun muvozanat shartlarini belgilaydi (
Fazali o'tishlarning termodinamiği. Ta'riflar
Qaysi tizimlarning termodinamikasini ko'rib chiqaylik fazali o'tishlar. Moddalarni almashtira oladigan termodinamik tizim muhit, chaqirildi ochiq.
Termodinamik tizim deyiladi bir hil yoki bir hil, agar uning har bir kichik qismida jismoniy xususiyatlar moddalar va intensiv termodinamik parametrlar bir xil yoki fazoda uzluksiz ravishda o'zgaradi.
Moddaning fizik xossalari va intensiv parametrlari tizim ichidagi ba'zi sirtlarda keskin o'zgarib turadigan termodinamik tizimlar deyiladi. heterojen. Geterogen sistemaga qaynoq suyuqlik misol bo'la oladi.
Bir jinsli yoki doimiy o'zgaruvchan xususiyat va parametrlarga ega bo'lgan geterogen tizimdagi maydonlar deyiladi. bosqichlari. Geterogen tizimning muvozanat holatida tashqi maydonlar bo'lmaganda, har bir faza ichidagi intensiv parametrlar doimiy bo'ladi.
Ammo bu intensiv parametrlar turli bosqichlarda bir xil bo'lishi shart emas. Shunday qilib, bir hil tizim bir fazali.
Fazalarning har biri, umumiy holatda, kimyoviy toza moddalarning bir hil aralashmasi bo'lishi mumkin, ular orasida kimyoviy reaksiyalar. Aralashmadagi kimyoviy toza moddalar deyiladi komponentlar. Umumiy holatda fazalar nafaqat ish yoki issiqlik ko'rinishidagi energiyani, balki materiyani ham almashishi mumkin. Moddaning bir faza holatidan ikkinchisiga o'tishi deyiladi fazali o'tish.
Bir komponentli bir fazali TD tizimi ochiq bo'lsin va faqat tizimni tashkil etuvchi modda qobiqdan o'tishi mumkin. Va tizim muvozanatda bo'lsin.
O'zgartirish ichki energiya Bunday tizim nafaqat issiqlik ta'minoti va undagi ishlarning bajarilishi, balki uning massasining o'zgarishi tufayli ham yuzaga keladi. Qobiq orqali o'tadigan modda o'ziga xos energiyani olib yuradi. Keyin to'rttasining har biri uchun Gibbs tenglamalari termodinamik potensiallar(5.3) va (5.5) tizim massasining o'zgarishiga mutanosib bo'lgan yana bitta atama bilan to'ldirilishi kerak, ya'ni.
Qiymat μ , qisman hosilalari bilan aniqlanadi
deyiladi kimyoviy potentsial va termodinamik tizimning massasi bir ga o'zgarganda uning energiyasini o'zgartirish mantiqiy bo'ladi, bunda tizimning u yoki bu juft mustaqil parametrlari doimiysi saqlanadi.
Kimyoviy potentsialning sistemaning boshqa potentsiallari bilan bog'lanishi topilsin. Buning uchun (4.12) ifodalarning to'rtinchisini ko'rib chiqing. Gibbsning erkin energiyasi P, entropiya S va tizim hajmi V Biz ularning o'ziga xos qiymatlari orqali yozamiz:
Gibbs erkin energiya differensialini uning ifodasi bilan almashtirish ![]() va shartlarni qayta tartibga solib, biz quyidagilarni olamiz:
va shartlarni qayta tartibga solib, biz quyidagilarni olamiz:
(4.5) ga muvofiq M= konst = 1 kg ![]() , qayerdan, ommaviy differensialning o'zboshimchaliklarini hisobga olgan holda d M, topamiz:
, qayerdan, ommaviy differensialning o'zboshimchaliklarini hisobga olgan holda d M, topamiz:
bular. Moddaning kimyoviy potentsiali uning o'ziga xos Gibbs erkin energiyasidir.
4.6. Ko'p fazali tizimlarning termodinamik muvozanatining shartlari. Gibbs faza qoidasi
O'ylab ko'ring bir komponentli tizim, o'zaro ta'sir qiluvchi ikkita fazadan iborat. Fazalarning har biri o'zining ichki muvozanatida bo'lsin, ya'ni. ularning har biri o'ziga xos parametrlar to'plami bilan tavsiflanadi. Keling, fazalar orasidagi muvozanat masalasini o'rganamiz. Buning uchun biz butun tizimni izolyatsion qobiqqa o'rab olamiz (4.1-rasm). Keyin, har bir fazaning (quyi tizimlarning) holatini ozgina o'zgartirish bilan ular uchun (4.1) ga muvofiq termodinamik identifikatsiyalarni yozish mumkin.
 (4.15)
(4.15)
Keng miqdordagi qo'shimchalar tufayli ![]() , tizimning yopiqligi va jarayonning teskariligi, bizda mavjud
, tizimning yopiqligi va jarayonning teskariligi, bizda mavjud
![]()
bular. (4.5) tengliklarni yig'ib, biz quyidagilarni olamiz:
Differensiallarning o'zboshimchaliklari tufayli ![]() , bu differensiallarda qavs ichidagi omillar nolga teng bo'lishi kerak, shundan biz kerakli tizimning termodinamik muvozanat shartlarini olamiz:
, bu differensiallarda qavs ichidagi omillar nolga teng bo'lishi kerak, shundan biz kerakli tizimning termodinamik muvozanat shartlarini olamiz:
 (4.16)
(4.16)
Kimyoviy potentsial, ta'rifiga ko'ra, o'zgaruvchilarning tabiiy juftligi funktsiyasidir, shuning uchun fazaviy muvozanat sharti quyidagicha yozilishi mumkin.
dan funksiyalar turi T va p umumiy holatda fazalarning har biri uchun har xil, shuning uchun (4.17) shart identifikatsiya emas. Bu muvozanat tizimidagi harorat va bosimga bog'liq algebraik tenglama bo'lib, ular o'rtasida issiqlik, ish va materiya almashinadigan ikkita o'zaro ta'sir qiluvchi fazadan iborat.
Shunday qilib, ikki fazali bir komponentli tizimda harorat va bosim o'ziga xos tarzda bog'liq. Tizimning hajmi fazalar massalari orasidagi nisbatga qarab ixtiyoriy qiymatni olishi mumkin. Ikki fazali tizimning muvozanat holati to'yinganlik holati deb ataladi va fazalar uchun teng bo'lgan harorat va bosim to'yinganlik parametrlari deb ataladi. T s , p s .
Muvozanatni ko'rib chiqing uch fazali bir komponentli tizim. Ushbu holatda:
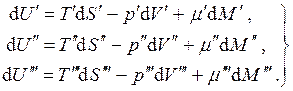 (4.18)
(4.18)
Lekin uchun yopiq tizim:
nimani hisobga olib, (4.8) tenglamalarni qo'shib, biz quyidagilarni olamiz:
Bu yerdagi barcha differentsiallar mustaqil va ularning qiymatlari ixtiyoriy bo'lgani uchun biz muvozanat shartlarini topamiz:
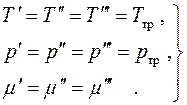 (4.19)
(4.19)
Kimyoviy muvozanat, ya'ni. fazalarning kimyoviy potentsiallarining tengligi, ikkita algebraik tenglama shaklida yozilishi mumkin
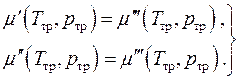 (4.20)
(4.20)
Bu ikkita noma'lum ikkita tenglamalar tizimi. Muvozanatli bir komponentli tizim bir vaqtning o'zida mavjud bo'lishi mumkin uch fazalar faqat qat'iy belgilangan bosim va harorat qiymatlarida. Tizimning bu holati deyiladi uch nuqta.
Muvozanat uchun To'rt fazali bir komponentli tizim:
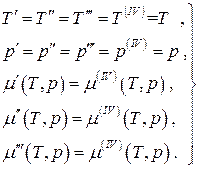 (4.21)
(4.21)
ikkita noma'lumli uchta tenglamalar tizimi. Bunday tenglamalar tizimi nomuvofiqdir, bundan tashqari ularning har qanday ikkitasi bir-biriga proportsional bo'lgan, ya'ni. to'rt bosqichdan ikkitasi aslida farqlanmaydigan bo'lsa va bu allaqachon uch fazali tizim bo'ladi. Shunday qilib, muvozanatli bir komponentli tizimda bir vaqtning o'zida uch fazadan ko'p bo'lmagan holda yashashi mumkin. Agar muvozanat termodinamik tizim ko'p komponentli bo'lsa, u holda bir vaqtning o'zida mavjud bo'lgan fazalar soni uchtadan ko'p bo'lishi mumkin, ya'ni
qayerda n tizim komponentlari soni. Bu natija deyiladi Gibbs bosqichi qoidalari.
MA'RUZA REJASI:
1. Ma’ruzaning tashkiliy qismi: kursantlarning darsga tayyorgarligi to‘g‘risida hisobot qabul qilinadi, darsga qatnashmaganlar jurnalda qayd etiladi (vaqt 3-5 minut).
2. “Issiqlik va massa almashinuvi” bo‘limiga kirish.
Dars savollari:
Issiqlik uzatish mexanizmlari.
harorat maydoni.
harorat gradienti.
Issiqlik o'tkazishning asosiy qonuni.
· Issiqlik o'tkazuvchanlik koeffitsienti.
· Issiqlik o'tkazuvchanligining differensial tenglamasi.
· Chegara shartlari.
3. Xulosa.
Keyingi sinf uchun talabalar:
BILING: differensial tenglama issiqlik o'tkazuvchanligi; issiqlik va issiqlik tarqalish koeffitsientlarini aniqlash.
IMKONIYATIGA EGA BO'LISH: Furye tenglamasiga oid masalalarni yechishda chegara shartlarini qo‘llash.
TAQDIM OLING: turli tuzilishdagi va agregat holatidagi jismlarda issiqlik uzatish mexanizmlari haqida.
4. O'z-o'zini tayyorlash uchun vazifalar:
_____________/ professor Fizika va issiqlik almashinuvi, fizika-matematika fanlari doktori, P.V. Skripov
Ma’ruza kafedra majlisida ko‘rib chiqildi va tasdiqlandi
2011 yil “_____” _______-sonli bayonnoma
Fizika va issiqlik almashinuvi kafedrasi mudiri
professor, d.t. ________________ / N.M. barbin
"_____"______________ 2011 yil
Tizimning erkin energiyasi (Gibbs energiyasi G va Gelmgolts energiyasi F) ga bog'liq tashqi sharoitlar:
Bu bog'liqlik bir komponentdan iborat eng oddiy tizimlar uchun to'liqdir.
Termodinamik tizim bir yoki bir nechta komponentlardan iborat bo'lishi mumkin. Shubhasiz, ko'p komponentli tizimning erkin energiyasining qiymati tashqi sharoitlarga bog'liq bo'ladi ( T,R, yoki V), tizimni tashkil etuvchi moddalarning tabiati va miqdori, ya'ni erkin energiya, har qanday termodinamik funktsiya kabi, tizimning keng xususiyatidir. Agar tizimning tarkibi vaqt o'tishi bilan o'zgarsa (ya'ni, tizimda kimyoviy reaktsiya sodir bo'lsa), tizimning erkin energiyasining qiymatiga tarkib o'zgarishining ta'sirini hisobga olish kerak.
dan tashkil topgan termodinamik tizimni ko'rib chiqaylik k komponentlar. Mayli n 1 , n 2 , …, n k- 1, 2, ... mollar soni, k th komponentlar. Keyin Gibbsning erkin energiyasi quyidagi o'zgaruvchilarning funktsiyasidir:
G = f(p, T, n 1 , n 2 , …, n k )
Barcha o'zgaruvchilarga nisbatan farqlang:
 (2.1)
(2.1)
Keling, belgi bilan tanishtiramiz:
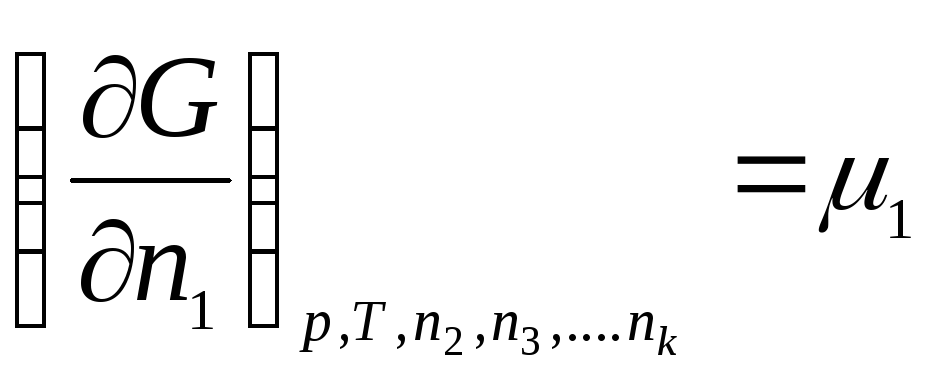
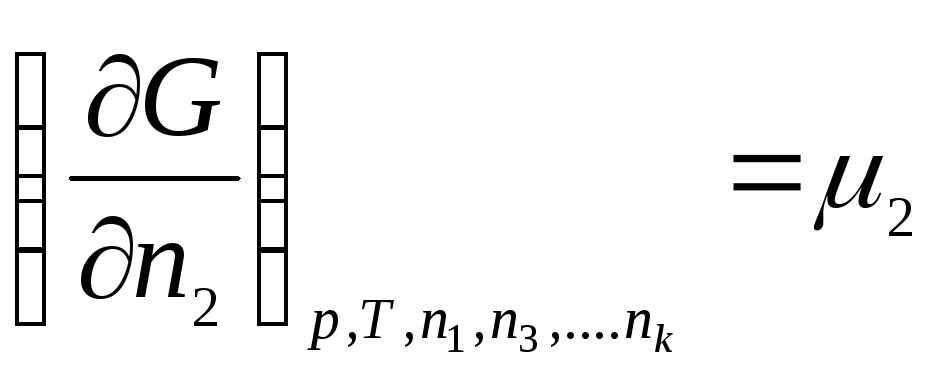
………………….
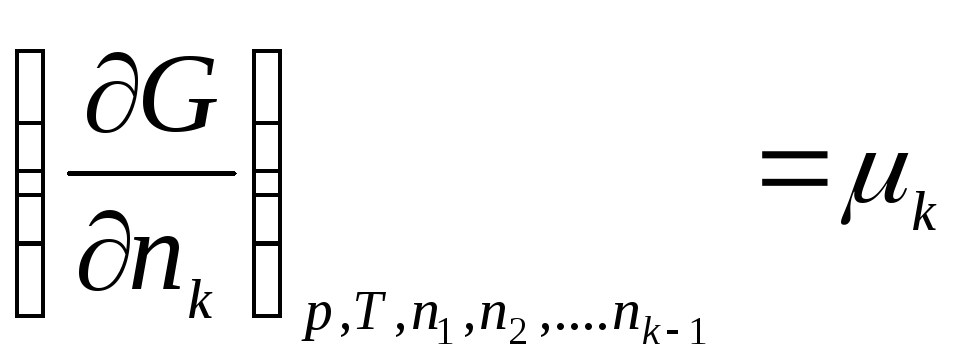 ,
,
qayerda μ 1 , μ 2 , …, μ k- kimyoviy potentsiallar 1, 2, ..., k mos ravishda th komponentlar.
Umuman
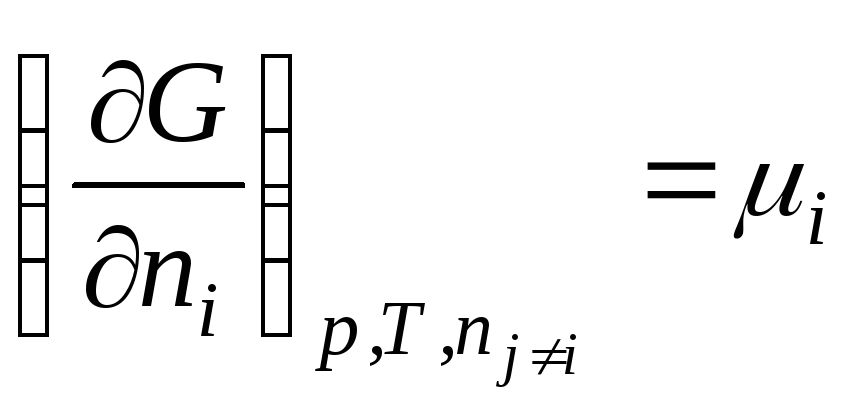 .
.
Biz Helmgolts erkin energiyasi uchun shunga o'xshash ifodani olamiz:
F = f(V, T, n 1 , n 2 , …, n k )
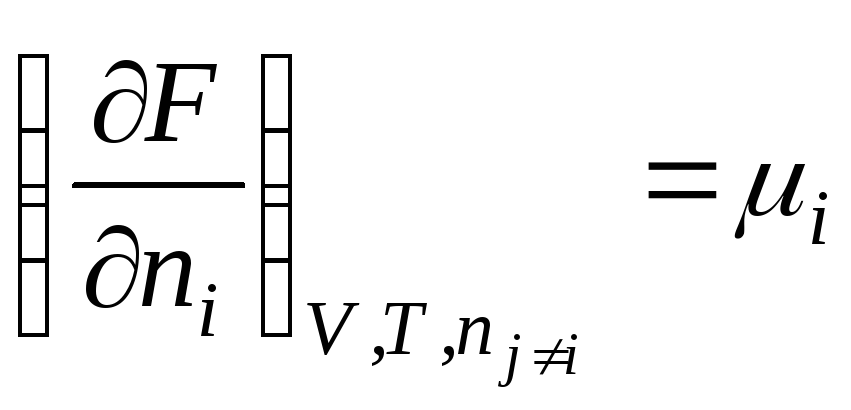 .
.
Shunday qilib, kimyoviy potentsial erkin energiyaning mollar soniga nisbatan qisman hosilasidir i- mos keladigan tashqi parametrlarning doimiyligi va boshqa barcha komponentlarning mollari soniga ega bo'lgan komponent. Shunday qilib, kimyoviy potentsial qisman molyar Gibbs energiyasidir (at R, T = const):
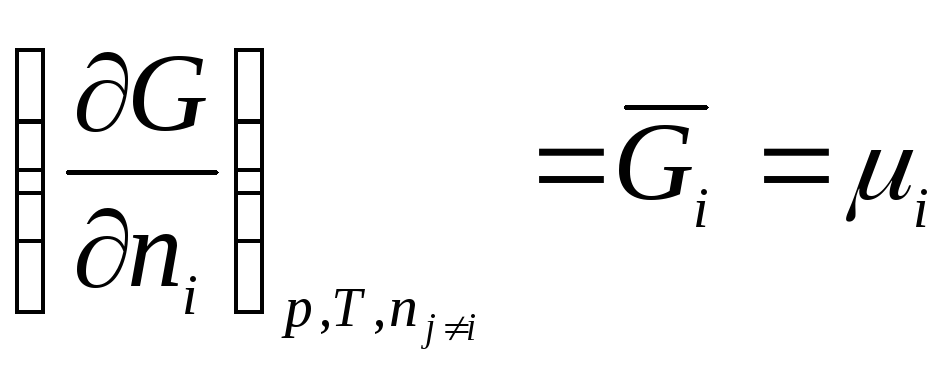 .
.
Erkin energiya umumiy mulk tizimlar, kimyoviy potentsial tizimga kiritilgan individual komponentning xususiyatlarini tavsiflaydi. Kimyoviy potentsial tizimning intensiv mulkidir, chunki tizimning massasiga bog'liq emas.
Da p, T =const(2.1) tenglama quyidagi ko'rinishga ega:
![]() .
(2.2)
.
(2.2)
Bunda Gibbs energiyasining o'zgarishi, ya'ni sistemaning foydali ishi faqat kimyoviy reaksiya natijasida sistema tarkibining o'zgarishi yoki sistema o'rtasida moddalar almashinuvi tufayli sodir bo'ladi. va atrof-muhit.
(2.2) tenglama tizimning umumiy xossasi bilan uning har bir komponentining xossalari o'rtasidagi bog'liqlikni ifodalaydi. Kimyoviy potentsial doimiy qiymat deb faraz qilib, (2.2) tenglamani integrallaymiz:
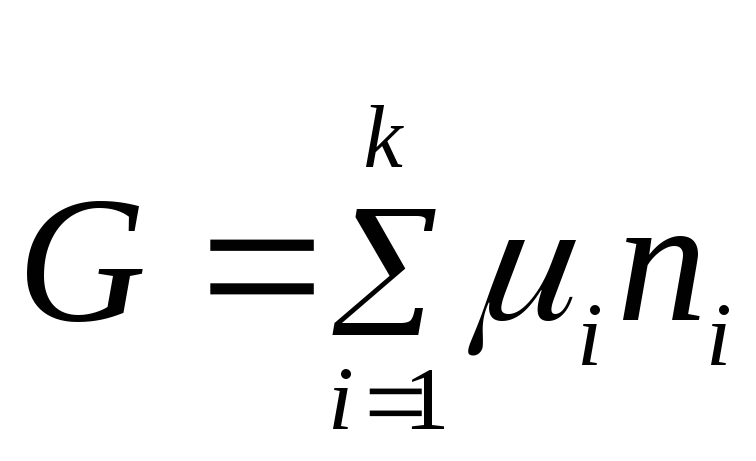 .
.
Integratsiya konstantasi nolga teng, chunki agar hammasi n i= 0, Gibbs energiyasi ham nolga teng.
Shaxsiy modda uchun
 ,
,
bular. alohida moddaning kimyoviy salohiyati Gibbs molyar energiyasiga teng.
Muvozanat holatida dG = 0 va (2.1) tenglama quyidagi shaklni oladi:
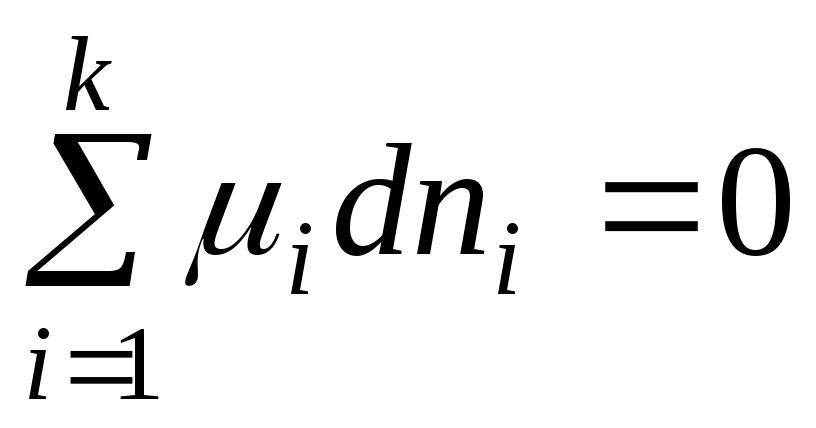 . (2.3)
. (2.3)
Olingan tenglama at o'zgaruvchan tarkibi bo'lgan tizimdagi umumiy muvozanat shartidir R,T =const.
Individual ideal gazning kimyoviy salohiyati.
Ideal gaz bo'lgan termodinamik tizimni ko'rib chiqing. Kimyoviy salohiyat ideal gaz teng:
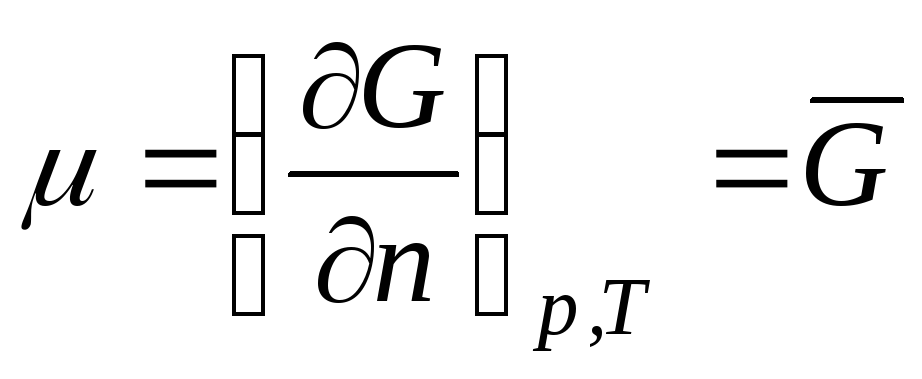 ,
,
qayerda  Gibbs molyar energiyasi (1 mol ideal gazning izobarik potensiali).
Gibbs molyar energiyasi (1 mol ideal gazning izobarik potensiali).
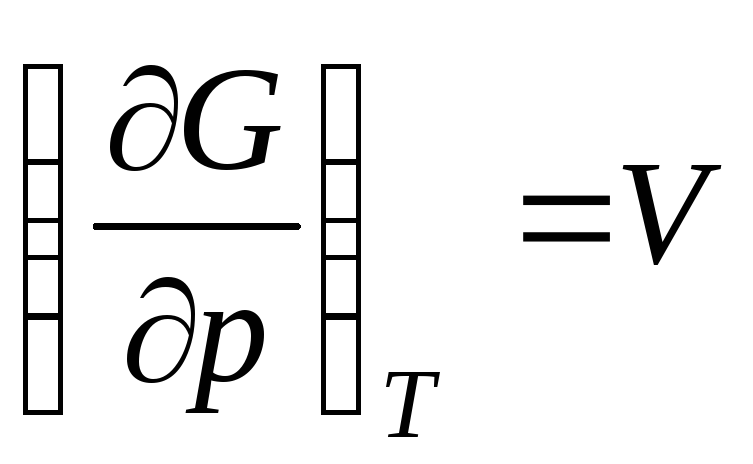 ,
,
keyin 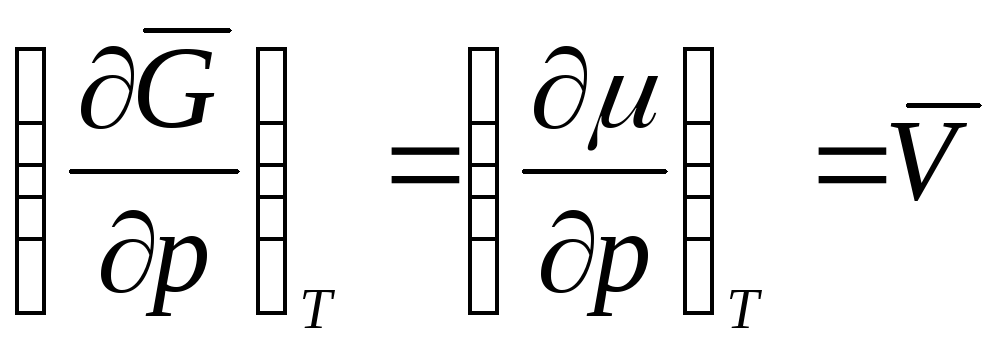 ,
,
qayerda  ideal gazning molyar hajmi (1 mol gazning hajmi).
ideal gazning molyar hajmi (1 mol gazning hajmi).
Agar jarayon ishlayotgan bo'lsa T =const, qisman hosila jami bilan almashtirilishi mumkin. Keyin

1 mol ideal gaz uchun holat tenglamasi:
 ;
;
 ,
,
![]()
dan oraliqda integrallashaylik R 0 oldin R:
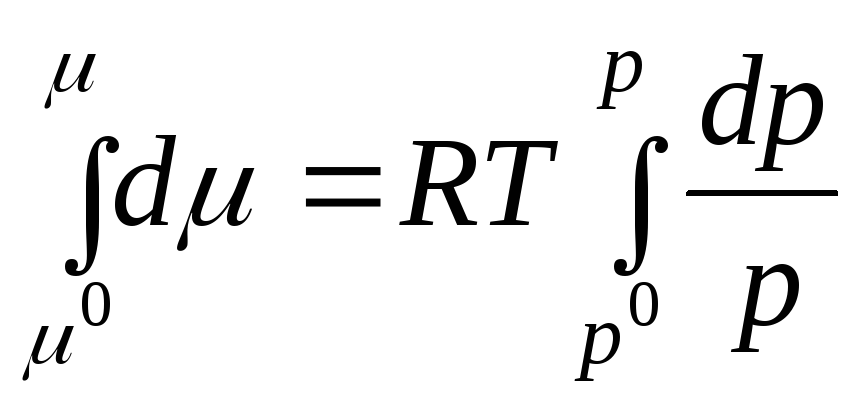
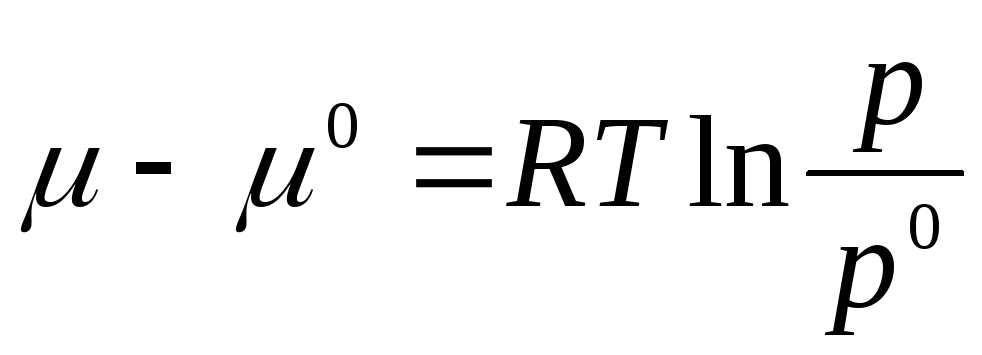
qayerda μ 0 , R 0 - standart holatdagi ideal gazning kimyoviy potentsiali va bosimi.
Standart holat ideal gazning holati sifatida qabul qilinadi R 0 = 1 atm.
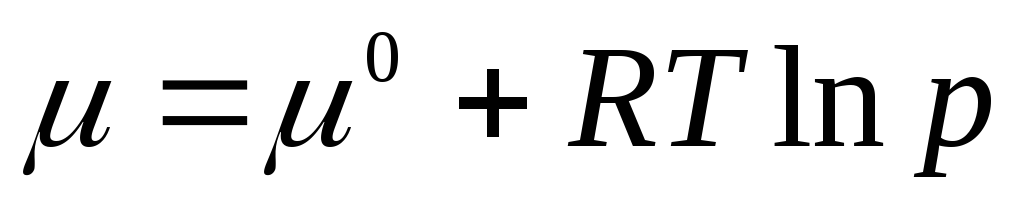 .
(2.3)
.
(2.3)
Standart kimyoviy potentsial 1 atm gaz bosimidagi kimyoviy potentsialdir. Standart holatdagi kimyoviy potentsial μ 0 faqat haroratga bog'liq va bosimga bog'liq emas, ya'ni. μ 0 = f(T). (2.3) tenglama logarifm belgisi ostida bosim nisbatiga teng o'lchamsiz kattalik ekanligini ko'rsatadi. R standart bosimga R 0 = 1 atm.
Chunki μ
=
 , yozish mumkin
, yozish mumkin
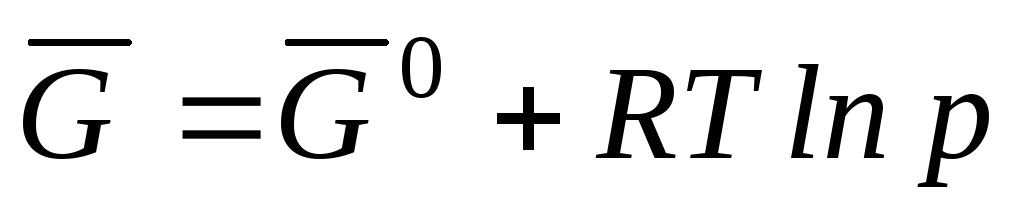
qayerda  Gibbs standart molyar energiyasidir.
Gibbs standart molyar energiyasidir.
Ideal eritmalar komponentining kimyoviy salohiyati.
Agar gaz aralashmasining umumiy bosimi kichik bo'lsa, unda har bir gaz o'z bosimiga ega bo'ladi, masalan, agar u butun hajmni egallagan bo'lsa. Bu bosim deyiladi qisman. Umumiy kuzatilgan bosim R har bir gazning parsial bosimlari yig‘indisiga teng (Dalton qonuni):
 .
.
Ideal gaz aralashmasining tarkibiy qismining kimyoviy potentsiali:
 ,
,
qayerda R i gazning parsial bosimidir.
Gazning parsial bosimini ifodalash R i gazning umumiy bosimi va mol ulushi orqali x i, kimyoviy potentsialning bog'liqligi ifodasini oling i-mol fraksiyasidan komponent:
qayerda  da ideal gazning kimyoviy salohiyati x i= 1 (ya'ni individual holatda) bosim ostida R va harorat T;
da ideal gazning kimyoviy salohiyati x i= 1 (ya'ni individual holatda) bosim ostida R va harorat T;
 harorat va bosimga ham bog'liq.
harorat va bosimga ham bog'liq.
Uchun ideal suyuqlik eritmalari qo'llaniladigan tenglama
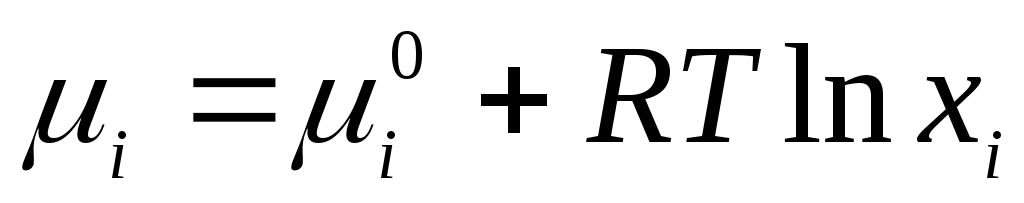 ,
,
qayerda 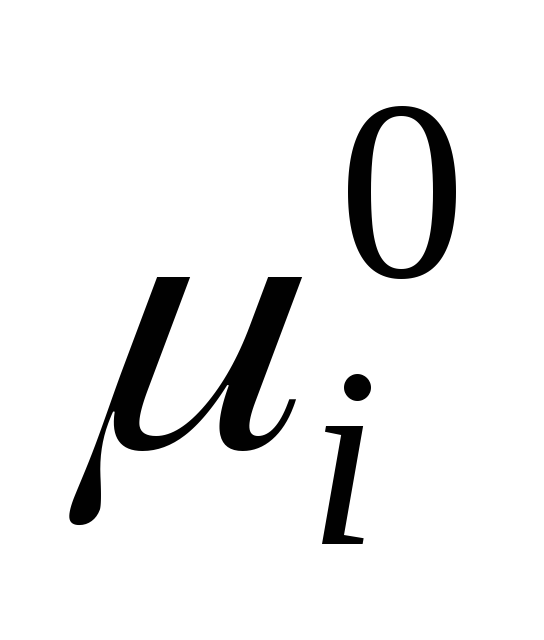 suyuq holatda individual komponentning standart kimyoviy salohiyati (
suyuq holatda individual komponentning standart kimyoviy salohiyati (  ) harorat va bosimga bog'liq; x i - komponentning mol ulushi.
) harorat va bosimga bog'liq; x i - komponentning mol ulushi.
Haqiqiy eritmalar komponentining kimyoviy salohiyati .
Haqiqiy echimlar uchun ko'rib chiqilgan barcha bog'liqliklar qo'llanilmaydi. Komponentning kimyoviy salohiyati haqiqiy gaz eritmasi Lyuis usuli yordamida hisoblab chiqilgan. Bunday holda, termodinamik tenglamalar shaklini saqlab qolish uchun qisman bosim o'rniga ular xayoliy miqdorni kiritadilar. f i, deb ataladi qisman qo'pollik, yoki o'zgaruvchanlik. Keyin
![]() ,
,
qayerda  standart holatdagi real gaz aralashmasi komponentining kimyoviy salohiyati.
standart holatdagi real gaz aralashmasi komponentining kimyoviy salohiyati.
O'zgaruvchanlikning nisbati qisman bosim Haqiqiy gaz eritmasi uchuvchanlik koeffitsienti deb ataladi:
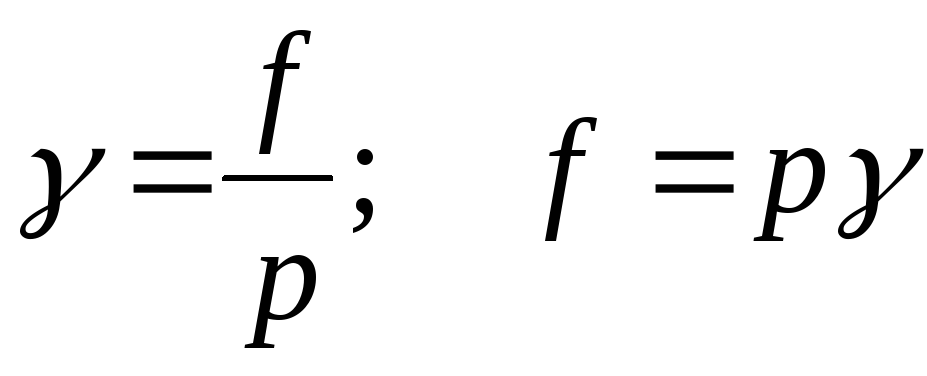 ;
;
Xuddi shunday, uchun suyuq real eritmalar haqiqiy konsentratsiya mos keladigan xayoliy qiymat - faoliyat bilan almashtiriladi a i :
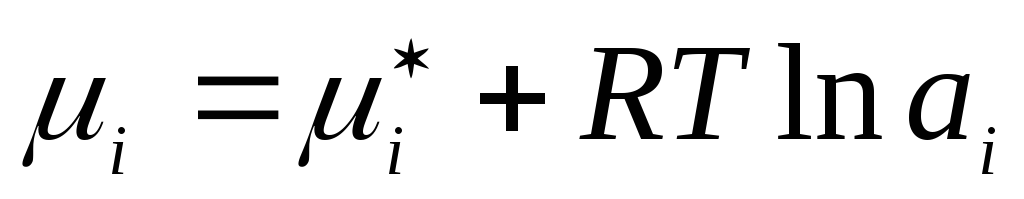 ,
,
qayerda  standart holatdagi real suyuq eritma komponentining kimyoviy salohiyati.
standart holatdagi real suyuq eritma komponentining kimyoviy salohiyati.
Faollik faollik koeffitsienti orqali konsentratsiya bilan bog'liq:
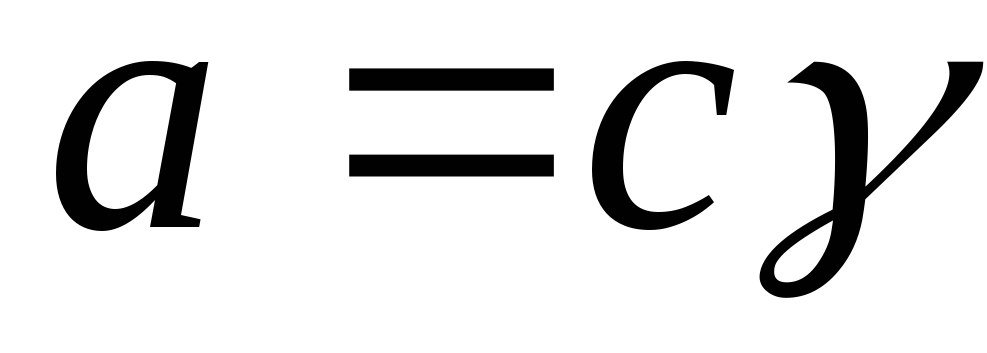 ,
,
Bu erda g i - faollik koeffitsienti.
Eritma konsentratsiyasini ifodalash usuliga qarab ratsional, molyar va molal faollik koeffitsientlari ajratiladi:

Faollik koeffitsienti eritmaning konsentratsiyasiga bog'liq. Cheksiz suyultirilgan eritmalarda g → 1, a i va f i → c i va p i mos ravishda.
Kimyoviy potentsial tenglamasini shaklda qayta yozamiz
 ,
,
shuning uchun termodinamik faollik 1 mol o'tkazish ishidir i th komponent standart yechimdan berilgan real yechimga.
Tanlashning ikkita asosiy usuli mavjud standart holat- nosimmetrik va assimetrik.
nosimmetrik usul. Erituvchi va erigan modda uchun bir xil standart holat tanlanadi - eritma haroratidagi sof komponentning holati. Keyin standart holatda x i = 1, a i = 1va g i = 1. Bu usul ko'proq elektrolit bo'lmagan eritmalar uchun qo'llaniladi.
assimetrik usul. Erituvchi va erigan modda uchun boshqa standart holat tanlanadi. Solvent uchun - nosimmetrik usulda bo'lgani kabi: x i → 1, a i → 1va g i → 1. Eriydigan modda uchun standart holat - cheksiz suyultirilgan eritmadagi moddaning holati: x i → 0, a i → x i va g i → 1. Usul ko'pincha elektrolitlar eritmalarining termodinamikasida qo'llaniladi.






