Asosiy termodinamik potensiallar. Termodinamik potensiallar
TERMODINAMIK POTENTSIALLAR- termodinamikaning ma'lum bir to'plamining funktsiyalari. barcha termodinamikani topish imkonini beruvchi parametrlar. Ushbu parametrlarning funktsiyasi sifatida tizim xususiyatlari. Barcha P. t.lar oʻzaro bogʻlangan: ularning har biri uchun uning parametrlari boʻyicha differensiallash yordamida boshqa barcha potentsiallarni topish mumkin.
P. t. usuli 1874 yilda J. V. Gibbs (J. V. Gibbs) tomonidan ishlab chiqilgan boʻlib, u barchaning asosidir. termodinamika, jumladan, ko'p komponentli, ko'p fazali va geterogen tizimlar nazariyasi, shuningdek, termodinamik. nazariya fazali o'tishlar. P. t.ning mavjudligi 1 va 2-tamoyillarning natijasidir. Statistik fizika materiyaning tizim sifatida tuzilishi tushunchasiga asoslanib, P. t.ni hisoblash imkonini beradi katta raqam o'zaro ta'sir qiluvchi zarralar.
Ichki energiya
AQSh (AQSh, V, N) tizimning holati bilan tavsiflangan holda P. t. hisoblanadi entropiya S, hajmi V va zarrachalar soni N, bu bir komponentli izotrop suyuqliklar va gazlar uchun xosdir. U chaqirdi ham izoxorik-adiabatik. salohiyat. To'liq differentsial U teng:
Bu erda mustaqil o'zgaruvchilar uchta keng (proportsional) V) qiymatlar 5, V, N, bog'liq bo'lganlar esa u bilan bog'liq bo'lgan intensiv (termodinamik chegarada cheklangan) kattaliklar - haroratdir. T, bosim r va kimyoviy potentsial Shu shartdan U jami differensial bo'lib, u qaram o'zgaruvchilardan kelib chiqadi T, r ning qisman hosilalari bo'lishi kerak U:
Ikkinchi hosila U hajmi bo'yicha adiabatik koeffitsientni beradi. elastiklik:
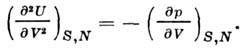
DC da issiqlik sig'imi hajmi hisoblanadi
![]()
Biroq, bu P. t ni aniqlaydigan mustaqil o'zgaruvchilarning yagona mumkin bo'lgan tanlovi emas. Ular to'rtta dekomp tomonidan tanlanishi mumkin. usullar, bir termal va ikkita mexanik mustaqil bo'lganda. qiymatlar: S, V, N; S, p, N; T, V, N; T, p, N. Mustaqil o'zgaruvchilardan birini (1) turdagi jami differentsialdagi konjugat bilan almashtirish uchun biz quyidagilarni bajarishimiz kerak. Legendre transformatsiyasi, ya'ni ikkita konjugat o'zgaruvchining mahsulotini ayirish.
Bu. entalpiyasini olish mumkin H(S, p, N) (Gibbsning issiqlik funktsiyasi, issiqlik miqdori, izoxorik - mustaqil o'zgaruvchilar bilan izotermik potensial S, p, N):
bundan kelib chiqadi
Bilim H doimiy oqimdagi issiqlik sig'imini topishga imkon beradi. bosim
Erkin energiya
F(T,V,N)(Gelmgolts energiyasi, issiqlik miqdori, o'zgaruvchilardagi izobarik-izotermik potensial T, V, N) o'zgaruvchilarning Legendre konvertatsiyasi yordamida olinishi mumkin S, V, N uchun T, V, N:
qayerda
Ikkinchi hosilalar F V p G ga ko'ra, doimiy oqimdagi issiqlik sig'imini bering. izotermik hajm. koeffitsienti bosim
va izoxorik koeffitsient. bosim
Oxirgi munosabat P. t.ning ikkinchi aralash hosilasining farqlanish tartibidan mustaqilligiga asoslanadi. va orasidagi farqni topish uchun xuddi shu usuldan foydalanish mumkin:
va adiabatik orasidagi nisbat. va izotermik koeffitsienti siqish:
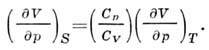
Gibbs energiyasi (izobarik - o'zgaruvchilardagi izotermik potentsial). T, p, N) P. ga Legendre oʻzgarishi bilan bogʻliq. U, H, F:
qayerda
Proportsionallik G zarrachalar soni uni ilovalar uchun juda qulay qiladi, ayniqsa nazariy jihatdan fazali o'tishlar. Ikkinchi hosilalar G postda issiqlik sig'imini bering. bosim
![]()
va izotermik koeffitsienti siqilish
(3), (5), (6), (8) tenglamalardan P. t. U, H, F, G ulangan:
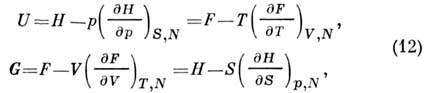
to-javdar uchastkasini qurish uchun ishlatilgan. P. t. sobiq perimga ko'ra. termal ma'lumotlar. va kaloriya. ur-niya davlati. Buning uchun zarur bo'lgan chegara shartlari ideal gaz va chegaraga o'tish orqali beriladi Nernst teoremasi, buni belgilaydi S=0 chegara doirasida T Oh va hokazo U=F va G - H.
Yopiq bo'lmagan tizimlar uchun, buning uchun N qatʼiy emas, oʻzgaruvchilarda P. t.ni tanlash qulay T, V, bu maxsus nom olmagan va odatda belgilanadi ![]()
Uning umumiy farqi
Barcha P. t.lar har xil bilan bogʻlangan Gibbs taqsimoti. P. t.
buyuk kanon bilan bog'liq. Munosabatlar bo'yicha Gibbs taqsimoti
qayerda - statistik integral Faza o'zgaruvchilari va yig'indisi ustidan N klassika misolida mexanika yoki bo'lim funktsiyasi yoqilgan kvant holatlari. P. t. F(T, V, N) kanonik bilan bog'langan Gibbs ansambli:
statistika qayerda. klassikada integral holat va statistik kvantdagi miqdor. P. t. H izobarik-izotermik bilan bog'liq. S. A. Boguslavskiy taklif qilgan Gibbs ansambli (1922). P. t. / 7 mikrokanonik bilan bog'liq. Entropiya orqali Gibbs taqsimoti:
qayerda W(U, V, N) - statistik. vazn, to-ry mikrokanonik uchun normalizatsiya omilidir. Gibbs taqsimoti. Umumiy entropiya differensialligi
(1) tenglamaga teng.
Statistik integrallar yoki statistika. so'mlarni printsipial jihatdan klassikada Gamiltonning f-soni asosida hisoblash mumkin. hol yoki ko'p sonli o'zaro ta'sir qiluvchi zarralar tizimi uchun kvant holatidagi Gamilton operatori va boshqalar. P. t.ni statistik usullar bilan hisoblash. mexanika.
Roʻyxatda keltirilgan P. t.dan tashqari, masalan, boshqalar ham qoʻllaniladi. Massieux funktsiyalari - F(T, V, N) IT, Plank funktsiyalari - ![]() Umumiy holatda, berilgan entropiyaga ega bo'lgan tizim termodinamik bilan tavsiflanganda parametrlari va ular bilan bog'liq termodinamik parametrlar. kuchlar
Umumiy holatda, berilgan entropiyaga ega bo'lgan tizim termodinamik bilan tavsiflanganda parametrlari va ular bilan bog'liq termodinamik parametrlar. kuchlar ![]()

va shunga o'xshash statsionar tizimlar uchun energiya.
Polarizatsiya qilinadigan muhitlar uchun P. t. elektr vektorlariga bog'liq. va magn. induksiya D
va DA
. P. t. usuli elektrning tenzorlarini topish imkonini beradi. va magn. o'tkazuvchanlik. Izotrop holatda dielektrik o'tkazuvchanlik tenglamalar bo'yicha aniqlanadi

P. t. usulidan foydalanish, masalan, parametrlar o'rtasida bog'lanish mavjud bo'lganda samarali bo'ladi. termodinamik sharoitlarni o'rganish. qo'shni fazalardan tashkil topgan geterogen tizimning muvozanati va dekomp. komponent. Bunday holda, agar tashqi ko'rinishni e'tiborsiz qoldirish mumkin bo'lsa kuchlar va sirt hodisalari, qarang. har bir fazaning energiyasi ![]() komponentning zarrachalari soni qayerda i bosqichda k. Shuning uchun, har bir bosqich uchun
komponentning zarrachalari soni qayerda i bosqichda k. Shuning uchun, har bir bosqich uchun
(- fazadagi i komponentning kimyoviy potentsiali k). P. t. U Har bir komponentning zarrachalarining umumiy soni, har bir fazaning umumiy entropiyasi va hajmi doimiy bo'lib qolishi sharti bilan minimaldir.
P. t. usuli termodinamikaning barqarorligini oʻrganish imkonini beradi. uning termodinamikasining kichik o'zgarishlariga nisbatan tizimning muvozanati. parametrlari. Muvozanat max bilan tavsiflanadi. mustaqil termodinamik tajriba sharoitlariga mos keladigan entropiya qiymati yoki uning P. t.ning minimal qiymati (ichki energiya, entalpiya, erkin energiya, Gibbs energiyasi). o'zgaruvchilar.
Shunday qilib, mustaqil ravishda S, V, N muvozanat uchun minimal int bo'lishi kerak. energiya, ya'ni o'zgaruvchilardagi kichik o'zgarishlar va doimiylik bilan S, V, N. Demak, muvozanatning zaruriy sharti sifatida barcha fazalardagi bosim va haroratning doimiyligi va kimyoviy tengligi. birgalikda mavjud bo'lgan fazalarning potentsiallari. Biroq, termodinamik uchun barqarorlik yetarli emas. P. t.ning minimallik shartidan ikkinchi oʻzgarishning musbatligi kelib chiqadi: > 0. Bu termodinamik sharoitga olib keladi. barqarorlik, masalan. doimiy oqimda hajm va musbat issiqlik sig'imi oshishi bilan bosimning pasayishiga. hajmi. P. t. usuli ko'p fazali va ko'p komponentli tizimlar uchun o'rnatish imkonini beradi Gibbs faza qoidasi, unga ko'ra muvozanatda birga mavjud bo'lgan fazalar soni mustaqil komponentlar sonidan ikkitadan ortiq emas. Bu qoida mustaqil parametrlar soni fazaviy muvozanatda ularni aniqlash uchun tenglamalar sonidan oshmasligidan kelib chiqadi.
Termodinamik qurish uchun hisobga oladigan nazariyalar sirt hodisalari, P. t.ning oʻzgarishlarida, kontakt fazalari yuzasidagi oʻzgarishlarga mutanosib atamalarni hisobga olish kerak. Bu atamalar proportsionaldir sirt tarangligi s, bu mantiqiy o'zgarishlarni keltirib chiqaradi. sirtga nisbatan har qanday P. t.ning hosilasi.
P. usuli uzluksiz fazoviy bir jinsli boʻlmagan muhitlarga ham tegishli. Bunda P. t. termodinamikaning funksionallari hisoblanadi. o'zgaruvchilar va termodinamik. tengliklar funksional hosilalarda tenglamalar shaklini oladi.
Lit.: Vaals I.D. you der, Konstamm F., Termostatika kursi, 1-qism. Umumiy termostatik, trans. nemis tilidan., M., 1936; Munster A., Kimyoviy termodinamika, trans. nemis tilidan., M., 1971; Gibbs J. B., Termodinamika. Statistik mexanika, trans. ingliz tilidan, M., 1982; Novikov I.I., Termodinamika, M., 1984 y. D. N. Zubarev.
Termodinamikada barcha hisob-kitoblar termodinamik potentsial deb ataladigan holat funksiyalaridan foydalanishga asoslangan. Har bir mustaqil parametrlar to'plami o'z termodinamik salohiyatiga ega. Har qanday jarayonlarda yuzaga keladigan potentsiallarning o'zgarishi sistola tomonidan bajarilgan ishni yoki tizim tomonidan qabul qilingan issiqlikni aniqlaydi.
Termodinamik potentsiallarni ko'rib chiqishda biz (103.22) munosabatdan foydalanamiz, uni shaklda taqdim etamiz.
Tenglik belgisi qaytar jarayonlarni, tengsizlik belgisi - qaytarilmas jarayonlarni bildiradi.
Termodinamik potensiallar holat funksiyalaridir. Shuning uchun har qanday potentsialning o'sishi u ifodalangan funktsiyaning to'liq differentsialiga teng. O'zgaruvchilar va y funktsiyasining to'liq differensialligi ifoda bilan aniqlanadi
![]()
Shuning uchun, agar transformatsiyalar jarayonida biz ma'lum bir qiymatni oshirish uchun shaklning ifodasini olsak
bu miqdor parametrlarning funksiyasi, funksiyalar esa funksiyaning qisman hosilalari ekanligi haqida bahslashish mumkin.
Ichki energiya. Biz allaqachon termodinamik potentsiallardan biri bilan tanishmiz. Bu tizimning ichki energiyasi. Qaytariladigan jarayon uchun birinchi qonun ifodasi sifatida ifodalanishi mumkin
![]() (109.4)
(109.4)
(109.2) bilan taqqoslash shuni ko'rsatadiki, S va V o'zgaruvchilari V potentsial uchun tabiiy o'zgaruvchilar rolini o'ynaydi. (109.3) dan kelib chiqadiki,
![]()
Bu munosabatdan kelib chiqadiki, bu holatda - tananing issiqlik almashinuvi yo'q bo'lganda tashqi muhit, uning bajargan ishi teng
![]()
yoki integral shaklda:
Shunday qilib, tashqi muhit bilan issiqlik almashinuvi yo'q bo'lganda, ish tananing ichki energiyasining pasayishiga teng bo'ladi.
Da, doimiy hajm
Shuning uchun, - doimiy hajmdagi issiqlik sig'imi ga teng
![]() (109.8)
(109.8)
Erkin energiya. (109.4) ga ko'ra, qaytariladigan issiqlik bilan ishlab chiqarilgan ish izotermik jarayon, sifatida ifodalanishi mumkin
Davlat funktsiyasi
![]() (109.10)
(109.10)
tananing erkin energiyasi deb ataladi.
Qaytariladigan izotermik jarayonda "(109.9) va (109.10) formulalariga muvofiq ish tananing erkin energiyasining pasayishiga teng:
![]()
(109.6) formula bilan taqqoslash shuni ko'rsatadiki, izotermik jarayonlarda erkin energiya adiabatik jarayonlarda ichki energiya bilan bir xil rol o'ynaydi.
E'tibor bering, formula (109.6) ham qaytar, ham qaytarilmas jarayonlar uchun amal qiladi. Formula (109.12) faqat qaytar jarayonlar uchun amal qiladi. Qaytarib bo'lmaydigan jarayonlar bilan (qarang). Ushbu tengsizlikni munosabatga almashtirib, qaytarilmas izotermik jarayonlar uchun shuni olish oson.
Shuning uchun erkin energiyaning yo'qolishi tizimning izotermik jarayonda bajarishi mumkin bo'lgan ish hajmining yuqori chegarasini belgilaydi.
(109.10) funksiyaning differentsialini olaylik. (109.4) ni hisobga olgan holda biz quyidagilarni olamiz:
(109.2) bilan taqqoslashdan biz erkin energiya uchun tabiiy o'zgaruvchilar T va V degan xulosaga kelamiz. (109.3) ga muvofiq.
O'rnini almashtiramiz: (109.1) dQ orqali va hosil bo'lgan munosabatni ( - vaqt) ga bo'linadi. Natijada, biz olamiz
![]()
Agar harorat va hajm o'zgarmas bo'lsa, u holda (109.16) munosabatni shaklga aylantirish mumkin
Bu formuladan kelib chiqadiki, doimiy harorat va hajmda sodir bo'ladigan qaytarilmas jarayon tananing erkin energiyasining kamayishi bilan birga keladi. Muvozanatga erishilganda, F vaqt o'tishi bilan o'zgarishni to'xtatadi. Shunday qilib; doimiy T va V da, muvozanat holati erkin energiya minimal bo'lgan holatdir.
Entalpiya. Agar jarayon "da sodir bo'lsa doimiy bosim, u holda tana tomonidan qabul qilingan issiqlik miqdori quyidagicha ifodalanishi mumkin:
Davlat funktsiyasi
![]()
entalpiya yoki issiqlik funktsiyasi deb ataladi.
(109.18) va (109.19) dan kelib chiqadiki, izobatik jarayon davomida tananing olgan issiqlik miqdori tengdir.
yoki integral shaklda
![]()
Shuning uchun, bosim doimiy bo'lib qolsa, tana tomonidan qabul qilingan issiqlik miqdori entalpiya o'sishiga teng bo'ladi. (109.19) ifodani (109.4) ga nisbatan farqlash beradi
Shu yerdan xulosa qilamiz. entalpiya - o'zgaruvchilardagi termodinamik potensial.Uning qisman hosilalari
![]()
Agar harorat va bosim o'zgarmas bo'lsa, (109.16) munosabatni quyidagicha yozish mumkin:
Bu formuladan kelib chiqadiki, doimiy harorat va bosimda sodir bo'ladigan qaytarilmas jarayon termodinamik Gibbs potensialining pasayishi bilan birga keladi. Muvozanatga erishilganda, G vaqt o'tishi bilan o'zgarishni to'xtatadi. Shunday qilib, doimiy T va muvozanat holatida termodinamik Gibbs potentsiali minimal bo'lgan holat (qarang. (109.17)).
Jadvalda. 109.1 termodinamik potentsiallarning asosiy xususiyatlarini ko'rsatadi.
109.1-jadval

Mavzu bo'yicha ma'ruza: "Termodinamik potentsiallar"
1. Energiya o'lchamiga ega bo'lgan "E F G H" potentsiallar guruhi.
2. Termodinamik potensiallarning zarrachalar soniga bog'liqligi. Entropiya termodinamik potentsial sifatida.
3. Ko'p komponentli tizimlarning termodinamik potensiallari.
4. Termodinamik potensiallar usulini amaliy tadbiq qilish (kimyoviy muvozanat masalasi misolida).
Zamonaviy termodinamikaning asosiy usullaridan biri termodinamik potensiallar usulidir. Bu usul asosan klassik mexanikada potentsiallardan foydalanish tufayli paydo bo'ldi, bu erda uning o'zgarishi bajarilgan ish bilan bog'liq edi va potentsialning o'zi termodinamik tizimning energiya xarakteristikasi hisoblanadi. Tarixiy jihatdan dastlab kiritilgan termodinamik potentsiallar ham energiya o'lchamiga ega bo'lib, ularning nomini aniqladi.
Ushbu guruhga quyidagi tizimlar kiradi:
Ichki energiya;
Erkin energiya yoki Helmgolts salohiyati;
Gibbs termodinamik salohiyati;
Entalpiya.
Ichki energiyaning potentsiali oldingi mavzuda ko'rsatilgan. Bu qolgan miqdorlarning potentsialini nazarda tutadi.
Termodinamik potentsiallarning differentsiallari quyidagi shaklda bo'ladi:
(3.1) munosabatlardan ko'rinib turibdiki, mos keladigan termodinamik potentsiallar bir xil termodinamik tizimni turli usullar bilan tavsiflaydi .... tavsiflar (termodinamik tizim holatini o'rnatish usullari). Shunday qilib, adiabatik uchun izolyatsiya qilingan tizim, o'zgaruvchilarda tasvirlangan, ichki energiyani termodinamik potentsial sifatida ishlatish qulay.Keyin tizimning termodinamik jihatdan potentsiallarga konjugatsiyalangan parametrlari munosabatlardan aniqlanadi:
Agar tavsiflash usuli sifatida o'zgaruvchilar tomonidan berilgan "termostatdagi tizim" ishlatilsa, potentsial sifatida erkin energiyadan foydalanish eng qulaydir. Shunga ko'ra, tizim parametrlari uchun biz quyidagilarni olamiz:
Keyinchalik, biz uni tavsiflash usuli sifatida "piston ostidagi tizim" modelini tanlaymiz. Bu hollarda holat funksiyalari to‘plamni () hosil qiladi va termodinamik potensial sifatida Gibbs potensiali G ishlatiladi.So‘ngra quyidagi ifodalardan tizim parametrlari aniqlanadi:
Va "piston ustidagi adiabatik tizim" bo'lsa, funksiyalar orqali beriladi holatda, termodinamik potentsial rolini entalpiya H o'ynaydi. Keyin tizim parametrlari shaklni oladi:
Chunki munosabatlar (3.1) belgilaydi umumiy farqlar termodinamik potentsiallar, biz ularning ikkinchi hosilalarini tenglashtirishimiz mumkin.
Masalan, shuni hisobga olgan holda
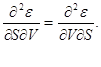
olamiz
Xuddi shunday, termodinamik potentsial bilan bog'liq tizimning qolgan parametrlari uchun biz yozamiz:
Shunga o'xshash identifikatsiyalar tizimning termodinamik holatining boshqa parametrlari to'plami uchun ham tegishli termodinamik funktsiyalarning potentsialiga asoslangan holda yozilishi mumkin.
Shunday qilib, potentsialga ega "termostatdagi tizim" uchun bizda:
Gibbs potentsialiga ega "piston ustidagi" tizim uchun tengliklar amal qiladi:
Va nihoyat, H potentsialiga ega adiabatik pistonli tizim uchun biz quyidagilarni olamiz:
(3.6) - (3.9) ko'rinishdagi tenglamalar termodinamik o'ziga xosliklar deb ataladi va bir qator hollarda amaliy hisoblar uchun qulay bo'lib chiqadi.
Termodinamik potentsiallardan foydalanish tizimning ishlashini va issiqlik effektini aniqlashni ancha osonlashtiradi.
Shunday qilib, munosabatlar (3.1) quyidagilarni nazarda tutadi:
Tenglikning birinchi qismidan issiqlik izolyatsiyalangan tizimning () ishi uning ichki energiyasining kamayishi tufayli amalga oshiriladigan ma'lum qoidadan kelib chiqadi. Ikkinchi tenglik erkin energiya ichki energiyaning izotermik jarayonda to'liq ishga aylanadigan qismi ekanligini anglatadi (mos ravishda ichki energiyaning "qolgan" qismi ba'zan bog'langan energiya deb ataladi).
Issiqlik miqdori quyidagicha ifodalanishi mumkin:
Oxirgi tenglikdan nega entalpiya issiqlik miqdori deb ham atalishi aniq. Yonayotganda va boshqalar kimyoviy reaksiyalar doimiy bosimda sodir bo'ladigan (), chiqarilgan issiqlik miqdori entalpiya o'zgarishiga teng.
Termodinamikaning ikkinchi qonunini (2.7) hisobga olgan holda (3.11) ifoda issiqlik sig'imini aniqlashga imkon beradi:
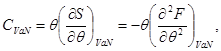

Energiya tipidagi barcha termodinamik potentsiallar qo'shilish xususiyatiga ega. Shunday qilib, biz yozishimiz mumkin:
Gibbs potentsialida faqat bitta qo'shimcha parametr mavjudligini ko'rish oson, ya'ni. Gibbsning o'ziga xos potentsiali unga bog'liq emas. Keyin (3.4) dan quyidagicha:
Ya'ni, kimyoviy potentsial o'ziga xos Gibbs potensiali bo'lib, tenglik sodir bo'ladi
Termodinamik potentsiallar (3.1) o'zaro bevosita aloqalar bilan bog'langan bo'lib, ular bir potentsialdan ikkinchisiga o'tish imkonini beradi. Masalan, barcha termodinamik potentsiallarni ichki energiya bilan ifodalaymiz.
Bunda biz barcha termodinamik potentsiallarni () funksiyasi sifatida oldik. Ularni boshqa o'zgaruvchilarda ifodalash uchun re… protsedurasidan foydalaning.
Bosim o'zgaruvchilarda ():
Oxirgi ifodani holat tenglamasi sifatida yozamiz, ya'ni. formasini toping
Ko'rinib turibdiki, agar holat o'zgaruvchida () berilgan bo'lsa, u holda termodinamik potentsial ichki energiyadir.(3.2) yordamida biz topamiz.
(3.18) ni S uchun tenglama sifatida qarasak, uning yechimini topamiz:
(3.19) ni (3.17) ga almashtirib, olamiz
Ya'ni o'zgaruvchilardan () biz o'zgaruvchilarga () o'tdik.
Termodinamik potentsiallarning ikkinchi guruhi, agar yuqorida ko'rib chiqilganlarga qo'shimcha ravishda, kimyoviy potentsial termodinamik o'zgaruvchilar sifatida kiritilgan bo'lsa, paydo bo'ladi. Ikkinchi guruh potentsiallari ham energiya o'lchamiga ega va birinchi guruhning potentsiallari bilan quyidagi munosabatlar bilan bog'lanishi mumkin:
Shunga ko'ra, potentsial farqlar (3.21) quyidagi shaklga ega:
Birinchi guruhning termodinamik potentsiallari kabi (3.21) potentsiallar uchun termodinamik identifikatsiyalarni qurish, termodinamik tizim parametrlari uchun ifodalarni topish va hokazo.
Keling, kvazi-erkin energiyani ifodalovchi va guruhning boshqa potentsiallari orasida amalda eng ko'p qo'llaniladigan "omega potensiali" uchun xarakterli munosabatlarni ko'rib chiqaylik (3.22).
Potensial xayoliy devorlarga ega termodinamik tizimni tavsiflovchi o'zgaruvchilarda () berilgan. Bu holda tizim parametrlari munosabatlardan aniqlanadi:
Potensialdan kelib chiqadigan termodinamik identifikatsiyalar quyidagi shaklga ega:
Ikkinchi guruh termodinamik potentsiallarining qo'shimcha xususiyatlari juda qiziq. Bu holda zarrachalar soni tizimning parametrlari orasida bo'lmaganligi sababli, hajm qo'shimcha parametr sifatida ishlatiladi. Keyin potentsial uchun biz olamiz:
Bu erda - 1 uchun o'ziga xos potentsial. (3.23) ni hisobga olgan holda, biz quyidagilarni olamiz:
Shunga ko'ra, (3.26)
(3.26) ning to'g'riligi (3.15) asosida ham isbotlanishi mumkin:
Potensial shaklda yozilgan termodinamik funksiyalarni shaklga aylantirish uchun ham ishlatilishi mumkin. Buning uchun N uchun (3.23) munosabat:
ruxsat etilgan:
Termodinamik potentsial sifatida nafaqat tizimning energiya xarakteristikalari, balki (3.1) munosabatga kiritilgan boshqa kattaliklar ham harakat qilishi mumkin. Muhim misol sifatida, entropiyani termodinamik potentsial sifatida ko'rib chiqing. Entropiya uchun dastlabki differensial munosabat termodinamikaning I va II tamoyillarining umumlashtirilgan yozuvidan kelib chiqadi:
Shunday qilib, entropiya parametrlar bilan berilgan tizim uchun termodinamik potentsialdir. Boshqa tizim parametrlari quyidagicha ko'rinadi:
Birinchi munosabatlarni (3.28) hal qilish orqali o'zgaruvchilardan o'zgaruvchilarga o'tish nisbatan mumkin.
Entropiyaning qo'shimcha xususiyatlari ma'lum munosabatlarga olib keladi:
Keling, termodinamik tizimning berilgan makroskopik holatlari asosida termodinamik potentsiallarni aniqlashga o'tamiz. Hisob-kitoblarni soddalashtirish uchun biz tashqi maydonlar yo'qligini taxmin qilamiz (). Bu natijalarning umumiyligini kamaytirmaydi, chunki qo'shimcha tizimlar oddiygina uchun olingan ifodalarda paydo bo'ladi.
Misol tariqasida, holat tenglamasi, holatning kaloriya tenglamasi va tizimning xatti-harakatlarini boshlang'ich sifatida ishlatib, erkin energiya uchun ifodalarni topamiz. (3.3) va (3.12) ni hisobga olgan holda biz quyidagilarni topamiz:
(3.30) sistemaning ikkinchi tenglamasini quyidagi chegaraviy shartni hisobga olgan holda integrallaymiz:
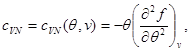
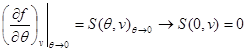

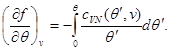
Keyin (3.30) tizim quyidagi shaklni oladi:
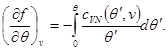
(3.31) sistemaning yechimi shakldagi xususiy erkin energiyani topish imkonini beradi
Maxsus erkin energiyaning kelib chiqishini quyidagi shartlardan ham topish mumkin:
Keyin (3.32) quyidagi shaklni oladi:
va tizimning qo'shimcha konstantagacha bo'lgan butun erkin energiyasining ifodasi quyidagi shaklni oladi:
Keyin tizimning tashqi maydonni kiritishiga reaktsiyasi holat o'zgaruvchilari to'plamiga qarab quyidagi shaklga ega bo'lgan qo'shimcha holat tenglamasi bilan beriladi:
Keyin nolni noldan kiritish bilan bog'liq mos keladigan termodinamik potentsialning o'zgarishi quyidagi ifodalardan aniqlanadi:
Shunday qilib, makroskopik nazariyada termodinamik potentsialni belgilash faqat foydalanish asosida mumkin berilgan tenglamalar termodinamik holatlar, ular o'z navbatida termodinamik potentsiallarni belgilash asosida olinadi. Buni buzing " ayovsiz doira” faqat mikroskopik nazariya asosida mumkin bo'lib, bunda tizimning holati statistik xususiyatlarni hisobga olgan holda taqsimlash funktsiyalari asosida o'rnatiladi.
Olingan natijalarni ko'p komponentli tizimlar holatiga umumlashtiramiz. Ushbu umumlashtirish parametrni to'plam bilan almashtirish orqali amalga oshiriladi. Keling, aniq misollarni ko'rib chiqaylik.
Buni taxmin qilaylik termodinamik holat tizim parametrlar bilan beriladi, ya'ni. Biz termostatdagi bir nechta komponentlardan tashkil topgan, zarrachalar soni teng bo'lgan tizimni ko'rib chiqamiz erkin energiya, bu tavsifda termodinamik potentsial shaklga ega:
(3.37) dagi qo'shimcha parametr zarrachalar soni emas, balki tizimning hajmi V. Keyin tizimning zichligi bilan belgilanadi. Funktsiya qo'shimchasiz argumentlarning qo'shimcha bo'lmagan funktsiyasidir. Bu juda qulay, chunki tizim qismlarga bo'linganda, funktsiya har bir qism uchun o'zgarmaydi.
Keyin termodinamik tizimning parametrlari uchun quyidagilarni yozishimiz mumkin:
Bizda borligini hisobga olsak
Shaxsiy komponentning kimyoviy potentsiali uchun biz yozamiz:
Erkin energiyaning qo'shimcha xususiyatlarini hisobga olishning boshqa usullari mavjud. Keling, har bir komponentning zarrachalari sonining nisbiy zichligini kiritamiz:

tizim hajmidan mustaqil V. Bu erda - umumiy soni tizimdagi zarralar. Keyin
Bu holda kimyoviy potentsialning ifodasi yanada murakkab shaklni oladi:
va ning hosilalarini hisoblang va ularni oxirgi ifodaga almashtiring:
Bosim ifodasi, aksincha, soddalashtiriladi:
Shunga o'xshash munosabatlarni Gibbs potentsiali uchun ham olish mumkin. Shunday qilib, agar hajm qo'shimcha parametr sifatida berilgan bo'lsa, (3.37) va (3.38) ni hisobga olgan holda biz yozamiz:
xuddi shu ifodani (3.yu) dan olish mumkin, u koʻp zarrachalarda quyidagi shaklni oladi:
(3.39) ifodani (3.45) ga almashtirib, biz quyidagilarni topamiz:
(3.44) bilan to'liq mos keladi.
An'anaviy Gibbs potentsial yozuviga o'tish uchun (holat o'zgaruvchilari orqali ()) tenglamani echish kerak (3.38):
V jildga kelsak, natijani (3.44) yoki (3.45) ga almashtiring:
Agar qo'shimcha parametr sifatida tizimdagi zarrachalarning umumiy soni N berilgan bo'lsa, u holda (3.42) hisobga olingan holda Gibbs potentsiali quyidagi shaklni oladi:
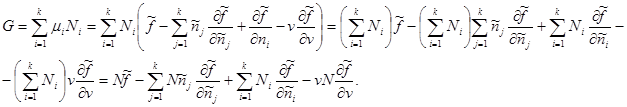
Muayyan qiymatlarning turini bilib, biz quyidagilarni olamiz:
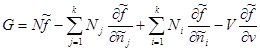
Oxirgi ifodada jamlash tugadi j yig'indisi bilan almashtiring i. Keyin ikkinchi va uchinchi a'zolar nolga teng bo'ladi. Keyin Gibbs potentsiali uchun biz nihoyat qo'lga kiritamiz:
Xuddi shu munosabatni boshqa yo'l bilan ham olish mumkin ((3.41) va (3.43) dan):
Keyin har bir komponentning kimyoviy potentsiali uchun biz quyidagilarni olamiz:
(3.48) ning hosilasida (3.42) ning hosilasidagiga o'xshash transformatsiyalar xayoliy devorlar yordamida amalga oshirildi. Tizim holati parametrlari to'plamni () hosil qiladi.
Termodinamik potentsial rolini potentsial o'ynaydi, u quyidagi shaklni oladi:
(3.49) dan ko'rinib turibdiki, bu holda yagona qo'shimcha parametr tizim V hajmidir.
Keling, bunday tizimning ba'zi termodinamik parametrlarini aniqlaylik. Bu holda zarrachalar soni quyidagi nisbatdan aniqlanadi:
Erkin energiya uchun F va Gibbs salohiyati G yozilishi mumkin:
Shunday qilib, ko'p komponentli tizimlar holatida termodinamik potentsiallar va parametrlar uchun munosabatlar faqat har bir komponentning zarrachalari (yoki kimyoviy potentsiallari) sonini hisobga olish zarurati tufayli o'zgartiriladi. Shu bilan birga, termodinamik potentsiallar usuli va unga asoslangan hisob-kitoblar g'oyasi o'zgarishsiz qolmoqda.
Termodinamik potentsiallar usulidan foydalanishga misol sifatida kimyoviy muvozanat masalasini ko'rib chiqing. Reaksiyaga kiruvchi uchta modda aralashmasidagi kimyoviy muvozanat shartlari topilsin. Bundan tashqari, biz boshlang'ich reaktsiya mahsulotlari kam uchraydigan gazlar deb taxmin qilamiz (bu molekulalararo o'zaro ishlab chiqarishni e'tiborsiz qoldirishga imkon beradi) va tizim doimiy harorat va bosim, (bunday jarayonni amalda qo'llash eng oson, shuning uchun kimyoviy reaktsiya uchun sanoat inshootlarida bosim va haroratning doimiyligi sharti yaratiladi).
Termodinamik tizimning muvozanat holati, uni tasvirlash usuliga qarab, tizimning maksimal entropiyasi yoki tizimning minimal energiyasi bilan belgilanadi (batafsilroq, Bazarov termodinamikasiga qarang). Keyin tizim uchun quyidagi muvozanat shartlarini olishimiz mumkin:
1. () parametrlari bilan berilgan adiabatik izolyatsiyalangan termodinamik tizimning muvozanat holati entropiya maksimal bilan tavsiflanadi:
(3.53a) dagi ikkinchi ifoda muvozanat holatining barqarorligini tavsiflaydi.
2. () parametrlari bilan berilgan izoxorik-izotermik sistemaning muvozanat holati erkin energiyaning minimal bilan tavsiflanadi. Bu holda muvozanat sharti quyidagi shaklni oladi:
3. () parametrlari bilan berilgan izobar-izotermik sistemaning muvozanati quyidagi shartlar bilan tavsiflanadi:
4. () parametrlari bilan aniqlangan zarrachalar soni o'zgaruvchan bo'lgan termostatdagi tizim uchun muvozanat sharoitlari potentsial minimallar bilan tavsiflanadi:
Keling, bizning holatimizda kimyoviy muvozanatdan foydalanishga murojaat qilaylik.
Umumiy holda, kimyoviy reaksiya tenglamasi quyidagicha yoziladi:
Bu erda belgilar kimyoviy moddalar, - stoxiometrik sonlar deb ataladi. Shunday qilib, reaktsiya uchun
Bosim va harorat tizimning parametrlari sifatida tanlanganligi sababli, ular doimiy deb hisoblanadi. Gibbs potentsialini termodinamik potensial holati sifatida ko'rib chiqish qulay G. Shunda tizim uchun muvozanat sharti potentsialning doimiyligi talabidan iborat bo'ladi G:
Biz uch komponentli tizimni ko'rib chiqayotganimiz sababli, biz o'rnatdik Bundan tashqari, (3.54) ni hisobga olgan holda, zarrachalar soni uchun balans tenglamasini yozishimiz mumkin ():
Komponentlarning har biri uchun kimyoviy potentsiallar bilan tanishish va taxminlarni hisobga olgan holda biz quyidagilarni topamiz:
(3.57) tenglama birinchi marta 1876 yilda Gibbs tomonidan olingan. va kerakli kimyoviy muvozanat tenglamasidir. (3.57) va (3.54) ni solishtirsak, kimyoviy muvozanat tenglamasi kimyoviy reaksiya tenglamasidan oddiygina reaksiyaga kirishuvchi moddalarning belgilarini kimyoviy potentsiallari bilan almashtirish orqali olinganligini ko'rish oson. Bu usuldan ixtiyoriy reaksiya uchun kimyoviy muvozanat tenglamasini yozishda ham foydalanish mumkin.
Umumiy holatda (3.57) tenglamaning yechimi hatto uchta komponent uchun ham yetarlicha yuklangan. Bu, birinchidan, bir komponentli tizim uchun ham kimyoviy potentsialning aniq ifodalarini olish juda qiyinligi bilan bog'liq. Ikkinchidan, nisbiy konsentratsiyalar va kichik miqdorlar emas. Ya'ni, ular ustida ketma-ket kengaytirishni amalga oshirish mumkin emas. Bu kimyoviy muvozanat tenglamasini yechish masalasini yanada murakkablashtiradi.
Jismoniy jihatdan qayd etilgan qiyinchiliklar qayta qurishni hisobga olish zarurati bilan izohlanadi elektron qobiqlar reaksiyaga kirishuvchi atomlar. Bu mikroskopik tavsifda ma'lum qiyinchiliklarga olib keladi, bu ham makroskopik yondashuvga ta'sir qiladi.
Biz o'zimizni gazning siyraklanishini o'rganish bilan cheklanishga rozi bo'lganimiz sababli, biz modeldan foydalanishimiz mumkin ideal gaz. Biz barcha reaksiyaga kirishuvchi komponentlar umumiy hajmni to'ldiruvchi va bosim hosil qiluvchi ideal gazlar deb hisoblaymiz p. Bunday holda, gaz aralashmasining tarkibiy qismlari o'rtasidagi har qanday o'zaro ta'sirni (kimyoviy reaktsiyalardan tashqari) e'tiborsiz qoldirish mumkin. Bu bizga kimyoviy potentsial deb taxmin qilish imkonini beradi i-chi komponent faqat bir xil komponentning parametrlariga bog'liq.
Bu yerda - qisman bosim i-chi komponent va:
(3.58) ni hisobga olsak, uch komponentli tizim (3.57) uchun muvozanat sharti quyidagi shaklni oladi:
Keyinchalik tahlil qilish uchun biz ideal gazning holati tenglamasidan foydalanamiz, biz uni quyidagi shaklda yozamiz:
Bu erda, avvalgidek, biz termodinamik haroratni belgilaymiz. Keyin maktabdan ma'lum bo'lgan yozuv quyidagi shaklni oladi: (3.60) da yozilgan.
Keyin aralashmaning har bir komponenti uchun biz olamiz:
Ideal gazning kimyoviy potensialini ifodalash shaklini aniqlaymiz. (2.22) dan kelib chiqqan holda, kimyoviy potentsial quyidagi shaklga ega:
Shaklda yozilishi mumkin bo'lgan (3.60) tenglamani hisobga olgan holda, kimyoviy potentsialni aniqlash masalasi o'ziga xos entropiya va o'ziga xos ichki energiyani aniqlashga tushiriladi.
Muayyan entropiya uchun tenglamalar tizimi termodinamik identifikatsiyadan (3.8) va issiqlik sig'imi ifodasidan (3.12) kelib chiqadi:
(3.60) holat tenglamasini hisobga olgan holda va o'ziga xos xususiyatlarga o'tsak, biz quyidagilarga ega bo'lamiz:
(3.63) yechim quyidagi shaklga ega:
Ideal gazning solishtirma ichki energiyasi uchun tenglamalar tizimi (2.23) dan kelib chiqadi:
Ushbu tizimning yechimini quyidagicha yozish mumkin:
(3.64) - (3.65) ni (3.66) ga almashtirib, ideal gazning holat tenglamasini hisobga olsak:
Aralash uchun ideal gazlar(3.66) ifoda quyidagi shaklni oladi:
(3.67) ni (3.59) ga almashtirsak, biz quyidagilarni olamiz:
Transformatsiyalarni amalga oshirib, biz yozamiz:

Oxirgi ifodada potentsiallashtirishni amalga oshirsak, bizda:
Munosabat (3.68) massa ta'siri qonuni deyiladi. Qiymat faqat haroratning funktsiyasi bo'lib, kimyoviy reaktsiyaning komponenti deb ataladi.
Shunday qilib, kimyoviy muvozanat va kimyoviy reaktsiyaning yo'nalishi bosim va haroratning kattaligi bilan belgilanadi.
Termodinamik potensiallar, Schuka, 36-bet
Termodinamik potensiallar, Schuka, 36-bet
Izolyatsiya qilingan tizimlar uchun bu munosabat entropiya hech qachon kamayishi mumkin bo'lmagan klassik formulaga tengdir. Bunday xulosani Nobel mukofoti laureati I. R. Prigoji tahlil qilib chiqdi ochiq tizimlar. U bu tamoyilni ham ilgari surdi muvozanatning buzilishi tartib manbai bo'lib xizmat qilishi mumkin.
Uchinchi boshlanish termodinamika tizimning mutlaq nolga yaqin holatini tavsiflaydi. Termodinamikaning uchinchi qonuniga muvofiq, u entropiya mos yozuvlar nuqtasini o'rnatadi va uni har qanday tizim uchun o'rnatadi. Da T 0 issiqlik kengayish koeffitsientini, har qanday jarayonning issiqlik sig'imini yo'qotadi. Bu bizga qachon degan xulosaga kelishimizga imkon beradi mutlaq nol harorat, holatdagi har qanday o'zgarish entropiya o'zgarmasdan sodir bo'ladi. Bu bayonot Nobel mukofoti laureati V. G. Nernst teoremasi yoki termodinamikaning uchinchi qonuni deb ataladi.
Termodinamikaning uchinchi qonuni shunday deydi :
mutlaq nolga asosan erishib bo'lmaydi, chunki at T = 0 va S = 0.
Agar harorat nolga teng bo'lgan jism mavjud bo'lsa, u holda termodinamikaning ikkinchi qonuniga zid bo'lgan ikkinchi turdagi abadiy harakat mashinasini qurish mumkin edi.
Tizimdagi kimyoviy muvozanatni hisoblash uchun termodinamikaning uchinchi qonunini o'zgartirish Nobel mukofoti sovrindori M. Plank tomonidan shunday shakllantirilgan.
Plank postulati : absolyut nol haroratda entropiya qiymatini oladi S 0 , bosim, agregatsiya holati va moddaning boshqa xususiyatlaridan mustaqil. Bu qiymat nolga o'rnatilishi mumkin, yokiS 0 = 0.
Statistik nazariyaga ko'ra, entropiya qiymati quyidagicha ifodalanadi S = ln, bu yerda Boltsman doimiysi, - statistik og'irlik yoki makrostatlarning termodinamik ehtimoli. U -potentsial deb ham ataladi. Statistik og'irlik ostida biz ma'lum bir makrostate amalga oshiriladigan mikroholatlar sonini tushunamiz. Ideal kristalning entropiyasi T = 0 K, ga bo'ysunadi = 1 yoki makroholatni bitta mikroholat tomonidan amalga oshirish mumkin bo'lgan holatda, nolga teng. Boshqa barcha holatlarda mutlaq noldagi entropiya qiymati noldan katta bo'lishi kerak.
3.3. Termodinamik potensiallar
Termodinamik potentsiallar ma'lum termodinamik parametrlar to'plamining funktsiyalari bo'lib, tizimning barcha termodinamik xususiyatlarini xuddi shu parametrlarning funktsiyasi sifatida topishga imkon beradi..
Termodinamik potentsiallar tizimning termodinamik holatini to'liq aniqlaydi va har qanday tizim parametrlarini differentsiallash va integratsiyalash orqali hisoblash mumkin.
Asosiy termodinamik potentsiallarga quyidagi funktsiyalar kiradi .
1. Ichki energiya U, bu mustaqil o'zgaruvchilarning funktsiyasi:
entropiya S,
hajmi V,
zarrachalar soni N,
umumlashtirilgan koordinatalar x i
yoki U = U(S, V, N, x i).
2. Gelmgoltsning erkin energiyasi F haroratning funksiyasidir T, hajm V, zarrachalar soni N, umumlashtirilgan koordinata x i shunday qilib F = F(T, V, N, x t).
3. Gibbs termodinamik potensiali G = G(T, p, N, x i).
4. Entalpiya H =H(S, P, N, x i).
5. Termodinamik potentsial , buning uchun mustaqil o'zgaruvchilar haroratdir T, hajmi V, kimyoviy potentsial x, = (T, V, N, x i).
Termodinamik potentsiallar o'rtasida klassik munosabatlar mavjud:
U = F + TS = H – PV,
F = U – TS = H – TS – PV,
H = U + PV = F + TS + PV,
G = U – TS + PV = F + PV = H – TS,
= U – TS – V = F – N = H – TS – N, (3.12)
U = G + TS – PV = + TS + N,
F = G – PV = + N,
H = G + TS = + TS + N,
G = + PV + N,
= G – PV – N.
Termodinamik potentsiallarning mavjudligi termodinamikaning birinchi va ikkinchi qonunlarining natijasi bo'lib, tizimning ichki energiyasini ko'rsatadi. U faqat tizimning holatiga bog'liq. Tizimning ichki energiyasi makroskopik parametrlarning to'liq to'plamiga bog'liq, lekin bu holatga erishish yo'liga bog'liq emas. Ichki energiyani differentsial shaklda yozamiz
dU = TdS– PdV– X i dx i + dN,
T = ( U/ S) V, N, x= const,
P = –( U/ V) S, N, x= const,
= ( U/ N) S, N, x= const.
Xuddi shunday, yozish mumkin
dF = – SdT–PdV – X t dx t + dN,
dH= TdS+VdP– X t dx t + dN,
dG= – SdT+VdP – X i dx i + dN,
d = – SdT–PdV – X t dx t – Ndn,
S = – ( F/ T) V ; P = –( F/ V) T ; T = ( U/ S) V ; V = ( U/ P) T ;
S = – ( G/ T) P ; V = ( G/ P) S ; T = ( H/ S;); P = – ( U/ V) S
S = – ( F/ T); N = – ( F/); = ( F/ N); X = – ( U/ x).
Bu tenglamalar muvozanat jarayonlari uchun amal qiladi. Keling, termodinamik izobarik-izotermik potentsialga e'tibor beraylik G, chaqirdi Gibbs bo'sh energiya,
G = U – TS + PV = H –TS, (3.13)
va izoxorik-izotermik potensial
F = U – TS, (3.14)
Bu Helmgolts erkin energiya deb ataladi.
Doimiy bosim va haroratda sodir bo'ladigan kimyoviy reaktsiyalarda,
G = U – TS + PV = N, (3.15)
qayerda kimyoviy potentsialdir.
Tizimning ba'zi tarkibiy qismlarining kimyoviy potentsiali ostida i biz boshqa termodinamik o'zgaruvchilarning doimiy qiymatlarida ushbu komponentning miqdoriga nisbatan termodinamik potentsiallarning qisman hosilasini tushunamiz.
Kimyoviy salohiyat moddaning bitta zarrasi qo'shilganda tizim energiyasining o'zgarishini aniqlaydigan miqdor sifatida ham belgilanishi mumkin, masalan,
i = ( U/ N) S , V= xarajat , yoki G = i N i .
Oxirgi tenglamadan = ekanligi kelib chiqadi G/ N i , ya'ni, zarrachaga Gibbs energiyasidir. Kimyoviy potentsial J/mol bilan o'lchanadi.
Omega potentsiali katta bo'linish funktsiyasi orqali ifodalanadi Z Qanday
= – T ln Z, (3.16)
Qaerda [jamlash tugadi N va k(N)]:
Z= exp[( N – E k (N))/T].






