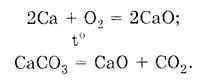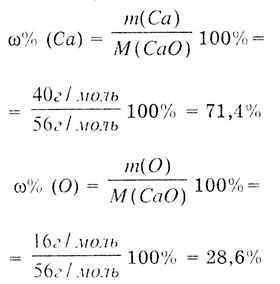Kimya ifadelerinde kütlenin korunumu yasası. Kütle ve enerjinin korunumu yasası. Dünya biliminin en büyük başarısı
Kütlenin korunumu yasası.
Kimyasal reaksiyona giren maddelerin kütlesi, reaksiyon sonucunda oluşan maddelerin kütlesine eşittir.
Kütlenin korunumu yasası, genel doğa yasasının özel bir durumudur - madde ve enerjinin korunumu yasası. Bu yasaya dayanarak, kimyasal reaksiyonlar, kimyasal denklemler kullanılarak, maddelerin kimyasal formülleri ve reaksiyona dahil olan maddelerin nispi miktarlarını (mol sayısı) yansıtan stokiyometrik katsayılar kullanılarak görüntülenebilir.
Örneğin, metanın yanma reaksiyonu aşağıdaki gibi yazılır:
Maddelerin kütlesinin korunumu yasası
(M.V. Lomonosov, 1748; A. Lavoisier, 1789)
Bir kimyasal reaksiyonda yer alan tüm maddelerin kütlesi, reaksiyonun tüm ürünlerinin kütlesine eşittir.
Atom-moleküler teori bu yasayı şu şekilde açıklar: kimyasal reaksiyonlar sonucunda atomlar yok olmaz ve ortaya çıkmazlar, ancak yeniden düzenlenirler (yani kimyasal dönüşüm, atomlar arasındaki bazı bağların kırılması ve atomların oluşumu sürecidir. diğerleri, bunun sonucunda orijinal maddelerin moleküllerinden reaksiyon ürünleri molekülleri elde edilir). Reaksiyon öncesi ve sonrası atom sayısı değişmediği için toplam kütleleri de değişmemelidir. Kütle, madde miktarını karakterize eden bir miktar olarak anlaşıldı.
20. yüzyılın başında, kütlenin korunumu yasasının formülasyonu, bir cismin kütlesinin hızına bağlı olduğu görelilik teorisinin (A. Einstein, 1905) ortaya çıkmasıyla bağlantılı olarak revize edildi ve bu nedenle, yalnızca maddenin miktarını değil, aynı zamanda hareketini de karakterize eder. Cismin aldığı enerji E, kütlesindeki m artışla E = m c2 bağıntısıyla ilişkilidir, burada c ışık hızıdır. Bu oran kimyasal reaksiyonlarda kullanılmaz çünkü 1 kJ enerji ~10 -11 g kütle değişimine karşılık gelir ve m zor ölçülebilir. AT nükleer reaksiyonlarЕ kimyasal reaksiyonlardan ~10 6 kat daha büyük olduğunda, m dikkate alınmalıdır.
Kütlenin korunumu yasasına dayanarak, kimyasal reaksiyonlar için denklemler oluşturmak ve bunları hesaplamak için kullanmak mümkündür. Kantitatif kimyasal analizin temelidir.
Kompozisyonun sabitliği kanunu
Bileşim sabitliği yasası ( J.L. proust, 1801 -1808.) - herhangi bir spesifik kimyasal olarak saf bileşik, hazırlanma yönteminden bağımsız olarak, aynı kimyasal elementler, ve kütlelerinin oranları sabittir ve göreceli sayılar onlara atomlar tam sayılar olarak ifade edilir. Bu temel yasalardan biridir. kimya.
Bileşimin değişmezliği yasası aşağıdakiler için geçerli değildir: berthollidler(değişken bileşimli bileşikler). Bununla birlikte, geleneksel olarak, basitlik için, birçok berthollidin bileşimi sabit olarak kaydedilir. Örneğin, kompozisyon demir(II) oksit FeO olarak yazılır (daha kesin formül Fe 1-x O yerine).
|
SABİT BİLEŞİM YASASI |
|
Bileşimin sabitliği yasasına göre, herhangi bir saf madde, hazırlanma yönteminden bağımsız olarak sabit bir bileşime sahiptir. Böylece, kalsiyum oksit aşağıdaki şekillerde elde edilebilir:
CaO maddesinin nasıl elde edildiğine bakılmaksızın, sabit bir bileşime sahiptir: bir kalsiyum atomu ve bir oksijen atomu, kalsiyum oksit CaO molekülünü oluşturur. CaO'nun molar kütlesini belirleyin:
Ca'nın kütle fraksiyonunu aşağıdaki formülle belirleriz:
Sonuç: Kimyasal olarak saf oksitte, kalsiyumun kütle oranı her zaman %71.4 ve oksijen %28.6'dır. |
Çoklu oranlar kanunu
Çoklu oranlar kanunu bunlardan biridir. stokiyometrik yasalar kimya: eğer iki maddeler (basit veya zor) birbirleriyle birden fazla bileşik oluştururlarsa, bir maddenin aynı kütlesi başına başka bir maddenin kütleleri şu şekilde ilişkilidir: tüm sayılar, genellikle küçük.
Örnekler
1) Azot oksitlerin bileşimi (kütle olarak yüzde olarak) aşağıdaki sayılarla ifade edilir:
|
Azot oksit N 2 Ö |
Nitrik oksit HAYIR |
Nitröz anhidrit N 2 Ö 3 |
Azot dioksit HAYIR 2 |
Nitrik anhidrit N 2 Ö 5 |
|
|
Özel O/N |
Alt sıradaki sayıları 0,57'ye bölersek 1:2:3:4:5 olarak ilişkili olduklarını görürüz.
2) Kalsiyum klorür su ile formlar 4 kristal hidrat Bileşimi aşağıdaki formüllerle ifade edilir: CaCl 2 H 2 O, CaCl 2 2H 2 O, CaCl 2 4H 2 O, CaCl 2 6H 2 O, yani tüm bu bileşiklerde, CaCl molekülü 2 başına su kütlesi 1:2:4:6 ile ilgili.
Hacimsel İlişkiler Yasası
(Gay-Lussac, 1808)
"Kimyasal tepkimelere giren gazların hacimleri ile tepkime sonucunda oluşan gazların hacimleri birbiriyle küçük tamsayılar olarak ilişkilidir."
Sonuçlar. Gaz halindeki maddelerin molekülleri için kimyasal reaksiyon denklemlerindeki stokiyometrik katsayılar, gaz halindeki maddelerin hangi hacim oranlarında reaksiyona girdiğini veya elde edildiğini gösterir.
2CO + O 2 2CO 2
İki hacim karbon monoksit (II) bir hacim oksijen ile oksitlendiğinde 2 hacim karbon dioksit oluşur, yani. ilk reaksiyon karışımının hacmi 1 hacim azaltılır.
b) Elementlerden amonyak sentezinde:
n 2 + 3h 2 2nh 3
Bir hacim nitrojen, üç hacim hidrojen ile reaksiyona girer; bu durumda 2 hacim amonyak oluşur - ilk gaz halindeki reaksiyon kütlesinin hacmi 2 kat azalacaktır.
Klaiperon-Mendeleev denklemi
Herhangi bir gazın herhangi bir kütlesi için birleşik gaz yasasını yazarsak, Claiperon-Mendeleev denklemini elde ederiz:
burada m gazın kütlesidir; M moleküler ağırlıktır; p - basınç; V - hacim; T - mutlak sıcaklık (°K); R, evrensel gaz sabitidir (8.314 J / (mol K) veya 0.082 l atm / (mol K)).
Belirli bir gazın belirli bir kütlesi için m/M oranı sabittir, dolayısıyla birleşik gaz yasası Claiperon-Mendeleev denkleminden türetilir.
17 ° C sıcaklıkta ve 84 g ağırlığında 250 kPa karbon monoksit (II) basıncında hangi hacim alacak?
CO mol sayısı:
(CO) \u003d m (CO) / M (CO) \u003d 84 / 28 \u003d 3 mol
n.c.'de CO hacmi dır-dir
3 22,4 l = 67,2 l
Boyle-Mariotte ve Gay-Lussac'ın birleşik gaz yasasından:
(P V) / T = (P 0 V 0) / T 2
V (CO) \u003d (P 0 T V 0) / (PT 0) \u003d (101.3 (273 + 17) 67.2) / (250 273) \u003d 28.93 l
Gazların bağıl yoğunluğu, 1 mol gazın 1 mol gazdan kaç kez daha ağır (veya daha hafif) olduğunu gösterir.
D A(B) = (B) (A) = M (B) / M (A)
Bir gaz karışımının ortalama moleküler ağırlığı, karışımın toplam kütlesinin toplam mol sayısına bölünmesine eşittir:
M cf \u003d (m 1 + .... + m n) / ( 1 + .... + n) \u003d (M 1 V 1 + .... M n V n) / ( 1 + .. .. + n)
ENERJİ KORUMASI HUKUKU : izolasyonda. sistemin enerjisi sabit kalır, sadece bir enerji türünün diğerine geçişleri mümkündür. Enerji korunumu termodinamiğinde, yasa, Q \u003d DU + W denklemi ile ifade edilen termodinamiğin birinci yasasına karşılık gelir; burada Q, sisteme iletilen ısı sayısıdır, DU, ext'deki değişikliktir. sistemin enerjisi, W sistem tarafından yapılan iştir. Enerjinin korunumu yasasının özel bir durumu Hess yasasıdır.
Enerji kavramı, görelilik teorisinin ortaya çıkışıyla bağlantılı olarak revize edildi (A. Einstein, 1905): toplam enerji E, kütle m ile orantılıdır ve onunla, E = mc2 ilişkisi ile ilişkilidir, burada c, ışık hızı. Bu nedenle kütle, enerji birimlerinde ifade edilebilir ve kütle ile enerjinin korunumuna ilişkin daha genel bir yasayı formüle edebilir: izolirde. Bir sistemde, kütlelerin ve enerjinin toplamı sabittir ve yalnızca bazı enerji biçimlerinin kesinlikle eşdeğer oranlarında diğerlerine dönüşümleri ve kütle ve enerjide eşdeğer olarak ilişkili değişiklikler mümkündür.
Eşdeğerler Yasası
maddeler, eşdeğerleriyle orantılı miktarlarda birbirleriyle etkileşime girer. Bazı problemleri çözerken, bu yasanın farklı bir formülasyonunu kullanmak daha uygundur: birbirleriyle reaksiyona giren maddelerin kütleleri (hacimleri), eşdeğer kütleleri (hacimleri) ile orantılıdır.
eşdeğerler: kimyasal elementler, eşdeğerlerine karşılık gelen kesin olarak tanımlanmış miktarlarda birbirleriyle birleşir. Eşdeğerler yasasının matematiksel ifadesi şu şekildedir: m1 ve m2 reaksiyona giren veya oluşan maddelerin kütleleri olduğunda, m eq (1) ve m eq (2) bu maddelerin eşdeğer kütleleridir.
Örneğin: eşdeğer kütlesi 28 g / mol olan belirli bir miktarda metal, normal koşullar altında ölçülen 0,7 litre hidrojeni bir asitten uzaklaştırır. Metalin kütlesini belirleyin. Çözüm: Hidrojenin eşdeğer hacminin 11,2 l / mol olduğunu bilerek, bu bir orantıdır: 28 g metal 11,2 l hidrojene eşittir x g metal 0,7 l hidrojene eşittir. Sonra x \u003d 0.7 * 28 / 11.2 \u003d 1.75 g.
Eşdeğer veya eşdeğer kütleyi belirlemek için hidrojen ile kombinasyonundan devam etmek gerekli değildir. Belirli bir elementin bileşiğinin, eşdeğeri bilinen herhangi bir diğeriyle bileşimi ile belirlenebilirler.
Örneğin: 5,6 g demir kükürt ile birleştirildiğinde, 8,8 g demir sülfür oluşmuştur. Kükürtün eşdeğer kütlesinin 16 g/mol olduğu biliniyorsa, eşdeğer demir kütlesini ve eşdeğerini bulmak gerekir. Çözüm: sorunun koşullarından, demir sülfürde 5.6 g demirin 8.8-5.6 = 3.2 g kükürt olduğu sonucu çıkar. Eşdeğerler yasasına göre, etkileşen maddelerin kütleleri eşdeğer kütleleriyle orantılıdır, yani 5,6 g demir 3,2 g kükürt meq (Fe) 16 g/mol kükürte eşdeğerdir. Buradan m3KB(Fe) = 5.6*16/3.2=28 g/mol olduğu sonucu çıkar. Demir eşdeğeri: 3=meq(Fe)/M(Fe)=28 g/mol:56 g/mol=1/2'dir. Bu nedenle demirin eşdeğeri 1/2 moldür, yani 1 mol demir 2 eşdeğer içerir.
Avogadro yasası
Yasanın sonuçları
Avogadro yasasının ilk sonucu: aynı koşullar altında herhangi bir gazın bir molü aynı hacmi kaplar.
Özellikle normal koşullar altında, yani 0°C (273 K) ve 101,3 kPa'da 1 mol gazın hacmi 22,4 litredir. Bu hacme gazın molar hacmi denir V m . Mendeleev-Clapeyron denklemini kullanarak bu değeri diğer sıcaklık ve basınçlara göre yeniden hesaplayabilirsiniz:
![]() .
.
Avogadro yasasının ikinci sonucu: birinci gazın molar kütlesi ürüne eşittir molar kütle ikinci gaza göre birinci gazın nispi yoğunluğu ile ikinci gazın.
Bu konum, kimyanın gelişimi için büyük önem taşıyordu, çünkü gaz veya buhar haline geçebilen cisimlerin kısmi ağırlığını belirlemeyi mümkün kılıyor. eğer aracılığıyla m vücudun kısmi ağırlığını belirtiriz ve d buhar halindeki özgül ağırlığı, ardından oran m / d tüm bedenler için sabit olmalıdır. Deneyim, parçalanmadan buhara geçen, incelenen tüm cisimler için, kısmi ağırlığı belirlerken, bir birim olarak alınan havanın özgül ağırlığından yola çıkarsak, bu sabitin 28.9'a eşit olduğunu göstermiştir, ancak bu sabit olacaktır. Hidrojenin özgül ağırlığını bir birim olarak alırsak 2'ye eşittir. Bu sabiti veya aynı olan, tüm buhar ve gazlar için ortak olan kısmi hacmi ifade etmek İTİBAREN, diğer taraftan formülden aldık m = dC. Buharın özgül ağırlığı kolayca belirlenebildiğinden, değeri ikame etmek d formülde, verilen cismin bilinmeyen kısmi ağırlığı da görüntülenir.
Termokimya
termal etki Kimyasal reaksiyon
Vikipedi, özgür ansiklopedi
Bir kimyasal reaksiyonun veya değişimin termal etkisi entalpi kimyasal reaksiyonun meydana gelmesi nedeniyle sistem - kimyasal reaksiyonun gerçekleştiği sistem tarafından alınan kimyasal değişkendeki değişiklikle ilgili ısı miktarı ve reaksiyon ürünleri, reaktanların sıcaklığını aldı.
Termal etkinin yalnızca devam eden kimyasal reaksiyonun doğasına bağlı bir miktar olması için aşağıdaki koşulların karşılanması gerekir:
Reaksiyon ya sabit bir hacimde devam etmelidir Q v (izokorik süreç) veya sabit basınçta Q p( izobarik süreç).
P = const ile yapılabilecek genişletme işi dışında sistemde herhangi bir iş yapılmamaktadır.
Reaksiyon, T \u003d 298.15 K \u003d 25 ° C ve P \u003d 1 atm \u003d 101325 Pa'da standart koşullar altında gerçekleştirilirse, termal etkiye reaksiyonun standart termal etkisi veya standart entalpi reaksiyonlar Δ H r O. Termokimyada, bir reaksiyonun standart termal etkisi, standart oluşum entalpileri kullanılarak hesaplanır.
Standart oluşum entalpisi (standart oluşum ısısı)
Standart oluşum ısısı, bir maddenin bir molünün oluşum reaksiyonunun ısı etkisi olarak anlaşılır. basit maddeler, kararlı olan bileşenleri standart durumlar.
Örneğin, standart oluşum entalpisi 1 mol metan itibaren karbon ve hidrojen reaksiyonun ısısına eşit:
C (tv) + 2H2 (g) \u003d CH4 (g) + 76 kJ / mol.
Standart oluşum entalpisi Δ ile gösterilir H fO. Burada f indeksi oluşum (eğitim) anlamına gelir ve üzeri çizili daire, Plimsol diskine benzer - değerin ifade ettiği standart durum maddeler. Literatürde, standart entalpi için başka bir tanım sıklıkla bulunur - ΔH 298,15 0 , burada 0, basıncın bir atmosfere eşit olduğunu gösterir (veya biraz daha kesin olarak, standart koşullara ) ve 298.15 sıcaklıktır. Bazen indeks 0, aşağıdakilerle ilgili miktarlar için kullanılır: saf madde, ancak standart hal olarak seçilen saf bir madde olduğunda onunla standart termodinamik miktarları belirtmenin mümkün olduğunu şart koşar. . Standart ayrıca örneğin maddenin durumu olarak da alınabilir. son derece seyreltikçözüm. Bu durumda "Plimsol diski", seçimine bakılmaksızın maddenin gerçek standart durumu anlamına gelir.
Basit maddelerin oluşum entalpisinin sıfır olduğu varsayılır ve oluşum entalpisinin sıfır değeri, T = 298 K'da kararlı olan kümelenme durumunu belirtir. iyot kristal halde Δ H I2(tv) 0 = 0 kJ/mol ve sıvı için iyot Δ H I2(l) 0 = 22 kJ/mol. Standart koşullar altında basit maddelerin oluşum entalpileri, temel enerji özellikleridir.
Herhangi bir reaksiyonun termal etkisi, tüm ürünlerin oluşum ısılarının toplamı ile bu reaksiyondaki tüm reaktanların oluşum ısılarının toplamı arasındaki fark olarak bulunur (sonuç olarak). Hess yasası):
Δ H reaksiyonlar O = ΣΔ H f O (ürünler) - ΣΔ H f O (reaktifler)
Termokimyasal etkiler kimyasal reaksiyonlara dahil edilebilir. Kimyasal Denklemler salınan veya emilen ısı miktarının belirtildiği, termokimyasal denklemler olarak adlandırılır. Çevreye ısı salınımının eşlik ettiği reaksiyonlar olumsuz bir termal etkiye sahiptir ve denir. ekzotermik. Isı absorpsiyonunun eşlik ettiği reaksiyonlar pozitif bir termal etkiye sahiptir ve denir. endotermik. Termal etki genellikle, stokiyometrik katsayısı maksimum olan reaksiyona giren başlangıç malzemesinin bir molüne karşılık gelir.
Reaksiyonun termal etkisinin (entalpi) sıcaklığa bağımlılığı
Reaksiyon entalpisinin sıcaklığa bağımlılığını hesaplamak için moları bilmek gerekir. ısı kapasitesi reaksiyona katılan maddeler. T1'den T2'ye artan sıcaklıkla reaksiyonun entalpisindeki değişim Kirchhoff yasasına göre hesaplanır (bu sıcaklık aralığında molar ısı kapasitelerinin sıcaklığa bağlı olmadığı ve faz dönüşümleri):
![]()
Belirli bir sıcaklık aralığında faz dönüşümleri meydana gelirse, hesaplamada, ilgili dönüşümlerin ısılarının yanı sıra, bu tür dönüşümlerden geçen maddelerin ısı kapasitesinin sıcaklığa bağlılığındaki değişikliği dikkate almak gerekir:
burada ΔC p (T 1 ,T f), T 1'den faz geçiş sıcaklığına sıcaklık aralığındaki ısı kapasitesindeki değişikliktir; ΔC p (T f ,T 2 ) faz geçiş sıcaklığından son sıcaklığa kadar olan sıcaklık aralığındaki ısı kapasitesindeki değişimdir ve Tf, faz geçiş sıcaklığıdır.
Standart yanma entalpisi
Standart yanma entalpisi - Δ H Gor o, oksijendeki bir mol maddenin yanmasının, en yüksek oksidasyon derecesinde oksit oluşumuna tepkimesinin termal etkisi. Yanıcı olmayan maddelerin yanma ısısının sıfır olduğu varsayılır.
Standart çözünme entalpisi
Standart çözünme entalpisi - Δ HÇözelti, 1 mol maddenin sonsuz miktarda çözücü içinde çözülmesi sürecinin termal etkisi. Yıkım ısısından oluşur kristal kafes ve sıcaklık hidrasyon(veya ısı çözme sulu olmayan çözeltiler için), çözücü moleküllerinin çözünmüş maddenin molekülleri veya iyonları ile etkileşiminin bir sonucu olarak, değişken bileşimli bileşiklerin oluşumu - hidratlar (solvatlar). Kristal kafesin imhası, kural olarak, endotermik bir süreçtir - Δ H resh > 0 ve iyon hidrasyonu ekzotermiktir, Δ H hidra< 0. В зависимости от соотношения значений ΔH resh ve Δ H hidr çözünme entalpisi hem pozitif hem de negatif değerlere sahip olabilir. Böylece kristalin çözünmesi Potasyum hidroksitısı salınımı ile birlikte
Δ Hçözüm KOH o \u003d Δ H yeniden o + Δ H hidrK + o + Δ H hidroOH -o = -59 kJ/mol
Hidrasyon entalpisi altında - Δ H hidr, 1 mol iyonun vakumdan çözeltiye geçişi sırasında açığa çıkan ısıyı ifade eder.
Standart nötralizasyon entalpisi
Standart nötralizasyon entalpisi - Δ H standart koşullar altında güçlü asitlerin ve bazların etkileşiminin 1 mol su oluşumu ile reaksiyonunun entalpisi hakkında nötr:
HCl + NaOH = NaCl + H2O
H + + OH - \u003d H20, ΔH nötr ° \u003d -55.9 kJ / mol
Konsantre çözeltiler için standart nötralizasyon entalpisi güçlü elektrolitler Seyreltildiğinde ΔH hidrasyon ° iyonlarının değerindeki değişiklik nedeniyle iyonların konsantrasyonuna bağlıdır.
entalpi
entalpi maddenin ısıya dönüştürülebilen enerji miktarını gösteren bir özelliğidir.
entalpi moleküler yapısında depolanan enerji seviyesini gösteren bir maddenin termodinamik özelliğidir. Bu, maddenin sıcaklık ve basınca dayalı enerjiye sahip olabilmesine rağmen, tamamının ısıya dönüştürülemediği anlamına gelir. İç enerjinin bir kısmı her zaman maddede kalır ve moleküler yapısını korur. Bölüm kinetik enerji sıcaklığı ortam sıcaklığına yaklaştığında madde mevcut değildir. Bu nedenle, entalpi, belirli bir sıcaklık ve basınçta ısıya dönüştürülebilen enerji miktarıdır. entalpi birimleri- Enerji için İngiliz ısı birimi veya joule ve özgül enerji için Btu/lbm veya J/kg.
entalpi miktarı
Miktar entalpi verilen sıcaklığa göre madde. Verilen sıcaklık bilim adamları ve mühendisler tarafından hesaplamalar için temel olarak seçilen değerdir. Bu, bir maddenin entalpisinin sıfır J olduğu sıcaklıktır. Başka bir deyişle, maddenin ısıya dönüştürülebilecek kullanılabilir enerjisi yoktur. Bu sıcaklık çeşitli maddeler farklı. Örneğin, suyun bu sıcaklığı üçlü nokta (0°C), nitrojen -150°C ve metan ve etan bazlı soğutucular -40°C'dir.
Bir maddenin sıcaklığı, verilen sıcaklığın üzerindeyse veya belirli bir sıcaklıkta gaz halini değiştirirse, entalpi pozitif bir sayı olarak ifade edilir. Tersine, belirli bir maddenin entalpisinin altındaki bir sıcaklıkta negatif bir sayı olarak ifade edilir. Entalpi, iki durum arasındaki enerji seviyelerindeki farkı belirlemek için hesaplamalarda kullanılır. Bu, ekipmanı kurmak ve belirlemek için gereklidir. katsayı sürecin kullanışlılığı.
Entalpi genellikle şu şekilde tanımlanır: maddenin toplam enerjisi, çünkü belirli bir durumda iç enerjisinin (u) ve iş yapma yeteneğinin (pv) toplamına eşittir. Ama gerçekte, entalpi göstermez tam Enerji mutlak sıfırın (-273°C) üzerinde belirli bir sıcaklıktaki maddeler. Bu nedenle entalpiyi bir maddenin toplam ısısı olarak tanımlamak yerine, bir maddenin ısıya dönüştürülebilen toplam kullanılabilir enerji miktarı olarak tanımlamak daha doğrudur. H=U+pV
İçsel enerji
Bir cismin iç enerjisi (E veya U olarak gösterilir), bir molekülün moleküler etkileşimlerinin ve termal hareketlerinin enerjilerinin toplamıdır. İç enerji, sistemin durumunun tek değerli bir fonksiyonudur. Bu, sistem belirli bir durumda olduğunda, onun içsel enerji sistemin geçmişi ne olursa olsun, bu durumun doğasında var olan değeri alır. Sonuç olarak, bir durumdan diğerine geçiş sırasında iç enerjideki değişiklik, geçişin yapıldığı yoldan bağımsız olarak, her zaman son ve ilk durumlardaki değerleri arasındaki farka eşit olacaktır.
Bir cismin iç enerjisi doğrudan ölçülemez. Sadece iç enerjideki değişim belirlenebilir:
Vücuda bağlı sıcaklık, ölçülen joule
- İş, vücut tarafından dış kuvvetlere karşı gerçekleştirilen, joule cinsinden ölçülen
Bu formül matematiksel bir ifadedir. termodinamiğin birinci yasası
İçin yarı statik süreçler aşağıdaki ilişki geçerlidir:
-sıcaklık, ölçülen kelvin
-entropi, joule/kelvin cinsinden ölçülür
-baskı yapmak, ölçülen paskallar
-kimyasal potansiyel
Sistemdeki parçacık sayısı
ideal gazlar
Ampirik olarak türetilen Joule yasasına göre, iç enerji Ideal gaz basınç veya hacimden bağımsızdır. Bu gerçeğe dayanarak, iç enerjideki değişim için bir ifade elde edebiliriz. Ideal gaz. Tanım olarak molar ısı kapasitesi sabit bir hacimde 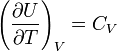 . İdeal bir gazın iç enerjisi yalnızca sıcaklığın bir fonksiyonu olduğundan,
. İdeal bir gazın iç enerjisi yalnızca sıcaklığın bir fonksiyonu olduğundan,
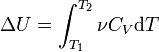 .
.
Aynı formül, herhangi bir cismin iç enerjisindeki değişimi hesaplamak için de geçerlidir, ancak yalnızca sabit hacimli işlemlerde ( izokorik süreçler); Genel olarak C V (T,V) hem sıcaklığın hem de hacmin bir fonksiyonudur.
Molar ısı kapasitesindeki değişimi sıcaklıktaki bir değişiklikle ihmal edersek, şunu elde ederiz:
Δ sen = ν C V Δ T,
burada ν madde miktarıdır, Δ T- sıcaklık değişimi.
BİR MADDE, BEDEN, SİSTEMİN İÇ ENERJİSİ
(Yunanca: ένέργια - aktivite, enerji). İç enerji Bölüm toplam vücut enerjisi (sistemler tel): E = E k + E p + sen, nerede E k - kinetik enerji makroskobik hareketler sistemler, E p - potansiyel enerji, dış kuvvetin varlığı nedeniyle alanlar(yerçekimi, elektrik vb.), sen- içsel enerji. İçsel enerji maddeler, bedenler, beden sistemleri - işlev devletler bir maddenin, cismin, sistemin iç durumunun toplam enerji rezervi olarak tanımlanan, değişen (serbest kalan) işlem kimyasal reaksiyonlar, ısı transferi ve performans iş. İç enerjinin bileşenleri: (a) termal enerjinin kinetik enerjisi olasılıksal parçacıkların hareketi (atomlar, moleküller, iyonlar vb.), bir madde (vücut, sistem) oluşturan; (b) moleküller arası moleküllerinden dolayı parçacıkların potansiyel enerjisi etkileşim; (c) elektron kabukları, atomlar ve iyonlardaki elektronların enerjisi; (d) intranükleer enerji. İç enerji, sistemin durumunu değiştirme süreci ile ilgili değildir. Sistemdeki herhangi bir değişiklikle, sistemin iç enerjisi, çevresiyle birlikte sabit kalır. Yani içsel enerji ne kaybedilir ne de kazanılır. Aynı zamanda, enerji sistemin bir kısmından diğerine geçebilir veya bir kısımdan diğerine dönüştürülebilir. formlar başka bir. Bu ifadelerden biri yasa enerjinin korunumu - termodinamiğin birinci yasası. İç enerjinin bir kısmı işe dönüştürülebilir. İç enerjinin bu kısmına denir. bedava enerji - G. (Kimyasal bileşiklerde buna kimyasal denir potansiyel). İşe dönüştürülemeyen iç enerjinin geri kalanına bağlı enerji denir - W b .
Entropi
Entropi (dan Yunanἐντροπία - çevirmek, dönüştürmek) Doğa Bilimleri- düzensizlik ölçüsü sistemler, birçoğundan oluşan elementler. özellikle, istatistiksel fizik - ölçüm olasılıklar herhangi bir makroskopik durumun gerçekleştirilmesi; içinde bilgi teorisi- farklı sonuçlara sahip olabilecek herhangi bir deneyimin (test) belirsizliğinin bir ölçüsü ve dolayısıyla sayı bilgi; içinde tarih bilimi, için açıklamalar fenomen alternatif tarih (değişmezlik ve değişkenlik tarihsel süreç).
Atomların ve moleküllerin varlığını kanıtladıktan sonra büyük keşif atom-moleküler teori, 1748'de büyük Rus bilim adamı Mikhail Vasilyevich Lomonosov (1711-1765) tarafından felsefi bir kavram şeklinde formüle edilen ve 1756'da deneysel olarak ve bağımsız olarak Fransız kimyager tarafından onaylanan kütlenin korunumu yasasıydı. 1789 yılında AL Lavoisier
Bir kimyasal reaksiyona giren tüm maddelerin kütlesi, reaksiyonun tüm ürünlerinin kütlesine eşittir.
Lomonosov'dan önce gerçekleştirilen maddelerin yanması üzerine yapılan deneyler, reaksiyon sürecindeki maddelerin kütlesinin korunmadığını ileri sürdü. Havada ısıtıldığında cıva, kütlesi metalinkinden daha büyük olan kırmızı ölçeğe dönüştü. Aksine, odunun yanması sırasında oluşan kül kütlesi her zaman orijinal maddenin kütlesinden daha azdır.
Lomonosov, bir metalin yanmasının bir ekleme reaksiyonu olduğunu ve metalin kütlesindeki artışın, havanın bir kısmının eklenmesi nedeniyle meydana geldiğini gösteren basit bir deney yaptı. Metalleri kapalı bir cam kapta kalsine etti ve kimyasal bir reaksiyon meydana gelmesine rağmen kabın kütlesinin değişmediğini buldu. Gemi açıldıktan sonra içine hava girdi ve geminin kütlesi arttı. Böylece, reaksiyondaki tüm katılımcıların kütlesinin doğru bir ölçümü ile kimyasal reaksiyondaki maddelerin kütlesinin korunduğu ortaya çıkıyor. Kütlenin korunumu yasası, atom ve moleküler teori için büyük önem taşıyordu. Atomların bölünmez olduğunu ve kimyasal reaksiyonlar sırasında değişmediğini doğruladı. Moleküller reaksiyon sırasında atomları değiştirir, ancak toplam sayısı her türden atom değişmez ve bu nedenle reaksiyon sürecindeki maddelerin toplam kütlesi korunur.
Kütlenin korunumu yasası, genel bir doğa yasasının özel bir durumudur - yalıtılmış bir sistemin enerjisinin sabit olduğunu belirten enerjinin korunumu yasası. Enerji, hareket ve etkileşimin bir ölçüsüdür. Çeşitli türlerÖnemli olmak. Herhangi bir işlem için yalıtılmış sistem enerji ne üretilir ne de yok edilir, sadece bir biçimden diğerine geçebilir.
Bir enerji biçimi, Einstein ilişkisi ile kütle ile ilgili olan sözde dinlenme enerjisidir.
E 0 \u003d m 0 s 2,
burada c ışığın boşluktaki hızıdır (c = 3 10 8 m/s). Bu ilişki, kütlenin enerjiye dönüştürülebileceğini ve bunun tersini göstermektedir. Bu, tüm nükleer reaksiyonlarda tam olarak olan şeydir ve bu nedenle nükleer süreçlerde kütlenin korunumu yasası ihlal edilir. Ancak, kalan enerjiyi hesaba katarsak, bu durumda enerjinin korunumu yasası geçerli kalır.
Kimyasal reaksiyonlarda, enerjinin serbest bırakılması veya emilmesinden kaynaklanan kütle değişikliği çok küçüktür. Bir kimyasal reaksiyonun tipik termal etkisi büyüklük sırasına göre 100 kJ/mol'dür. Bu durumda kütlenin nasıl değiştiğini hesaplayalım:
∆m = ∆E/s 2 = 10 5 / (3 10 8) 2 ~ 10 -12 kg/mol = 10 -9 g/mol.
Konu: İlk kimyasal fikirler
Ders: Kimyasal reaksiyonun özü. Maddelerin kütlesinin korunumu yasası
Öz Sorusu kimyasal dönüşüm uzun süre doğa bilimcileri için bir sır olarak kaldı. Sadece atom-moleküler teorinin gelişmesiyle, kimyasal reaksiyonların atomlar ve moleküller düzeyinde nasıl meydana geldiğini varsaymak mümkün oldu.
Atom-moleküler teoriye göre, maddeler moleküllerden, moleküller de atomlardan oluşur. Bir kimyasal tepkime sırasında orijinal maddeleri oluşturan atomlar kaybolmaz ve yeni atomlar ortaya çıkmaz.
O halde, bir kimyasal reaksiyon sonucunda, daha önce orijinal maddelerin bir parçası olan atomlardan reaksiyon ürünlerinin oluştuğunu varsayabiliriz. İşte bir kimyasal reaksiyon modeli:
Pirinç. 1. AMT açısından bir kimyasal reaksiyon modeli
Bu modeli analiz ettikten sonra bir hipotez ortaya koyabiliriz (bilimsel temelli varsayım):
Reaksiyon ürünlerinin toplam kütlesi, başlangıç malzemelerinin toplam kütlesine eşit olmalıdır.
Leonardo da Vinci bile şöyle dedi: "Tüm kesinliğin anası olan deneyimle doğrulanmayan bilgi, sonuçsuz ve hatalarla doludur." Bu, deneysel olarak doğrulanmadıkça bir hipotezin asla yasa olmayacağı anlamına gelir.
Kimyada deneysel yöntem, 17. yüzyılda R. Boyle'un araştırmasından sonra yaygın olarak kullanılmaya başlandı. İngiliz doğa bilimci, metalleri mühürlenmemiş kaplarda kalsine etti - imbikler ve kalsinasyondan sonra metal kütlesinin daha da büyüdüğünü buldu.
Bu deneylere dayanarak, havanın rolünü dikkate almadı ve kimyasal reaksiyonlar sırasında maddelerin kütlesinin değiştiği yanlış sonucuna vardı.
M.V. Lomonosov, R. Boyle'den farklı olarak, metalleri açık havada değil, kapalı imbiklerde kalsine etti ve kalsinasyondan önce ve sonra tarttı. Reaksiyondan önce ve sonra maddelerin kütlesinin değişmediğini ve kalsine edildiğinde metale hava eklendiğini (o sırada oksijen henüz keşfedilmemişti) kanıtladı. Ancak Lomonosov araştırmasının sonuçlarını yayınlamadı.
1774'te R. Boyle'un deneyleri A. Lavoisier tarafından Lomonosov ile tamamen aynı sonuçlarla tekrarlandı. Ancak yeni, çok önemli bir gözlem yaptı, yani mühürlü imbikteki havanın sadece bir kısmının metalle birleştiği ve teraziye geçen metalin ağırlığındaki artışın azalmaya eşit olduğu. imbikteki havanın ağırlığında. Ancak metalin bir kısmı serbest formda kaldı.
Böylece, birbirinden bağımsız olarak, M.V. Lomonosov ve A. Lavoisier, kimyasal reaksiyon sonucunda madde kütlesinin korunumuna ilişkin varsayımın geçerliliğini doğruladı.
Bu varsayım, ancak 20. yüzyılın başında Alman kimyager G. Landolt tarafından yapılan on yıllık bir çalışmanın ardından yasa haline geldi. Bugün kütlenin korunumu yasasışu şekilde formüle edilir:
Tepkimeye katılan maddelerin kütlesi tepkimeye giren ürünlerin kütlesine eşittir.
Maddelerin kütlesinin korunumu yasasının doğruluğu aşağıdaki deney kullanılarak doğrulanabilir. İlk Landolt kabında potasyum iyodür ve kurşun nitrat çözeltileri hazırlayın. İkinci kapta, demir klorürün potasyum tiyosiyanat ile reaksiyonu gerçekleşecektir. Fişleri sıkıca kapatın. Teraziyi dengeliyoruz. Reaksiyonlar sona erdikten sonra denge korunacak mı? İlk kapta, sarı bir kurşun iyodür çökeltisi çöker; ikinci kapta koyu kırmızı ferrik tiyosiyanat oluşur. Landolt'un kaplarında kimyasal reaksiyonlar meydana geldi: yeni maddeler oluştu. Ancak denge bozulmadı (Şekil 2). Başlangıç maddelerinin kütlesi her zaman reaksiyon ürünlerinin kütlesine eşittir.

Pirinç. 2. Maddelerin kütlesinin korunumu yasasının doğruluğunu onaylayan bir deney
Kimyasal tepkimelerde madde kütlesinin korunumu yasasının doğruluğunu kanıtlayan başka bir deney örneği verelim. Şişenin içinde mantar kapatıldığında bir mum yanar. Terazileri dengeleyelim. Mumu ateşe verelim ve şişeye indirelim. Şişeyi bir tıpa ile sıkıca kapatın. Mum yakmak kimyasal bir işlemdir. Şişedeki oksijeni tükettikten sonra mum söner, kimyasal reaksiyon tamamlanır. Ancak ağırlıkların dengesi bozulmaz: reaksiyon ürünlerinin kütlesi, ilk maddelerin kütlesi ile aynı kalır (Şekil 3).

Pirinç. 3. Bir şişede yanan bir mumla deney yapın
Maddelerin kütlesinin korunumu yasasının keşfi, kimyanın daha da gelişmesi için büyük önem taşıyordu. Maddelerin kütlesinin korunumu yasasına dayanarak, en önemli hesaplamalar yapılır ve kimyasal reaksiyonların denklemleri derlenir.
1. Kimyadaki görev ve alıştırmaların toplanması: 8. sınıf: P.A. Orzhekovsky ve diğerleri "Kimya, 8. Sınıf" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – E.: AST: Astrel, 2006.
2. Ushakova O.V. Kimya çalışma kitabı: 8. sınıf: P.A. Orzhekovsky ve diğerleri “Kimya. Sınıf 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; altında. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (s. 15-16)
3. Kimya: 8. sınıf: ders kitabı. genel için kurumlar / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005.(§6)
4. Kimya: inorg. kimya: ders kitabı. 8 hücre için. genel kurumlar / G.E. Rudzitis, FuGyu Feldman. - M.: Eğitim, JSC "Moskova ders kitapları", 2009.
5. Çocuklar için ansiklopedi. Cilt 17. Kimya / Bölüm. V.A tarafından düzenlendi. Volodin, lider. ilmi ed. I. Leenson. – E.: Avanta+, 2003.
Ek web kaynakları
1. Tek bir dijital eğitim kaynakları koleksiyonu ().
2. "Kimya ve Yaşam" dergisinin elektronik versiyonu ().
Ev ödevi
İle birlikte . 16 №№ 3,5 itibaren Çalışma kitabı kimyada: 8. sınıf: P.A. Orzhekovsky ve diğerleri “Kimya. Sınıf 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; altında. ed. Prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
1. Kütle ve enerjinin korunumu yasası.
Bu birleşik bir yasadır. İki yasa içerir.
BEN. Kütlenin korunumu yasası : Reaksiyona katılan maddelerin kütlesi, reaksiyon ürünlerinin kütlesine eşittir.
Bu yasa, 1748'de M. V. Lomonosov tarafından keşfedildi ve 1789'da A. L. Lavoisier tarafından desteklendi.
Reaksiyon sırasında, her birinin kütlesi 1 öğe.
Bu yasa, kimyasal reaksiyonların denklemlerini oluşturmanıza ve bunlara dayalı hesaplamalar yapmanıza izin verir. Mutlak değildir (aşağıya bakınız). Enerjinin korunumu yasası mutlaktır.
2. Enerjinin korunumu yasası: Enerji yoktan doğmaz ve yok olmaz, sadece bir biçimden diğerine geçer.
Bu yasa, A. Einstein'ın çalışmasının sonucudur. Enerji ve maddenin kütlesi arasındaki bağlantıyı kurdu (1905):
E \u003d ts 2,(6)
nerede İle birlikte- ışığın boşluktaki hızı, -300.000 km/s'ye eşittir. Enerji bir kimyasal reaksiyonun sonucu olarak salındığından veya emildiğinden, Einstein denklemine göre maddelerin kütlesi de değişir. Ancak bu değişiklik o kadar küçüktür ki pratikte dikkate alınmaz (sözde kütle kusuru).
Basit maddelerden bir mol hidrojen klorür oluşumuna, maddenin yaklaşık 10-9 g'lık bir kütle kaybına ("kütle kusuru") karşılık gelen 92.3 kJ / mol'lük bir termal etki eşlik eder.
Aşağıdaki yasalar yalnızca sabit bir moleküler bileşime sahip bileşikler için geçerlidir.- daltonidler. Değişken bir molekül bileşimine sahip bileşiklerden farklıdırlar - berthollidler.
Metal alaşımları, aşağıdaki türdeki bileşikleri içerir: M t M l, nerede t ve n- değişkenler.
2. Kompozisyonun sabitliği kanunu (J.L. Proust, 1801).
kütleler arasındaki oran kimyasal elementler Bu bileşiğin bir parçası olan , hazırlanma yönteminden bağımsız olarak sabit bir değerdir.
3. Çoklu oranlar kanunu (J. Dalton, 1803).
Eğer iki eleman birkaç tane oluşturuyorsa kimyasal bileşikler, o zaman elementlerden birinin kütlesi diğerinin belirli bir kütlesine göre küçük tamsayılar olarak birbiriyle ilişkilidir.
Karbon monoksit (II) CO: M (C) / M (O) \u003d 12/16 \u003d 3/4, karbon monoksit (IV) CO 2: M (C) / M (2 O) \u003d 12 /32 \u003d 3 /sekiz. Bu nedenle, bu bileşiklerde belirli bir oksijen kütlesi başına karbon kütleleri şu şekilde ilişkilidir:
3 / 4: 3 / 8 =2:1
4. Basit hacimsel oranlar kanunu (J.L. Gay-Lussac, 1808).
Reaksiyona giren gazların hacimleri birbirleriyle ve küçük tamsayılar olarak oluşan gazların hacimleriyle ilişkilidir.
Reaksiyon denklemindeki stokiyometrik katsayılara göre amonyak oluşumunun reaksiyonunda:
H 2 + 3N 2 = 2NH 3, V (N 2) : V (H 2) : V (NH 3) = 1:3:2'yi elde ederiz.
5. Avogadro Yasası (1811). Aynı koşullar altında (p ve T) eşit hacimde farklı gazlar aynı sayıda molekül içerir.
Bu yasa, Mendeleev-Clapeyron ideal gaz hal denkleminin analizinden çıkar:
pV = nRT.
Bu denklem iki gaz için yazılabilir: p 1 V 1= V 1 RT 1, p 2 V 2= V2 RT2 .
eşit ise p 1 \u003d p 2, T 1 \u003d T 2 ve V ben = V2 gazların madde miktarları eşit olacaktır: 1= n 2 veya Avogadro numarası verildiğinde:
n 1 N A \u003d n 2 N A,
yani, bu gazların molekül sayısı da eşit olacaktır.
Avogadro yasası var sonuçlar:
1. Aynı koşullar altında herhangi bir gazın aynı sayıda molekülü aynı hacmi kaplar.
2. Aynı koşullarda (p, T) eşit hacimlerde alınan gazların kütleleri, mol kütleleri olarak birbirleriyle ilişkilidir:
t 1 / t 2 \u003d M1 / M2.(7)
Bu sonuç, bu gazların maddelerinin miktarlarının eşitliğinden kaynaklanmaktadır (yukarıya bakınız): ν 1 = ν 2 .
Bir maddenin miktarı yerine, kütlesinin molar kütleye oranını değiştirirsek (denklem 2) şunu elde ederiz:
t 1 / M 1 \u003d t 2 / M 2
t 1 / t 2 \u003d Mg / M2.
İkinci sonuç, bilinmeyen bir gazın molar kütlesini bu gazın bilinen bir diğer gazdan göreli yoğunluğunun bilinen bir değerinden belirlemek için bir denklem türetmemize izin verir.
Eşit olan birinci ve ikinci gazların 7 hacminin denkleminin sol tarafının pay ve paydasını değiştirdikten sonra, şunu elde ederiz:
1· V 2 / t 2 V 1 \u003d M 1 / M 2.
Bir maddenin kütlesinin hacmine oranı yoğunluk ile değiştirilir (bkz. denklem 5):
R 1 / R 2 \u003d M 1 / M 2
ve ikinciden birinci gazın moleküler ağırlığını hesaplamak için bir denklem elde ederiz:
1= (ρ 1 / ρ 2) M 2 = D 1/2 M2(8)
veya içinde Genel görünüm:
E=D G M g(9)
nerede DG- ikinciye göre birinci gazın nispi yoğunluğu.
Belirli bir gazın hidrojen yoğunluğu biliniyorsa, aşağıdaki denklem kullanılır:
M \u003d 2DH 2.(10)
Gazın havadaki yoğunluğu biliniyorsa, denklem kullanılır:
M = 29D hava. (11)