Kimyasal elementlerin dönüşümü. Harika! Kimya
Şu anda bilinen 26 transuranyum elementinden 24'ü gezegenimizde bulunmuyor. İnsan tarafından yaratıldılar. Ağır ve süper ağır elementler nasıl sentezlenir?
Otuz üç sözde elementin ilk listesi, "Doğanın tüm krallıklarına ait olan ve en basit olarak kabul edilebilecek olan Maddeler Tablosu". oluşturan parçalar tel", Antoine Laurent Lavoisier tarafından 1789'da yayınlandı. Oksijen, nitrojen, hidrojen, on yedi metal ve diğer birkaç gerçek elementle birlikte, içinde ışık, kalori ve bazı oksitler yer aldı. Mendeleev 80 yıl sonra Periyodik Tabloyu bulduğunda kimyagerler 62 elementi biliyorlardı. 20. yüzyılın başlarında, bazıları henüz keşfedilmemiş olsa da, doğada hidrojenden uranyuma kadar 92 element olduğuna inanılıyordu.
Ancak, zaten içinde geç XIX Yüzyıllar boyunca bilim adamları, periyodik tabloda uranyumu (transuranları) takip eden elementlerin varlığını varsaydılar, ancak tespit edilemediler. Artık yerkabuğunun eser miktarda 93. ve 94. elementler - neptünyum ve plütonyum - içerdiği bilinmektedir. Ancak tarihsel olarak, bu elementler önce yapay olarak elde edildi ve ancak daha sonra minerallerin bileşiminde keşfedildi.
94 ilk elementten 83'ü, yarı ömrü güneş sisteminin yaşıyla karşılaştırılabilir olan kararlı veya uzun ömürlü izotoplara sahiptir (gezegenimize bir ön-gezegen bulutundan geldiler). Kalan 11 doğal elementin ömrü çok daha kısadır ve bu nedenle yerkabuğunda yalnızca radyoaktif bozunmaların bir sonucu olarak ortaya çıkarlar. kısa zaman. Peki ya 95'ten 118'e kadar tüm diğer elementler? Gezegenimizde hiçbiri yok. Hepsi yapay olarak elde edildi.
İlk yapay
Yapay elementlerin yaratılması uzun bir geçmişe sahiptir. Bunun temel olasılığı 1932'de Werner Heisenberg ve Dmitri Ivanenko'nun şu sonuca vardıkları zaman netleşti. atom çekirdeği proton ve nötronlardan oluşur. İki yıl sonra, Enrico Fermi'nin grubu, uranyumu yavaş nötronlarla ışınlayarak transuranyum üretmeye çalıştı. Uranyum çekirdeğinin bir veya iki nötron yakalayacağı ve ardından 93. veya 94. elementlerin doğuşuyla beta bozunmasına uğrayacağı varsayılmıştır. Fermi'nin 1938 Nobel konuşmasında ausonium ve hesperium olarak adlandırdığı transuranların keşfini bile hızlı bir şekilde duyurdular. Ancak Alman radyokimyacılar Otto Hahn ve Fritz Strassmann, Avusturyalı fizikçi Lise Meitner ile birlikte kısa süre sonra Fermi'nin yanıldığını gösterdiler: bu nüklidler zaten izotoplardı. bilinen elementler uranyum çekirdeklerinin yaklaşık olarak aynı kütleye sahip parça çiftlerine bölünmesinden kaynaklanır. Aralık 1938'de yapılan bu keşif, bir nükleer reaktörün oluşturulmasını mümkün kıldı ve atom bombası.İlk sentezlenen element transuranyum değil, Mendeleev tarafından tahmin edilen ekamarganezdi. Çeşitli cevherlerde arandı, ancak başarılı olamadı. Ve 1937'de, daha sonra teknesyum (Yunanca ??? - yapay) olarak adlandırılan ekamarganez, Lawrence Berkeley Ulusal Laboratuvarı'ndaki siklotronda dağılmış döteryum çekirdekleri ile bir molibden hedefini bombalayarak elde edildi.
hafif mermiler
93'ten 101'e kadar olan elementler, onu izleyen uranyum çekirdekleri veya transuranyumların nötronlar, döteryumlar (döteryum çekirdekleri) veya alfa parçacıkları (helyum çekirdekleri) ile etkileşimi ile elde edildi. Buradaki ilk başarı, 1940'ta neptünyum-239'u sentezleyen ve Fermi'nin fikrini geliştiren Amerikalı Edwin Macmillan ve Philip Abelson tarafından elde edildi: yavaş nötronların uranyum-238 tarafından yakalanması ve ardından uranyum-239'un beta bozunması.Bir sonraki 94. element olan plütonyum ilk olarak 1941'in başlarında UC Berkeley siklotronunda uranyumun döteron bombardımanı ile elde edilen neptünyum-238'in beta bozunumu incelenirken keşfedildi. Ve kısa süre sonra, yavaş nötronların etkisi altında plütonyum-239'un uranyum-235'ten daha kötü fisyonlara sahip olmadığı ve bir atom bombasının doldurulması olarak hizmet edebileceği anlaşıldı. Bu nedenle, bu elementin makbuzu ve özellikleri hakkındaki tüm bilgiler sınıflandırıldı ve Macmillan, Glenn Seaborg'un makalesi (paylaştıkları keşifler için) Nobel Ödülü 1951) ve meslektaşları, ikinci uranyum ötesi hakkında bir mesajla sadece 1946'da basıldı.
Amerikan makamları ayrıca, 1944'ün sonunda Seaborg grubu tarafından bir nükleer reaktörde plütonyumun nötron bombardımanının ürünlerinden izole edilen 95. element olan americium'un keşfinin yayınlanmasını neredeyse altı yıl erteledi. Birkaç ay önce, aynı ekipteki fizikçiler, uranyum-239'u hızlandırılmış alfa parçacıklarıyla bombardıman ederek sentezlenen, atom ağırlığı 242 olan, element 96'nın ilk izotopunu elde etmişti. Pierre ve Marie Curie'nin bilimsel değerlerinin tanınması için curium olarak adlandırıldı, böylece fizik ve kimya klasiklerinin onuruna transuranyumları adlandırma geleneği açıldı.
California Üniversitesi'ndeki 60 inçlik siklotron, 97., 98. ve 101. olmak üzere üç elementin daha yaratıldığı yerdi. İlk ikisi, doğum yerlerinin adını aldı - berkelium ve california. Berkelium, Aralık 1949'da amerikyumun alfa parçacıkları ile bombardımanı sırasında ve iki ay sonra kaliforniyumun aynı curium bombardımanı ile sentezlendi. Element 99 ve 100, einsteinium ve fermiyum, 1 Kasım 1952'de Amerikalıların, kabuğu uranyumdan yapılmış Mike on megaton termonükleer yükünü patlattığı Eniwetok Atoll bölgesinde toplanan örneklerin radyokimyasal analizi sırasında keşfedildi. 238. Patlama sırasında, uranyum çekirdekleri on beşe kadar nötron emdi, ardından bu elementlerin oluşumuna yol açan beta bozunma zincirleri geçirdiler. Element 101, mendelevium, 1955'in başlarında elde edildi. Seaborg, Albert Ghiorso, Bernard Harvey, Gregory Choppin ve Stanley Thomson alfa-gövdesi, altın folyo üzerinde elektrolitik olarak biriken yaklaşık bir milyar (çok az, ama artık yoktu) einsteinium atomunu bombaladı. Son derece yüksek ışın yoğunluğuna (saniyede 60 trilyon alfa parçacığı) rağmen, sadece 17 mendelevium atomu elde edildi, ancak aynı zamanda ışınımlarını ve ışınımlarını belirlemek mümkün oldu. Kimyasal özellikler.
ağır iyonlar
Mendelevium, nötronlar, döteronlar veya alfa parçacıkları kullanılarak üretilen son uranyumötesiydi. Aşağıdaki elementleri elde etmek için, 100 - fermiyum element numarasından hedefler gerekliydi, ki bu daha sonra yapılamadı (şimdi bile nükleer reaktörler fermiyum nanogram miktarlarda elde edilir).Bilim adamları diğer yöne gittiler: çekirdekleri ikiden fazla proton içeren (bunlara ağır iyonlar denir) hedefleri bombalamak için iyonize atomlar kullandılar. İyon ışınlarını hızlandırmak için özel hızlandırıcılar gerekliydi. Bu tür ilk HILAC makinesi (Ağır İyon Doğrusal Hızlandırıcı) 1957'de Berkeley'de piyasaya sürüldü, ikincisi U-300 siklotron Laboratuvarda piyasaya sürüldü. nükleer reaksiyonlar 1960 yılında Dubna'da Ortak Nükleer Araştırma Enstitüsü. Daha sonra Dubna'da daha güçlü U-400 ve U-400M kurulumları başlatıldı. Diğer bir hızlandırıcı UNILAC (Evrensel Doğrusal Hızlandırıcı), Darmstadt'ın ilçelerinden biri olan Vixhausen'deki Alman Helmholtz Ağır İyon Araştırma Merkezi'nde 1975 yılının sonundan beri faaliyet göstermektedir.
Kurşun, bizmut, uranyum veya uranyum ötesi hedeflerin ağır iyon bombardımanı, nötronlar yayarak (buharlaştırarak) ya parçalanan ya da fazla enerjilerini serbest bırakan yüksek derecede uyarılmış (sıcak) çekirdekler üretir. Bazen bu çekirdekler bir veya iki nötron yayar, ardından alfa bozunması gibi başka dönüşümlere uğrarlar. Bu tür senteze soğuk denir. Darmstadt'ta onun yardımıyla 107'den (boryum) 112'ye (copernicium) kadar sayılara sahip elementler elde edildi. Aynı şekilde, 2004 yılında Japon fizikçiler 113. elementin bir atomunu yarattılar (bir yıl önce Dubna'da elde edildi). Sıcak füzyon sırasında yenidoğan çekirdekleri kaybeder daha fazla nötron- üçten beşe. Bu şekilde, Berkeley ve Dubna'da 102'den (nobelium) 106'ya (liderliğinde dokuz yeni elementin yaratıldığı Glenn Seaborg onuruna seaborgium) elementler sentezlendi. Daha sonra, Dubna'da, en büyük süper ağır ağırlıklardan altısı bu şekilde yapıldı - 113'ten 118'e. Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC, Uluslararası Temel ve Uygulamalı Kimya Birliği) şimdiye kadar sadece 114. (flerovium) ve 116. (livermorium) elementlerin isimlerini onayladı.
Sadece üç atom
Ununoctia'nın geçici adı ve Uuo sembolü olan 118. element (IUPAC kurallarına göre, elementlerin geçici isimleri, atom numaralarının basamaklarının adlarının Latince ve Yunanca köklerinden oluşur, un-un-oct (ium) ) - 118) iki bilimsel grubun ortak çabalarıyla oluşturuldu: Yuri Oganesyan yönetiminde Dubninskaya ve Seaborg'un öğrencisi Kenton Moody yönetiminde Livermore Ulusal Laboratuvarı. Ununoktiyum periyodik tablodaki radon altında bulunur ve bu nedenle soy gaz olabilir. Bununla birlikte, fizikçiler bu elementin sadece üç atomunu oluşturduğu için kimyasal özellikleri henüz netlik kazanmamıştır. kütle Numarası 294 (118 proton, 176 nötron) ve yaklaşık bir milisaniyelik bir yarı ömür: 2002'de iki ve 2005'te bir. Bir kaliforniyum-249 hedefini (98 proton, 151 nötron), U-400 hızlandırıcısında dağılmış, atom kütlesi 48 (20 proton ve 28 nötron) olan ağır bir kalsiyum izotopunun iyonlarıyla bombalayarak elde edildiler. Toplam sayısı kalsiyum "mermileri" 4.1x1019'a ulaştı, bu nedenle Dubna "ununoctium jeneratörünün" performansı son derece düşük. Ancak Kenton Moody'ye göre U-400, dünyadaki 118. elementi sentezleyebilen tek makinedir."Transuranyum sentezi üzerine yapılan her bir deney dizisi, süper ağır çekirdeklerin özelliklerini modellemek için kullanılan nükleer maddenin yapısı hakkında yeni bilgiler ekliyor. Kenton Moody, özellikle 118. elementin sentezi üzerine yapılan çalışmaların önceki birkaç modelin atılmasını mümkün kıldığını hatırlıyor. "Hedefi kaliforniyumdan yaptık, çünkü gerekli miktarlarda daha ağır elementler mevcut değildi. Kalsiyum-48, ana izotopu kalsiyum-40'a kıyasla sekiz ekstra nötron içerir. Çekirdeği bir kaliforniyum çekirdeği ile birleştiğinde, 179 nötronlu çekirdekler oluştu. Çok heyecanlıydılar ve bu nedenle özellikle nötronları bırakarak hızla çıktıkları kararsız hallerdeydiler. Sonuç olarak, 176 nötronlu 118. elementin bir izotopunu elde ettik. Ve bunlar tam bir elektron setine sahip gerçek nötr atomlardı! Biraz daha uzun yaşarlarsa, kimyasal özellikleri de değerlendirilebilir.
Metuşelah numarası 117
Ununseptium olarak da bilinen Element 117, daha sonra - Mart 2010'da elde edildi. Bu element, daha önce olduğu gibi, Oak Ridge Ulusal Laboratuvarı'nda sentezlenen berkelium-249'dan bir hedefe kalsiyum-48 iyonlarının ateşlendiği aynı U-400 makinesinde üretildi. Berkelium ve kalsiyum çekirdeklerinin çarpışması, yüksek derecede uyarılmış ununseptium-297 çekirdeği (117 proton ve 180 nötron) üretti. Deneyciler, beşi her biri dört nötronu buharlaştırıp ununseptium-293'e dönüşen ve geri kalanlar üç nötron yayarak ununseptium-294'ü oluşturan altı çekirdek elde etmeyi başardılar.Ununoctius ile karşılaştırıldığında, ununseptius'un gerçek bir Methuselah olduğu ortaya çıktı. Daha hafif izotopun yarı ömrü 14 milisaniyedir ve daha ağır olan 78 milisaniye kadardır! 2012 yılında, Dubna fizikçileri beş tane daha ununseptium-293 atomu ve daha sonra her iki izotopun birkaç atomunu daha elde ettiler. 2014 baharında, Darmstadt'tan bilim adamları, ikisi 294 atom kütlesine sahip olan 117. elementin dört çekirdeğinin sentezini bildirdiler. Alman bilim adamları tarafından ölçülen bu "ağır" ununseptiumun yarı ömrü yaklaşık 51 milisaniyeydi. (Bu, Dubna'dan bilim adamlarının tahminleriyle iyi bir uyum içindedir).
Şimdi Darmstadt'ta, 119. ve 120. elementlerin sentezine izin verecek, süper iletken mıknatıslar üzerinde ağır iyonların yeni bir lineer hızlandırıcısı için bir proje hazırlıyorlar. Yeni bir DS-280 siklotronun inşa edildiği Dubna'da da benzer planlar uygulanıyor. Sadece birkaç yıl içinde yeni süper ağır transuranyumların sentezinin mümkün olması mümkündür. Ve 120. hatta 126. elementin 184 nötronla yaratılması ve kararlılık adasının keşfi gerçek olacak.
İstikrar adasında uzun ömür
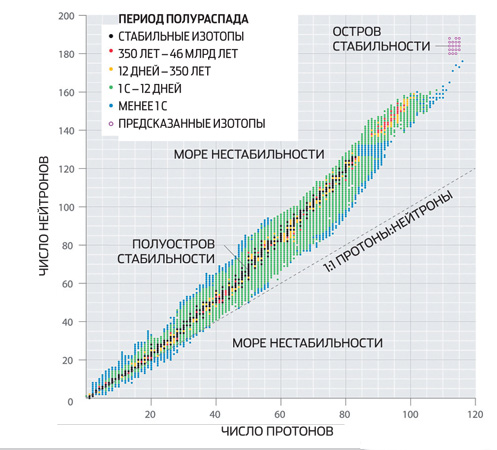 Çekirdeklerin içinde, atomların elektron kabuklarına biraz benzeyen proton ve nötron kabukları vardır. Tamamen doldurulmuş kabuklu çekirdekler, kendiliğinden dönüşümlere karşı özellikle dirençlidir. Bu kabuklara karşılık gelen nötron ve proton sayılarına sihirli sayılar denir. Bazıları deneysel olarak belirlenir - bunlar 2, 8, 20 ve 28'dir.
Çekirdeklerin içinde, atomların elektron kabuklarına biraz benzeyen proton ve nötron kabukları vardır. Tamamen doldurulmuş kabuklu çekirdekler, kendiliğinden dönüşümlere karşı özellikle dirençlidir. Bu kabuklara karşılık gelen nötron ve proton sayılarına sihirli sayılar denir. Bazıları deneysel olarak belirlenir - bunlar 2, 8, 20 ve 28'dir.
Kabuk modelleri, tam bir garanti olmasa da, süper ağır çekirdeklerin "sihirli sayılarını" teorik olarak hesaplamayı mümkün kılar. 184 numaralı nötronun büyülü olmasını beklemek için nedenler var. 114, 120 ve 126 proton sayıları buna karşılık gelebilir ve ikincisi yine sihir olmalıdır. Eğer öyleyse, her biri 184 nötron içeren 114., 120. ve 126. elementlerin izotopları, periyodik tablodaki komşularından çok daha uzun yaşayacak - dakikalar, saatler ve hatta yıllar (bu alan u200btablo genellikle istikrar adası olarak adlandırılır). Bilim adamları, en büyük umutlarını, çift sihirli bir çekirdeğe sahip son izotopa bağladılar.
Dubna yöntemi
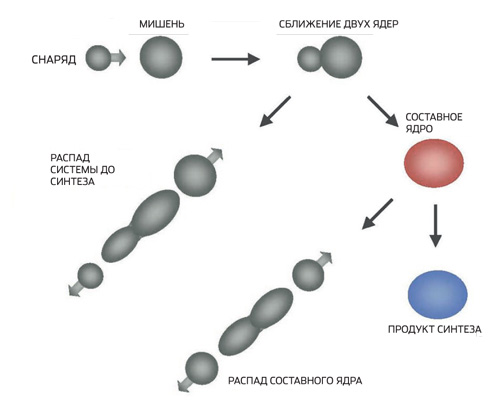
Darmstadt ekibinin bir üyesi olan Alexander Yakushev, “113 ila 118 arasındaki elementler, Dubna'da Yuri Oganesyan'ın rehberliğinde geliştirilen harika bir yöntem temelinde oluşturuldu” diye açıklıyor. — Darmstadt'taki hedefleri bombalamak için kullanılan nikel ve çinko yerine Oganesyan, çok daha düşük atom kütlesine sahip bir izotop - kalsiyum-48 aldı. Buradaki nokta, hafif çekirdeklerin kullanılmasının, bunların hedef çekirdeklerle füzyon olasılığını artırmasıdır. Kalsiyum-48 çekirdeği, 20 proton ve 28 nötrondan oluştuğu için iki kat büyülüdür. Bu nedenle, Oganesyan'ın seçimi, hedefin bombardımanı sırasında ortaya çıkan bileşik çekirdeklerin hayatta kalmasına büyük katkıda bulundu. Sonuçta, çekirdek birkaç nötron fırlatabilir ve ancak doğumdan hemen sonra parçalara ayrılmazsa yeni bir uranyumötesi oluşturabilir. Süper ağır elementleri bu şekilde sentezlemek için Dubninsk fizikçileri, ABD'de üretilen transuranyumlardan hedefler yaptılar - önce plütonyum, sonra americium, curium, California ve son olarak berkelium. Kalsiyum-48 doğada sadece %0.7'dir. Elektromanyetik ayırıcılarda çıkarılır, bu pahalı bir prosedürdür. Bu izotopun bir miligramı yaklaşık 200 dolara mal oluyor. Bu miktar, hedefi bir veya iki saat bombalamak için yeterlidir ve deneyler aylarca sürer. Hedeflerin kendileri daha da pahalı, bir milyon dolara ulaşıyor. Elektrik faturalarını ödemek de oldukça pahalıya mal olur - ağır iyon hızlandırıcılar megawatt güç tüketir. Genel olarak, süper ağır elementlerin sentezi ucuz bir zevk değil.”
I. Periyodik sistemdeki hidrojenin konumu
Hidrojen - en yaygın kimyasal element, ayrıca en hafifidir. Seri numarası 1'dir. Periyodik tabloda ilk periyottadır. Özellikleri göz önüne alındığında, hem 1A hem de 7A gruplarına yerleştirilir. Soru ortaya çıkıyor - neden?
Hidrojenin çekirdeği, etrafında bir elektronun döndüğü bir protondan oluşur. Elektronik formül 1s 1 . Hidrojen molekülü, polar olmayan bir kovalent bağ ile bağlanmış iki atomdan oluşur. H 2 en hafif gazdır. Renksiz ve kokusuzdur.
Hidrojen kimyasal olarak aktif bir maddedir. O gibi davranabilir indirgeyici ajan ve oksitleyici ajan.
1) bazı metallerle hidrit oluşturur
2Na+H2 =2NaH, burada hidrojen - oksitleyici
H
0
+ 1
e
-
→
H
-1
Halojenlerin etkileşimi sırasında benzer bir süreç meydana gelir - 7A grubunun metal olmayanları
2Na + Cl2 \u003d 2NaCl
Bu nedenle, hidrojen 7A grubuna yerleştirilir.
2) hidrojenden daha güçlü oksitleyici özellikler sergileyen metal olmayanlar
H2 + Cl2 = 2HCl burada hidrojen - indirgeyici ajan H 0 - 1 e - → H +1
Etkileşim sırasında benzer bir süreç oluşur alkali metaller- 1A grubu metaller
2K + Cl2 \u003d 2KCl
Bu nedenle, hidrojen 1A grubuna yerleştirilir.
II. Periyodik sistemdeki konumu kimyasal elementler D. I. Mendeleev lantanitler ve aktinitler
Eğitici film: “Lantanidlerin ve aktinitlerin özellikleri”
AT lantandan sonraki altıncı dönem adı verilen 58-71 seri numaralı 14 eleman vardır. lantanitler ("Lantanitler" kelimesi "lantan gibi" anlamına gelir ve "aktinitler", "aktinyum gibi" anlamına gelir). Bazen lantanidler ve aktinitler olarak adlandırılırlar, yani lantan'ın yanında; aşağıdaki aktinyum) . Lantanitler, tablonun altına ayrı ayrı yerleştirilir ve hücrede bir yıldız işareti, sistemdeki konumlarının sırasını gösterir: La-Lu. Lantanitlerin kimyasal özellikleri çok benzerdir. Örneğin, hepsi su ile reaksiyona girerek hidroksit ve hidrojen oluşturan reaktif metallerdir. Lantanda (Z = 57), bir elektron 5d alt seviyesine girer, bundan sonra bu alt seviyenin doldurulması durur ve yedi yörüngesi 14 elektron tarafından işgal edilebilen 4f seviyesi dolmaya başlar. Bu, Z = 58 - 71 olan tüm lantanitlerin atomları için meydana gelir. Bu elementler derin 4f alt seviyesini doldurduğundan üçüncü dış seviye, çok benzer kimyasal özelliklere sahiptirler.
Bundan, lantanitlerin güçlü bir şekilde telaffuz edildiği sonucu çıkar. yatay benzetme.
AT yedinci periyot 14 element 90-103 seri numaraları aileyi oluşturur aktinitler. Ayrıca ayrı olarak yerleştirilirler - lantanitlerin altına ve karşılık gelen hücrede iki yıldız, sistemdeki konumlarının sırasını gösterir: Ac-Lr. Aktinyum ve aktinitlerde seviyelerin elektronlarla doldurulması lantan ve lantanitlere benzer. Bununla birlikte, lantanitlerin aksine, aktinitler için yatay analoji zayıf bir şekilde ifade edilir. Bileşiklerinde daha farklı oksidasyon durumları sergilerler. Örneğin, aktinyumun oksidasyon durumu +3'tür ve uranyum +3, +4, +5 ve +6'dır. Aktinitlerin kimyasal özelliklerinin incelenmesi, çekirdeklerinin kararsızlığı nedeniyle son derece zordur.
Tüm aktinitler radyoaktiftir. Örtüşen iki aktinit grubu vardır: "transuranyum elementler"- uranyum için periyodik tablodaki aşağıdaki tüm elementler ve "transplütonyum elementleri"- hepsi plütonyumu takip ediyor. Her iki grup da belirtilen çerçeve ile sınırlı değildir ve "trans-" ön eki belirtildiğinde, lavrensiyum - rutherfordium, vb.'den sonraki elementleri içerebilirler. Bunun nedeni, bu tür elementlerin son derece küçük miktarlarda sentezlenmesidir. Doğada önemli miktarlarda bulunan (prometyum hariç) lantanitlerle karşılaştırıldığında, aktinitlerin sentezlenmesi daha zordur. Ancak istisnalar vardır, örneğin uranyum ve toryum doğada sentezlenmesi veya bulunması en kolay olanlardır, ardından plütonyum, amerikyum, aktinyum, protaktinyum ve neptunyum gelir.
III. D. I. Mendeleev'in yapay olarak elde edilen elementlerin kimyasal elementlerinin periyodik sistemindeki konumu
2008 yılına kadar 117 kimyasal element bilinmektedir (1'den 116 ve 118'e kadar seri numaralarıyla), bunların 94'ü doğada bulunur (bazıları sadece eser miktarlardadır), geri kalan 23'ü nükleer reaksiyonlar sonucunda yapay olarak elde edilir (bkz. Ekler). İlk 112 elementin kalıcı isimleri var, geri kalanı geçici.
Sayfa 1
Uranyumu takip eden yapay olarak elde edilen elementlere uranyum ötesi denir.
Yapay olarak elde edilen elemanlar bir üst simge ile işaretlenir; onlar için göreceli değerler atom kütleleri(kesinlik belirtilmeksizin) veya en uzun ömürlü izotopların kütle numaraları. Element sembolünün solundaki alt dizin, Periyodik sistemdeki seri numarasını gösterir. Yaygın olmayan eleman sembolleri parantez içine alınır. Henüz sembolü olmayan 106 ve 107 seri numaralı elemanlar tablonun sonuna yerleştirilmiştir.
Yapay olarak elde edilen elementler: Astatin - No. 85, teknesyum - No. 43, fransiyum - No. 87 (bkz. s.
Yapay olarak elde edilen tüm bu elementler henüz doğada bulunmadı, ancak büyük bilimsel ilgi görüyor. Bazıları zaten teknolojide kullanılıyor.
| Enerji seviyeleri 5 / ve. |
Bildiğiniz yapay olarak elde edilen elementleri adlandırın, D. I. Mendeleev'in periyodik kimyasal element tablosundaki yerlerini belirtin ve bu elementlerin atomlarındaki yörüngelerdeki elektronların düzenini yansıtan diyagramlar çizin.
Onlara karşılık gelen yeni yapay olarak elde edilen elemanlar yaygın isim transuranik elementler.
Masada. 1, elementlerin isimlerini (Rusça ve Latince), kimyasal işaretleri, D. I. Mendeleev'in periyodik element sistemindeki seri numaralarını, bağıl atom kütlesini ve keşif yılını gösterir. Atom kütleleri 1981 Uluslararası Tablosuna göre verilmiştir. Yapay olarak elde edilen elementler bir yıldızla işaretlenmiştir; Antik Belirli bir radyoaktif element için en uzun yarı ömre sahip izotopların kütle numaraları köşeli parantez içinde verilmiştir. Parantez içinde verilen elementlerin isimleri ve kimyasal sembolleri genel olarak kabul edilmemektedir.
Masada. 1, elementlerin isimlerini (Rusça ve Latince), D. I. Mendeleev'in periyodik element sistemindeki seri numaralarını, bağıl atom kütlesini ve keşif yılını verir. Atomik kütleler (dört anlamlı rakamla birlikte) 1977 Uluslararası Tablosuna göre verilmiştir. Yıldız işareti yapay olarak elde edilmiş eski elementleri gösterir.
yapay elementler
Uranyum termal nötronlarla bombardımana tutulduğunda, ondan 35-65 seri numaralı daha hafif elementler oluşur: Bu, 43 ve 61 numaralı elementlerin izotoplarının da parçalar arasında bulunacağını ummamızı sağladı. 43, 61, 85 ve 87 numaralı elementlerin yanı sıra 1930'da gözle görülür bir ilerleme yakalamak mümkün oldu. Her şeyden önce, 43 ve 61 numaralı elementlerin "yok olmuş" kararsız maddeler olduğu şüphesi doğrulandı. 85 ve 87 numaralı elementlere gelince, bunlar uzun zamandır bozunmuş radyoaktif maddeler olarak kabul edilmektedir.
1934'te fizikçi Josef Mattauch, izotop çekirdeklerinin kararlılığını tahmin etmeye izin veren bir başparmak kuralı buldu. Mattauch kuralına göre, çekirdeğinin yükü, aynı kütle numarasına sahip bilinen kararlı bir izotopun çekirdeğinin yükünden yalnızca bir farklıysa, ikinci bir kararlı izotop var olamaz. Bu model, tek atom numarasına (yani, tek sayıda proton ve elektrona) sahip elementlerin, çekirdeklerinin kararlılığı düşük olduğu için Dünya'da çok daha az yaygın olduğu Harkins kuralını tamamlar.
43 ve 61 numaralı elementlerle ilgili olarak Mattauch kuralı aşağıdaki gibi ifade edilebilir. Periyodik sistemdeki konumlarına bağlı olarak, 43 numaralı elementin kütle numarası yaklaşık 98 ve 61 numaralı element için yaklaşık 147 olmalıdır. Bununla birlikte, kararlı izotoplar 42 ve 44 elementleri için olduğu kadar kütleli 60 ve 62 elementleri için de zaten biliniyordu. 94'ten 102'ye ve sırasıyla 142'den 150'ye. Aynı kütle numarasına sahip ikinci bir kararlı izotop bulunamayacağından, 43 ve 61 öğelerinin yalnızca kararsız temsilcileri olmalıdır. Hiç şüphe yok ki, 43 ve 61 numaralı elementler bir zamanlar Dünya'da yeterli miktardaydı.
bizim ne zaman Güneş Sistemi, sonra tüm elementler proton ve nötronların birleştirilmesiyle oluştu. Ancak, Dünya'nın varlığı sırasında - 4.6 milyar yıl - kararsız temsilcileri yavaş yavaş tamamen ortadan kayboldu. Tek istisna olanlar radyoaktif elementler doğal radyoaktif serinin sınırları içinde sürekli olarak yenilenebilen, çünkü başlangıç maddeleri Uranüs veya toryum- milyarlarca yıllık yarı ömürleri sayesinde hala Dünya'da varlar. 43 ve 61 elementleri bu doğal radyoaktif serilere ait değildir. Ancak bu elementlerin uzun ömürlü bir izotopu varsa, onun radyokimyasal izlerini bulmayı umabiliriz.
Bazı alimler henüz sahte transuranlar, diğer araştırmacılar imrenilen 43 ve 87 öğelerini bulmayı başardılar. İşte onların keşiflerinin hikayesi...
1936'da Emilio segre evlendikten sonra Fermi ve çalışma arkadaşlarından ayrılarak Sicilya'nın eski başkenti Palermo'ya gitti. Oradaki üniversitede kendisine fizik kürsüsü teklif edildi. Palermo'da Segre, büyük üzüntüsüne, Fermi ile başlayan araştırmaya devam edemedi. Üniversitenin radyoaktif araştırmalar için herhangi bir ekipmanı yoktu. Hızlı bir karar veren İtalyan bilim adamı, en iyi ekipmanla ünlü Berkeley'deki California Üniversitesi ile tanışmak için Amerika'ya gitti. O zamanlar dünyada tek siklotron. "Gördüğüm bu radyoaktivite kaynakları, daha önce yalnızca Ra-Be kaynaklarıyla çalışmış biri için gerçekten şaşırtıcıydı.", fizikçi hatırladı.
Segre özellikle ilgilendi siklotronun saptırma plakası. Hızlandırılmış parçacıkların akışını gerekli yöne yönlendirmesi gerekiyordu. Yüksek enerjili parçacıklarla çarpışmalar nedeniyle - hızlandırılmış döteronlar Bu tabak çok ısındı. Bu nedenle, refrakter metalden yapılması gerekiyordu - molibden. İtalya'dan gelen konuğun dikkatini çeken, döteronlar tarafından bombalanan bu metalik molibdendi. Segre, 42 nolu element molibdenden, döteronlarla bombardımanın bir sonucu olarak, hala bilinmeyen 43 elementinin izotoplarının oluşabileceğini öne sürdü.Belki, denkleme göre:
96 Ay + D = 97 X + n
Doğal molibden altı kararlı izotopun bir karışımıdır. Segre, belki de molibdenin teorik olarak dönüşebileceği 43 numaralı elementin altı olası radyoaktif izotopundan birinin - en az bir tanesinin - Sicilya'ya yapılacak bir deniz yolculuğuna dayanacak kadar uzun ömürlü olduğunu öne sürdü. İtalyan fizikçi için 43. elementi sadece anavatanındaki bir enstitüde aramayı amaçladı.
Araştırmacı, cebinde Berkeley siklotronundan bir parça molibden levhasıyla dönüş yolculuğuna çıktı. Ocak 1937'nin sonunda, mineralog ve analitik kimyager Perrier'in desteğiyle araştırmalarına başladı. Gerçekten de kimyasal özellikleriyle manganez ve renyum arasına yerleştirilebilecek radyoaktif atomlar buldular. İnsanın araştırma dehası sayesinde Dünya'da yeniden yapay olarak yeniden doğan emarganez miktarları hayal edilemeyecek kadar küçüktü: 43. elementin 10 -10 ila 10 -12 g!
Temmuz 1937'de Segre ve Perrier, Dünya'da uzun süre önce soyu tükenmiş olan ilk yapay elementin sentezini rapor ettiklerinde, tarihe geçmiş bir gündü. 43. element için daha sonra çok doğru bir isim bulundu: teknesyum, Yunancadan türetilmiş teknetos- yapay. Onu önemli miktarlarda elde etmek ve elinizde tutmak hiç mümkün olacak mı? Uranyum fisyonunun nispeten yüksek verimle 43 izotopa yol açtığı keşfedildiğinde, bu soruyu olumlu olarak yanıtlamak çok geçmeden mümkün oldu. Kütle numarası 101 ve yarı ömrü 14 dakika olan bir izotop özellikle dikkat çekti. 13 dakikalık bir yarı ömre sahip olan Fermi maddesinin, hayali element 93'ün, element 43'ün bir izotopu olması gerektiği varsayılmıştır.
Doğal radyoaktif seriler son halini aldı- özellikle uranyum-235'in Dempster tarafından kütle spektrografik olarak tanımlanmasından sonra kimse bundan şüphe etmeye cesaret edemedi. Ancak, uranyum-aktinyum serisinde zayıf bir nokta vardı. Neredeyse unutulmaya mahkum olan bu dizideki "yanlışlık" not edildiğinden bu yana yirmi yıldan fazla bir süre geçti.
1913/1914'te, bu tutarsızlık İngiliz kimyager Cranston ve Avusturyalı radyoaktivite araştırmacıları Mayer, Hess ve Panet tarafından aktinyum üzerinde çalışırken tesadüfen bulundu. Beta yayıcı olarak aktinyum dönüştüğü biliniyor radyoaktinyum, yani, izotopa toryum. Bilim adamları dönüşüm sürecini incelediklerinde, her zaman zayıf alfa radyasyonu gözlemlediler. Bu kalıntı aktivite (yaklaşık %1), saf aktinyum elde etmek için yapılan deneylerde Otto Hahn tarafından da bulunmuştur. " Bu küçük miktara önem vermeye cesaret edemedim.", Khan daha sonra bildirdi. Bunun büyük olasılıkla bir kirlilik olduğuna inanıyordu.
Yıllar sonra. Fransız bilim adamı Marguerite perey, Paris'teki ünlü Radyum Enstitüsü'nün bir çalışanı, yine bu izi takip etti, kesirleri çok dikkatli bir şekilde temizledi. anemon ve Eylül 1939'da yeni bir radyoaktif izotopun başarılı izolasyonu hakkında rapor verebildi. Kalan %1 aktinyum aktivitesini veren alfa yayan yan ürün olan uzun süredir eksik olan element 87'ydi. Madam Perey önceden doldurulmuş sırada bir çatal buldu, çünkü element 87'nin izotopu, bilinen radyo aktinyum ile tam olarak aynı şekilde aktinyum X'e dönüşür. Perey'in önerisiyle, element 87 olarak adlandırıldı. Fransa vatanının şerefine.
Doğru, bugüne kadar kimyagerler element 87'yi incelemekte büyük bir başarı elde etmediler. Sonuçta, tüm fransiyum izotopları kısa ömürlüdür ve milisaniyeler, saniyeler veya dakikalar içinde bozunur. Bu nedenle, element birçok kimyasal çalışma ve pratik kullanım için şimdiye kadar "ilginç" olarak kaldı. Gerekirse yapay olarak elde edilir. Tabii ki, fransiyum doğal kaynaklardan da "elde edilebilir", ancak bu şüpheli bir girişimdir: 1 g doğal uranyum sadece 10 -18 g fransiyum içerir!
Periyodik sistem keşfedildiğinde 23 element eksikti, şimdi sadece ikisi: 61 ve 85. Element avı nasıl devam etti? 1938 yazında Emilio Segre yeniden Berkeley'e gitti. 43. elementin kısa ömürlü izotoplarını incelemeyi amaçladı. Tabii ki, bu tür çalışmalar hemen yapılmalıydı. Kısa yarı ömre sahip izotoplar, İtalya yolculuğunda "hayatta kalamaz". Berkeley'e varır varmaz Segre, ırkçı terör yüzünden faşist İtalya'ya dönüşün onun için imkansız hale geldiğini öğrendi. Segré, Berkeley'de kaldı ve çalışmalarına orada devam etti.
Berkeley'de, daha güçlü bir siklotronla, alfa parçacıkları yüksek enerjilere hızlandırılabilir. Sözde Coulomb etkileşim eşiğini aştıktan sonra, bu alfa parçacıkları ağır atomların çekirdeklerine bile nüfuz edebildi. Şimdi Segre dönmek için bir fırsat gördü bizmut, element 83, bilinmeyen element 85'e. Amerikalı Corson ve Mackenzie ile birlikte, aşağıdaki işlemi gerçekleştirmek için bizmut çekirdeklerini 29 MeV enerjili alfa parçacıklarıyla bombaladı:
209 Bi + 4 He = 211 X + 2 n
Reaksiyon gerçekleşti. Araştırmacılar ilk ortak çalışmalarını 1 Mart 1940'ta tamamladıklarında, bu fikri sadece temkinli bir şekilde ifade ettiler " 85 elementinin radyoaktif izotopunun olası üretimi hakkında"Bundan kısa bir süre sonra, zaten emindiler: 85. element doğada bulunmadan önce yapay olarak elde edildi. İkincisi, sadece birkaç yıl sonra İngiliz kadın Ley-Smith ve Bern'deki enstitüden İsviçreli Minder yapacak kadar şanslıydı. 85 numaralı elementin toryumun radyoaktif serilerinde bir yan işlem sonucunda oluştuğunu göstermeyi başardı. açık eleman sözlü saçmalık olarak eleştirilen Anglo-Helvetium adını seçtiler. Avusturyalı araştırmacı Karlik ve iş arkadaşı Bernert kısa süre sonra diğer doğal radyoaktivite serilerinde de bir yan ürün olarak 85. elementi buldular. Bununla birlikte, yalnızca izlerde bulunan bu öğeye bir isim verme hakkı Segre ve işbirlikçilerinde kaldı: şimdi Yunanca'da kalıcı anlamına gelen astatin olarak adlandırılıyor. Sonuçta, bu elementin en kararlı izotopunun yarılanma ömrü sadece 8,3 saattir.
Bu arada, Profesör Segre de 61. elementi sentezlemeye çalışıyordu. Bu arada, bu elementin periyodik sistemdeki her iki komşusunun, neodimyum ve samaryumun zayıf radyoaktif olduğu ortaya çıktı. İlk başta bu şaşırtıcı görünüyordu, çünkü o zamanlar radyoaktivitenin en ağır elementlerin doğasında olduğuna inanılıyordu. 60. element olan neodimyum, beta ışınları yaydı ve bu nedenle element 61'e dönüşmek zorunda kaldı. Bu bilinmeyen kimyasal elementin şimdiye kadar izole edilememesi, muhtemelen hızlı radyoaktif bozunmasından kaynaklanıyordu. Ne yapalım? Burada yine çıkış yolu, istenen öğeyi yapay olarak elde etmekti. 61. element doğada bulunamadığı için fizikçiler onu sentezlemeye çalıştılar.
1941/42'de bilim adamları Lowe, Poole, Quill ve Kurbatov Devlet Üniversitesi Ohio'da bombalanan nadir toprak neodimyum döteronlar bir siklotronda hızlandı. Keşfettiler Radyoaktif İzotoplar siklonyum adı verilen yeni element. Ancak, filmde sadece bir iz kaldı.
Emilio Segre'nin başarıları nelerdi? Alfa ışınlarıyla ışınlandı praseodimyum- element 59. Bununla birlikte, onun tarafından koşulsuz olarak sentezlenen element 61 izotoplarının işlenmesinin çok karmaşık olduğu ortaya çıktı. Diğer nadir toprak elementlerinden izolasyonları başarısız oldu.
Finlandiya'dan bir sonuçsuz çalışma bildirildi. 1935'te kimyager Eremetse, bir oksit karışımının konsantrelerini analiz etmeye başladı. samaryum ve neodimyum içlerindeki 61. elementin doğal içeriği üzerine. Bu amaçla birkaç ton apatit işlendi.
61. element mücadelesinin ilk etabı berabere kaldı. Önerilen başlığı bile kabul edemedi" siklon".
KİMYA DERSİNE İLİŞKİN BİLGİLERİN SİSTEMLENDİRİLMESİ, GENELLEŞTİRİLMESİ VE DERİNLENDİRİLMESİ
Bölüm II. Periyodik yasa ve periyodik sistem D.I. Mendeleev öğretilere dayanarak
atomun yapısı hakkında
§§1-3 için görevler (s. 70)
Soru 1
D.I. tarafından verilen periyodik yasanın formülasyonunu karşılaştırın. Mendeleev, modern bir formülasyonla. Bu ifade değişikliğinin neden gerekli olduğunu açıklayın.
D.I. tarafından verilen periyodik yasanın formülasyonu. Mendeleev, kimyasal elementlerin özelliklerinin, bu elementlerin atom kütlelerine periyodik olarak bağımlı olduğunu söyledi. Modern formülasyon şöyle diyor: kimyasal elementlerin özellikleri, bu elementlerin çekirdeğinin yüküne periyodik olarak bağımlıdır. Böyle bir açıklama gerekliydi, çünkü Mendeleev periyodik yasayı oluşturduğunda atomun yapısı henüz bilinmiyordu. Atomun yapısını aydınlattıktan ve elektronların elektronik seviyelerde dağılımını yöneten yasaları belirledikten sonra, elementlerin özelliklerinin periyodik olarak tekrarlanmasının elektron kabuklarının yapısının tekrarı ile ilişkili olduğu anlaşıldı.
Soru 2
Neden periyotlardaki eleman sayısı 2 - 8 - 18 - 32 numaralı bir diziye karşılık geliyor? Elektronların dizilişini dikkate alarak bu modeli açıklayın. enerji seviyeleri.
Bir atomdaki elektronlar s-, p-, d- ve f-orbitallerini işgal edebilir. Bir elektronik seviyede bir s-yörüngesi, üç p-yörüngesi, beş d-yörüngesi, yedi f-yörüngesi olabilir. bir yörüngede
ikiden fazla elektron olamaz. Böylece sadece s-orbitalleri dolu ise elektron seviyesinde 2 elektron vardır. Eğer s- ve p-orbitalleri dolu ise bir elektronik seviyede 2 + 6 = 8 elektron vardır. s-, p- ve d-orbitalleri dolu ise elektronik seviyede 2 + 6 + 10 = 18 elektron vardır. Son olarak s-, p-, d- ve f-orbitalleri dolu ise elektron seviyesinde 2 + 6 + 10 + 14 = 32 elektron vardır. Böylece periyotlardaki element sayısı, elektronik seviyedeki mümkün olan maksimum elektron sayısına karşılık gelir.
Soru 3
Atomların yapısı teorisine dayanarak, element gruplarının neden ana ve ikincil olarak ayrıldığını açıklayın.
Periyodik element sisteminin ana alt gruplarının elemanlarında, dış elektronik seviyenin yörüngeleri elektronlarla doldurulur. Yan alt grupların elemanlarında, sondan bir önceki elektronik seviyenin yörüngeleri elektronlarla doldurulur.
4. soru
s-, p-, d- ve f-momentleri hangi kriterlere göre ayırt edilir?
s-elementlerinin atomlarında s-orbitalleri doldurulur; p-elemanlarının atomlarında p-orbitalleri; d-elemanlarının atomlarında doldurulur.
– d-orbitalleri ve f-elementlerinin atomlarında – f-orbitalleri.
5. soru
Periyodik kimyasal element sistemi tablosunu kullanarak D.I. Mendeleev, vanadyum V, nikel Ni ve arsenik As elementlerinin atomlarındaki elektronların yörüngelerdeki ve enerji seviyelerindeki düzeninin bir diyagramını çizin. Hangisi p elementi, hangileri d elementi ve neden?
Vanadyum atomu:
1s2 2s2 2p6 3s2 3p6 3d3 4s2
Nikel atomu: 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Arsenik atomu: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Vanadyum ve nikel atomlarında 3d alt seviye doldurulur, bu nedenle d elementleri olarak adlandırılırlar. Arsenik atomunda 4p alt seviyesi doldurulur, yani arsenik bir p elementidir.
6. soru
Sebebini açıkla kimyasal işaret hidrojen genellikle grup I'in ana alt grubuna ve grup VII'nin ana alt grubuna yerleştirilir.
Hidrojen atomunun, alkali metal atomlarında olduğu gibi, dış (ve tek) elektron kabuğunda bir s-elektronu vardır. Bu nedenle hidrojen, periyodik sistemin ilk grubuna yerleştirilir. Öte yandan, dış elektron kabuğunu doldurmak için hidrojen atomu, halojen atomları gibi bir elektrondan yoksundur, bu nedenle hidrojen de periyodik sistemin VII grubunun ana alt grubuna yerleştirilir.
7. soru
Elektronların yörüngelerdeki dağılım modellerine dayanarak, lantanitlerin ve aktinitlerin neden benzer kimyasal özelliklere sahip olduğunu açıklayın.
Lantanitlerin ve aktinitlerin atomlarında, dışarıdan üçüncü elektronik seviye doldurulur. Kimyasal özellikler esas olarak dış kabuğun elektronlarına bağlı olduğundan, lantanitler ve aktinitlerin özellikleri çok benzerdir.
Soru #8
Bildiğiniz yapay olarak elde edilen elementleri adlandırın, D.I.'nin periyodik kimyasal element tablosu tablosundaki yerlerini belirtin. Mendeleev ve çizim diyagramları,
bu elementlerin atomlarındaki orbitallerdeki elektronların düzenini yansıtır.
Doğada bulunmazlar ve sadece teknetyum (No. 43), prometyum (No. 61), astatin (No. 85), fransiyum (No. 87) ve transuranyum elementler, yani içinde bulunan elementler yapay olarak elde edilebilir. uranyumdan sonraki periyodik sistem (93 ve daha fazla sayılarla).
Elektronik devreler teknesyum, prometyum, astatin ve fransiyum:
43 Tc 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2
61 Pm 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2
85 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p5
Transuranyum elementlerinin ilkinin elektronik devresi - neptünyum:
93Np
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2
9. soru
Atomların yapısı ve kimyasal bir bağın oluşumu hakkında modern fikirler açısından "değerlik" kavramının özünü açıklayın.
Değerlik sayıya eşittir Kimyasal bağlar belirli bir elementin bir atomunun diğer elementlerin atomlarıyla oluşabileceğidir. Dış elektronik seviyenin elektronları, kimyasal bağların oluşumuna katılır. Değerlik, belirli bir kimyasal elementin atomunun diğer elementlerin atomlarıyla kimyasal bağlar oluşturmak için sağlayabileceği elektron sayısı olarak da tanımlanabilir.
10. soru
Değerliğin sayısal değeri neden her zaman dış enerji seviyelerindeki elektronların sayısıyla çakışmaz?
Atomda eşleşmemiş elektronların varlığında kimyasal bağların oluşumu mümkündür. Birçok elementte, dış elektronik seviyedeki tüm elektronlar eşlenmemiş değildir.
Örneğin, oksijen ve kükürt atomlarının dış düzeyde altı elektronu vardır, ancak bunlardan sadece ikisi eşleşmemiştir:
16S↓ | ||||||||||||||
Bununla birlikte, dış elektronik seviyedeki kükürt atomunda hala 3s ve 3p orbitallerinden elektronların geçebileceği boş 3d orbitaller vardır, sonuç olarak kükürt atomunda altı eşleşmemiş elektron olur:
16S↓ | ||||||||||||||
Bu nedenle, kükürtün maksimum değeri altıdır, yani dış elektronik seviyedeki elektron sayısı ile çakışır. İkinci seviyede oksijen atomunda d-orbital yoktur, bu nedenle elektron eşleşmesi mümkün değildir ve oksijen değerliliği ikiden fazla olamaz, yani dış seviyedeki elektron sayısına eşit değildir. .
11. soru
2. periyodun elemanlarının maksimum değeri neden 4 sayısını aşamaz?

İkinci periyodun elementlerinin atomlarında, ikinci elektronik seviyede bir s-orbital ve üç p-orbital olduğundan, 4'ten fazla eşleşmemiş elektron olamaz. Değerlik, eşleşmemiş elektronların sayısına eşittir, bu nedenle ikinci periyodun elemanlarının değerliliği 4'ten fazla olamaz.
12. soru
Nitrik asitte azotun değerini, karbon monoksitte karbon ve oksijenin değerini yansıtan elektronik devreler yapın (II).
a) Karbon monoksit molekülü. Karbon ve oksijen atomlarının elektron kabuklarının yapısı:
Bir karbon monoksit molekülünde, karbon atomu üzerindeki eşleşmemiş iki elektron ve oksijen atomu üzerindeki eşleşmemiş iki elektron tarafından iki bağ oluşturulur. Oksijen atomunun 2p yörüngesinde başka bir elektron çifti vardır ve karbon atomunun serbest 2p yörüngesi vardır. Bir çift elektron, bir oksijen atomundan bir karbon atomuna geçerek bir verici-alıcı bağı oluşturur. Karbon monoksitin (II) elektronik formülü aşağıdaki gibi gösterilebilir:
(ok, verici-alıcı bağını gösterir).
b) Nitrik asit molekülü. Hidrojen, oksijen ve nitrojen atomlarının elektronik devreleri:
Hidrojen atomu, tek bir elektron nedeniyle oksijen atomu ile bir bağ oluşturur. Oksijen atomunun ikinci elektronu, azot atomu ile bir bağ oluşumunda rol oynar:
Azot atomunun iki eşleşmemiş elektronu kalır ve ikinci oksijen atomuyla iki bağ oluşturur:
HONO
saat nitrojen atomunun hala bir elektron çifti var 2s yörüngeler.
AT Üçüncü oksijen atomunda elektron eşleşmesi meydana gelir ve serbest bir yörünge oluşur:
Azot atomundan bir çift elektron oksijen atomunun boş yörüngesine geçer ve bir verici-alıcı bağı oluşur:
13. soru
Modern kavramlara göre değerlik kavramı neden iyonik bileşiklere uygulanamaz?
Değerlik, bir atomun oluşturduğu bağ sayısına eşittir ve dış elektronik düzeydeki elektron sayısına bağlıdır. İyonik bileşikler, elektriksel çekim ile bir arada tutulan pozitif ve negatif yüklü iyonlardan oluşur. İyonik bileşiklerde iyonlar arasındaki bağ sayısı,
kristal kafesin yapısındaki elekler, farklı olabilir ve dış elektronik seviyedeki elektron sayısı ile ilgili değildir.
14. soru
Soldan sağa periyotlarda atom yarıçaplarındaki değişimde ve bir periyottan diğerine geçişte hangi örüntüler gözlenir?
Periyotlarda, atom yarıçapları soldan sağa doğru azalır. Bunun nedeni, çekirdeğin yükünün artması ve elektronların çekirdeğe daha güçlü bir şekilde çekilmesidir. elektron kabuğu küçülüyor gibi. Gruplarda, elektron kabuklarının sayısı arttıkça atomların yarıçapları yukarıdan aşağıya doğru artar.
15. soru
D.I. tarafından verilen periyodik yasanın formülasyonunu hatırlayın. Mendeleev ve bu yasanın modern formülasyonu. Belirli örneklerde, yalnızca kimyasal elementlerin özelliklerinin değil, aynı zamanda bileşiklerinin formlarının ve özelliklerinin de periyodik olarak değiştiğini doğrulayın.
D.I. tarafından verilen periyodik yasanın formülasyonu. Mendeleev, kimyasal elementlerin özelliklerinin, bu elementlerin atom kütlelerine periyodik olarak bağımlı olduğunu söyledi. Modern formülasyon şöyle diyor: kimyasal elementlerin özellikleri, bu elementlerin çekirdeğinin yüküne periyodik olarak bağımlıdır. Kimyasal elementlerin bileşiklerinin özellikleri de periyodik olarak değişir. Örneğin, grup I'in ana alt grubunun (Li2 O, Na2 O, K2 O, Rb2 O, Cs2 O) tüm metallerinin oksitleri, temel özellikler sergiler ve grup IV'ün ana alt grubunun (CO2, SiO2) tüm elementlerinin oksitleri , GeO2 SnO2, PbO2) - asidik özellikler .
3 görev numarası 1
0.68 g bilinmeyen bir maddenin tam yanması ile 1.28 g kükürt oksit (IV) ve 0.36 g su elde edildi. Bulmak kimyasal formül yakılan madde.
Su ve kükürt oksidin (IV) molar kütlelerini hesaplayın:
M (H20) \u003d 1 2 + 16 \u003d 18 g / mol
M(SO2) \u003d 32 + 16 2 \u003d 64 g / mol
Maddenin yanması sırasında oluşan su maddesi ve kükürt oksit (IV) miktarını hesaplayalım:
ν(H2O) = | m(H2O) | ||||||||
M(H2O) | |||||||||
ν(SO2) = | |||||||||
M(SO2) | |||||||||
Çünkü reaksiyonda SO2 ve H2 O elde edilir, daha sonra ilk maddede sadece S, H ve O bulunabilir, daha sonra ilk madde şematik olarak Sx Hy Oz formülü ile temsil edilebilir. Sonra reaksiyon denklemi yazılacak
x+y | |||||||||
0.02 mol su, 0.02 2 = 0.04 mol hidrojen atomu içerir. 0.02 mol kükürt oksit, 0.02 mol hidrojen atomu içerir. Maddedeki hidrojen ve kükürt kütlesini hesaplayın:
m (H) \u003d n (H) M (H) \u003d 0.04 mol 1 g / mol \u003d 0.04 g.
m(S) = n(S) M(S) = 0.02 mol 32 g/mol = 0.64 g
Kükürt ve hidrojenin kütlesi 0.64 + 0.04 = 0.68 g, yani maddenin kütlesine eşittir, yani maddenin kükürt ve hidrojen dışında başka elementler içermediği anlamına gelir. 0.04 mol hidrojen başına 0.02 mol kükürt vardır, yani 2 hidrojen atomu başına 1 kükürt atomu vardır, H2 S maddesinin en basit formülü hidrojen sülfürdür.
Cevap: hidrojen sülfür H2S.
3 görev numarası 2
20 g hidrojen sülfür, 10 g sodyum hidroksit içeren bir çözeltiden geçirildi. Bu durumda hangi tuz oluştu? Kütlesini ve miktarını belirleyin.
İki tuzun oluşumu mümkündür - denklem (1)'e göre sodyum sülfür ve denklem (2)'ye göre sodyum hidrosülfür.
2NaOH + H2S = Na2S + 2H2O | |
NaOH + H3 8 \u003d NaHS + H2 O |
Sodyum hidroksit ve hidrojen sülfürün molar kütlelerini hesaplayın:
M(NaOH) = 23 + 16 + 1 = 40 g/mol
M(H2S) = 1 2 + 32 = 34 g/mol
Sodyum hidroksit ve hidrojen sülfürün madde miktarını hesaplayın:
Denklem (2)'ye göre, 1 mol sodyum hidroksit, 1 mol hidrojen sülfür ile reaksiyona girer, bu, 0,59 mol hidrojen sülfür ile reaksiyon için 0,59 mol sodyum hidroksitin gerekli olduğu ve duruma göre, sadece 0,25 mol olduğu anlamına gelir. alınmış. Sonuç olarak, fazla hidrojen sülfür alınır ve sodyum hidrosülfit oluşur, sodyum hidroksit kullanılarak hesaplama yapılır. 1 mol sodyum hidroksitten denkleme göre 1 mol sodyum hidrosülfit oluşur, bu nedenle 0.25 mol sodyum hidroksitten 0.25 mol sodyum hidrosülfit elde edilir.
hesaplama molar kütle sodyum hidrosülfür:
M(NaHS) = 23 + 1 + 32 = 56 g/mol
Sodyum hidrosülfürün kütlesini hesaplayın:
m(NaHS) = ν (NaHS) M(NaHS) = 0.25 mol 56 g/mol = 14 g.
Cevap: 0.25 mol (14 g) sodyum hidrosülfür elde edilecektir.
3 görev numarası 3
100 g hidratlı alüminyum klorür AlCl3 6H2 O'dan gram olarak ne kadar alüminyum oksit elde edilebilir?






