Molar kütleyi mol olarak alıyoruz. Bir mol, bir maddenin miktar birimidir. Molar kütle. Yeni formüller kullanarak sorunları çözüyoruz
8. sınıf kimya dersi “Madde miktarı. Güve"
Dersin Hedefleri:
- öğrencilere yeni bir fiziksel miktar - bir maddenin miktarı, ölçü birimi ile - bir köstebek hakkında bilgi vermek; madde miktarını ve köstebek kullanmayı öğrenin.
Molar kütle kavramını vermek, madde miktarı kavramının oluşumuna devam etmek, bu değeri kullanabilmek, içeriği zenginleştirmek kimyasal formül.
Görevler:
Ders sırasında "madde miktarı", "Avogadro sayısı" kavramlarını oluşturmak.
"Madde miktarı", "Avogadro sayısı" kavramlarını kullanarak problem çözme becerisini oluşturmak.
Maddelerle çalışma, gözlemleme, analiz etme, sonuç çıkarma, gerekli bilgileri vurgulama konusunda deneysel beceriler geliştirmeye devam edin.
Planlanan sonuç:
Öğrenciler "madde miktarı", "Avogadro sayısı" kavramlarını bilir, bu kavramları kullanarak hesaplama problemlerini çözebilirler.
ders türü: birleşik ICT - etkileşimli öğretim yöntemlerini kullanan bir ders.
Ders planı.
ben sahne. zaman düzenleme
Tebrik, olumlu bir duygusal ruh hali yaratmak.
Öğrencileri sınıf için kontrol etmek.
İyi öğlenler millet!(işaret eksik)
Seni gördüğüm için memnunum. Önümde akıllı, nazik yüzler görüyorum. Bugün nasıl çalışacağımızı anlamak için hangi ruh halinde olduğunuzu bilmek istiyorum. İyi bir ruh halindeysen, bana gülümse. Birbirinize bakın, gülümseyin!
Bugünkü dersin bizi tatmin edeceğinden ve verimli olacağından ve dersin sonunda ruh halinizin daha da kötüleşmeyeceğinden eminim.
II sahne. Doğrulama dahil gerekli bilgi ve becerilerin güncellenmesi ev ödevi(slayt 2)
Periyodik Tabloda aşağıdakilere karşılık gelen elementler nerede basit maddeler metaller?
Periyodik Tabloda metal olmayanlar nerede bulunur?
genel nelerdir fiziksel özellikler metaller?
allotropi nedir?
Allotropi örnekleri verir misiniz?
Cümleleri tamamlayın: (slayt 3)
Bilinen 22 metal olmayan
iyot kristalleri mor renkler
sıvı metal olmayan brom
Karbon formları elmas ve grafit
Havada bir fırtına oluştuktan sonra ozon
Aşağıdaki cümlelerden bir sütuna metallere karşılık gelen sayıları, diğer sütuna metal olmayanlara karşılık gelen sayıları yazın. (slayt 4)
1. Toplam durum: katı.
2. Metalik bir parlaklığa sahip olun.
3. Metalik bir parlaklığa sahip değildir.
5. Elektriksel olarak iletken.
6. Gazlı.
7. Katı halde - kırılgan.
8.Plastik.
9. Isı iletmeyin.
metaller
1,2,4,5,8
metal olmayanlar
1,3, 6,7, 9
(slayt 5) Yeni bir konudan önce durumunuzu değerlendirin.
III sahne. Yeni malzemenin açıklaması. (slayt 6)
Yapıştırıcı döküldü - kelimeler birbirine yapıştı. Kelimeleri tire ile birbirinden ayırın.
şeker|köstebek|su|miktar|bir|madde|
Öğretmen dersin amaç ve hedeflerini iletir.
Dersin konusunu kaydetme (slayt 7)
Öğretmen öğrencilere kimyanın maddelerin ve bunların dönüşümlerinin bilimi olduğunu hatırlatır. Belirli bir miktarda ürün elde etmek için ( kimyasal laboratuvar veya fabrikada) kesin olarak tanımlanmış miktarları ilk maddeler.
Deneyler yapan kimyagerler, bazı reaksiyonların ürünlerinin bileşiminin, reaktanların alındığı oranlara bağlı olduğunu fark ettiler.
(slayt 8)Örneğin, kömür oksijenden fazla yakılırsa, karbondioksit üretilir:
C + O 2 →CO 2
Ve 2 kat daha az alırsanız, karbon monoksit elde edersiniz:
C + 0.5O2 → CO2
İlk durumda, 1 oksijen molekülü 1 karbon atomu ile reaksiyona girdi ve ikinci durumda bir oksijen molekülü iki karbon atomu ile reaksiyona girdi.
Soru ortaya çıkıyor: belirli sayıda atom veya molekül nasıl ölçülür?
Bir maddenin kütlesini (terazi yardımıyla) veya bir gaz veya sıvının hacmini (ölçü aletleri yardımıyla) ölçmek kolaydır. Yani ihtiyacın var fiziksel miktar atomların veya moleküllerin sayısını kütleye veya hacme dönüştürmenize izin verir.
Basit hesaplamalar yapalım: en hafif atomun kütlesi - hidrojen 1,66 10 -24 g'dır, bu kütle bağıl atom kütlesi birimi olarak alınır: Ar(H) = 1. Şimdi 1 g hidrojen atomumuz olduğunu varsayalım. Bu kütlede kaç atom olacak? Hesaplamak için, bir hidrojen parçasının kütlesini 1 hidrojen atomunun kütlesine bölmeniz gerekir: 1 g: 1.66 11 -24 g ≈ 6.02 10 23 atom.
Herhangi bir elementin kütlesi (gram cinsinden), sayısal olarak göreli olana eşittir. atom kütlesi, bu elementin aynı sayıda atomunu içerecektir.
Göreceli moleküler ağırlığına sayısal olarak eşit olan herhangi bir maddenin kütlesi (gram olarak), aynı sayıda molekül içerecektir. Bu sabit bir değerdir, Avogadro sayısı olarak adlandırılır ve N A ile gösterilir.
(slayt 9)
(slayt 10)Çizim hangi çağrışımları çağrıştırıyor? (mol). Bir maddenin miktarını ölçmek için kullanılan birime " köstebek"
6.02 10 23 yapısal birim içeren bir maddenin miktarına ne ad verilir? köstebek .(slayt 11)
Öğretmen, ele alınan örneklere dayanarak, diğer parçacıkların sayısının da mol cinsinden ölçüldüğünü ekler: atomlar, iyonlar, elektronlar, vb.
(slayt 12/1)1 mol herhangi bir madde toplama durumu içerir N A = 6∙10 23 onun molekülleri.
köstebek - birim madde miktarı .
Bir maddenin miktarı, bir maddenin yapısal birimlerinin sayısı ile kütlesini veya hacmini birbirine bağlamak için verilen fiziksel bir miktardır.
(slayt 12/2) Bir maddenin miktarı belirtilir n(tr) veya (nu) (eski), mol cinsinden ölçülür.
n[mol]
(slayt 13)Madde miktarının genel slaytı.
(slayt 14-15) Herhangi bir maddenin 1 mol'ü, sayısal olarak bağıl moleküler kütleye eşit bir kütleye sahiptir, ancak bir g / mol birimine sahiptir.
Bu kitle denir azı dişi , M ile gösterilir.
Bay = M [g/mol]
1 mol maddeyi nasıl görebilirsin?
Bir çorba kaşığı alın, suyla doldurun ve bir behere dökün. Bu yaklaşık 1 mol su olacaktır. Bir bardağa bir kaşık daha su dökün. Şimdi bardakta bu maddeden 2 mol var. Bir kaşık daha ekleyelim. Su miktarı 3 mol'e eşit olacaktır.
(slayt 16)Sınıfa bazı maddeleri 1 mol: 56 g demir tozu miktarını gösterin ( Fe ), 58 gr tuz ( NaCl ), 342 gr şeker ( C 12 H 22 Ö 11 )
(slayt 17-18)Bazı maddelerin molar kütlesinin belirlenmesi
(slayt 19) Madde ve kütle miktarı aşağıdaki ilişki ile ilişkilidir:
m = n M
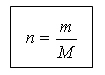
Madde miktarı ve yapısal birim sayısı N aşağıdaki ilişki ile ilişkilidir:
N = N A n
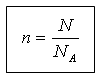
- Peki, üç mol suda bulunan taneciklerin sayısını nasıl hesaplayacağız? (slayt 20)
Alınan maddenin miktarını (bu durumda su) Avogadro sabiti ile çarpmak gerekir:
N(H20) \u003d 3 mol 6 10 23 molekül \u003d 18 10 23
(slayt 22) Derste durumunuzu değerlendirin
IV sahne. Konsolidasyon. Problem çözme.
10 mol azotun kütlesini bulunuz? (slayt 23)
Çözüm:
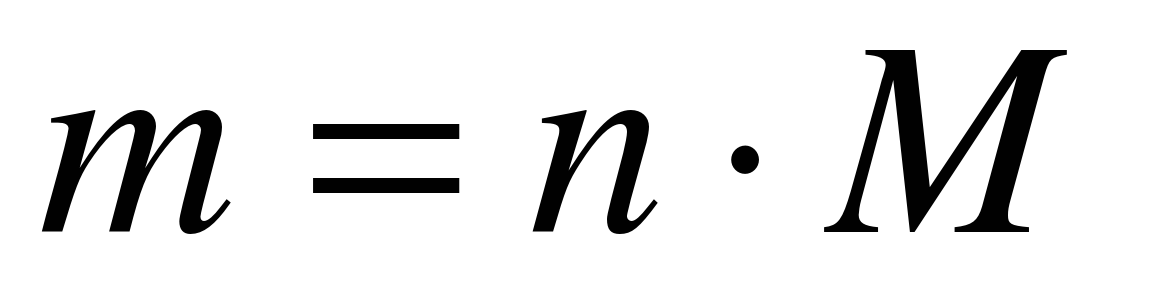
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Cevap: m (N 2) \u003d 280 g
Verilen:
n (N 2) \u003d 10 mol
Bulmak:
m (N 2) - ?
(slayt 24)V sahne.Ev ödevi
§15, ör. 1-3
Soruyu cevaplayın:
Bir parça rafine şekerde, bir parçanın kütlesinin 1.3 g olduğunu bilen kaç şeker molekülü vardır?






