Emisioni spektar Balmerove formule atoma vodika. Proučavanje spektra atoma vodika
Najjednostavniji atom, atom vodika, bio je neka vrsta testnog objekta za Borovu teoriju. Do trenutka kada je teorija stvorena, bila je dobro eksperimentalno proučavana. Bilo je poznato da sadrži samo jedan elektron. Jezgro atoma je proton - pozitivno nabijena čestica čiji je naboj po apsolutnoj vrijednosti jednak naboju elektrona, a masa je 1836 puta veća od mase elektrona. Takođe u početkom XIX veka otkriveni su diskretno spektralne linije u vidljivom području zračenja atoma vodika (tzv linijski spektar ). Nakon toga, obrasci kojima se povinuju talasne dužine (ili frekvencije) linijskog spektra su dobro kvantitativno proučavani (I. Balmer, 1885). Skup spektralnih linija atoma vodika u vidljivom dijelu spektra nazvan je Balmer serija . Kasnije su slične serije spektralnih linija pronađene u ultraljubičastom i infracrvenom dijelu spektra. Johannes Rydberg je 1890. godine izveo empirijsku formulu za frekvencije spektralnih linija:
To može dovesti do stvaranja spoja formiranog od dva atoma aluminija i tri atoma kisika. Kombiniraće se sa dva atoma kiseonika i formirati spoj. Iako je periodni sistem bio veliki uspjeh u to vrijeme, otkriće novih elemenata koji se ne uklapaju u ovu tablicu dovelo je do traženja drugog sistema klasifikacije.
Osim toga, Mendeljejev je poznavao neke rijetke zemne elemente kao što su lantan, iterbijum, erbijum, terbijum, prazeodim i neodimijum, kojima nije bilo mesto u tabeli. Problem je riješen kada je otkriveno da je atomski broj karakteristika elemenata, označavajući periodičnost njegovih svojstava. Danas se elementi poredaju s lijeva na desno i odozgo prema dolje uzlaznim redoslijedom njihove vrijednosti. atomski brojevi, tj. brojem protona u jezgru njihovih atoma.
Za seriju Balmer m = 2, n= 3, 4, 5, ... . Za ultraljubičastu seriju (Lyman serija) m = 1, n= 2, 3, 4, ... . Konstantno R u ovoj formuli se zove Rydbergova konstanta . Njegova numerička vrijednost R= 3,29 10 15 Hz. Prije Bohra, mehanizam pojave linijskih spektra i značenje cijelih brojeva uključenih u formule spektralnih linija vodika (i niza drugih atoma) ostao je neshvatljiv.
U isti red stavljaju se elementi koji imaju isti broj elektronskih slojeva i čija se svojstva progresivno mijenjaju, dok su elementi koji imaju isti broj elektrona u posljednjem sloju i koji stoga imaju slična svojstva smješteni u istu kolonu. Prvi period, kao i drugi i treći, nazivaju se kratkim periodima; četvrti i peti, sa osam elemenata, su dugi, a šesti i sedmi, sa 32 elementa, su veoma dugi. Posljednja dva, pored prelaznih metala, su rijetki zemni elementi.
Borovi postulati odredili su pravac razvoja nove nauke - kvantne fizike atoma. Ali nisu sadržavali recept za određivanje parametara stacionarnih stanja (orbita) i odgovarajućih energetskih vrijednosti En.
Bohr je pogodio pravilo kvantizacije koje vodi do eksperimentalno konzistentnih vrijednosti energija stacionarnih stanja atoma vodika. On je sugerirao da ugaoni moment elektrona koji rotira oko jezgre može poprimiti samo diskretne vrijednosti koje su višekratne Planckove konstante. Za kružne orbite, Borovo pravilo kvantizacije se zapisuje kao
Obrasci u svojstvima elemenata periodnog sistema. Klasifikacija elemenata u rastućem redoslijedu atomskog broja uključuje korištenje još dva kriterija: atomske mase i sličnosti u svojstvima. Ako su ovi elementi poredani od najmanjeg do najvišeg prema njihovom atomska masa, argin bi se trebao pojaviti na poziciji koju kalijum zauzima u modernom periodnom sistemu. Ali argon je plemeniti plin i ne može biti u grupi litijuma i natrijuma, koji su visoko reaktivni metali.
Ako su poredani po atomskom broju, argon je 18, a kalijum 19, tako da je svaki u svojoj grupi. Razlog sličnosti svojstava elemenata leži upravo u broju i raspodjeli elektrona u njihovim atomima. Elementi čiji atomi imaju isti broj elektrona u svom posljednjem sloju ili energetskom nivou imaju slično Hemijska svojstva i stoga su u istoj grupi kao i periodni sistem.
![]()
Evo m e - masa elektrona, υ - njegova brzina, rn je polumjer stacionarne kružne orbite. Borovo pravilo kvantizacije omogućava izračunavanje polumjera stacionarnih orbita elektrona u atomu vodika i određivanje vrijednosti energije. Brzina elektrona koji rotira u kružnoj orbiti nekog radijusa r u Kulonovom polju jezgra, kao što slijedi iz drugog Newtonovog zakona, određena je relacijom
Elektronska distribucija prvih 10 elemenata je sljedeća. Imajte na umu da se elektronski nivoi ili nivoi završavaju kako napredujete dalje određenom periodu. Helijum i neon, koji su poslednji elementi perioda 1 i 2, imaju svoje pune elektronske slojeve.
Sve alkalije imaju jedan elektron u zadnjem nivou. Njegova elektronska konfiguracija. Svi elementi koji su u istoj grupi imaju istu konfiguraciju na zadnjem nivou. Svi imaju slična svojstva. Generalno, atomi koji čine materiju, bilo da su isti ili različiti, su kombinovani, iako u prirodi postoje i supstance formirane od izolovanih atoma, kao što su elementi grupe.

gdje e - elementarnog naboja, ε 0 - električna konstanta. Brzina elektrona υ i polumjer stacionarne orbite rn povezani su Bohrovim pravilom kvantizacije. Iz toga slijedi da su polumjeri stacionarnih kružnih orbita određeni izrazom
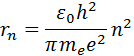
Jedna od karakteristika elemenata grupe 18 je da svi imaju osam elektrona u svom vanjskom sloju, s izuzetkom helijuma koji ima samo dva. Ova struktura je najstabilnija, tako da atomi ovih elemenata obično ne interferiraju hemijske reakcije. Zbog toga dobijaju nadimak plemeniti ili inertni gasovi. Način na koji ostali elementi pokušavaju imati 8 elektrona u svom posljednjem sloju opravdava njihovo kemijsko ponašanje.
Stoga možemo zaključiti da atomi teže da se kombinuju u formu hemijske supstance sa određenim karakteristikama koje su energetski nestabilnije od originalnih atoma. Ova vrsta veze se naziva hemijsko vezivanje. Hemijska veza je privlačna sila koja drži atome u različitim atomskim klasterima.
Orbita najbliža jezgru odgovara vrijednosti n= 1. Radijus prve orbite, koja se zove Bohrov radijus , je jednako

Radijusi narednih orbita se proporcionalno povećavaju n 2 .
Završeno mehanička energija E sistem atomskog jezgra i elektrona koji kruži u stacionarnoj kružnoj orbiti poluprečnika rn, je jednako
Atom helija ima zadnji puni sloj, što mu daje veliku stabilnost. Nasuprot tome, atom vodika, koji ima elektron u svom posljednjem i jedinom sloju, mnogo je manje stabilan. Međutim, ova stabilnost se povećava ako su dva atoma vodika dovoljno blizu jedan drugom da povežu svoje elektronske slojeve dijeleći svoje elektrone. Takva veza je moguća jer je veći dio vanjskog područja atoma prazan prostor. Dijagram pokazuje da se pod ovim uslovima manifestuje niz elektrostatičkih sila: dva jezgra imaju iste električni naboj i odbijaju se, kao dva elektrona; međutim, postoji uzajamno privlačenje između jezgara i elektrona, a četiri čestice su raspoređene na takav način da se privlačne sile tačno suprotstavljaju silama odbijanja.

Treba napomenuti da E str< 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ 2 и rn, dobijamo:

Integer n= 1, 2, 3, ... naziva se u kvantnoj fizici atoma glavni kvantni broj .
Kada se to dogodi, a hemijska veza. Atomi koji postižu svoju stabilnost dijeljenjem elektrona s drugim atomima vezani su kovalentnom vezom. Par atoma vodika je najstabilniji oblik vodika na normalnoj temperaturi.
Molekule koje, poput vodika, sadrže dva atoma nazivaju se dvoatomne molekule. Ako sadrže više od dva atoma, nazivaju se poliatomskim. Dva atoma hlora se dodaju na sličan način. Pojedinačni atom ima sedam elektrona u svom posljednjem sloju. Kada se dva atoma hlora približe jedan drugom i povežu svoje elektronske slojeve, oni imaju par elektrona. Dakle, svaki atom se može smatrati okruženim sa osam elektrona. Dva atoma hlora ostaju vezana kao molekul.
Prema Borovom drugom postulatu, prilikom prelaska elektrona iz jedne stacionarne orbite sa energijom En na drugu stacionarnu orbitu sa energijom Em < En atom emituje kvantum svjetlosti, frekvencije ν nmšto je jednako Δ Enm / h:
![]()
Ova formula se tačno poklapa sa Rydbergovom empirijskom formulom za spektralni niz atoma vodika, ako postavimo konstantu R jednaka
Postoji mnogo drugih gasova hemijski elementi, koji se pri normalnoj temperaturi javljaju u obliku biatomskih molekula, kao što su kisik, dušik, fluor. Predstavljanje kovalentne veze. Kovalentna veza je sila privlačenja koju dva jezgra vrše na parove elektrona između njih: par u jednostrukoj vezi, dva para u dvostrukoj vezi i tri para u trostrukoj vezi. Kovalentna veza se može predstaviti na nekoliko načina; na primjer, veza između dva atoma u molekulu fluorida može se odrediti na dva načina.
Zamjena numeričkih vrijednosti m e , e, ε 0 i h u ovu formulu daje rezultat
što se veoma dobro slaže sa empirijskom vrednošću R. Rice. 6.3.1 ilustruje formiranje spektralnih serija u zračenju atoma vodonika tokom prelaska elektrona sa visokih stacionarnih orbita na niže.
Na sl. 6.3.2. prikazan je dijagram energetskih nivoa atoma vodika i prikazani su prelazi koji odgovaraju različitim spektralnim serijama.
Osobine kovalentnih elemenata. Njegove tačke topljenja i ključanja su niske. Pošto nema slobodnih elektrona, ali se nalaze, ovi elementi ne provode struja. U kovalentnim kristalima, atomi se drže zajedno samo kovalentnim vezama koje formiraju trodimenzionalnu mrežu.
Dijamant sadrži samo atome ugljika i stoga je jedan od oblika u kojem je ovaj element prisutan. Atom ugljika ima posljednja četiri elektrona u posljednjem sloju, a još četiri nedostaju da bi imali strukturu plemenitog plina i mogu se dobiti dijeljenjem svakog od ovih elektrona s četiri druga atoma ugljika.
Odlično slaganje Borove teorije atoma vodika i eksperimenta poslužilo je kao značajan argument u prilog njene valjanosti. Međutim, pokušaji primjene ove teorije na složenije atome nisu bili uspješni. Bohr nije mogao dati fizičku interpretaciju pravila kvantizacije. To je deceniju kasnije uradio de Broglie na osnovu ideja o valna svojstva ah čestice. De Broglie je predložio da svaka orbita u atomu vodika odgovara talasu koji se širi u krug oko jezgra atoma. Stacionarna orbita nastaje kada se talas neprekidno ponavlja nakon svake revolucije oko jezgra. Drugim riječima, stacionarna orbita odgovara kružnom stojećem de Broljevom talasu po dužini orbite (slika 6.3.3). Ovaj fenomen je vrlo sličan stacionarnoj slici stajaćih talasa u nizu sa fiksnim krajevima.
Tako dobija stabilnu elektronska struktura, slično strukturi neona, sa četiri para elektrona u zadnjem sloju. Supstanca jod formirana je od molekula joda povezanih međumolekularnih sila koje formiraju kristalnu ili trodimenzionalnu mrežu. Pošto su ove privlačne sile između molekula slabe, ovi kristali se mogu lako uništiti.
U dijagramu strukture ugljenika, primećuje se da samo centralni element ima poslednji sloj. Ovo omogućava svakom od ostala četiri atoma da formira, zauzvrat, kovalentne veze sa četiri druga atoma i tako popuni njihove elektronske slojeve. Kako svaki atom to radi, stvara se ogromna mreža.
U stacionarnom stanju kvantno stanje atoma vodika, prema de Broglieovoj zamisli, cijeli broj valnih dužina λ, tj.
Zamjenjujući u ovu relaciju de Broglieovu talasnu dužinu λ = h / str, gdje str = m e υ - impuls elektrona, dobijamo:
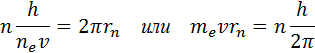
U dijamantu, atomi ugljika su u obliku trodimenzionalne mreže koja je izuzetno stabilna u svim smjerovima. Dijamant je jedan od najvećih čvrste materije, koji je poznat i ostaje u čvrstom stanju na vrlo visoke temperature. Svojstva kovalentnih atomskih kristala.
Sva svojstva ovih čvrsti kristali pokazuju da su vrlo jake sile uspostavljene između čestica koje ih formiraju. Teorema nam govori da su ove sile posljedica kovalentnih veza između njihovih atoma. Dijamant je veoma tvrd, njegove tačke topljenja i ključanja su veoma visoke. kovalentne veze između atoma ugljika koji formiraju mrežu su toliko jaki da je potrebna značajna količina energije za uništavanje strukture. Budući da nema slobodnih elektrona, ne provodi električnu energiju.
Dakle, Borovo pravilo kvantizacije povezano je sa valnim svojstvima elektrona.
Uspjeh Borove teorije u objašnjavanju spektralnih obrazaca u proučavanju atoma vodika bio je nevjerovatan. Postalo je jasno da su atomi kvantni sistemi, i nivoi energije stacionarna stanja atoma su diskretna. Gotovo istovremeno sa stvaranjem Borove teorije dobijeni su direktni eksperimentalni dokazi za postojanje stacionarnih stanja atoma i za kvantizaciju energije. Diskretnost energetskih stanja atoma dokazana je 1913. godine, u eksperimentu D. Franka i G. Hertza, u kojem je proučavan sudar elektrona sa atomima žive. Ispostavilo se da ako je energija elektrona manja od 4,9 eV, onda se njihov sudar s atomima žive događa prema zakonu apsolutno elastičnog udara. Ako je energija elektrona 4,9 eV, tada sudar s atomima žive poprima karakter neelastičnog udara, odnosno, kao rezultat sudara s nepokretnim atomima žive, elektroni potpuno gube svoju kinetičku energiju. To znači da atomi žive apsorbuju energiju elektrona i prelaze iz osnovnog stanja u prvo pobuđeno stanje,
Pri aproksimaciji dva atoma mogu se pojaviti sljedeći slučajevi. Postoje odbojne sile između elektrona i jezgara koje se povećavaju kako se približavaju, a veza se nikada ne formira, kao što je pokušaj približavanja dva atoma helija. Sile privlačenja nastaju između jezgra jednog atoma i elektrona drugog, i obrnuto. U ovom slučaju, energija sistema se smanjuje za određenu udaljenost; tada se formira veza između dva atoma.
U procesu stvaranja veze energija se uvijek oslobađa. Stoga, da bi se razdvojili atomi koji tvore element ili jedinjenje, potrebno je osigurati energiju jednaku ili veću od energije koja se oslobađa prilikom formiranja veze. Grafit je još jedan oblik ugljika koji se nalazi u prirodi. U ovom slučaju, atomi ugljika su raspoređeni u šesteročlane prstenove. Svaki atom ugljika je kovalentno vezan za tri druga atoma. Dakle, elektroni ostavljaju slobodu kretanja, pa grafit provodi elektricitet.
|
E 2 - E 1 = 4,9 eV. |
Prema Borovom konceptu, tokom obrnute spontane tranzicije atoma, živa bi trebala emitovati kvante sa frekvencijom
![]()
Spektralna linija s takvom frekvencijom zapravo je detektirana u ultraljubičastom dijelu emisionog spektra atoma žive.
To je supstanca crne boje, sjajna, mekana i bezbojna na dodir, jer je predstavljena u listićima malo pričvršćenim jedno za drugo i koje klize jedna preko druge. Koristi se za izradu elektroda zbog njihovog svojstva da provode električnu energiju, te za izradu osovina za olovke i traka za štampač za računare.
Metali imaju svojstva vrlo različita od drugih supstanci koja poboljšavaju postojanje određene vrste veze i karakteristike koje ih čine mogućim. Metalni elementi obično imaju atome koji sadrže 1, 2 ili 3 elektrona u svom vanjskom sloju. Ovi elektroni su slabo vezani za atomsko jezgro tako da se mogu lako reciklirati.
Koncept diskretnih stanja je u suprotnosti sa klasičnom fizikom. Stoga se postavlja pitanje da li kvantna teorija pobija svoje zakone.
Kvantna fizika nije poništila osnovne klasične zakone održanja energije, količine gibanja, električnog pražnjenja, itd. Prema N. Bohru princip usaglašenosti , kvantna fizika uključuje zakone klasične fizike, a pod određenim uvjetima moguće je otkriti glatki prijelaz sa kvantnih na klasične koncepte. To se može vidjeti na primjeru energetskog spektra atoma vodika (slika 6.3.2). Za velike kvantne brojeve n>> 1 diskretni nivoi se postepeno približavaju jedan drugom i dolazi do glatke tranzicije u oblast kontinuiranog spektra, što sledi iz klasične fizike.
Zamislite skup atoma metalnog elementa koji su razdvojeni i što bliže jedan drugom. Pod ovim uslovima, spoljni elektronski slojevi atoma se potpuno preklapaju, i bilo koji elektron koji prvobitno emanira iz datog elektronskog sloja sada nije povezan ni sa jednim određenim atomom, već ga dele svi atomi u skupu. Ovi atomi su povezani metalnom vezom.
Metalni kristal formiraju pozitivno nabijeni stacionarni atomi uronjeni u more elektrona koji se delokaliziraju i stoga ne pripadaju nijednom određenom atomu. Pošto su veoma kompaktni, metali su prilično tvrdi, ali se mogu rastegnuti i formirati žice, jer se jedan sloj atoma može pomerati preko drugog.
Polovična, poluklasična Borova teorija bila je važna faza u razvoju kvantnih koncepata, čije je uvođenje u fiziku zahtijevalo radikalno restrukturiranje mehanike i elektrodinamike. Takvo restrukturiranje je izvršeno 20-ih - 30-ih godina XX vijeka.
Borova ideja o određenim orbitama duž kojih se kreću elektroni u atomu pokazala se vrlo uslovnom. U stvari, kretanje elektrona u atomu vrlo malo liči na kretanje planeta ili satelita. Fizičko značenje je samo vjerovatnoća pronalaska elektrona na jednom ili drugom mjestu, opisana kvadratom modula valne funkcije |Ψ| 2. Talasna funkcija Ψ je rješenje glavne jednadžbe kvantna mehanika - Schrödingerove jednadžbe . Pokazalo se da stanje elektrona u atomu karakteriše čitav niz kvantnih brojeva. Glavni kvantni broj n određuje kvantizaciju energije atoma. Za kvantizaciju ugaonog momenta, tzv orbitalni kvantni broj l . Projekcija ugaonog momenta na bilo koji smjer koji se razlikuje u prostoru (na primjer, smjer vektora magnetsko polje) također uzima diskretni niz vrijednosti. Da bismo kvantizirali projekciju ugaonog momenta, uvodimo magnetski kvantni broj m . kvantni brojevi n, l, m vezani određenim pravilima kvantizacije. Na primjer, orbitalni kvantni broj l može uzeti cjelobrojne vrijednosti od 0 do ( n- jedan). Magnetski kvantni broj m može uzeti bilo koje cjelobrojne vrijednosti u intervalu ± l. Dakle, svaka vrijednost glavnog kvantnog broja n, koji određuje energetsko stanje atoma, odgovara nizu kombinacija kvantnih brojeva l i m. Svaka takva kombinacija odgovara određenoj distribuciji vjerovatnoće |Ψ| 2 detekcija elektrona u različitim tačkama u svemiru ("elektronski oblak").
Stanja u kojima je orbitalni kvantni broj l= 0 opisuju se sferno simetričnim distribucijama vjerovatnoće. Zovu se s-država (1 s, 2s, ..., ns, ...). Za vrijednosti l> 0 sferna simetrija elektronskog oblaka je narušena. Države od tada l= 1 se pozivaju str- navodi, sa l = 2 - d- države itd.
Na sl. 6.3.4 prikazuje krivulje distribucije vjerovatnoće ρ ( r) = 4π r 2 |Ψ| 2 detekcija elektrona u atomu vodika na različitim udaljenostima od jezgra u stanjima 1 s i 2 s.
Kao što se može vidjeti sa sl. 6.3.4, elektron u stanju 1 s(osnovno stanje atoma vodika) može se detektovati na različitim udaljenostima od jezgra. OD najvjerovatnije može se detektovati na udaljenosti jednakoj radijusu r 1 prve Borove orbite. Vjerovatnoća pronalaženja elektrona u stanju 2 s maksimalna udaljenost r = 4r 1 iz srži. U oba slučaja, atom vodika se može predstaviti kao sferno simetričan elektronski oblak, u čijem se središtu nalazi jezgro.
Spektralni niz atoma vodika.
Studije emisionih spektra razrijeđenih plinova (tj. emisionih spektra pojedinačnih atoma) su pokazale da svaki plin ima određenu vladao spektar koji se sastoji od pojedinačnih spektralnih linija ili grupa blisko raspoređenih linija. Ovo je posebno izraženo u spektru najjednostavnijeg atoma vodika.
Švicarski naučnik I. Balmer odabrao je empirijsku formulu koja opisuje sve spektralne linije atoma vodika poznate u to vrijeme u vidljivo područje spektra:
gdje n=3;4;5;6.
Uz Balmerovu seriju, u spektru atomskog vodika pronađene su i druge serije, čiji se talasni brojevi mogu predstaviti sličnim formulama.
AT ultraljubičasto Područja Lyman serije:
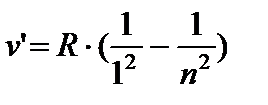 n = 2;3… (8.4)
n = 2;3… (8.4)
AT infracrveni područja:
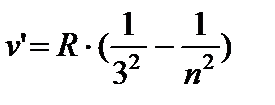 - Pašenov red, n =4;5…
- Pašenov red, n =4;5…
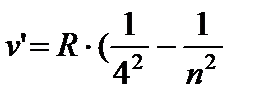 ) - Niz zagrada, n = 5;6… (8.5)
) - Niz zagrada, n = 5;6… (8.5)
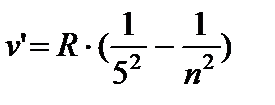 - Pfund serija, n = 6;7…
- Pfund serija, n = 6;7…
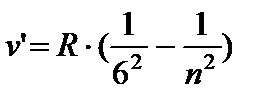 - Humphreyjev niz, n = 7;8…
- Humphreyjev niz, n = 7;8…
Analizirajući relacije (8.3) - (8.5), možemo reći da se sve serije atomskog vodonika mogu predstaviti opšta formula pozvao po generalizovanoj Balmerovoj formuli:
 (8.6)
(8.6)
gdje m ima konstantnu vrijednost u svakoj datoj seriji, m=1;2;3;4;5;6 (definiše niz); a n=m+1, m+2,… (definiše pojedinačne linije ove serije).
Energija stacionarnog stanja atoma:  (8.9)
(8.9)
Znak "-" ima uslovna vrijednost, čisto fizičko značenje– energija elektrona u polju pozitivnog jezgra je negativna. Iz (8.9) se može vidjeti da energija stacionarnih stanja formira diskretni niz za n=1;2;3…
Postulati koje je iznio Bohr omogućili su izračunavanje spektra atoma vodika i sistema sličnih vodiku (sistema koji se sastoje od jezgra s nabojem Ze i jedan elektron (na primjer, joni Ne + , Li +), i teoretski izračunati Rydbergovu konstantu.
Prateći Bora, razmotrimo kretanje elektrona u sistemu nalik vodiku, ograničavajući se na kružne stacionarne orbite. Potencijalna energija interakcije elektrona sa jezgrom:
 (9.1),
(9.1),
r je poluprečnik orbite. Kinetička energija elektron koji se kreće oko jezgra: 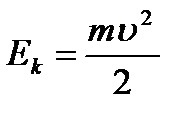 (9.2).
(9.2).
Onda ukupna energija atom:
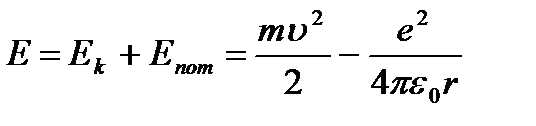 (9.3).
(9.3).
Elektron oko jezgra se kreće ubrzano 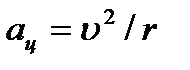 pod uticajem Kulonove sile:
pod uticajem Kulonove sile:  .
.
Prema drugom Newtonovom zakonu ( ma = F k) može se napisati:
 (9.4);
(9.4);
odavde 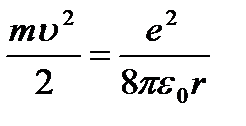 (9.5).
(9.5).
Stavljamo (9.5) u (9.3): 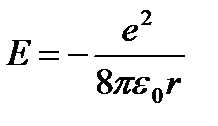 (9.6).
(9.6).
Bohr je predložio pravilo selekcije ili pravilo kvantizacije (Bohrov treći postulat): od svih mogućih orbita elektrona, ostvarene su samo one za koje je ugaoni moment elektrona višestruki od Planckove konstante:
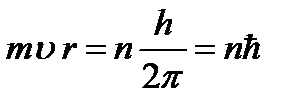 (9.7),
(9.7),
gdje n=1,2,3,… je glavni kvantni broj. Koristeći relacije (9.4) i (9.7), određujemo polumjer stacionarne elektronske orbite:

 (9.8),
(9.8),
at (radijus prve orbite).
Iz (9.8) slijedi 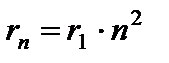 . Zamjenom (9.8) u (9.10) dobijamo izraz za energije stacionarnog stanja:
. Zamjenom (9.8) u (9.10) dobijamo izraz za energije stacionarnog stanja:
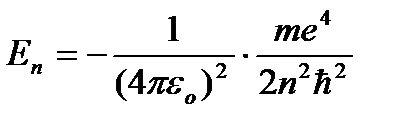 =
= 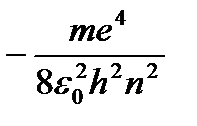 (9.9)
(9.9)
u - energija prvog stacionarnog stanja.
U stanju energije E 1 atom može ostati neograničeno. Da bi se ionizirao atom vodonika, tj. da bi se od njega otkinuo elektron, treba mu dati energiju od 13,55 eV.
 eV;
eV;  ;
;
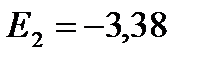 eV;
eV; 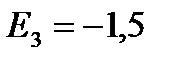 eV;
eV; ![]() eV itd.
eV itd.
Stanje , ,… odgovara pobuđenom atomu. Životni vijek u ovim stanjima je reda  . Za to vrijeme, elektron uspijeva napraviti oko 100 miliona okretaja oko jezgra.
. Za to vrijeme, elektron uspijeva napraviti oko 100 miliona okretaja oko jezgra.
Davanje n različite cjelobrojne vrijednosti, dobijamo za atom vodonika, prema formuli (9.9), moguće nivoe energije. Energija atoma vodika sa povećanjem P raste i nivoi energije se približavaju granici koja odgovara vrijednosti n=¥. Tako atom vodika ima minimalnu energiju (E 1 = -13,55 eV) na n=1 i maksimum (E ¥ =0) pri P=¥ . Dakle, vrijednost E ¥ = 0 odgovara jonizaciji atoma (odvajanju elektrona od njega). Prema Borovom drugom postulatu, prilikom prijelaza atoma vodika iz stacionarnog stanja n u stabilno stanje t kvant se emituje sa manje energije:

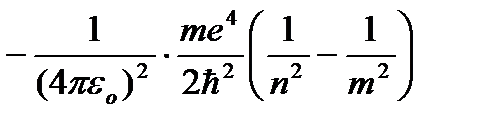 ,
,
odakle frekvencija zračenja:
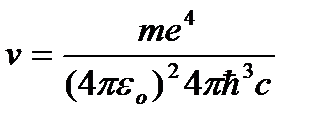
 =R
=R  , (9.10)
, (9.10)
gdje  .
.
Korištenje u proračunu R moderne vrednosti univerzalne konstante, dobivamo vrijednost koja se poklapa s eksperimentalnom vrijednošću Rydbergove konstante u empirijskim formulama za atom vodika: ![]() .
.
Ova koincidencija dokazuje ispravnost formule koju je dobio Bohr za nivoe energije sistema sličnog vodoniku.
Zamjena, na primjer, u formulu (9.10) m=1 i n=2, 3, 4, ..., dobijamo grupu linija koje formiraju Lymanovu seriju i odgovaraju prijelazima elektrona sa pobuđenih nivoa (n= 2, 3, 4, ...) na glavnom (t= 1). Slično, prilikom zamjene t= 2, 3, 4, 5, 10 i njihove odgovarajuće vrijednosti n dobijamo Balmer, Paschen, Bracket, Pfund i Humphrey niz (neki od njih su šematski prikazani na slici 9.1.). Shodno tome, prema Bohrovoj teoriji, koja je kvantitativno objasnila spektar atoma vodika, spektralni niz odgovara zračenju koje je rezultat prijelaza atoma u dato stanje iz pobuđenih stanja koja se nalaze iznad ovog.
 Borova teorija je pokazala neprimjenjivost klasične fizike na unutaratomske fenomene i potrebu primjene kvantnih zakona u mikrokosmosu. Ali pokušaj da se napravi slična teorija za atom helija nije uspio. Borova teorija nije bila ni dosledno klasična ni dosledno kvantna teorija. Nedostaci Borove teorije mogli bi se otkloniti stvaranjem nove kvantna teorija, u kojem se ponašanje i kretanje mikročestica pokorava vlastitim zakonima. To je učinjeno u stvaranju kvantne mehanike.
Borova teorija je pokazala neprimjenjivost klasične fizike na unutaratomske fenomene i potrebu primjene kvantnih zakona u mikrokosmosu. Ali pokušaj da se napravi slična teorija za atom helija nije uspio. Borova teorija nije bila ni dosledno klasična ni dosledno kvantna teorija. Nedostaci Borove teorije mogli bi se otkloniti stvaranjem nove kvantna teorija, u kojem se ponašanje i kretanje mikročestica pokorava vlastitim zakonima. To je učinjeno u stvaranju kvantne mehanike.
Stanje elektrona u atomu karakterizira ne jedno, već nekoliko kvantni brojevi.
Prvo njihovi kvantni brojevi - glavni kvantni broj: n=
jedan; 2;3,... Određuje energetske nivoe elektrona u atomu:  i radijusi stacionarnih orbita
i radijusi stacionarnih orbita  . Ovi izrazi slijede iz rješenja Schrödingerove jednadžbe i podudaraju se s odgovarajućim formulama koje je dobio Bohr.
. Ovi izrazi slijede iz rješenja Schrödingerove jednadžbe i podudaraju se s odgovarajućim formulama koje je dobio Bohr.
Sekunda kvantni broj - orbitalni kvantni broj, koji na datoj n može uzeti vrijednosti 0, 1, 2, ..., n-jedan. Ovaj broj određuje orbitalni ugaoni moment  elektrona u odnosu na jezgro. Ugaoni impuls elektrona u atomu kvantizira se formulom:
elektrona u odnosu na jezgro. Ugaoni impuls elektrona u atomu kvantizira se formulom: 
Treće kvantni broj - magnetni kvantni broj, koji, kada je dat, uzima vrijednosti 0; ±1; ±2,…, ± ; ukupno 2+1 vrijednosti. Ovaj broj određuje projekcije orbitalnog ugaonog momenta elektrona na neki proizvoljno odabrani pravac Z. Moguće su samo takve orijentacije vektora ugaonog momenta za koje je projekcija vektora na smjer vanjskog magnetskog polja (os OZ) uzima vrijednosti: 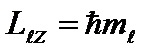
Četvrto kvantni broj - spin(magnetski spin) kvantni broj gospođa
. Može uzeti samo dvije vrijednosti 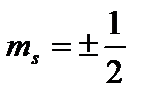 i karakterizira moguće vrijednosti projekcije na Z os spina (unutarnji mehanički ugaoni moment) elektrona:
i karakterizira moguće vrijednosti projekcije na Z os spina (unutarnji mehanički ugaoni moment) elektrona: 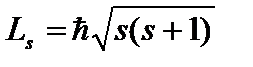 , gdje
, gdje ![]() je spin kvantni broj. Prostorna spinska kvantizacija znači da se projekcija vektora spina na smjer vanjskog magnetskog polja nalazi po formuli:
je spin kvantni broj. Prostorna spinska kvantizacija znači da se projekcija vektora spina na smjer vanjskog magnetskog polja nalazi po formuli:  .
.
Godine 1924. švicarski fizičar Pauli formulirao je princip da: ni u jednom atomu ne mogu postojati dva elektrona koji su u dva identična stacionarna stanja, određena skupom od četiri kvantna broja - glavnim n; orbitalni; magnetni m i spin m s. Paulijev princip, osim elektrona, poštuje i druge čestice koje imaju polucijeli spin (u jedinicama).
Odredimo broj elektrona sa određenim .
Pozivaju se elektroni sa =0 s 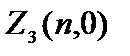 = 2(2×0+1)=2.
= 2(2×0+1)=2.
Pozivaju se elektroni sa =1 R-elektrona, njihov maksimalni broj je 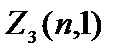 =2(2×1+1)=6.
=2(2×1+1)=6.
Zovu se elektroni sa =2 d-elektrona, njihov maksimalni broj je  =2(2 2+1)=10.
=2(2 2+1)=10.
Zovu se elektroni sa =3 f-elektrona, njihov maksimalni broj je  2(2×3+1)=14 itd.
2(2×3+1)=14 itd.
Maksimalni broj elektrona u stanjima određenim vrijednošću n glavni kvantni broj
= 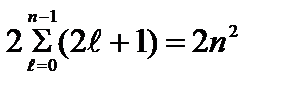
Elektroni koji zauzimaju skup stanja sa istom vrednošću glavnog kvantnog broja n formiraju elektronsku ljusku. Postoje sljedeće elektronske ljuske (ili slojeva): K-sloj na n = 1; L-sloj na n = 2; M-sloj na n = 3; N-sloj na n=4 itd. U svakoj kvantnoj ljusci atoma, elektroni su raspoređeni među podljuske koje odgovaraju određenoj vrijednosti orbitalnog kvantnog broja; zavisno od elektrona je u podgrupi sa simbolima s, p, d, f itd.
| Glavni kvantni broj | Elektronska školjka (sloj) | Broj elektrona u stanjima | Maksimalni broj elektrona | |||
| s ( =0) | str ( =1) | d ( =2) | f ( =3) | |||
| K | – | – | – | |||
| L | – | – | ||||
| M | – | |||||
| N |
U stanju određenom glavnim kvantnim brojem n= 1, mogu postojati samo dva s-elektrona sa dve različite orijentacije spina (vidi sliku 10.1).
Ako a n= 2, tada kolo ima oblik prikazan na sl. 10.2.
Redoslijed popunjavanja elektronskih stanja u atomima kemijskih elemenata objašnjava se Paulijevim principom.
Ovaj princip objašnjava periodičnost svojstava hemijskih elemenata u periodičnom sistemu koji je stvorio D. I. Mendeljejev.
Pratimo konstrukciju periodnog sistema (ili punjenje slojeva atoma elektronima), koji se povinuje dvama principima: a) punjenje počinje od najniže energije (najstabilnije stanje); b) Paulijev princip isključenja.
Prvi element u periodnom sistemu je atom vodonika H, za njega je Z = 1. Ima jedan elektron, kvantni brojevi za koji su: n = 1, = 0, m e = 0, m s = +1/2 ili -1/2, tj. elektronska konfiguracija atoma vodonika: 1S1.
Sledeći element je helijum Ne postoje dva elektrona, kvantni brojevi: n = 1, = 0, m e = 0, m s = ±1/2, tj. elektronska konfiguracija atoma helija: 1S 2. Sloj K sa brojem elektrona N = 2 je potpuno ispunjen.
Treći element je litijum Li. Njegov treći elektron ima kvantne brojeve: n \u003d 2, \u003d 0, m e \u003d 0, m s \u003d +1/2 ili - 1/2, tj. elektronska konfiguracija atoma 1S22S1.
berilijum Ve: Z = 4 elektronska konfiguracija atoma 1S 2 2S 2 .
Sljedećih šest elemenata imaju školjke ispunjene 2p. Kao rezultat, neon Ne sa Z = 10 ima elektronsku konfiguraciju atoma 1S 2 2S 2 2P 6, tj. L- sloj je potpuno popunjen i time se završava drugi sloj periodnog sistema. He, Ne, kao i drugi atomi u kojima su s- ili s- i p-podgrupe potpuno zauzete elektronima, slični su po svojstvima i hemijski inertni.
| Z | simbol elementa | Ime elementa | Elektronska konfiguracija |
| H | vodonik | 1s 1 | |
| Ne | helijum | 1s2 | |
| Li | litijum | 1s1 2s1 | |
| Budi | berilijum | 1s2 2s2 | |
| B | bor | 1s 2 2s 2 2p 1 | |
| C | ugljenik | 1s 2 2s 2 2p 2 | |
| N | nitrogen | 1s 2 2s 2 2p 3 | |
| O | kiseonik | 1s 2 2s 2 2p 4 | |
| F | fluor | 1s 2 2s 2 2p 5 | |
| Ne | neon | 1s 2 2s 2 2p 6 | |
| N / A | natrijum | 1s 2 2s 2 2p 6 3s 1 | |
| mg | magnezijum | 1s 2 2s 2 2p 6 3s 2 | |
| Al | aluminijum | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| Si | silicijum | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| R | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| S | sumpor | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| Cl | hlor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 |
Poremećaji tokom punjenja slojeva se uočavaju u elementu sa Z=19 (kalijum K), gde punjenje ljuske 4s počinje sa nepopunjenim 3d:
i tako sve dok se 3d školjka ne popuni.
Ovo kršenje je povezano sa interakcijom između elektrona, čije stanje karakterišu glavni kvantni brojevi n=3, n=4, itd. Kao rezultat interakcije, nastaje takva situacija da stanje sa velikim n, ali mali može biti energetski povoljniji.
Slična situacija je uočena u elementima rijetkih zemalja, ili lantanidima (atomi s brojevima 58-71), u kojima su školjke 5s, 5p, 6s ispunjene nepopunjenim 4 fškoljka. Svi imaju vanjski omotač 6s 2 . Drugo odstupanje se odnosi na aktinide (atome sa brojevima 90-103), u kojima 5 fškoljka nakon punjenja vanjske ljuske 7s 2 .
Tema 29. Optički kvantni generatori
Zbog pravila selekcije, atomi mnogih elemenata imaju nivoe energije sa kojih se elektron ne može direktno pomaknuti na niži nivo. Ovi nivoi se nazivaju metastabilan države. Elektron može ići na takav nivo kada se sudara sa drugim elektronom ili kada se kreće sa višeg visoki nivo. Trajanje boravka elektrona u metastabilnom stanju je reda 10–3 s, dok je u pobuđenom stanju 10–8 s.
Zračenje koje se emituje tokom spontanog prelaska atoma iz pobuđenog u osnovno stanje naziva se spontana emisija. Spontana emisija raznih atoma ne javlja koherentno, jer svaki atom pokreće i završava zračenje nezavisno od ostalih (slika 15.1a).
Emisija energije od strane atoma, u kojoj prelazi iz metastabilno stanje u glavnom se zove elektromagnetnog zračenja odgovarajuća frekvencija se zove prisilno ili izazvano, zračenje (slika 15.1b).
Vjerovatnoća stimulirane emisije naglo raste kada se frekvencija poklopi elektromagnetno polje sa prirodnom frekvencijom zračenja pobuđenog atoma. Stimulirano zračenje ima istu frekvenciju, fazu, polarizaciju i pravac širenja kao i stimulativno zračenje. shodno tome, stimulisana emisija striktno koherentan sa stimulirajućim zračenjem, to jest, emitovani foton se ne razlikuje od fotona koji upada na atom. Emitirani fotoni, krećući se u jednom smjeru i susrećući druge pobuđene atome, stimuliraju dalje inducirane prijelaze, a broj fotona raste poput lavine.
Međutim, uz stimulisanu emisiju, moguć je i konkurentski proces, apsorpcija. U sistemu atoma koji je u termodinamičkoj ravnoteži, apsorpcija upadnog zračenja će prevladati nad prisilnom, tj. Upadno zračenje će biti oslabljeno dok prolazi kroz materiju.
Da bi medij pojačao zračenje koje na njega upada, potrebno je stvoriti neravnotežno stanje sistema, pri čemu bi broj atoma u pobuđenim stanjima bio veći od njihovog broja u osnovnom stanju. Takva stanja se nazivaju državama. sa inverznom populacijom. Proces stvaranja neravnotežnog stanja materije (prenošenje sistema u stanje sa inverzijom populacije) naziva se pumped. Pumpanje se može vršiti optičkim, električnim i drugim metodama. Mediji sa inverznim stanjima nazivaju se aktivnim. Mogu se smatrati medijima sa negativnim koeficijentom apsorpcije, jer upadni snop svjetlosti će biti pojačan dok prolazi kroz ove medije.
Po prvi put mogućnost dobijanja medija u kojima se svetlost može pojačati usled stimulisane emisije ukazao je 1939. godine ruski fizičar V. A. Fabrikant. Eksperimentalno je otkrio stimuliranu emisiju živine pare pobuđenu električnim pražnjenjem. Otkriće fenomena pojačanja elektromagnetnih talasa i izumljena metoda njihovog pojačavanja (V.A. Fabrikant, M.M. Vudynsky, F.A. Butaeva; 1951.) činili su osnovu kvantne elektronike, čije su odredbe kasnije omogućile implementaciju kvantnih i kvantnih pojačala. generatori svetlosti.
Praktično inverzno stanje medija se ostvaruje u optičkim kvantnim generatorima, odnosno laserima (od prvih slova engleskog naziva Light Amplification by Stimulated Emission of Radiation - pojačanje svjetlosti stimuliranom emisijom). Laseri stvaraju u vidljivom, infracrvenom i bliskom ultraljubičastom području (u optičkom opsegu). Ideja o kvalitativno novom principu pojačanja i generisanja elektromagnetnih talasa, primenjenom u maserima (generatorima i pojačavačima koji rade u centimetarskom opsegu radio talasa) i laserima, pripada ruskim naučnicima N.G. Basovu i A.M. Prohorovu i američkom fizičaru. C. Gradovi, koji su nagrađeni nobelova nagrada 1964
Najvažnije od postojeće vrste laseri su čvrsti, plinoviti, poluvodički i tekući (osnova takve podjele je vrsta aktivnog medija). Preciznija klasifikacija takođe uzima u obzir metode pumpanja - optičke, termičke, hemijske, elektrojonizacijske, itd. Osim toga, potrebno je uzeti u obzir i način proizvodnje - kontinuirani ili impulsni.
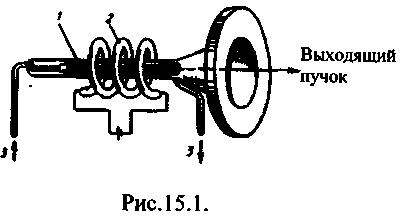 Laser nužno ima tri glavne komponente: 1) aktivno okruženje, u kojima se stvaraju države sa populacijskom inverzijom; 2) pumpni sistem(uređaj za stvaranje inverzija u aktivnom mediju); 3) optički rezonator(uređaj koji odvaja selektivni smjer snopa fotona u prostor i formira izlazni svjetlosni snop).
Laser nužno ima tri glavne komponente: 1) aktivno okruženje, u kojima se stvaraju države sa populacijskom inverzijom; 2) pumpni sistem(uređaj za stvaranje inverzija u aktivnom mediju); 3) optički rezonator(uređaj koji odvaja selektivni smjer snopa fotona u prostor i formira izlazni svjetlosni snop).
Prvi laser u čvrstom stanju koji radi u vidljivom području spektra (valna dužina zračenja 0,6943 μm) bio je rubin laser stvoren 1960. godine (T. Maiman, SAD). Slika 16.1 prikazuje šemu rubin lasera. U njemu se inverzna populacija nivoa provodi prema trostepenoj shemi koju su 1955. predložili N. G. Basov i A. M. Prokhorov. Kristal rubina je aluminij oksid Al 2 Oz, u čijoj kristalnoj rešetki su neki od atoma Al zamijenjeni trovalentnim Cr e + ionima (0,03 odnosno 0,05% hromovih iona, ružičastog i crvenog rubina). Za optičko pumpanje koristi se pulsirajuća lampa s plinskim pražnjenjem (2), spiralno uvijena oko rubinske šipke (1). Kada je rubin intenzivno ozračen svjetlošću moćne bljeskalice, atomi hroma prelaze sa nižeg nivoa na nivoe širokog pojasa 3 (Sl. 16.2). Budući da je životni vijek atoma hroma u pobuđenim stanjima kratak (manje od 10 -7 s), dolazi do spontanih 3®1 prijelaza (oni su beznačajni) ili do najvjerovatnijih neradijativnih prijelaza na nivo 2 (naziva se metastabilnim) s prijenosom viška energije na kristalnu rešetku rubina. Prelazak 2®1 je zabranjen pravilima selekcije, dakle trajanje pobuđenog stanja 2 atomi hroma reda 10 -3 s, tj. oko četiri reda veličine veća nego za državu 3. To dovodi do "akumulacije" atoma hroma na nivou 2 . Uz dovoljnu snagu pumpe, njihova koncentracija na nivou 2 će biti mnogo veća nego na nivou 1 , tj., medij nastaje sa inverznom populacijom nivoa 2.
Rubinska laserska šipka je bila cilindar, čiji su krajevi bili pažljivo polirani i prekriveni slojem srebra na način da je jedan kraj potpuno odbijao svjetlost, a drugi djelomično reflektirao i djelomično propuštao svjetlost. Kada lampica pumpe treperi, fotoni različitih frekvencija ulaze u rubin štap. Atomi hroma, apsorbujući dio fotona određene energije, prelaze u pobuđeno stanje. Zbog ograničenih spontanih prijelaza, u štapu može nastati stimulirano zračenje, koje se širi striktno duž svoje ose i pojačava se višestrukim refleksijama od krajnjih ogledala, koji igraju ulogu rezonator šupljine. Kao rezultat toga, nastaje snažno monokromatsko zračenje - svjetlosni impuls, čiji dio izlazi kroz prozirno ogledalo. Trajanje takvog impulsa je 10-3 s. To je zbog činjenice da svi pobuđeni joni hroma za to vrijeme prelaze u nepobuđeno stanje. Laserski snop svjetlosti je strogo usmjeren i ima malu divergenciju. Rezonator u šupljini lasera služi za stvaranje pozitivne povratne sprege i formiranje geometrijskih parametara laserskog izlaznog snopa.
Ne pretvara se sva energija koju rubin štap apsorbira u lasersko zračenje. Dio toga, prilično značajan (50%), troši se na zagrijavanje štapa, tako da laserski dizajn predviđa hlađenje 3. Na temperaturi štapa od oko 1000 K, rubin laser je uništen.
Postoji veliki broj laserskih materijala: staklo, u koje su uvedeni neodimijum joni, kalcijum fluorit sa samarijum ionima itd. Daju svetlosno zračenje razne dužine talasi: rubin laser - 0,694 mikrona, laser od neodimijum stakla - 1,06 mikrona (infracrveno zračenje). U laserima se kao aktivni medij mogu koristiti plinovi ili mješavine plinova (Ne, Ar, Ne–He, CO 2 itd.). U gasnim laserima, atomi aktivnog medija se često pobuđuju visokofrekventnim pražnjenjem. Emisija gasnih lasera je po pravilu kontinuirana. Stvoreni su poluprovodnički, hemijski, gasnodinamički i drugi laseri.
Lasersko zračenje ima sljedeća svojstva:
1) vremenska i prostorna koherentnost;
2) stroga jednobojnost;
3) velika gustina toka energije;
4) vrlo mala ugaona divergencija u snopu.
Unusual Properties lasersko zračenje našle široku primenu. Na primjer, u mašinama sa svjetlosnim snopom, pomoću laserskog snopa, rupe se prave u kamenu za satove od rubina, dijamanta, u vatrostalnim legurama i metalima koji se teško seku. U mikroelektronici, laseri se koriste za zavarivanje raznih spojeva za mikro kola, taloženje poluvodičkih slojeva itd.
Tema 30. Elementi kvantne mehanike
Francuski naučnik Louis de Broglie, razvijajući ideje o dualnoj korpuskularno-talasnoj prirodi svjetlosti, iznio je 1923. hipotezu o univerzalnosti korpuskularno-valnog dualizma. De Broglie je tvrdio da postoji duboka analogija između svojstava svjetlosti i svojstava materijalnih čestica; stoga i materijalne čestice imaju dvostruku prirodu, tj. pod određenim uslovima ispoljavaju se njihova talasna svojstva.
 De Broglie je pretpostavio da je to čestica sa impulsom
De Broglie je pretpostavio da je to čestica sa impulsom ![]() odgovara talasnoj dužini:
odgovara talasnoj dužini:  (1.2)
(1.2)
Ova relacija (de Broglieova formula) vrijedi za svaku česticu s impulsom R.
Ubrzo je de Broljeva hipoteza eksperimentalno potvrđena. američki fizičari K. Davisson i L. Germer su 1927. proučavali rasejanje elektrona na monokristalu nikla koristeći postavku prikazanu na sl. Snop elektrona iz elektronskog topa 1 bio je usmjeren na kristal nikla 2, elektroni 3 raspršeni iz kristala su uhvaćeni posebnim prijemnikom 4 spojenim na osjetljivi galvanometar. Intenzitet reflektovanog snopa određen je iz jačine struje koja teče kroz galvanometar. Eksperimenti su pokazali da se pri datom upadnom kutu elektroni reflektiraju od površine kristala pod različitim uglovima, au nekim smjerovima postoje maksimumi u broju reflektiranih elektrona, u drugim - minimumi, odnosno uočen je difrakcijski obrazac. Ovaj fenomen je uočen kada je de Broglie elektrona talasne dužine 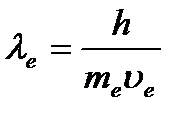 je reda međuatomske udaljenosti u kristalu. Difrakcijski maksimumi su odgovarali Wulf-Braggs formuli
je reda međuatomske udaljenosti u kristalu. Difrakcijski maksimumi su odgovarali Wulf-Braggs formuli ![]() , a Bragova talasna dužina se pokazala tačnom jednaka dužini talas izračunat po formuli (1.2).
, a Bragova talasna dužina se pokazala tačnom jednaka dužini talas izračunat po formuli (1.2).
Kasnije su PS Tartakovskii i G. Thomson istraživali prolaz brzih elektrona kroz tanke metalne filmove. Istovremeno, na fotografskim pločama iza ovih filmova dobijen je difrakcijski uzorak, isti kao kod difrakcije x-zrake na polikristalima.
Godine 1849. V.A. Fabrikant, L.M. Biberman i N.G. Sushkin izveli su eksperimente na difrakciji elektrona sa vrlo malom strujom u uređaju, odnosno svaki elektron je snimljen fotografskom pločom na nasumičnom mjestu. Kod dugotrajne ekspozicije dobijen je isti uzorak difrakcije kao i kod kratke ekspozicije sa velikom jakošću struje. To znači da su valna svojstva svojstvena svakom elektronu posebno, ali difrakcija jednog elektrona ne daje cijeli sistem tačaka, koji se dobija difrakcijom od toka. Trag jednog elektrona biće samo u jednoj tački, što je dozvoljeno uslovom difrakcije. Ovo pokazuje korpuskularnu prirodu elektrona, budući da se elektron ne može širiti. Na koje će od mjesta pasti elektron, nemoguće je reći. Možemo govoriti samo o vjerovatnoći da pogodimo tačku u prostoru.
Dakle, elektron ima dvostruku prirodu, tj. kombinuje svojstva čestica i talasa. Valna priroda elektrona je potvrđena eksperimentima na njihovoj difrakciji. Korpuskularna priroda elektrona očituje se u činjenici da elektron djeluje kao cjelina, bez raspadanja na dijelove.
Nakon toga, otkriveni su i fenomeni difrakcije za neutrone, protone, atomske i molekularne zrake. Ovo je konačno poslužilo kao dokaz o prisutnosti valnih svojstava mikročestica i omogućilo da se opiše kretanje mikročestica u obliku valnog procesa koji karakteriše određena talasna dužina izračunata de Broglieovom formulom (1.2).






