Šta je relativna atomska masa u fizici. Formula atomske mase
Mase atoma i molekula su vrlo male, pa je zgodno odabrati masu jednog od atoma kao mjernu jedinicu i izraziti mase preostalih atoma u odnosu na nju. Upravo je to učinio osnivač atomske teorije Dalton, koji je sastavio tablicu atomskih masa, uzimajući masu atoma vodika kao jedinicu.
Do 1961. godine, u fizici, 1/16 mase atoma kiseonika 16 O uzimana je kao jedinica atomske mase (skraćeno amu), au hemiji - 1/16 od prosjeka atomska masa prirodni kiseonik, koji je mešavina tri izotopa. Jedinica hemijske mase bila je 0,03% veća od fizičke.
Trenutno je u fizici i hemiji usvojen jedinstveni mjerni sistem. 1/12 mase atoma ugljika 12 C se bira kao standardna jedinica atomske mase.
1 amu \u003d 1/12 m (12 C) \u003d 1,66057 × 10 -27 kg \u003d 1,66057 × 10 -24 g.
DEFINICIJA
Relativna atomska masa elementa (A r)- ovo je bezdimenzionalna veličina jednaka omjeru prosječne mase atoma elementa i 1/12 mase atoma 12 C.
Prilikom izračunavanja relativne atomske mase uzima se u obzir obilje izotopa elemenata u zemljinoj kori. Na primjer, hlor ima dva izotopa 35 Cl (75,5%) i 37 Cl (24,5%).Relativna atomska masa hlora je:
A r (Cl) \u003d (0,755 × m (35 Cl) + 0,245 × m (37 Cl)) / (1/12 × m (12 C) = 35,5.
Iz definicije relativne atomske mase slijedi da je prosječna apsolutna masa atoma jednaka relativnoj atomskoj masi puta amu:
m(Cl) = 35,5 × 1,66057 × 10 -24 = 5,89 × 10 -23 g.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | U kojoj je od sljedećih tvari maseni udio elementa kisika veći: a) u cink oksidu (ZnO); b) u magnezijum oksidu (MgO)? |
| Rješenje |
Odredite molekulsku masu cink oksida: Mr(ZnO) = Ar(Zn) + Ar(O); Mr(ZnO)=65+16=81. Poznato je da je M = Mr, što znači M(ZnO) = 81 g/mol. Tada će maseni udio kisika u cink oksidu biti jednak: ω (O) = Ar (O) / M (ZnO) × 100%; ω(O) = 16 / 81 × 100% = 19,75%. Odredite molekulsku masu magnezijum oksida: Mr(MgO) = Ar(Mg) + Ar(O); Mr (MgO) = 24+ 16 = 40. Poznato je da je M = Mr, što znači M(MgO) = 60 g/mol. Tada će maseni udio kisika u magnezijevom oksidu biti jednak: ω (O) = Ar (O) / M (MgO) × 100%; ω (O) = 16 / 40 × 100% = 40%. Dakle, maseni udio kiseonika je veći u magnezijum oksidu, jer je 40 > 19,75. |
| Odgovori | Maseni udio kiseonika veći je u magnezijum oksidu. |
PRIMJER 2
| Vježbajte | U kojem je od sljedećih jedinjenja maseni udio metala veći: a) u aluminijum oksidu (Al 2 O 3); b) u oksidu željeza (Fe 2 O 3)? |
| Rješenje | Maseni udio elementa X u molekuli sastava HX izračunava se po sljedećoj formuli: ω (X) = n × Ar (X) / M (HX) × 100%. Izračunajmo maseni udio svakog elementa kisika u svakom od predloženih spojeva (vrijednosti relativnih atomskih masa uzetih iz periodnog sistema D.I. Mendelejeva zaokružit će se na cijele brojeve). Odredite molekulsku masu aluminijum oksida: Mr (Al 2 O 3) = 2×Ar(Al) + 3×Ar(O); Mr (Al 2 O 3) \u003d 2 × 27 + 3 × 16 = 54 + 48 = 102. Poznato je da je M \u003d Mr, što znači M (Al 2 O 3) = 102 g / mol. Tada će maseni udio aluminija u oksidu biti jednak: ω (Al) \u003d 2 × Ar (Al) / M (Al 2 O 3) × 100%; ω (Al) \u003d 2 × 27 / 102 × 100% = 54 / 102 × 100% = 52,94%. Odredite molekulsku masu željeznog oksida (III): Mr (Fe 2 O 3) = 2×Ar(Fe) + 3×Ar(O); Mr (Fe 2 O 3) = 2 × 56 + 3 × 16 = 112 + 48 = 160. Poznato je da je M \u003d Mr, što znači M (Fe 2 O 3) = 160 g / mol. Tada će maseni udio željeza u oksidu biti jednak: ω (O) \u003d 3 × Ar (O) / M (Fe 2 O 3) × 100%; ω (O) = 3×16 / 160 × 100% = 48 / 160× 100% = 30%. Dakle, maseni udio metala je veći u aluminijum oksidu, jer je 52,94 > 30. |
| Odgovori | Maseni udio metala je veći u aluminij oksidu. |
Svako tijelo ima masu. Uzmimo tijelo kao vreću jabuka. Ovo tijelo ima masu. Njegova masa će biti zbir mase svake jabuke u vrećici. Vrećica pirinča takođe ima svoju masu, koja se određuje dodavanjem mase svih zrna pirinča, iako su vrlo mala i lagana.
Sva tijela su sastavljena od materije. Masu tijela čini masa njegovih sastavnih supstanci. Supstance se, pak, sastoje od čestica, molekula ili atoma, stoga i čestice tvari imaju masu.
§ 2. Jedinica za atomsku masu
Masa atoma kiseonika je oko šesnaest puta veća i iznosi 2,66∙ 10 -23 g, masa atoma ugljika 1,99∙ 10 -23 g. Masa atoma se označava -m a.
U ovom slučaju, masa atoma vodika bit će 1 amu, masa atoma kisika će biti 16 amu, a masa atoma ugljika će biti 12 amu.
Hemičari dugo vremena nisu imali pojma koliko jedan atom bilo kojeg elementa teži u uobičajenim i pogodnim jedinicama za mjerenje mase (grami, kilogrami, itd.).
Pokušali su da se utvrdi koliko su puta atomi nekih elemenata teži od drugih. Stoga su naučnici nastojali da uporede masu atoma jednog elementa sa masom atoma drugog elementa.
Rješenje ovog problema je također bilo bremenito velikim poteškoćama, a prije svega izborom standarda, tj. hemijski element, u odnosu na koje treba izvršiti poređenje atomskih masa preostalih elemenata.
§3 . Relativna atomska masa
Naučnici 19. vijeka riješili su ovaj problem na osnovu eksperimentalnih podataka za utvrđivanje sastava supstanci. Najlakši atom, atom vodonika, uzet je kao standard. Eksperimentalno je utvrđeno da je atom kisika 16 puta teži od atoma vodika, tj. relativna masa(u odnosu na masu atoma vodika) je 16.
 Ova vrijednost je bila označena slovima A r (indeks "r “ – od početnog slova engleska riječ"rođak" - srodnik). Dakle, zapis vrijednosti relativnih atomskih masa kemijskih elemenata trebao bi izgledati ovako: relativna atomska masa vodonika je 1, relativna atomska masa kisika je 16, relativna atomska masa ugljika je 12.
Ova vrijednost je bila označena slovima A r (indeks "r “ – od početnog slova engleska riječ"rođak" - srodnik). Dakle, zapis vrijednosti relativnih atomskih masa kemijskih elemenata trebao bi izgledati ovako: relativna atomska masa vodonika je 1, relativna atomska masa kisika je 16, relativna atomska masa ugljika je 12.
Relativna atomska masa pokazuje koliko je puta masa atoma jednog hemijskog elementa veća od mase atoma, što je standard, stoga ova vrijednost nema dimenziju.
Kao što je već spomenuto, u početku su se vrijednosti atomskih masa određivale u odnosu na masu atoma vodika. Kasnije je standard za određivanje atomske mase bio 1/12 mase atoma ugljika (atom ugljika je 12 puta teži od atoma vodika).
Relativna atomska masa elementa ( A r ) je omjer mase atoma kemijskog elementa i 1/12 mase atoma ugljika.
Vrijednosti atomskih masa hemijskih elemenata date su u Periodnom sistemu hemijskih elemenata D.I. Mendeljejev. Pogledajte periodni sistem i razmotrite bilo koju njegovu ćeliju, na primjer, broj 8.
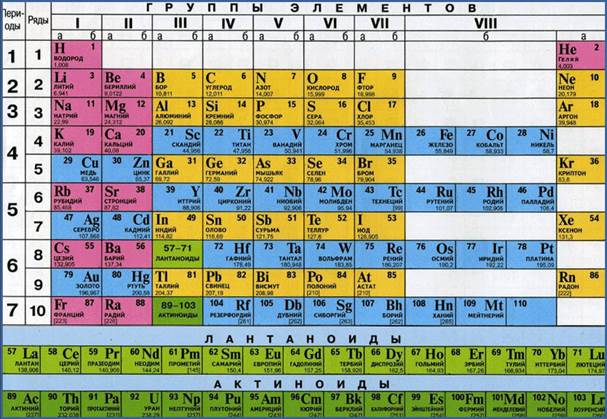
Ispod hemijski znak a naziv u donjem redu označava vrijednost atomske mase hemijskog elementa:relativna atomska masa kiseonika je 15,9994. Imajte na umu: relativne atomske mase gotovo svih hemijskih elemenata imaju frakcionu vrijednost. Razlog za to je postojanje izotopa. Da vas podsjetim da se izotopi nazivaju atomi istog hemijskog elementa, malo različite mase.
U školi se u proračunima obično koriste vrijednosti relativnih atomskih masa, zaokružene na cijele brojeve. Ali u nekoliko slučajeva koriste se frakcione vrijednosti, na primjer: relativna atomska masa klora je 35,5.
§ 4. Relativna molekulska težina
Mase atoma zbrajaju masu molekula.
Relativna molekulska težina tvari je broj koji pokazuje koliko je puta masa molekula ove tvari veća od 1/12 mase atoma ugljika.
Relativna molekulska težina se označava sa −Gospodin
Relativna molekulska težina supstanci izračunava se iz hemijskih formula koje izražavaju sastav supstanci. Da biste pronašli relativnu molekulsku težinu, potrebno je zbrojiti vrijednosti relativnih atomskih masa elemenata koji čine molekulu tvari, uzimajući u obzir kvantitativni sastav, odnosno broj atoma svakog elementa (u hemijske formule izražava se pomoću indeksa). Na primjer, relativna molekulska težina vode, koja ima formulu H2O , jednak je zbroju dvije vrijednosti relativne
atomska masa vodika i jedna vrijednost relativne atomske mase kisika:![]()
Relativna molekulska težina sumporne kiseline koja ima formulu H 2 SO 4 je jednak zbiru
dvije vrijednosti relativne atomske mase vodika, jedna vrijednost relativne atomske mase sumpora i četiri vrijednosti relativne atomske mase kisika:![]() .
.
Relativna molekulska težina je bezdimenzionalna veličina. Ne treba je brkati sa pravom masom molekula, izraženom u jedinicama atomske mase.
Književnost:
NE. Kuznetsova. hemija. 8. razred. Tutorial za obrazovne institucije. – M. Ventana-Graf, 2012.
Izvori koji se koriste za vizuelni dizajn:
http://www.google.ru/imgres?imgurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkimages%2Fst000_26.jpg&imgrefurl=http%3A%2F%2Fwww.pskgu.ru%2Febooks%2Fkps018. htm&h=333&w=400&tbnid=aUsXyHOtCzUHGM%3A&zoom=1&docid=G82TADT3Vv3rxM&ei=VwB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0WCst=spb=spb=0WB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0WB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0WB3VP7OC-a6ygP61oKQDw&tbm=isch&ved=0WC30MB0&sp=sp=0WB3VP7OC&tbm=isch&ved=0WB3VP7Vv3rxM
atomska masa je zbir masa svih protona, neutrona i elektrona koji čine atom ili molekul. U poređenju sa protonima i neutronima, masa elektrona je veoma mala, pa se ne uzima u obzir u proračunima. Iako je netačan sa formalne tačke gledišta, ovaj termin se često koristi za označavanje prosječne atomske mase svih izotopa elementa. U stvari, ovo je relativna atomska masa, koja se još naziva atomska težina element. Atomska težina je prosjek atomskih masa svih prirodnih izotopa elementa. Hemičari moraju razlikovati ove dvije vrste atomske mase kada rade svoj posao - netačna vrijednost za atomsku masu može, na primjer, dovesti do netačnog rezultata za prinos produkta reakcije.
Koraci
Određivanje atomske mase prema periodnom sistemu elemenata
- Jedinica za atomsku masu karakterizira masu jedan mol datog elementa u gramima. Ova vrijednost je vrlo korisna u praktičnim proračunima, jer se može koristiti za lako pretvaranje mase određenog broja atoma ili molekula date tvari u molove, i obrnuto.
-
Pronađite atomsku masu u Mendeljejevom periodnom sistemu. Većina standardnim stolovima Mendeljejev sadrži atomske mase (atomske težine) svakog elementa. Po pravilu se daju kao broj na dnu ćelije sa elementom, ispod slova koja označavaju hemijski element. Ovo obično nije cijeli broj, već decimalni.
Zapamtite da periodni sistem pokazuje prosječne atomske mase elemenata. Kao što je ranije napomenuto, relativne atomske mase date za svaki element u periodnom sistemu su proseci masa svih izotopa atoma. Ova prosječna vrijednost je vrijedna za mnoge praktične svrhe: na primjer, koristi se za izračunavanje molarne mase molekula koje se sastoje od nekoliko atoma. Međutim, kada se radi o pojedinačnim atomima, ova vrijednost obično nije dovoljna.
- Pošto je prosječna atomska masa prosjek nekoliko izotopa, vrijednost data u periodnom sistemu nije precizan vrijednost atomske mase bilo kojeg pojedinačnog atoma.
- Atomske mase pojedinačnih atoma moraju se izračunati uzimajući u obzir tačan broj protona i neutrona u jednom atomu.
Naučite kako se piše atomska masa. Atomska masa, odnosno masa datog atoma ili molekula, može se izraziti u standardnim SI jedinicama - gramima, kilogramima i tako dalje. Međutim, zbog činjenice da su atomske mase izražene u ovim jedinicama izuzetno male, često se pišu u jedinstvenim jedinicama atomske mase, ili skraćeno a.u.m. su jedinice atomske mase. Jedna jedinica atomske mase jednaka je 1/12 mase standardnog izotopa ugljika-12.
Proračun atomske mase pojedinačnog atoma
-
Pronađite atomski broj datog elementa ili njegovog izotopa. Atomski broj je broj protona u atomima elementa i nikada se ne mijenja. Na primjer, svi atomi vodika, i samo imaju jedan proton. Natrijum ima atomski broj 11 jer ima jedanaest protona, dok kiseonik ima atomski broj osam jer ima osam protona. Atomski broj bilo kojeg elementa možete pronaći u periodičnoj tablici Mendelejeva - u gotovo svim njegovim standardnim verzijama ovaj broj je naveden iznad slovne oznake kemijskog elementa. Atomski broj je uvijek pozitivan cijeli broj.
- Pretpostavimo da nas zanima atom ugljika. U atomima ugljika uvijek postoji šest protona, tako da znamo da je njegov atomski broj 6. Osim toga, vidimo da je u periodnom sistemu, na vrhu ćelije sa ugljikom (C) broj "6", koji označava da atomski broj ugljika je šest.
- Imajte na umu da atomski broj elementa nije jedinstveno povezan s njegovom relativnom atomskom masom u periodnom sistemu. Iako, posebno za elemente na vrhu tabele, atomska masa elementa može izgledati dvostruko veća od atomskog broja, nikada se ne izračunava množenjem atomskog broja sa dva.
-
Pronađite broj neutrona u jezgru. Broj neutrona može biti različit za različite atome istog elementa. Kada dva atoma istog elementa sa istim brojem protona imaju različit broj neutrona, oni su različiti izotopi tog elementa. Za razliku od broja protona, koji se nikada ne mijenja, broj neutrona u atomima pojedinog elementa se često može mijenjati, pa se prosječna atomska masa elementa zapisuje kao decimalni razlomak između dva susjedna cijela broja.
Zbrojite broj protona i neutrona. Ovo će biti atomska masa ovog atoma. Zanemarite broj elektrona koji okružuju jezgro - njihova ukupna masa je izuzetno mala, tako da oni imaju mali ili nikakav uticaj na vaše proračune.
Izračunavanje relativne atomske mase (atomske težine) elementa
-
Odredite koji se izotopi nalaze u uzorku. Hemičari često određuju omjer izotopa u određenom uzorku koristeći poseban instrument koji se zove maseni spektrometar. Međutim, tokom obuke, ovi podaci će vam biti dostavljeni u uslovima zadataka, kontrole i tako dalje u obliku vrednosti preuzetih iz naučne literature.
- U našem slučaju, recimo da imamo posla sa dva izotopa: ugljenikom-12 i ugljenikom-13.
-
Odredite relativnu količinu svakog izotopa u uzorku. Za svaki element se javljaju različiti izotopi u različitim omjerima. Ovi omjeri su gotovo uvijek izraženi u procentima. Neki izotopi su vrlo česti, dok su drugi vrlo rijetki—ponekad toliko rijetki da ih je teško otkriti. Ove vrijednosti se mogu odrediti pomoću masene spektrometrije ili pronaći u priručniku.
- Pretpostavimo da je koncentracija ugljika-12 99%, a ugljika-13 1%. Drugi izotopi ugljika stvarno postoje, ali u toliko malim količinama da se u ovom slučaju mogu zanemariti.
-
Pomnožite atomsku masu svakog izotopa njegovom koncentracijom u uzorku. Pomnožite atomsku masu svakog izotopa sa njegovim postotkom (izraženim decimalom). Za pretvaranje postotaka u decimalni, samo ih podijelite sa 100. Dobivene koncentracije uvijek bi trebale biti zbirne do 1.
- Naš uzorak sadrži ugljik-12 i ugljik-13. Ako je ugljik-12 99% uzorka, a ugljik-13 1%, onda pomnožite 12 (atomska masa ugljika-12) sa 0,99 i 13 (atomska masa ugljika-13) sa 0,01.
- Priručnici daju procente na osnovu poznatih količina svih izotopa elementa. Većina udžbenika hemije sadrži ove informacije u tabeli na kraju knjige. Za uzorak koji se proučava, relativne koncentracije izotopa se također mogu odrediti pomoću masenog spektrometra.
-
Zbrojite rezultate. Zbrojite rezultate množenja koje ste dobili u prethodnom koraku. Kao rezultat ove operacije, naći ćete relativnu atomsku masu vašeg elementa - prosječnu vrijednost atomskih masa izotopa dotičnog elementa. Kada se element posmatra kao celina, a ne određeni izotop datog elementa, koristi se ta vrednost.
- U našem primjeru, 12 x 0,99 = 11,88 za ugljik-12, i 13 x 0,01 = 0,13 za ugljik-13. Relativna atomska masa u našem slučaju je 11,88 + 0,13 = 12,01 .
- Neki izotopi su manje stabilni od drugih: raspadaju se na atome elemenata s manje protona i neutrona u jezgri, oslobađajući čestice koje čine atomsko jezgro. Takvi izotopi se nazivaju radioaktivni.






