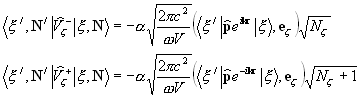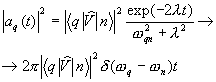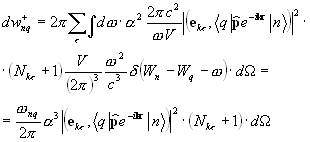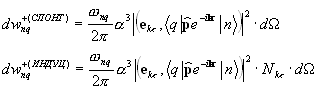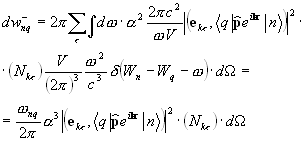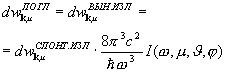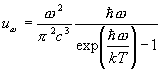Spontana i stimulirana emisija
Ogroman broj različitih pojava se javlja jer se energija atoma i molekula mijenja. U nekim slučajevima, za praksu, nema potrebe za atomsko-molekularnim pristupom analizi fenomena. U drugima, djelotvorno korištenje fenomena moguće je samo uz neophodno razmatranje njegove molekularne (atomske) prirode.
Ovo poglavlje opisuje karakteristike zračenja i apsorpcije energije od strane atoma i molekula, kao i neke praktično važne pojave, čije je poznavanje atomske prirode neophodno za njihovu upotrebu. Neka od ovih širokih tema razmatraju se u sljedećem poglavlju.
29.1. OSOBINE ZRAČENJA I APSORPCIJE ENERGIJE
ATOMI I MOLEKULI
Atom i molekul mogu biti u stacionarnim energetskim stanjima. U tim stanjima ne emituju niti apsorbuju energiju. Energetska stanja su šematski prikazana kao nivoi (vidi, na primjer, sliku 28.13). Najniži energetski nivo - nivo zemlje - odgovara osnovnom stanju.
U kvantnim prijelazima, atomi i molekuli skaču iz jednog stacionarnog stanja u drugo, s jednog energetskog nivoa na drugi.
Promena stanja atoma je povezana sa energetske tranzicije elektrona. U molekulima se energija može mijenjati ne samo kao rezultat elektronskih prijelaza, već i kao rezultat promjena u vibracijama atoma i prijelaza između rotacijskih nivoa.
Kada se krećete sa višeg nivoi energije odaje energiju nižem atomu ili molekuli i apsorbira je tokom obrnutih prijelaza. Atom u svom osnovnom stanju može apsorbirati samo energiju.
Postoje dvije vrste kvantnih prijelaza:
1) bez zračenja ili apsorpcije elektromagnetne energije od strane atoma ili molekula. Takav neradijativni prijelaz događa se kada atom ili molekul interagiraju s drugim česticama.
mi, na primjer, u procesu sudara. Razlikovati neelastični sudar, u kojem se mijenja unutarnje stanje atoma i dolazi do neradijativne tranzicije, i elastičnog - s promjenom kinetičke energije atoma ili molekule, ali uz očuvanje unutrašnjeg stanja; 2) sa emisijom ili apsorpcijom fotona.
Energija fotona jednaka je razlici između energija početnog i konačnog stacionarnog stanja atoma ili molekule:
Formula (29.1) izražava zakon očuvanja energije.
Ovisno o uzroku koji uzrokuje kvantni prijelaz s emisijom fotona, razlikuju se dvije vrste zračenja. Ako je ovaj uzrok unutrašnji i pobuđena čestica spontano prelazi na niži energetski nivo, takvo zračenje se naziva spontano(Sl. 29.1, a). Ona je nasumična i haotična u vremenu, frekvenciji (mogu postojati prijelazi između različitih podnivoa), u smjeru širenja i polarizacije. Konvencionalni izvori svjetlosti emituju uglavnom spontano zračenje. Ostalo zračenje prisiljen, ili inducirano(Sl. 29.1, b). Nastaje tokom interakcije fotona sa pobuđenom česticom, ako je energija fotona jednaka razlici između energetskih nivoa. Kao rezultat prisilnog kvantnog prijelaza, dva identična fotona će se širiti iz čestice u istom smjeru: jedan je primarni, prisiljavajući, a drugi je sekundarni, emitiran.
Energija koju emituju atomi ili molekuli formira emisioni spektar, a apsorbovana energija formira apsorpcioni spektar.
Intenzitet spektralne linije je određen brojem identičnih prelaza koji se dešavaju u sekundi, i stoga zavisi od broja emitujućih (apsorbujućih) atoma i verovatnoće odgovarajućeg prelaza.
Kvantni prijelazi se ne izvode između bilo kojeg energetskog nivoa. Utvrđena pravila selekcije, odnosno zabrane, koja formulišu uslove pod kojima su tranzicije moguće, a nemoguće ili malo verovatne.
Energetski nivoi većine atoma i molekula su prilično složeni. Struktura nivoa i, shodno tome, spektri ne zavise od

samo iz zgrade pojedinačni atom ili molekula, ali i iz vanjskih uzroka.
Elektromagnetna interakcija elektrona dovodi do finog cijepanja 1 nivoa energije (fina struktura). Utjecaj magnetnih momenata jezgara uzrokuje hiperfino cijepanje (hiperfina struktura). Vanjski prema atomu ili molekuli, električni i magnetna polja takođe izazivaju cepanje energetskih nivoa (Starkov i Zeeman fenomen; videti 30.2).
Spektri su izvor različitih informacija.
Prije svega, atomi i molekuli se mogu identificirati po obliku spektra, što je dio zadataka kvalitativne spektralne analize. Broj emitujućih (apsorbujućih) atoma određuje se iz intenziteta spektralnih linija – kvantitativna spektralna analiza. Istovremeno, nečistoće u koncentracijama od 10 -5 - 10 -6% relativno je lako pronaći i utvrditi sastav uzoraka vrlo male mase - do nekoliko desetina mikrograma.
Iz spektra se može suditi o strukturi atoma ili molekula, strukturi njihovih energetskih nivoa, pokretljivosti pojedinih dijelova velikih molekula itd. Znajući ovisnost spektra o poljima koja djeluju na atom ili molekulu, dolazi se do informacija o relativnu pozicijučestice, jer se uticaj susjednih atoma (molekula) vrši kroz elektromagnetno polje.
Proučavanje spektra pokretnih tijela omogućava da se na osnovu optičkog Doplerovog efekta odrede relativne brzine emitera i prijemnika zračenja.
Ako uzmemo u obzir da je iz spektra supstance moguće izvući zaključke o njenom stanju, temperaturi, pritisku itd., onda možemo visoko cijeniti korištenje zračenja i apsorpciju energije atomima i molekulama kao istraživačku metodu .
Ovisno o energiji (frekvenciji) fotona kojeg emituje ili apsorbira atom (ili molekula), klasificiraju se sljedeće vrste spektroskopije: radio, infracrveno, vidljivo zračenje, ultraljubičasto i rendgensko 2 .
Prema vrsti supstance (izvor spektra), atomski, molekularni spektri i spektrikristali.
1 Pojam "cijepanje" ovdje ne označava proces, već neko već formirano stanje.
2 Gama spektroskopija zbog nuklearnih kvantnih prijelaza ovdje nije naznačena.
29.2. APSORPCIJA LIGHT
Intenzitet svjetlosti koja se širi u mediju može se smanjiti zbog njegove apsorpcije i raspršenja od strane molekula (atoma) tvari.
Upijanjem svjetlostinaziva se slabljenjem intenziteta svjetlosti pri prolasku kroz bilo koju supstancu zbog pretvaranja svjetlosne energije u druge oblike energije.
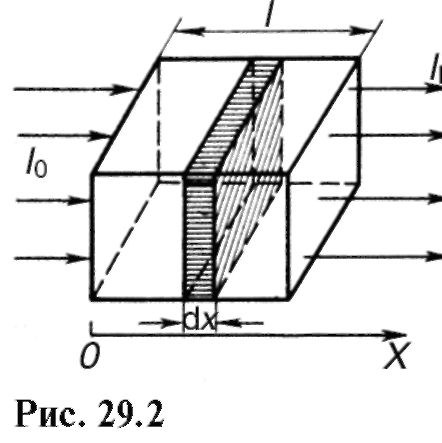
Hajde da uspostavimo zakon apsorpcije svetlosti materijom. Ako odaberemo mali sloj tvari debljine dx(Sl. 29.2), tada će slabljenje intenziteta dI svjetlosti od strane ovog sloja tokom apsorpcije biti to veće, što je veća debljina sloja i intenzitet svjetlosti koja pada na ovaj sloj:
gdje k- indeks prirodnog apsorpcije (faktor proporcionalnosti koji zavisi od apsorpcionog medija i ne zavisi u određenim granicama od intenziteta svetlosti); znak “-” znači da se intenzitet svjetlosti smanjuje pri prolasku kroz supstancu, tj. dI<0. Интегрируя (29.2) и подставляя соответствующие пределы (рис. 29.2), получаем:
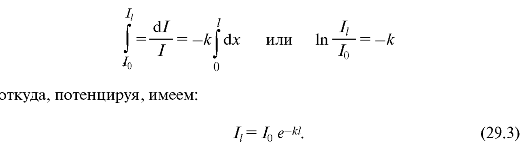
Ova formula izražava Bouguerov zakon apsorpcije svjetlosti. Kao što vidite, prirodna stopa apsorpcije k je recipročna udaljenost na kojoj je intenzitet svjetlosti oslabljen kao rezultat apsorpcije u mediju u e jednom.
Prirodni indeks apsorpcije zavisi od talasne dužine svetlosti, pa je preporučljivo napisati zakon (29.3) za monohromatsko svetlo:
gdje k x- monohromatski prirodni indikator apsorpcije.
Budući da je apsorpcija svjetlosti posljedica interakcije s molekulima, zakon apsorpcije se može povezati s određenim karakteristikama molekula.
Neka P je koncentracija molekula koji apsorbiraju kvante svjetlosti. Označimo efektivni presjek apsorpcije molekula kao σ (neka površina, kada foton uđe u koju ga molekula zarobi).
Ukupna površina efektivnog poprečnog presjeka molekula ovog sloja jednaka je σnSdx. Tok fotona pada na ovaj sloj F = IS. Udio efektivne površine poprečnog presjeka molekula u ukupnoj površini poprečnog presjeka:
Udio fotona koje apsorbira sloj može se izraziti u terminima fluksa (F/F) ili intenziteta (dI/I) svjetlosti. Na osnovu navedenog možemo napisati:


29.3. RASPIRANJE SVJETLA
Rasipanje svetlostinaziva se fenomen u kojem se svjetlosni snop koji se širi u mediju odbija u svim mogućim smjerovima.
Neophodan uslov za nastanak rasejanja svetlosti je prisustvo optičkih nehomogenosti, tj. regije s indeksom prelamanja koji nije glavni medij.
Rasipanje i difrakcija svetlosti imaju neke zajedničke karakteristike, obe pojave zavise od odnosa barijere ili nehomogenosti i talasne dužine. Razlika između ovih pojava leži u činjenici da je difrakcija posljedica interferencije sekundarnih valova, a raspršivanje je posljedica dodavanja (a ne interferencije!) zračenja koje nastaje zbog prisilnih oscilacija elektrona u nehomogenostima pod utjecajem svjetlosti.
Postoje dvije glavne vrste takvih nehomogenosti:
1) male strane čestice u homogenoj providnoj materiji. Takvi mediji su mutni: dim (čvrste čestice u gasu), magla (tečne kapljice u gasu), suspenzije, emulzije itd. Rasipanje u mutnim medijima naziva se Tyndallov fenomen;
2) optičke nehomogenosti koje nastaju u čistoj supstanci usled statističkog odstupanja molekula od ujednačene raspodele (fluktuacije gustine). Rasipanje svjetlosti nehomogenostima ovog tipa naziva se molekularno; na primjer, rasipanje svjetlosti u atmosferi.
Smanjenje intenziteta svjetlosti zbog raspršenja, kao u slučaju apsorpcije, opisuje se eksponencijalnom funkcijom:
gdje m- indeks raspršenja (prirodni).
Pod kombiniranim djelovanjem apsorpcije i raspršenja svjetlosti, slabljenje intenziteta je također eksponencijalna funkcija:
gdje je μ indeks slabljenja (prirodni). Lako je vidjeti da je μ = m+k.
Rayleigh je otkrio da je tokom rasejanja u zamućenoj sredini nehomogenostima približno manjim od 0,2λ, kao i tokom molekularnog rasejanja, intenzitet raspršene svetlosti obrnuto proporcionalan četvrtom stepenu talasne dužine (Rayleighov zakon):
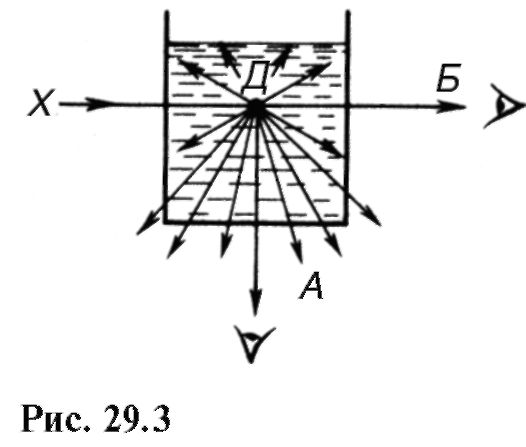
To znači da iz bijele svjetlosti tvar, na primjer, u tački d(Sl. 29.3), plavi i ljubičasti zraci će se pretežno raspršivati (smjer A), a crveni zraci će proći u pravcu b padajuće svjetlo. Sličan fenomen se uočava u prirodi: plava boja neba je raspršena svjetlost, crvena boja zalazećeg Sunca je promjena u spektru bijele svjetlosti zbog značajnog raspršenja
plavi i ljubičasti zraci u atmosferi kosog upada (vidi objašnjenje za sliku 27.3).
Manje rasipanje crvenih zraka koristi se u signalizaciji: identifikaciona svetla na aerodromima, najvažniji semafor je crveni itd. Infracrveni zraci se još manje raspršuju. Na sl. 29.4 prikazuje dvije fotografije krajolika: na lijevoj strani, snimljenoj uobičajenom metodom, magla je jako ograničena vidljivost: na desnoj strani, snimljena infracrvenim zračenjem na posebnoj ploči, magla ne ometa, ispostavilo se da je prozirna za duži talasi.
Ako su suspendovane čestice velike u poređenju sa talasnom dužinom, onda rasejanje ne odgovara Rayleighovom zakonu (29.14) – imenilac razlomka će biti λ 2 . Difuzno svjetlo gubi plavetnilo i postaje bjelji. Tako nam se prašnjavo nebo gradova čini bjelkasto, za razliku od tamnoplavog neba čistih morskih prostora.
Smjer raspršene svjetlosti, stepen njene polarizacije, spektralni sastav itd. donose informacije o parametrima koji karakterišu međumolekulsku interakciju, veličinama makromolekula u rastvorima, čestica u koloidnim rastvorima, emulzijama, aerosolima itd.

Metode za mjerenje raspršene svjetlosti kako bi se dobila ovakva informacija se nazivaju nefelometrija, i odgovarajućih uređaja nefelometri.
29.4. OPTIČKI ATOMSKI SPEKTRI
Atomski spektri su i emisioni i apsorpcioni spektri koji nastaju tokom kvantnih prelaza između nivoa slobodnih ili slabo interakcijskih atoma.
Pod optičkim atomskim spektrima podrazumijevamo one koji su posljedica prijelaza između nivoa vanjskih elektrona s energijama fotona reda nekoliko elektron volti. Ovo uključuje ultraljubičastu, vidljivu i blisku infracrvenu (do mikrometara) područja spektra.
Najveći interes su optički spektri atomske emisije, koji se dobijaju od pobuđenih atoma. Njihovo pobuđivanje obično se postiže kao rezultat neradijativnih kvantnih prijelaza tijekom električnog pražnjenja u plinu ili zagrijavanja tvari plamenom plinskog plamenika, električnim lukom ili iskrom.
U 29.1, data su opšta razmatranja o spektrima atoma. Detaljne informacije o spektrima određenih atoma mogu se naći u posebnim referentnim knjigama o spektroskopiji. Kao jednostavan primjer, razmotrite spektar atoma vodika i jona sličnih vodiku.
Iz formula (28.24) i (29.1) može se dobiti formula za frekvenciju svjetlosti koju emituje (apsorbira) atom vodonika (Z = 1):
Ovu formulu je eksperimentalno pronašao I.Ya. Balmer mnogo prije stvaranja kvantne mehanike i teoretski dobiven od Bohra (vidi 28.7); i i k su redni brojevi nivoa između kojih se dešava kvantni prelaz.
Spektar se može podijeliti u grupe linija tzv spektralne serije.
Svaka serija, primijenjena na emisione spektre, odgovara prijelazima sa različitih nivoa na isti konačni nivo (slika 29.5).
Nalazi se u ultraljubičastom području lyman serija, koja nastaje pri prelasku sa najviših energetskih nivoa na najviše
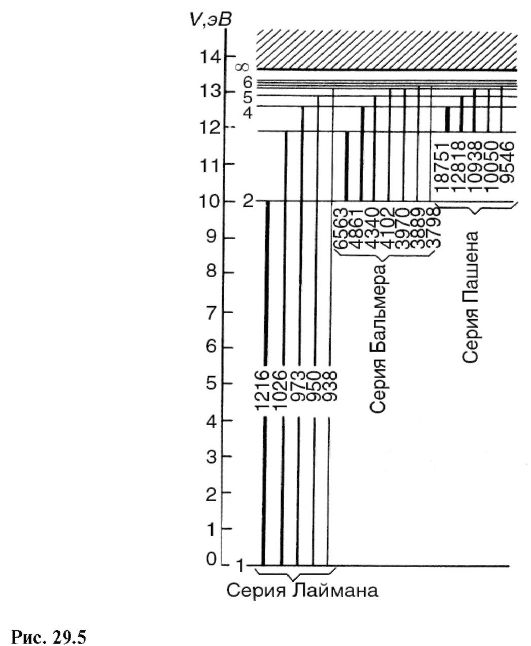
donji, glavni (k = 1). Iz formule (29.15) za Lymanov niz dobijamo:
one. pronađite frekvencije svih linija ove serije. Najduža linija talasne dužine ima najveći intenzitet. Intenzitet spektralnih linija na sl. 29.5 su uslovno prikazane debljinom odgovarajućih direktnih prelaza.
U vidljivom i bliskom ultraljubičastom području spektra nalazi se Balmerova serija, koja nastaje kao rezultat prijelaza sa gornjeg energetskog nivoa na drugi (k = 2). Iz formule (29.15) for Balmer serija dobijamo:

29.5. MOLEKULARNI SPEKTRI
Molekularni spektri (emisije i apsorpcije) nastaju tokom kvantnih prelaza molekula sa jednog energetskog nivoa na drugi (videti 28.9) i sastoje se od skupa manje ili više širokih traka, koje su blisko raspoređene linije. Složenost molekularnih spektra u poređenju sa atomskim je posljedica
velika raznolikost kretanja i, posljedično, energetskih prijelaza u molekuli.
Uzimajući u obzir (29.1) i (28.37), nalazimo frekvenciju koju emituje ili apsorbuje molekul:


Molekularni spektri omogućavaju proučavanje ne samo strukture molekula, već i prirode međumolekulskih interakcija.
Spektri molekularne apsorpcije (apsorpcije) su važan izvor informacija o biološki funkcionalnim molekulima, široko se koriste u savremenim biohemijskim i biofizičkim studijama.
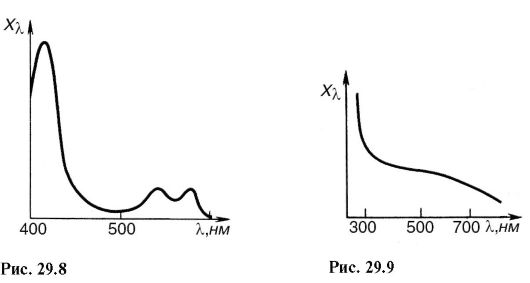
U mnogim slučajevima, ovi spektri se snimaju kao kontinuirani, ne rješavajući detalje koji su gore opisani.
Tako, na primjer, na sl. 29.8 prikazuje apsorpcijski spektar suspenzije eritrocita. Spektar apsorpcije ljudske kože prikazan je na Sl. 29.9, u ultraljubičastom dijelu, stopa apsorpcije je visoka i koža apsorbira zračenje u najvišim slojevima. U vidljivom dijelu, apsorbancija se smanjuje i ostaje gotovo konstantna sve do crvene regije.
29.6. RAZNE VRSTE LUMINESCENCIJE
Luminescencija se naziva višak toplotnog zračenja tela na datoj temperaturi, koji ima trajanje znatno duže od perioda(10 -15 s) emitovanih svetlosnih talasa.
Znak trajanja u ovoj definiciji predložio je S.I. Vavilova kako bi se luminiscencija razlikovala od nekih drugih pojava sekundarne luminiscencije, kao što su refleksija i raspršivanje svjetlosti.
Ovisno o vrsti pobude, razlikuje se nekoliko vrsta luminiscencije.
Luminescencija uzrokovana nabijenim česticama: joni - jonoluminiscencija, elektroni - katodoluminiscencija, nuklearno zračenje - radioluminiscencija. Luminiscencija pod uticajem rendgenskog i γ-zračenja naziva se rendgenska luminiscencija, fotoni - fotoluminiscencija (vidi 29.7). Prilikom trljanja, drobljenja ili cijepanja nekih kristala, triboluminiscencija. Pobuđen električnim poljem elektroluminiscencija, poseban slučaj je sjaj gasnog pražnjenja. Luminiscencija koja prati egzotermnu hemijsku reakciju naziva se hemiluminiscencija (vidi 29.8).
Fotoluminiscencija, koja se ponekad naziva jednostavno i luminiscencija, dijeli se na fluorescenciju (kratko naknadno sjajenje) i fosforescenciju (relativno dugo poslijesjaj).
Početni čin bilo koje fotoluminiscencije je pobuđivanje fotona energijom hv atom ili molekul. U najjednostavnijem slučaju, koji se obično realizuje u monoatomskim parama i gasovima, atom se vraća u osnovno stanje, emitujući foton svetlosti iste frekvencije ν (slika 29.10). Ovaj fenomen se zove rezonantna fluorescencija (rezonantno rasipanje). Posebni eksperimenti su pokazali šta je svjetlost
29.7. FOTOLUMINESCENCIJA
![]()
Emisija se javlja otprilike 10 -8 s nakon osvjetljenja supstance i stoga nije rasipanje u uobičajenom smislu riječi.
Kada se luminiscentnim parama dodaju strani gasovi (vodonik, kiseonik, itd.), rezonantna fluorescencija se smanjuje. To je zbog činjenice da je za vrijeme dok je atom

u pobuđenom stanju, može se susresti s različitim vrstama molekula i dati mu energiju. U tom slučaju kinetička energija molekula raste, a atom neradijativno prelazi u osnovno stanje.
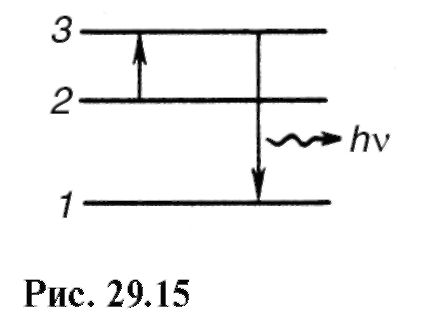
Verovatnije je da iz uzbuđenog stanja 3 (Sl. 29.11) molekul će neradijativno preći na nivo 2, a zatim spontano sa emisijom kvanta sa energijom hv" do nivoa 1.
U složenim organskim molekulima dolazi do prijelaza iz pobuđenog stanja 3 u neki srednji, metastabilan 4, prelazak iz kojeg u osnovno stanje je malo verovatan (slika 29.12). Zbog molekularno-kinetičke energije okolnih čestica ili zbog novog kvanta svjetlosti moguć je prijelaz molekula na pobuđeni nivo 2, a iz njega u osnovno stanje 1. Ovo je jedan od mehanizama fosforescencije. Zagrijavanje povećava vjerovatnoću napuštanja metastabilnog nivoa i pojačava fosforescenciju.
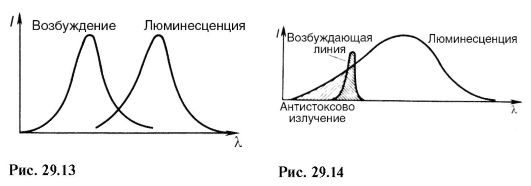
Za fotoluminiscenciju je u osnovi tačno Stokesov zakon: spektar luminescencije je pomeren prema dugim talasnim dužinama u odnosu na spektar koji je izazvao ovu fotoluminiscenciju (slika 29.13).
U stvari, kao što se može vidjeti sa Sl. 29.10, energija hv "emitovanog fotona nije veća od energije hv apsorbiranog fotona:
odakle λ "\u003e λ. Postoje odstupanja od Stokesovog zakona - anti-Stokesova luminiscencija. Ovo je posebno vidljivo kada je fotoluminiscencija pobuđena posebnom spektralnom linijom, tj. monohromatskom svjetlošću (slika 29.14). Anti-Stokesovo zračenje nastaje kada pobuđena je čestica koja je već bila u pobuđenom stanju (slika 29.15, nivo 3). 2 na glavnom 1 energija hv se emituje". Kao što se vidi sa slike:
Brojni biološki funkcionalni molekuli, kao što su proteinski molekuli, pokazuju fluorescenciju. Parametri fluorescencije su osjetljivi na strukturu okoline fluorescentnog molekula, stoga se luminescencija može koristiti za proučavanje kemijskih transformacija i međumolekularnih interakcija.
Poslednjih decenija, specijalni fluorescentni molekuli dodani membranskim sistemima izvana su postali široku upotrebu. Takvi molekuli se nazivaju fluorescentne sonde (nekovalentna veza sa membranom) ili fluorescentne oznake (hemijska veza).
Promjena fluorescencije sondi i oznaka omogućava otkrivanje konformacijskih preuređivanja u proteinima i membranama.
Razmotrite neke primjene fotoluminiscencije u medicinske svrhe.
Luminescentna analiza, zasnovana na posmatranju luminiscencije objekata u cilju njihovog proučavanja, koristi se za otkrivanje početne faze kvarenja hrane, sortiranje farmakoloških preparata i dijagnosticiranje određenih bolesti. Dakle, kosa i ljuske zahvaćene gljivicom pod ultraljubičastim svjetlom daju jarko zeleni luminiscentni sjaj. Propustljivost kapilara kože može se odrediti subkutanim ubrizgavanjem fluorescentnih boja.
Pod povoljnim uslovima, luminiscentna analiza omogućava detekciju luminiscentnih supstanci težine do 10 -10 g.
Luminescentna analiza mikroskopskih objekata provodi se pomoću posebnih luminiscentnih mikroskopa, u kojima se, za razliku od konvencionalnih izvora svjetlosti, obično koriste živine lampe visokog i ultravisokog tlaka i dva svjetlosna filtera. Jedan od njih se nalazi ispred kondenzatora

leglo, ističe područje spektra izvora svjetlosti, što uzrokuje luminescenciju objekta; drugi, koji se nalazi između sočiva i okulara, emituje luminescentno svjetlo. Na osnovu fotoluminiscencije stvoreni su izvori svjetlosti čiji je spektar konzistentniji s dnevnom svjetlošću nego kod žarulja sa žarnom niti. Ovo je važno i za industrijske i za higijenske svrhe. U takvim fluorescentnim lampama, koje se nazivaju fluorescentne lampe, dolazi do električnog pražnjenja u pari žive pri niskom pritisku (elektroluminiscencija). Na unutrašnjoj površini lampe, napravljenoj od običnog stakla (sl. 29.16), taložen je tanak sloj fosfora koji fotoluminescira pod uticajem zračenja živinih para.
Promjenom sastava fosfora može se izabrati najprikladniji fotoluminiscencijski spektar. Na sl. 29.17 prikazuje jedan od mogućih spektra, intenzivne linije odgovaraju spektru para čije zračenje djelimično prolazi kroz fosfor.
29.8. KEMILUMINESCENCIJA
Luminiscencija koja prati hemijske reakcije naziva se hemiluminiscencija.
Emituju ga ili direktno produkti reakcije, ili druge komponente koje se pobuđuju kao rezultat prijenosa energije na njih iz produkta reakcije.
Sjaj hemiluminiscencije, tj. broj kvanta emitovanih u jedinici vremena raste sa povećanjem brzine reakcije i efikasnosti hemiluminiscencije – prosečan broj kvanta po jednom reakcijskom aktu. Hemiluminiscencija se može koristiti za određivanje sastava supstance (hemiluminiscentna analiza).
Posebna manifestacija hemiluminiscencije - sjaj koji prati hemijske reakcije bioloških objekata - naziva se biohe-
miluminiscencija.Zračenje trulih, krijesnica - primjeri biokemiluminiscencije (bioluminiscencije).
Među biofizičarima se naziva bioluminiscencija niskog intenziteta super slabo svjetlo, aktivno su ga proučavali brojni naučnici, posebno Yu.A. Vladimirov.
Pokazano je da u biološkim sistemima hemiluminiscencija nastaje tokom rekombinacije slobodnih radikala lipid peroksida: RO 2 +RO 2 -- pobuđeni proizvod -- proizvod + + kvant hemiluminiscencije.
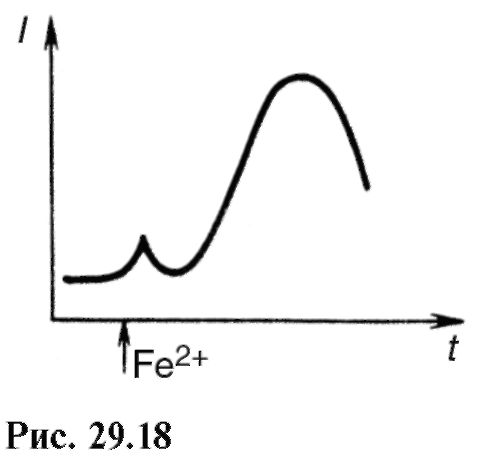
Intenzitet hemiluminiscencije se značajno povećava kada se biološkim sistemima koji se proučavaju dodaju, na primjer, soli željeza. Na sl. 29.18 pokazuje povećanje intenziteta luminiscencije u suspenziji mitohondrija u vrijeme uvođenja obojenog željeza. Ako se sličan eksperiment uradi s krvnom plazmom u slučaju gnojnog apendicitisa ili kolecistitisa, onda se može primijetiti da je sjaj u prvom slučaju znatno slabiji. Stoga se hemiluminiscencija može koristiti kao dijagnostička metoda.
29.9. FOTOBIOLOŠKI PROCESI
Fotobiološkim procesima nazivamo procese koji počinju apsorpcijom svjetlosnih kvanta biološki funkcionalnim molekulima, a završavaju odgovarajućom fiziološkom reakcijom u tijelu ili tkivima.
Važna karakteristika uticaja svetlosti na tok bioloških procesa je spektar fotobiološkog delovanja – zavisnost fotobiološkog efekta od talasne dužine delujuće svetlosti. Akcioni spektri omogućavaju da se odredi koja oblast spektra najefikasnije izaziva biološki proces, kao i da se otkrije mehanizam takvog efekta.
Lekaru je potrebno razumevanje ovih procesa kako bi objasnio mehanizam vida (videti 29.10) i procenio različite efekte UV zračenja (videti 27.7).
Nakon što je apsorbirao kvant svjetlosti (vidjeti 29.2), molekul se pobuđuje. Energija pobude može se prenijeti na druge molekule. Za fotobiološki proces je bitno da se kao rezultat takve ekscitacije dogodi hemijska transformacija (fotokemijska reakcija). Nakon primarnog fotohemijskog čina, reakcije se razvijaju tako da prisustvo svjetlosti nije neophodno (mračne reakcije), na kraju dovode do odgovora biološkog sistema na svjetlost.
Razmotrimo kvantitativno početne faze ovog procesa: apsorpciju svjetlosti i primarnu fotohemijsku reakciju.
Slično kao u 29.2, uvodimo koncept efektivnog presjeka apsorpcije fotonskog molekula σ. Razlika u odnosu na izvođenje Bouguer-Lambert-Beerovog zakona je barem sljedeća: prvo ćemo uzeti u obzir smanjenje broja aktiviranih molekula, budući da izlaganje svjetlosti uzrokuje njihovu transformaciju; drugo, razmotrite dovoljno tanak sloj razrijeđenog rastvora, to će nam omogućiti da očitamo intenzitet svjetlosti I 0 konstantan i isti kroz cijelo rješenje.
Elementarno smanjenje koncentracije dn molekula pod djelovanjem svjetlosti proporcionalno je:
Koncentracije n molekule;
Efektivni presjek apsorpcije σ;
Vrijeme ozračivanja dt;
Broj fotona koji u jedinici vremena prođu kroz 1 m 2 površine ćelije (I 0):

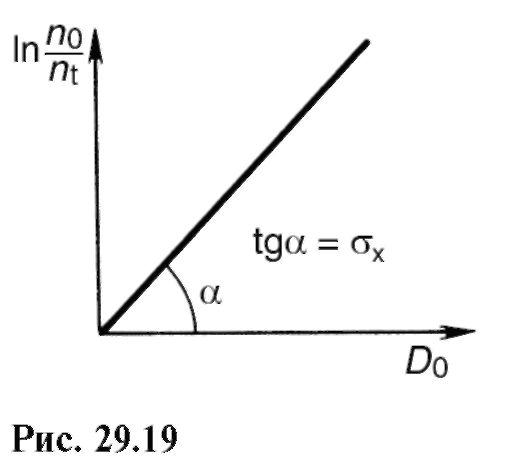
Evo I 0 t = D0- doza zračenja, i σφ χ = σ χ - površina poprečnog presjeka molekule za fotokemijsku transformaciju, proporcionalna je vjerovatnoći takve interakcije fotona s molekulom, uslijed koje će doći do fotokemijske reakcije .
Da biste pronašli φ χ, nacrtajte zavisnost ln (" 0 / n t) = f(D0) i duž nagiba prave linije [vidi (29.24)] odredite ovu vrijednost (slika 29.19).
U fotohemiji, zavisnost σ χ (λ) naziva se akcijski spektar. Ovaj odnos se može pronaći pomoću odnosa σ χ = σφχ . Poenta je da kvantna
Ukupni prinos fotohemijskih reakcija u rastvorima ne zavisi od talasne dužine svetlosti koja deluje (φ χ = const). Fizički, to znači da će bez obzira na energiju pobude hv, molekul biti pobuđen (vidjeti 28.9) i moći će započeti fotokemijsku transformaciju. Uzimajući ovo u obzir, možemo zaključiti da spektar djelovanja σ χ (λ) i spektar apsorpcije (vidi 29.2) - ovisnost σ (λ) - imaju isti oblik, jer se razlikuju samo po konstantnom faktoru φ χ . Takve
Ova karakteristika omogućava da se upoređivanjem spektra fotobiološkog delovanja sa spektrima apsorpcije različitih biohemijskih jedinjenja utvrdi mehanizam delovanja svetlosti, a posebno UV zračenja.
Tako je, na primjer, utvrđeno da je krivulja smrti bakterija pod djelovanjem UV zračenja (spektar fotobiološkog djelovanja) slična spektru apsorpcije nukleinskih kiselina. To je dalo osnovu za zaključak da je smrt bakterija posljedica oštećenja nukleinskih kiselina.
U 26.4 razmatrane su karakteristike dijela oka koji provodi svjetlo. Percepcija svjetlosti okom je fotobiološki proces, stoga se ovdje razmatra mehanizam rada aparata za percepciju svjetlosti.
29.10. BIOFIZIČKE OSNOVE VIZUELNE RECEPCIJE
Vizualne ćelije osetljive na svetlost - štapići i čunjevi - igraju različite uloge u pobuđivanju svetlosnog senzacija. Štapovi su osjetljiviji na svjetlost, ali ne razlikuju boje. Češeri razlikuju boje; osim toga, uz dovoljnu svjetlinu objekta, osjetljivi su na percepciju detalja slike, pa je rezolucija oka posljedica postavljanja čunjića na mrežnicu (vidi 26.4).
Štapovi pripadaju aparatu sumraka i akromatskog vida, a čunjevi - dan i boju.
Razmotrite prvo neka opća pitanja o osjetljivosti oka na svjetlost i boju.
Osetljivost oka na svetlost je recipročna vrednost praga osvetljenosti, tj. minimalna svjetlina koja stvara vizualni osjećaj pod datim uvjetima gledanja.
Svjetlosna osjetljivost oka varira u širokom rasponu zbog vida adaptacija- sposobnost oka da se prilagodi različitim svjetlinama. Adaptacija se vrši na sljedeće načine:
1) promenom prečnika zenice u rasponu od 2 do 8 mm, čime se svetlosni tok menja za 16 puta;
2) smanjenje koncentracije nerazložene fotosenzitivne supstance;
3) zaklanjanje čunjeva i štapića tamnim pigmentom smeštenim u žilnici i sposobnim da se pomera prema staklastom telu u procesu adaptacije;
4) promena stepena učešća štapića i čunjeva u pobudi svetlosnog osećaja, u zavisnosti od osvetljenosti objekta.
Adaptacija omogućava oku da normalno funkcionira u rasponu svjetline od 10 -7 do 10 5 cd/m 2 . Donja granica, odnosno apsolutni prag svjetlosne osjetljivosti oka s potpunom adaptacijom na tamu, je oko sto fotona u sekundi. Od toga, samo oko 10% se apsorbira od strane molekula vizualnog pigmenta u retinalnim štapićima, a ostatak se reflektira od rožnice, apsorbira optički medij oka, ili prolazi kroz mrežnicu i apsorbira se u stanicama pigmentnog epitela. . Prisutnost pigmentnog epitela ispod mrežnice značajno smanjuje refleksiju i raspršivanje svjetlosti sa stražnje stijenke oka. Ljudsko oko reaguje na elektromagnetne talase talasne dužine od približno 400 do 760 nm. Spektralnu osjetljivost oka karakterizira vidljivost radijacije:

Maksimum krivulje vidljivosti dnevnog vida odgovara maksimumu sunčevog zračenja koje je prošlo kroz atmosferu i pogodilo površinu Zemlje (vidi 27.4), što pokazuje svrsishodnost organizacije ljudskog oka.
Štap se sastoji (sl. 29.21) od vanjskog segmenta osjetljivog na svjetlost 1 i domaćem segmentu 2, koji sadrže jezgro i mitohondrije, koji osiguravaju funkcionisanje ćelije. Unutar vanjskog segmenta su tanki diskovi 3 oko 6 µm u prečniku. Svaki disk se sastoji od dvoslojne membrane i ima oblik spljoštenog liposoma (vidjeti 13.1). Vizualni pigment je ugrađen u vizuelne diskove.

![]()
ment - rodopsin. Broj diskova u jednoj ćeliji mjeri se u nekoliko stotina. Iz unutrašnjeg segmenta postoji veza sa nervnim vlaknom.
Rodopsin je složen protein molekulske težine oko 40 000. Promjer njegovog molekula je 4 nm, ako se njegov oblik uzme kao sferni.
Rodopsin se sastoji od proteina opsina i grupe hromofora - retinala.
Retinal, općenito govoreći, može imati nekoliko prostornih izomera, ali samo P-cisretinal se vezuje za opsin (slika 29.22). Pod dejstvom svetlosti, retinal se odvaja od rodopsina i prelazi u najstabilniju konformaciju kontinuiranog trans izomera.
Kao rezultat promjena u strukturi retine, nastaju promjene na membrani diska povezane s promjenom položaja rodopsina. Rodopsin prelazi sa interdiskalne hidrofilne površine u unutrašnju žirofobnu fazu membrane.
Ako je u mraku membrana diska nepropusna za Na+, K+, Ca 2+, itd., tada kao rezultat osvjetljenja, konformacijska promjena rodopsina dovodi do promjene stanja membrane: propusnost za neke ione se povećava . U ovim procesima, funkcija rodopsina je da pod dejstvom svetlosti pospešuje stvaranje pora u diskovima za neke jone i zatvara kanale na spoljnoj membrani za jone natrijuma. To dovodi do pojave potencijala koji izazivaju nervni impuls. Karakteristika vanjskih segmenata štapića retine je da u mraku potencijal ima natrijevu prirodu, za razliku od potencijala drugih stanica (vidi 13.7). Kao rezultat promjene strukture rodopsina pod djelovanjem svjetlosti, propusnost membrana za natrij naglo opada, a za druge ione ne.
se mijenja. U ovom slučaju, propusnost za kalij dolazi na prvo mjesto, potencijal postaje kalijumske prirode i mijenja se njegov polaritet. To dovodi do činjenice da, za razliku od svih drugih poznatih stanica, na citoplazmatskoj membrani vanjskih segmenata štapića potencijal ima znak plus iznutra i znak minus izvana.
Pigment češera također sadrži P-cisretinal, poput rodopsina, ali je proteinski dio pigmenta drugačiji, pa se pigmenti čunjeva nazivaju jodopsini.
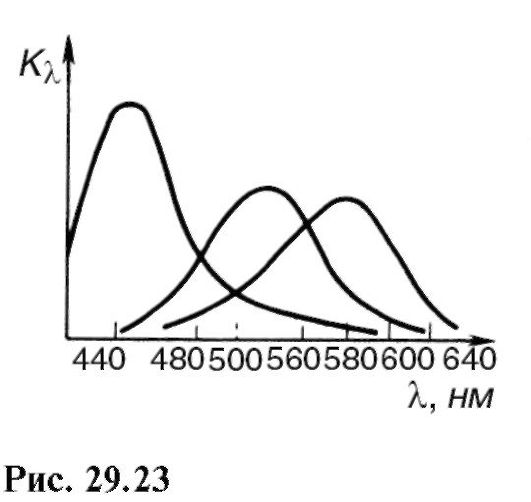
Mjerenje spektra apsorpcije pojedinih varijanti čunjeva pokazalo je da svaki konus sadrži određenu vrstu jodo-psina. Ljudski konusni jodopsini imaju maksimume apsorpcije na 445, 535 i 570 nm (slika 29.23). Ove informacije su zasnovane na trokomponentnoj teoriji vida boja. Kod nekih genetskih bolesti poremećena je sinteza proteina jodopsina i oko ne može razlikovati crvenu i zelenu boju (sljepilo za boje).
§ 6 Apsorpcija.
Spontano i stimulisana emisija
U normalnim uslovima (u odsustvu spoljašnjih uticaja), većina elektrona u atomima je na najnižem nepobuđenom nivou E 1 , tj. atom ima minimalnu količinu unutrašnje energije, preostali nivoi E 2 , E 3 ....E
n koji odgovaraju pobuđenim stanjima, imaju minimalnu populaciju elektrona ili su uopće slobodni. Ako je atom u osnovnom stanju sa E 1 , zatim pod djelovanjem vanjskog zračenja dolazi do prisilnog prijelaza u pobuđeno stanje s E 2. Vjerovatnoća takvih prijelaza je proporcionalna gustoći zračenja koje uzrokuje ove prijelaze.
Atom, koji je u pobuđenom stanju 2, može nakon nekog vremena spontano spontano (bez vanjskih utjecaja) preći u stanje sa nižom energijom, dajući višak energije u obliku elektromagnetno zračenje, tj. emituje foton.
Proces emisije fotona od strane pobuđenog atoma bez ikakvih vanjskih utjecaja naziva se spontana (spontana) emisija.Što je veća vjerovatnoća spontanih prijelaza, kraći je prosječni životni vijek atoma u pobuđenom stanju. Jer spontane tranzicije su, dakle, međusobno nepovezane spontana emisija nije koherentna.
Ako je atom u pobuđenom stanju 2 izložen vanjskom zračenju sa zadovoljavajućom frekvencijomhn = E 2 - E 1 , tada dolazi do prisilnog (indukovanog) prijelaza u osnovno stanje 1 uz emisiju fotona iste energijehn = E 2 - E jedan . U takvoj tranziciji dolazi do zračenja atoma dodatno na foton pod kojim je došlo do prijelaza. Zračenje koje nastaje vanjskim izlaganjem naziva se prisiljen. Dakle, u proces stimulisana emisija uključena su dva fotona: primarni foton koji uzrokuje emisiju zračenja pobuđenog atoma i sekundarni foton koji emituje atom. Sekundarni fotoni nerazlučiv od osnovne.
Einstein i Dirac su dokazali da je stimulirana emisija identična stimulativnoj emisiji: imaju istu fazu, frekvenciju, polarizaciju i smjer širenja.Þ Stimulirana emisija strogo koherentno sa prinudnom emisijom.
Emitirani fotoni, krećući se u jednom smjeru i susrećući druge pobuđene atome, stimuliraju dalje inducirane prijelaze, a broj fotona raste poput lavine. Međutim, zajedno sa stimuliranom emisijom, doći će do apsorpcije. Stoga je za pojačanje upadnog zračenja neophodno da broj fotona u stimulisanim emisijama (koji je proporcionalan populaciji pobuđenih stanja) bude veći od broja apsorbovanih fotona. U sistemu su atomi u termodinamičkoj ravnoteži, apsorpcija će prevladati nad stimulisanom emisijom, tj. Upadno zračenje će biti oslabljeno dok prolazi kroz materiju.
Da bi medij pojačao zračenje koje na njega upada, potrebno je stvoriti neravnotežno stanje sistema, pri čemu je broj atoma u pobuđenom stanju veći nego u osnovnom stanju. Takva stanja se nazivaju države sa populacijska inverzija. Proces stvaranja neravnotežnog stanja materije naziva se pumped. Pumpanje se može vršiti optičkim, električnim i drugim metodama.
U medijima sa invertiranom populacijom, stimulisana emisija može premašiti apsorpciju, tj. upadno zračenje će se pojačati pri prolasku kroz medij (ovi mediji se nazivaju aktivnim). Za ove medije u Bouguerovom zakonuI = I 0e- ax , koeficijent apsorpcije a - negativan.
§ 7. Laseri - optički kvantni generatori
Početkom 60-ih stvoren je kvantni generator optičkog opsega - laser “ Pojačanje svjetlosti stimuliranom emisijom zračenja ” - pojačanje svjetlosti indukovanom emisijom zračenja. Osobine laserskog zračenja: visoka monohromatnost (ekstremno visoka frekvencija svetlosti), oštra prostorna orijentacija, ogromna spektralna svetlost.
Prema zakonima kvantne mehanike, energija elektrona u atomu nije proizvoljna: može imati samo određeni (diskretni) raspon vrijednosti E 1, E 2, E 3 ... E n pozvao nivoi energije. Ove vrijednosti su različite za različite atome. Skup dozvoljenih energetskih vrijednosti se zove energetski spektar atom. U normalnim uslovima (u odsustvu spoljašnjih uticaja) većina elektrona u atomima je na najnižem pobuđenom nivou E 1, tj. atom ima minimalnu količinu unutrašnje energije; ostali nivoi E 2 , E 3 ..... E n odgovaraju višoj energiji atoma i nazivaju se uzbuđen.
Tokom prelaska elektrona sa jednog energetskog nivoa na drugi, atom može emitovati ili apsorbovati elektromagnetne talase čija je frekvencija n m n \u003d (E m - E n) h,
gdje h - Plankova konstanta ( h = 6,62 10 -34 J s);
E n - finale, E m - Prvi nivo.
Pobuđeni atom može se odreći dijela svoje viška energije, primljene iz vanjskog izvora ili stečene od njega kao rezultat toplinskog kretanja elektrona, na dva različita načina.
Svako pobuđeno stanje atoma je nestabilno i uvijek postoji mogućnost njegovog spontanog prijelaza u niže energetsko stanje uz emisiju kvanta elektromagnetnog zračenja. Takav prelaz se zove spontano(spontano). Nepravilan je i haotičan. Svi obični izvori proizvode svjetlost spontanom emisijom.
Ovo je prvi mehanizam emisije (elektromagnetno zračenje). U recenziranom dvostepena šema emisijom svjetlosti, ne može se postići pojačanje zračenja. Apsorbovana energija h n oslobođen kao kvant sa istom energijom h n i možete pričati o tome termodinamička ravnoteža: procesi pobuđivanja atoma u gasu su uvek uravnoteženi obrnutim procesima emisije.

§2 Šema na tri nivoa
U atomima tvari u termodinamičkoj ravnoteži, svaki sljedeći pobuđeni nivo sadrži manje elektrona od prethodnog. Ako na sistem djelujemo uzbudljivim zračenjem čija frekvencija pada u rezonanciju s prijelazom između nivoa 1 i 3 (šematski 1→ 3), tada će atomi apsorbirati ovo zračenje i preći sa nivoa 1 na nivo 3. Ako je intenzitet zračenja dovoljno visok, onda broj atoma koji su prešli na nivo 3 može biti prilično značajan, a mi, narušivši ravnotežu distribucija populacija nivoa, povećaće populaciju nivoa 3 i samim tim smanjiti populaciju nivoa 1.
Sa gornjeg trećeg nivoa mogući su prijelazi 3→ 1 i 3 → 2. Ispostavilo se da je prelaz 3→ 1 dovodi do emisije energije E 3 -E 1 = h n 3-1 , i prijelaz 3 → 2 nije radijativna: dovodi do populacije "odozgo" srednjeg nivoa 2 (dio energije elektrona se predaje supstanci tokom ove tranzicije, zagrijavajući je). Ovaj drugi nivo se zove metastabilan, te će kao rezultat na njemu biti više atoma nego na prvom. Pošto atomi stižu na nivo 2 sa nivoa 1 preko gornjeg stanja 3, i vraćaju se nazad na nivo tla sa „velikim zakašnjenjem“, tada je nivo 1 „iscrpljen“.
Kao rezultat toga, postoji inverzija, one. inverzna inverzna distribucija populacija nivoa. Populaciona inverzija energetskih nivoa je stvorena intenzivnim pomoćnim zračenjem tzv zračenje pumpe i na kraju dovodi do inducirano(prisilno) množenje fotona u inverznom mediju.
Kao iu svakom generatoru, iu laseru je potrebno da bi se dobio način generiranja Povratne informacije. U laseru se povratna informacija implementira pomoću ogledala. Pojačavajući (aktivni) medij se postavlja između dva ogledala - ravna ili češće konkavna. Jedno ogledalo je napravljeno čvrsto, drugo je delimično providno.
“Sjeme” za proces generiranja je spontana emisija fotona. Kao rezultat kretanja ovog fotona u mediju, on stvara lavinu fotona koji lete u istom smjeru. Došavši do prozirnog ogledala, lavina će se delimično reflektovati, a delimično će proći kroz ogledalo napolje. Nakon refleksije od desnog ogledala, val se vraća nazad, nastavljajući da jača. Hodanje na daljinul, stiže do lijevog ogledala, reflektira se i opet juri ka desnom ogledalu.
Takvi uslovi se stvaraju samo za aksijalne talase. Kvanti drugih pravaca nisu u stanju da preuzmu primjetan dio energije pohranjene u aktivnom mediju.
Talas koji izlazi iz lasera ima gotovo ravan front i visok stepen prostorne i vremenske koherentnosti po cijelom poprečnom presjeku snopa.
U laserima se kao aktivni medij koriste različiti plinovi i mješavine plinova ( gasni laseri), kristali i stakla sa primesama određenih jona ( solid state laseri), poluprovodnici ( poluprovodnički laseri).
Metode pobude (u pumpnom sistemu) zavise od vrste aktivnog medija. Ovo je ili metoda prijenosa energije pobuđivanja kao rezultat sudara čestica u plazmi plinskog pražnjenja (gasni laseri), ili prijenos energije zračenjem aktivnih centara nekoherentnom svjetlošću iz posebnih izvora (optičko pumpanje u laserima u čvrstom stanju), ili ubrizgavanje neravnotežnih nosača kroz p- n - tranzicija, bilo pobuđivanje elektronskim snopom, ili optičko pumpanje (poluprovodnički laseri).
Trenutno je stvoren izuzetno veliki broj različitih lasera koji proizvode zračenje u širokom rasponu valnih dužina (200¸ 2 10 4 nm). Laseri rade sa vrlo kratkim svetlosnim impulsima. t » 1·10 -12 s takođe može dati kontinuirano zračenje. Gustina fluksa energije laserskog zračenja je oko 10 10 W/cm 2 (intenzitet Sunca je samo 7·10 3 W/cm 2).
Do sada je neutrino bio vrlo sličan fotonu. Poput fotona, neutrino je nenabijen, nema masu i uvijek putuje brzinom svjetlosti. Obe čestice imaju spin. Spin fotona je +1 ili -1, dok je spin neutrina +1/2 ili -1/2 (razlika nije značajna). Ipak, postoji zanimljiva, pa čak i iznenađujuća razlika između njih, koju će nam sljedeće rezonovanje pomoći da shvatimo.
Hajde da pratimo dva događaja obrnuta u vremenu. Neka osoba koja drži loptu baci je, recimo, na jug. Ako se lopta približi osobi, krećući se u suprotnom smjeru, osoba podiže ruku i hvata je. U prvom slučaju, slijed događaja je bio: 1) osoba drži loptu, 2) osoba baca loptu, 3) lopta leti prema jugu. Vremenski obrnuto kretanje imalo je drugačiji slijed događaja: 1) lopta leti na sjever, 2) osoba hvata loptu, 3) osoba drži loptu. Sve ovo jako podsjeća na film koji se prvo skroluje u jednom, a zatim u suprotnom smjeru.
Pokušajmo ovaj princip prenijeti u subatomski svijet. Ako elektron u atomu prijeđe iz pobuđenog stanja u manje pobuđeno stanje, on emituje foton vidljive svjetlosti čija valna dužina ovisi o razlici energije između dva pobuđena stanja atoma. Isti atom može apsorbirati ili "uhvatiti" foton s potpuno istom talasnom dužinom, a elektron će prijeći iz manje pobuđenog stanja u više pobuđeno stanje. Svaki tip atoma emituje fotone određenih talasnih dužina (u zavisnosti od energije njegovih pobuđenih stanja) i, pod pravim uslovima, apsorbuje fotone sa potpuno istim talasnim dužinama.
Ipak, razlika između direktnog i vremenski obrnutog događaja nije samo promjena smjera i slijeda. Uhvatiti loptu je teže nego baciti. Bacanjem lopte pokrećete nepokretni predmet, a sve zavisi samo od vas. Sa svojim vremenom možete bolje uzeti loptu, pažljivo ciljati itd. Kada uhvatite loptu, morate imati posla sa predmetom koji se kreće i nema vremena za zijevanje. Kako se lopta približava, mora se brzo uhvatiti, jer će lopta ostati na dohvat ruke djelić sekunde. U tom deliću sekunde trebalo bi da imate vremena da ispružite ruku tačno u pravcu lopte i zaustavite je. Ako promašite, lopta će proletjeti.
Ista stvar se dešava sa atomom koji emituje foton. Takav atom emituje foton u vremenu koje je u prosjeku oko 10 -8 sec. Shodno tome, atom, da tako kažemo, upravlja svojim vremenom i emituje foton kada mu to odgovara.
Da bi apsorbirao isti foton, atomu je potrebno 10 -8 sec,što je prirodna posledica reverzibilnosti događaja. Ali atom ne može apsorbirati foton bez mnogo problema. Foton se kreće brzinom svjetlosti i ne ostaje blizu atoma tokom cijelog vremenskog intervala 10 -8 sec. Za takav vremenski period foton svjetlosti preleti u prosjeku 300 cm. Neki fotoni mogu putovati veću udaljenost, drugi manje. Jasno je zašto je atomima obično vrlo teško uhvatiti fotone: na kraju krajeva, veličina atoma je mnogo manja od ove udaljenosti! (Slično, košarkaši teško hvataju lopte koje idu prebrzo.) Međutim, slučajno, atom može uhvatiti i apsorbirati foton.
Sve gore navedeno pretpostavlja da foton nema intrinzične dimenzije; iako je zapravo prilično velika. Tipičan foton vidljive svjetlosti ima talasnu dužinu od oko 1/20 000 cm. Na ovoj dužini oko hiljadu atoma stane u niz. Foton vidljive svjetlosti može se zamisliti kao neka vrsta sfere, čiji je prečnik hiljadu puta veći od prečnika atoma, a zapremina je 1.000.000.000 puta veća od zapremine atoma. U svakom trenutku, foton svjetlosti dolazi u kontakt sa oko milijardu atoma, od kojih ga jedan uspijeva uhvatiti i apsorbirati.
Stoga dubina do koje foton prodire u materiju prije apsorpcije nije 300 cm, i milijardu puta manje, tj. 3 10 -7 cm.
Na ovoj udaljenosti ne stane više od 10-15 atoma u nizu. To znači da foton svjetlosti prije trenutka apsorpcije prodire u tvar ne dublje od 10-15 atomskih slojeva. Debljina od 10-15 atoma je sitnica na običnim skalama, tako da je većina čvrstih materija, čak i u obliku tankih filmova, neprozirna za svjetlost (iako se zlatna folija može napraviti tako tanka da postane prozirna).
Što je valna dužina svjetlosti kraća, foton je manji, to je manje atoma u kontaktu s njim u bilo kojem trenutku i, prema tome, duže putuje kroz materiju prije nego što se apsorbira. Iz tog razloga ultraljubičasto svjetlo prodire u ljudsku kožu dublje od vidljive svjetlosti; rendgenski zraci slobodno prolaze kroz meka tkiva tijela i zaustavlja ih samo gušća koštana supstanca; a?-zraci prodiru u gustu materiju na mnogo centimetara. (Naravno, vidljiva svjetlost putuje znatnu udaljenost u supstancama kao što su staklo ili kvarc, da ne spominjemo većinu tekućina, ali to su sve odvojena razmatranja.)
Apsorpcija neutrina
Pokušajmo sada iskoristiti sve navedeno u odnosu na neutrine i antineutrine. Napišimo još jednom reakciju raspada neutrona, koja rezultira stvaranjem protona, elektrona i antineutrina:
P> p++ e -+ "?.
Pretpostavimo da je, pod odgovarajućim uslovima, moguć obrnuti proces, u kojem proton, hvatajući elektron i antineutrino, postaje neutron. Tada bi povratna informacija izgledala ovako:
p++ e -+ "? > P.
Naravno, proton mora uhvatiti elektron i antineutrino u isto vrijeme, što uvelike smanjuje vjerovatnoću uspješan završetak proces. (Ovo je ekvivalentno traženju od košarkaša da jednom rukom uhvati dvije lopte u isto vrijeme, leteći na njega iz različitih smjerova.)
Da bismo pojednostavili zadatak, mijenjamo redoslijed pozivanja. Svaki proces koji apsorbira elektron može se zamijeniti procesom koji proizvodi pozitron. (Slično pravilo postoji u algebri: oduzimanje -1 je isto kao i dodavanje +1.) Drugim riječima, umjesto da istovremeno apsorbira elektron i antineutrino, proton može apsorbirati antineutrino i emitovati pozitron:
p++ "? > n + "e+.
Kod ove varijante reakcije zakoni održanja su zadovoljeni. Budući da je proton zamijenjen neutronom (oba s barionskim brojem +1), a antineutrino zamijenjen pozitronom (oba s leptonskim brojem -1), vrijede zakoni održanja bariona i leptonskog broja.
Ostaje da se razmotri vjerovatnoća apsorpcije antineutrina protonom. Poluživot neutrona je 12,8 min, iako je pojedinačnim neutronima potrebno više ili manje od 12,8 za raspad min. Shodno tome, za formiranje neutrona kada antineutrino uhvati proton i emituje pozitron, u prosjeku je 12,8 min. Drugim riječima, antineutrino apsorbira proton u prosjeku za 12,8 min.
Ali neutrini putuju brzinom svjetlosti i za 12,8 min pređe put od 2,3 10 8 km(tj. putanja približno jednaka udaljenosti od Sunca do Marsa). Teško je povjerovati da antineutrino može prijeći tako veliku udaljenost u čvrstoj tvari prije nego što se apsorbira, čak i ako pretpostavimo da je njegov volumen jednak volumenu fotona. Ali u stvari, antineutrini su mnogo manji od atoma.
U stvarnosti je situacija mnogo komplikovanija.U slučaju fotona apsorpcija se dešava zbog elektrona koji zauzimaju veliki deo zapremine atoma, a u čvrstoj materiji atomi su tijesno jedni uz druge. Antineutrine apsorbiraju protoni smješteni u atomskim jezgrama, koji zauzimaju neznatan dio atoma. Antineutrini lete solidan, vrlo rijetko se sudara sa sićušnim jezgrom. Samo stomilioni deo vremena kada se antineutrino nalazi unutar atoma, toliko je blizu protona da ga ovaj može uhvatiti. Stoga, da bi antineutrino imao određenu šansu da ga uhvati proton, mora proći put u čvrstoj materiji sto miliona puta duži od 230.000.000 km. Utvrđeno je da, u prosjeku, antineutrino mora preći oko 3500 svjetlosnih godina u olovu prije nego što se apsorbira.
Naravno, nigdje u svemiru nema sloja olova debljine 3.500 svjetlosnih godina. Univerzum se sastoji od pojedinačnih zvijezda, izuzetno rijetko raspoređenih u prostoru, a prečnik svake zvijezde je mnogo manji od milionitog dijela svjetlosna godina. Većina zvijezda je napravljena od materije mnogo manje gustoće od olova. Izuzetak je supergusta materija relativno malog zvjezdanog jezgra. (Postoje i superguste zvijezde u Univerzumu, ali one su vrlo male - ne više planeta.) Ali čak ni supergusti dijelovi zvijezda ne mogu zaustaviti antineutrine. Leteći kroz Univerzum u bilo kom pravcu, antineutrini vrlo retko prolaze kroz zvezdu, a još ređe kroz njeno supergusto jezgro. Ukupna debljina zvjezdane materije kroz koju prolazi antineutrino, leteći s jednog kraja vidljivog svemira na drugi, mnogo je manja od jedne svjetlosne godine.
Sve što je ovdje rečeno o antineutrinima vrijedi, naravno, i za neutrine, pa se stoga može tvrditi da se neutrini i antineutrini praktički ne apsorbiraju. Jednom kada su nastali u nekom subatomskom procesu, oni se zauvek kreću i nisu podložni nikakvim promenama i uticajima svega oko sebe. S vremena na vrijeme se apsorbuju, ali je broj apsorbiranih neutrina zanemarljiv u odnosu na ogroman broj već postojećih i novonastalih. Savremeno znanje nam omogućava da sa sigurnošću kažemo da praktično svi neutrini i antineutrini koji su nastali tokom života Univerzuma postoje do danas.
Kako su uhvatili antineutrino?
Gornji zaključak nije bio baš dobra vijest. Koliko god fizičar iz zakona održanja izvodio zaključak o nužnosti postojanja neutrina i antineutrina, bio bi istinski srećan tek kada bi zaista otkrio sićušne čestice direktnim posmatranjem. Ali da bi dokazao njihovo postojanje, on prvo mora uhvatiti barem jednu česticu, odnosno natjerati je u interakciju s nekom drugom česticom kako bi se mogao detektirati rezultat te interakcije. A kako je zapravo bilo nemoguće uhvatiti neutrine ili antineutrine, postojala je ozbiljna sumnja u stvarnost njihovog postojanja!
Kao rezultat toga, fizičar je sačuvao svoje razumevanje strukture univerzuma, koje se razvijalo tokom tri veka, insistirajući na postojanju nečega što se mora uzeti zdravo za gotovo. On je dokazao postojanje neutrina na osnovu svojih teorija i spasio svoje teorije tvrdnjom o postojanju neutrina. Ispostavilo se " začarani krug". Razlozi za sumnju i neizvjesnost su ostali. Bilo je izuzetno važno razviti neku metodu detekcije neutrina ili antineutrina, ako je ikako moguće.
Proboj u gotovo neprobojnom oklopu neuhvatljivog neutrina bio je probijen riječju "prosječno". Rekao sam da prije nego što se apsorbira, antineutrino u prosjeku prolazi kroz sloj čvrstog olova debljine 3.500 svjetlosnih godina. Ali to je samo prosjek. Neki antineutrini mogu krenuti kraćim putem, drugi dužim, a samo nekoliko će ići u apsorpciju ili vrlo malu ili vrlo velika udaljenost. Stoga je potrebno fokusirati se na beskonačno mali dio antineutrina koji se apsorbira u takvoj debljini materije (recimo, nekoliko metara) koju je lako stvoriti u laboratoriju. Da bi ovaj beskonačno mali procenat sadržao što više antineutrina, potrebno je imati veoma moćan izvor ovih čestica. Tako moćan izvor antineutrina je nuklearni reaktor. Višak neutrona proizveden u reaktoru prije ili kasnije se raspada na protone, elektrone i antineutrine. Kada reaktor radi punim kapacitetom, kontinuirano se proizvodi ogroman broj antineutrina. Godine 1953. grupa američki fizičari, na čelu sa Clydeom Cowanom i Frederickom Reinesom, započeo je eksperimente na registraciji antineutrina. Koristili su nuklearni reaktor u rijeci Savannah, u Južnoj Karolini, kao izvor čestica. Ovaj reaktor je emitovao oko 10 18 antineutrina svake sekunde.
Rice. 7. Detekcija antineutrina.
Za tako bezbroj antineutrina, bilo je potrebno stvoriti metu bogatu protonima. Najjednostavniji prirodni cilj je voda. Svaki molekul vode sastoji se od dva atoma vodika, čija su jezgra protoni, i atoma kisika. Cowan i Reines su koristili pet rezervoara vode 1.9 m i širina 1.4 m. Debljina rezervoara je bila različita (slika 7). Dva tanka rezervoara visine 7,6 cm korišćeni kao meta. Tri druga rezervoara visine 60 cm služio kao detektor. Tenkovi su postavljeni sledećim redosledom: detektor - meta - detektor - meta - detektor. Voda u ciljnim rezervoarima sadržavala je malu količinu otopljenog kadmijum hlorida. Rezervoari detektora sadržavali su rastvor scintilatora, supstance koja emituje deo energije koju je primila kada apsorbuje subatomsku česticu u obliku kratkog praska svetlosti. Takav „dvostruki sendvič“ rezervoara nalazio se na putu antineutrinskog toka iz reaktora. Ostalo je samo čekati. Ako antineutrini zaista postoje, svakih dvadeset minuta (u prosjeku) jedan od njih bi trebao biti apsorbiran od strane protona. Ali tenkovi su bili izloženi kontinuiranom kosmičkom zračenju iz međuplanetarnog prostora, bombardovani česticama koje su emitovale male količine radioaktivnih supstanci u vazduhu, građevinski materijal, tlo. Čitava poteškoća je bila izdvojiti apsorpciju antineutrina na svim ovim pozadini događaja koji su se odvijali unutar rezervoara za vodu.
U početku je neželjena subatomska "šuma" spriječila detekciju apsorpcije antineutrina. Postepeno je stvorena sve efikasnija zaštita da se riješi neželjenog zračenja i čestica. Naravno, nikakva zaštita, nikakva debljina metala ili betona nisu mogli zaustaviti antineutrine, i na kraju se „buka“ smanjila na nivo koji više nije bio sakriven slabašnim „šapatom“ vrlo rijetkih antineutrina koje su slučajno uhvatili protoni. Ali ovaj šapat još nije bio identifikovan.
Kada antineutrino apsorbira proton, nastaju neutron i pozitron - kombinacija čestica koju je lako razlikovati. Čim se pozitron formira u jednom od ciljnih rezervoara, on stupa u interakciju sa elektronom za manje od jednog milionitog dela sekunde i nastaju dva fotona, od kojih svaki ima energiju od 0,51 MeV. Prema zakonu održanja impulsa, dva fotona se moraju raspršiti u potpuno suprotnim smjerovima: ako jedan od njih iz ciljnog spremnika uđe u gornji spremnik detektora, onda drugi mora pasti u donji spremnik detektora. U svakom rezervoaru za detekciju dolazi do bljeska svjetlosti. Ove bljeskove odmah automatski registruje stotinu ili više fotomultiplikatora koji se nalaze oko rezervoara za vodu.
Ali šta se dešava sa neutronom? Obično samo luta među molekulima vode (koje vrlo rijetko apsorbuju neutron), sudarajući se s njima dok se spontano ne raspadnu nakon prosječnih 12,8 min nakon njegovog nastanka. Međutim, nema smisla čekati tako dugo, jer se propadanje može dogoditi nekoliko minuta ranije ili kasnije. Tu u pomoć dolazi kadmijum hlorid u ciljnom rezervoaru. Neutron luta sve dok se ne sudari sa atomom kadmijuma, u kom trenutku se skoro trenutno apsorbuje. Ovo se dešava u roku od nekoliko milionitih delova sekunde nakon anihilacije pozitrona – period je prilično kratak, a ipak dovoljan da razdvoji dva događaja u vremenu: anihilaciju pozitrona i apsorpciju neutrona. Kada atom kadmija apsorbuje neutron, oslobađa se energija koja se odmah emituje u obliku tri ili četiri fotona sa ukupnom energijom od 9 Mev.
Dakle, Cowen i Reines su uočili sljedeću sliku: prvo, dva fotona sa energijom od 0,5 mev svaki, koje su registrovala dva fotomultiplikatora na suprotnim stranama rezervoara za vodu, a zatim nakon nekoliko milionitih delova sekunde, istovremena proizvodnja tri fotona sa energijom od 3 mev svaki (ponekad četiri fotona sa energijom od 2,25 mev svaki). Nijedna druga subatomska interakcija nije dovela do takvog slijeda događaja. A ako je upravo takav tok događaja registrovan, razumno je bilo zaključiti da proton apsorbuje antineutrino, dakle, antineutrino zaista postoji.
Ali onda se još jedna misao pojavila u opreznim umovima eksperimentatora. Ali šta ako takav slijed događaja nije uzrokovan jednom subatomskom interakcijom, već dvije?
Pretpostavimo da je na neki način stvoren pozitron i da je nakon nekoliko milionitih delova sekunde atom kadmijuma apsorbovao neutron koji je postojao nezavisno od pozitrona. U ovom slučaju, pojava dva, a zatim tri fotona bila bi rezultat ne jedne interakcije (antineutrino sa protonom), već dvije potpuno nepovezane interakcije. Kakvu interakciju su primijetili Cowan i Reines?
Eksperimentatori su problem riješili tako što su svoja mjerenja prvo izvršili dok je reaktor radio, a zatim i kada je bio isključen. Ako se reaktor isključi, buka će djelovati na spremnike, a njihovo bombardiranje strujom antineutrina će prestati. (Zapravo, u okolnom prostoru uvek ima antineutrina, ali je njihov broj mnogo manji od broja antineutrina u blizini reaktora koji radi.) Stoga, kada bi reaktor bio isključen, dvostruke koincidencije bi se nastavile beležiti, a apsorpcija antineutrina bi prestala.
Ispostavilo se da je s isključenim reaktorom zabilježeno 70 događaja dnevno manje nego s uključenim reaktorom. To znači da je dnevno apsorbovano i snimljeno 70 antineutrina (po jedan svakih dvadeset minuta). Rezultati eksperimenta mogli bi se smatrati nepobitnim dokazom, a 1956. je objavljeno da je, dvadeset pet godina nakon što je Pauli prvi put predvidio postojanje antineutrina, takva čestica konačno registrovana. Ovaj događaj se obično naziva "detekcija neutrina", iako je antineutrino detektovan. Međutim, nakon što su "uhvatili" antineutrino, fizičari vjeruju da je postojanje neutrina nesumnjivo.
Spektri višeelektronskih atoma
a . Zakon o očuvanju energije. Izraženo pravilom frekvencije Bora. (7.1)
Energija emitovanog (apsorbovanog) fotona jednaka je razlici između energija atoma koji emituje (apsorbuje).
b . Zakon održanja impulsa . Ona se manifestuje u da je slobodni atom u zračenju(apsorpcija)se odbija. Ako uzmemo impuls atoma mase m a prije emisije fotona iznad nule, tada u projekciji na smjer emisije fotona dobijamo jednakost:
![]() . (7.2)
. (7.2)
Znak minus označava da atom "odskače" u pravcu obrnuti smjer kretanje fotona. Kada se foton apsorbira, smjer brzine trzanja poklapa se sa smjerom kretanja fotona ![]() . (7.3)
. (7.3)
Brzina trzaja atoma tokom emisije svjetlosti u IR, vidljivom i UV opsegu je niska. Na primjer, atom vodika koji emituje foton ljubičaste serije Balmer With l= 410 nm, prima brzinu trzanja v x = hçm a l = 6,6 10 -34 ç (0,001 ç 6 10 23) 410 10 -9 = 1m ç With. To je 1000 puta manje od brzine toplotnog kretanja atoma.
Zbog trzaja, dio energije zračenja se odnosi na atom. Stoga, uzimajući u obzir trzaj, zakon održanja energije ima oblik: ![]() . (7.4)
. (7.4)
Energija trzanja atoma je vrlo mala. Za atom vodonika u gornjem primjeru ne prelazi 10 -8 energije fotona. Zbog trzaja atoma smanjuje se energija i frekvencija emitiranih fotona. U IR, vidljivom i UV opsegu, efekti koji se odnose na trzaj se obično zanemaruju zbog njihove male veličine. I samo u rendgenskom i gama - opsegu ovi efekti postaju značajni.
in . Zakon održanja ugaonog momenta . Kao što iskustvo pokazuje, fotoni, kao i elektroni, imaju obrtni mehanički moment L S, što je dvostruko veći spin mehanički impuls elektrona. U projekciji na smjer kretanja, spin ugaoni moment fotona može imati dvije vrijednosti, ħ. (7.5)
Emitujući ili apsorbujući foton, atom ne samo da daje ili prima energiju, već i mijenja svoj ugaoni moment za vrijednost koja je jednaka momentu gibanja fotona. Ova promjena može nastati kako zbog promjene konfiguracije elektronskog oblaka (promjena orbitalnog momenta elektrona), tako i zbog promjene orijentacije spina elektrona.
U prvom slučaju mi pričamo o promjena orbitalnog mehaničkog momenta elektrona po vrijednosti ħ , što odgovara promjeni azimuta kvantni broj l po jedinici. Iz ovoga dobijamo pravilo odabira (5.12), koje na taj način izražava zakon održanja ugaonog momenta.
Drugi način - preorijentacija spina elektrona takođe po veličini ħ . Ovaj put je malo verovatan. Dakle, prijelazi koji krše pravilo odabira D l = ± 1 u zemaljskim izvorima svjetlosti se praktično ne realizuju. Na primjer, prijelazi pobuđenog atoma vodika iz 2 s- u 1 s- stanje može nastati samo u vrlo razrijeđenoj solarnoj koroni ili u atmosferama zvijezda. Pobuđeni atomi ovdje ne doživljavaju sudare dugo vremena. Stoga se u njima ostvaruju i tako nevjerovatni prijelazi.
2. Spektri alkalnih metala više od ostalih elemenata slični su spektru vodonika. Atomi alkalnih metala su centralno simetrično jezgro s ljuskom inertnog plina i ukupnim nabojem od + e oko koje se kreće jedan elektron.
Alkalni metali čine glavnu podgrupu prve grupe tabele Mendeljejev. Sa njima počinju sve menstruacije. Od stabilnih elemenata ovo je litijum Li, Z= 3 (jezgro je jezgro sa helijumskom ljuskom, gornji elektron u nepobuđenom atomu je 2 s- stanje), natrijum Na, Z= 11 (jezgro je jezgro sa neonskom školjkom, elektron u 3 s- stanje), kalijum K , Z= 19 (jezgro je jezgro sa argonom ljuskom, elektron u 4 s- stanje), rubidijum Rb, Z= 37 (jezgro je jezgro sa kriptonskom školjkom, elektron u 5 s- stanje), cezij Cs, Z= 55 (jezgro je jezgro sa ksenonskom školjkom, elektron u 6 s- stanje).
Postoji nekoliko serija u spektrima alkalnih metala. Najvažnije od njih su 4: glavni, oštri, difuzni i glavni. Godine 1900 Johannes Rydberg pronađeno opšti oblik serijska formula za alkalne metale. 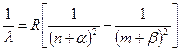 . (7.6)
. (7.6)
Evo n £ m– broj energetskih nivoa, a i b- ispravke koje imaju različita značenja za različite metale i za različite serije.
Razmotrimo, kao primjer, spektar natrijuma. Slika 44 prikazuje nivoe energije u atomu natrijuma i šeme elektronskih prelaza koji formiraju spektralne serije.
 a . Glavna serija
. Tako nazvan jer postoji ne samo u emisionim spektrima, već iu spektrima apsorpcije. Odgovara seriji Lyman u spektru vodonika. Za natrijum se opisuje formulom ( m= 3,4,5,…¥):
a . Glavna serija
. Tako nazvan jer postoji ne samo u emisionim spektrima, već iu spektrima apsorpcije. Odgovara seriji Lyman u spektru vodonika. Za natrijum se opisuje formulom ( m= 3,4,5,…¥):
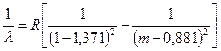 . (7.7)
. (7.7)
U spektru emisije, glavna serija nastaje kada elektron prođe iz str– navodi na glavnu 3 s- stanje. Linija glave ove serije (odnosno linija sa maksimalnom talasnom dužinom l, što odgovara minimalnoj vrijednosti broja m= 3) - karakteristična jarko žuta D- natrijum linija sa l=589 nm. Ovo je jedina linija ove serije u vidljivom asortimanu. Nastaje kada elektron prođe iz 3 str u 3 s- stanje unutar jednog energetskog sloja.
Sljedeća linija u ovoj seriji emituje se na prelazu 4 str 3s. Njena talasna dužina l=330nm je u UV opsegu. Granična talasna dužina glavne serije (linija na m = ¥) =241nm.
Zbog interakcije spin-orbita str– podnivo je energetski podeljen na dva. Stoga su spektralne linije glavne serije dubleti. Na primjer, linija glave glavne serije žutog natrijevog dubleta sastoji se od dvije linije sa l 1 = 589,6 nm i l 2 =589,0 nm.
Ne samo str- podnivo, ali i drugi viši d, f– podnivoi su energetski podijeljeni na dva. Stoga je multipletsko cijepanje u spektrima alkalnih metala prisutno iu drugim serijama.
Proučavanje spektra višeelektronskih atoma pokazalo je da je konstanta Rydberg R donekle raste sa povećanjem broja elemenata. Dakle, za vodonik R H\u003d 1,09678 10 7 m -1, za natrijum R Na\u003d 1,09735 10 7 m -1, a za najteže atome R Z > 20 \u003d 1,09737 10 7 m -1. Rast R javlja se uglavnom na početku periodnog sistema, a već sa hlorom Cl ( Z= 17) visina R praktično nevidljiv.
b . oštar
(oštar) serije
javlja se samo u spektar zračenja natrijum tokom tranzicije elektrona iz s- navodi u str- stanje (Sl. 44). Formula oštre serije za natrijum je: 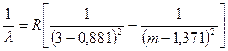 , m=4, 5, 6,… (7.8)
, m=4, 5, 6,… (7.8)
Zbog cijepanja na dvije komponente str– linije podnivoa oštre serije takođe predstavljaju dublete. Glava dublet serije ( m= 4) leži u IR području, l 1 = 1140 nm i l 2 = 1138 nm (prijelaz 4 s 3str). Prijelazni dublet 5 s 3str 616 i 615 nm spada u vidljivi domet. Prijelaz 6 s 3str odgovara liniji od 515 nm (cijepanje D l manje od 1 nm). Granična talasna dužina oštre serije = 408 nm. Dakle, sa izuzetkom vodeće linije, cela oštra serija je u vidljivom opsegu.
Kao što naziv govori, linije oštre serije su u kontrastu. To se objašnjava činjenicom da tokom emisije ove serije prolaze elektroni s- stanja koja nemaju podjelu energije. Pošto su elektroni udarili u dvije komponente str– podnivo, onda energija emitovanih fotona u dubletima oštrog niza ima istu razliku h D n za celu seriju. Razlika u frekvenciji D n između komponenti dubleta je konstantna. Izraženo u talasnim dužinama, razlika D l brzo se smanjuje kada se kreće prema ljubičastom kraju serije.
in . difuzno (difuzno) serije postoji samo u emisionom spektru i nastaje tokom prijelaza elektrona u dvostruki 3 str- podnivo takođe od dvostrukog nadslojavanja d- podnivoi (Sl. 44). Pravila odabira dozvoljavaju implementaciju samo tri od četiri opcije prijelaza. Dakle, svaka linija u nizu je trojka. Energetske udaljenosti između komponenti d– ima mnogo manje podnivoa u odnosu na udaljenost 3 str– podnivo. Zbog toga se u spektralnim uređajima nedovoljne razlučive moći komponente tripleta ne razlučuju, a cijeli triplet se percipira kao jedna zamućena (difuzna) linija. Formula difuzne serije za natrijum je:
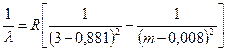 , m= 3, 4, 5,… (7.9)
, m= 3, 4, 5,… (7.9)
Glavna linija ove serije ( m= 3) ima dužinu l= 818 nm i nalazi se u bliskom IC opsegu. Emituje se tokom prelaza elektrona 3 d 3str unutar istog energetskog sloja. Kako broj raste m linije se emituju u vidljivom opsegu, l(m= 4) = 586 nm, l(m= 5) = 498 nm. Granična talasna dužina, kao u oštroj seriji, l(m= ¥) = 408 nm. Sa izuzetkom vodećih linija, obje serije - oštre i difuzne - su u vidljivom rasponu.
G . Main (Fundamentalno), fundamentalno serija je tako nazvana jer njena formula ima minimalne razlike od formule Balmer. Za natrijum
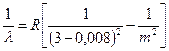 ,m= 4,5,6,… (7.10)
,m= 4,5,6,… (7.10)
Javlja se kada se elektron kreće od f– stoji u 3 d- stanje. Sve linije ove serije su u IR opsegu. Linija glave (4 f 3d) ima dužinu l= 1846 nm, sljedeće (5 f 3d) l= 1268 nm, granična linija ( m= ¥) l= 813 nm. Glavna serija u spektru natrijuma je vrlo slična seriji Pashen u spektru vodonika (1875 - 820 nm).
Korekcioni faktori a i b u formulama serije (7.6) opadaju kako raste energija nivoa. Da, nivo 3 s ima amandman 1.371, nivo 3 str– izmjena 0.881, nivo 3 d- korekcija 0,008. Iz ovoga možemo zaključiti da je nivo energije u atomu niži alkalni metal, što je bliže omotaču inertnog gasa, to je električno polje jezgra više deformisano, to se više razlikuje od Kulonovog polja atoma vodika. Osnovna serija je stoga toliko slična seriji Pashen u spektru atoma vodonika koji nivoi d i f nalazi daleko od jezgra atoma alkalnog metala.
3. Prirodna širina spektralnih linija. Emisija fotona u normalnim uslovima nastaje kada spontano(spontani) prijelaz atoma iz pobuđenog, odnosno energetski višeg, u energetski niže stanje. Vrijeme t, preko koje se smanjuje broj atoma u datom pobuđenom stanju e puta, zove se životni vijek uzbuđeno stanje. U većini slučajeva t»10 -8 10 -9 s. I samo unutra metastabilan stanja (nenormalno dugovječno) vrijeme t možda 10 -1 s.
Mogućnost spontanih prelaza ukazuje da se pobuđena stanja ne mogu smatrati striktno stacionarnim. Energija pobuđenog stanja nije precizno definisana. Iz relacije neizvjesnosti Heisenberg za energiju i vrijeme (3.3) slijedi da je energetska nesigurnost D E atom u pobuđenom stanju obrnuto je proporcionalan vremenu t : ħ, . (7.11)
Nesigurnost u energiji pobuđenog atoma dovodi do širenja energija fotona koje on emituje. . (7.12)
Prijeđimo iz frekvencijskog intervala D n na interval talasne dužine D l. Jer
![]() , zatim . (7.13)
, zatim . (7.13)
Za naslovne serije Balmer (l= 656,3 nm, t= 10 -8 s) ova širina je D l= 2,3 10 -5 nm. Moderni spektralni uređaji omogućavaju mjerenje ovoga prirodna širina spektralne linije.
Ako na grafikonu nacrtate ovisnost intenziteta svjetlosti I od talasne dužine l, tada se dobija simetrična zvonasta kriva. Na slici 45, takva kriva je prikazana za crvenu liniju kadmijuma Cd sa talasnom dužinom l= 643,8 nm. Postoji vrlo malo takvih zaista jednostavnih linija u ogromnoj raznolikosti spektra. Čak i za one linije koje se smatraju jednostavnim u shemi fine strukture (spin-orbitalna interakcija), višestrukost se nalazi sa povećanjem rezolucije.
4. Hiperfina struktura spektra. Takav dodatni hiperfina struktura može nastati iz dva razloga.
prvo, zbog mješovitog izotopskog sastava emitujućih atoma. Na primjer, prirodni vodonik se sastoji od mješavine dva izotopa - protia i deuterijum- u omjeru 5000:1. Spektralne linije deuterija su blago pomjerene u područje kraćih valnih dužina. U običnoj mješavini, linije deuterijuma su nevidljive. Ali ako se koncentracija deuterija u plinu poveća, onda svaka linija, na primjer, u nizu Balmer, dijeli se na dva. Ovo je izotopska višestrukost.
drugo, zbog prisustva atomsko jezgro mehanički i magnetni momenti. Magnetski moment jezgara je otprilike 1000 puta manji od orbitalnog magnetnog momenta elektrona. Ali, ipak, interakcija spin-orbitalnih momenata elektrona sa magnetnim momentom jezgra dovodi do višestrukosti, što se bilježi spektralnim uređajima visoke rezolucije. Na primjer, zelena linija Hg žive s talasnom dužinom l= 546,0724 nm, pored glavne linije, ima hiperfinu strukturu od šest linija, -0,0236, -0,0102, -0,0069, l= 546,0724 nm, +0,0085, +0,0128, +0,0214 nm.
5. Doplerovo proširenje spektralnih linija. Translacijsko kretanje zračećih atoma, zbog njihovog termičkog kretanja, dovodi do dodatnog proširenja spektralnih linija.
Frekvencija svjetlosti koju emituje atom koji se približava prijemniku zbog efekta Dopler nešto veći i jednak n 0+D n. Frekvencija svjetlosti iz atoma koji se povlači je nešto manja i jednaka n 0-D n. Evo n 0 je frekvencija svjetlosti koju emituje nepokretni atom. Kao rezultat, ista spektralna linija zbog kretanje napred atomi se proširuju na frekvencijski pojas ( n 0+D n) – (n 0-D n) = 2D n.
Iz optičke formule za longitudinalni efekat Dopler(Optika, f. 28.10) iz toga slijedi
![]() , gdje . (7.14)
, gdje . (7.14)
Dakle, . (7.15)
Relativno Doplerovo proširenje. (7.16)
Na sobnoj temperaturi, brzina toplinskog kretanja atoma vodika v= 2 10 3 m ç With. Odavde.
Doplerovo proširenje se pojavljuje već u znaku 5-6 frekvencije n ili talasne dužine l. Moderni spektralni uređaji omogućavaju mjerenje n ili l do 7-8 znakova. Stoga je termičko širenje spektralnih linija dobro izražen i često nepoželjan efekat. Da bi se to eliminisalo, potrebno je primijeniti takve metode pobuđivanja atoma koje se mogu realizirati na niskim temperaturama. Na primjer, luminiscencija(vidi §10).
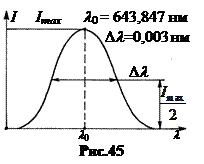
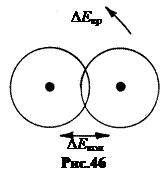 6. Molekularni spektri. Kombinacija atoma u molekulu dovodi do toga da, uz energiju elektronskog kretanja u atomima, molekula, kao složen sistem, ima energiju oscilatorno i rotaciono kretanje(Sl. 46). Po redu veličine, kvantni energetski koraci su najčešće raspoređeni na sljedeći način: D E email >D E broj >D E temp. Ovdje D E– koraci nivoa elektronske energije u atomu.
6. Molekularni spektri. Kombinacija atoma u molekulu dovodi do toga da, uz energiju elektronskog kretanja u atomima, molekula, kao složen sistem, ima energiju oscilatorno i rotaciono kretanje(Sl. 46). Po redu veličine, kvantni energetski koraci su najčešće raspoređeni na sljedeći način: D E email >D E broj >D E temp. Ovdje D E– koraci nivoa elektronske energije u atomu.
Najznačajniji uticaj na spektar koji emituje molekul ima oscilatorno kretanje. Budući da je energija unutarmolekularnog vibracijskog kretanja kvantizirana, u bilo kojoj zapremini plina postoje grupe molekula s istim vrijednostima energije vibracija D E kolon 1, D E kolona 2, D E kolona 3 itd. Kao rezultat iste elektronske tranzicije u atomu različite grupe molekuli odgovaraju fotonima različitih frekvencija n 1 , n 2 , n 3 ,… budući da se tokom emisije fotona energija vibracije molekula može dodati energiji elektronskog prijelaza.
Ako tvar u atomskom stanju, na primjer, vodik H, emituje liniju sa frekvencijom n, tada se ova linija koju emituje supstanca u molekularnom stanju (H 2) dijeli na sistem linija ovisno o broju energetskih koraka molekularne vibracije.
Do cijepanja linija, osim vibracijskog, dolazi i zbog rotaciono kretanje molekule. Kao rezultat toga, emisioni spektri molekula sadrže grupe sa veliki broj linije - pruge i stoga se nazivaju prugasti (Sl. 47).
9.1. Operator sistemske interakcije električnih naboja sa elektromagnetnim poljem
U klasičnoj elektrodinamici, energija interakcije naelektrisanja sa elektromagnetnim poljem može se izraziti kao skalarni proizvod četiri vektora gustine struje i potencijala (9.1), a uzimajući u obzir izabrani Lorencov merač, kao skalarni proizvod od trodimenzionalni vektori gustine struje i vektorskog potencijala. Po analogiji sa klasičnim izrazom, uvodimo operator interakcije sa eksternim poljem, što je očito izraženo u terminima operatora stvaranja i anihilacije (9.2). Operator interakcije je podijeljen na beskonačan zbir operatora nezavisnih jedan od drugog, koji odgovaraju interakciji sa svakim modom zračenja. Za svaki mod postoji zbir dva operatora koji odgovaraju stvaranju i uništenju fotona. Kao stanja nulte aproksimacije biraju se proizvodi stanja neinteragirajućih podsistema (9.3). Na tim stanjima matrični elementi stvaranja i poništavanja fotona u svakom od modova imaju oblik (9.4). Da bi se dobile formule za vjerovatnoću prijelaza s emisijom ili apsorpcijom, treba koristiti standardnu metodu teorije perturbacije.
|
Klasični izraz za energiju sistema naelektrisanja u vanjskom elektromagnetnom polju (Lorentz mjerač) |
||
|
Operator perturbacije koji opisuje interakciju vanjskog elektromagnetnog polja sa sistemom naelektrisanja |
||
|
|
Talasna funkcija sistema bez interakcije |
|
|
|
Nenulti matrični elementi operatora stvaranja i poništenja u svakom modusu. |
9.2. Teorija perturbacije (prvi red)
Stanje sistema u prisustvu interakcije između naelektrisanja poljem može se proširiti u terminima stacionarnih stanja (9.3) nulte aproksimacije (9.5). sistem je bio u stanju |n>, i nije bilo interakcije između njegovih podsistema (9.6). Zamjena ekspanzije (9.5) u nestacionarnu Schrödingerovu jednačinu lako dovodi do sistema diferencijalne jednadžbe za vremenski zavisne koeficijente ekspanzije (9.7), čije rješenje sa početnim uslovima (9.6) nije teško u slučaju slabe perturbacije, što uzrokuje malenost svih vremenski zavisnih koeficijenata, osim amplitude u početnom stanju (9.8). Prema opšta pravila kvantna mehanika, vjerovatnoća tranzicije u stanje q dat kvadratom modula amplituda i ispada da je proporcionalan vremenu (9.9), što nam omogućava da uvedemo vjerovatnoću prijelaza po jedinici vremena (9.10). U slučaju konačnog stanja sa kontinuiranim spektrom, uvodi se vjerovatnoća prelaska u beskonačno mali interval dm (9.11).
|
Proširenje stanja sistema sa interakcijom u terminima stacionarnih stanja 0-aproksimacije. |
||
|
Početno stanje sistema. |
||
|
Sistem jednadžbi za vremenski zavisne amplitude prijelaza s emisijom i apsorpcijom. |
||
|
|
Približno rješenje sistema (9.7) |
|
|
|
q do vremena t. |
|
|
Vjerojatnost prijelaza stanja q po jedinici vremena. |
||
|
Vjerojatnost prijelaza po jedinici vremena u stanje s kontinuiranim spektrom. |
9.3. Vjerojatnosti prijelaza sa emisijom i apsorpcijom svjetlosti
U slučaju prelaza između stanja atoma sa svetlosnom emisijom, konačno stanje pripada kontinuiranom spektru, koji odgovara beskonačnom broju pravaca i frekvencija emitovanog fotona (9.12). Uzimajući u obzir dobijeni izraz, vjerovatnoća prijelaza s emisijom fotona u jedan odabrani mod ispada proporcionalna broju fotona koji su već prisutni u ovom modu (9.13) povećanom za 1. Dva pojma koja su nastala na ovaj način (proporcionalno broju dostupnih fotona i neovisno o broju fotona) se obično tumače kao vjerovatnoće prisiljen i spontana emisija(9.14) Vjerovatnoća prijelaza sa apsorpcijom ima sličan oblik kao (9.13), ali ne sadrži termin koji opisuje spontani proces (9.15).
Izrazi koji se odnose na vjerovatnoću emisije i apsorpcije fotona toliko su važni za brojne primjene da se čini prikladnim zapisati ih u obliku ovisnosti o veličinama tradicionalnijim za eksperimentalnu fiziku. Umjesto broja popunjavanja (broja fotona), zgodnije je koristiti koncept spektralna gustina intenziteta zračenja u datom modu, koji je energetski tok elektromagnetnog zračenja date polarizacije, koji pada na dati beskonačno mali frekvencijski interval i širi se unutar beskonačno malog čvrstog ugla (9.16). Očigledno je da ulazna vrijednost treba biti proporcionalna proizvodu energije jednog fotona i njihovog broja i brzine kretanja u prostoru. Prilikom brojanja broja fotona, njihova koncentracija u modu koji odgovara odabranom prostornom pravcu mora se pomnožiti sa odgovarajućom gustinom broja stanja. Za razliku od izraza prethodno datog izraza (7.12), on ne uzima u obzir sva stanja date energije, već samo ona koja odgovaraju širenju svjetlosti date polarizacije u datom smjeru.
Zamjena broja fotona spektralnom gustinom intenziteta zračenja omogućava da se dobije izraz pogodan za primjene za odnos između vjerovatnoća emisije i apsorpcije svjetlosti (9.17).
|
|
Broj stanja koja odgovaraju emisiji fotona u b.m. frekvencijski interval i b.m. solidan ugao. |
|
|
|
Vjerojatnost prijelaza između stanja |n> i |q> sa svjetlosnom emisijom u datom modu. |
|
|
|
Vjerojatnosti spontane i inducirane emisije |
|
|
|
Vjerovatnoća apsorpcije svjetlosti iz datog moda. |
|
|
|
Veza između spektralne gustine intenziteta zračenja u elementarnom solidnom kutu i broja fotona u odgovarajućem modu. |
|
|
|
Odnos između vjerovatnoća stimulirane i spontane emisije i apsorpcije svjetlosti. |
9.3. Einstein koeficijenti
U slučaju izotropnog zračenja, razumnija karakteristika je spektralna gustina volumetrijska gustina energije zračenja(9.18), koja se dobija iz spektralne gustine intenziteta kao rezultat integracije po uglovima i sumiranja po polarizacijama i, naravno, dijeljenja brzinom širenja energije u prostoru. Integracija po uglovima izraza za vjerovatnoće zračenja (9.17) dovodi do dobro poznatog odnosa između ukupnih (zbirnih po smjerovima i polarizacijama) vjerovatnoća radijacijskih prijelaza (9.19). Gornji izraz takođe uzima u obzir mogućnost degeneracije atomskih nivoa (tj. prisustvo različitih stanja sa istom energijom) uvođenjem njihovih statističkih težina g i .
Zbog činjenice da su vjerovatnoće induciranih radijacijskih prijelaza proporcionalne intenzitetu zračenja, pokazalo se da je zgodno zapisati ih kao proizvod intenziteta koeficijentima (9.20) neovisnim o broju fotona. Na ovaj način uvedene količine nazivaju se Einstein koeficijenti. Relacija (9.19) implicira očiglednu vezu između ovih koeficijenata (9.21). Zanimljivo je napomenuti da klasični (nerelativistički) kvantna mehanika pokazalo se da nije u stanju da na konzistentan način objasni prirodu spontanog zračenja. U okviru ove teorije fenomenološki je uveden izraz za Ajnštajnov koeficijent za spontane prelaze, zasnovan na zahtevu da je moguća termodinamička ravnoteža između zračenja i materije.
|
|
Spektralna gustina zapreminske gustine energije u slučaju prostorno izotropnog zračenja. |
|
|
Ukupne (zbirne po uglovima i polarizacijama) vjerovatnoće prijelaza između gornjeg |u> i niže |d> stanja atoma sa emisijom ili apsorpcijom fotona. |
||
|
Einstein koeficijenti |
||
|
|
Odnos između Einsteinovih koeficijenata |
9.4. Ravnotežno zračenje
Uspostavljeni odnos između vjerovatnoća spontane i stimulirane emisije olakšava dobivanje dobro poznatog izraza za frekvencijsku distribuciju spektralne gustine energije zračenja u stanju termodinamičke ravnoteže sa materijom, odnosno spektrom zračenje crnog tela. Pod uslovom ravnoteže, broj činova apsorpcije i emisije fotona od strane atoma u jedinici vremena treba da bude jednak jedan drugom (9.22). Ovo razmatranje, zajedno s pretpostavkom Boltzmannove raspodjele energije atoma, omogućava da se pronađe broj fotona u modu koji odgovara energetskom jazu između atomski nivoi(9.23) i izračunati zavisnost zapreminske gustine energije zračenja od njegove frekvencije (9.24). rezultirajući omjer, tzv Plankova distribucija, odlično se slaže sa eksperimentalnim podacima. Uključeno u karakteristiku izraza za Bose-Einstein statistiku faktor se može tumačiti kao vjerovatnoća pronalaženja fotona u stanju sa datom energijom. Budući da je Bose-Einstein statistika implementirana za kvantnomehaničke objekte sa cjelobrojnim spinom, dobijeni rezultat je u potpunosti u skladu sa zaključkom iz predavanja 7 da foton ima spin jednak 1.
|
Uslov ravnoteže između zračenja i materije: broj događaja zračenja i apsorpcije su međusobno jednaki. n i- koncentracija atoma u gornjem ili donjem energetskom stanju. |
||
|
|
Broj elektrona u jednom modu ravnotežnog zračenja. |
|
|
|
Plankova raspodjela za ravnotežno zračenje. |