Spektralne linije atoma vodika. Postupak za obavljanje laboratorijskih radova. Izoelektronski niz vodonika
U vreme kada se pojavila Borova teorija, atom vodonika je bio prilično dobro proučavan. To je najjednostavniji atom. Jedan elektron se okreće oko svog jezgra. Linijski spektar vodonika je takođe jednostavan. Stoga je dobijen njegov opis prije opisa spektri drugih atoma.
Molekularni spektri se posmatraju kada molekul podleže apsorpciji ili emisiji elektromagnetno zračenje kao rezultat povećanja ili smanjenja energije. Postoje ograničenja koja nameću zakoni o tome koje pare mogu učestvovati u promjenama energije i u kojoj mjeri se zračenje apsorbira ili emituje. Ova dva fenomena se nazivaju indukovana apsorpcija i, respektivno. Također, molekul u stanju pobuđene energije može spontano emitovati elektromagnetno zračenje, vraćajući se na neki niži energetski nivo bez prisustva inducirajuće radijacije.
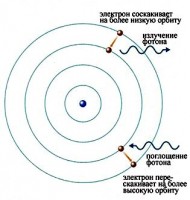
Prema prvom Borovom postulatu, u atomu se elektroni oko jezgre mogu rotirati ne u bilo kojoj, već samo u određenim stacionarnim orbitama, koje se nazivaju "dozvoljenim". U ovom slučaju atom ne emituje niti apsorbuje energiju. Svaka takva orbita odgovara određenoj nivo energije atom. Energija atoma se mijenja samo kada se elektron pomakne na drugu orbitu ili na drugi energetski nivo. Kada se to dogodi, apsorpcija ili oslobađanje kvanta energije.
Već ste naučili o strukturi atoma. Okolina elektrona atomsko jezgro, raspoređeni su u nizu rastućih energetskih nivoa. Svaki element ima jedinstveni broj elektrona u jedinstvenoj konfiguraciji, tako da svaki element ima svoj skup energetskih nivoa. Ovakav raspored energetskih nivoa služi kao jedinstveni otisak atoma.
Međutim, plin zagrijan na slične temperature emitirao bi svjetlost samo na određenim specifičnim valnim dužinama. Razlog za ovo zapažanje tada nije bio shvaćen. Naučnici su proučavali ovaj efekat koristeći cijev za pražnjenje. Protočna cijev je staklena cijev punjena plinom s metalnom pločom na oba kraja. Ako postoji dovoljno velika razlika napona između dvije metalne ploče, atomi plina unutar cijevi će apsorbirati dovoljno energije da prouzrokuju da se neki od njihovih elektrona odvoje, tj. atomi plina će ionizirati.
Atom vodonika u Borovoj teoriji
Atom vodika prema Boru
U svojoj teoriji, Bohr je pretpostavio da je jezgro atoma nepomično, a da se elektron okreće oko njega po kružnoj orbiti. Ali moderna nauka poznato je da dozvoljena orbita duž koje se elektron kreće uopće nije fiksna kružna linija. Zapravo, radi se o određenom prostoru prostora, tankom koncentričnom sloju u obliku lopte, u čijem je središtu jezgro atoma i u kojem je najvjerovatnija pojava elektrona. Ova oblast se naziva elektronska ljuska atoma, ili orbitalni.
Ovi elektroni počinju da se kreću kroz gas i stvaraju struju koja podiže neke od elektrona u drugim atomima na više energetske nivoe. Zatim, kada elektroni u atomima padaju nazad, oni emituju elektromagnetno zračenje. Količina svjetlosti koja se emituje na različitim talasnim dužinama, koja se zove emisioni spektar, prikazana je za ispražnjenu cijev ispunjenu vodonikom ispod. Uočavaju se samo određene talasne dužine svetlosti, kao što pokazuju linije na slici.
Na kraju, naučnici su shvatili da ove linije potiču od fotona određene energije koju emituju elektroni koji prave prelaze između specifičnih energetskih nivoa atoma. Na slici je prikazan primjer ovoga. Kada elektron u atomu padne sa višeg energetskog nivoa na niži energetski nivo, on emituje foton da odnese dodatnu energiju.
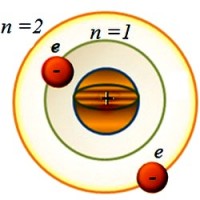
Atom može imati više elektronskih omotača. Svaki od njih je okarakterisan glavni kvantni broj n . Uzima cjelobrojne vrijednosti 1, 2, 3, ..., 7, ..., označava broj energetskog nivoa i određuje energiju elektrona koji se nalaze u datoj orbiti. Što je vrijednost veća n , što je elektron udaljeniji od jezgra i ima više energije. U fizici elektronske školjkečešće označavaju slovima K, L, M, N, O, P, Q . Najbliži jezgru je To -ljuska. Za nju n = 1. Elektron koji se nalazi na njemu ima najmanju energetsku vrijednost. Na primjer, za školjku L n = 2, itd.
Kao što smo ranije raspravljali, frekvencija fotona je povezana s njegovom energijom putem jednačine. Budući da nam određena frekvencija fotona daje određenu boju, možemo vidjeti kako je svaka linija boja povezana s određenim prijelazom. Vidljiva svjetlost nije jedina vrsta emituje elektromagnetno zračenje. Energičniji ili manje energetski prijelazi mogu proizvesti ultraljubičasto ili infracrveno zračenje. Međutim, budući da svaki atom ima svoj skup energetskih nivoa, svaki atom ima svoj emisioni spektar.
Atomi ne emituju samo fotone; oni takođe apsorbuju fotone. Ako foton udari u atom, a energija fotona odgovara jazu između dva energetska nivoa elektrona u atomu, tada elektron na nižem energetskom nivou može apsorbirati foton i skočiti na viši energetski nivo. Ako energija fotona ne odgovara razlici između dva nivoa energije, foton se neće apsorbirati.
Ali, poput Bora, pojednostavimo problem i pretpostavimo da se elektron okreće oko jezgra po kružnoj orbiti. Ako je elektron u prvoj orbiti ( n =1), onda se ovo stanje atoma naziva main. Ovo je stabilno stanje. A njegova energija u ovom slučaju ima minimalnu vrijednost.
A šta je potrebno elektronu da se pomakne na udaljeniju orbitu? Da bi to učinio, on treba da savlada privlačenje pozitivno nabijenog jezgra. A to je moguće kada dobije dodatnu energiju izvana. I tada će biti u orbiti sa brojem n ˃ 1 (n =2, 3, 4, …). U tom slučaju se energija atoma povećava. I on ulazi u stanje tzv uzbuđen.
Koristeći ovaj efekat, ako imamo izvor fotona različitih energija, možemo dobiti spektre apsorpcije za različite materijale. Da biste dobili spektar apsorpcije, jednostavno obasjajte bijelom svjetlošću uzorak materijala koji vas zanima. Bijelo svjetlo se sastoji od svih različitih talasnih dužina vidljivo svetlo sakupljeni zajedno. Postojaće praznine u spektru apsorpcije. Praznine odgovaraju energijama za koje postoji odgovarajuća razlika u nivoima energije za određeni element.
Apsorbovani fotoni se pojavljuju kao crne linije jer se fotoni ovih talasnih dužina apsorbuju i ne pojavljuju se. Zbog toga je spektar apsorpcije tačan recipročan spektru emisije. Pogledajte dvije slike ispod. Na slici možete vidjeti emisioni spektar vodonikove linije. Slika prikazuje spektar apsorpcije. Ovo je sušta suprotnost spektru zračenja! I emisione i apsorpcione metode mogu se koristiti za dobijanje istih informacija o energetskim nivoima atoma.
Čak je i Max Planck shvatio da atomi apsorbiraju ili emituju energiju u strogo određenim dijelovima, koje je nazvao quanta. A veličina ove energije je proporcionalna frekvenciji svjetlosnih vibracija.
Ε = ħ· ѵ ,
Tamne linije odgovaraju frekvencijama svjetlosti koje je apsorbirao plin. Kada elektroni apsorbuju fotone svjetlosti, elektroni se kreću na više energetske nivoe. Ovo je suprotan proces radijacije. Tamne linije, apsorpcione linije, odgovaraju frekvencijama emisionog spektra istog elementa. Količina energije koju apsorbuje elektron da bi se prešao na više visoki nivo, poklapa se s količinom energije koja se oslobađa pri povratku na početni energetski nivo.
Imam nepoznati plin u staklenoj posudi. Imam predosjećaj da bi plin mogao biti vodonik. Šta je dato i šta treba učiniti? Imamo liniju apsorpcije na 642 nm. To znači da supstanca u staklenoj posudi apsorbuje fotone talasne dužine od 642 nm. Moramo izračunati koja 2 energetska nivoa vodonika odgovaraju ovom prelazu. Dakle, moramo znati koliko su energije apsorbirali fotoni.
gdje ѵ - frekvencija kvantno zračenje,
ħ je Plankova konstanta.
A kada se elektron kreće sa udaljene orbite na orbitu bliže jezgru, emituje se kvant energije.
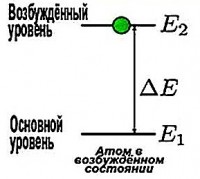
Budući da atom vodika ima samo jedan elektron, on je najčešće u osnovnom stabilnom stanju ( n =1), u kojem može ostati prilično dugo, a da pritom ništa ne emituje. Ali to se nastavlja sve dok ne dobije dodatni kvant energije. I pošto ga primi, elektron skoči na drugu dozvoljenu orbitu većeg radijusa, a atom prelazi u pobuđeno stanje. Međutim, on ne može dugo ostati u ovom stanju. Vraćajući se u osnovno stanje, atom emituje foton (kvant svjetlosti). Energija ovog kvanta jednaka je razlici između energija pobuđenog i osnovnog stanja.
Izračunajte energiju apsorbiranih fotona. Apsorbovani fotoni su imali energiju od 3,1 × 10 -19 J. Nađite energiju prelaza koji vode do zračenja na vidljivim talasnim dužinama. Slika prikazuje različite prelaze nivoa energije. Prijelazi povezani s vidljivim valnim dužinama označeni su kao prijelazi koji počinju ili završavaju na energetskom nivou. Nađimo energiju ovih prelaza i uporedimo je sa energijom apsorbovanih fotona koju smo upravo izračunali.
Energija prelaska sa energetskog nivoa 2 na energetski nivo 3. 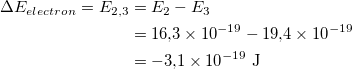
Prema tome, energija fotona koju elektron mora apsorbovati da bi prešao sa energetskog nivoa 2 na energetski nivo 3 je 3,1 × 10 -19 J. To je ista energija kao fotoni koje apsorbuje gas u posudi! Stoga, budući da su prijelazi svih elemenata jedinstveni, može se reći da je plin u posudi vodonik. Prijelaz je apsorpcija fotona između energetskog nivoa 2 i energetskog nivoa.
Zašto je spektar atoma vodika obložen
Emisioni spektar atoma vodika
Još početkom 19. stoljeća ustanovljeno je da se spektar atoma vodonika u vidljivom dijelu sastoji od 4 odvojene linije: crvene, zelene, plave i ljubičaste. Kako se ovo može objasniti? Na kraju krajeva, ima samo jedan elektron.
Stvar je u tome da pri zračenju elektron može skočiti, na primjer, iz četvrte orbite ne samo u treću, već i u drugu i prvu, kao i iz treće u drugu, itd.
Primjena spektra emisije i apsorpcije
Energija fotona ne odgovara energiji energetskog nivoa, ona odgovara razlici energije između dva energetska nivoa. Proučavanje spektra zvijezda i galaksija u astronomiji naziva se spektroskop. Spektroskopija je alat koji se široko koristi u astronomiji za otkrivanje različitih stvari o astronomskim objektima.
Identifikacija elemenata u astronomskim objektima korištenjem njihovih spektra
Mjerenje spektra svjetlosti zvijezde može reći astronomima od čega je zvijezda napravljena. Pošto svaki element emituje ili apsorbuje svetlost samo na određenim talasnim dužinama, astronomi mogu da identifikuju koji se elementi nalaze u zvezdama na osnovu linija u njihovom spektru. Proučavajući spektre mnogih zvijezda, znamo da ih ima mnogo različite vrste zvijezde koje sadrže različite elemente iu različitim količinama.
Pretpostavimo da je elektron u drugoj orbiti. Nakon što je apsorbirao foton, on se kreće u treću orbitu. A vrijednost energije apsorbiranog fotona jednaka je razlici između energija ovih nivoa.
Ε = E 3 – E 2
Određivanje brzina galaksija pomoću spektroskopije
Već ste naučili u 9. poglavlju o Doplerovom efektu i kako se frekvencija mijenja. zvučni talasi u zavisnosti od toga da li se objekat koji emituje zvuk kreće prema vama ili od njega. Ista stvar se dešava i sa elektromagnetnim zračenjem. Ako se objekat koji emituje svetlost kreće prema nama, tada je talasna dužina svetlosti kraća. Ako se predmet udalji od nas, tada se valna dužina njegove svjetlosti izdužuje.
Doplerov efekat utiče na spektre objekata u svemiru u zavisnosti od njihovog kretanja u odnosu na nas na Zemlji. Na primjer, svjetlost iz udaljene galaksije koja se udaljava od nas određenom brzinom bit će crvena. To znači da će emisione i apsorpcijske linije u spektru galaksije biti pomjerene na veću valnu dužinu. Poznavanje gdje bi se svaka linija u spektru obično nalazila da se galaksija ne kreće i upoređivanje sa njenim crvenim pomakom omogućava astronomima da precizno izmjere brzinu galaksije u odnosu na Zemlju.
Ali energetska razlika između susjednih energetskih nivoa nije konstantna vrijednost. Što je elektron udaljeniji od jezgra, to je manji. U skladu s tim, energija emitiranih fotona i frekvencija zračenja elektromagnetskih oscilacija bit će različite. Njegova vrijednost se može odrediti korištenjem pravila frekvencije, ili Borovog drugog postulata.
Globalno zagrijavanje i staklenički plinovi
Sunce emituje zračenje u rasponu talasnih dužina, koje su uglavnom u vidljivom delu spektra. Zračenje na ovim talasnim dužinama putuje kroz gasove atmosfere da bi zagrejalo kopno i okeane ispod. Topli vazduh tada zrači tu toplotu na dugim infracrvenim talasnim dužinama. Ugljični dioksid u atmosferi ima nivoe energije koji odgovaraju infracrvenim talasnim dužinama koje mu omogućavaju da apsorbuje infracrveno zračenje. Zatim takođe zrači na infracrvenim talasnim dužinama u svim pravcima.
Kada se elektron kreće iz orbite m u orbitu n emituje se kvant energije čija se vrednost izračunava relacijom:
Ε = ħ· ѵ = E m – E n , m ˃ n ;
gdje ѵ - kvantna frekvencija zračenja,
ħ je Plankova konstanta.
Odavde ѵ = (E m – E n)/ ħ
Kao što vidimo, frekvencija zračenja ovisi o razlici energije u orbitama između kojih je došlo do prijelaza. I svaka frekvencija odgovara liniji u emisionom spektru atoma. Ovo objašnjava prisustvo pojedinačnih linija u spektru atoma vodika.
Ovaj efekat sprečava da velika količina infracrvenog zračenja izađe iz atmosfere, što uzrokuje zagrevanje atmosfere i zemlje. Više radijacije ulazi nego što se vraća. Rydbergova jednadžba, kvantna stanja, elektronska struktura. Svjetlost je definirana svojom bojom, talasnom dužinom ili frekvencijom - bilo koji od ova tri kvaliteta određuje osnovnu strukturu svjetlosnog vala. Svetlosni talasi se odbijaju oko nas, odbijajući se od miliona površina, što rezultira beskonačnim brojem boja. svjetlost prolazi kroz refrakcijsku rešetku, prizmu ili oblak oblaka, svjetlost se dijeli na sve dugine boje.
Puni spektar atoma vodika
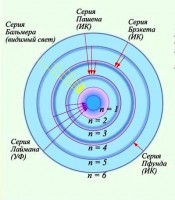
Spektralni niz atoma vodika
Mora se reći da se u emisionom spektru bilo kog gasa uočavaju pojedinačne spektralne linije ili grupe blisko raspoređenih linija. I ove linije nisu raspoređene nasumično, već određenim redoslijedom.
Ali svjetlost koja dolazi iz atoma je veoma različita od reflektirane svjetlosti. Otkrivamo da svjetlost sadrži samo nekoliko valnih dužina. Svjetlost koju emituju atomi i njena jedinstvena svojstva daju nam ideju o strukturi atoma iz kojeg izlazi.
U ovom eksperimentu ćete koristiti spektrometar za ispitivanje svjetlosti koju emituje pobuđeni helijum, a zatim i atomi vodika. Vidjet ćete kako se svjetlost koju emituje jedan element razlikuje od prirodne svjetlosti oko nas i drugačija od svjetlosti koju emituje drugi element. Kalibrirat ćete svoj spektrometar s plinom helijuma, a zatim koristiti spektrometar za mjerenje emisija vodika. Izračunat ćete dostupne nivoe energije u atomu vodonika, a zatim odrediti koji prijelazi između ovih kvantiziranih energetskih nivoa odgovaraju svakoj liniji, svakoj talasnoj dužini, u spektrima vodonika koje mjerite.
Matematički opis lokacije spektralne linije atom vodonika napravio je švajcarski naučnik Johann Jacob Balmer 1855. godine

Johann Jacob Balmer
Balmer je bio matematičar i vjerovao je da različite kombinacije cijelih brojeva mogu objasniti povezanost mnogih fizičke pojave. Kažu da je Balmerov prijatelj, švajcarski fizičar, učestvovao u nastanku formule koja vam omogućava da izračunate talasnu dužinu svake od četiri vidljive linije vodonikovog spektra. Eduard Hagenbach-Bischoff, koji ga je izazvao da opiše crvene, zelene, plave i ljubičaste linije vodonikovog spektra. I Balmer je empirijski izveo sljedeću formulu:
![]()
gdje λ - talasna dužina;
n = 3, 4, 5, 6 (glavni kvantni broj početni nivo energije);
b = 3645,6 Å (angstrom).
Fizičko značenje Balmerove formule u to vrijeme niko nije mogao objasniti. I tek 1913. Niels Bohr je shvatio da su cijeli brojevi u formuli dozvoljene orbite, a spektralne linije rezultat prijelaza elektrona iz jedne orbite u drugu.
Ali pokazalo se da spektralne serije u spektru zračenja atoma vodika postoje ne samo u vidljivom dijelu. Kasnije su pronađeni u ultraljubičastim i infracrvenim zonama.
Talasna dužina koju emituje atom vodika u različitim rasponima može se izračunati po formuli, koju je 1889. izveo švedski fizičar Johannes Rydberg:
![]() ,
,
gdje R ≈ 109737,3157 cm–1 (Rydbergova konstanta za atom vodonika);
λ - talasna dužina;
n - cijeli broj;
n" je broj spektralne serije, i n" < n .

Johannes Rydberg
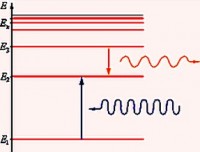
U emisionom spektru Balmer serija uočeno tokom tranzicije elektrona sa pobuđenih energetskih nivoa na n ˃ 2 (n = 3, 4, 5,…) na drugi energetski nivo ( n" = 2). U apsorpcionom spektru nastaje tokom prelaska elektrona sa drugog nivoa na više energetske nivoe.
Rydbergova formula u ovom slučaju ima oblik:
![]()
Serija pronađena u ultraljubičastom dijelu spektra naziva se Lyman serija. Otkrio ga je 1906. godine američki fizičar Theodore Lyman. U emisionom spektru ovaj niz nastaje pri prelasku elektrona sa pobuđenih energetskih nivoa na prvi, au apsorpcionom spektru pri prelasku sa prvog nivoa na najviši.
Rydbergova formula za Lyman seriju:
![]()
n" = 1;
n = 2, 3, 4…
A u infracrvenom opsegu otkrivene su 4 serije: Paschen serija, serija nosača, serija Pfund i Humphrey serija.
Paschen Series otkrio je austrijski fizičar 1908 Friedrich Paschen.
Rydbergova formula za Paschenovu seriju:
![]()
gdje n" = 3;
n = 4, 5, 6, …
Sljedeću seriju otvorio je američki fizičar Frederick Sumner Brackett 1922. Odgovara Rydbergovoj formuli za n' = 4 i n = 5, 6, 7…
Pfund seriju je otkrio američki fizičar August Hermann Pfund 1924. Za ovu seriju n' = 5 i n = 6, 7, 8, …
Za Humphrey seriju, otvorenu 1953. američki fizičar Curtis Humphrey, n' = 6 i n = 7, 8, 9, …:
Zamjena odgovarajućih vrijednosti u Rydbergovu formulu n" i n , dobijamo formule za sve serije spektra atoma vodika.
Borova teorija objašnjava linijski uzorak spektra atoma vodika i spektre atoma sličnih vodiku, koji uključuju teške izotope deuterijuma i tricijuma, kao i svaki jon koji ima samo jedan elektron, na primjer, ionizirani helij atom. Ali, nažalost, ne može se primijeniti na složenije atome.
Cilj:
1. Istražite vidljivi dio spektra atoma vodika.
2. Odrediti Rydbergovu konstantu i energiju ionizacije atoma vodika.
Glavne teorijske odredbe rada.
Zakoni klasične fizike opisuju kontinuirane procese. Atom koji se sastoji od pozitivno nabijenog jezgra i elektrona koji ga okružuju, prema ovim zakonima, bit će u ravnoteži samo ako se elektroni neprekidno kreću oko jezgra u određenim orbitama. Ali sa stajališta klasične elektrodinamike, elektroni koji se kreću ubrzano zrače elektromagnetske valove, zbog čega gube energiju i postupno padaju na jezgro. U ovim uslovima, frekvencija elektronske revolucije se neprekidno menja i emisioni spektar atoma mora biti kontinuiran. Kada elektron udari u jezgro, atom prestaje da postoji.
Jednostavnim proračunima može se osigurati da je vremenski interval nakon kojeg elektron pada na jezgro 10 -11 s. Eksperiment pokazuje da se atomski spektri sastoje od pojedinačnih linija ili grupa linija. Sve ovo ukazuje da procese u koje su uključeni mikroobjekti karakteriše diskontinuitet (diskretnost), a metode klasične fizike, uopšteno govoreći, nisu primjenjive na opis unutaratomskih kretanja.
Godine 1913. N. Bohr je uspio izgraditi konzistentnu teoriju koja je uspješno objasnila strukturu atoma vodika. Bohr je proširio postulat M. Plancka (1900) o postojanju stabilnih stacionarnih stanja oscilatora (što je neophodan preduvjet za izvođenje ispravna formula zračenje crnog tijela) na bilo koji atomski sistem. Borova teorija se zasniva na dva postulata:
1. Atom i atomski sistemi mogu dugo ostati samo u određenim (stacionarnim) stanjima, u kojima, uprkos kretanju naelektrisanih čestica koje se dešavaju u njima, ne emituju niti apsorbuju energiju. U tim stanjima atomski sistemi imaju energije koje formiraju diskretni niz: E 1 , E 2 , …, E n . Ova stanja karakterizira njihova stabilnost: svaka promjena energije kao rezultat apsorpcije ili emisije elektromagnetskog zračenja ili kao rezultat sudara može se dogoditi samo uz potpuni prijelaz (skok) iz jednog stanja u drugo.
2. Tokom prelaska iz jednog stanja u drugo, atomi emituju (ili apsorbuju) zračenje samo striktno definisane frekvencije. Zračenje koje se emituje (ili apsorbuje) tokom prelaska iz stanja sa energijom E m u stanje E n je monohromatsko, a njegova frekvencija se određuje iz uslova
Oba postulata su u suprotnosti sa zahtjevima klasične elektrodinamike. Prvi postulat kaže da atomi ne zrače, iako elektroni koji ga formiraju čine ubrzano kretanje (kruženje u zatvorenim orbitama). Prema drugom postulatu, emitovane frekvencije nemaju nikakve veze sa frekvencijama periodičnih kretanja elektrona.
Emisioni spektar supstance je njena važna karakteristika, koja vam omogućava da utvrdite njen sastav, neke karakteristike njegove strukture, svojstva atoma i molekula.
Atomi plina emituju linijske spektre koji se sastoje od grupa pojedinačnih spektralnih linija tzv spektralne serije. Najjednostavniji spektar je spektar atoma vodika. Već 1885. Balmer je pokazao da se talasne dužine četiri linije koje leže u vidljivom delu spektra mogu vrlo precizno predstaviti empirijskom formulom
gdje je n = 3, 4, 5, 6,…, V empirijska konstanta.
Pravilnost izražena ovom formulom postaje posebno evidentna ako se prikaže u obliku u kojem se obično koristi u današnje vrijeme:
![]() (3)
(3)
Količina se ponekad označava i naziva spektroskopski talasni broj. Konstanta se zove Rydbergova konstanta. Dakle, konačno dobijamo
![]() . (4)
. (4)
Kako se broj linije n povećava, intenzitet linije opada. Razlika između valnih brojeva susjednih linija također se smanjuje. Za n = ∞ dobija se konstantna vrijednost =. Ako šematski predstavimo lokaciju spektralnih linija definisanih (4) i uslovno opišemo njihov intenzitet dužinom linije, dobijamo sliku prikazanu na slici 1.
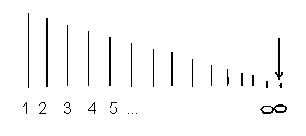
Skup spektralnih linija koje u svom nizu i distribuciji intenziteta otkrivaju pravilnost prikazanu na slici 1 naziva se spektralne serije. Zove se granična talasna dužina oko koje se linije debljaju kao n → ∞ granica serije. Niz opisan formulom (4) naziva se Balmerov red.
Uz Balmerovu seriju, u spektru atoma vodika pronađen je niz drugih serija, predstavljenih potpuno analognim formulama.
U ultraljubičastom području pronađena je serija Lyman:
![]() (5)
(5)
U infracrvenom području spektra pronađeni su
Paschen Series
![]() (6)
(6)
Bracket Series
![]() (7)
(7)
Pfund serija
![]() (8)
(8)
Humphrey serija
![]() (9)
(9)
Dakle, sve poznate serije atomskog vodonika mogu se predstaviti tzv po generaliziranoj Balmerovoj formuli:
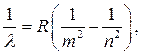 (10)
(10)
gdje m u svakoj seriji ima konstantnu vrijednost, a n je niz cjelobrojnih vrijednosti počevši od m+1.
Traži fizičkog čula formule (10) dovele su do stvaranja kvantna teorija atom vodonika. Schrödingerova jednačina za to se piše kao:
![]() (11)
(11)
gdje je Ψ(r) valna funkcija koja opisuje stanje elektrona u atomu, E je ukupna energija elektrona.
Rješenje ove jednačine je spektar mogućih vrijednosti puna energija atom vodonika:
![]() (12)
(12)
Prema (1), učestalost prijelaza između stanja određena je pomoću
S druge strane, prema poznatoj formuli
Kombinujući (12), (13) i (14) dobijamo:
![]() (15)
(15)
poklapa se sa generalizovanom Balmerovom formulom.
Teorijska vrijednost Rydbergove konstante (16) još uvijek se značajno razlikuje od eksperimentalne vrijednosti dobivene spektroskopskim mjerenjima. To je zbog činjenice da se pri izvođenju formule (16) postavljaju dvije pretpostavke: a) masa jezgra atoma je beskonačno velika u poređenju s masom elektrona (otuda simbol “∞” u oznaci a konstanta) i b) jezgro je nepomično. U stvarnosti, na primjer, za atom vodonika, masa jezgra je samo 1836,1 puta veća od mase elektrona. Obračunavanje ove okolnosti dovodi do sljedeće formule:
gdje je M masa atomskog jezgra. U ovoj aproksimaciji, Rydbergova konstanta ovisi o masi jezgra, te se stoga njene vrijednosti za različite atome slične vodiku razlikuju jedna od druge (slika 2).
Fig.2 Sl.3
Da bi se dobio kompletan skup informacija o atomu, zgodno je koristiti dijagram nivoa energije (slika 3). Horizontalne prave linije odgovaraju različitim energetskim stanjima atoma vodika. Kako se broj stanja povećava, udaljenost između susjednih nivoa se smanjuje i nestaje u granici. Iznad tačke ušća je kontinuirana oblast nekvantizovanih pozitivnih energija. Nulti energetski nivo se uzima kao energija nivoa sa n = ∞. Ispod ove vrijednosti, nivoi energije su diskretni. Oni odgovaraju negativnim vrijednostima ukupne energije atoma. Ova okolnost ukazuje da je energija elektrona u takvim stanjima manja od njegove energije u slučaju kada je odvojen od atoma i miruje u beskonačnosti. velika udaljenost, odnosno da je elektron u vezanom stanju.
Prisustvo nevezanih elektrona omogućava kvantne prelaze između stanja kontinuiranog energetskog spektra, kao i između takvih stanja i stanja diskretnog energetskog spektra. To se manifestuje u obliku kontinuirani spektar emisija ili apsorpcija superponirana na linijski spektar atom. Stoga se spektar ne zaustavlja na granici serije, već se nastavlja dalje od nje prema kraćim talasnim dužinama, gdje postaje kontinuiran. Prijelazi iz stanja kontinuiranog spektra (onih stanja u kojima je atom ioniziran) u stanja diskretnog spektra praćeni su rekombinacijom elektrona i pozitivni ion. Rezultirajuće zračenje se naziva rekombinacija.
Prijelaz atoma iz normalnog stanja u viši energetski nivo diskretnog spektra je ekscitacija atoma. Prijelaz atoma sa jednog od nivoa diskretnog spektra u područje kontinuiranog spektra pretvara atom u nevezani sistem. To je proces jonizacija atoma. Energija koja odgovara talasnom broju početka kontinuiranog spektra sa strane dugih talasa (talasni broj granice serije) treba da bude jednaka energija jonizacije, to jest, energija potrebna da se elektron odvoji od atoma i ukloni na beskonačnu udaljenost. Dakle, talasni broj granice Lajmanove serije daje energiju jonizacije atoma vodika u osnovnom, najstabilnijem stanju.
U ovom radu proučavamo prve četiri linije Balmerove serije, koje imaju sljedeće oznake:
Crvena linija (n = 3),
Plavo - plava linija (n = 4),
Plava linija (n=5),
Ljubičasta linija (n = 6).






