Gas u čvrst. Struktura čvrstih, tečnih i gasovitih tela - Hipermarket znanja
Uspostavljanje idealnog poretka u rasporedu atoma, odnosno formiranje čvrstog tijela, ometaju toplinska kretanja, glavna karakteristikašto je, kao što znamo, slučajnost, nered. Dakle, da bi supstanca bila u čvrstom stanju, njena temperatura mora biti dovoljno niska - toliko niska da je energija toplotnog kretanja manja od potencijalna energija interakcije atoma.
Potpuno idealan kristal, u kojem su svi atomi u ravnoteži i imaju minimalnu energiju, tijelo može biti samo kada apsolutna nula. U stvari, sve supstance postaju čvrste u mnogo većoj meri visoke temperature. Jedini izuzetak je helijum, koji ostaje tečan čak i na apsolutnoj nuli, ali to je zbog nekih kvantnih efekata, o kojima ćemo ukratko govoriti u nastavku.
Supstanca može preći iz tekućeg u čvrsto stanje, kao i iz gasovitog stanja. U oba slučaja, takav prijelaz je prijelaz iz stanja lišenog simetrije u stanje u kojem postoji simetrija (ovo se, u svakom slučaju, odnosi na poredak dugog dometa koji postoji u kristalima, ali ne postoji ni u tekućini ni u gasovite supstance). Dakle, prijelaz u čvrsto stanje mora se dogoditi naglo, odnosno na određenoj temperaturi, za razliku od prijelaza plin-tečnost, koji se, kao što znamo, može odvijati i kontinuirano.
Razmotrimo prvo transformaciju tečnosti- solidan. Proces nastajanja čvrstog tijela pri hlađenju tečnosti je proces formiranja kristala (kristalizacije), (a dešava se na određenoj temperaturi, temperaturi kristalizacije ili očvršćavanja. Pošto se pri takvoj transformaciji energija smanjuje, to je praćeno oslobađanjem energije u obliku latentne toplote kristalizacije.Reverzna transformacija je taljenje – takođe se dešava naglo na istoj temperaturi i praćena je apsorpcijom energije u obliku
toplina fuzije jednaka po veličini toplini kristalizacije.
Ovo se jasno vidi iz grafikona zavisnosti temperature rashladne tečnosti u odnosu na vreme prikazanog na Sl. 179 (kriva a). Dio 1 krive a daje tok monotonog pada temperature tekućine uslijed odvođenja topline iz nje. Horizontalni presjek 2 pokazuje da pri određenoj temperaturi njeno smanjenje prestaje, uprkos činjenici da se odvođenje topline nastavlja. Nakon nekog vremena, temperatura ponovo počinje da se smanjuje (odjeljak 3). Temperatura koja odgovara dijelu 2 je temperatura kristalizacije. Toplota koja se oslobađa tokom kristalizacije nadoknađuje uklanjanje toplote iz supstance i stoga se smanjenje temperature privremeno zaustavlja. Nakon završetka procesa kristalizacije, temperatura, sada čvrstog tijela, ponovo počinje opadati.
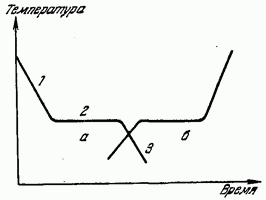
Takav tok grafa smanjenja temperature je tipičan za kristalna tela. Prilikom hlađenja tekućina koje ne kristaliziraju (amorfne tvari), latentna toplota ne ističe i kriva hlađenja je monotona kriva bez zaustavljanja hlađenja.
U obrnutom procesu tranzicije supstance iz čvrsto stanje u tečnost (topljenje) na krivulji grijanja, dolazi i do zaustavljanja porasta temperature, zbog apsorpcije latentne topline topljenja - topline, zbog čega se kristalna rešetka razara (kriva na sl. 179 ).
Za početak kristalizacije neophodno je prisustvo centra ili centara kristalizacije. Takvi centri mogu biti nasumične nakupine tečnih čestica zalijepljenih jedna za drugu, na koje bi se moglo pridružiti sve više čestica, dok se cijela tekućina ne pretvori u čvrsto tijelo. Međutim, stvaranje takvih nakupina u samoj tekućini otežano je toplinskim pokretima, koji ih uništavaju i prije nego što uspiju da dobiju bilo kakve uočljive dimenzije. Kristalizacija je uvelike olakšana ako su u tekućini od samog početka prisutne dovoljno velike čvrste čestice u obliku čestica prašine i tijela, koja postaju centri kristalizacije.
Formiranje centara kristalizacije u samoj tečnosti je olakšano, naravno, smanjenjem temperature. Dakle, kristalizacija čiste tečnosti, lišene stranih formacija,
obično počinje na temperaturi nešto nižoj od prave temperature kristalizacije. U normalnim uslovima, u tečnosti koja kristališe postoji mnogo centara kristalizacije, tako da mnogi kristali rastu zajedno u tečnosti, a očvrsnuta tvar se ispostavlja kao polikristalna.
Samo pod posebnim uslovima, koje je obično teško obezbediti, može se dobiti pojedinačni kristal – jedan kristal koji raste iz jednog centra kristalizacije. Ako su u ovom slučaju obezbijeđeni isti uvjeti za akumulaciju čestica za sve smjerove, tada se kristal dobija pravilno fasetiran prema svojim svojstvima simetrije.
Prijelaz tekućina-čvrsto, kao i reverzna transformacija, je fazni prijelaz, jer se tekuće i čvrsto stanje mogu smatrati dvije faze tvari. Obje faze na temperaturi kristalizacije (taljenja) mogu doći u dodir jedna s drugom, nalazeći se u ravnoteži (led, na primjer, može plutati u vodi bez topljenja), kao što tekućina i njena zasićena para mogu biti u ravnoteži.
Baš kao što tačka ključanja zavisi od pritiska, temperatura kristalizacije (i njena ekvivalentna tačka topljenja) takođe zavisi od pritiska, obično raste sa povećanjem pritiska. Raste jer vanjski pritisak spaja atome, a da bi se uništila kristalna rešetka tokom topljenja, atomi se moraju udaljiti jedan od drugog: na veći pritisak za to je potrebna veća energija toplotnih kretanja, odnosno veća temperatura.
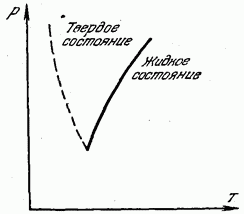
Na sl. 180 prikazuje krivu temperature topljenja (kristalizacije) u odnosu na pritisak. Puna kriva dijeli cijeli region na dva dijela. Područje lijevo od krive odgovara čvrstom stanju, a područje desno od krive odgovara tekućem stanju. Bilo koja tačka koja leži na samoj krivulji topljenja odgovara ravnoteži čvrste i tekuće faze: pri ovim pritiscima i temperaturama, tvar u tekućem i čvrstom stanju je u ravnoteži, u kontaktu jedna s drugom i tekućina se ne stvrdne, a čvrsta materija se ne topi.
Isprekidana linija na sl. 180 prikazuje krivulju topljenja za onih nekoliko supstanci (bizmut, antimon, led, germanijum) kod kojih se tokom skrućivanja volumen ne smanjuje, već povećava. Takve
materije, naravno, tačka topljenja opada sa povećanjem pritiska.
Promjena tačke topljenja povezana je s promjenom pritiska Clausius-Clapeyronovom relacijom:
![]()
Ovdje je temperatura topljenja (kristalizacije), odnosno molarni volumen tečne i čvrste faze i molarna toplota fuzije.
Ova formula vrijedi i za druge fazne prijelaze. Konkretno, za slučaj isparavanja i kondenzacije, Clausius-Clapeyronova formula je izvedena u Pogl. VII [vidi (105.6)].
Iz Clapeyron-Clausiusove formule može se vidjeti da je predznak promjene temperature topljenja s promjenom tlaka određen kojom od dvije vrijednosti, ili više. Strmina krivulje također ovisi o vrijednosti latentne topline prijelaza; što je temperatura niža, temperatura topljenja se manje mijenja s pritiskom. U tabeli. 20 prikazuje vrijednosti specifične (tj. po jedinici mase) topline fuzije za neke tvari.
Tabela 20 (vidi skeniranje) Specifična toplota topljenje za neke supstance
Clausius-Clapeyronova jednadžba se također može napisati u ovom obliku:
![]()
Ova jednadžba pokazuje kako se pritisak pod kojim se nalaze obje ravnotežne faze mijenja s temperaturom.
Čvrsta materija se može formirati ne samo kristalizacijom tečnosti, već i kondenzacijom gasa (pare) u kristal, zaobilazeći tečnu fazu. U ovom slučaju se oslobađa i latentna toplina prijelaza, koja je, međutim, uvijek veća od latentne topline fuzije. Na kraju krajeva, do formiranja čvrste supstance na određenoj temperaturi i pritisku može doći i direktno iz gasovitog stanja i preliminarnim ukapljivanjem, u oba
slučajevima, početno i konačno stanje su isto. To znači da je energetska razlika ovih stanja ista. U međuvremenu, u drugom slučaju, prvo, oslobađa se latentna toplota kondenzacije tokom prelaska iz gasovitog u tečno stanje i, drugo, latentna toplota kristalizacije tokom prelaska iz tekućeg u čvrsto stanje. Iz toga slijedi da latentna toplina u direktnom formiranju čvrste tvari iz plinovite faze mora biti jednaka zbiru toplina kondenzacije i kristalizacije iz tekućine. Ovo se odnosi samo na toplote merene na tački topljenja. Na nižim temperaturama, toplota kondenzacije iz gasa se povećava.
Obrnuti proces isparavanja čvrste tvari obično se naziva sublimacija ili sublimacija. Isparavanje čestica čvrste tvari stvara paru iznad nje na potpuno isti način kao što se događa kada tečnost isparava. Pri određenim pritiscima i temperaturama para i čvrsta supstanca mogu biti u ravnoteži. Pare u ravnoteži s čvrstim tijelom također se nazivaju zasićena para. Kao iu slučaju tečnosti, elastičnost zasićena para iznad čvrste materije zavisi od temperature, brzo se smanjuje sa opadanjem temperature, tako da je za mnoge čvrste materije na uobičajenim temperaturama pritisak zasićene pare zanemarljiv.
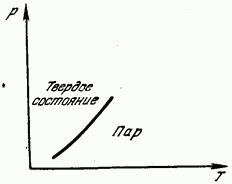
Na sl. 181 prikazuje krivu pritiska zasićene pare u odnosu na temperaturu. Ova kriva je linija ravnoteže između čvrste i gasovite faze. Područje lijevo od krive odgovara čvrstom stanju, desno od njega, plinovitom stanju. Sublimacija, kao i topljenje, povezana je s uništavanjem rešetke i zahtijeva utrošak energije potrebne za to. Ova energija se manifestuje kao latentna toplota sublimacije (sublimacije), jednaka, naravno, latentnoj toploti kondenzacije, pa je stoga toplota sublimacije jednaka zbiru toplota topljenja i isparavanja.
Većina tvari koje mogu ostati u tri 
agregatno stanje: tečno, čvrsto i gasovito. Ova stanja se nazivaju agregatna stanja.
 Supstanca prelazi iz jednog stanja u drugo kada se zagreje ili ohladi, kao i kada se pritisak promeni.
Supstanca prelazi iz jednog stanja u drugo kada se zagreje ili ohladi, kao i kada se pritisak promeni.
Već znate da ako zagrijete vodu do tačke ključanja, ona će se pretvoriti u pare. Odnosno, ići će na gasovitom stanju. Postoji teorija koja objašnjava svojstva sva tri stanja.
Naziva se kinetičkim i zasniva se na tvrdnji da se čestice kreću u sastavu materije.
Kinetička teorija.
 Većina hipoteza u nauci se ne prihvata dok se ne dokažu, već se smatraju istinitim samo zato što objašnjavaju određene pojave. Objasni svojstva čvrstih, tečnih i gasovita tela, na osnovu energije čestica koje se nalaze u njihovom sastavu, daje kinetička teorija. Čestice čvrstog tijela nalaze se vrlo blizu jedna drugoj, vezane su silom privlačenja i ne mogu se osloboditi. Oni samo osciliraju oko centra. Ali čim počnemo zagrijavati tijelo, energija njegovih čestica će početi rasti. Tada se mogu odvojiti jedno od drugog. Čvrsta materija počinje da se topi i teče. Čestice plina imaju još više energije i nalaze se na još većoj udaljenosti jedna od druge. Zagrijavanje vam omogućava da povećate energiju čestica, one se kreću brže i tijelo prelazi u drugo stanje agregacije.
Većina hipoteza u nauci se ne prihvata dok se ne dokažu, već se smatraju istinitim samo zato što objašnjavaju određene pojave. Objasni svojstva čvrstih, tečnih i gasovita tela, na osnovu energije čestica koje se nalaze u njihovom sastavu, daje kinetička teorija. Čestice čvrstog tijela nalaze se vrlo blizu jedna drugoj, vezane su silom privlačenja i ne mogu se osloboditi. Oni samo osciliraju oko centra. Ali čim počnemo zagrijavati tijelo, energija njegovih čestica će početi rasti. Tada se mogu odvojiti jedno od drugog. Čvrsta materija počinje da se topi i teče. Čestice plina imaju još više energije i nalaze se na još većoj udaljenosti jedna od druge. Zagrijavanje vam omogućava da povećate energiju čestica, one se kreću brže i tijelo prelazi u drugo stanje agregacije.
Brownovo kretanje.
 Engleski biolog Robert Braun je 1927. godine pod mikroskopom ispitivao čestice polena smeštene u tečnost.
Engleski biolog Robert Braun je 1927. godine pod mikroskopom ispitivao čestice polena smeštene u tečnost.
Primijetio je da se kreću cik-cak, ali to nije mogao objasniti.
Ovo nasumično kretanje molekula naziva se braunovsko kretanje. Objašnjenje je kasnije dao Albert Ajnštajn.
On je naveo da se čestice koje se nalaze u tečnosti kreću zbog sudara takođe pokretnih, ali nevidljivih molekula.
 Promjena države.
Promjena države.
Kako temperatura raste, energija čestica tijela se povećava i dostiže tačku topljenja.Tada dolazi do prekida veza između čestica i tijela se topi.
Na primjer, parafin iz svijeće. Kada se zagreje, teče dole, dok se hladi, ponovo se stvrdne u čvrstom stanju.
Daljnjim zagrijavanjem se postiže tačka ključanja, a čestice se potpuno oslobađaju međusobne veze i tekućina se pretvara u paru.
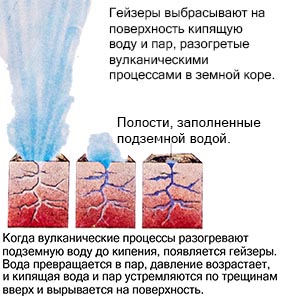 Primjer je gejzir koji, zagrijavan vulkanskim procesima, izbacuje kipuću vodu i paru na površinu. Ali kada se ohladi, dolazi do obrnutog procesa. Gas se kondenzuje i postaje tečnost, a tečnost, dalje se hladeći, smrzava, pretvarajući se u čvrstu supstancu.
Primjer je gejzir koji, zagrijavan vulkanskim procesima, izbacuje kipuću vodu i paru na površinu. Ali kada se ohladi, dolazi do obrnutog procesa. Gas se kondenzuje i postaje tečnost, a tečnost, dalje se hladeći, smrzava, pretvarajući se u čvrstu supstancu.
Ugljični dioksid može prijeći iz čvrstog u plinovito stanje, zaobilazeći tekuće stanje.
Nedostatak vode na Marsu objašnjava se zanemarljivim atmosferskim pritiskom.
Tamo voda odmah proključa i ispari. Za različite tvari, prijelaz u drugo stanje se događa na različitim temperaturama.
Također možete promijeniti tačku topljenja i ključanja dodavanjem neke nečistoće u supstancu ili promjenom tlaka.
Pritisak zemljine atmosfere nazivamo atmosferskim pritiskom.
 |
 |
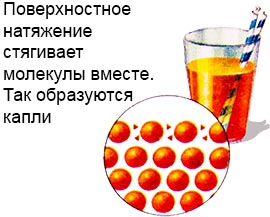
 Površinski napon.
Površinski napon.
Vidjeli ste kako vodoskoci mirno hodaju po površini rezervoara.
Ne tonu i mogu se kretati po površini vode koliko god žele.
 To je moguće jer tekućina ima sloj površinske napetosti.
To je moguće jer tekućina ima sloj površinske napetosti.
Molekuli ovog sloja su mnogo jače vezani nego u dubini tečnosti.
To stvara neku vrstu filma na površini tekućine, a također formira kapi.
A težina vodoskoka jednostavno nije dovoljna da ga razbije.
Isparavanje.
 Tečnost konstantno isparava, čak i kada nije zagrejana. To je zbog činjenice da je energija molekula na površinskom sloju mnogo veća i to omogućava da se molekuli odvoje od površine, odnosno da ispare.
Tečnost konstantno isparava, čak i kada nije zagrejana. To je zbog činjenice da je energija molekula na površinskom sloju mnogo veća i to omogućava da se molekuli odvoje od površine, odnosno da ispare.
Kako isparava, temperatura tečnosti se smanjuje. Ovo je posebno tačno kada se osoba znoji.
Kapljice vode na koži isparavaju i koža se hladi.
Gasovi.
 Gas je tvar koja nema fiksni volumen ili oblik. Prema kinematičkoj teoriji, energija molekula plina dovoljna je da razbije veze i, razlijećući se, ispuni cijeli volumen oko njih.
Gas je tvar koja nema fiksni volumen ili oblik. Prema kinematičkoj teoriji, energija molekula plina dovoljna je da razbije veze i, razlijećući se, ispuni cijeli volumen oko njih.
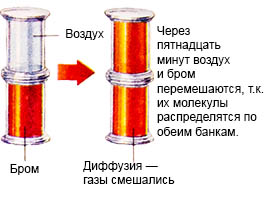
Ovaj proces se naziva difuzija.
Količina tlaka plina ovisi o tome koliko snažno molekuli plina udaraju o zidove posude. Ako se, bez promjene temperature, volumen plina smanji smanjenjem volumena posude, tada će se njegov tlak povećati, jer će molekuli plina češće udarati o zidove posude.Ili ako pumpate novu porciju gasa.
Kada se zagreju, molekuli gasa se kreću brže i dalje, gas se širi i postaje manje gust. Ako se zagrijavanjem plina ograniči njegov volumen, tada će tlak početi rasti.
 |
 |
Zapremina, masa i gustina.
Volumen je količina prostora koju tečno ili čvrsto tijelo zauzima. Zapremina se mjeri u kubnim metrima. Da biste saznali zapreminu tečnosti, potrebno je da je sipate u mernu posudu. Zapremina čvrstog tijela ispravan oblik prepoznaju se po zapremini tečnosti koju je istisnuo iz posude. Volumen čvrstog tijela pravilnog oblika - prema formuli.
Na jednu stranu vage stavljamo tijelo koje treba izmjeriti, a na drugu - tijelo sa poznatom masom. Masa čvrstog, tečnog ili gasovitog tela nam govori koliko materije sadrži. Masa se mjeri u kilogramima i gramima. Potrebno je razumjeti razliku između mase i težine - veličinu gravitacijske sile koja djeluje na tijelo.
 |
 |
 Po gustini možemo procijeniti koliko su čvrsto „uklopljene“ čestice koje čine tijelo. Na primjer, molekule metala su bliže jedna drugoj od molekula papira.
Po gustini možemo procijeniti koliko su čvrsto „uklopljene“ čestice koje čine tijelo. Na primjer, molekule metala su bliže jedna drugoj od molekula papira.
To znači da je gustina metala veća. Gustina se izračunava tako što se masa tijela podijeli s njegovom zapreminom i mjeri se u kilogramima po kubnom metru (kg/m3).
Postoji uređaj za mjerenje gustine tečnosti - hidrometar. U gustoj tečnosti pluta blizu površine, jer svojom težinom može istisnuti samo mali volumen tečnosti.
KOMBINACIJA KORISNO SA PRIJATNIM!
 Ovaj eksperiment pokazuje učinak sile površinskog napona. Sipajte čistog vola u tanjir i dodajte malo praha, npr. talka.
Ovaj eksperiment pokazuje učinak sile površinskog napona. Sipajte čistog vola u tanjir i dodajte malo praha, npr. talka.
Nakapajte tečni sapun u sredinu. Šta se dešava?
Sapun uništava površinski napon, tj. privlačna sila između molekula. Molekuli koji se nalaze u blizini zidova čvršće su vezani jedni za druge, tako da se sav prah u tanjuriću skupio sa strane.
Mineralna goriva u zemljinoj kori koncentrirana su u obliku nakupina ugljika (razni ugljevi i škriljci) i ugljovodonika (nafta i plin). U nauci i praksi je čvrsto utemeljena ideja da se nakupine ugljovodonika s molekulskom težinom većom od 60 nalaze u zemljinoj kori u tečno stanje, a lakši - u gasovitim.
Međutim, sovjetski naučnici akademik A. A. Trofimuk, dopisni član Akademije nauka SSSR-a N. V. Chersky, dr. tehničke nauke F. A. Trebin, Yu. F. Makogon, kandidat tehničkih nauka, i V. G. Vasiliev, kandidat geoloških i mineraloških termodinamički uslovi prelaze u zemljinoj kori u čvrsto stanje i formiraju naslage gasnih hidrata, i to sa neuporedivo većom koncentracijom gasa po jedinici zapremine poroznog medija nego u običnim gasnim naslagama.
Gas prelazi u čvrsto stanje u zemljinoj kori, povezujući se sa formacijskom vodom pri hidrostatskim pritiscima i relativno niskim temperaturama - do +25°. Eksperimentalne studije je pokazao da pri istim pritiscima ležište gasnih hidrata sadrži nekoliko puta više gasa od konvencionalnog gasnog depozita jednake zapremine, jer jedna zapremina vode, kada pređe u hidratno stanje, veže do 220 zapremina gasa, dok uobičajeno rastvorljivost gasa u vodi ne prelazi dva do četiri zapremine, a za led je još niža.
Fizičke karakteristike rezervoara gasnih hidrata se veoma razlikuju od fizičkih karakteristika konvencionalnog rezervoara za gas. Električna provodljivost takvog ležišta je mnogo niža od one kod konvencionalnog ležišta, što omogućava razvoj novih metoda za tumačenje geofizičkih karakteristika u cilju identifikacije naslaga gasnih hidrata u zemljinoj kori, kao i korištenje ovih svojstava za stvaranje novih procesi (odvajanje gasa, skladištenje velikih količina gasa na niske pritiske itd.).
Proces formiranja ležišta gasnih hidrata može biti praćen značajnim smanjenjem ležišnog pritiska (ispod hidrostatskog), smanjenjem veličine ležišta, a u prisustvu priliva gasa i vode, značajnim povećanjem rezervi gasa u depozit.
Zone naslaga gasnih hidrata koncentrisane su uglavnom u oblastima permafrosta, i zajednički prostor, gdje se takva nalazišta mogu naći, je više od 50% teritorije Sovjetski savez, oko četvrtine kopna naše planete i više od 90% okeana.
Jedan od istraživača, šef Odjela za geologiju Ministarstva plinske industrije SSSR-a, V. G. Vasiliev, rekao je: „Ovo je važna rezerva prirodnog gasa koja će umnožiti energetske i hemijske resurse naše zemlje. Osim toga , pretpostavlja se da se ispod dna Svetskog okeana nalaze i nalazišta gasa u stanju.. Logika rezonovanja naučnika je sledeća: dno okeana je pod pritiskom vode od 300-500 atm, a pri takvom pritiska, niske temperature unutrašnjosti Jakutije više nisu potrebne za stvaranje hidrata.Pošto okean pokriva veći dio planete, a permafrost zauzima značajan dio kopna, onda se može pretpostaviti da je čvrsto stanje plina nije izuzetak, nego pravilo.
Na koji način se hidrati mogu izvući iz podzemlja bez izgradnje rudnika? Istraživači su predložili da se metan prebaci iz čvrstog u plinovito stanje direktno u rezervoaru, a zatim ga "odabira" koristeći konvencionalne bušotine. Postoji nekoliko načina da to učinite. Ako se tlak u bušotini umjetno smanji ili se temperatura u rezervoaru poveća, to će uzrokovati razgradnju hidrata, a slobodni plin će se podići kroz cijevi. Ali najperspektivnije je, vjeruju naučnici, djelovanje na vodu katalizatorom koji ubrzava oslobađanje molekula plina iz snažnog zahvata molekula vode. Koncentracija gasa u rezervoaru je previsoka i ova titanska sila mora se pažljivo otpustiti.
Može li se danas govoriti o industrijskoj eksploataciji ležišta gasnih hidrata? Dopisni član Akademije nauka SSSR-a N. V. Chersky odgovara na ovo pitanje: „Mnoge stotine hiljada kubnih metara gasa ekstrahovanog iz formacija gasnih hidrata Mesojahskog polja na Arktiku,“ kaže on, „već je stiglo u Norilsk Mining i Metalurški kombinat. Cena gasa je otprilike ista. Kao i obično, već je otkriveno više od 30 nalazišta čvrstog gasa. Naučnici u Moskvi, Novosibirsku i Jakutsku rade na problemima njihovog racionalnog razvoja i korišćenja."
>>Struktura čvrstih, tečnih i gasovitih tela
Dostavili čitaoci sa internet stranica
biblioteka fizike, časovi fizike, program fizike, apstrakti časova fizike, udžbenici fizike, gotovi domaći zadaci
Sadržaj lekcije sažetak lekcije podrška okvir prezentacije lekcije akcelerativne metode interaktivne tehnologije Vježbajte zadaci i vježbe samoispitivanje radionice, treninzi, slučajevi, potrage domaća zadaća diskusija pitanja retorička pitanja učenika Ilustracije audio, video i multimedija fotografije, slike grafike, tabele, šeme humor, anegdote, vicevi, strip parabole, izreke, ukrštene reči, citati Dodaci sažetakačlanci čipovi za radoznale cheat sheets udžbenici osnovni i dodatni glosar pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku elementi inovacije u lekciji zamjenom zastarjelih znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu smjernice diskusioni programi Integrisane lekcijeStanje agregacije supstance se obično naziva njenom sposobnošću da održi svoj oblik i zapreminu. Dodatna karakteristika su načini na koje supstanca prelazi iz jednog agregatnog stanja u drugo. Na osnovu toga razlikuju se tri agregatna stanja: čvrsto, tečno i gasovito. Njihova vidljiva svojstva su sljedeća:
Čvrsto tijelo zadržava i oblik i volumen. Može preći i u tečnost topljenjem, i direktno u gas sublimacijom.
- Tečnost - zadržava volumen, ali ne i oblik, odnosno ima tečnost. Prolivena tečnost ima tendenciju da se neograničeno širi po površini na koju se izliva. Tečnost može preći u čvrstu materiju kristalizacijom, a u gas isparavanjem.
- Gas - ne zadržava ni oblik ni zapreminu. Plin izvan bilo kojeg spremnika ima tendenciju da se neograničeno širi u svim smjerovima. U tome ga može spriječiti samo gravitacija, zahvaljujući kojoj se Zemljina atmosfera ne raspršuje u svemir. Gas prelazi u tečnost kondenzacijom, a direktno u čvrstu materiju može proći kroz taloženje.
Fazni prelazi
Prijelaz tvari iz jednog agregatnog stanja u drugo naziva se fazni prijelaz, jer je naučni sinonim za stanje agregacije faza materije. Na primjer, voda može postojati u čvrstoj fazi (led), tekućini (obična voda) i plinovitoj (para).
Primjer vode također dobro pokazuje sublimaciju. Veš okačen u dvorištu da se suši u mraznom danu bez vjetra odmah se promrzne, ali se nakon nekog vremena ispostavi da je suh: led sublimira, direktno se pretvarajući u vodenu paru.
U pravilu, fazni prijelaz iz čvrstog u tekućinu i plin zahtijeva zagrijavanje, ali temperatura medija se ne povećava: toplotnu energiju razbija unutrašnje veze u supstanci. To je takozvana latentna toplina faznog prijelaza. Kada je obrnuto fazni prelazi(kondenzacija, kristalizacija) ova toplota se oslobađa.
Zato su opekotine od pare tako opasne. Kada dođe u kontakt sa kožom, kondenzuje se. Latentna toplota isparavanja/kondenzacije vode je veoma visoka: u tom pogledu, voda je anomalna supstanca; Zato je život na Zemlji moguć. Prilikom parne opekotine, latentna toplota kondenzacije vode "opeći" opečeno mjesto veoma duboko, a posljedice opekotina parom su mnogo teže nego od plamena na istom dijelu tijela.
Pseudofaze
Fluidnost tečne faze supstance određena je njenom viskoznošću, a viskoznost je određena prirodom unutrašnjih veza, čemu je posvećen sledeći odeljak. Viskoznost tečnosti može biti veoma visoka, a takva tečnost može neprimetno da teče za oko.
Klasičan primjer je staklo. Nije čvrsta, već veoma viskozna tečnost. Imajte na umu da se staklo u skladištima nikada ne skladišti koso naslonjeno na zid. U roku od nekoliko dana pokleknut će pod vlastitom težinom i postati neupotrebljivi.
Drugi primjeri pseudo čvrstih tijela su smola za cipele i građevinski bitumen. Ako zaboravite ugaoni komad bitumena na krovu, on će se preko ljeta raširiti u kolač i zalijepiti za podlogu. Pseudočvrsta tijela mogu se razlikovati od pravih po prirodi topljenja: prava ili zadržavaju svoj oblik dok se ne rašire odjednom (lemi se prilikom lemljenja), ili plutaju, puštajući lokve i potoke (led). I vrlo viskozne tekućine postepeno omekšaju, poput iste smole ili bitumena.
Izuzetno viskozne tekućine, čija se tečnost ne primjećuje dugi niz godina i decenija, su plastika. Njihova visoka sposobnost da zadrže svoj oblik osigurava ogromna molekularna težina polimera, mnogo hiljada i miliona atoma vodika.
Struktura faza materije
U gasnoj fazi, molekuli ili atomi neke supstance su veoma udaljeni, mnogo puta veći od udaljenosti između njih. Međusobno komuniciraju povremeno i neredovno, samo tokom sudara. Sama interakcija je elastična: sudarile su se poput tvrdih loptica i odmah se raspršile.
U tečnosti, molekuli/atomi stalno "osećaju" jedni druge zbog veoma slabih veza hemijske prirode. Ove veze se stalno raskidaju i odmah se ponovo obnavljaju, molekuli tečnosti se neprestano kreću jedan u odnosu na drugi, te stoga tečnost teče. Ali da biste ga pretvorili u gas, morate prekinuti sve veze odjednom, a za to je potrebno mnogo energije, zbog čega tečnost zadržava svoj volumen.
U tom pogledu voda se razlikuje od ostalih supstanci po tome što su njeni molekuli u tekućini povezani takozvanim vodikovim vezama, koje su prilično jake. Stoga voda može biti tečnost na normalnoj temperaturi za cijeli život. Mnoge supstance sa molekulskom težinom desetine i stotine puta većom od vode, u normalnim uslovima, su gasovi, kao barem obični gasovi za domaćinstvo.
U čvrstom stanju, svi njegovi molekuli su čvrsto na svom mjestu zbog jakog hemijske veze između njih, formirajući kristalnu rešetku. Kristali pravilnog oblika zahtijevaju posebne uslove za svoj rast i stoga se rijetko nalaze u prirodi. Većina čvrstih materija su konglomerati malih i sićušnih kristala - kristalita, čvrsto povezanih silama mehaničke i električne prirode.
Ako je čitatelj vidio, na primjer, napuklu poluosovinu automobila ili rešetku od livenog gvožđa, onda su zrna kristalita na otpadu vidljiva jednostavnim okom. A na fragmentima razbijenog porculanskog ili fajansnog posuđa mogu se promatrati pod lupom.
Plazma
Fizičari razlikuju i četvrto agregatno stanje materije - plazmu. U plazmi se odvajaju elektroni atomska jezgra, a to je mješavina električno nabijenih čestica. Plazma može biti veoma gusta. Na primjer, jedan kubni centimetar plazme iz unutrašnjosti zvijezda bijelih patuljaka težak je desetine i stotine tona.
Plazma je izolirana u zasebno agregacijsko stanje jer s njom aktivno stupa u interakciju elektromagnetna polja jer su njegove čestice nabijene. AT slobodan prostor plazma teži da se širi, hladi se i pretvara u gas. Ali pod utjecajem elektromagnetnih polja, može zadržati svoj oblik i volumen izvan posude, poput čvrstog tijela. Ovo svojstvo plazme koristi se u termonuklearnim energetskim reaktorima - prototipovima elektrana budućnosti.






