Struktura i energetska svojstva čvrstih kristala
Prema sposobnosti vođenja struja Svi čvrsti materijali se obično dijele na provodnike, poluvodiče i dielektrike. Da li se provodni materijali klasifikuju kao provodnici? > 10 6 Ohm -1 cm -1; to uključuje metale u kojima je visoka provodljivost osigurana visokom koncentracijom provodnih elektrona. U dielektricima na sobnoj temperaturi ima vrlo malo elektrona, a njihova provodljivost je niska?< 10 -10 Ом -1 см -1 . В промежуточную группу попадают полупроводники, которые могут иметь концентрацию электронов, близкую к нулю (тогда они являются диэлектриками) и близкую к концентрации электронов в металле (тогда они являются проводниками).
Metali i poluprovodnici, osim što imaju različitu električnu provodljivost, razlikuju se i po zavisnosti električne provodljivosti o temperaturi. U metalima, električna provodljivost, po pravilu, opada gotovo linearno s porastom temperature. U poluvodičima, u kojima nema defekata i nečistoća (oni se obično nazivaju intrinzičnimi), s povećanjem temperature, provodljivost raste približno prema eksponencijalnom zakonu:
Razmotriti strukturu i energetska svojstva kristalno čvrste materije, koji uključuju silicijum i germanijum (poluprovodnike koji se najčešće koriste za proizvodnju poluprovodničkih uređaja), prvo se treba obratiti energetskim svojstvima jednog atoma.
Atom se sastoji od jezgra oko kojeg se kreću elektroni, stvarajući elektronsku ljusku. Ukupno negativni naboj ravnoteže elektrona pozitivan naboj jezgro, tako da je u normalnom stanju atom električno neutralan. Prema kvantna teorija, elektroni atoma mogu imati samo striktno određene energetske vrijednosti, koje se nazivaju dozvoljene. Ove energetske vrijednosti nazivaju se energetskim nivoima. Energetski nivoi elektrona su odvojeni jedan od drugog zabranjenim intervalima. Krećući se oko jezgre u određenim orbitama, elektroni se uklanjaju iz jezgre na različitim udaljenostima i, shodno tome, imaju različite energetske vrijednosti: što je dalje od jezgre, to je energija elektrona veća i slabije je povezan s jezgrom.
elektrona spoljašnjeg sloja elektronska školjka zove se valencija. Imaju najveću energiju i najmanje su vezani za jezgro. Grafički, energetski spektar elektrona u jednom atomu može se predstaviti kao energetski dijagram. Primjer takvog dijagrama prikazan je na sl. 1.1, a. Vrijednosti energije su iscrtane duž vertikale, a odgovarajući energetski nivoi su prikazani kao horizontalne linije. U skladu sa Paulijevim principom, najviše dva elektrona mogu istovremeno biti na istom energetskom nivou, koji imaju različite smjerove rotacije oko svoje ose (suprotni spinovi).
Ako je atom u normalnom stanju i ne apsorbira energiju izvana, tada su svi niži dozvoljeni energetski nivoi zauzeti elektronima; prelazak elektrona sa jednog nivoa na drugi je nemoguć. Viši dozvoljeni nivoi ostaju nezauzeti elektronima i nazivaju se slobodnim. Prelazak elektrona na viši nivo slobodne energije, tj. na orbitu udaljeniju od jezgra, moguće je samo kada apsorbira izvana strogo određeni dio (kvant) energije (toplotne, svjetlosne, električne, magnetske), jednak razlici energetskih vrijednosti slobodne i zauzete nivoe ovim elektronom. U ovom slučaju, atom prelazi u pobuđeno stanje.
Pobuđeno stanje atoma je vrlo nestabilno. Traje samo stomilioniti dio sekunde, a atom se vraća u svoje normalno stanje, što je praćeno tranzicijom elektrona nazad na prethodni energetski nivo. Prijelaz atoma iz pobuđenog u normalno stanje praćen je oslobađanjem viška energije u obliku kvanta elektromagnetnog zračenja.
Ako elektron primi dovoljan kvant energije, odvoji se od atoma, atom se ionizira: dijeli se na slobodni elektron i pozitivan ion. Obrnuti proces je udruživanje slobodnog elektrona i pozitivni ion u neutralni atom - naziva se rekombinacija i praćen je oslobađanjem viška energije u obliku kvanta zračenja. Oslobođena energija jednaka je energiji koja je ranije utrošena na ionizaciju atoma.
Prilikom formiranja kristala čvrste supstance dolazi do interakcije između atoma, usled čega se dozvoljeni energetski nivoi pojedinačnih atoma dele na N podnivoa, formirajući energetske zone (slika 1.1, b). U ovom slučaju, kao u jednom atomu, ne može biti više od dva elektrona sa suprotnim spinovima na jednom energetskom nivou (očuvan je Paulijev princip). Budući da je broj podnivoa (N) velik (u 1 cm 3 čvrste tvari ima oko 10 22 - 10 23 atoma), energetska udaljenost između podnivoa je vrlo mala, a elektron se može kretati s podnivoa na podnivo. od dna zone do plafona čak i uz male spoljne energetske uticaje, tj. ponaša se kao slobodan čovek. Ovo, međutim, važi samo ako gornji energetski nivoi u zoni nisu zauzeti, tj. područje nije u potpunosti popunjeno.
Energetski nivoi pojedinačnog atoma, okupirani elektronima na temperaturi apsolutne nule (T = 0 K), formiraju ispunjene zone u kristalu, od kojih je gornja zauzeta valentnih elektrona, naziva se valentni pojas.
Dozvoljeni viši energetski nivoi atoma koji nisu zauzeti elektronima na
T = 0 K, formiraju slobodne zone u kristalu. Slobodni pojas koji je najbliži valentnom pojasu naziva se provodni pojas, budući da se elektroni koji su tamo dospjeli mogu kretati između atoma i stvoriti električnu struju. Elektroni u ispunjenoj zoni ne mogu se kretati pod djelovanjem polja (i, shodno tome, dobiti energiju), jer su svi energetski nivoi zauzeti, a prema Paulijevom principu, elektron ne može prijeći iz zauzetog stanja u zauzeto. Dakle, elektroni potpuno ispunjene valentne zone ne učestvuju u stvaranju električne provodljivosti.
Između pojasa provodljivosti i valentnog pojasa nalazi se pojas Eg (mjeri se u elektronskim voltima (eV)), u kojem, prema zakonima kvantne mehanike, elektroni ne mogu biti (kao što elektroni u atomu ne mogu imati energije koje ne odgovaraju energijama elektronskih ljuski). Razmak u pojasu je glavni parametar koji određuje električna svojstvačvrsto telo.
Prema prirodi punjenja zona elektronima, sva tijela se mogu podijeliti u dvije velike grupe:
- to prva grupa obuhvataju tijela u kojima se samo djelomično ispunjena zona nalazi iznad potpuno ispunjenih zona (slika 1.2, a). Ova zona se javlja kada atomskom nivou, od kojeg se formira, nije u potpunosti ispunjen u atomu. Metalima je svojstveno prisustvo zone ispunjene samo djelimično. Metali nemaju jaz u pojasu;
- to druga grupa uključuju tijela u kojima se slobodne zone nalaze iznad potpuno ispunjenih zona (sl. 1.2, b, c). Tipični primjeri takvih tijela su hemijski elementi Grupa IV periodnog sistema: ugljenik u modifikaciji dijamanta, silicijum, germanijum i sivi kalaj, koji ima strukturu dijamanta. Ova grupa tijela uključuje mnoga hemijska jedinjenja - metalni oksidi, nitridi, karbidi, halogenidi alkalni metali itd.
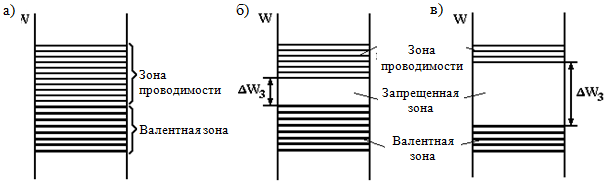
Prema širini zabranjene zone, tijela druge grupe uvjetno se dijele na dielektrike i poluvodiče. To dielektrika uključuju tijela s relativno širokim pojasom. Za tipične dielektrike, E g > 3 eV. Dakle, za dijamant E g = 5,2 eV; za bor nitrid E g = 4,6 eV; za A1 2 O 3 E g \u003d 7 eV, itd.
To poluprovodnici uključuju tijela koja imaju relativno uzak pojas (slika 1.2, b). Za tipične poluprovodnike, E g ? 1 eV, na primjer:
- za germanijum E g = 0,72 eV;
- silicijum ima E g = 1,12 eV;
- za indijum antimonid E g = 0,17 eV;
- za galijum arsenid E g = 1,43 eV, itd.
Energetski dijagrami metala, poluprovodnika i dielektrika na
T = 0 K prikazani su na sl. 1.2. Na ovim dijagramima valentni pojas, koji je ispunjen elektronima, prikazan je debljim punim linijama, a pojas provodljivosti, u kojem nema elektrona pod ovim uslovima, tankim linijama.
Odgovori na kolokvijum №2 iz fizike.
Energetski nivoi atoma i molekula. Kvantni prijelazi u atomima i molekulima. Apsorpcija i emisija energije od strane atoma i molekula, apsorpcijski i emisioni spektri.
Elektronski nivoi energije u atomu Elektroni u nepobuđenom stanju ispunjavaju nižu energiju. nivoa, a gornji nivoi su besplatni. Ako atom primi energiju kao rezultat sudara s drugim atomima ili apsorbiranjem kvanta svjetlosti, tada prelazi u pobuđeno stanje i bilo koji elektron atoma prelazi s donjeg nivoa na jedan od gornjih. Nakon kratkog vremenskog perioda, vraća se na niži nivo, emitujući kvantum svjetlosti određene frekvencije.
Molekule se sastoje od atoma koji međusobno djeluju, unutarmolekularno kretanje je složenije od intraatomskog. U molekuli, pored kretanja elektrona u odnosu na jezgra, oscilirajuće kretanje atoma oko njihovog ravnotežnog položaja i rotacijskog kretanja molekula kao cjeline. Elektronsko, vibraciono i rotaciono kretanje molekula odgovara tri tipa nivoa energije: jegulja, ekol, heb. Ukupna energija molekula je: E=Eel+Eur+Ecol. Prema kvantnoj mehanici, vibracijska i rotaciona energija molekula, kao i elektronska energija, imaju kvantni karakter, tj. mijenjati diskretno. Udaljenost između vibracionih nivoa je mnogo manja nego između elektronskih. Stoga se svaki elektronski nivo molekula raspada na više vibracionih nivoa (podnivoa). Zauzvrat, svaki vibracioni nivo molekula odgovara broju rotacionih podnivoa, među kojima je rastojanje čak i manje nego između vibracionih nivoa.
Stacionarna energija. stanje: energija se ne emituje niti apsorbuje. U kvantnim prijelazima, atomi i molekuli skače iz jednog stacionarnog stanja u drugo, iz jednog nivo energije drugi. To je zbog energetskih prijelaza elektrona.
Prilikom prelaska sa viših energetskih nivoa na niže, atom ili molekula odaju energiju, inače apsorbuju. Atom u svom osnovnom stanju može apsorbirati samo energiju.
Energija koju emituju atomi ili molekuli formira emisioni spektar, a apsorbovana energija formira apsorpcioni spektar.
At prelaz elektrona u atomu energija se oslobađa ili apsorbuje u obliku kvanta EM zračenja. Spektri atomske emisije i apsorpcije su linijski.
Prijelaz u molekulima:
Kao rezultat činjenice da se elektronski nivoi u molekulu raspadaju na vibracione i rotacione podnivoe, broj mogućih energetske tranzicije značajno povećava u odnosu na atome. Stoga molekularni spektri postaju složeniji, imaju kontinuirani karakter.
∆E >>∆Epol.> ∆Eur.
∆Ee ~ 1-3 EV λ~ 0,5 μV
∆Epol. ~ 10 -2 -10 -1 EP λ~1-100mkV
∆Heb. ~ 10 3 -10 -5 V λ~100-1000 mkV
apsorpcija energije molekula
2- zračenje energije atoma na molekulu
Spektri luminescencije, emisije i apsorpcije, Stokesovo pravilo. Upotreba luminescencije u biofizici i medicini.
Luminescencija- zračenje, koje je višak u odnosu na toplotno zračenje na datoj temperaturi, i ima period t (10 -15) veći od perioda svjetlosnog talasa. Luminescencija se javlja na bilo kojoj temperaturi. Luminescentne tvari sijaju bez zagrijavanja. Nikada nije balansiran.
Prema vrsti ekscitacije, luminiscencija je:
1) Fotoluminiscencija - pobuđivanje svjetlom;
2) Elektroluminiscencija - ekscitacija električno polje;
3) Hemiluminiscencija (pobuda putem hemijske reakcije).
Utjecaj ovih izvora dovodi do ekscitacije atoma, molekula ili jona luminiscentne tvari. Zračenje nastaje kao rezultat kvantnih prijelaza čestica materije iz pobuđenih stanja u tlo (ili manje pobuđeno)
Prema trajanju sjaja fotoluminiscencija se dijeli na:
Fluorescencija - kratkotrajni naknadni sjaj
Fosforescencija - relativno dug naknadni sjaj

Spektar luminiscencije je kontinuiran.
Osnovne karakteristike luminiscencije.
1) kvantni prinos:
ζ= 100% N(emisija)/N(apsorpcija),
gdje je N(zračenje) broj kvanta koji su dali svjetlost,
N(apsorbovati) – broj apsorbovanih kvanta.
2) D je optička gustina uzorka.
D=lgI 0 /I λ =Esl, gdje je E indeks molekularne apsorpcije
3) D= f(λ ) je spektar apsorpcije
I λ = f(λ ) je emisioni spektar
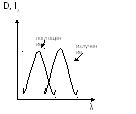
Stokesovo pravilo:
Spektar apsorpcije date supstance se pomera u odnosu na emisioni spektar prema kraćim talasnim dužinama.
Upotreba luminiscencije u biofizici i medicini:
fotoluminiscencija:
Detekcija početne faze kvarenja hrane
Razvrstavanje farmakoloških preparata
Dijagnoza određenih bolesti (sjaj kose, ljuskica, noktiju kod dijagnosticiranja njihovog oštećenja gljivicom ili lišajevom)
Na osnovu fotoluminiscencije stvoreni su izvori svjetlosti čiji je spektar sličniji dnevnom svjetlu nego žarulja sa žarnom niti (fluorescentne lampe)
Hemiluminiscencija - primjena u dijagnostici
Upotreba specijalnih fluorescentnih molekula koji se dodaju membranskim sistemima izvana. Takvi molekuli se nazivaju fluorescentne sonde ili oznake. Njihova promjena omogućava otkrivanje konformacijskih preuređivanja u proteinima u membranama.
indukovana emisija. Inverzna populacija nivoa. Optički kvantni generatori (laseri). Svojstva lasersko zračenje i njegovu upotrebu u medicini.
stimulisana emisija je prisilni prijelaz pobuđene čestice na niži nivo. U ovom slučaju, broj prijelaza u sekundi zavisi od broja fotona koji ulaze u supstancu u isto vrijeme, tj. od intenziteta svetlosti. Osim toga, prisilne tranzicije će biti određene populacijom odgovarajućih energetskih stanja. populaciona inverzija- takvo stanje medija u kojem je broj čestica na jednom od gornjih nivoa veći od chm na donjem. Inverzna populacija nivoa je obezbeđena činjenicom da elektroni mogu ostati na metastabilnom nivou 10 -5 puta duže nego na pobuđenom nivou.
Vv 1960 prvi kvantni generator vidljivog opsega zračenja - laser sa rubinima kao radnom supstancom. Stvara impulsno zračenje talasne dužine od 694,3 nm.
Princip rada lasera je sličan luminiscenciji.
![]()
![]()
Al 2 O 3 + Cr 2 O 3 - rubin
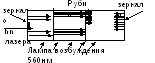
Osobine laserskog zračenja
Lasersko zračenje je uvijek monohromatsko
Polarizacija
Zraci se ne razilaze, striktno paralelni
Možete dobiti vrlo visoke intenzitete.
Laserska aplikacija:
Identifikacija DNK i proteina.
Oftalmologija
Liječenje trofičnih ulkusa, malignih tumora
Laseri koji rade u kontinuiranom režimu koriste se za operacije na obilno snabdjevenim organima.
Rentgensko zračenje: karakteristično i kočno zračenje; mehanizam zračenja, spektri karakterističnih i kočnih rendgenskih zraka.
rendgensko zračenje je elektromagnetski talas u opsegu od 80 do 10 -4 nm. Dugotalasno rendgensko zračenje se preklapa sa kratkotalasnim UV zračenjem, kratkotalasno sa dugotalasnim γ-zračenjem. Prema načinu ekscitacije, rendgensko zračenje se dijeli na kočno i karakteristično
kočnicaRe-zračenje.
Zračenje koje nastaje kada se elektron usporava u materijalu anode naziva se kočno rendgensko zračenje. Kada se elektroni usporavaju, samo dio energije odlazi na stvaranje fotona, drugi dio se troši na zagrijavanje anode. Pošto je odnos između ovih delova slučajan, kada se veliki broj elektrona uspori, formira se kontinuirani spektar rendgenskog zračenja.
Spektar kočnog zračenja: (1) - pri različitim naponima u rendgenska cijev)
Fluks rendgenskih zraka se mjeri po formuli:
F=KUa-kIZ 2), gde je U, I - napon i struja u rendgenskoj cevi, Z - redni broj atomske supstance anode, k=10 -9 V -1 - - koeficijent proporcionalnosti.
F=- λ min ˜ ∫F λ d λ
Ako se temperatura katodne niti poveća, tada će se povećati emisija elektrona i struja u cijevi. Ovo će povećati broj rendgenskih fotona koji se emituju svake sekunde. Ali njegov spektralni sastav se ne mijenja.
2) Karakteristično rendgensko zračenje.
Povećanje napona na rendgenskoj cijevi dovodi do činjenice da se na pozadini kontinuiranog spektra pojavljuje linija, koja odgovara karakterističnom rendgenskom zračenju. Elektroni ubrzani visokim naponom prodiru duboko u atom i izbacuju elektrone iz njegovih unutrašnjih slojeva. Elektroni sa gornjih nivoa prelaze na slobodna mesta, usled čega se emituju fotoni karakterističnog zračenja.
Karakteristični rendgenski spektar atom ne zavisi od hemijskog spoja u koji je ovaj atom uključen. Spektar:
Interakcija rendgenskih zraka sa materijom (koherentno rasipanje, fotoelektrični efekat, Comptonov efekat). Zakon slabljenja intenziteta rendgenskih zraka. Zaštita od rendgenskih zraka.
Interakcija rendgenskog zračenja sa materijom
1)
Koherentno rasipanje– rasipanje dugotalasnih X zraka Stanje: hn hn 1 = hn 2, gdje je n frekvencija. 2)
fotoelektrični efekat. hn≥A i. U ovom slučaju, rendgenski kvant se apsorbuje, a elektron se odvaja od atoma. Odvojeni elektron dobija kinetička energija. Ako je velika, onda elektron može ionizirati susjedne atome sudarom. uklanjanje elektrona - proces jonizacije hn \u003d Eion + m 0 v 2 / 2 3) Comptonov efekat hn>>Ai. U ovom slučaju, elektron se odvaja od atoma i dobiva određenu kinetičku energiju. Energija samog fotona se smanjuje. To. kao rezultat nekoherentnog raspršenja (Comptonov efekat), nastaje sekundarno raspršeno zračenje i dolazi do jonizacije atoma materije. hn \u003d Eion + mv 2 / 2 + hn Zakon slabljenja intenziteta rendgenskih zraka: Ix \u003d I 0 e -µx µ=µ p +µ p doprinos svakog procesa procesa je određen energijom fotona. fotoelektrični efekat Comptonov efekat 6. Uređaj rendgenske cijevi i rendgenskog aparata. Krutost i intenzitet zračenja, njihovo prilagođavanje. Metoda za dobijanje rendgenskih zraka. Upotreba rendgenskih zraka u medicini. Uređaj sa rendgenskom cijevi: Cev je staklena boca (sa eventualno visokim vakuumom), sa dve elektrode: anodom i katodom, na koje se primenjuje visoki napon. Katoda je izvor elektrona. Anoda je metalna šipka nagnuta površina kako bi se rendgenski zraci koji se pojavljuju pod uglom usmjerili prema osi cijevi. Pod dejstvom visokog napona, elektroni koje emituje nit vruće katode ubrzavaju se do visoke energije. Kinetička energija koju dobija elektron jednaka je radu električnih sila i proporcionalna je naponu između katode i anode. Rentgensko zračenje nastaje kao rezultat intenzivnog usporavanja brzih elektrona u materijalu anode pri sudaru sa njegovim atomima (interakcija sa električnim poljem atomsko jezgro i elektrona). Ua-k≈100∙10 3 V λmin= hc/ eUa-k 1) Rendgenski zraci kratkotalasne dužine obično imaju veću prodornu moć od dugotalasnih i nazivaju se tvrdi, a dugotalasno meki. Meko zračenje materija jače apsorbuje. Povećanjem napona na rendgenskoj cijevi mijenja se spektralni sastav zračenja i povećava krutost. Dobivanje rendgenskih zraka. Ako se nehomogeno tijelo postavi na putanju rendgenskih zraka, a ispred njega se postavi fluorescentni ekran, tada ovo tijelo, apsorbirajući ili prigušujući zračenje, formira sjenu na ekranu. Po prirodi ove sjene može se suditi o obliku, gustoći, strukturi iu mnogim slučajevima o prirodi tijela. one. značajna razlika u apsorpciji rendgenskog zračenja od strane različitih tkiva omogućava vam da vidite sliku unutrašnjih organa u projekciji sjene. µ1<µ2
I 2 < primjena rendgenskog zračenja u medicini: rendgenska dijagnostika: 1) Fluoroskopija (rendgenska cijev se nalazi iza pacijenta. Fluorescentni ekran se nalazi ispred njega. Na ekranu se uočava senka (pozitivna) slika). 2) radiografija (predmet se postavlja na kasetu u koju je umetnut film sa posebnom fotografskom emulzijom. Rendgenska cijev se nalazi iznad objekta. Dobijeni radiograf daje negativnu sliku, tj. suprotno od slike. uočeno tokom transmisije.. Kod ove metode postoji veća jasnoća slike. Obećavajuća varijanta ove metode je rendgenska tomografija i kompjuterska tomografija). 3) Fluorografija 4) Rentgenska terapija - upotreba rendgenskih zraka za uništavanje malignih tumora. 7. Princip rendgenske tomografije. Rentgenski tomograf. Njegov uređaj. Koje su glavne razlike između rendgenskog tomograma i rendgenskog snimka? 1) Ponovna apsorpcija µ - koeficijent apsorpcije, svojstva tkiva 2) Ponovno učenje Ia = I 0 e -µ x 1 Iv \u003d I 0 e -µ2 x 2 Iv \u003d I 0 e -µ1x1 e -µ2x2 = I 0 e - (µ1x1 + µ2x2) Svrha dijagnoze. Odrediti µ3 i ∆µ3 lnI1/I 0 = -(µ1+µ2)∆h lnI2/I 0 = -(µ3+µ4)∆h lnI3/I 0 = -(µ3+µ1)∆h lnI4/I 0 = -(µ4+µ2)∆h I 0 - set I1,I2,I3,I4 - izmjereno (poznato) ∆x - skup (poznat) naći µ1µ2µ3µ4 rješavanjem sistema od 4 jednačine 2048∙2048= 4194304 Sistem Radonovih teorema Ako uzmem beskonačan broj slika nekog objekta, onda ga je moguće vratiti s bilo kojom točnošću. Tehničko rješenje. faza: merenja I1,I2,I3,I4… faza: izgradnja imidža Svakoj vrijednosti µ, PC dodjeljuje vlastitu svjetlinu (boju) 1 kriška - 1 sekunda Kontrast ∆µ/µ=0,1% (za 10%) Debljina sloja - 1-2mm Granica rezolucije 0,2 mm Tomografijom je moguće dobiti slojevitu rendgensku sliku tijela s detaljima manjim od 2 mm. To vam omogućava da razlikujete sive i bijele tvari mozga i vidite vrlo male tumorske stanice. obrazovanje 8. Vrste jonizujućeg zračenja. Djelovanje jonizujućeg zračenja na materiju. Apsorbovane, ekspozicijske i biološke (ekvivalentne) doze, odnos između njih. Jedinice doza u SI sistemu i nesistemske jedinice koje se koriste u medicini. U procesu zračenja fenomena radioaktivnosti otkrivene su 3 vrste zraka koje emituju radioaktivna jezgra. Alfa raspad sastoji se u spontanoj transformaciji jezgra sa emisijom α-čestica (jezgra helijuma). A Z X → A-4 Z -2 Y+ 4 2 Tokom α-raspada, kćerka jezgra se može formirati u pobuđenom stanju. U ovom slučaju energija pobuđenog jezgra se najčešće oslobađa u obliku -kvanta. Stoga je alfa raspad praćen zračenjem. beta raspad sastoji se u spontanoj transformaciji jezgra sa emisijom elektrona (ili pozitrona). A Z X→ A Z +1 Y + 0 -1 β +ν Gdje je ν oznaka antineutrino čestice. Elektron nastaje kao rezultat intranuklearne transformacije neutrona u proton. Gama zračenje ima elektromagnetnu prirodu i predstavlja foton sa talasnom dužinom od λ≤10 -10 m Zračenje ovog tipa prati ne samo -raspad, već i složenije nuklearne reakcije. Interakcija sa materijom: Nabijena čestica koja prolazi kroz materiju gubi svoju energiju zbog jonizacionog otpora. Istovremeno, njegova kinetička energija se troši na pobuđivanje i ionizaciju atoma medija. Za kvantitativno karakterizaciju interakcije nabijene čestice sa supstancom koriste se sljedeće veličine: linearna gustina jonizacije, i, broj parova jona formiranih po jedinici putanje čestice: i=dn/dl linearna zaustavna moć supstance (S) je energija koju naelektrisana čestica gubi po jedinici puta: S=dE/dl prosječni linearni raspon nabijene jonizujuće čestice (R) je udaljenost između početka i kraja raspona čestica u datoj supstanci. Karakteristične karakteristike interakcije različitih vrsta zračenja sa materijom: Alfa zračenje: Kako se alfa čestica kreće u mediju, prvo se povećava I (sa smanjenjem brzine povećava se vrijeme koje provede u blizini molekula medija, pa se povećava vjerovatnoća ionizacije), a na kraju ciklusa (x = R ) naglo se smanjuje, što je povezano sa smanjenjem brzine kretanja. Kada energija čestice postane manja od energije potrebne za jonizaciju, formiranje jona prestaje. Grafikon zavisnosti linearne gustine jonizacije od puta koji prelazi alfa čestica u mediju: Ionizacija i ekscitacija su primarni procesi. Sekundarni: povećanje brzine molekularnog termičkog kretanja, karakteristično rendgensko zračenje, radioluminiscencija, hemijski procesi. Beta zračenje. Izaziva jonizaciju, ekscitaciju, rendgensko zračenje (kada se elektroni usporavaju), karakteristično Čerenkovljevo zračenje, kada brzina elektrona u mediju premašuje brzinu svjetlosti u ovoj sredini. Gama zračenje izaziva blagu primarnu jonizaciju, koherentno i nekoherentno rasejanje, jonizujući fotoelektrični efekat, formiranje elektron-pozitronskih parova, fotonuklearne reakcije usled interakcije kvanta sa jezgrom. Apsorbirana doza (D)
-
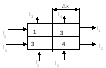
vrijednost jednaka omjeru energije ∆E prenesene na element ozračene tvari i mase m ovog elementa: D=∆E /m. U C, jedinica apsorbirane doze je siva (Gy). 1 Gy odgovara dozi zračenja pri kojoj se energija jonizujućeg zračenja od 1 J prenosi na ozračenu supstancu težine 1 kg Nesistemska jedinica 1rad=10 -2 Gy Doza ekspozicije zračenje (X) karakteriše jonizujući efekat rendgenskog i γ-zračenja u vazduhu koji okružuje ozračeno telo. SI jedinica doze izloženosti je C/kg. SI jedinica doze izloženosti je C/kg. 1C/kg odgovara ekspozicijskoj dozi fotonskog zračenja, pri kojoj se, kao rezultat jonizacije 1 kg suhog zraka (n.c.), formiraju ioni sa nabojem od 1C svakog znaka. Jedinica brzine ekspozicije je 1A/kg, a jedinica van sistema je 1R/s. Budući da je doza zračenja proporcionalna upadnom jonizujućem zračenju, treba postojati proporcionalan odnos između doze zračenja i ekspozicije: D=fH, gdje je f određeni prijelazni koeficijent ovisno o ozračenoj tvari i energiji fotona. Ekvivalentna doza - (N) koristi se za procjenu djelovanja jonizujućeg zračenja na biološke objekte; ima istu dimenziju kao i apsorbovana doza zračenja, ali se naziv razlikuje. U SI: Sievert [Sv], 1Sv=1J/kg Vansistemska jedinica: 1ber=10 -2 Sv. Postoji veza između izloženosti i apsorbiranih doza: H=KD, gdje je K faktor kvaliteta (pokazuje koliko je puta efektivnost biološkog djelovanja ove vrste zračenja veća od efekta fotonskog zračenja, uz istu dozu zračenja u tkivima). 9. brzina doze. Odnos između ekspozicijske doze i aktivnosti radioaktivnog preparata. Brzina doze je vrijednost koja određuje dozu koju objekt primi u jedinici vremena. Kod jednolikog dejstva zračenja, brzina doze N je numerički jednaka odnosu doze D i vremena t tokom kojeg je delovalo jonizujuće zračenje: N=D/t. Jedinica za brzinu doze zračenja je siva (Gy), što odgovara dozi zračenja pri kojoj se energija jonizujućeg zračenja od 1J prenosi na ozračenu supstancu težine 1 kg; brzina doze zračenja izražena je u Gy/sec. Nesistemska jedinica doze zračenja je rad (1 rad=10 -2 Gy=100erg/g), njena snaga je rad po sekundi. Ekspozicijska doza zračenja (X) karakteriše jonizujući efekat rendgenskog i γ-zračenja u vazduhu koji okružuje ozračeno telo. SI jedinica doze izloženosti je C/kg. 1C/kg odgovara ekspozicijskoj dozi fotonskog zračenja, pri kojoj se, kao rezultat jonizacije 1 kg suhog zraka (n.c.), formiraju ioni sa nabojem od 1C svakog znaka. Jedinica brzine ekspozicije je 1A/kg, a jedinica van sistema je 1R/s. Budući da je doza zračenja proporcionalna upadnom jonizujućem zračenju, treba postojati proporcionalan odnos između doze zračenja i ekspozicije: D=fH, gdje je f određeni prijelazni koeficijent ovisno o ozračenoj tvari i energiji fotona. Za vodu i ljudska meka tkiva, f=1, dakle, doza zračenja u rads je numerički jednaka odgovarajućoj dozi izlaganja u rendgenima. Odnos između brzine doze izloženosti i aktivnosti radioaktivnog preparata: Iz izvora γ-fotoni lete u svim smjerovima. Broj ovih fotona koji prodiru kroz 1m 2 površine određene sfere za 1s je proporcionalan aktivnosti A i obrnuto proporcionalan površini sfere (4πr 2) / Brzina doze ekspozicije (X / t) u zapremina V zavisi od broja fotona, jer upravo oni izazivaju jonizaciju: X /t=k γ A/r 2 Gdje je k γ - što je tipično za dati radionuklid. 10. Zakon radioaktivnog raspada (zaključak). Pravni grafikon. umjetna radioaktivnost. Tagged atom metoda, primjena u medicini. radioaktivnog raspada je statistički fenomen. Neka se dN jezgra raspadnu u kratkom vremenskom intervalu dt. Ovaj broj je proporcionalan vremenskom intervalu dt, kao i ukupnom broju N radioaktivnih jezgara: dN=-λNdt, gdje je λ konstanta raspada, koja je proporcionalna vjerovatnoći raspada radioaktivnog jezgra t, koja je različita za različita radioaktivna jezgra, opada s vremenom. Integriramo rezultirajući izraz i dobijemo lnN/N 0 =-λt. N= N 0 e - λt . Ovo je osnovni zakon radioaktivnog raspada: za isti vremenski period, isti dio početnog broja jezgara se raspada. Procesi radioaktivnog raspada za dvije supstance λ1>λ2. Zadatak broj 1.
Koji su dijelovi biljne ćelije vidljivi pod svjetlosnim školskim mikroskopom?
1. Ribozomi 2. Mitohondrije 3. Ćelijski zid 4. Plazma membrana Objašnjenje: veliki dijelovi ćelija vidljivi su pod svjetlosnim mikroskopom. Od prikazanih, tako velika organela je stanični zid (prilično je debeo), a plazma membranu je teško vizualno (s malim povećanjem) izolirati od ćelijskog zida. Tačan odgovor je 3. Zadatak broj 2.
Fragment molekule DNK, koji se sastoji od 12 nukleotida, pohranjuje informacije o
1. 4 aminokiseline u molekulu proteina 2. 16 nukleotida tRNA molekula 3. 12 aminokiselina mRNA molekula 4. 24 nukleotida rRNA molekula Objašnjenje: Tri nukleotida molekula DNK kodiraju jednu aminokiselinu (ova struktura se naziva triplet), tako da 12 nukleotida DNK kodira 4 aminokiseline u molekulu proteina. Tačan odgovor je 1. Zadatak broj 3.
Prijelaz elektrona na viši energetski nivo događa se u svjetlosnoj fazi u molekulima
1. Hlorofil 2. Voda 3. Glukoza 4. Ugljični dioksid Objašnjenje: tokom fotosinteze, molekula klorofila prelazi u pobuđeno stanje, jer upravo od pigmenta počinje lanac biohemijskih reakcija tokom fotosinteze. Tačan odgovor je 1. Zadatak broj 4.
U toku individualnog razvoja životinje iz zigote se razvija višećelijski organizam
1. Mejoza 2. Mitoza 3. Filogenija 4. Gametogeneza Objašnjenje: nakon formiranja zigote, zigota se počinje dijeliti upravo mitozom (ovo je proces diobe somatskih stanica), odnosno iz jedne diploidne ćelije nastaju dvije diploidne ćelije: dvije iz jedne ćelije, 4 iz dvije, 8 od četiri, itd. Tačan odgovor je 2. Zadatak broj 5.
Posebnost aseksualnog razmnožavanja je da se iz njega razvija novi organizam
1. Muška gameta 2. Neoplođeno jaje 3. Zigote sa dvostrukim setom hromozoma 4. Somatska ćelija sa dvostrukim setom hromozoma Objašnjenje: aseksualna reprodukcija nije povezana sa zametnim stanicama, stoga je, iz predstavljenih opcija odgovora, aseksualna reprodukcija moguća samo kada se organizam razvije iz somatske stanice s dvostrukim setom kromosoma. Vegetativnom reprodukcijom dobija se ćerki organizam, identičan roditeljskom. Tačan odgovor je 4. Zadatak broj 6.
Odredite obrazac razmnožavanja ako je poznato da kada se okrugloplodni paradajz, čiji je genotip nepoznat, ukršta sa kruškolikim paradajzom (recesivno svojstvo), 50% potomaka ima plodove kruškolikog oblika. 1. AA x aa 2. Aa x aa 3. Aa x Aa 4. AA x AA Objašnjenje: 50% potomaka će imati kruškoliki plod samo ako se heterozigot ukrsti sa homozigotom za recesivnu osobinu - Aa x aa. Tačan odgovor je 2. Zadatak broj 7.
Nezavisna divergencija homolognih hromozoma u mejozi je uzrok varijabilnosti
1. Genomski 2. Kombinativna 3. Hromozomski 4. Citoplazmatski Objašnjenje: kombinativna varijabilnost - varijabilnost koja se javlja kada se roditeljski geni rekombinuju. Razlozi mogu biti kršenja u: križanju u metafazi mejoze, divergenciji kromosoma u mejozi, fuziji zametnih stanica. Tačan odgovor je 2. Zadatak broj 8.
N.I. Vavilov je, proučavajući osobine nasljeđivanja svojstava kultiviranih biljaka, potkrijepio zakon 1. Homologne serije u nasljednoj varijabilnosti 2. Nezavisno nasljeđivanje nealelnih gena 3. Dominacija hibrida prve generacije 4. Naslijeđe vezano za spol Objašnjenje: N.I. Vavilov je formulisao zakon homoloških nizova, koji glasi: zbog velike sličnosti njihovih genotipova (gotovo identičnih skupova gena), blisko srodne vrste imaju sličnu potencijalnu naslednu varijabilnost (slične mutacije identičnih gena); kako evolutivno-filogenetsko uklanjanje proučavanih grupa (taksona), zbog nastalih genotipskih razlika, paralelizam nasljedne varijabilnosti postaje manje potpun. Shodno tome, osnova paralelizama u nasljednoj varijabilnosti su mutacije homolognih gena i genotipskih regija kod predstavnika različitih taksona, odnosno istinski homologna nasljedna varijabilnost. Međutim, čak i unutar iste vrste, spolja slični karakteri mogu biti uzrokovani mutacijama u različitim genima; takve fenotipske paralelne mutacije različitih gena mogu se, naravno, pojaviti i kod različitih, ali prilično blisko povezanih vrsta. Tačan odgovor je 1. Zadatak broj 9.
Carstvo bakterija uključuje
1. Chlamydomonas 2. E. coli 3. Infuzorija-cipela 4. Malarijski plazmodijum Objašnjenje: chlamydomonas, cilijatna papučica i malarijski plazmodijum su protozoe, a Escherichia coli ( Escherichia coli - bakterija. Tačan odgovor je 2. Zadatak broj 10.
Krtola, lukovica je
1. Organi disanja tla 2. Modifikovani izdanci 3. Generativni organi 4. Rudimentarni izdanci Objašnjenje: gomolj i lukovica (kao i, na primjer, rizom) su modificirani izdanci. Tačan odgovor je 2. Zadatak broj 11.
Paprati se, za razliku od cvjetnica, razmnožavaju
1. Spor 2. Korijeni 3. Rhizome 4. Pupanje Objašnjenje: cvjetnice se razmnožavaju sjemenkama, dok se paprati razmnožavaju sporama. Tačan odgovor je 1. Zadatak broj 12.
Koje klase artropoda imaju jednostavne oči i četiri para hodajućih nogu?
1. Insekti 2. Glavonošci 3. Školjke 4. Arachnids Objašnjenje: pogledaj sliku i zaključi da je tačan odgovor 4. Zadatak broj 13.
Visoka brzina metabolizma omogućava pticama
1. Vodite računa o potomstvu 2. Polagati jaja u gnijezda 3. Jedite biljnu hranu 4. Potrošite mnogo energije tokom leta Objašnjenje: visoka brzina metabolizma je jedna od adaptacija za letenje, pa se odlučujemo da trošimo mnogo energije tokom leta. Tačan odgovor je 4. Zadatak broj 14.
Ako osoba pati od anemije, tada je u njegovoj krvi, u poređenju s normom, sadržaj
1. Leukociti 2. Crvena krvna zrnca 3. Trombociti 4. Fibrinogen Objašnjenje: anemija (drugi naziv - anemija) se izražava u smanjenom sadržaju crvenih krvnih zrnaca - eritrocita i/ili hemoglobina. Simptomi bolesti: vrtoglavica, povećan umor itd. zbog nedovoljnog snabdijevanja ćelija kiseonikom. Tačan odgovor je 2. Zadatak broj 15.
Primarna razgradnja složenih ugljikohidrata u ljudskom tijelu se događa u
1. Usna šupljina pod dejstvom enzima pljuvačke 2. Želučane šupljine pod dejstvom enzima pepsina 3. Ćelije jetre koje skladište glikogen 4. Ćelije pankreasa koje proizvode hormone Objašnjenje: enzim proizveden u želucu i usnoj šupljini – amilaza započinje razgradnju složenih ugljikohidrata – polimera u usnoj šupljini. Tačan odgovor je 1. Zadatak broj 16.
Funkciju uništavanja stranih mikroorganizama u ljudskoj krvi obavlja
1. Neuroni 2. Crvena krvna zrnca 3. Epitelne ćelije 4. Limfociti Objašnjenje: limfociti su ćelije imuniteta, odnosno bore se sa stranim mikroorganizmima u ljudskoj krvi. Tačan odgovor je 4. Zadatak broj 17.
Ljudski vizuelni analizator pretvara uticaj sumraka u nervne impulse
1. Očno sočivo 2. Zjenica irisa 3. Retinalni štapići 4. Sklera očne jabučice Objašnjenje: receptori koji percipiraju svjetlosne signale u sumrak i mrak su retinalni štapići. Od njih se signal prenosi u centralni nervni sistem. Tačan odgovor je 3. Zadatak broj 18.
Udvajanje slomljenog ekstremiteta
1. Smanjuje krvarenje 2. Smanjuje edem ekstremiteta 3. Sprječava prodiranje mikroorganizama u mjesto prijeloma 4. Sprečava pomeranje slomljenih kostiju Objašnjenje: na slomljeni ekstremitet se postavlja udlaga kako bi se spriječilo pomicanje kostiju. Tačan odgovor je 4. Zadatak broj 19.
Kreativna uloga prirodne selekcije se manifestuje u
1. Jačanje intraspecifične borbe 2. Razvoj novih staništa od strane organizama 3. Pojava novih mutacija 4. Pojava novih vrsta Objašnjenje: prirodna selekcija je jedna od pokretačkih snaga evolucije. Cilj evolucije je stvaranje najprilagođenijih vrsta u datim uslovima, pa se kreativna uloga prirodne selekcije manifestuje i u stvaranju novih vrsta. Tačan odgovor je 4. Zadatak broj 20.
U savremenoj biološkoj nauci populacijom se smatra
1. Ukupnost organizama jednog kraljevstva 2. Pojedinci koji formiraju lanac ishrane 3. Jedinke različitih vrsta koje formiraju biocenozu 4. Jedinke iste vrste koje žive na istoj teritoriji Objašnjenje: populacija - grupa jedinki iste vrste koje žive na istoj teritoriji i slobodno se ukrštaju. Tačan odgovor je 4. Zadatak broj 21.
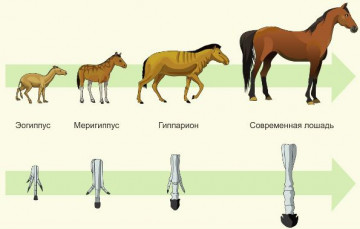
Filogenetski niz konja svjedoči o (oko)
1. Reverzibilnost procesa evolucije 2. Redovno vraćanje rodnim oblicima 3. Sličnost postembrionalnog razvoja organizama 4. Istorijski razvoj modernog izgleda Objašnjenje: Razmotrite filogenetski niz konja. Kao što se vidi sa slike, filogenetski niz vrste je praćenje faza njenog istorijskog razvoja. Tačan odgovor je 4. Zadatak broj 22.
Koji od sljedećih primjera ilustruje kompetitivni odnos između organizama?
1. Vjeverica - djetlić 2. Hrast - bijela gljiva 3. Krava - bikova trakavica 4. Već - žaba Zadatak broj 23.
Kao rezultat dugotrajnih biotičkih odnosa, posmatra se grabežljivac-plijen u prirodnoj biocenozi
1. Neregulisano povećanje broja predatora 2. Redovne fluktuacije u obilju obe grupe organizama 3. Akumulacija mutantnih alela u genskom fondu žrtava 4. Manifestacija dominantnih osobina u populaciji predatora Objašnjenje: uz dugotrajnu vezu grabežljivac-plijen, održava se konstantan broj ove dvije vrste, ali zbog promjena uslova okoline dolazi do populacijskih talasa koji se postepeno gase postojanošću ovog sistema (tj. takav sistem je prilično stabilan). Tačan odgovor je 2. Zadatak broj 24.
Zahvaljujući živoj materiji u biosferi, kruženje supstanci
1. Otvorite 2. Uključuje mnogo hemijskih elemenata 3. Povećava raznolikost agrocenoza na Zemlji 4. Obezbeđuje akumulaciju inertnih gasova u atmosferi Objašnjenje: zahvaljujući živim organizmima (a posebno mikroorganizmima), u prirodi postoje ciklusi mnogih elemenata (i složenih supstanci - ugljen-dioksida, vode), kao što su: ugljenik, vodonik, kiseonik, sumpor i mnogi drugi. drugi, pa čak i gvožđe. Tačan odgovor je 2. Zadatak broj 25.
Da li su sljedeće tvrdnje o oblicima prirodne selekcije tačne?
A. Stabilizujuća selekcija se manifestuje u uslovima nagle promene polnog sastava stanovništva.
B. Pogonska selekcija doprinosi povećanju broja jedinki sa prosječnom vrijednošću osobine.
1. Samo A je tačno 2. Samo B je tačno 3. Obje presude su tačne 4. Obje presude su pogrešne Objašnjenje: stabilizacijska selekcija deluje samo u stalnim uslovima sredine i čuva jedinke sa prosečnom vrednošću osobine, A - netačno. Vozačka selekcija zadržava jedinke sa odstupanjem od prosječne vrijednosti osobine, B - netačno. Tačan odgovor je 4. Zadatak broj 26.
Tokom spermatogeneze
1. Formiraju se muške polne ćelije 2. Formiraju se somatske ćelije 3. Prepoloviti broj hromozoma 4. Formiraju se četiri gamete 5. Formira se jedno jaje 6. Formiraju se ćelije sa diploidnim setom hromozoma Objašnjenje: spermatogeneza - proces formiranja muških zametnih ćelija, dok se od prekursorske (diploidne) ćelije formiraju četiri haploidne zametne ćelije (odnosno, hromozomski set je prepolovljen). Tačan odgovor je 1, 3, 4. Zadatak broj 27.
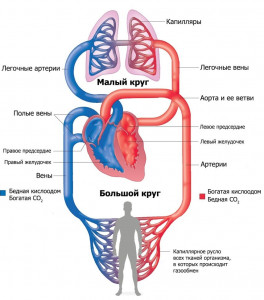
Sistemska cirkulacija u ljudskom tijelu
1. Počinje u lijevoj komori 2. Polazi iz desne komore 3. Zasićene kiseonikom u alveolama pluća 4. Opskrbljuje organe i tkiva kisikom i hranjivim tvarima 5. Završava u desnoj pretkomori 6. Dovodi krv u lijevu stranu srca Objašnjenje: Uzmite u obzir sistemsku cirkulaciju. Kao što se može vidjeti sa slike, veliki krug nastaje u lijevoj komori i nosi krv (kiseonik, hormone, itd.) do svih ćelija tijela, a ugljični dioksid je uzima iz ćelija i nosi natrag u srce, naime u desnu pretkomoru. Tačan odgovor je 1, 4, 5. Zadatak broj 28.
Procesi koji dovode do stvaranja novih vrsta u prirodi uključuju
1. Mitotička podjela ćelija 2. Proces mutacije sličan skoku 3. Promjenjivost modifikacije 4. Geografska izolacija 5. Aseksualno razmnožavanje jedinki 6. Prirodna selekcija Objašnjenje: razne mutacije dovode do stvaranja novih vrsta (tome prethodi njihova akumulacija i distribucija u populaciji), geografske izolacije (u nedostatku reprodukcije sa jedinkama drugih populacija može se pojaviti nova vrsta) i prirodne selekcije je usmjereni proces tokom kojeg najprilagođeniji preživljavaju organizam i potom se formira vrsta koja je maksimalno prilagođena datim uslovima sredine. Tačan odgovor je 2, 4, 6. Zadatak broj 29.
Uspostavite korespondenciju između karakteristika autotrofne ishrane i njenog tipa.
Karakteristika Tip autotrofne ishrane A. Koristi se energija oksidacije 1. Fotosinteza neorganske supstance 2. Hemosinteza B. Izvor energije - sunčeva svjetlost B. Izvodi se u biljnim ćelijama D. Dolazi do oksidacije amonijaka D. Kiseonik se oslobađa u atmosferu Objašnjenje: fotosinteza je proces pretvaranja energije Sunca u energiju hemijskih veza, koji provode fototrofi. Hemosinteza je proces pretvaranja neorganskih supstanci u organske supstance koristeći energiju oksidacije hemijskih jedinjenja. Dakle, fotosinteza se odnosi na: izvor energije je sunčeva svjetlost, proces se odvija u biljnim stanicama i oslobađanje kisika u atmosferu. Preostale dvije odredbe odnose se na hemosintezu. Tačan odgovor je 21121. Zadatak broj 30.
Uspostavite korespondenciju između karakteristike i carstva organizama.
Karakteristično Carstvo organizama A. Ćelijski zid sadrži hitin 1. Pečurke B. Vrsta ishrane autotrofna 2. Biljke B. Formirajte organske supstance iz neorganskih D. Rezervni nutrijent je skrob. D. U prirodnim sistemima oni su razlagači E. Tijelo se sastoji od micelija Objašnjenje: sastav ćelijskog zida gljiva uključuje hitin, heterotrofi su (tj. konzumiraju gotove organske tvari) i razlagači (razlažu organske tvari do anorganskih), tijelo im se sastoji od micelija. Biljke su autotrofi (tvore organske tvari iz neorganskih tvari, škrob je rezervna tvar. Tačan odgovor je 122211. Zadatak broj 31.
Uspostaviti korespondenciju između znaka regulacije funkcija u ljudskom tijelu i njegovog mehanizma.
Znak Mehanizam regulacije A. Izvodi endokrini sistem 1. Nervni B. Širenje hormona 2. Humoralno B. Dostavljeno u organe krvlju D. Brzina ekspozicije je veoma velika D. Na osnovu bioelektričnih fenomena Objašnjenje: nervna regulacija - regulacija uz pomoć nervnog sistema, odnosno vrši se duž procesa nervnih ćelija (uz pomoć električnih impulsa), brzina takve regulacije je veoma velika. Humoralna (hormonska) regulacija – regulacija uz pomoć biološki aktivnih supstanci – hormona koji se krvlju dostavljaju organima, a proizvode ih žlijezde endokrinog sistema. Tačan odgovor je 22211. Zadatak broj 32.
Uspostavite korespondenciju između vrste organizama i pravca evolucije koji je za njih karakterističan.
Vrsta Pravac evolucije A. Sivi pacov 1. Biološki napredak B. Snježni leopard 2. Biološka regresija B. Amurski tigar G. Puzava pšenična trava Konj D. Przewalskog E. obični maslačak Objašnjenje: biološki napredak - povećanje kondicije pojedinaca, praćeno povećanjem broja, proširenjem raspona i intraspecifične varijabilnosti. Biološka regresija - smanjenje sposobnosti jedinki, praćeno smanjenjem brojnosti, smanjenjem raspona i daljnjim izumiranjem vrste. Smanjenje broja tipično je za snježnog leoparda, amurskog tigra i konja Przewalskog. Tačan odgovor je 122121. Zadatak broj 33.
Navedite redoslijed procesa geografske specijacije.
1. Distribucija osobine u populaciji 2. Pojava mutacija u novim životnim uslovima 3. Prostorna izolacija populacija 4. Odabir pojedinaca sa korisnim modifikacijama 5. Formiranje nove vrste Objašnjenje: specijacija počinje izolacijom, pod takvim uvjetima počinju se pojavljivati mutacije među kojima se biraju samo korisne, zatim se te korisne mutacije šire među svim jedinkama u populaciji. Geografska specijacija završava, što je i logično, formiranjem nove vrste. Tačan odgovor je 32415. Zadatak broj 34.
Koja je svrha korištenja gljiva kvasca u pečenju kruha i pekarskih proizvoda? Koji proces se odvija? Objašnjenje: pri pečenju kruha koristi se kvasac, jer kvasac vrši fermentaciju (disanje bez kisika), oslobađajući ugljični dioksid koji pomaže dizanju tijesta (nastaju mjehurići u tijestu), što tijestu naknadno daje sjaj. Zadatak broj 35.
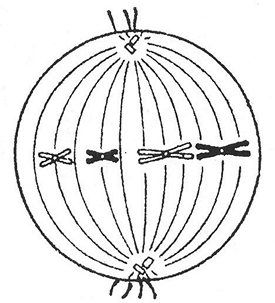
Koja je podjela i koja faza prikazana na slici? Navedite skup hromozoma (n), broj DNK molekula (s) u ovom periodu. Obrazložite odgovor. Objašnjenje: na slici, parovi homolognih hromozoma su poređani na ekvatoru ćelije i spremni su za divergaciju (to jest, ovo je period pre anafaze 1), a pre anafaze 1, metafaze 1. To znači da je diploid postavljen u ćelija je 2n (pošto vidimo parove hromozoma), a broj molekula DNK - 4c, pošto se svaki hromozom sastoji od dve hromatide (odnosno dva molekula DNK). Zadatak broj 36.
Pronađite greške u datom tekstu. Navedite brojeve rečenica u kojima su napravljene greške, ispravite ih.
1. Mitohondrije i plastidi su dvomembranske organele. 2. Fotosenzitivni pigmenti se nalaze na unutrašnjoj membrani mitohondrija i plastida. 3. Za razliku od plastida, mitohondrije sadrže vlastitu kružnu molekulu nukleinske kiseline. 4. Proces fotosinteze odvija se u hloroplastima. 5. Glavna funkcija mitohondrija je sinteza ćelijskih lipida. Objašnjenje: 2 - na mitohondrijalnoj membrani nema pigmenata (pošto ne provode proces fotosinteze). 3 - plastidi također sadrže vlastitu nukleinsku kiselinu. 5 - glavna funkcija mitohondrija je sinteza ATP-a (univerzalne energetske molekule), a ne lipida. Zadatak broj 37.
Kako se odvija neurohumoralna regulacija odvajanja želudačnog soka u ljudskom tijelu? Objasnite odgovor. Objašnjenje: Nervna regulacija se odvija na dva načina: 1. Uz pomoć uslovnih refleksa: pri pogledu na limun (ili hranu uopšte) ili zvuk lonaca u ustima počinje da se oslobađa pljuvačka, tj. priprema za jelo oslobađanjem enzima. 2. Uz iritaciju receptora usne duplje i želuca, odnosno uz pomoć bezuslovnih refleksa. Humoralna regulacija se provodi samo kada hranjive tvari uđu u krv tokom apsorpcije. Hormoni počinju da se oslobađaju i prenose u ćelije tela. Zadatak broj 38.
Navedite koji su kriterijumi tipa naznačeni u tekstu.
Sve jedinke agilnih vrsta guštera imaju isti kariotip. Kod mužjaka brzog guštera boja tijela je zelena, dok je kod ženki smeđa. Ove životinje su najbrojnije u tropskim i suptropskim zonama svijeta. Objašnjenje: opis kariotipa - genetski kriterijum. Opis boje tijela (i razlike između ženki i mužjaka) je morfološki kriterij. Opis raspona vrste je geografski kriterij. Zadatak broj 39.
tRNA sa antikodonima CCA, GUU i GAA su sukcesivno uključene u sintezu proteina. Odredite sastav molekula DNK i mRNA. Objašnjenje: Počnimo pisati sastav molekula obrnutim redoslijedom, odnosno prvo tRNA, zatim mRNA i na kraju DNK. tRNA: CCA GUU GAA mRNA: GGU CAA CUU DNK: CCA GTT GAA Zadatak broj 40.
Za ženku (A) zelenu (B) urađeno je analiziranje ukrštanja, u potomstvu su dobijene četiri fenotipske klase. Rezultirajuće čebrasto potomstvo ukršteno je među sobom. Da li je na ovom prelazu moguće dobiti potomstvo bez grba? Ako je tako, kojeg će spola biti, kakvog fenotipa? Kod kanarinaca, prisustvo grebena zavisi od autosomnog gena, boja perja (zelena ili smeđa) zavisi od gena koji je povezan sa X hromozomom. Heterogametni pol kod ptica je ženka. Objašnjenje:
Prvi križ: R: AaHVU x aaHvHv G: AHV, AHV, AU, AU X AHV F1: AaHVHv - zeleni mužjak aaHVHv - zeleni mužjak bez grebena AaHvU - žuta smeđa ženka Ukrštamo mužjaka i ženku sa grbom: R: AaHVHv x AaHvU G: AHV, AHV, AHV, AHV x AHV, AU, AHV, AU F2: dobijamo 16 genotipova, među kojima se mogu razlikovati samo 4 fenotipa. Fenotipovi jedinki bez grebena: Ženke: aaHVU - zelena ženka bez grebena aaHvU - smeđa ženka bez grebena Mužjaci: aaHVHv - zeleni mužjak bez grebena aaHvHv - smeđi mužjak bez grebena. Ako je molekul tvari u nepobuđenom stanju, tada se elektroni nalaze na najnižem energetskom nivou. U ovom slučaju, elektronska ljuska molekula je u singletnom stanju, odnosno u takvom stanju kada su svi elektroni upareni, a ukupni spinski moment jednak je nuli. Ovo stanje se naziva osnovno singletno stanje, a nivo na kojem se elektroni nalaze u ovom trenutku naziva se osnovni energetski nivo. Označimo ga S 0 (slika 1). Razmotrimo elektronske prelaze u molekulima na primeru elektronskih prelaza u molekulu tirozina. Ako molekuli apsorbuju kvante svjetlosti, tada elektroni vanjskih omotača molekula prelaze na viši energetski nivo S 2 * (prijelaz 1 na sl. 1). U ovom slučaju, elektronske ljuske ostaju u singletnom stanju, iako se molekula pobuđuje. Vrijednost energije apsorbiranog kvanta jednaka je razlici između dva energetska nivoa između kojih se odvija prijelaz elektrona: hv apsorpcija \u003d E 2 - E 0 (8) Tako će prijelaz elektrona sa glavnog singletnog nivoa na pobuđeni singlet nivo odgovarati apsorpciji svjetlosti, što je ukratko napisano: S 0 -> S * Ako molekul može apsorbirati svjetlost različite talasne dužine, tada elektron više neće ići na nivo S 2 *, već na drugi nivo koji odgovara energiji apsorbovanog kvanta. Ako je energija ovog kvanta manja, tada će se nivo energije nalaziti ispod S 2 * (na slici 1, ovo je nivo S 1 * i prelaz 2). Molekul može imati nekoliko takvih pobuđenih singletnih nivoa. Svaki od njih na spektru apsorpcije odgovarat će svojoj maksimalnoj optičkoj gustoći. Na sl. 1 prikazuje samo elektronske nivoe molekula i ne prikazuje vibracione i rotacione podnivoe. Kada bi molekuli imali samo elektronske nivoe, tada bi broj energetskih prelaza bio ograničen i molekularni spektri bi imali linijski karakter, a supstance bi imale visoku selektivnost apsorpcije. Zapravo, zbog cijepanja elektronskih nivoa na vibracione i rotacijske podnivoe, broj energetskih prijelaza molekula se značajno povećava i molekularni spektri su kontinuirani. U ovom slučaju, najvjerovatniji elektronski prijelazi u apsorpcionom spektru odgovaraju maksimumima. Osim toga, interakcija molekula sa rastvaračem, čija je priroda različita za različite molekule, od velike je važnosti za pojavu kontinuiranih spektra molekula. Molekuli ne mogu dugo ostati u pobuđenom stanju; obično trajanje perioda dok je molekul u pobuđenom stanju ne prelazi 10 -8 s. Elektronska energija pobuđenog molekula može se potrošiti kao rezultat nekoliko procesa: može se prenijeti na drugi molekul – migracija energije; može se koristiti za povećanje vibracijske (toplinske) energije molekula. U svim ovim slučajevima, elektron se ili vraća na nivo energije zemlje S 0 ili odlazi na neki nivo koji leži ispod datog pobuđenog nivoa. Isprekidane strelice 5 na sl. 1 prikazuju elektronske neradijativne prelaze, praćene rasipanjem energije u toplotu. Pored gore navedenih procesa, može doći do luminescencije molekula, što prati njihov prelazak u nepobuđeno stanje. Elektroni se tada vraćaju na energetski nivo zemlje. Proces luminescencije molekula, koji prati prelazak elektrona sa pobuđenih nivoa na nivo prizemlja, naziva se luminiscencija. Luminescencija se dijeli na dvije vrste: fluorescenciju i fosforescenciju (poslijesjaj). Tranzicija elektrona sa pobuđenih nivoa na prizemni nivo uvek počinje prelaskom elektrona sa gornjeg pobuđenog nivoa na najniži pobuđeni nivo. Ovo su prijelazi U ovom slučaju, kvanti se ne emituju i elektronska energija molekula se pretvara u toplotu. Ovaj proces rasipanja energije odvija se vrlo brzo - za 10 -13 - 10 -12 s. Sljedeća faza tranzicije elektrona je prijelaz sa nižeg pobuđenog nivoa S 0 * na osnovni nivo S 0 . U tom slučaju će se emitovati kvant luminiscencije. Budući da se dio energije pohranjene tokom apsorpcije svjetlosti troši na toplinu, energija kvanta luminescencije uvijek će biti manja od energije apsorbiranog kvanta. Bit će manji za količinu energije E topline utrošene na toplinu: hv lum = hv apsorbirati - E toplinu (9) Stoga će emitirana svjetlost imati nižu frekvenciju i veću valnu dužinu od apsorbirane svjetlosti. Ovaj odnos se zove Stokesov zakon: talasna dužina svetlosti koja se emituje tokom luminescencije je uvek veća od talasne dužine svetlosti koja ju je izazvala: λ lum > λ pre. Ovaj obrazac je odraz drugog zakona termodinamike, prema kojem je prijelaz energije iz jednog oblika u drugi praćen rasipanjem energije u toplinu. Intenzitet luminescencije se procjenjuje korištenjem posebnog koncepta - kvantnog prinosa. Kvantni prinos luminescencije φ podrazumijeva se kao omjer broja kvanta luminescencije n i broja apsorbiranih kvanta N: Budući da se luminiscencija uvijek uočava pri prelasku elektrona sa donjeg pobuđenog nivoa na osnovni, intenzitet luminescencije neće zavisiti od nivoa na koji je elektron ranije bačen tokom apsorpcije kvanta. Ova odredba se naziva Vavilovljev zakon: kvantni prinos (vjerovatnost) luminescencije ne ovisi o talasnoj dužini svjetlosti koja je izazvala luminescenciju. Luminescencija, koja se uočava tokom tranzicije elektrona sa donjeg pobuđenog singletnog nivoa na osnovni S 0 * -> S 0 , naziva se fluorescencija. Pošto je životni vek molekula u pobuđenom stanju 10 -9 - 10 -8 s, fluorescencija se posmatra samo direktno tokom osvetljenja objekta. Međutim, odavno je otkriveno da mnoge tvari (posebno na niskim temperaturama) nastavljaju intenzivno svijetliti čak i nakon što se svjetlo isključi. Ovaj sjaj je posledica prelaska elektrona sa takozvanog tripletnog nivoa. Već smo spomenuli tripletno stanje elektronskih ljuski, u kojem se nalaze dva nesparena elektrona. Nivo tripleta (T na slici 1) nalazi se nešto ispod donjeg pobuđenog singletnog nivoa S 0 * . Nivo tripleta je zabranjen - elektron ne može doći ovdje sa nivoa zemlje (prijelazi S 0 -> T su malo vjerovatni). Elektron može ući u triplet nivo sa pobuđenog singletnog nivoa; tada će njegov cijeli put biti S 0 -> S * -> T. Elektron troši dio energije u toplinu i prelazi sa donjeg pobuđenog singletnog nivoa na nivo tripleta. Tokom ove tranzicije, spin elektrona je obrnut, zbog čega dva elektrona postaju nesparena, a molekul se pretvara u biradikal. Životni vijek molekula u tripletnom stanju kreće se od 10 -3 s do nekoliko sekundi. Pošto u tripletnom stanju molekula ima dva nesparena elektrona, ona ima visoku hemijsku aktivnost i može ući u hemijska interakcija. Osim toga, elektron se može kretati od tripletnog nivoa do nivoa zemlje, a energija oslobođena u ovom slučaju se ili raspršuje u toplinu ili emituje u obliku kvanta luminiscencije. Luminiscencija koja prati tranziciju elektrona sa tripletnog nivoa na nivo tla T -> S 0 (prijelaz 4 na slici 1) naziva se fosforescencija. Pošto je nivo tripleta ispod nivoa pobuđenog singleta, talasna dužina svetlosti koja se emituje tokom fosforescencije je čak i duža od one koja se emituje tokom fluorescencije. Ako se talasna dužina svetlosti koja se emituje tokom luminescencije nacrta duž jedne ose, a intenzitet luminiscencije duž druge ose, tada se dobija krivulja spektra luminescencije. Spektri luminescencije dijele se na spektre fluorescencije i spektre fosforescencije. Na sl. 1a prikazuje spektre apsorpcije i luminescencije tirozina. Nivo S 0 - glavni singletni nivo molekula tirozina - uslovno ima energiju jednaku nuli. Tada je za prijelaz elektrona S 0 -> S 2 * nakon apsorpcije svjetlosti potrebna energija od 5,7 eV (elektron volt). Ovaj prelaz će odgovarati maksimumu u apsorpcionom spektru na talasnoj dužini od 217 nm. Drugi elektronski prelaz tokom apsorpcije kvantnog S 0 -> S 1 * odgovara skladištenju energije od 4,5 eV i u spektru apsorpcije odgovara maksimumu na λ = 275 nm. Fluorescencija se javlja kada se elektron vrati sa donjeg pobuđenog singletnog nivoa na nivo zemlje. U ovom slučaju, emitovani kvant ima energiju od 4,1 eV. Ova energija je manja od energije apsorbiranih fotona (5,7 i 4,5 eV). Ovaj prijelaz odgovara maksimumu u spektru fluorescencije na λ = 304 nm. Pošto je talasna dužina svetlosti koja se emituje tokom fluorescencije veća od talasne dužine apsorbovane svetlosti, spektar fluorescencije se pomera udesno na skali talasnih dužina u odnosu na spektar apsorpcije. Fosforescencija odgovara prelazu T -> S 0 . U ovom slučaju emituje se kvant sa energijom od 3,2 eV. Ovaj prelaz u spektru fosforescencije odgovara maksimumu na λ = 387 nm. Fosforescentni spektar je pomeren čak i više udesno na skali talasnih dužina od spektra fluorescencije. Spektri luminescencije, kao i spektri apsorpcije, dobijaju se pomoću spektrofotometara. Ovi spektrofotometri imaju neznatno drugačiji dizajn od onih o kojima se raspravljalo gore. Konkretno, oni sadrže niz svjetlosnih filtera. Na osnovu podataka o luminiscenciji može se suditi o veličini kvanta energije pohranjenih u molekulu. Uz podatke o apsorbovanim kvantima energije, ovo omogućava izračunavanje lokacije energetskih nivoa molekula. Na osnovu luminiscentne metode može se suditi o životnom vijeku molekula u pobuđenom stanju – po brzini pojave i nestanka luminescencije. Na osnovu intenziteta luminescencije može se izvesti zaključak o procesima rasipanja energije od strane molekula. Konačno, uz pomoć luminiscentne metode vrlo je zgodno istražiti stanje materije; čak i njegova mala promjena (agregacija, formiranje kompleksa, promjena pH, itd.) utiče na luminiscentna svojstva. Interpretacija informacija koje daju spektri vrši se pomoću teorije atoma. Stoga se ukratko prisjećamo nekih svojstava atoma i njihovog zračenja. Atom je sistem jezgra i elektrona koji se drže zajedno elektrostatičkim privlačenjem. Energija atoma (tačnije, njegova elektronska ljuska) može imati samo određene vrijednosti koje se nazivaju uslovi, ili nivoa. Najniže energetsko stanje se naziva main, ostalo - uzbuđen. Šema energetskih nivoa atoma vodonika prikazana je na sl. 4, gdje svaka crtica predstavlja nivo (donja predstavlja glavni). Udaljenosti nivoa od osnovnog stanja proporcionalna su energiji atoma mjerenoj iz energije osnovnog stanja. Atom može promijeniti svoju energiju prelazeći iz jednog stanja u drugo. To je obično zbog promjene u kretanju najudaljenijeg elektrona. Prijelazi od preko visoki nivoi do nižih može nastati spontano, bez spoljašnjeg uticaja, a razlika u energiji se emituje sa "porcijom" svetlosnog zračenja tzv. kvantna. Frekvencija emitovane svetlosti je proporcionalna kvantnoj energiji. Budući da striktno definirane promjene energije odgovaraju različitim prijelazima, atom emituje kvante samo određenih frekvencija, što dovodi do pojedinačnih linija u spektru. Prelazi "gore", tj. sa nižih nivoa na više, ne mogu se spontano dogoditi; njihova implementacija zahtijeva vanjski izvor energije (na primjer, kvante odgovarajuće frekvencije). Takav proces se zove preuzmi. Broj energetskih nivoa atoma je beskonačan; oni se kondenzuju do granice koja odgovara energiji pri kojoj se elektron potpuno odvaja od atoma. Zove se skup linija nastalih prilikom prelaska na dati nivo sa svih viših spektralne serije. Dakle, vodonik ima Lymanovu seriju koja odgovara prelazima na prvi nivo, Balmerovu seriju koja nastaje pri prelasku na drugi nivo, itd. Pošto je prvi nivo veoma udaljen od ostalih, prelazi na njega su praćeni velikom promenom energije , a kvanti Lajmanove serije leže u dalekom ultraljubičastom području. Na primjer, linija L α ;, nastala tokom prelaska sa drugog nivoa na prvi, ima talasnu dužinu od 1216Å 1, dok ljubičasti deo spektra odgovara talasnoj dužini od oko 4000 Å. Linije Balmerove serije - H α (6563 Å), H β (4861 Å) i druge, leže u vidljivom delu spektra. Ostatak niza vodonika nalazi se u infracrvenom području. Energetski nivoi drugih elemenata su složeniji. Da biste ih predstavili, morate nacrtati više od jedne kolone, kao na sl. 4, ali nekoliko, sa zajedničkom gornjom granicom. 1 (Å (angstrom) - jedinica mjerenja talasnih dužina u spektroskopiji, jednaka 10 -8 cm.) U većini atoma energetski nivoi su podijeljeni na nekoliko blisko raspoređenih podnivoa. Stoga se linije često sastoje od dvije ili tri komponente ili više, zbog čega se nazivaju dubleti, trojke itd., ili općenito - multipleti. Pozivaju se pojedinačne linije singlets. U složenim atomima, cijepanje nivoa može biti vrlo snažno. Nivoi atoma vodonika takođe se sastoje od dva podnivoa, ali su njihove energije praktično iste. Upoređujući spektar i šemu nivoa atoma bilo kojeg elementa, može se primijetiti da uočene linije ne odgovaraju svim prijelazima; neke tranzicije se uopšte ne dešavaju. Takvi prijelazi se nazivaju zabranjeno. Dozvoljeno prelazi odgovaraju strogo definisanim odnosima između nivoa energije, tzv pravila selekcije. Treba napomenuti da prijelazi koji krše pravila odabira nisu apsolutno zabranjeni: pod određenim uvjetima, odgovarajuće linije se i dalje mogu promatrati. "Stepen" zabrane najbolje karakteriše vreme koje u proseku mora da prođe dok atom ne može spontano da izvrši datu tranziciju. Za dozvoljenu tranziciju, ovo vreme je obično 10 -7 - 10 -8 sekundi. Ali po redu da bi izvršio zabranjenu tranziciju, atom mora biti u gornjem stanju mnogo duže - od 10 -3 sec do nekoliko dana ili više, u zavisnosti od stepena inhibicije.Ako nema dozvoljenih prelaza "dole" sa određenog nivoa, onda atom pod određenim uslovima može tamo ostati relativno dugo.Takvi nivoi se nazivaju metastabilan. Za većinu elemenata i njihovih jona, niski nivoi blizu nivoa tla su metastabilni. Zabranjene linije se obično označavaju simbolom elementa u uglastim zagradama, s rimskim brojem koji označava stepen jonizacije. Na primjer, [OH] označava zabranjenu liniju joniziranog kisika, a - zabranjenu liniju dvostruko ioniziranog kisika. Dozvoljeni redovi nemaju uglaste zagrade. Da bi atom emitovao kvant, on mora biti na jednom od pobuđenih nivoa, tj. mora mu se dati energija koja odgovara razlici između energija nivoa koji se razmatra i početnog. Ova energija se može prenijeti atomu bilo kada apsorbira kvant ili kada se sudari s drugom česticom, uglavnom elektronom. U tom slučaju energija elektrona mora biti veća od energije odgovarajućeg prijelaza. Prosječna energija čestice je proporcionalna apsolutna temperatura gas. Međutim, čak i ako je prosječna energija nedovoljna za pobudu, uvijek ima elektrona u plinu sa potrebnom energijom, ali njihov broj se brzo smanjuje s povećanjem energije. Stoga će broj pobuđivanja nivoa čija je energija primjetno veća od prosječne energije biti relativno mali 1 . 1 (Frekvencija pobude ne zavisi samo od broja elektrona čija je energija veća od praga pobude, već i od svojstava samog atoma, tačnije, od verovatnoće pobuđenja datog nivoa atoma brzim elektronom.) Udar jona ili neutralnog atoma takođe može prevesti atom u pobuđeno stanje, ali za to energija jona mora biti stotine ili hiljade puta veća od energije nivoa, jer teška čestica uvek prenosi samo vrlo mali dio svoje energije na svjetlosni elektron atoma. Stoga pobuđivanje teškim česticama obično nije od značaja u astrofizičkim uslovima, osim u slučajevima kada je energija nivoa izuzetno mala. Ako se elektron sudari s pobuđenim atomom, ovaj mu može prenijeti svoju energiju. Tada će atom otići u niže stanje bez emitiranja kvanta, a elektron u sudaru će se odbiti s povećanom energijom. Takav proces se zove udarac druge vrste, za razliku od procesa ekscitacije atoma tokom sudara ( hitovi prve vrste). Udarci druge vrste su bitni u gustim plinovima, gdje je vremenski interval između sudara atoma manji od vijeka trajanja atoma u pobuđenom stanju. U ovom slučaju, atomi se sudaraju prije nego što stignu da zrače, tako da udari druge vrste značajno prigušuju zračenje. Za metastabilne nivoe, sa kojih nema dozvoljenih 'dole' prelaza i gde se, stoga, atom zadržava mnogo duže, uticaji druge vrste takođe mogu biti značajni pri niskoj gustini. Zato u laboratoriji ne uočavamo linije koje odgovaraju zabranjenim prijelazima: ekscitacija se obično završava udarom drugog reda, a ne zračenjem. Kod vrlo razrijeđenog plina, interval između sudara može postati uporediv sa životnim vijekom u metastabilno stanje, i pojavit će se zabranjene linije. Kao što će se vidjeti u nastavku, ovi uvjeti se ostvaruju u maglinama. Ako elektron dobije više energije od granice termina, on će se odvojiti od atoma. Takav proces se zove jonizacija. Ionizacija atoma može se desiti i kada se kvant apsorbuje i kada se sudari sa brzim elektronom. Slobodni elektron koji nije vezan za atom može imati bilo koju energiju. Stoga, za razliku od prijelaza unutar atoma, gdje se kvanti samo određene frekvencije mogu apsorbirati, jonizaciju može proizvesti bilo koji kvant čija je energija veća od one potrebne za prijelaz sa početnog nivoa na energiju ionizacije. Na primjer, atom vodonika koji se nalazi na prvom nivou može apsorbirati bilo koji kvant čija je talasna dužina manja od 912 A, a sa drugog nivoa - kvant sa talasnom dužinom manjom od 3646 A. Ako je kvantna energija veća od potrebne za odvajanje elektrona, tada višak energije prelazi u kinetičku energiju izbačenog elektrona. Udarna jonizacija je moguća samo ako je energija udarnog elektrona veća od one potrebne za odvajanje. Što je temperatura gasa viša, to više elektroni imaju potrebnu energiju, što se češće dešavaju jonizacije i što je veći, pod jednakim uslovima, udio joniziranih atoma. Teška čestica može jonizirati atom samo pri visokim energijama, mnogo većim od energije ionizacije. Ako plin ima vrlo visoku temperaturu ili se nalazi u jakom radijacijskom polju, onda prije nego što stigne da uhvati elektron nazad, drugi, treći elektron, itd., može se otkinuti od njega. više puta jonizovani atomi. Međutim, odvajanje svakog sljedećeg elektrona zahtijeva sve više energije, kako se naboj jona povećava. Stoga je za višestruku jonizaciju potrebna vrlo visoka temperatura plina ili izvora jonizujućeg zračenja. Obrnuti proces jonizacije se naziva rekombinacija. Predstavlja hvatanje elektrona jonom. Elektron može biti zarobljen od strane atoma na bilo kojem nivou. Stoga, atom nastao kao rezultat rekombinacije može biti pobuđen ili nepobuđen. Tokom rekombinacije, energija jednaka razlici između energija slobodnog i vezanog elektrona treba da se oslobodi, obično u obliku kvanta. Ako se elektron sa malom energijom rekombinuje, tada je frekvencija kvanta blizu granice serije odgovarajućeg nivoa. Što je veća energija elektrona koji se rekombinuje, to je veća frekvencija emitovanog kvanta. Budući da slobodni elektroni mogu imati bilo koju energiju, spektar koji se emituje tokom rekombinacija ima oblik kontinuirane trake, koja počinje odmah nakon granice serije i rasteže se, postepeno slabeći, ka višim frekvencijama. Takav spektar se zove kontinuum. Slabljenje svjetline uzrokovano je činjenicom da se udio brzih elektrona uvijek smanjuje s povećanjem energije. Što je temperatura plina viša, to je veća prosječna energija rekombinirajućih elektrona i sporije opada intenzitet izvan granice serije. Gore smo već rekli da je atom sposoban da emituje svetlost ne samo tokom rekombinacije, već i tokom prelaza sa jednog energetskog nivoa na drugi. Ispostavilo se da je slobodni elektron, koji se kreće u električnom polju jona, takođe sposoban da emituje zračenje. Slobodni elektron se kreće u polju jona duž hiperboličke orbite, a različite orbite odgovaraju različitim energijama. Baš kao što se kvant emituje ili apsorbuje tokom tranzicije elektrona vezanog u atomu iz jedne eliptične orbite u drugu, kvant se može emitovati ili apsorbovati kada elektron prelazi iz jedne hiperboličke orbite u drugu. Takav proces zove se tranzicija od slobodnog do slobodnog. Budući da energija obje orbite može imati bilo koju vrijednost, emisija i apsorpcija tokom slobodnih prijelaza se javljaju u kontinuiranom spektru. Promjena energije tokom slobodnih tranzicija je obično mali dio puna energija elektrona, tako da je energija emitovanih fotona manja od prosječne energije elektrona. Kada ne baš visoke temperature zračenje slobodnog gasa koncentrisano je u području dugih talasa - od infracrvenih zraka do radio talasa. Do sada smo govorili o emisiji i apsorpciji svjetlosti od strane pojedinačnih atoma. U stvarnosti, zračenje iz čitavog sloja gasa se uvek posmatra. Ako je sloj plina proziran na svim frekvencijama, zračenje pojedinačnih atoma će se jednostavno zbrati. Sastojat će se od svijetlih linija na pozadini manje svijetlog kontinuiranog spektra formiranog tokom rekombinacija na raznim nivoima i tranzicije od slobodnog do slobodnog. Ali ako povećate debljinu sloja plina, tada će dio zračenja biti apsorbiran. Prije svega, kvanti koji formiraju linije će biti apsorbirani, te će stoga linije biti manje kontrastne u odnosu na pozadinu kontinuiranog spektra. Ako je homogeni sloj praktički neproziran na svim frekvencijama, tada će linije nestati. Zračenje će imati kontinuirani spektar u zavisnosti samo od temperature, a maksimalni intenzitet u ovom spektru će se pomerati prema kratkim talasima sa povećanjem temperature gasnog sloja. Istovremeno, ukupna količina energije koju emituje jedinica površine će se povećati. Zračenje zvijezda je komplicirano činjenicom da sloj nije homogen - njegova temperatura i gustina rastu sa dubinom. Dakle, u spektru zvijezda postoje tamne linije, a ukupni tok intenziteta u njemu ne poklapa se sa spektrom neprozirnog sloja plina.

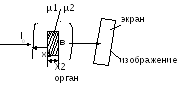

ukupno stranica: 6
gdje je v abs. - frekvencija apsorbovane svetlosti, E 2 i E 0 - energija nivoa između kojih se vrši prelaz.
gdje je v lum frekvencija svjetlosti koja se emituje tokom luminescencije. Stranica
3
ukupno stranica: 6






