Svojstva i struktura gasovitih, tečnih i čvrstih tela
Sva neživa materija se sastoji od čestica čije se ponašanje može razlikovati. Struktura gasovitih, tečnih i čvrste materije ima svoje karakteristike. Čestice u čvrstim materijama se drže zajedno jer su veoma blizu jedna drugoj, što ih čini veoma jakim. Osim toga, mogu zadržati određeni oblik, jer se njihove najsitnije čestice praktički ne pomiču, već samo vibriraju. Molekule u tečnostima su prilično blizu jedna drugoj, ali se mogu slobodno kretati, tako da nemaju svoj oblik. Čestice u plinovima kreću se vrlo brzo, a oko njih obično ima dosta prostora, što sugerira da se lako sabijaju.
Svojstva i struktura čvrstih tijela
Koja je struktura i karakteristike strukture čvrstih tijela? Sastoje se od čestica koje su veoma blizu jedna drugoj. Ne mogu se pomicati i stoga njihov oblik ostaje fiksan. Koja su svojstva čvrstog tijela? Ne skuplja se, ali ako se zagrije, njegov volumen će se povećavati s povećanjem temperature. To je zato što čestice počinju vibrirati i kretati se, što dovodi do smanjenja gustoće.

Jedna od karakteristika čvrstih tijela je da imaju fiksni oblik. Kada se čvrsta materija zagreje, kretanje čestica se povećava. Brže pokretne čestice sudaraju se jače, uzrokujući da svaka čestica gura svoje susjede. Stoga povećanje temperature obično dovodi do povećanja snage tijela.
Kristalna struktura čvrstih tijela
Intermolekularne sile interakcije između susjednih molekula čvrste tvari dovoljno su jake da ih drže u fiksnom položaju. Ako su ove najmanje čestice u visoko uređenoj konfiguraciji, tada se takve strukture obično nazivaju kristalnim. Unutrašnjim uređenjem čestica (atoma, jona, molekula) elementa ili jedinjenja bavi se posebna nauka - kristalografija.

Hemijska struktura čvrste supstance je takođe od posebnog interesa. Proučavajući ponašanje čestica, kako se prave, hemičari mogu objasniti i predvidjeti kako će se određene vrste materijala ponašati pod određenim uvjetima. Najmanje čestice čvrstog tijela raspoređene su u obliku rešetke. To je takozvani regularni raspored čestica, gdje je različit hemijske veze između njih.

Pojasna teorija strukture čvrstog tijela smatra ga skupom atoma, od kojih se svaki, zauzvrat, sastoji od jezgra i elektrona. AT kristalna struktura jezgra atoma se nalaze u čvorovima kristalne rešetke, koju karakteriše određena prostorna periodičnost.

Kakva je struktura tečnosti?
Struktura čvrstih tela i tečnosti je slična po tome što se nalaze čestice od kojih se sastoje blizina. Razlika je u tome što se molekule slobodno kreću, jer je između njih mnogo slabiji nego u čvrstom stanju.
Koja su svojstva tečnosti? Prvo, to je fluidnost, a drugo, tečnost će poprimiti oblik posude u koju je smeštena. Ako se zagrije, volumen će se povećati. Zbog blizine čestica jedna drugoj, tekućina se ne može komprimirati.

Kakva je struktura i struktura gasovitih tela?
Čestice plina su nasumično raspoređene, toliko su udaljene jedna od druge da između njih ne može postojati privlačna sila. Koja svojstva ima gas i kakva je struktura gasovitih tela? Po pravilu, plin ravnomjerno ispunjava cijeli prostor u kojem je postavljen. Lako se kompresuje. Brzina čestica gasovito telo raste sa porastom temperature. Istovremeno dolazi i do povećanja pritiska.

Strukturu gasovitih, tečnih i čvrstih tela karakterišu različite udaljenosti između najmanjih čestica ovih supstanci. Čestice gasa su mnogo udaljenije nego u čvrstom ili tečno stanje. U zraku, na primjer, prosječna udaljenost između čestica je oko deset puta veća od prečnika svake čestice. Dakle, zapremina molekula zauzima samo oko 0,1% ukupne zapremine. Preostalih 99,9% je prazan prostor. Nasuprot tome, tečne čestice ispunjavaju oko 70% ukupne zapremine tečnosti.
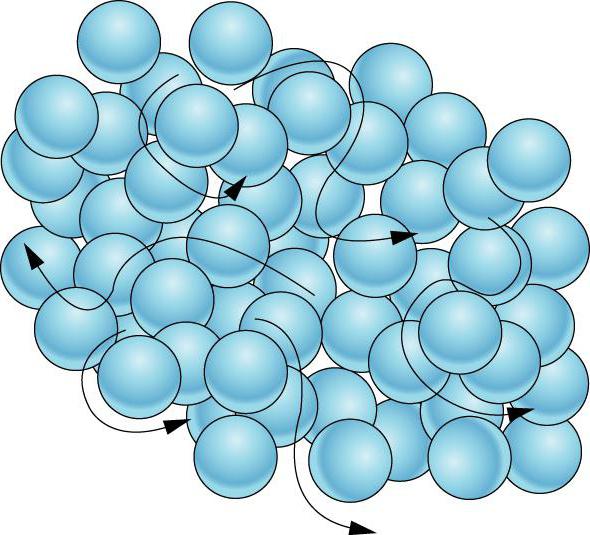
Svaka čestica gasa kreće se slobodno duž pravog puta sve dok se ne sudari sa drugom česticom (gas, tečnost ili čvrsta). Čestice se obično kreću dovoljno brzo da se nakon što se dvije od njih sudare, odbijaju jedna od druge i nastavljaju put same. Ovi sudari mijenjaju smjer i brzinu. Ova svojstva čestica plina omogućavaju plinovima da se šire kako bi ispunili bilo koji oblik ili volumen.

Promjena države
Struktura gasovitih, tečnih i čvrstih tela može se promeniti ako se na njih izvrši određeni spoljašnji uticaj. Oni čak mogu da prelaze jedno u drugo stanje pod određenim uslovima, kao što je tokom grejanja ili hlađenja.

- Isparavanje. Struktura i svojstva tečnih tijela omogućavaju im da pod određenim uvjetima pređu u potpuno drugačije fizičko stanje. Na primjer, ako slučajno prolijete benzin dok sipate gorivo u automobil, brzo ćete osjetiti njegov oštar miris. Kako se to događa? Čestice se kreću kroz tekućinu, kao rezultat toga, određeni dio njih dospijeva na površinu. Njihovo usmjereno kretanje može odnijeti ove molekule s površine u prostor iznad tekućine, ali će ih privlačnost povući nazad. S druge strane, ako se čestica kreće vrlo brzo, može se odvojiti od drugih na pristojnu udaljenost. Dakle, sa povećanjem brzine čestica, što se obično dešava pri zagrevanju, dolazi do procesa isparavanja, odnosno transformacije tečnosti u gas.
Ponašanje tijela u različitim fizičkim stanjima
Struktura plinova, tekućina, čvrstih tijela je uglavnom zbog činjenice da su sve te tvari sastavljene od atoma, molekula ili iona, ali ponašanje ovih čestica može biti potpuno drugačije. Čestice plina su haotično udaljene jedna od druge, molekule tekućine su blizu jedna drugoj, ali nisu tako kruto strukturirane kao u čvrstom stanju. Čestice plina vibriraju i kreću se velikom brzinom. Atomi i molekuli tečnosti vibriraju, kreću se i klize jedni pored drugih. Čestice čvrstog tijela također mogu vibrirati, ali kretanje kao takvo za njih nije svojstveno.

Karakteristike unutrašnje strukture
Da bismo razumjeli ponašanje materije, prvo moramo proučiti karakteristike njene unutrašnje strukture. Koje su unutrašnje razlike između granita, maslinovog ulja i helijuma balon? Jednostavan model strukture materije pomoći će odgovoriti na ovo pitanje.
 Model je pojednostavljena verzija stvarnog objekta ili supstance. Na primjer, prije nego što počne stvarna gradnja, arhitekti prvo konstruiraju projekt izgradnje modela. Ovako pojednostavljeni model ne podrazumijeva nužno tačan opis, ali u isto vrijeme može dati grubu predstavu o tome kakva će biti ova ili ona struktura.
Model je pojednostavljena verzija stvarnog objekta ili supstance. Na primjer, prije nego što počne stvarna gradnja, arhitekti prvo konstruiraju projekt izgradnje modela. Ovako pojednostavljeni model ne podrazumijeva nužno tačan opis, ali u isto vrijeme može dati grubu predstavu o tome kakva će biti ova ili ona struktura.
Pojednostavljeni modeli
U nauci, međutim, modeli nisu uvijek fizička tijela. U prošlom vijeku došlo je do značajnog povećanja ljudskog razumijevanja fizičkog svijeta. Međutim, veliki dio akumuliranog znanja i iskustva zasniva se na izuzetno složenim prikazima, na primjer u obliku matematičkih, hemijskih i fizičkih formula.  Da biste sve ovo razumjeli, morate biti prilično upućeni u ove egzaktne i složene nauke. Naučnici su razvili pojednostavljene modele za vizualizaciju, objašnjenje i predviđanje fizičkih pojava. Sve ovo uvelike pojednostavljuje razumijevanje zašto neka tijela imaju stalan oblik i zapreminu na određenoj temperaturi, dok ih druga mogu mijenjati i tako dalje.
Da biste sve ovo razumjeli, morate biti prilično upućeni u ove egzaktne i složene nauke. Naučnici su razvili pojednostavljene modele za vizualizaciju, objašnjenje i predviđanje fizičkih pojava. Sve ovo uvelike pojednostavljuje razumijevanje zašto neka tijela imaju stalan oblik i zapreminu na određenoj temperaturi, dok ih druga mogu mijenjati i tako dalje.
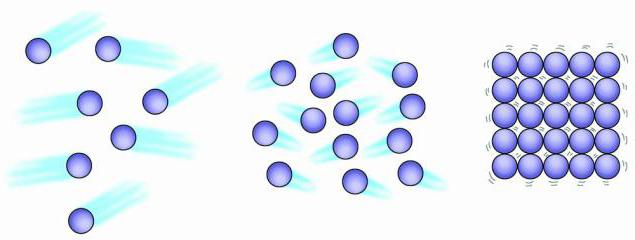
Sva materija je sastavljena od sićušnih čestica. Ove čestice su u stalnom kretanju. Volumen kretanja je povezan s temperaturom. Povećana temperatura ukazuje na povećanje brzine kretanja. Strukturu gasovitih, tečnih i čvrstih tela razlikuje se po slobodi kretanja njihovih čestica, kao i po tome koliko su čestice snažno privučene jedna drugoj. Fizički zavise od njegovog fizičkog stanja. tečna voda i led imaju isto Hemijska svojstva, ali oni fizička svojstva značajno razlikuju.
>>Fizika: Struktura gasovitih, tečnih i čvrstih tela
Teorija molekularne kinetike omogućava razumijevanje zašto supstanca može biti u plinovitom, tekućem i čvrstom stanju.
Gasovi. U plinovima je udaljenost između atoma ili molekula u prosjeku višestruka više veličina sami molekuli ( sl.8.5). Na primjer, pri atmosferskom pritisku, zapremina posude je desetine hiljada puta veća od zapremine molekula sadržanih u njoj.
Plinovi se lako komprimiraju, dok se prosječna udaljenost između molekula smanjuje, ali se oblik molekula ne mijenja ( sl.8.6).
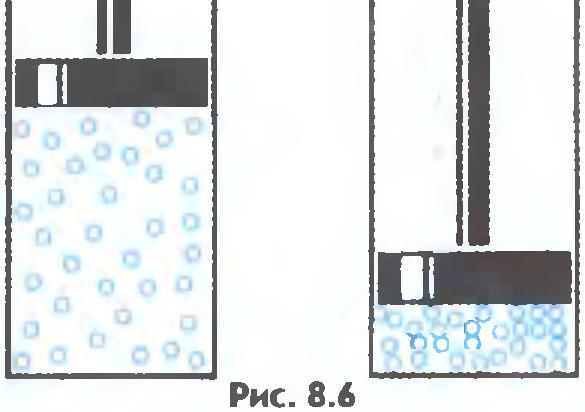
Molekuli sa ogromnim brzinama - stotinama metara u sekundi - kreću se u svemiru. Sudarajući se, odbijaju se jedna od druge u različitim smjerovima poput bilijarskih loptica. Slabe sile privlačenja molekula gasa nisu u stanju da ih drže jedna blizu druge. Zbog toga gasovi se mogu neograničeno širiti. Ne zadržavaju ni oblik ni volumen.
Brojni udari molekula na zidove posude stvaraju pritisak plina.
Tečnosti. Molekuli tečnosti nalaze se gotovo blizu jedan drugom ( sl.8.7), tako da se molekul tekućine ponaša drugačije od molekula plina. U tečnostima postoji takozvani poredak kratkog dometa, tj. uređeni raspored molekula je očuvan na udaljenostima jednakim nekoliko prečnika molekula. Molekul oscilira oko svog ravnotežnog položaja sudarajući se sa susjednim molekulima. Tek s vremena na vrijeme napravi još jedan "skok", zapadajući u novi položaj ravnoteže. U ovom ravnotežnom položaju, sila odbijanja je jednaka sili privlačenja, tj. ukupna sila interakcije molekula je nula. Vrijeme sređen život molekula vode, tj. vrijeme njenih oscilacija oko jednog specifičnog ravnotežnog položaja na sobnoj temperaturi je u prosjeku 10 -11 s. Vrijeme jedne oscilacije je mnogo manje (10 -12 -10 -13 s). Kako temperatura raste, vrijeme staloženog života molekula se smanjuje.

Priroda molekularnog kretanja u tečnostima, koju je prvi ustanovio sovjetski fizičar Ya.I. Frenkel, omogućava razumevanje osnovnih svojstava tečnosti.
Molekuli tečnosti nalaze se direktno jedan pored drugog. Sa smanjenjem zapremine, sile odbijanja postaju veoma velike. Ovo objašnjava niska kompresibilnost tečnosti.
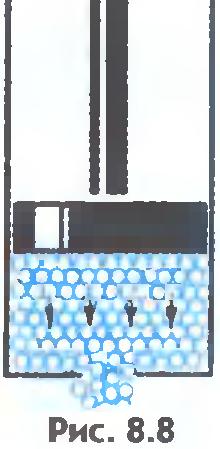
kao što je poznato, tečnosti su tečne, odnosno ne zadržavaju svoj oblik. To se može objasniti ovako. Vanjska sila ne mijenja primjetno broj molekularnih skokova u sekundi. Ali skokovi molekula iz jednog stacioniranog položaja u drugi događaju se pretežno u smjeru djelovanja spoljna sila (sl.8.8). Zbog toga tečnost teče i poprima oblik posude.
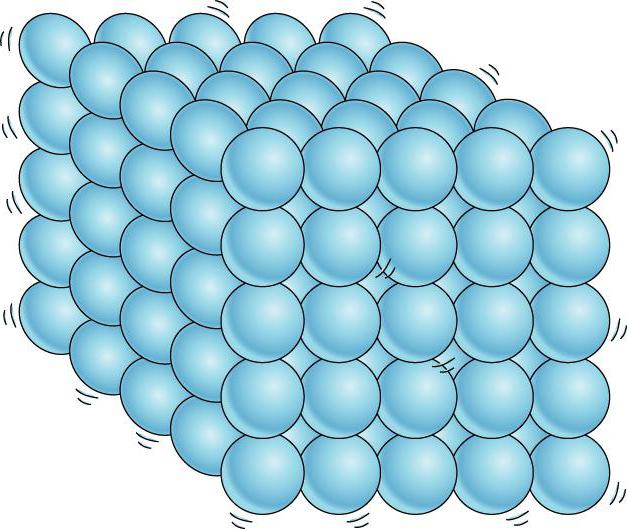
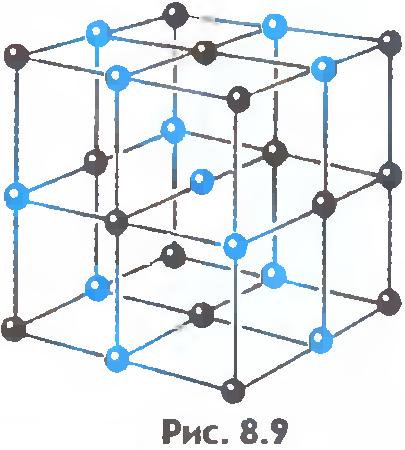
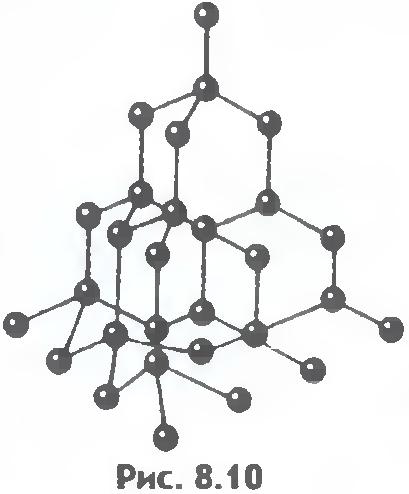
Postoji još jedna važna razlika između tečnosti i čvrstih materija. Tečnost se može uporediti sa gomilom ljudi, gde se pojedini pojedinci nemirno guraju na mestu, a čvrsto telo je kao vitka grupa istih pojedinaca koji, iako ne stoje na pažnji, održavaju u proseku određene udaljenosti između sebe. . Ako povežemo centre ravnotežnih položaja atoma ili jona čvrstog tijela, onda ćemo dobiti ispravnu prostornu rešetku, tzv. kristalno.
Slike 8.9 i 8.10 prikazuju kristalne rešetke kuhinjske soli i dijamanta. Unutrašnji poredak u rasporedu kristalnih atoma dovodi do pravilnih spoljašnjih geometrijskih oblika.
Slika 8.11 prikazuje dijamante Jakutije.
udaljenost gasa l između molekula je mnogo veća od veličine molekula r0:" l>>r 0
.
Za tečnosti i čvrste materije l≈r0. Molekuli tečnosti su poređani u neredu i s vremena na vreme skaču iz jednog staloženog položaja u drugi.
U kristalnim čvrstim materijama, molekuli (ili atomi) su raspoređeni na striktno uređen način.
???
1. Plin je sposoban za neograničeno širenje. Zašto Zemlja ima atmosferu?
2. Koja je razlika između putanja kretanja molekula plina, tekućine i čvrste tvari? Nacrtajte približne putanje molekula tvari u tim stanjima.
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, fizika 10. razred
Sadržaj lekcije sažetak lekcije podrška okvir prezentacije lekcije akcelerativne metode interaktivne tehnologije Vježbajte zadaci i vježbe radionice samoispitivanja, obuke, slučajevi, zadaci pitanja za raspravu o domaćim zadacima retorička pitanja od studenata Ilustracije audio, video i multimedija fotografije, slike grafike, tabele, šeme humor, anegdote, vicevi, strip parabole, izreke, ukrštene reči, citati Dodaci sažetakačlanci čipovi za radoznale cheat sheets udžbenici osnovni i dodatni glosar pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku elementi inovacije u lekciji zamjenom zastarjelih znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu smjernice diskusioni programi Integrisane lekcijeAko imate ispravke ili prijedloge za ovu lekciju,
Teorija molekularne kinetike omogućava razumijevanje zašto supstanca može biti u plinovitom, tekućem i čvrstom stanju.
Gas. U plinovima je udaljenost između atoma ili molekula u mediju mnogo puta veća od veličine samih molekula (slika 10). Na primjer, kada atmosferski pritisak zapremina posude u desetinama
hiljadu puta veći od zapremine molekula gasa u posudi.
Gasovi se lako sabijaju, jer se pri kompresiji gasa smanjuje samo prosječna udaljenost između molekula, ali se molekuli ne „stiskuju” jedni druge (slika 11).
Molekuli sa ogromnim brzinama - stotinama metara u sekundi - kreću se u svemiru. Sudarajući se, odbijaju se jedna od druge u različitim smjerovima poput bilijarskih loptica.
Slabe sile privlačenja molekula gasa nisu u stanju da ih drže jedna blizu druge. Stoga se plinovi mogu neograničeno širiti. Ne zadržavaju ni oblik ni volumen.
Brojni udari molekula na zidove posude stvaraju pritisak plina.
Tečnosti. U tečnostima, molekuli se nalaze skoro blizu jedan drugom (slika 12). Stoga se molekul u tečnosti ponaša drugačije nego u gasu. Stegnuta, kao u ćeliji, drugim molekulima, ona obavlja „trčanje na mestu“ (osciluje oko ravnotežnog položaja, sudarajući se sa susednim molekulima). Tek s vremena na vrijeme napravi "skok", probijajući "rešetke kaveza", ali onda upada u novi "kavez" formiran od novih komšija. Vrijeme "sređenog života" molekula vode, odnosno vrijeme oscilacija oko jednog određenog ravnotežnog položaja, na sobnoj temperaturi je u prosjeku s. Vrijeme jedne oscilacije je mnogo manje (s). Kako temperatura raste, "sjedeći život" molekula se smanjuje. Priroda molekularnog kretanja u tečnostima, koju je prvi ustanovio sovjetski fizičar Ya. I. Frenkel, omogućava razumevanje osnovnih svojstava tečnosti.
Molekuli tečnosti se nalaze direktno jedan do drugog, pa kada pokušate da promenite zapreminu tečnosti, makar i za malu količinu, počinje deformacija samih molekula (slika 13). A za to je potrebno mnogo snage. Ovo objašnjava nisku kompresibilnost tečnosti.
Tečnosti su, kao što znate, fluidne, odnosno ne zadržavaju svoj oblik. Ovo se objašnjava na sljedeći način. Ako tečnost ne teče, onda se skokovi molekula iz jednog "sjedećeg" položaja u drugi događaju istom frekvencijom u svim smjerovima (slika 12). Vanjska sila ne mijenja primjetno broj molekularnih skokova u sekundi, ali se skokovi molekula iz jednog "sjedećeg" položaja u drugi dešavaju pretežno u smjeru vanjske sile (slika 14). Zbog toga tečnost teče i poprima oblik posude
Čvrste materije. Atomi ili molekuli čvrstih tijela, za razliku od tekućina, osciliraju oko određenih ravnotežnih položaja. Istina, ponekad molekuli mijenjaju svoj ravnotežni položaj, ali to se događa izuzetno rijetko. Zbog toga čvrsta tijela zadržavaju ne samo volumen, već i oblik.
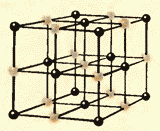
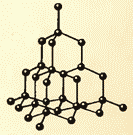
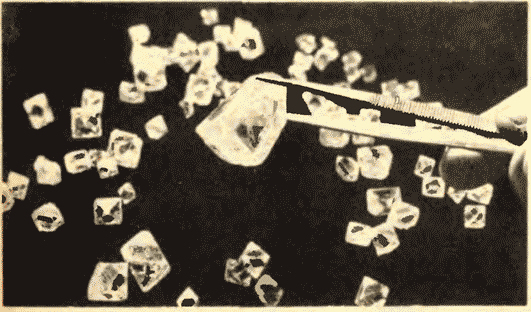
Postoji još jedna važna razlika između tečnosti i čvrstih materija. Tečnost se može uporediti sa gomilom čiji se pojedini članovi nemirno guraju na mestu, a čvrsto telo je kao vitka kohorta čiji članovi, iako ne stoje na pažnji (zbog toplotnog kretanja), održavaju određene intervale u prosjeku između sebe. Ako povežemo centre ravnotežnih položaja atoma ili jona čvrstog tijela, onda ćemo dobiti pravilnu prostornu rešetku, koja se zove kristalna. Slike 15 i 16 prikazuju kristalne rešetke kuhinjske soli i dijamanta. Unutrašnji poredak u rasporedu atoma kristala dovodi do geometrijski ispravnih spoljašnjih oblika. Slika 17 prikazuje dijamante Jakuta.
Kvalitativno objašnjenje osnovnih svojstava materije na osnovu molekularne kinetičke teorije, kao što ste vidjeli, nije posebno teško. Međutim, teorija koja uspostavlja kvantitativne odnose između eksperimentalno izmjerenih veličina (pritisak, temperatura itd.) i svojstava samih molekula, njihovog broja i brzine kretanja, vrlo je složena. Ograničavamo se na razmatranje teorije gasova.
1. Navedite dokaze za postojanje termičkog kretanja molekula.
2. Zašto Brownovo kretanje primjetno samo za čestice male mase?
3. Kakva je priroda molekularnih sila? 4. Kako sile interakcije između molekula zavise od udaljenosti između njih? 5. Zašto se dvije olovne šipke sa glatkim, čistim rezovima lijepe zajedno kada su pritisnute jedna na drugu? 6. Koja je razlika između toplotnog kretanja molekula gasova, tečnosti i čvrstih tela?







