Grupa je vertikalni red elemenata
Nizove elemenata unutar kojih se svojstva uzastopno mijenjaju, kao što je niz od osam elemenata od litijuma do neona ili od natrijuma do argona, Mendeljejev je nazvao periodima. Ako ova dva perioda zapišemo jedan ispod drugog tako da je natrijum ispod litijuma, a argon ispod neona, dobićemo sledeći raspored elemenata:
Ovim rasporedom elementi koji su slični po svojim svojstvima i imaju istu valenciju, na primjer, litijum i natrijum, berilijum i magnezijum itd., padaju u vertikalne stubove.
Podijelivši sve elemente na periode i rasporedivši jedan period pod drugi tako da elementi slični po svojstvima i vrsti nastalih spojeva padaju jedni pod druge, Mendeljejev je sastavio tablicu koju je nazvao periodični sistem elemenata po grupama i serijama. Ovaj sto unutra modernom obliku, dopunjen elementima otkrivenim nakon Mendeljejeva, dat je na početku knjige.
Sastoji se od deset horizontalnih redova i osam vertikalnih kolona, odnosno grupa, u kojima su međusobno slični elementi postavljeni jedan ispod drugog.
Prvo obratimo pažnju na raspored elemenata u horizontalnim redovima. U prvom redu su samo dva elementa - vodonik i helijum. Ova dva elementa čine prvi period. Drugi i treći red se sastoje od elemenata koje smo već razmatrali i čine dva perioda od po osam elemenata. Oba perioda počinju alkalnim metalom i završavaju se plemenitim gasom. Sva tri perioda nazivaju se manjim periodima.
Četvrti red takođe počinje alkalnim metalom - kalijumom. Sudeći po tome kako su se svojstva mijenjala u prethodna dva reda, očekivalo bi se da će se ovdje mijenjati istim redoslijedom i da će sedmi element u nizu opet biti halogen, a osmi - plemeniti plin. Međutim, to se ne primjećuje. Umjesto halogena, na sedmom mjestu je mangan, metal koji stvara i bazične i kisele okside, od kojih je samo najveći sličan odgovarajućem hlor-oksidu. Nakon mangana, u istom redu su još tri metala - gvožđe, kobalt i nikl, koji su međusobno veoma slični. I tek sljedeći, peti red, počevši od bakra, završava se plemenitim plinom kriptonom. Šesti red opet počinje sa alkalnim metalom rubidijumom itd. Tako se u elementima nakon argona manje-više potpuno ponavljanje svojstava uočava tek nakon osamnaest elemenata, a ne nakon osam, kao što je bio slučaj u drugom. i treći redovi. Ovih osamnaest elemenata čine četvrti - takozvani veliki period, koji se sastoji od dva reda.
Peti glavni period sastoji se od naredna dva reda, šestog i sedmog. Ovaj period počinje alkalni metal rubidijum i završava se plemenitim gasom ksenonom.
U osmom redu, iza lantana, nalazi se četrnaest elemenata zvanih lantanidi (ili lantanidi), koji su izuzetno slični lantanu i jedni drugima. S obzirom na ovu sličnost, zbog osobenosti strukture njihovih atoma (videti § 32), lantanidi se obično stavljaju van opšte tabele, uz napomenu samo u polju za lantan njihov položaj u sistemu.
Pošto je plemeniti gas radon koji sledi ksenon tek na kraju devetog reda, osmi i deveti red takođe čine jedan veliki period – šesti, koji sadrži trideset i dva elementa.
U velikim periodima ne mijenjaju se sva svojstva elemenata tako dosljedno kao u drugom i trećem. Ovdje još uvijek postoji određena periodičnost u promjeni svojstava unutar samih perioda.
Dakle, najviša valencija kisika u početku se ravnomjerno povećava pri prelasku s jednog elementa na drugi, ali zatim, dostižući maksimum sredinom perioda, pada na dva, nakon čega se ponovo povećava na sedam do kraja perioda. U tom smislu, veliki periodi su podijeljeni na dva dijela (dva reda).
Deseta serija, koja čini sedmi - još nedovršeni - period, sadrži devetnaest elemenata, od kojih su prvi i poslednjih trinaest dobijeni tek relativno nedavno veštačkim putem. Četrnaest elemenata nakon aktinijuma slični su po strukturi svojih atoma aktinijumu; stoga se pod imenom aktinidi (ili aktinidi) stavljaju, kao i lantanidi, izvan opšte tabele.
U vertikalnim kolonama tabele, ili u grupama, nalaze se elementi koji imaju slična svojstva. Stoga je svaka vertikalna grupa, takoreći, prirodna porodica elemenata. U tabeli je osam takvih grupa. Brojevi grupa su na vrhu označeni rimskim brojem.
Elementi prve grupe formiraju okside sa opšta formula, u drugoj - RO, u trećoj - itd. Dakle, najveća valencija elemenata svake grupe u smislu kiseonika odgovara, uz nekoliko izuzetaka, broju grupe.
Upoređujući elemente koji pripadaju istoj grupi, lako je vidjeti da, počevši od petog reda (četvrte periode), svaki element pokazuje najveću sličnost ne s elementom koji se nalazi neposredno ispod ili iznad njega, već sa elementima odvojenim od njega pomoću jedna ćelija. Na primjer, u sedmoj grupi brom se ne spaja direktno s hlorom i jodom, već je odvojen od hlora manganom, a od joda tehnecijumom; slični elementi u šestoj grupi - selen i telur su odvojeni molibdenom, koji se veoma razlikuje od njih; rubidijum, koji je u prvoj grupi, pokazuje veliku sličnost sa cezijumom, koji se nalazi u osmom redu, ali malo podseća na srebro koje se nalazi neposredno ispod njega, itd.
To se objašnjava činjenicom da od četvrtog reda počinju veliki periodi, od kojih se svaki sastoji od dva reda smještena jedan iznad drugog. Kako u periodu metalna svojstva slabe s lijeva na desno, jasno je da u svakom većem periodu elementi gornjeg (parnog) reda imaju izraženije od elemenata donjeg (neparnog). Da bi se označila razlika između redova, elementi prvih redova velikih perioda se pomeraju ulevo u tabeli, a elementi drugih redova se pomeraju udesno.
Dakle, počevši od četvrtog perioda, svaka grupa periodnog sistema može se podijeliti u dvije podgrupe: "parnu", koju čine elementi gornjih redova, i "neparnu", koju čine elementi donjih redova. Što se tiče elemenata malih perioda, koje je Mendeljejev nazvao tipičnim, u prvoj i drugoj grupi oni su po svojim svojstvima bliži elementima parnih redova i pomaknuti su ulijevo, u drugima - elementima neparnih redova i pomaknuti su. nadesno.
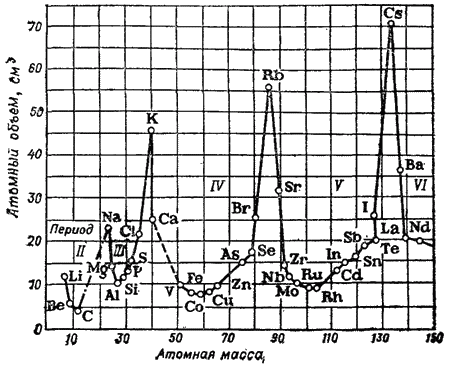
Rice. 1. Zavisnost atomske zapremine elementa od atomske mase.
Stoga se tipični elementi obično kombinuju sa sličnim elementima parnih ili neparnih redova u jednu glavnu podgrupu, a druga podgrupa se naziva sekundarnom.
Prilikom konstruisanja periodnog sistema Mendeljejev se rukovodio principom raspoređivanja elemenata prema rastućim atomskim masama. Međutim, kao što se vidi iz tabele, u tri slučaja je ovo načelo prekršeno. Da, argon atomska masa 39,948) je ispred kalijuma (39,098), kobalta (58,9332) je ispred nikla (58,70) i telura (127,60) ispred joda (126,9045). Ovde je Mendeljejev odstupio od redosleda koji je usvojio, polazeći od svojstava ovih elemenata, što je zahtevalo upravo takav redosled njihovog rasporeda. Dakle, on nije pridavao izuzetan značaj atomskoj masi i, određujući mjesto elementa u tabeli, rukovodio se ukupnošću njegovih svojstava. Kasnija istraživanja su pokazala da je raspored elemenata u periodičnom sistemu koji je napravio Mendeljejev potpuno ispravan i da odgovara strukturi atoma (za više detalja vidi Poglavlje III).
Dakle, u periodičnom sistemu, svojstva elemenata, njihova atomska masa, valencija i hemijski karakter se menjaju u poznatom nizu, kako u horizontalnom tako iu vertikalnom pravcu. Mjesto elementa u tabeli je, dakle, određeno njegovim svojstvima, i, obrnuto, svako mjesto odgovara elementu koji ima određeni skup svojstava.
Stoga, znajući poziciju elementa u tabeli, možete prilično precizno odrediti njegova svojstva.
Ne samo hemijska svojstva elemenata, već i mnoga fizička svojstva jednostavne supstance periodično se menjaju ako ih posmatramo kao funkcije atomske mase.
Periodičnost u promeni fizička svojstva jednostavne tvari jasno se otkriva, na primjer, kada se porede njihove atomske zapremine.
Prikazano na sl. 1 kriva pokazuje kako se atomski volumen elemenata mijenja sa povećanjem atomske mase: alkalni metali imaju najveće atomske zapremine.
Mnoge druge fizičke konstante jednostavnih supstanci također se povremeno mijenjaju.
Dmitrij Ivanovič Mendeljejev rođen je 27. januara (8. februara) 1834. godine u gradu Tobolsku u porodici direktora lokalne gimnazije. Nakon što je završio gimnaziju u Tobolsku, upisao je Pedagoški institut u Sankt Peterburgu, koji je diplomirao 1855. godine sa zlatnom medaljom. Godine 1859, odbranivši magistarski rad na temu „On specifične količine“, Mendeljejev je otišao u inostranstvo na dvogodišnje naučno putovanje. Po povratku u Rusiju, izabran je za profesora prvo na Tehnološkom institutu u Sankt Peterburgu, a dve godine kasnije - na Univerzitetu u Sankt Peterburgu, gde je 33 godine vodio naučni i pedagoški rad. Godine 1892. Mendeljejev je imenovan za naučnog čuvara Depoa uzornih utega i mjera, koji je na njegovu inicijativu 1893. pretvoren u Glavnu komoru za tegove i mjere (sada Svesavezni naučno-istraživački institut za mjeriteljstvo imena D. I. Mendeljejeva).
Najveći rezultat Mendeljejevljeve stvaralačke aktivnosti bilo je njegovo otkriće periodnog zakona 1869. godine, odnosno u 35. godini života i stvaranje periodnog sistema elemenata. Od ostalih Mendeljejevih radova najvažniji su „Studije vodenih rastvora prema specifična gravitacija“, doktorska disertacija “O kombinaciji alkohola sa vodom” i “Razumijevanje rješenja kao asocijacija”. Osnovni koncepti hemijske ili hidratne teorije rastvora koje je razvio Mendeljejev čine važan deo moderne teorije rastvora.
Izvanredan rad Mendeljejeva je njegova knjiga "Osnovi hemije", u kojoj su po prvi put svi neorganska hemija predstavljeno u smislu periodičnog zakona.
Organski kombinujući teoriju sa praksom, Mendeljejev je tokom svog života mnogo pažnje posvetio razvoju domaće industrije.
1984. naučna zajednica Sovjetski savez i mnoge zemlje svijeta svečano su proslavile sto pedesetu godišnjicu rođenja D. I. Mendeljejeva, izvanrednog naučnika koji je otkrio periodični zakon i stvorio periodični sistem elemenata.
Periodični sistem hemijski elementi
Trenutno je poznato 109 hemijskih elemenata. Posljednji elementi dobiveni su u količini od svega nekoliko atoma i nemaju praktičan značaj. Međutim, periodični sistem se može dalje proširiti.
Forms grafička slika periodični sistem (periodični sistem) može biti različit; glavna dva od njih su: dugo i kratko.
U dugačkom obliku tabele, svaki period je upisan u jednom redu. U obrazovne svrhe obično se koristi kratka forma tabele u kojoj su dugi periodi ispisani u dva reda.
Periodični sistem se sastoji iz sedam perioda, raspoređeni vodoravno u tabeli, i osam grupa raspoređenih okomito.
Period je horizontalni niz elemenata, koji počinje (s izuzetkom 1. perioda) alkalnim metalom i završava se inertnim (plemenitim) gasom.
1. period sadrži 2 elementa, 2. i 3. period - po 8 elemenata. Prvi, drugi i treći period se nazivaju mali (kratki) periodi. 4. i 5. period sadrže po 18 elemenata, 6. period - 32 elementa, 7. period sadrži elemente od 87. i dalje, do posljednjeg od trenutno poznatih elemenata - 109. Zovu se četvrti, peti, šesti i sedmi period veliki (dugi) periodi.
Svaki Grupa Periodični sistem se sastoji od dvije podgrupe: glavne podgrupe (A) i sekundarne podgrupe (B). Glavna podgrupa sadrži elemente malih i velikih perioda (metali i nemetali). bočna podgrupa sadrži elemente samo velikih perioda (samo metali).
Na primjer, glavnu podgrupu grupe I čine elementi litijum, natrijum, kalijum, rubidijum, cezijum i francijum, a sekundarnu podgrupu grupe I čine elementi bakar, srebro i zlato. Glavnu podgrupu VIII grupe čine inertni gasovi, a sekundarnu podgrupu čine metali gvožđe, kobalt, nikl, rutenijum, rodijum, paladijum, osmijum, iridijum, platina, hasijum i meitnerijum. .
Svojstva jednostavnih supstanci i spojeva elemenata se mijenjaju monotono u svakom periodu i grčevito na granicama perioda. Ova priroda promjene svojstava je značenje periodične zavisnosti.
AT periodi s lijeva na desno, nemetalna svojstva elemenata monotono rastu, dok metalna slabe. Na primjer, u drugom periodu, litijum je vrlo aktivan metal, berilij je metal koji formira amfoterni oksid i, shodno tome, amfoterni hidroksid, B, C, N, O su tipični nemetali, fluor je najaktivniji nemetal, neon je inertan gas. Dakle, na granicama perioda, svojstva se naglo mijenjaju: period počinje alkalnim metalom i završava se inertnim plinom.
AT periodi s lijeva na desno, kisela svojstva oksida elemenata i njihovih hidrata se povećavaju, dok bazična svojstva slabe. Na primjer, u trećem periodu, natrijum oksid je bazični oksid, magnezijev oksid je bazičan, aluminijum oksid je amfoterni, a oksidi silicija, fosfora, sumpora i hlora su kiseli oksidi. Natrijum hidroksid je jaka baza (alkalija), magnezijum hidroksid je slaba nerastvorljiva baza, A1 (OH) 3 je nerastvorljivi amfoterni hidroksid, silicijumska kiselina je vrlo slaba kiselina, H 3 PO 4 je kiselina srednje jačine, sumporna je jaka kiselina, HClO 4 (perhlorna) je najjača kiselina ove serije.
AT glavne podgrupe od vrha do dna, metalna svojstva elemenata su poboljšana, dok su nemetalna svojstva oslabljena. Na primjer, u podgrupi 4A: ugljenik i silicijum su nemetali, germanijum, kalaj, olovo su metali, a kalaj, olovo su tipičniji metali od germanijuma. U podgrupi 1A svi elementi su metali, ali prema hemijska svojstva može se pratiti i jačanje metalnih svojstava od litijuma do cezijuma i francijuma.
Kao rezultat toga, metalna svojstva u većina izraženo u cezijumu i francijumu, a nemetalno - u fluoru.
AT glavne podgrupe od vrha do dna, osnovna svojstva oksida i njihovih hidrata se povećavaju, dok svojstva kiselina slabe. Na primjer, u podgrupi 3A: B 2 O 3 - kiseli oksid, i T1 2 O 3 - osnovni. Njihovi hidrati: H 3 BO 3 je kiselina, a T1 (OH) 3 je baza.
1. Otkriće periodnog zakona od strane D.I. Mendeljejev.
2.
Otkriće periodnog zakona od strane D.I. Mendeljejev
Na dan otkrića periodnog zakona od strane D.I. Mendeljejev se smatra 1. martom 1869. godine, iako je put do ovog otkrića ležao mnogo godina kasnije. Sada je ime Mendeljejeva zauvijek ušlo na listu imena najvećih naučnika svijeta, a njegovo otkriće postalo je osnova moderne hemije.
Osnova klasifikacije hemijskih elemenata D.I. Mendeljejev je postavio dva osnovna svojstva poznata u to vreme: 1) atomsku masu; 2) hemijska svojstva. Rad na sistematici poznatih elemenata (tada ih je bilo 63 poznato) sastojao se u činjenici da je D.I. Mendeljejev je rasporedio elemente prema porastu njihove atomske mase, uzimajući u obzir njihova osnovna svojstva. Otkrio je da se hemijski slični elementi javljaju u pravilnim intervalima i da se stoga mnoga njihova svojstva periodično ponavljaju u nizu elemenata. Utvrđena je zavisnost svojstava elemenata od atomskih masa.
Ovaj obrazac je izražen u periodičnom zakonu: svojstva jednostavnih tijela, kao i oblici i svojstva spojeva elemenata, u periodičnoj su zavisnosti od veličine atomskih težina (masa) elemenata.
Pravo je moćno novo oruđe u proučavanju elemenata. On je omogućio da se unapred definišu svojstva elemenata koji još nisu otkriveni. Tako je opisao svojstva tada nepoznatih elemenata pod br. 21, 31, 32 (ostavio je prazne ćelije). Za života D.I. Mendeljejeva, ova tri elementa su otkrivena: 1875. otkrio 31 Ga (Lecoq de Boisbaudran), 1879 - 21 Sc (Nilson i Cleve), 1886 - 32 Ge (Winkler) i stavljen u periodični sistem. Ova tri elementa D.I. Mendeljejev je nazvao "ojačavačima" periodičnog zakona. Napisao je: "Budućnost ne prijeti uništenjem periodičnog zakona, već se samo obećava dalja nadgradnja i razvoj." Raspoređivanje elemenata povećanjem atomske mase, D.I. Mendeljejev je u tri navrata napustio ovaj princip. Dakle, 18 Ar(A=39,948) košta do 19 K(A=39,098); 27 Co(A=58,933) je do 28 Ni(A=58,70); 52 Te(127,60) do 53 I(A=126,904). Dakle, on nije pridavao izuzetan značaj atomskoj masi, već je utvrdio mjesto elementa u tabeli, uzimajući u obzir sveukupnost svojstava elemenata. Razvoj teorije strukture atoma pokazao je da je postavljanje elemenata od strane D.I. Mendeljejev u periodičnom sistemu je apsolutno ispravan i odgovara strukturi atoma.
Trenutno je otvoreno 114 stavki. Postoje li ograničenja za periodični sistem? Nauka odgovara: ne mogu postojati oštro ocrtane granice – ni početak ni kraj periodnog sistema. Tako je 1953. godine otkriven pozitronijum (Ps) čija je masa skoro 1000 puta manja od atoma vodika. On otkriva Mendeljejev sistem elemenata.
Pozitronijum se može predstaviti kao elektron i pozitron. Pozitron je čestica koja je po masi slična elektronu, ali ima pozitivan naboj. Pozitronijum (Ps) je elektron i pozitron koji se kreću oko zajedničkog centra gravitacije. Pozitronijum se sastoji od elektron-pozitronske ljuske i nema jezgro, ali ima kratak životni vek: oko 10 -7 - 10 -10 sec. i nestaje sa emisijom fotona. Pozitronijum otvara periodni sistem elemenata, jak je redukcioni agens i može da učestvuje u hemijskim reakcijama kao redukcioni agens. Na primjer, obnavlja ione: Fe 3+ u Fe 2+
Otkriće pozitronijuma pokrenulo je pitanje postojanja potpuno drugačijeg materijalnog svijeta izgrađenog od anti-atoma. Zaista, pozitronijum se nalazi na granici između atoma - koji se sastoji od pozitivno nabijenog jezgra i negativno nabijenih elektrona, a anti-atomi – sistemi negativno nabijenih jezgara i pozitivno nabijenih pozitrona:
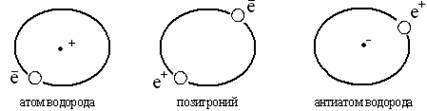
Antiatomi postoje, neki od njih (antiatomi vodonika, helijuma) su eksperimentalno proučavani. Stoga se ne može govoriti o početku periodnog sistema, jer tabela o pozitronijumu može ponoviti u svetu anti-atoma strukturu periodnog sistema D.I. Mendeljejev.
Postoji razvoj sistema hemijskih elemenata u oblasti teških elemenata: element 114 je već otkriven. Moguće je da će se pojaviti novi obrasci koji dopunjuju (ali ne krše) zakon D.I. Mendeljejev.
Prirodni kraj periodnog sistema određen je atomskim brojem elementa za koji je prosječan životni vijek atomsko jezgro postaje manje od 1 * 10 -15 sek. Za elemente sa serijskim brojevima 108-114 ovo vrijeme je oko 1*10 -12 sec. Razvoj teorije atomskih jezgri omogućio je da se smatra da, pri velikim serijskim brojevima, mogu postojati takozvana "ostrva stabilnosti", tj. pojedinačni atomi sa dugim životnim vekom.
do početka
Konstrukcija periodnog sistema (period, grupa, podgrupa).
Izraz periodičnog zakona je periodični sistem hemijskih elemenata. Periodični sistem je grafički prikaz periodnog zakona. Mendeljejev je 1869. dao skicu tabele - dugačku formu, a 1870. je predložio kratku formu. Neke značajne promjene su napravljene u modernoj verziji kratke forme (plemeniti plinovi su premješteni iz nulte grupe u osmu grupu). Trenutno je poznato nekoliko stotina varijanti periodnog sistema elemenata (više od 400), a sve one u osnovi sadrže princip konstrukcije koji je predložio Mendeljejev.
Periodični sistem se sastoji od 7 perioda i 8 grupa.
Period - horizontalni niz elemenata, raspoređenih po rastućem nuklearnom naboju atoma, počevši od tipičnog metala (alkalnog), prolazeći kroz amfoterni element i završavajući s nemetalom (plemeniti plinovi). Broj perioda označava broj energetskih nivoa. Menstruacije su male i velike.
Malyugin 3. Struktura periodnog sistema. Periodi.
Kratkoperiodična verzija periodnog sistema se sastoji od periode, serije, grupe i podgrupe.
U dugoročnoj verziji serije nisu naznačene.
Period - horizontalni red periodnog sistema hemijskih elemenata, raspoređenih u rastućem redosledu naelektrisanja atomskog jezgra, koji počinje alkalnim metalom ( Li, Na, K.Rb, Cs, Fr) i završava se inertnim plinom (On, Ne, Ar, kr, Xe, Rn).
Izuzeci: prvi period, koji počinje vodonikom (nemetalnim).
Periodični sistem ima sedam perioda i 10 serija.
Razdoblja se dijele na mala i velika.
Prvi period, koji sadrži 2 elementa, i također drugi i treći, sa po 8 elemenata, nazivaju se malim. Sastoje se od jednog horizontalnog reda.
Preostali periodi, sa dva horizontalna reda u svakom, nazivaju se velikim.
Četvrti i peti period sadrže po 18 hemijskih elemenata. Peti i šesti period - po 32 hemijska elementa. Sedmi period sadrži, prema najnovijim podacima, 32 elementa, od kojih su mnogi umjetno dobiveni provođenjem reakcije nuklearne fuzije.
Svaki veći period ima dva reda.
Zovu se gornji redovi velikih perioda čak, donji redovi odd. U parnim redovima velikih perioda nalaze se samo metali.
U šestom periodu iza lantana La (redni broj Z=57) nalazi se 14 elemenata (redni brojevi Z=5, koji su po svojstvima slični lantanu i nazivaju se lantanidi, nalaze se na dnu periodnog sistema.
U nepotpunom sedmom periodu nakon aktinijuma Ac (redni broj Z=89) nalazi se 14 elemenata (redni brojevi Z=, koji su po svojstvima slični aktinijumu i nazivaju se aktinidi. Poput lantanoida, oni se nalaze na dnu periodnog sistema (slika 1)
Fig.1. Raspored perioda i serija
u periodičnom sistemu
Tabela 1. Broj elemenata u periodima:
Broj perioda | Broj redova | Naziv perioda | Broj elemenata | Broj elemenata po podgrupama |
||
strana | Lantanidi/ aktinidi |
|||||
2 reda + lantanidi | ||||||
2 reda + aktinidi |
Obrasci posmatrani u periodima.
Svaki period (osim prvog) počinje tipičnim metalom (Li, Na, K, Rb, Cs, Fr) i završava se plemenitim gasom (He, Ne, Ar, Kr, Xe, Rn), kojem prethodi tipični ne -metal (F, Cl, Br, I, At).
U svakom periodu, s lijeva na desno, naboj atomskog jezgra raste, radijus atoma se smanjuje, dolazi do slabljenja metalnih i jačanja nemetalnih svojstava, slabljenja redukcijskih i jačanja oksidacijskih svojstava. elemenata i jednostavnih i složenih supstanci koje oni formiraju.
Pitanja za samoispitivanje
1. Od kojih strukturnih elemenata se sastoji periodni sistem hemijskih elemenata?
2. Šta je period?
3. Koliko je tačaka i redova u periodnom sistemu?
4. Koliko elemenata ima u svakom periodu?
5. Koji se periodi nazivaju malim i zašto?
6. Koliko serija ima male periode?
7. Koji se periodi nazivaju velikim? Koliko redova ima duge periode?
8. Koje karakteristike postoje u strukturi VI, VII perioda?
9. Koji elementi počinju svaki period?
10. Kojim elementima završava svaki period?
11. Koji elementi prethode plemenitim (inertnim) gasovima?
12. Kako se svojstva elemenata mijenjaju u periodima s lijeva na desno?
Pogledaj odgovor
1. Iz perioda, serija, grupa i podgrupa.
2. Period - horizontalni red periodičnog sistema hemijskih elemenata, raspoređenih uzlaznim redom naelektrisanja atomskog jezgra, koji počinje alkalnim metalom (Li, Na, K. Rb, Cs, Fr) i završava se inertni gas (He, Ne, Ar, Kr, Xe, Rn).
3. 7 tačaka i 10 redova.
4. Vidi tabelu 1.
5. I, II i III periodi se nazivaju malim, oni sadrže, respektivno, 2, 8, 8 hemijskih elemenata.
6. Mali periodi imaju po jedan red. Vidi sl.1.
7. IV, V, VI, VII periodi se nazivaju velikim. Svaki glavni period ima 2 reda. Vidi sl.1.
8. VI sadrži 14 elemenata - lantanida, VII period sadrži 14 elemenata aktinida. Radi praktičnosti, nalaze se na dnu tabele.
13. Svaki period (osim prvog) počinje tipičnim alkalnim metalom (Li, Na, K, Rb, Cs, Fr)
14. Svaki period završava plemenitim gasom (He, Ne, Ar, Kr, Xe, Rn).
15. Prethode im tipični nemetali - halogeni (F, Cl, Br, I, At).
16. U svakom periodu, s lijeva na desno, dolazi do slabljenja metalnih i jačanja nemetalnih svojstava, slabljenja redukcijske i jačanja oksidacijskih svojstava elemenata i jednostavnih i složenih supstanci koje oni formiraju.
Zadaci za samostalno rješavanje
1. U kom periodu i nizu su elementi sa rednim brojevima 14, 48, 52, 56, 78? Navedite njihov simbol, ruski naziv, relativnu atomsku masu.
2. Napiši simbole, nazive i relativne atomske mase elemenata neparnog niza IV perioda.
3. Koji element ima izraženija metalna svojstva – kalcijum ili kalijum? Zašto?
4. Koji element ima izraženija nemetalna svojstva: fosfor ili hlor? Zašto?
5. Koji element četvrtog perioda je najaktivniji nemetal? Zašto?
6. Koji element petog perioda je najaktivniji metal? Zašto?
Pogledaj odgovor:
Serijski broj | ||||||
Simbol elementa | ||||||
Relativna atomska masa |
neparan je 5. red PSHE, uključuje elemente |
|||||||||
Simbol elementa | |||||||||
Serijski broj | |||||||||
Rusko ime | germanijum | ||||||||
Relativna atomska masa |
3. Kalijum. Morate pogledati položaj elemenata u PSCE-u. Kalijum (K) i kalcijum (Ca) su u istom (četvrtom) periodu. U jednom periodu, metalna svojstva slabe s lijeva na desno.
4. Hlor. Morate pogledati položaj elemenata u PSCE-u. Fosfor (P) i hlor (Cl) su u istom (trećem) periodu. U periodu, s lijeva na desno, nemetalna svojstva se povećavaju.
5. Najaktivniji nemetal ovog perioda je brom. U periodu, s lijeva na desno, nemetalna svojstva se povećavaju. Inertni element kripton ne pokazuje hemijsku aktivnost, prethodi mu najaktivniji nemetal.
6. Najaktivniji metal ovog perioda je rubidijum. Period počinje aktivnim alkalnim metalom (Li, Na, K. Rb, Cs, Fr), pri kretanju s lijeva na desno u periodu slabi metalna svojstva. .






