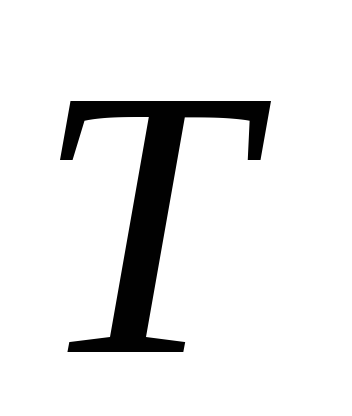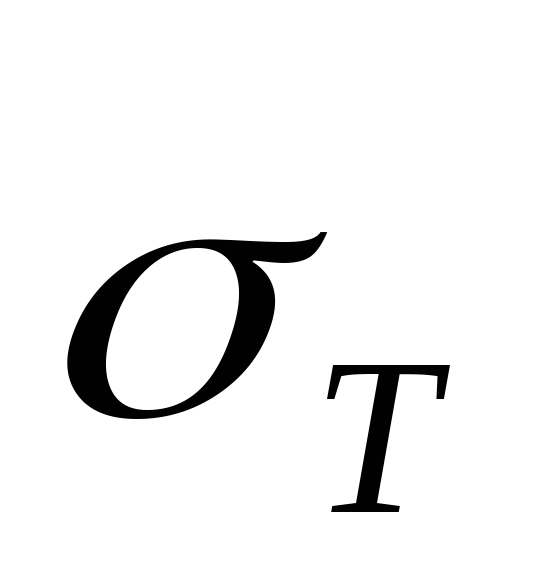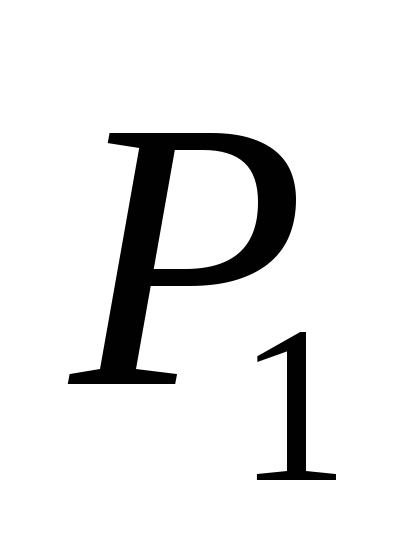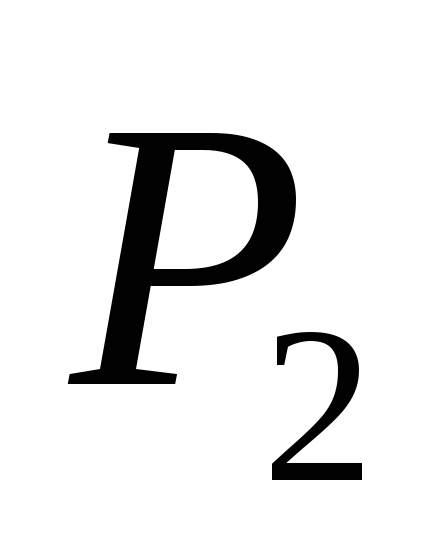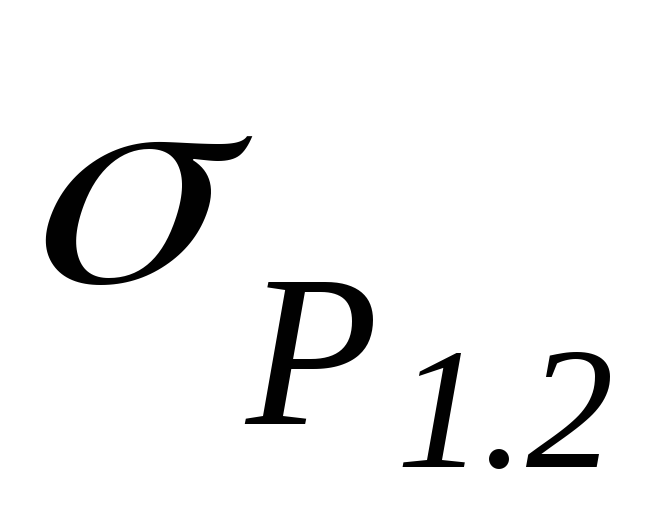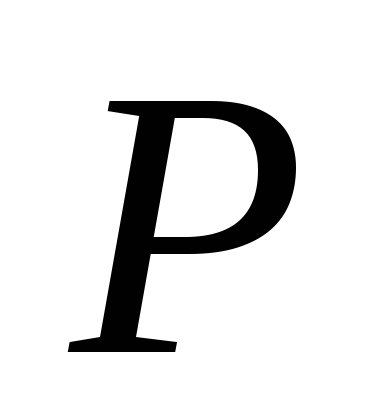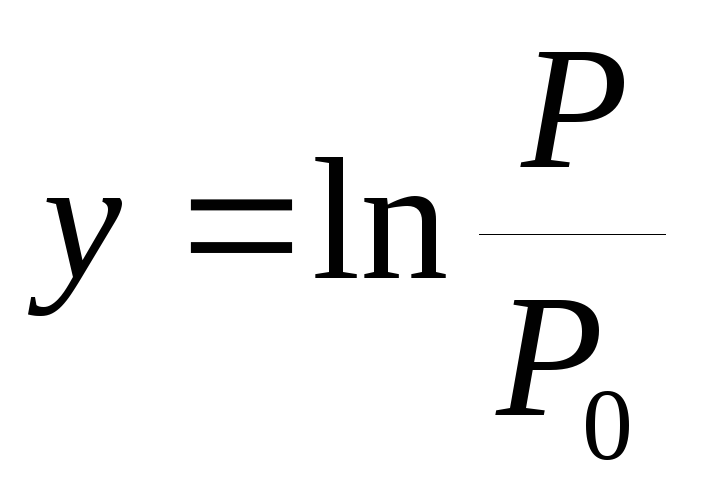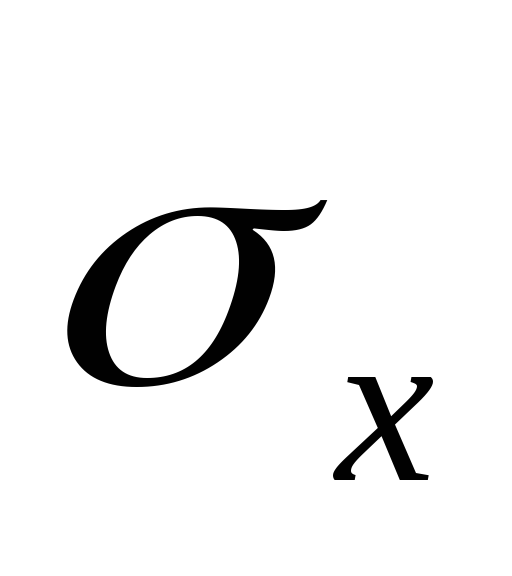Specifični toplotni kapacitet kondenzacije vodene pare. Određivanje specifične topline isparavanja
Laboratorijski rad №4.
Određivanje toplote isparavanja tečnosti
1. Kratka teorija
Isparavanje je prijelaz tvari iz tekućeg u plinovito stanje. Tokom isparavanja, molekuli izlete sa površine tečnosti, formirajući paru iznad nje. Samo najbrži molekuli mogu da izlete iz tečnosti u okolni prostor, jer samo oni mogu da savladaju privlačne sile koje deluju u površinskom sloju tečnosti. Kao rezultat odlaska brzih molekula, tečnost se hladi. Da bi njegova temperatura bila konstantna, potrebna je opskrba toplinom.
Količina topline koja se mora prenijeti tvari da bi se ona promijenila tečno stanje u gasovito konstantna temperatura i konstantan pritisak, naziva se toplota isparavanja (ili toplota isparavanja).
Toplota isparavanja tečnosti može se meriti direktno kalorimetrom. Ova metoda, međutim, ne daje precizne rezultate zbog nekontrolisanog gubitka toplote, koji je teško smanjiti. U ovom radu za određivanje topline isparavanja koristimo indirektnu metodu zasnovanu na Clausius-Clapeyron jednadžbi:
 . (1)
. (1)
Evo P
je pritisak zasićene pare tečnosti na temperaturi T
,T je apsolutna temperatura tečnosti i pare, 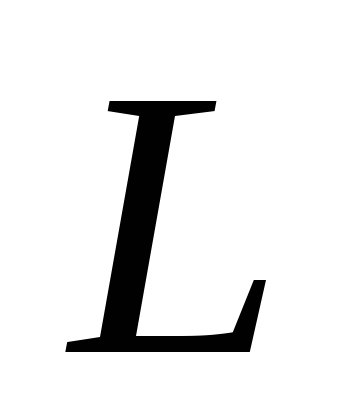 - specifična toplota isparavanja tečnosti,
- specifična toplota isparavanja tečnosti, 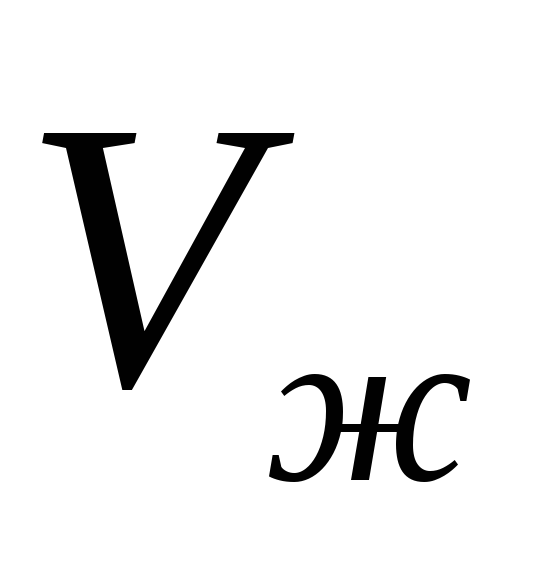 - specifična zapremina tečnosti,
- specifična zapremina tečnosti, 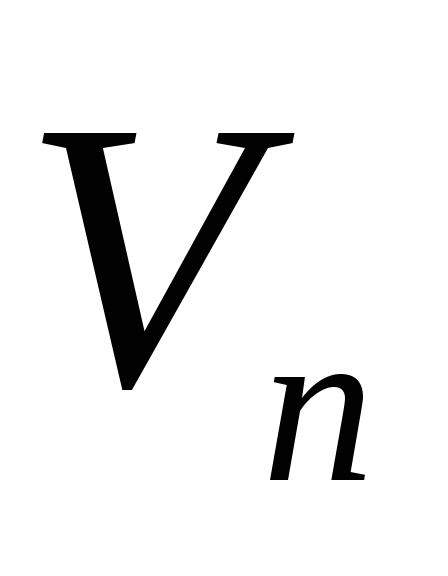 - specifična zapremina pare.
- specifična zapremina pare.
Ako je poznata zavisnost specifične toplote isparavanja 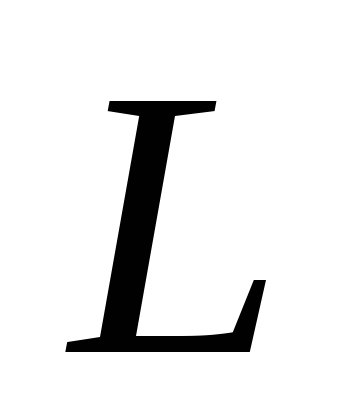 i specifične količine
i specifične količine 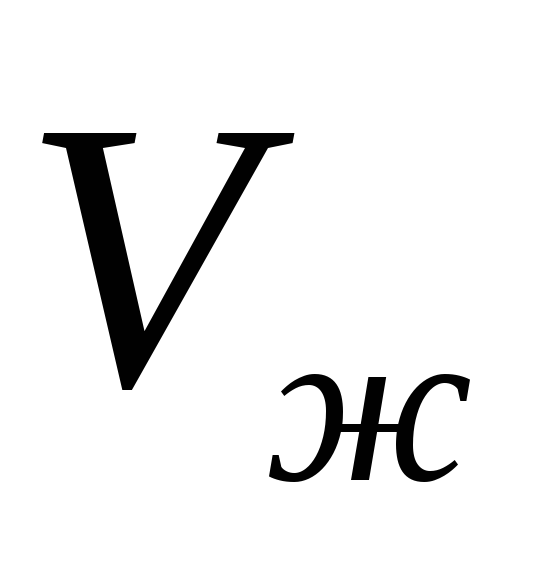 i
i 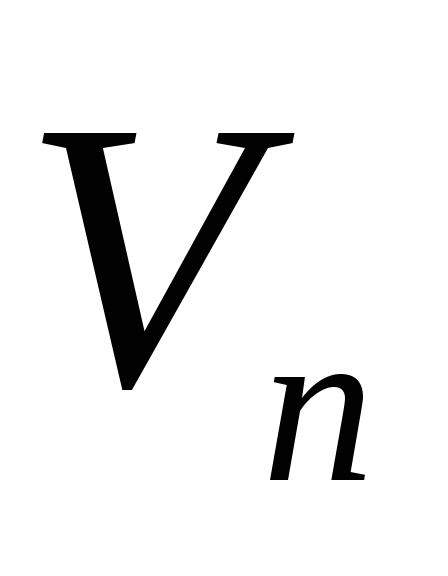 na temperaturu, tada se jednačina (1) može integrirati i eksplicitno naći ovisnost tlaka zasićene pare o temperaturi. U najgrubljem aproksimaciji možemo pretpostaviti da je vrijednost
na temperaturu, tada se jednačina (1) može integrirati i eksplicitno naći ovisnost tlaka zasićene pare o temperaturi. U najgrubljem aproksimaciji možemo pretpostaviti da je vrijednost 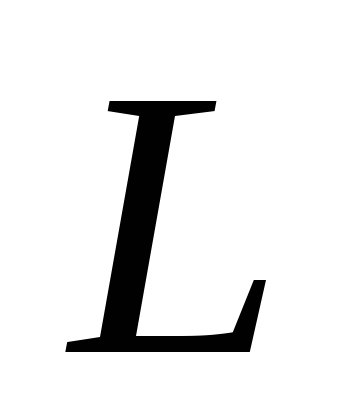 ne zavisi od temperature, a specifična zapremina tečnosti u poređenju sa specifičnom zapreminom pare može se zanemariti. Osim toga, možemo pretpostaviti da je jednadžba stanja idealnog plina (jednačina Mendelejeva-Klapejrona) primjenjiva na paru, iz koje izražavamo specifičan volumen par:
ne zavisi od temperature, a specifična zapremina tečnosti u poređenju sa specifičnom zapreminom pare može se zanemariti. Osim toga, možemo pretpostaviti da je jednadžba stanja idealnog plina (jednačina Mendelejeva-Klapejrona) primjenjiva na paru, iz koje izražavamo specifičan volumen par: 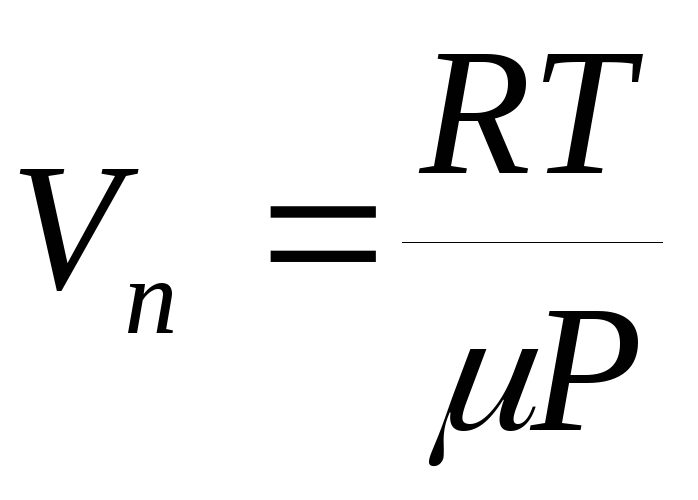 .
.
U prihvaćenoj aproksimaciji, jednačina (1) će se pretvoriti u diferencijalnu jednačinu:
 ,
,
integrirajući koje, dobijamo:
 , (2)
, (2)
gdje 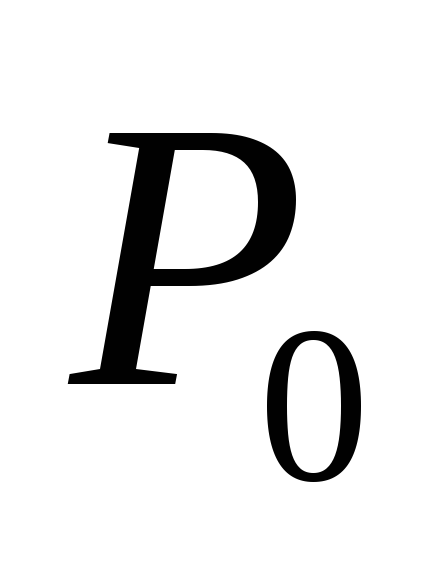
 .
.
Relacija (2) omogućava određivanje specifične toplote isparavanja, znajući zavisnost pritiska zasićene pare od temperature. Ovaj laboratorijski rad posvećen je određivanju specifične toplote isparavanja vode.
2. Eksperimentalna postavka. Eksperimentalna tehnika
Eksperiment se izvodi na postavci šematski prikazanoj na slici. Postavka se sastoji od termostata napunjenog vodom, grijaćih elemenata, sistema za hlađenje (nije prikazan na slici), dvije tikvice sa ispitnim plinovima i mjernih instrumenata.
H  grijaćih elemenata H služe za povećanje temperature u sistemu. Za ravnomjerno zagrijavanje sistema, voda se stalno miješa sa zrakom koji dovodi kompresor To. Uključivanje i isključivanje grijaćih elemenata i kompresora vrši se pomoću upravljačke ploče PU. Prije pokretanja dizalica To 1
i To 2
otvori, pa zatvori. Ovo je neophodno kako bi pritisak u bocama u početnom trenutku postao jednak atmosferskom. Termometar mjeri temperaturu T voda u koju su uronjene tikvice sa suvim i vlažnim vazduhom. Parametri instalacije su takvi da se voda polako zagreva i da gas u bocama ima vremena da se zagreje do iste temperature kao i voda u sistemu. Manometri M 1
i M 2
pokazati višak pritiska u tikvicama sa suvim i vlažnim vazduhom, respektivno.
grijaćih elemenata H služe za povećanje temperature u sistemu. Za ravnomjerno zagrijavanje sistema, voda se stalno miješa sa zrakom koji dovodi kompresor To. Uključivanje i isključivanje grijaćih elemenata i kompresora vrši se pomoću upravljačke ploče PU. Prije pokretanja dizalica To 1
i To 2
otvori, pa zatvori. Ovo je neophodno kako bi pritisak u bocama u početnom trenutku postao jednak atmosferskom. Termometar mjeri temperaturu T voda u koju su uronjene tikvice sa suvim i vlažnim vazduhom. Parametri instalacije su takvi da se voda polako zagreva i da gas u bocama ima vremena da se zagreje do iste temperature kao i voda u sistemu. Manometri M 1
i M 2
pokazati višak pritiska u tikvicama sa suvim i vlažnim vazduhom, respektivno.
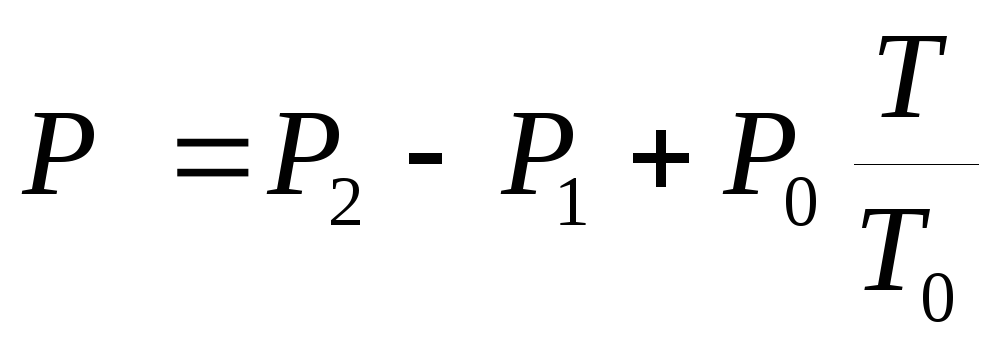 , (3)
, (3)
gdje P 1
i P 2
- indikacije manometara M 1
i M 2
odnosno, T– temperatura u sistemu 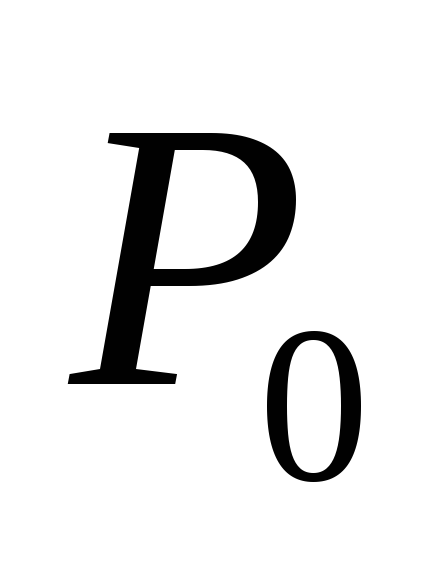 pritisak zasićene pare na početnoj temperaturi
pritisak zasićene pare na početnoj temperaturi  (ova vrijednost se smatra poznatom).
(ova vrijednost se smatra poznatom).
Prema iskustvu, gradi se graf zavisnosti  od
od 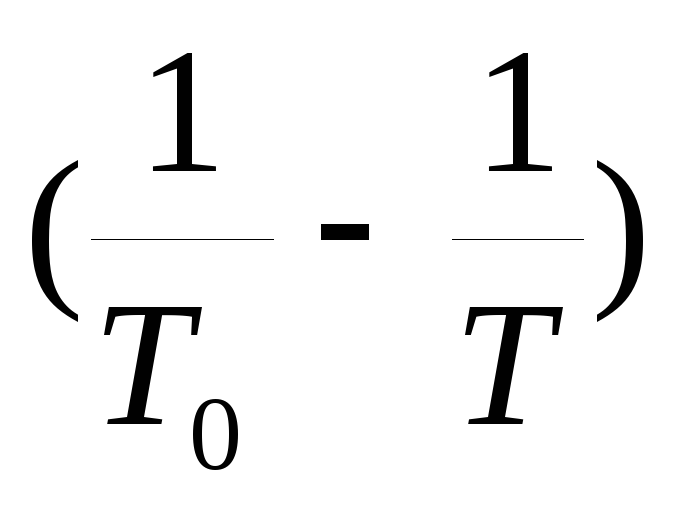 .
.
Prema jednačini (2), eksperimentalne tačke moraju ležati na pravoj liniji koja prolazi kroz ishodište. Prema grafu se određuje nagib ove linije  i nađena je specifična toplota isparavanja vode.
i nađena je specifična toplota isparavanja vode.
Jednačina (2) to pokazuje  i stoga:
i stoga: 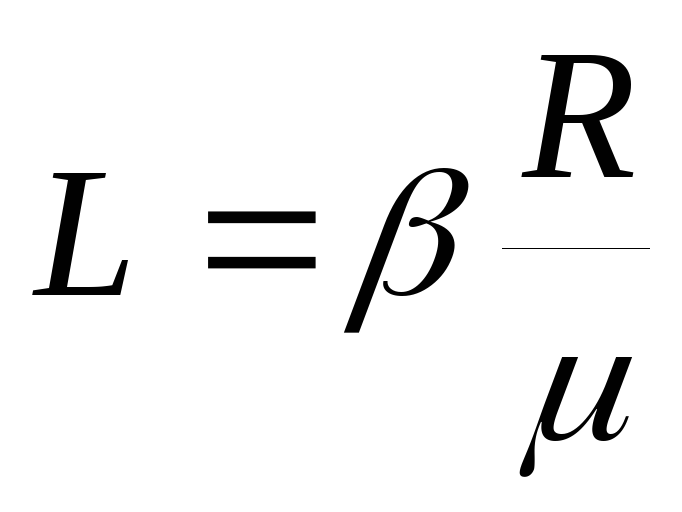 .
.
3. Mjerenja. Obrada rezultata mjerenja
1. Upoznajte se sa instalacijskim uređajem i njegovim elementima.
2. Uklonite zavisnost manometara P 1 i P 2 na temperaturu i izračunajte za svaku temperaturu pritisak pare zasićenja P koristeći formulu (3). Napravite tabelu na osnovu svog iskustva:
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
| ||||||
|
|
3. Grafikon tlaka zasićene pare u odnosu na temperaturu P(T) i grafikon logaritma odnosa pritisaka y=  od vrijednosti x =
od vrijednosti x =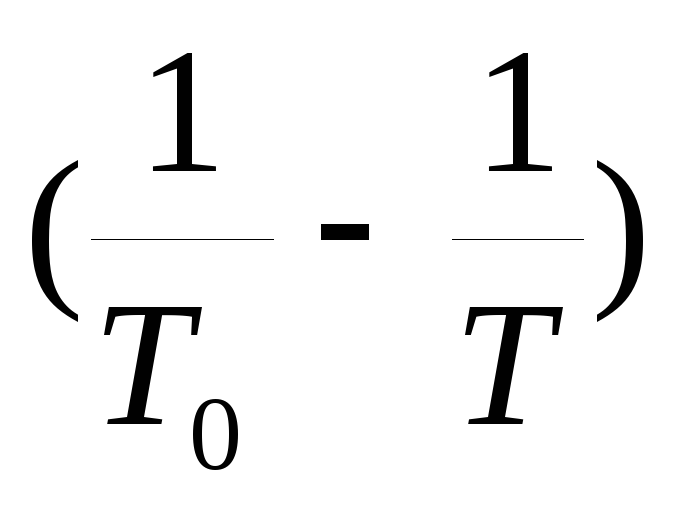 .
.
Da biste napravili posljednji grafikon, morate popuniti tabelu:
|
| ||||||
|
| ||||||
|
| ||||||
|
|
By ugaoni koeficijent graf određuje toplinu isparavanja L i procijeniti grešku rezultata.
4. Uporedite rezultat sa tabelarnom vrednošću.
4. Sigurnosna pitanja
Kako se zove specifična toplota isparavanja tečnosti?
Izvedite Clausius-Clapeyronovu jednačinu.
Koje su pretpostavke napravljene prilikom izvođenja relacije (2)? Izvedite ovaj omjer.
Azeotropno- izraz koji se koristi za označavanje mješavine tečnosti, čije tečne i gasovite faze, pod uslovima termodinamičke ravnoteže, imaju isti sastav. Tačka ključanja smjese je konstantna.
Azeotropna tačka- temperatura na kojoj ključa mješavina tečnosti i para istog sastava kao i tečna smjesa.
Vakuum(ili razrijeđeni plin) - stanje plinovitog medija u kojem je njegov tlak znatno niži od atmosferskog.
Dephlegmator - izmjenjivač topline za djelomičnu kondenzaciju pare. U kolonama za destilaciju služi za formiranje refluksa neophodnog za navodnjavanje kontaktnih elemenata kolone.
Isparavanje Isparavanje se dešava sa slobodne površine tečnosti. Molekuli tečnosti na istoj temperaturi kreću se različitim brzinama. Ako se dovoljno brz molekul nalazi na površini tekućine, tada može savladati privlačenje susjednih molekula i izletjeti iz tekućine. Molekuli koji izlaze sa površine tečnosti formiraju paru. Istovremeno sa isparavanjem, molekuli se prenose iz pare u tečnost. Fenomen transformacije pare u tečnost naziva se kondenzacija.
Ako nema priliva energije u tečnost izvana, tada se tečnost koja isparava hladi. Kondenzacija pare je praćena oslobađanjem energije.
Brzina isparavanja tečnosti zavisi od vrste tečnosti i od njene temperature, od njene površine, od kretanja vazdušnih masa (vetar) po površini tečnosti.
Kipuće- proces isparavanja koji se odvija u cijeloj zapremini tečnosti. Prilikom ključanja dolazi do isparavanja u mjehuriće zraka otopljene u tekućini. Sa povećanjem pritiska u mjehurićima, oni isplivaju na površinu i pucaju. Ovi mjehurići sadrže ne samo zrak, već i vodenu paru, jer tečnost isparava unutar ovih mjehurića.
Formacija centra vrenja- pojava i rast mjehurića pare na zagrijanoj površini u dodiru s tekućinom.
Tačka ključanja je tačka ključanja pri normalnom pritisku.
isparavanje - fazni prelaz prva vrsta; prelazak supstance iz tečnosti ili čvrsto stanje u gasovito stanje.
U zatvorenoj zapremini, isparavanje se nastavlja sve dok se prostor iznad tečnosti ili čvrste supstance ne napuni parom koja ima ravnotežni pritisak na datoj temperaturi (pritisak zasićenja). Najveći dio topline isparavanja troši se na razbijanje veza između čestica, dio ide na rad koji se obavlja prilikom širenja pare.
Temperatura ključanja je temperatura na kojoj tečnost ključa.
Temperatura ključanja:
Zavisi od prirode tečnosti i vanjskog pritiska; i
Smješten između trostruki poen i kritična temperatura.
Pri konstantnom pritisku, svaka tečnost ima svoju tačku ključanja.
S povećanjem atmosferskog tlaka, temperatura ključanja tekućine raste, a specifična toplina isparavanja se smanjuje.
Toplota isparavanja- količina toplote koja se mora preneti supstanci da bi je prešla iz tekućeg u gasovito stanje pri konstantnoj temperaturi.
Toplota isparavanja- količina topline koja se mora prenijeti tvari pri konstantnom pritisku i temperaturi da bi se ona prešla iz tekućeg u plinovito stanje.
U SI, toplota isparavanja se meri u J.
Specifična toplota isparavanja- količina toplote koja se mora preneti 1 kg supstance da bi se prešla iz tekućeg u gasovito stanje pri konstantnoj temperaturi.
Specifična toplota isparavanja se meri u J/kg.
Specifična toplota isparavanja je količina topline potrebna da se 1 kg tekućine pretvori u paru pri konstantnoj temperaturi. Ova vrijednost je označena slovom L ili slovom r i izražava se u džulima po kilogramu (J/kg).
Sa povećanjem temperature, vrijednost specifična toplota isparavanje je smanjeno.
Specifična toplota isparavanja - toplota isparavanja, izračunata po jedinici mase supstance.
Specifična toplota isparavanja opada sa porastom temperature i postaje nula na kritičnoj temperaturi.
Specifična toplina isparavanja pokazuje koliko energije treba dati jednom kilogramu tekućine uzeti na temperaturi ključanja da bi se potpuno pretvorila u paru na ovoj temperaturi (za kondenzaciju: koliko energije oslobađa jedan kilogram pare uzeti na temperatura kondenzacije, koja se potpuno pretvara u tečnost).
Pri istom pritisku, tačka ključanja i tačka kondenzacije iste supstance su iste.
Kondenzacija pare - proces vraćanja molekula pare u tečnost naziva se kondenzacija pare.
Kondenzator- izmjenjivač topline u kojem se pare kondenzuju, a toplotu odaju hladnjaku.
kondenzator vode Kondenzator koji koristi vodu kao rashladno sredstvo.
Kondenzator CIJEV U CIJEVI- kondenzator koji se sastoji od dvije koncentrične cijevi, pri čemu para najčešće kruži u prstenastom otvoru, a hladnjak u centralnoj cijevi.
Izmjena ili prijenos topline- proces tranzicije unutrašnja energija sa jednog tijela na drugo kao rezultat termičkog kontakta bez obavljanja posla.
Termička ravnoteža- stanje sistema u kojem se njegovi makroskopski parametri ne mijenjaju tokom vremena. U toplotnoj ravnoteži zapremina i pritisak se ne menjaju, ne dolazi do razmene toplote, nema međusobnih transformacija tečnosti i gasova, tečnosti i čvrste materije, stani hemijske reakcije i dr. U stanju termičke ravnoteže temperatura je ista u svim dijelovima sistema.
Specifična toplota- (malo slovo c) - karakteristika supstance koja pokazuje koliko je toplote potrebno da se 1 kg supstance zagreje za 1 stepen (ili oslobađa kada se 1 kg supstance ohladi za 1 stepen). Mjeri se u J/kg K ili J/kg 0C. Tablični podaci.
izmjenjivač topline- aparat dizajniran za prijenos topline između dva medija odvojena jedan od drugog.
Izmjenjivač topline sa školjkom i cijevi- izmjenjivač topline koji se sastoji od snopa cijevi smještenih u kućištu, pri čemu jedan od fluida teče kroz cijevi, a drugi u prostoru između cijevi i unutrašnje površine kućišta.
toplotna cijev- zatvoreni volumen, obično u obliku cijevi, djelomično ispunjen tekućinom i njenim parama i služi za prijenos topline između svoja dva krajnja dijela isparavanjem tekućine u vrućem dijelu i kondenzacijom pare u hladnom. Kondenzirana tečnost se vraća na vruću tačku gravitacijom ili kapilarnim silama kroz odgovarajući uređaj koji djeluje kao WICK
Parcijalni pritisak- (partialis - parcijalni) - pritisak koji bi imao gas koji je deo gasne mešavine da sam zauzima zapreminu jednaku zapremini smeše iste temperature.
Tačka rose Temperatura na kojoj vodena para u zraku postaje zasićena.
Faza- ravnotežno stanje materije, koje se razlikuje u fizička svojstva iz drugih mogućih stanja iste supstance. Supstanca ima faze: jedna je gasovita, jedna tečna i nekoliko čvrstih faza (na primer, led može biti u pet različitih modifikacija, što znači da ima pet čvrstih faza).
fazni prelaz- prijelaz tvari iz jedne faze u drugu.
Fizičko značenje gradijenta temperature je maksimalna stopa porasta temperature na udaljenosti. Ovo je vektor usmjeren u smjeru povećanja temperature, numerički jednak prvom izvodu temperature s obzirom na udaljenost. Temperaturni gradijent se meri u stepenima po metru. Temperaturni gradijent je različit od nule ako postoji temperaturna razlika.
Ejektor- uređaj koji povećava brzinu protoka jednog medija u suženom dijelu za stvaranje smanjeni pritisak i time uzrokujući priliv drugog medija tamo.
Sirup Obično rastvor šećera u vodi.
Salamuri- obično rastvor soli u vodi.
Upoznati učenike sa fenomenom ključanja. Naučiti objasniti proces ključanja na osnovu molekularnih - kinetička teorija. Razmotrite fizičke karakteristike ključanja. Odrediti metodu za proračun topline u procesu koji se proučava.
Skinuti:
Naslovi slajdova:
Prezentaciju je pripremila nastavnica fizike Starkova Evgenia Evgenievna MOU Burevestnikovskaya srednja škola
Tema lekcije:
Koji se proces naziva isparavanjem?
Šta je isparavanje?
Na kojoj temperaturi dolazi do isparavanja?
1. Zašto voda brže isparava iz tanjira nego iz posude?
2. Zašto je poremećena ravnoteža vage?
3. Zašto su se nivoi različitih tečnosti razlikovali nakon nekoliko dana?
Koji se proces naziva kondenzacija?
Da li se energija apsorbuje ili oslobađa tokom kondenzacije?
Vrenje je intenzivan prelazak tečnosti u paru, koji se javlja formiranjem mjehurića pare po cijeloj zapremini tečnosti na određenoj temperaturi.
Tačka ključanja nekih supstanci, 0C (normalno atmosferski pritisak)
Vodonik
-253
Voda
100
Kiseonik
-183
Merkur
357
Mlijeko
100
Olovo
1740
Eter
35
Bakar
2567
Alkohol
78
Iron
2750
Tačka ključanja zavisi od pritiska koji se vrši na slobodnu površinu tečnosti
Kako pritisak opada, temperatura ključanja tečnosti se smanjuje.
Kako pritisak raste, temperatura ključanja tečnosti se povećava.
Specifična toplota isparavanja.
Fizička količina, koji pokazuje koliko je toplote potrebno da se tečnost mase 1 kg pretvori u paru bez promene temperature, naziva se specifična toplota isparavanja.
Specifična toplina isparavanja označava se L, mjerena u J/kg
Specifična toplota isparavanja određenih supstanci, J/kg (na tački ključanja i normalnom atmosferskom pritisku)
Za pretvaranje vode sa maskom od 1 kg u paru na temperaturi od 100 0C potrebno je 2,3 * 106 J energije.
Kondenzirajući, para daje količinu energije koja je ušla u njeno formiranje
Proračun količine topline potrebne da se tekućina pretvori u paru
Da biste izračunali količinu topline koja je potrebna za isparavanje tekućine bilo koje mase, uzete na tački ključanja, trebate pomnožiti specifičnu toplinu isparavanja s masom
Q=lm
Q – količina toplote, J L – specifična toplota isparavanja, J/kg m – tjelesna težina, kg
Količina topline koju oslobađa para, koja se kondenzira na tački ključanja, određena je istom formulom
Q
3 *106 J
?
4,5*107 J
L
2,3*106 J/kg
2,3*106 J/kg
?
m
?
0,8 kg
19 kg
1,3 kg
1,84 * 106 J
2,3 * 106 J/kg
Na grafikonima su prikazani procesi zagrijavanja i ključanja identičnih masa vode i alkohola.
20
40
60
80
100
ALI
AT
OD
To
M
t, 0c
t, s
1. Navedite grafik zagrijavanja i ključanja izgrađen za alkohol
2. Izračunajte količinu topline koja se apsorbira tokom MC procesa. Pretpostavlja se da je masa vode 5 kg.
Udžbenik A.V. Peryshkin§18, §20Pr. 10 Br. 3.4
Pregled:
Čas fizike u 8. razredu.
Tema: Kipuće. Specifična toplota isparavanja i kondenzacije.
Svrha lekcije: Upoznati učenike sa fenomenom ključanja. Naučiti objasniti proces ključanja na osnovu molekularno-kinetičke teorije. Razmotrite fizičke karakteristike ključanja. Odrediti metodu za proračun topline u procesu koji se proučava.
Demos:1 .Posmatranje procesa zagrijavanja i ključanja vode u staklenoj tikvici.(Video)
2 . Kipuća voda pod smanjenim pritiskom (video).
3 . Posmatranje procesa kondenzacije (video).
Oprema: kompjuter, multimedijalni projektor.
Koraci lekcije:
- E Dodirnite da ažurirate znanje
- Motivaciona faza
- Faza stvaranja novog znanja
- Faza primjene stečenog znanja
- Zadaća
Struktura lekcije
- Faza ažuriranja znanja.
Org.moment.
Ispitivanje zadaća u obliku usmene ankete:
U prošloj lekciji naučili smo dva fizičke pojave To su isparavanje i kondenzacija. Prisjetimo se šta su oni.
Slajd 2. Koji se proces naziva isparavanjem?
Šta je isparavanje?
Na kojoj temperaturi dolazi do isparavanja?
Slajd 3. Brzina isparavanja ovisi o nekoliko faktora. Razjasnimo ih tako što ćemo odgovoriti na sljedeća pitanja:
Dakle, brzina isparavanja zavisi od:
- sa površine.
- na temperaturi tečnosti.
- Od neke vrste tečnosti.
slajd 4. Šta vidite na ekranu? ( rosa i oblaci).
Koji je proces rezultirao stvaranjem rose i oblaka?
Koji se proces naziva kondenzacija?
Da li se energija apsorbuje ili oslobađa tokom kondenzacije? ( izdvaja).
- motivaciona faza.
Dobro urađeno! Sada pogledajmo slike prikazane na ekranu:
Slajd 5. Reci mi šta vidiš? ( preko vodene pare)
slajd 6. Šta vidimo ovdje? (kipuće vode, para iznad vode)
Slajd 7. Šta objedinjuje slikovne podatke? ( para)
Dobro! U prošloj lekciji naučili smo da postoje dva načina da tečnost prođe gasovitom stanju, isparavanje i ključanje.
Danas ćemo razmotriti drugu metodu stvaranja pare - ključanje.
- Faza stvaranja novog znanja.
slajd 8. Demonstriram video sa iskustvom "Grijanje i ključanje vode u staklenoj tikvici."
Kada se zagrije, isparavanje vode s površine se povećava, ponekad čak možete primijetiti i maglu iznad nje. Ova vodena para kondenzuje se u vazduhu dok se hladi.
Daljnjim porastom temperature primijetit ćemo pojavu brojnih malih mjehurića u vodi. Njihova veličina postepeno raste. To su mjehurići zraka koji su otopljeni u vodi. Kada se zagrije, višak zraka se oslobađa iz vode u obliku mjehurića. Oni sadrže zasićena para kako voda isparava u ove mjehuriće zraka.
Kako se voda dalje zagrijava, mjehurići postaju sve veći i brojniji. Kako se veličina mjehurića povećava, tako se povećava i Arhimedova sila, gurajući ih iz vode i oni plutaju. U ovom trenutku se čuje buka, obično koja prethodi ključanju. Na određenoj temperaturi, kako se površina tečnosti približava, volumen mjehurića se naglo povećava. Na površini pucaju, a zasićena para u njima izlazi u atmosferu - voda ključa.
Uklonimo špiritus ispod tikvice. Šta posmatramo? (ključanje prestaje)
Za nastavak ključanja potrebno je opskrbiti energijom kipuću tekućinu.
slajd 9. Vrenje je intenzivan prelazak tečnosti u paru, koji se javlja formiranjem mjehurića pare po cijeloj zapremini tečnosti na određenoj temperaturi. (pisanje u svesku)
Temperatura na kojoj tečnost ključa naziva se tačka ključanja. (pisanje u svesku)
slajd 10. Tokom ključanja temperatura tečnosti se ne menja.
Različite tečnosti imaju različite tačke ključanja.
Slajd 11. Tačka ključanja zavisi od pritiska koji se vrši na slobodnu površinu tečnosti.
Demonstriram video sa iskustvom "Kupanje pod sniženim pritiskom"
Kako pritisak opada, temperatura ključanja tečnosti se smanjuje
(U planinskim predelima na velikim nadmorskim visinama, pri niskom atmosferskom pritisku, voda ključa na temperaturama nižim od 100 stepeni Celzijusa. Potrebno je duže čekati da se takva večera skuva.)
Kako pritisak raste, temperatura ključanja tečnosti se povećava
(Prilikom kuvanja pritisak unutar lonca - "preslona" - je oko 200 kPa, a supa u takvom loncu će se kuvati mnogo brže).
slajd 12. Specifična toplota isparavanja.
slajd 13. Specifična toplota isparavanja varira od supstance do supstance.
slajd 14. U kontaktu sa hladnim predmetom dolazi do kondenzacije vodene pare. U tom slučaju se oslobađa energija apsorbirana tokom stvaranja pare.
Demonstriram video sa iskustvom "Promatranje procesa kondenzacije".
Kondenzirajući, para daje količinu energije koja je ušla u njeno formiranje.
slajd 15. Proračun količine topline potrebne da se tekućina pretvori u paru.
- Faza primjene stečenog znanja.
(Nakon predstavljanja novog materijala, preporučljivo je izvršiti zadatke pojačanja)
slajd 16.
Rad s formulom za izračunavanje količine topline potrebne da se tekućina bilo koje mase pretvori u paru
Q = Lm.
odgovori:
slajd 17. Rad sa grafikonima.
Ishod . Danas smo se na lekciji upoznali sa fenomenom ključanja. Naučili smo objasniti proces ključanja na osnovu molekularno-kinetičke teorije. Razmotrili smo fizičke karakteristike ključanja i odredili metodu za proračun topline u proučavanom procesu.
- Zadaća
(Nastavnik beleži najaktivnije učenike, ocene)