Entropija entalpija unutrašnja energija u čemu je razlika. Unutrašnja energija i entalpija
OSNOVE HEMIJSKE TERMODINAMIKE
Osnovni pojmovi hemijske termodinamike. Sistem, stanje ravnoteže i termodinamički proces. Ekstenzivna i intenzivna svojstva. Funkcije stanja i procesne funkcije. Može li termodinamička veličina, koja je u opštem slučaju procesna funkcija, dobiti svojstva funkcije stanja? Ako da, navedite primjere.
Prvi zakon termodinamike. Unutrašnja energija. Toplota i rad kao oblici prijenosa energije. Međusobni odnos ovih vrijednosti u izohornim i izotermnim procesima.
Prvi zakon termodinamike, formulacije 1. zakona termodinamike. Unutrašnja energija sistema. Toplota i rad kao oblici prijenosa energije. Prvi zakon termodinamike primijenjen na izotermne i izohorične procese.
Nacrtajte šematski na jednom grafikonu u koordinatama parametara stanja R=f(V) procesi reverzibilne izotermne i reverzibilne izobarične ekspanzije idealnog dvoatomskog gasa iz istog početnog stanja do dvostrukog povećanja zapremine. Objasnite za koji od gore navedenih procesa rad proširenja je veći?
Adijabatski dijagram (debela linija) na dijagramu za gas. - pritisak gasa; - volumen.
U konkretnom slučaju, kada se rad vrši promjenom zapremine, on se može definirati na sljedeći način: neka plin bude zatvoren u cilindričnoj posudi čvrsto zatvorenoj klipom koji lako klizi, ako se plin širi, pomjeraće klip i, kada se krećete u segment, rade
gdje je F sila kojom plin djeluje na klip. Prepišimo jednačinu:
gdje je s površina klipa. Onda će posao biti
gdje je pritisak gasa, je mali prirast zapremine. Slično, može se vidjeti da jednačina vrijedi i za posude proizvoljnog oblika poprečnog presjeka
Izohorni i izobarični molarni toplotni kapaciteti. Komunikacija između njih za idealan gas. Ovisnost izobarnog toplinskog kapaciteta o temperaturi za tvari u kristalnom, tekućem i plinovitom stanju.
Prilikom zagrijavanja tekućine i čvrste materije njihov volumen se praktički ne mijenja, a rad ekspanzije se ispostavlja jednakim nuli. Dakle, cjelokupna količina topline koju primi tijelo ide na promjenu njegove unutrašnje energije. Za razliku od tečnosti i čvrstih materija, gas u procesu prenosa toplote može u velikoj meri da promeni svoju zapreminu i izvrši rad. Stoga, toplinski kapacitet plinovite tvari ovisi o prirodi termodinamičkog procesa. Obično se razmatraju dvije vrijednosti toplotnog kapaciteta plinova: C V – molarni toplotni kapacitet u izohornom procesu (V= const) i C str – molarni toplotni kapacitet u izobarnom procesu (str= const).
U procesu na konstantan volumen gas ne radi A= 0. Iz prvog zakona termodinamike za 1 mol plina slijedi
gdje je ∆ V- promjena volumena 1 mola idealnog plina kada se njegova temperatura promijeni za Δ T. Ovo implicira:
gdje R je univerzalna plinska konstanta. At str= konst
Dakle, relacija koja izražava odnos molarnih toplotnih kapaciteta C str i C V, ima oblik ( Mayerova formula ):
|
C str = C V + R. |
|
Tokom faznih prelaza(od jedne kristalne modifikacije u drugu, od čvrsto stanje u tečnost itd.) toplotni kapacitet se naglo menja, dok kod većine materija C V malo tečnije na tački topljenja C V kristalno (slika 1.7). |
|||
|
| |||
|
| |||
|
Rice. 1.7. Zavisnost toplotnog kapaciteta HCl temperatura T T F.P. - temperatura fazni prelaz; T PL. - temperatura topljenja; T KIP. - temperatura ključanja | |||
|
3. Toplotni kapacitet gasovitih i tečnih materija obično raste sa porastom temperature (slika 1.8). | |||
|
| |||
|
Obično se opisuje ovisnost toplinskog kapaciteta tvari o temperaturi u rasponu od 298 do T | |||
|
za organske supstance po empirijskoj jednadžbi: C P = a + in T + c T 2 (1.22) |
| ||
6. Unutrašnja energija i entalpija si, njihov odnos. Zavisnost unutrašnje energije i entalpije materije o temperaturi. Integracija odgovarajućih jednačina.
unutrašnja energija sistema naziva se zbir potencijalne energije interakcije svih čestica tijela jedna s drugom i kinetička energija njihova kretanja, tj. unutrašnja energija sistem se sastoji od energije translacije i rotaciono kretanje molekule, energija unutarmolekularnog vibracijskog kretanja atoma i atomskih grupa koje čine molekule, energija rotacije elektrona u atomima, energija sadržana u jezgri atoma, energija međumolekularne interakcije i druge vrste energije.
Apsolutna vrednost unutrašnje energije tela je nepoznata, ali za proučavanje hemijskih pojava važno je znati samo promenu unutrašnje energije pri prelasku sistema iz jednog stanja u drugo.U mnogim procesima energija se može delimično prenositi. u obliku topline i dijelom u obliku rada.
Dakle, toplota i rad karakterišu kvalitativno i kvantitativno dva različita oblika prenosa energije sa jednog tela na drugo; mjere se u istim jedinicama kao i energija.
Rad ili energija bilo koje vrste može se predstaviti kao proizvod dva faktora: faktor intenziteta pomnožen sa promjenom faktora kapacitivnosti, koji se također naziva faktor ekstenzivnosti (ako faktor intenziteta ostane konstantan tokom procesa). Tako je, na primjer, normalan rad (mehanički) jednak na proizvod primijenjene sile i prirasta putanje:
Ako se sistemu (supstanci ili skupu supstanci) dovede toplota Q, onda se ona, prema zakonu održanja energije, uglavnom troši na povećanje unutrašnje energije sistema U i na vršenje rada A, tj.
(1) gde je U promena unutrašnje energije sistema tokom prelaska iz početnog stanja U POČETAK u konačno stanje U CON.
![]() U hemijskim reakcijama rad se uglavnom karakteriše radom protiv spoljašnjeg pritiska. U prvoj aproksimaciji jednak je proizvodu promene pritiska i zapremine V sistema:
U hemijskim reakcijama rad se uglavnom karakteriše radom protiv spoljašnjeg pritiska. U prvoj aproksimaciji jednak je proizvodu promene pritiska i zapremine V sistema:
(2) gdje je V promjena volumena u procesu.
Sa izohoričnim procesom, A = 0, jer nema promene u zapremini sistema ( V=0), pa prelazak sistema, pretpostavimo iz stanja 1 u stanje 2, odgovara jednakosti:
(3) Prema tome, ako se reakcija odvija pri V=const, tada je oslobađanje i apsorpcija toplote Q V povezana sa promjenom unutrašnje energije U.
Za izobarični proces, V je razlika između zbira zapremina produkta reakcije i zbira zapremina polaznih supstanci (P=const).
![]() (4) Za izobarični proces, toplotni efekat Q P će biti jednak:
(4) Za izobarični proces, toplotni efekat Q P će biti jednak:
![]() (5)(6)
(5)(6)
Označiti, (8) - entalpija
Entalpija jednak je zbiru unutrašnje energije i proizvoda zapremine i pritiska.
Entalpija kao i unutrašnja energija, ona je opsežna funkcija stanja, ovisno o prirodi tvari, tlaku i temperaturi. U temperaturnom opsegu gde se fazno stanje sistema ne menja, entalpija je monotona funkcija glavnih parametara.
one. H je toplotni efekat reakcije Q p pri p=const.
Entalpija je funkcija stanja, tj. njegova promjena je određena zadatim početnim i konačnim stanjem sistema i ne zavisi od putanje tranzicije.
dim [H]=[kJ] ili [kJ/mol]
Dakle, kod izohorni proces termički efekat reakcije:
termalni efekat(toplina hemijska reakcija) je količina toplote (energije) koju sistem oslobađa ili apsorbuje tokom reakcije u uslovima konstantne zapremine ili pritiska, a dobijeni proizvodi imaju istu temperaturu kao izvorna supstanca.
unutrašnja energija idealnog gasa ne zavisi od zapremine i pritiska, već je samo funkcija temperature, pa na osnovu jednačine (2.7), nakon njene integracije dobijamo unutrašnju energiju na bilo kojoj temperaturi T:
U T = U o + With V (T – T o). (5.2) Entalpija idealnog gasa, kao i unutrašnja energija, takođe zavisi samo od temperature. Pošto je, po definiciji, H = U + pV, i za 1 mol gasa pV = RT i ( With R – With V)
=R, onda H = U o + With R (T – T o). (5.3) Izohorni i izobarični potencijali idealnog gasa pri konstantna temperatura određuju se integracijom jednačina (4.28) i (4.34). Za jedan mol idealnog gasa na T= konst dF =
– pdV =
– 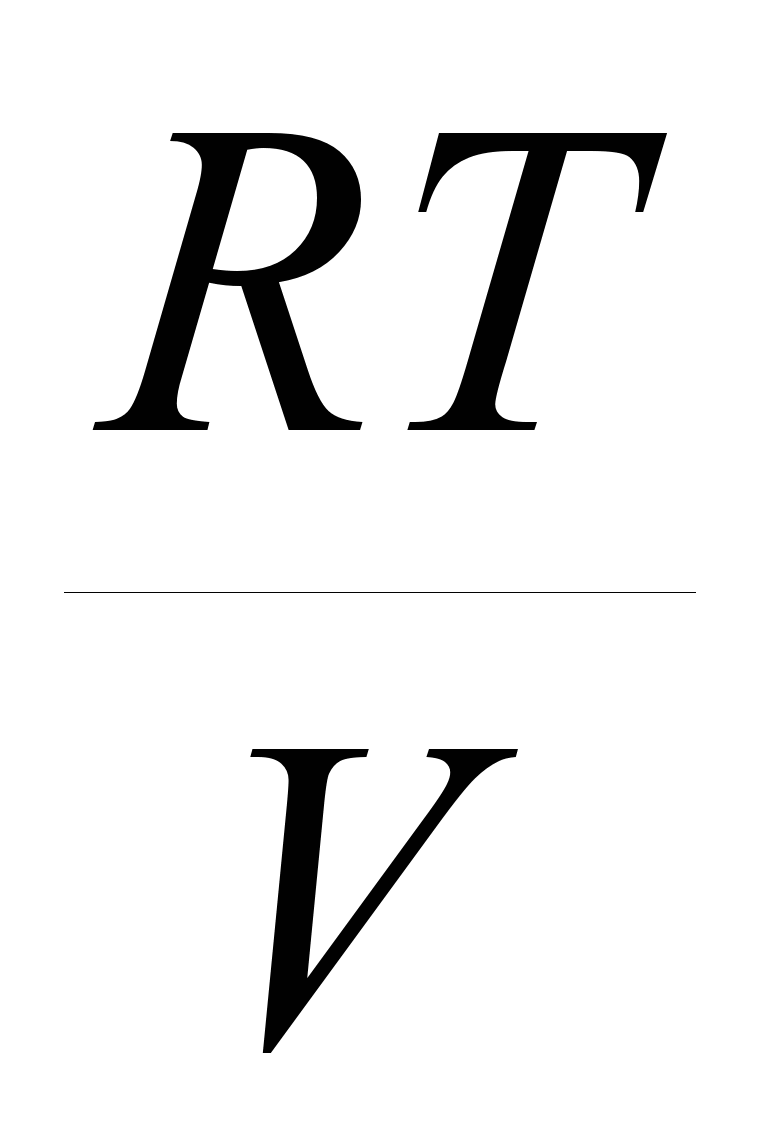 dV, (5.4) odakle nakon integracije dobijamo F = F(T)
– RT ln v.(5.5)
dV, (5.4) odakle nakon integracije dobijamo F = F(T)
– RT ln v.(5.5)
Termohemija. Hessov zakon i njegova termodinamička utemeljenost. Odnos toplotnih efekata hemijske reakcije pri konstantnom pritisku i konstantnoj zapremini.
Hesov zakon- osnovni zakon termohemije, koji je formulisan na sledeći način:
Toplotni učinak kemijske reakcije koja se izvodi u izobarično-izotermnim ili izohorno-izotermnim uvjetima ovisi samo o vrsti i stanju polaznih materijala i produkta reakcije i ne ovisi o putu njenog odvijanja..
Drugim riječima, količina topline koja se oslobađa ili apsorbira u bilo kojem procesu je uvijek ista, bez obzira da li se data hemijska transformacija odvija u jednoj ili više faza (pod uslovom da su temperatura, pritisak i agregatna stanja supstanci isti).

Na slici je shematski prikazan neki generalizovani hemijski proces transformacije polaznih supstanci A 1, A 2 ... u produkte reakcije B 1, B 2 ..., koji se može izvesti na različite načine na jedan, dva ili tri faze, od kojih je svaki praćen termičkim efektom ΔH i. Prema Hessovom zakonu, toplinski efekti svih ovih reakcija povezani su sljedećim odnosom.
TERMOHEMIJSKE JEDNAČINE
Hesov zakon
Svi kvalitativni proračuni su napravljeni u skladu sa Hesovim zakonom:
Promjena entalpije reakcije ovisi samo o fizičkom stanju i kemijskoj prirodi polaznih materijala i produkta reakcije i ne ovisi o međufazama reakcije. (1840)
Posljedice iz Hessovog zakona:
1) Toplotni efekat prednje reakcije jednak je po veličini i suprotan po predznaku od toplotnog efekta reverzne reakcije.
2) Toplotni efekat reakcije jednak je razlici između zbira entalpija nastanka reakcije proizvoda i polaznih materijala, pomnoženih sa stehiometrijskim koeficijentima.
3) Toplotni efekat reakcije jednak je razlici između zbira entalpija sagorevanja reakcije početnih supstanci i proizvoda, pomnoženih sa stehiometrijskim koeficijentima.
Termodinamički parametri
Termodinamički parametri su fizičke veličine, koji karakterišu stanje i procese u termodinamičkim sistemima.
Nazivaju se i termodinamičkim svojstvima. Dijele se na intenzivne (koje ne ovise o količini tvari) - to su temperatura, tlak, koncentracija i ekstenzivne (ovise o količini tvari) - to su masa, volumen, energija. Skup vrijednosti termodinamičkih svojstava karakterizira termodinamičko stanje sistemima.
Termodinamička svojstva se koriste za opisivanje termodinamičkih sistema i često se kvantitativno predstavljaju kao skup veličina.
Unutrašnja energija i entalpija
Entalpija je generalizirani parametar koji uzima u obzir promjene u energetskom sistemu zbog oslobađanja topline i obavljanja rada. Entalpija se još naziva i toplotnim sadržajem sistema, jer je promena entalpije pri konstantnom pritisku jednaka apsorbovanoj toploti. Ovo je opsežno svojstvo sistema.
Ako samo tečnosti i čvrste materije, tada je promjena entalpije reakcije približno jednaka promjeni unutrašnje energije. To je zbog činjenice da je promjena volumena praktički nula i ispada da se rad ekspanzije ne obavlja.
Ali ako se kao rezultat kemijske reakcije oslobađaju ili apsorbiraju plinovite tvari, tada se jednadžba koristi u potpunosti. U izotermnoj ekspanziji idealnog gasa unutrašnja energija je nula. U opštem slučaju, promena energije u sistemu nastaje u vezi sa razmenom između sistema i okruženje toplote ili rada.
Entropija i njena uloga u opisu procesa koji se odvijaju u izolovanim i zatvorenim sistemima
Entropija je kvantitativno termodinamičko svojstvo koje objašnjava slučajnost ili nered u sistemu; drugim riječima, nedostatak organizacije. Što je veći poremećaj, veća je vrijednost entropije i obrnuto. Entropija je proporcionalna vjerovatnoći sistema S=klnW, gdje je k Voltzmannova konstanta. Entropija univerzuma se stalno povećava. Prema drugom zakonu termodinamike u izolovani sistemi mogući su samo takvi procesi u kojima dolazi do povećanja entropije. Kada entropija dostigne maksimalni mogući nivo, dolazi do ravnoteže u sistemu. Entropija čistog, savršenog kristala na 0 K je nula (treći zakon termodinamike).
Ako sistem nije izolovan, onda je zbir promena entropija sistema i okoline tokom ireverzibilnih procesa uvek pozitivan. Ovaj zbir je jednak nuli samo u termodinamički reverzibilnim procesima.
U zatvorenim sistemima jedino je uz pomoć entropije nemoguće odrediti pravac i ravnotežu, koriste se generalizovani parametri: Helmholcova energija i Gibbsova energija.
Helmholcova energija se koristi u procesima u kojima su V i T konstantni. dA=dU-TdS
Gibbsova energija se koristi u procesima gdje su P i T konstantni. dG=dH-TdS 298K
Kvalitativno određivanje promjene entalpije i entropije
Promjena slobodna energija u sistemu, njegovu ulogu u opisivanju procesa koji se dešavaju u zatvoreni sistem
Vrijednost G karakteriše sposobnost sistema da obavlja koristan rad
Gibbsova energija se može koristiti za određivanje smjera procesa.
Ako je G<0, то процесс протекает самопроизвольно.
Ako je G=0, tada dolazi do ravnoteže.
HEMIJSKA RAVNOTEŽA
Faktori koji utiču na hemijsku ravnotežu
Na hemijsku ravnotežu sistema utiču koncentracija, pritisak (za gasovite materije), temperatura, kao i katalizatori.
Konstanta ravnoteže
Konstanta ravnoteže jednaka je omjeru čiji brojnik uključuje umnožak ravnotežnih koncentracija produkta reakcije, a nazivnik je umnožak koncentracija polaznih tvari, dok se sve vrijednosti koncentracije uzimaju u potencijama jednakim na stehiometrijske koeficijente u jednadžbi reakcije. Takođe, konstanta ravnoteže jednaka je omjeru konstanti brzine naprijed i obrnuto.
Promena hemijske ravnoteže
Položaj hemijske ravnoteže zavisi od sledećih parametara reakcije: temperature, pritiska i koncentracije. Uticaj koji ovi faktori imaju na hemijsku reakciju podložan je obrascu koji je generalno izrazio francuski naučnik Le Chatelier 1885. godine.
Faktori koji utiču na hemijsku ravnotežu:
1) temperatura
Kako temperatura raste, hemijska ravnoteža se pomera prema endotermnoj (apsorpcionoj) reakciji, a kako se smanjuje, prema egzotermnoj (izolovanoj) reakciji.
CaCO3=CaO+CO2 -Q t →, t↓ ←
N2+3H2↔2NH3 +Q t ←, t↓ →
2) pritisak
Kada se pritisak poveća, hemijska ravnoteža se pomera prema manjoj zapremini supstanci, a kada se smanji, prema većoj zapremini. Ovaj princip se odnosi samo na gasove, tj. ako su čvrste materije uključene u reakciju, one se ne uzimaju u obzir.
CaCO3=CaO+CO2 P ←, P↓ →
1mol=1mol+1mol
3) koncentracija polaznih supstanci i produkta reakcije
Sa povećanjem koncentracije jedne od polaznih supstanci, hemijska ravnoteža se pomera prema produktima reakcije, a sa povećanjem koncentracije produkta reakcije prema polaznim supstancama.
S2+2O2=2SO2 [S],[O] →, ←
Katalizatori ne utiču na promenu hemijske ravnoteže!
10. Princip LE - CHATELIER (razmotrimo primjer)
Ako je sistem u ravnoteži, onda kada se jedan od uslova (temp., konc., pritisak) promeni, ravnoteža se pomera u pravcu reakcije koja se suprotstavlja promeni. N2(g)+3H2(g)<->2NH3(g) +Q
Katalizatori
Katalizator je tvar koja mijenja brzinu kemijske reakcije, ali nije dio konačnih proizvoda. Katalizatori ne utiču na sastav ravnotežne reakcione smeše, ali ubrzavaju reakciju, što smanjuje vreme potrebno za postizanje hemijske ravnoteže. Postoje katalizatori (pozitivni katalizatori) i inhibitori (negativni katalizatori).
Homogena i heterogena kataliza
U homogenoj katalizi, reaktanti i katalizator formiraju jednofazni sistem - gas ili tečnost, ne postoji interfejs između katalizatora i reaktanata. Za homogenu katalizu, utvrđeno je da je brzina kemijske reakcije proporcionalna koncentraciji katalizatora.
U heterogenoj katalizi, reaktanti i katalizator formiraju sistem različitih faza. U ovom slučaju postoji interfejs između katalizatora i reaktanata. Katalizator je obično čvrsta materija, a reaktanti su gasovi ili tečnosti. Aktivnost čvrstog katalizatora zavisi od svojstava njegove površine (veličine, hemijskog sastava, strukture i stanja). Djelovanje pozitivnih katalizatora svodi se na smanjenje energije aktivacije reakcije, drugim riječima, na smanjenje visine energetske barijere. Ovo formira aktivirani kompleks sa nižim energetskim nivoom, a brzina reakcije se značajno povećava.
STRUKTURA ATOMA I PERIODIČNI ZAKON
Izotopi, izobare, tip jezgra?
Izotopi su prvi put otkriveni u eksperimentima JJ Thomsona 1912. godine, kada je promatrao skretanje nabijenih čestica u električnom i magnetskom polju. Izotopi su nazivani varijetetima atoma istog kemijskog elementa, koji imaju isti nuklearni naboj, ali različite masene brojeve. Elementi u prirodi sastoje se od mješavine izotopa, na primjer, prirodnog ugljika 12 6 C i 13 6 C. Ali masa atoma je vrlo mala, pa su relativne jedinice, koje se nazivaju jedinice atomske mase, 1/12 mase ugljika 12 .
Izobare su vrste atoma različitih hemijskih elemenata koji imaju isti maseni broj, ali različite atomske brojeve.
Osnovni tipovi:
Schrödingerova jednadžba
Za elektron koji se kreće u jednodimenzionalnom prostoru u polju sila potencijalne energije V ima sljedeći oblik:
-(h^2/8pi^2m)d^2horns/dx^2+Vhorns=Ehorns
U ovoj jednadžbi, m je masa elektrona, x je koordinata za elektron duž x ose, E je ukupna energija, a rogovi su valna funkcija. Drugi izvod valne funkcije u odnosu na x-koordinatu.
talasni brojevi
količina povezana sa talasnom dužinom λ relacijom: k= 2π/λ (broj talasa na dužini od 2π). U V. spektroskopiji, veličina recipročna talasnoj dužini (1/λ) se često naziva.
Paulijev princip
Svaka orbitala može sadržavati samo dva elektrona, a njihovi spinovi su suprotni. Atom ne može imati dva elektrona sa ista četiri kvantna broja.
Gundovo pravilo
Među nekoliko mogućih orbitala iste energije, najstabilnija konfiguracija je ona s najviše nesparenih elektrona.
kvantni brojevi
Glavni kvantni broj n određuje ukupnu energiju elektrona. Svaki broj odgovara energetskom nivou. n=1,2,3,4…ili K,L,M,N…
Orbitalni kvantni broj l određuje podnivoe na energetskom nivou. Kvantni broj l određuje oblik orbitala (n-1) 0,1,2…
Magnetski kvantni broj ml određuje broj orbitala u podnivou. …-2,-1,0,+1,+2… Ukupan broj orbitala u podnivou je 2l+1
Spin kvantni broj ms odnosi se na dvije različite orijentacije +1/2 -1/2 U svakoj orbitali mogu biti samo dva elektrona sa suprotnim spinovima.
Oksidacijska stanja elemenata
Oksidacijsko stanje (oksidacijski broj, formalni naboj) je pomoćna uvjetna vrijednost za evidentiranje procesa oksidacije, redukcije i redoks reakcija, numerička vrijednost električnog naboja koji se pripisuje atomu u molekuli pod pretpostavkom da su elektronski parovi koji nose veze su potpuno pomaknute prema više elektronegativnih atoma.
Ideje o stepenu oksidacije čine osnovu za klasifikaciju i nomenklaturu neorganskih jedinjenja.
Oksidacijsko stanje odgovara naboju jona ili formalnom naboju atoma u molekuli ili u hemijskoj formalnoj jedinici, na primjer:
Oksidacijsko stanje je naznačeno iznad simbola elementa. Za razliku od označavanja naboja atoma, kod označavanja stepena oksidacije prvo se stavlja znak, a zatim brojčana vrijednost, a ne obrnuto:
Stepen oksidacije,
Naplate.
Oksidacijsko stanje atoma u jednostavnoj tvari je nula, na primjer:
Algebarski zbir oksidacijskih stanja atoma u molekuli je uvijek nula:
Koncept stepena oksidacije je prilično primenljiv na nestehiometrijska jedinjenja (KS 8 , Mo 5 Si 3 , Nb 3 B 4 itd.). Na primjer, u dobro poznatoj reakciji prženja pirita:
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
najpogodnije je uzeti oksidaciono stanje gvožđa +3 u originalnom jedinjenju (iako u stvarnosti atom gvožđa istiskuje 2 elektrona iz sebe, odnosno oksidaciono stanje gvožđa je +2), a za sumpor je −3 /2 (!), što uopće nije u suprotnosti s definicijom oksidacijskog stanja, kao konvencionalne jedinice i omogućava vam da izjednačite reakciju jednostavno kao u slučaju drugih redoks procesa.
Ukupno stanje oksidacije atoma u molekulu je uvijek nula.
HEMIJSKA VEZA
Komunikacijski red
Red veze u teoriji molekularnih orbitala određen je izrazom
![]()
gdje su i ukupan broj elektrona u orbitalama vezivanja i labavljenja, respektivno.
Vrste hemijskih veza
Poznato je da se atomi mogu kombinovati jedni s drugima i formirati jednostavne i složene tvari. U tom slučaju nastaju različite vrste hemijskih veza: ionske, kovalentne (nepolarne i polarne), metalne i vodikove. Jedno od najbitnijih svojstava atoma elemenata, koje određuje kakva će se veza između njih formirati - jonska ili kovalentna, je elektronegativnost, tj. sposobnost atoma u spoju da privuče elektrone sebi.
Vrsta kemijske veze ovisi o tome koliko je velika razlika u vrijednostima elektronegativnosti spojnih atoma elemenata. Što se atomi elemenata koji formiraju vezu više razlikuju po elektronegativnosti, to je hemijska veza polarnija. Nemoguće je povući oštru granicu između tipova hemijskih veza. U većini jedinjenja, tip hemijske veze je srednji; na primjer, visoko polarna kovalentna hemijska veza je bliska ionskoj vezi. U zavisnosti od toga koji od graničnih slučajeva je po prirodi bliži hemijskoj vezi, ona se naziva ili jonska ili kovalentna polarna veza.
Elektronska hibridizacija
Hibridizacija orbitala je hipotetički proces miješanja različitih (s, p, d) orbitala centralnog atoma poliatomske molekule sa pojavom istog broja orbitala, koje su po svojim karakteristikama ekvivalentne. Vrste hibridizacije
[uredi] sp hibridizacija
sp hibridizacija
Javlja se pri miješanju jedne s- i jedne p-orbitale. Formiraju se dvije ekvivalentne sp-atomske orbitale, smještene linearno pod uglom od 180 stepeni i usmjerene u različitim smjerovima od jezgra atoma ugljika. Dvije preostale nehibridne p-orbitale nalaze se u međusobno okomitim ravninama i učestvuju u formiranju π-veza, ili su zauzete usamljenim parovima elektrona.
[uredi] sp 2 hibridizacija

sp 2 hibridizacija
Javlja se pri miješanju jedne s- i dvije p-orbitale. Formiraju se tri hibridne orbitale sa osama koje se nalaze u istoj ravni i usmjerene su na vrhove trougla pod uglom od 120 stepeni. Nehibridna p-atomska orbitala je okomita na ravan i po pravilu učestvuje u formiranju π-veza
[uredi] sp 3 hibridizacija
![]()
sp 3 hibridizacija
Javlja se pri miješanju jedne s- i tri p-orbitale, formirajući četiri sp3-hibridne orbitale jednakog oblika i energije. Oni mogu formirati četiri σ-veze s drugim atomima ili biti ispunjeni usamljenim parovima elektrona.
Osi sp3-hibridnih orbitala usmjerene su na vrhove pravilnog tetraedra. Tetraedarski ugao između njih je 109°28", što odgovara najnižoj energiji odbijanja elektrona. Sp3 orbitale također mogu formirati četiri σ-veze s drugim atomima ili biti ispunjene nepodijeljenim parovima elektrona.
Hibridizacija i molekularna geometrija
Ideje o hibridizaciji atomskih orbitala leže u osnovi Gillespie-Nyholmove teorije odbijanja elektronskih parova. Svaka vrsta hibridizacije odgovara strogo određenoj prostornoj orijentaciji hibridnih orbitala centralnog atoma, što joj omogućava da se koristi kao osnova stereohemijskih koncepata u neorganskoj hemiji.
U tabeli su prikazani primjeri korespondencije između najčešćih tipova hibridizacije i geometrijske strukture molekula, uz pretpostavku da sve hibridne orbitale sudjeluju u formiranju kemijskih veza (nema nepodijeljenih elektronskih parova).
| Vrsta hibridizacije | Broj hibridnih orbitala | Geometrija | Struktura | Primjeri |
| sp | Linearno | | BeF 2 , CO 2 , NO 2 + | |
| sp 2 | trouglasti |  | BF 3 , NO 3 – , CO 3 2– | |
| sp 3 | tetraedarski | 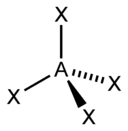 | CH 4, ClO 4 –, SO 4 2–, NH 4 + | |
| dsp2 | ravan kvadrat |  | Ni(CO) 4 , XeF 4 | |
| sp 3 d | Heksaedar | 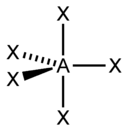 | PCl 5 , AsF 5 | |
| sp 3 d 2 | Octahedral | 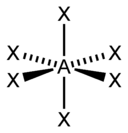 | SF 6 , Fe(CN) 6 3– , CoF 6 3– |
Sigma i pi veza
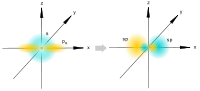
Sigma- i pi-veze (s- i p-veze), kovalentne hemijske veze, koje karakteriše određena, ali različita prostorna simetrija raspodele elektronske gustine. Kao što je poznato, kovalentna veza nastaje kao rezultat socijalizacije elektrona atoma u interakciji. Rezultirajući oblak elektrona s-veze je simetričan u odnosu na komunikacijsku liniju, odnosno liniju koja povezuje jezgre atoma u interakciji. Jednostavne veze u hemijskim jedinjenjima su obično (t-veze (vidi. Jednostavna veza). Oblak elektrona p-veze je simetričan u odnosu na ravninu koja prolazi kroz liniju veze (slika 1, b), iu ovoj ravni (koja se naziva čvorna ) gustoća elektrona jednaka je Upotreba grčkih slova s i p povezana je s njihovom korespondencijom s latinskim slovima s i p u označavanju elektrona atoma, uz čije sudjelovanje po prvi put postaje moguće da formiraju s- i p-veze, respektivno. p z) su simetrične u odnosu na odgovarajuće ose kartezijanskih koordinata (x, y, z), onda ako jedna p-orbitala, na primjer p z, učestvuje u formiranju s- (z-osa je komunikaciona linija), dve preostale p-orbitale (p x, p y) mogu učestvovati u formiranju dve p-veze (njihove čvorne ravni će biti yz i xz, respektivno; vidi sliku 2 ) d- (vidi sliku 1) i f također mogu učestvovati u formiranju s i p-veza -elektrona atoma. Ako između atoma u molekulu i s- i p-veza štucaju u isto vrijeme, tada je rezultirajuća veza višestruka (vidi Sl. višestruke veze, dvostruke veze, trostruke veze i valencija).  Rice. 1. Šematski prikaz prostorne orijentacije orbitala tokom formiranja s-veze kao rezultat s - s-, s - p s - , p s - p s -interakcija (a) i p-veza kao rezultat p p - , p p - , d p - d p - interakcije ( b). Rice. 1. Šematski prikaz prostorne orijentacije orbitala tokom formiranja s-veze kao rezultat s - s-, s - p s - , p s - p s -interakcija (a) i p-veza kao rezultat p p - , p p - , d p - d p - interakcije ( b). 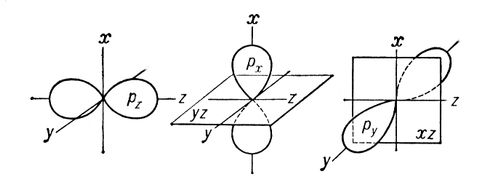 Rice. 2. Šematski prikaz oblaka p x -, p y -, p z - elektrona. Prikazane su ose kartezijanskih koordinata i nodalne ravni p x - i p y -orbitale. Rice. 2. Šematski prikaz oblaka p x -, p y -, p z - elektrona. Prikazane su ose kartezijanskih koordinata i nodalne ravni p x - i p y -orbitale. |
Dipolni moment
Jednostruka i višestruka veza
Relacije σ i π. Jednostruke i višestruke veze
Dva atoma također mogu formirati višestruke veze međusobno, odnosno dvostruke i trostruke veze. U ovom slučaju, komponenta koja se prva formira uvijek će biti σ-veza (ima najveću snagu i određuje geometrijski oblik molekule).
Druga i treća komponenta se nazivaju π-veze, formiraju se bočnim preklapanjem bilo koje orbitale, osim s-orbitale: 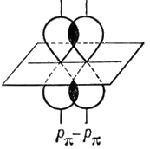

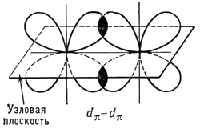
Na primjer, 2 str-orbitale dva atoma ugljika mogu se formirati između sebe jednokrevetna, dvokrevetna i trostruko veze. U prvom slučaju formira se kostur molekula etan C2H6.
At duplo prvo vezuju atome ugljika 2 str-orbitale stvaraju σ-vezu, a druga - π-vezu; u ovom slučaju se formira kostur molekula etilen C2H4.
At trostruko vezivanjem (jedna σ-veza, dvije π-veze) formira se okosnica molekule acetilen C2H2.
Takve višestruke veze su uvijek kraće i jače od pojedinačnih veza i teže ih je prekinuti. Često to objašnjava hemijska inertnost supstance - kao što su azot N 2 (:N≡N:) i ugljen dioksid CO 2 (O=C=O).
Primjeri čestica sa višestruki veze su i molekuli SO 3, SO 2, NO 2 i anjoni CO 3 2−, SO 4 2−, SO 3 2−
Jonska veza i njena svojstva
Nastaje potpunim prijenosom jednog ili više elektrona između atoma. Atom koji donira elektron(e) postaje kation, dok atom koji ga prima postaje anion. Jonski nastaje kao rezultat elektrostatičkih sila privlačenja između suprotno nabijenih jona. Jonska veza je karakteristična za spojeve i elemente čiji atomi imaju veliku razliku u vrijednostima elektronegativnosti, javlja se između atoma alkalnih metala (elektropozitivni elementi) i halogena (elektronegativni elementi). NEKRETNINE
Struktura jonskih jedinjenja
Struktura idealnog ionskog spoja, zbog maksimalnog privlačenja između različitih iona i minimalnog odbijanja sličnih jona, u velikoj mjeri je određena omjerom ionskog zračenja kationa i aniona. To se može pokazati jednostavnim geometrijskim konstrukcijama.
51. Donator-akceptor veza. Njegova svojstva, navedite primjere
Mehanizam donor-akceptor (inače mehanizam koordinacije) je metoda za formiranje kovalentne hemijske veze između dva atoma ili grupe atoma, koja se izvodi zahvaljujući usamljenom paru elektrona, atomu donora i slobodne orbitale akceptorski atom.
Izrazi "donor-akceptorska veza" ili "koordinirajuća veza" su netačni, jer ovo nije vrsta hemijske veze, već samo teorijski model koji opisuje posebnost njenog nastanka. Osobine kovalentne hemijske veze nastale mehanizmom donor-akceptor se ni na koji način ne razlikuju od svojstava veza formiranih mehanizmom razmene (na primer, NH veze u amonijum jonu NH 4 + ili O-H veze u jonu hidroksonija H 3 O +).

Formiranje adukta amonijaka i bor trifluorida
Donori su obično atomi dušika, kisika, fosfora, sumpora, itd., koji imaju nepodijeljene elektronske parove u malim valentnim orbitalama. Ulogu akceptora mogu obavljati jonizovani atom vodika H+, neki p-metali (npr. aluminijum u stvaranju AlH4- jona) i, posebno, d-elementi koji imaju neispunjene energetske ćelije u sloj valentnog elektrona.
Sa stanovišta mehanizma donor-akceptor opisano je stvaranje lokaliziranih kovalentnih veza u molekulama i molekularnim ionima kompleksnih (koordinacijskih) spojeva: veza nastaje zbog usamljenog para elektrona liganda i slobodne orbitale. kompleksirajućeg atoma. Mehanizam donor-akceptor također opisuje formiranje međuprodukta reakcije, kao što su kompleksi za prijenos naboja.
Model mehanizma donor-akceptor postoji samo u okviru koncepta valencije kao lokalizacije elektronske gustine pri formiranju kovalentnih veza (metoda valentnih šema). U okviru molekularne orbitalne metode, nema potrebe za takvim prikazima.
Vodikova veza
Ovo je vrsta intermolekularnih interakcija. Ove veze su slabe trajne sile između H atoma kovalentno vezanog za vrlo elektronegativni A atom i elektronegativnog B atoma sposobnog da obezbijedi slobodan par elektrona za formiranje veze. Vodikova veza je predstavljena sa tri tačke. -A-N ... B-
Vodikove veze nastaju samo s atomima najelektronegativnijih elemenata. Najvažniji od njih su F, O, N, Cl. DODATNO
53. Intermolekularne sile interakcije, njihova svojstva (van der Waalsove sile)
Van der Waalsove sile uključuju nekoliko tipova interakcija: orijentacijski dipol-dipol, indukciju i disperziju.
1) Ako su dvije molekule iste tvari ili različite tvari trajni dipoli, onda se međusobno privlače suprotno nabijenim rubovima i prema tome su orijentirani u prostoru. FORMULA (str. 172).
2) Induktivna interakcija je da polarni molekul uzrokuje polarizaciju (inducira dipol) susjednog nepolarnog molekula. Nadalje, oni su orijentirani relativno jedan prema drugom u prostoru. Konačni rezultat je interakcija: dipol - inducirani dipol. FORMULA (str. 172).
3) Interakcije disperzije su slabe privlačne sile između neutralnih atoma, kao što su atomi plemenitog plina, ili molekula, uključujući nepolarne molekule. FORMULA (str. 173).
SOLUTIONS
Šta je rešenje
Rešenja su termodinamički stabilni homogeni sistemi promenljivog sastava koji sadrže dve ili više komponenti. Supstanca čija je koncentracija veća od svih drugih supstanci naziva se rastvaračem, a druge supstance otopljene. Fazno stanje rastvarača u rastvoru se ne menja, na primer, voda ostaje tečna u rastvoru. Rastvori su tečni, čvrsti i gasoviti.
Voda
Voda je jedan od najčešćih rastvarača na Zemlji. Molekul vode ima ugaonu strukturu: (105 stepeni). Hemijska veza O-H je kovalentna, ali zajednički elektronski par je privučen atomu O. Pozitivni naboj se pojavljuje na svakom atomu H, a negativni naboj na O. Ova parcijalna naelektrisanja stvaraju polaritet molekula, što vodi kao rastvaraču daje njena posebna svojstva. Čista voda ima nisku koncentraciju O i OH i loš je provodnik električne energije. Intermolekularne vodonične veze imaju značajan uticaj na svojstva vode. Molekuli vode vezani vodoničnim vezama formiraju otvorenu prostornu mrežu. Voda može biti u tri agregatna stanja: tečno, čvrsto (led) ili gasovito (para). Isparavanje vode i sublimacija leda se dešavaju na bilo kojoj temperaturi.
Asocijacija molekula vode
Molekuli vode, koji su trajni dipoli, mogu, zbog međusobnog
privlačenje suprotno nabijenih polova može se kombinirati u dva, tri, itd.
Međutim, privlačne sile koje djeluju u ovom slučaju su male, au slučaju vode slične
dipolna asocijacija igra samo sporednu ulogu.
Od primarnog značaja za asocijaciju molekula vode je formiranje
koje se nazivaju vodoničnim vezama. Potonji nastaju zbog privlačenja vodonika
jedna molekula vode u kisik drugu prema sljedećoj shemi:
H
?
O-N O-N
.
.
H
Mogućnost takve privlačnosti je u skladu s pretpostavkom da postoje značajne
efektivni naboji za vodonik (?H = ?0,33) i kiseonik (?O = ?0,66) u molekulu
vode.
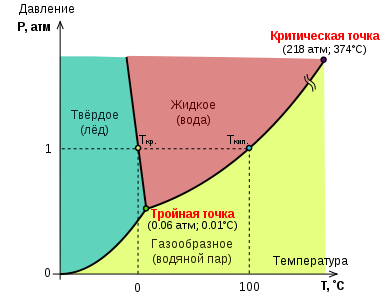
Dijagram statusa vode
Otopine neelektrolita
Neelektroliti su tvari čije vodene otopine i taline ne provode električnu struju, jer se njihovi molekuli ne disociraju na ione.
65. Raoultov prvi i drugi zakon!
Raoultov prvi zakon povezuje pritisak pare zasićenja nad rastvorom sa njegovim sastavom; formuliran je na sljedeći način:
Parcijalni pritisak zasićene pare komponente rastvora je direktno proporcionalan njenom molskom udjelu u rastvoru, a koeficijent proporcionalnosti jednak je pritisku zasićene pare nad čistom komponentom.
Knjiga 2 odjeljak 1.6
Otopine elektrolita
Budući da se jaki elektroliti u vodenim otopinama gotovo potpuno raspadaju na ione, koncentracija iona može biti visoka. U koncentriranim otopinama jakih elektrolita, joni se toliko približavaju da interakcija između njih postaje vrlo značajna. Zbog međujonske interakcije smanjuje se pokretljivost jona, a uz učešće iona u hemijskim reakcijama stvara se efekat smanjenja koncentracije. Dakle, joni ulaze u hemijske reakcije ne u skladu sa svojom pravom koncentracijom, već u skladu sa svojom prividnom koncentracijom - aktivnošću. Postoji veza između aktivnosti i koncentracije jona u otopini: ai=yi*ci .
Izotonični odnos
Omogućava vam da uzmete u obzir utjecaj neidealnih rješenja na njihova fizička svojstva. Molekuli otopljenih supstanci mogu disocirati, što je tipično za otopine elektrolita, ali uz disocijaciju može doći i do asocijacije molekula. Da bi se uzela u obzir promjena broja čestica u otopini zbog procesa njihove disocijacije i asocijacije, koristi se izotonični koeficijent i.
Izotonični koeficijent izražava omjer broja čestica otopljene tvari i broja njenih čestica u početnom stanju. Za otopine neelektrolita, izotonični koeficijent je 1, proces disocijacije je i.k. veći od 1, asocijacija manja od 1. Eksperimentalno određivanje izotoničnog koeficijenta omogućava da se izračuna stepen disocijacije ili asocijacije otopljene supstance.
Amfoterni hidroksidi
Amfoterni hidroksidi su hemikalije koje se ponašaju kao baze u kiseloj sredini i kao kiseline u alkalnoj sredini.
U svakom periodu, elementi sa svojstvima metala se zamjenjuju elementima koji pokazuju svojstva i metala i nemetala. Spojevi ovih elemenata nazivaju se amfoternim. Element aluminijum ispoljava svojstva metala i nemetala u jedinjenjima. Slična svojstva imaju elementi A-grupa - Be, Ga, Ge, Sn, Pb, Sb, Bi i drugi, kao i većina elemenata B-grupa - Cr, Mn, Fe, Zn, Cd i drugi. Gotovo svi su nerastvorljivi u vodi i slabi su elektroliti.
Kada se zagriju, spojevi se raspadaju. U većini slučajeva, interakcija metalnog hidroksida proizvodi hidroksilnu sol odgovarajuće kiseline: na primjer, ovako se odvija interakcija za Al(3+), Cr(3+), Zn(2+) i mnoge druge metale. Ova reakcija je reverzibilna, položaj ravnoteže zavisi od prirode pH vrednosti metala medija i delimično od temperature. Ioni sa nižim koordinacionim brojem metala takođe mogu postojati u rastvoru.
Jonska aktivnost
Aktivnost (jona) - efektivna koncentracija, uzimajući u obzir elektrostatičku interakciju između jona u rastvoru. Aktivnost se za određenu količinu razlikuje od koncentracije. Omjer aktivnosti (a) i koncentracije tvari u otopini (c, u g-ionu / l) naziva se koeficijent aktivnosti: γ \u003d a / c.
Faktor aktivnosti
Koeficijent aktivnosti je omjer aktivnosti date komponente otopine i njene koncentracije, koji karakterizira odstupanje svojstava stvarnih rješenja od svojstava idealnih rješenja. U idealnim rješenjima i pri beskonačnom razrjeđenju K. i. je jednako jedan. Približne vrijednosti K. a. izračunato po Debye-Hückelovoj jednadžbi.
Disocijacija vode
Disocijacija vode je razgradnja vode na njene sastavne hemijske elemente, koja se ponekad dešava sa stvaranjem novih elemenata koji u početku nisu sadržani u rastvoru raspadanja, ili su sadržani pre početka raspadanja u manjoj količini nego nakon završetka raspadanja. proces disocijacije.
Disocijacija vode je endotermna reakcija (vidi endotermna reakcija), tj. ide sa apsorpcijom toplote iz okoline.
Poznati načini odvajanja vode:
1. Elektroliza vodenih otopina elektrolita. - najmanje efikasna metoda razgradnje vode danas poznata, jer se u ovom slučaju energija troši uglavnom na zagrijavanje vodiča - elektrolita, toliko da se raspršena otopina ne samo da se ne hladi, već je, naprotiv, podvrgnuta značajnom grijanje. U industriji 20. vijeka upravo je ova metoda bila najšire korištena, zbog činjenice da obezbjeđuje potražnju i omogućava održavanje visokih cijena za robu kao što su neobnovljivi izvori energije iz kojih se dobija električna energija, poput nafte, gas, ugalj itd.
2. Model procesa raspadanja vode u centrifugalnom polju Na primjer, zagrijani elektrolit se sipa u rotirajući bubanj, u kojem se tokom rotacije, kao rezultat započetog elektrohemijskog procesa, voda razlaže na vodonik i kiseonik. Ovaj proces razgrađuje vodu koristeći kinetičku energiju vanjskog izvora i toplinsku energiju zagrijanog elektrolita. Na osnovu ovog procesa postoji niz patenata, od kojih su jedan (RU 98/00190 (06/22/1998)) autori - Kudymov G.I. i Studennikov V.V. pozicionirani su, između ostalog, kao toplotna pumpa koja apsorbuje toplotu okoline, pa se ovde vrši proizvodnja mešavine vodika i kiseonika, u velikoj meri zbog energije okoline ili usled obično nepovratno izgubljena toplota, na primer, izduvni gasovi motora sa unutrašnjim sagorevanjem.
Jonski proizvod vode
Ravnotežna vrijednost proizvoda koncentracije vodenih jona naziva se ionski proizvod vode. Označen je Kv i jednak je 10 -14 Kv \u003d (H +) (OH -)
Indeks vodika (pH)
pH je negativni decimalni logaritam ravnotežne koncentracije vodikovih jona. pH vrijednost se može koristiti za određivanje medija otopine. pH vrijednost se određuje pomoću posebnog uređaja - pH metra, kao i pomoću indikatora. Takođe, pH se može odrediti kroz ravnotežnu koncentraciju hidroksidnih jona pH=14-pOH.
Proizvod rastvorljivosti
U zasićenom rastvoru slabo rastvorljivog jonskog jedinjenja, proizvod koncentracije njegovih jona na datoj temperaturi je konstantna vrednost i naziva se proizvod rastvorljivosti. PR se odnosi samo na slabo rastvorljive jake elektrolite, što znači da se u rastvoru moraju potpuno razgraditi na jone i ne bi trebalo da učestvuju u sekundarnim reakcijama.
Ako hemijska formula spoja uključuje stehiometrijske koeficijente koji nisu jedinica, tada se koncentracije jona uzimaju u snagama jednakim njihovim stehiometrijskim koeficijentima.
Tri slučaja hidrolize
Postoje tri opcije za hidrolizu:
1) Kationska hidroliza je hidroliza soli koja sadrži slab bazni kation i jak kiseli anion.
2) Anion hidroliza je hidroliza soli koja sadrži jak bazni kation i anion slabe kiseline.
3) Hidroliza katjonom i anjonom je hidroliza soli koja sadrži kation slabe baze i anjon slabe kiseline.
puferske otopine
Unutrašnja energija supstance (ili sistema) je ukupna energija čestica koje čine ovu supstancu (vidi takođe § 54). Sastoji se od kinetičke i potencijalne energije čestica. Kinetička energija je energija translacionog, vibracionog i rotacionog kretanja čestica; potencijalna energija je posljedica sila privlačenja i odbijanja koje djeluju između čestica.
Unutrašnja energija zavisi od stanja materije. Može se odrediti promjena unutrašnje energije sistema AU u određenom procesu. Neka, kao rezultat nekog procesa, sistem prelazi iz početnog stanja 1 u konačno stanje 2, dok obavlja rad A i apsorbuje toplotu iz spoljašnje sredine.
Jasno je da će se unutrašnja energija sistema smanjiti za A, povećati za Q i u konačnom stanju biti jednaka
gdje je i unutrašnja energija sistema u početnom (1) i konačnom (2) stanju. Ako razliku označimo sa , tada se jednačina može predstaviti kao:
![]()
Ova jednačina izražava zakon održanja energije, prema kojem promjena unutrašnje energije ne zavisi od načina na koji se proces odvija, već je određena samo početnim i konačnim stanjem sistema. Međutim, koji će dio energije otići na rad, a koji će se pretvoriti u toplinu - ovisi o načinu na koji se proces odvija: omjer rada i topline može biti različit. Konkretno, ako se tokom procesa ne obavlja nikakav rad, uključujući rad ekspanzije protiv vanjskog pritiska, tj. ako se volumen sistema ne mijenja, tada
gde je toplota koju sistem apsorbuje u uslovima konstantne zapremine.
Posljednja jednačina omogućava određivanje promjene unutrašnje energije u različitim procesima. Na primjer, u slučaju zagrijavanja tvari pri konstantnom volumenu, promjena unutrašnje energije određena je toplinskim kapacitetom ove tvari:
Ovdje je molarni toplinski kapacitet tvari pri konstantnoj zapremini; n je količina supstance; je razlika između konačne i početne temperature.
U slučaju da se hemijska reakcija odvija bez promene zapremine sistema, promena unutrašnje energije jednaka je toplotnom efektu ove reakcije, uzetom sa suprotnim predznakom.
gdje je n količina supstance; Cp je molarni toplotni kapacitet supstance pri konstantnom pritisku.
Sa promjenama agregacijskog stanja tvari i s alotropskim prijelazima, promjena entalpije jednaka je veličini, ali suprotnog predznaka, toplini odgovarajuće transformacije (topljenje, ključanje, transformacija iz jedne modifikacije u drugu). Konačno, u slučaju kemijske reakcije, promjena entalpije jednaka je toplotnom efektu reakcije izvedene pri konstantnoj temperaturi i konstantnom pritisku, uzetim sa suprotnim predznakom.
Entalpija, kao i unutrašnja energija, karakterizira energetsko stanje tvari, ali uključuje energiju utrošenu na prevladavanje vanjskog pritiska, tj. rad ekspanzije. Kao i unutrašnja energija, entalpija je određena stanjem sistema i ne zavisi od toga kako se to stanje postiže. U slučaju gasova, razlika između i tokom datog procesa može biti značajna. U slučaju sistema koji ne sadrže gasove, promene unutrašnje energije i entalpije koje prate proces su bliske jedna drugoj. Ovo se objašnjava činjenicom da su promjene volumena tokom procesa kojima su tvari izložene u kondenziranom (tj. u čvrstom ili tekućem) stanju obično vrlo male, a vrijednost je mala u odnosu na .

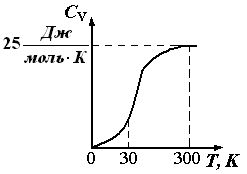 Rice. 1.6. Ovisnost toplinskog kapaciteta kristalnih tvari o temperaturi
Rice. 1.6. Ovisnost toplinskog kapaciteta kristalnih tvari o temperaturi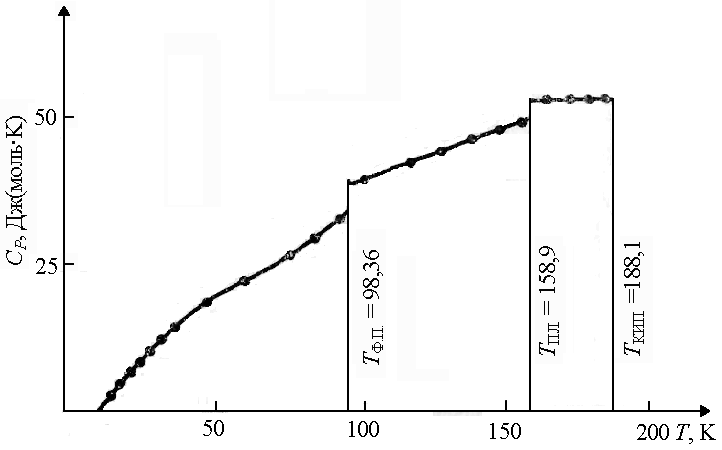
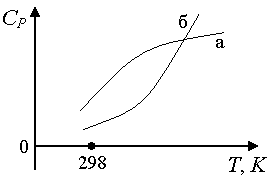 Rice. 1.8. Zavisnost toplotnog kapaciteta gasova o temperaturi: a) ako je kriva niska ^
T ima veću zakrivljenost nego kod visokih, poželjno je opisati ga empirijskim nizom snaga u obliku: C P
= a + inT + c'/T 2; b) kriva b niz snaga oblika: C P = a + inT + cT 2
Rice. 1.8. Zavisnost toplotnog kapaciteta gasova o temperaturi: a) ako je kriva niska ^
T ima veću zakrivljenost nego kod visokih, poželjno je opisati ga empirijskim nizom snaga u obliku: C P
= a + inT + c'/T 2; b) kriva b niz snaga oblika: C P = a + inT + cT 2