Vodena para i njene vrste. Vodena para je gasovito stanje vode
3. Vodena para i njena svojstva
3.1. vodena para. Osnovni pojmovi i definicije.
Jedan od najčešćih radnih fluida u parnim turbinama, parnim mašinama, nuklearnim elektranama, rashladna tečnost u raznim izmenjivačima toplote je vodena para. Steam - gasovito tijelo u stanju bliskom tečnosti koja ključa. isparavanje Proces promjene tvari iz tekućeg stanja u stanje pare. Isparavanje - isparavanje, koje se uvijek javlja pri bilo kojoj temperaturi sa površine tečnosti. Na određenoj temperaturi, u zavisnosti od prirode tečnosti i pritiska pod kojim se nalazi, počinje isparavanje u celoj masi tečnosti. Ovaj proces se zove ključanje . Obrnuti proces isparavanja se naziva kondenzacije . Takođe radi na konstantnoj temperaturi. Proces tranzicije solidan direktno u paru tzv sublimacija . Obrnuti proces prelaska pare u čvrsto stanje naziva se desublimacija . Kada tečnost isparava u ograničenom prostoru (kod parnih kotlova), istovremeno se javlja suprotna pojava - kondenzacija pare. Ako brzina kondenzacije postane jednaka brzini isparavanja, tada nastupa dinamička ravnoteža. Para u ovom slučaju ima maksimalnu gustinu i naziva se zasićena para . Ako je temperatura pare viša od temperature zasićena para isti pritisak, onda se takva para naziva pregrejano . Razlika između temperature pregrijane pare i temperature zasićene pare pri istom tlaku naziva se stepen pregrijavanja . Pošto je specifična zapremina pregrijane pare veća od specifične zapremine zasićene pare, gustina pregrijane pare je manja od gustine zasićene pare. Dakle, pregrijana para je nezasićena para . U trenutku isparavanja poslednje kapi tečnosti u ograničenom prostoru, bez promene temperature i pritiska, a suva zasićena para . Stanje takve pare određuje jedan parametar - pritisak. Mehanička mješavina suvih i sitnih kapljica tekućine naziva se mokra para . Maseni udio suve pare u mokra para pozvao stepen suvoće –X.
X\u003d m cn / m ch,
m cn - masa suve pare u mokroj; m vp - masa vlažne pare. Maseni udio tečnosti u vlažnoj pari naziva se stepen vlažnosti –at.
at= 1 – .
Za tečnost koja ključa na temperaturi zasićenja = 0, za suhu paru – = 1.
3.2 Vlažan vazduh. Apsolutna i relativna vlažnost.
Atmosferski vazduh se široko koristi u tehnici: kao radni fluid (u vazdušnim rashladnim uređajima, klima uređajima, izmenjivačima toplote i sušačima) i kao sastavni deo za sagorevanje goriva (u motorima sa unutrašnjim sagorevanjem, gasnoturbinskim postrojenjima, parogeneratorima).
Suh vazduh zove se vazduh koji ne sadrži vodenu paru. Atmosferski vazduh uvek sadrži malo vodene pare.
vlažan vazduh je mešavina suvog vazduha i vodene pare.
U toplotnoj tehnici, neka gasovita tela se nazivaju para. Tako se, na primjer, voda u plinovitom stanju naziva vodena para, amonijak - amonijačna para.
Razmotrimo detaljnije termodinamička svojstva vode i pare. (1-6).
Do formiranja pare iz istoimene tečnosti dolazi isparavanje i ključanje . Postoji fundamentalna razlika između ovih procesa. Isparavanje tečnosti se dešava samo sa otvorene površine. Pojedinačni molekuli velikom brzinom savladavaju privlačenje susjednih molekula i lete u okolni prostor. Brzina isparavanja raste sa temperaturom tečnosti. Suština ključanja je da se stvaranje pare događa uglavnom u zapremini same tečnosti zbog njenog isparavanja unutar mjehurića pare. Postoje sljedeća stanja vodene pare:
mokra para;
suha zasićena para;
pregrijana para.
Atmosferski vazduh (vlažan vazduh) može biti:
prezasićeni vlažan vazduh;
zasićen vlažan vazduh;
nezasićeni vlažni vazduh.
prezasićeno Vlažan vazduh je mešavina suvog vazduha i vlažne vodene pare. Prirodni fenomen je magla. Zasićen Vlažan vazduh je mešavina suvog vazduha i suve zasićene vodene pare. nezasićeni Vlažan vazduh je mešavina suvog vazduha i pregrejane vodene pare.
Treba napomenuti fundamentalno različita značenja pojma "mokro" u odnosu na paru i zrak. Para se naziva vlažnom ako sadrži fino raspršenu tečnost. Vlažan zrak u svim slučajevima od interesa za tehnologiju sadrži pregrijanu ili suhu zasićenu vodenu paru. U opštem slučaju, vlažan vazduh može sadržati i vlažnu vodenu paru (na primer, oblaci), ali ovaj slučaj nije od tehničkog interesa i ne razmatra se dalje.
U atmosferskom (vlažnom) vazduhu, svaka komponenta je pod svojim parcijalnim pritiskom, ima temperaturu jednaku temperaturi vlažnog vazduha i ravnomerno je raspoređena po zapremini.
Termodinamička svojstva vlažnog zraka kao plinovite mješavine suhog zraka i vodene pare određuju se prema zakonima karakterističnim za idealne plinove.
Proračun procesa sa vlažnim vazduhom obično se vrši pod uslovom da se količina suvog vazduha u smeši ne menja. Varijabla je količina vodene pare sadržana u smjesi. Stoga se specifične vrijednosti koje karakteriziraju vlažni zrak odnose na 1 kg suhog zraka.
Pritisak vlažnog vazduha određen je Daltonovim zakonom:
R=Rv+Rp, (3.1)
Gdje Rv - parcijalni pritisak suvi vazduh, kPa; Pp je parcijalni pritisak vodene pare, kPa.
Napišimo Clapeyron – Mendeljejevsku jednačinu
mokro zrak PV=MRT; (3.2)
suho vazduh P B V=M B R B T; (3.3)
vode para P P V=M P R P T, (3.4)
gdje je V zapremina vlažnog zraka, m 3; M, M V, M P - masa vlažnog, suvog vazduha i vodene pare, respektivno, kg; R, R V, R P – gasna konstanta vlažnog, suvog vazduha i vodene pare, respektivno, kJ/(kgK); T - apsolutna temperatura vlažan vazduh, K.
Apsolutna vlažnost vazduha - količina vodene pare sadržana u 1 m 3 vlažnog zraka. Označava se sa P i mjeri se u kg / m 3 ili g / m 3. Drugim riječima, predstavlja gustinu vodene pare u zraku: P \u003d R P / (R P T). Očigledno je da
P \u003d M P / V, gdje je V volumen vlažnog zraka mase M.
Relativna vlažnost je odnos apsolutne vlažnosti vazduha u datom stanju prema apsolutna vlažnost zasićeni vazduh (H) na istoj temperaturi.
Dva karakteristična stanja vazduha mogu se uočiti u smislu vrednosti :<100 %, при этом Р П <Р Н и водяной пар перегретый, а влажный воздух ненасыщенный;=100 %, при этом Р П =Р Н и водяной пар сухой насыщенный, а влажный воздух насыщенный. Температура, до которой необходимо охлаждать ненасыщенный влажный воздух, чтобы содержащийся в нем перегретый пар стал сухим насыщенным, называется температурой точки росы t Н.
3.3 id - dijagram vlažnog vazduha
Po prvi put id - grafikon za vlažan vazduh predložio je prof. UREDU. Ramzin. Trenutno se koristi u proračunima sistema klimatizacije, sušenja, ventilacije i grijanja. Vid - dijagram duž apscise prikazuje sadržaj vlage d, g / kg suhog zraka, a duž ordinate - specifičnu entalpiju vlažnog zraka i, kJ / kg suhog zraka. Za pogodniji raspored pojedinačnih linija nacrtanih na id - dijagramu, ugrađen je u kosim koordinatama, u kojima je osa apscisa nacrtana pod kutom od 135 ° u odnosu na y-osu.
Sa ovakvim rasporedom koordinatnih osa, prave i=const, koje treba da budu paralelne sa x-osom, idu koso. Radi praktičnosti proračuna, vrijednosti d se spuštaju na horizontalnu koordinatnu os.
Prave d=const su u obliku pravih linija paralelnih sa y-osom, tj. vertikalno. Osim toga, izoterme t C =const, t M =const (isprekidane linije na dijagramu) su iscrtane na id.-dijagramu u liniji konstantnih vrijednosti relativne vlažnosti (počevši od .=5% do =100 %). Linije konstantnih vrednosti relativne vlažnosti =const grade se samo do izoterme 100°, odnosno sve dok parcijalni pritisak pare u vazduhu P P ne bude manji od atmosferskog pritiska P. U trenutku kada P P postane jednak P, ove linije gube fizičko značenje, što se vidi iz jednačine (10), u kojoj je, pri P P = P, sadržaj vlage d=const.
Kriva konstantne relativne vlažnosti =100% dijeli cijeli dijagram na dva dijela. Taj njen dio koji se nalazi iznad ove linije je područje nezasićenog vlažnog zraka u kojem je para u pregrijanom stanju. Dio dijagrama ispod linije =100% je površina zasićenog vlažnog zraka.
Pošto su pri =100% očitanja suhih i mokrih termometara ista, t C =t M , tada se izoterme t C =t M =const seku na pravoj =100%.
Da biste pronašli tačku na dijagramu koja odgovara stanju datog vlažnog zraka, dovoljno je znati dva njegova parametra od onih prikazanih na dijagramu. Prilikom izvođenja eksperimenta preporučljivo je koristiti one parametre koji se u eksperimentu lakše i preciznije mjere. U našem slučaju ovi parametri su temperatura suve i vlažne sijalice.
Poznavajući ove temperature, na dijagramu se može pronaći presečna tačka odgovarajućih izotermi. Ovako pronađena tačka će odrediti stanje vlažnog vazduha, a iz id - dijagrama možete odrediti sve ostale parametre vazduha: sadržaj vlage - d; relativna vlažnost -, entalpija vazduha -i; parcijalni pritisak pare - R P, temperatura tačke rose - t M.
Vodena para ima visok pritisak i relativno nisku temperaturu, blizu je stanju
tečnosti, stoga je nemoguće zanemariti kohezione sile između njenih molekula i njihovog volumena, kao u idealnim gasovima. Stoga nije moguće koristiti jednačine stanja idealnih gasova za određivanje parametara stanja vodene pare, tj.
par pv ≠ RT.
Koja je razlika između procesa ključanja i isparavanja?
Tečnost se može pretvoriti u paru kada ispari i proključa. isparavanjem zvano isparavanje, koje se dešava samo sa površine tečnosti i na bilo kojoj temperaturi. Brzina isparavanja zavisi od prirode tečnosti i njene temperature. Isparavanje tečnosti može biti potpuno ako postoji neograničen prostor iznad tečnosti. U procesu isparavanja, isparavanje se događa samo na slobodnoj površini tekućine. Ovo je dvosmjeran proces, u kojem se, uz odlazak dijela molekula iz tekućine, događa i djelomični povratak molekula natrag u tečnost. U procesu ključanje para se formira u celoj masi tečnosti. Kada se tekućina zagrije, topljivost plinova u njoj se smanjuje, zbog čega se na dnu i zidovima posude u kojoj se nalazi voda stvaraju mjehurići. U procesu zagrijavanja unutar mjehurića tečnost počinje da isparava, a na određenoj temperaturi pritisak zasićene pare unutar mjehurića postaje jednak vanjskom pritisku. U ovom trenutku, mjehurići se odvajaju i tekućina počinje da ključa. Dakle, ako se isparavanje događa s površine tekućine na bilo kojoj temperaturi, tada se ključanje događa pri jednom, sasvim određenom za dati tlak i temperaturu, tzv. tačka ključanja ili temperatura zasićenja.
Opišite proces isparavanja u p-V koordinatama.
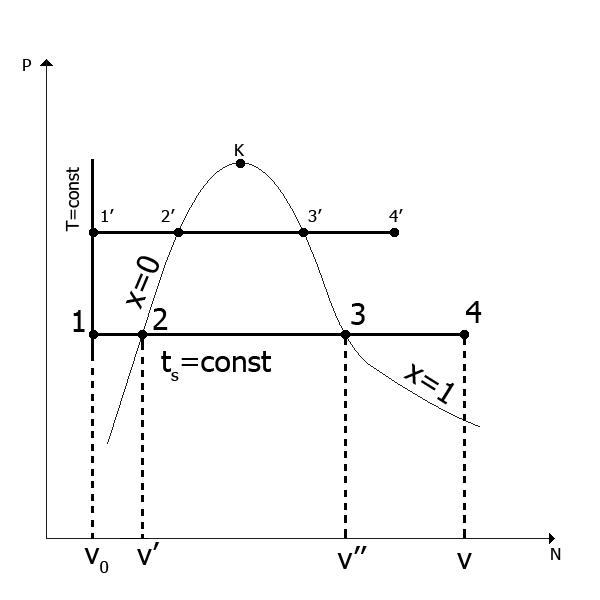
Za početnu temperaturu vode pod bilo kojim pritiskom, uzmite temperaturu t=0°C. Dakle, linija I na slici 1 odgovara stanjima takozvane hladne tečnosti na različitim pritiscima, koja ima temperaturu 0°C(izoterma hladne tečnosti). Specifična zapremina vode pri t=0°C uzeto jednako 0,001 m3/kg. Zbog blage stišljivosti vode, linija I ispada gotovo okomita prava linija. Lijevo od ove prave linije je područje ravnotežne koegzistencije vode i leda. Za porijeklo u, i i s za vodu je uobičajeno uzeti u obzir trostruku tačku TT (str 0 =611 Pa, t 0 =0,01 0 Životopis 0 =0,00100 m 3 /kg). Zanemarujući uticaj pritiska na promenu zapremine vode, razmatra se za sva stanja na liniji I v 0 \u003d 0,00100 m 3 / kg, u 0 =0, i 0 =0 i s 0 =0. Konačno stanje vode u fazi grijanja (tačka b) određuje se postizanjem pri datom pritisku tačke ključanja, koja zavisi od pritiska. Od pv- dijagram pokazuje da se sa povećanjem pritiska povećava tačka ključanja. Ova zavisnost je utvrđena empirijski. Stanja kipuće vode za različite pritiske će odgovarati liniji II, koja se zove donja granična kriva. Prikazuje zavisnost specifične zapremine kipuće vode o pritisku. Na donjoj graničnoj krivulji, stepen suhoće X= 0. Parametri ključale vode dati su u tabelama u zavisnosti od pritiska ili temperature.
Daljnje dovod topline u kipuću vodu, koje se provodi u evaporativnom krugu generatora pare, praćeno je brzim isparavanjem unutar tekućine i prelaskom dijela vode u paru. Dakle, sajt b-cće odgovarati ravnotežnom stanju mješavine tekućine i pare (vlažna zasićena para). U svakoj točki ovog procesa, vodu će karakterizirati maseni udio suhe zasićene pare koja se u njoj nalazi (stepen suhoće X).
Konačno stanje u ovoj fazi karakteriše potpuna transformacija tečnosti u paru, koja će imati temperaturu jednaku temperaturi zasićenja ( t c =t n) pri datom pritisku. Takva para, kao što je već spomenuto, naziva se suha zasićena para.
Proces isparavanja b-c je istovremeno izobaran ( p=p 1 =konst) i izotermni ( T=T 1 =konst). U ovom slučaju, utrošena toplina se ne troši na podizanje temperature, već samo na savladavanje sila privlačenja između molekula i na rad širenja pare.
S obzirom da je između temperature zasićenja t n i pritisak R postoji nedvosmislen odnos, stanje suhe zasićene pare će biti određeno samo jednim parametrom - tlakom ili temperaturom.
Stanja suhe zasićene pare pri različitim pritiscima odgovarat će liniji III, koja se naziva gornja granična kriva. Sasvim je očigledno da je na gornjoj graničnoj krivulji u svakoj tački stepen suhoće x=1.
Treba napomenuti da se u procesu isparavanja specifični volumen vode naglo povećava. Dakle, za vodu R= 0,1 MPa specifična zapremina kipuće vode v\u003d 0,001043 m 3 /kg, dok je specifična zapremina suhe zasićene pare 1,696 m 3 /kg. Sa povećanjem pritiska, ova razlika se takođe smanjuje na kritičnoj tački To specifične zapremine vode i pare su jednake 0,00326 m 3 /kg. Gde t kr =374,15 0 OD, a str kr=221,29 bara. Pri visokim kritičnim pritiscima i temperaturama, proces isparavanja izostaje. Prilikom prelaska izobare dolazi do prijelaza vode u paru T kr .
Šta je vlažna i suva zasićena para?
Voda zagrijana do temperature zasićenja naziva se zasićena tečnost. Smjesa tečnosti i pare na tački ključanja naziva se vlažna zasićena para.Daljnjim dovodom topline do vlažne zasićene pare, njen volumen će se povećati, a temperatura će ostati konstantna. Doći će trenutak kada će se sva tečnost pretvoriti u paru - suva zasićena para. Stanje suhe zasićene pare je izuzetno nestabilno, jer je lagano odvođenje topline iz nje pri konstantnom pritisku povezano s transformacijom suhe pare u mokru paru, a blagi dotok topline pretvara je u pregrijanu paru.
Šta je sadržaj pare?
Šta je toplota isparavanja?
Toplota isparavanja supstance- količina topline potrebna za prevođenje 1 mola tvari u stanje pare na tački ključanja. Izmjereno u džulima.
Šta je pregrijana para?
Ako se toplota nastavi sa dovodom toplote u suhu zasićenu paru, dolazi do daljeg povećanja zapremine pare i njene temperature - pregrijana para. Stanje pregrijane pare je relativno stabilno (praktična upotreba).
Šta se dešava sa vodom na kritičnoj tački?
Kritična tačka- kombinacija vrijednosti temperature i tlaka pri kojoj nestaje razlika u svojstvima tekuće i plinovite faze tvari (tj. u ovom trenutku se poklapaju gustina i druga svojstva tekuće i plinovite vode). Kritična tačka za vodu dostiže se s velikim poteškoćama pri temperaturi od 374,2°C i pritisku od 21,4 MPa. U trenutku dostizanja kritične tačke, vodu karakteriše izuzetno niska viskoznost, neprozirnost, nagli pad brzine prostiranja zvučnih talasa i tri puta manja gustina nego u normalnim uslovima. Superkritično stanje je ukrštanje između tečnosti i gasa. Voda u superkritičnom stanju može se komprimirati poput plina, a istovremeno je u stanju rastvarati čvrste tvari, što nije tipično za plinove.
Šta je entalpija? Kako se unutarnja energija pare određuje entalpijom?
Entalpija je funkcija H stanja termodinamičkog sistema, jednaka zbiru unutrašnje energije sistema U i proizvoda pritiska p i zapremine V sistema.
shodno tome,
U izobaričnom procesu (p = const), prirast entalpije je jednak količini toplote koja je predata sistemu.
Kako se određuje specifična zapremina, specifična entalpija, unutrašnja energija i entropija vlažne zasićene pare?
Specifična zapremina vlažne pare vx sa stepenom suvoće X određuje se uzimajući u obzir sledeće uslove. Ako je zapremina suve pare v"" i 1 kg mokre pare sa stepenom suvoće X sadrži X delova suve pare, tada je zapremina koju zauzima v""X. Ostatak (1 - X) zauzima voda čija je zapremina jednaka v"(1 - X), gdje je v" – specifična zapremina vode. Dakle, specifična zapremina vlažne pare
v x= v"" X + v"(1 - X).
Od kada je obično 1 > X > 0 v"" >>v“, onda možemo pisati
v x= v"" X.
Slično, specifična entalpija vlažne pare je
h x =h" + (h"-h")x = h" + rx,
specifična unutrašnja energija vlažne pare
u x = u´+ (u´´-u´)x
specifična entropija vlažne pare
U ovom članku ćemo razmotriti vodena para, što je gasovito stanje vode.
Gasovito stanje se odnosi na tri glavna stanja agregacije vode koja se nalazi u prirodi u prirodnim uslovima. Ovo pitanje je detaljno razmotreno u materijalu.
vodena para
Čisto vodena para nema boju ni ukus. Najveća akumulacija pare uočena je u troposferi.
Vodena para je voda koja se nalazi u atmosferi u gasovitom stanju. Količina vodene pare u vazduhu veoma varira; njegov najveći sadržaj je do 4%. Vodena para je nevidljiva; ono što se u svakodnevnom životu naziva para (para od udisanja hladnog vazduha, para iz kipuće vode, itd.) rezultat je kondenzacije vodene pare, poput magle. Količina vodene pare određuje najvažniju karakteristiku za stanje atmosfere - vlažnost vazduha.
Geografija. Moderna ilustrovana enciklopedija. - M.: Rosman. Pod uredništvom prof. A.P. Gorkina. 2006.
Kako nastaje vodena para
Voda pare nastala kao rezultat isparavanja. Vaporizacija nastaje kao rezultat dva procesa - isparavanja ili ključanja. Tokom isparavanja, para se formira samo na površini supstance, dok se para koja ključa formira u celoj zapremini tečnosti, o čemu svjedoče mjehurići koji se aktivno dižu prema gore tokom procesa ključanja. Voda se ključa na temperaturama koje zavise od hemijskog sastava vodenog rastvora i atmosferskog pritiska, tačka ključanja ostaje nepromenjena tokom celog procesa. Steam, koji nastaje ključanjem, naziva se zasićenim. Zasićen pare zauzvrat se dijeli na zasićenu suhu i zasićenu mokru paru. Zasićen mokra para sastoji se od suspendiranih kapljica vode, čija je temperatura na nivou ključanja, i, shodno tome, same pare i zasićene suva para ne sadrži kapljice vode.
Postoji i "pregrejana para", koja nastaje daljim zagrevanjem mokre pare, ova vrsta pare ima višu temperaturu i manju gustinu.
Vodena para je nezamjenjiv element tako važnog procesa za našu planetu kao što je.
Stalno se susrećemo sa parom u svakodnevnom životu, ona se pojavljuje - iznad grla kotla kada voda proključa, prilikom peglanja, prilikom posete kupatilu... Međutim, ne zaboravite da, kao što smo gore napomenuli, čistite vodena para nema boju ni ukus. Zbog svojih fizičkih svojstava i kvaliteta, para je odavno našla svoju praktičnu primjenu u ljudskoj ekonomskoj djelatnosti. I to ne samo u svakodnevnom životu, već iu rješavanju velikih globalnih problema. Dugo je vremena para bila glavna pokretačka snaga napretka, i doslovno i figurativno. Koristio se kao radno tijelo parnih mašina, od kojih je najpoznatija parna lokomotiva.
Upotreba pare od strane čovjeka
Para se još uvijek široko koristi u kućanstvima i industrijskim potrebama:
- u higijenske svrhe;
- u medicinske svrhe;
- za gašenje požara;
- koriste se termička svojstva pare (para kao nosač toplote) - parni kotlovi; parne košulje (autoklavi i reaktori); zagrijavanje "zamrznutih" materijala; izmjenjivači topline; sistemi grijanja; parenje betonskih proizvoda; u posebnoj vrsti izmjenjivača topline ...;
- koristiti transformaciju energije pare u kretanje - parne mašine...;
- sterilizacija i dezinfekcija - prehrambena industrija, poljoprivreda, medicina...;
- para kao ovlaživač - u proizvodnji armiranobetonskih proizvoda; šperploča; u prehrambenoj industriji; u hemijskoj i parfemskoj industriji; u drvnoj industriji; u poljoprivrednoj proizvodnji ...;
Sumirajući, napominjemo da, uprkos svoj svojoj "nevidljivosti", vodena para nije samo važan element globalnog ekosistema Zemlje, već i vrlo korisna tvar za ljudske ekonomske i ekonomske aktivnosti.
Na riječ "para" sjetim se vremena kada sam još bio u osnovnoj školi. Potom bi roditelji, vraćajući se iz škole, počeli pripremati večeru i stavljali lonac vode na plinski šporet. I nakon deset minuta u šerpi su se počeli pojavljivati prvi mjehurići. Taj me proces oduvijek fascinirao, činilo mi se da ga mogu gledati zauvijek. A onda je, neko vrijeme nakon pojave mjehurića, počela da teče i sama para. Jednom sam pitao majku: "Odakle dolaze ovi bijeli oblaci?" (Tako sam ih zvao). Na šta mi je ona odgovorila: "Sve se dešava zbog zagrevanja vode." Iako odgovor nije dao potpunu sliku procesa stvaranja pare, na časovima školske fizike naučio sam sve što sam htio o pari. pa...
Šta je vodena para
Sa naučne tačke gledišta, vodena para je jednostavno jedno od tri fizička stanja same vode. Poznato je da se javlja kada se voda zagreje. Kao i ona sama, para nema boju, nema ukus, nema miris. Ali ne znaju svi da parni klubovi imaju svoj pritisak, koji zavisi od njegovog obima. I to je izraženo u Pascals(u čast ozloglašenog naučnika).
Vodena para nas okružuje ne samo kada nešto kuvamo u kuhinji. Stalno je sadržan u uličnom vazduhu i atmosferi. I njegov procenat sadržaja se zove "apsolutna vlažnost".

Činjenice o vodenoj pari i njenim karakteristikama
Dakle, evo nekoliko zanimljivih tačaka:
- što je temperatura viša, koji deluje na vodu, što je brži proces isparavanja;
- osim toga, brzina isparavanja raste s veličinom površine površine na kojoj se nalazi voda. Drugim riječima, ako počnemo zagrijavati mali sloj vode na širokoj metalnoj čaši, tada će se isparavanje odvijati vrlo brzo;
- Biljkama nije potrebna samo tečna voda, već i gasovita voda.. Ova se činjenica može objasniti činjenicom da pare neprestano dolaze iz lišća bilo koje biljke, hladeći je. Pokušajte dodirnuti list drveta po vrućem danu - i primijetit ćete da je hladno;
- isto važi i za ljude, isti sistem radi sa nama kao i sa biljkama iznad. Isparavanje hladi našu kožu tokom vrućeg dana. Iznenađujuće, čak i uz mala opterećenja, naše tijelo ostavlja oko dva litra tekućine na sat. Šta možemo reći o povećanim opterećenjima i vrućim ljetnim danima?

Ovako možete opisati suštinu pare i njenu ulogu u našem svijetu. Nadam se da ste otkrili puno zanimljivih stvari!
Vodena para se koristi kao radni fluid u raznim procesima, na primjer, za rotaciju parne turbine.
Para se obično proizvodi kuvanjem tečnosti. Ako se tekućini dovodi toplina pri konstantnom pritisku, temperatura tekućine raste do određene vrijednosti Tbp. Daljnjim zagrijavanjem temperatura ostaje konstantna - para se stvara tokom ključanja tečnosti.
Kipuće- to je proces isparavanja u masi tečnosti, dok se isparavanje dešava samo sa slobodne površine tečnosti, pod uslovom da je parcijalni pritisak pare nad tečnošću manji od pritiska zasićene pare.
Proces ključanja je prikazan na p - V dijagramu izobar, što je takođe izoterma.
Specifična toplota isparavanja (r, J/kg) - je količina topline potrebna da se 1 kg tekućine pretvori u paru.
Prema prvom zakonu termodinamike:
q = r = (u // - u /) + p(v // - v /), (69)
gdje je u // , v // - specifična unutrašnja energija i specifični volumen suhe zasićene pare; u / , v / – isto za vodu.
(u // - u /) je promjena unutrašnje energije povezana sa savladavanjem sila privlačenja između molekula tokom prelaska tekućine u paru. p(v // - v /) je rad parne ekspanzije.
Steam može biti mokro, suho, zasićeno i pregrijano.
Mokra para je mješavina kipuće tekućine i suhe zasićene pare. Omjer mase pare i mase smjese naziva se stepen suvoće pare.
Druga vrijednost (1-x) se također koristi, tzv stepen vlažnosti pare:
![]() (71)
(71)
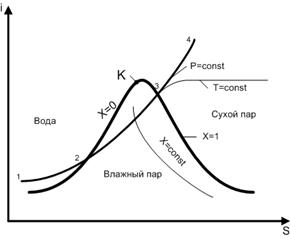 Za analizu procesa isparavanja i određivanje parametara vodene pare koriste se i - S dijagrami vodene pare.
Za analizu procesa isparavanja i određivanje parametara vodene pare koriste se i - S dijagrami vodene pare.
|
Glavna kriva na i–S dijagramu je kriva zasićenja sa naznačenom kritičnom tačkom To, koji krivulju dijeli na dvije linije. Lijevo od tačke K je linija ključanja vode. Na ovoj liniji, x = 0, odnosno nema para. Desno od kritične tačke je kondenzaciona linija, za koju je x = 1, što odgovara odsustvu vode. Kriva zasićenja, zajedno sa kritičnom tačkom na njoj, dijeli cijeli dijagram na tri regije. Ispod krivulje zasićenja nalazi se područje vlažne pare sa stepenom suhoće od 0< x < 1. Над кривой насыщения слева от точки К имеет место состояние воды. Справа от критической точки над кривой насыщения расположена область сухого пара. Кроме кривой насыщения на i – S диаграмме проводятся изобары (p = const), изотермы (t = const) и линии постоянной степени сухости пара (x = const). Под кривой насыщения изотермы и изобары совпадают.
Razmotrimo proces zagrijavanja vode pri konstantnom pritisku, krećući se duž izobare 1-2-3-4 (slika 12). U odeljku 1-2 voda se zagreva do tačke ključanja. Količina topline koja se za to treba isporučiti određena je razlikom između entalpija i 2 i i 1:
q voda \u003d i 2 - i 1
U dijelu 2-3 voda ključa na konstantnoj temperaturi. Razlika entalpije ovdje određuje specifičnu toplinu isparavanja:
U odeljku 3-4, suha para je pregrejana. Temperatura u ovom području raste. Povećanje entalpije određuje troškove topline za pregrijavanje pare:
q pregrijavanje = i 4 - i 3
i - S dijagram vam omogućava da odredite ukupne troškove topline potrebne za proizvodnju pregrijane pare:
q = q voda + r + q pregrijavanje = ∆i voda + ∆i para + ∆i pregrijavanje
Kraj rada -
Ova tema pripada:
Osnovni pojmovi termodinamike. Predmet termodinamike. Osnovni parametri stanja termodinamičkog sistema
Na web stranici pročitajte: Bilješke sa predavanja Disciplina prema nastavnom planu i programu smjera pripreme: 260901 Tehnologija odjevnih predmeta. Omsk SADRŽAJ...
Ako vam je potreban dodatni materijal na ovu temu, ili niste pronašli ono što ste tražili, preporučujemo da koristite pretragu u našoj bazi radova:
Šta ćemo sa primljenim materijalom:
Ako vam se ovaj materijal pokazao korisnim, možete ga spremiti na svoju stranicu na društvenim mrežama:
| tweet |
Sve teme u ovoj sekciji:
Istorijat
Termodinamika se kao nauka počela razvijati od 18. stoljeća nakon pojave prvih parnih mašina. Godine 1824. francuski inženjer Sadi Carnot objavio je prvi rad o teoriji topline
Energija termodinamičkog sistema
Ukupna energija sistema je zbir njegove unutrašnje i spoljašnje energije, a to je mehanička energija. E = U + Emech. mehanička energija
Jednačine stanja
Funkcionalni odnos između parametara stanja termodinamičkog sistema - pritiska p, zapremine V i temperature T - naziva se jednačina stanja. Ovaj za
Jednačina stanja idealnog gasa
Idealan plin je plin koji se sastoji od molekula koje imaju zanemarive dimenzije, među kojima se sile interakcije mogu zanemariti. Jednačina
Zakoni termodinamike
Prvi zakon (prvi zakon) termodinamike.Ovo je zakon održanja energije primijenjen na termodinamičke procese. Formuliše se na sledeći način: Količina toplote
Totalni diferencijalni uvjet
Iz matematičke analize je poznato da se diferencijal funkcije nekoliko varijabli F(x1, x2, x3, ...) izražava kao:
Reverzibilni i ireverzibilni procesi
Definicija reverzibilnih i ireverzibilnih procesa povezana je sa konceptima ravnotežnih i neravnotežnih procesa. Budući da su ravnotežni procesi idealni procesi koji stvarno ne postoje u prirodi, za
Uslovi postojanja i svojstva ravnotežnih procesa.
1. Beskonačno mala razlika između djelujućih i suprotstavljenih sila. 2. Maksimalni rad u direktnom procesu. 3. Beskonačno spor tok procesa povezan sa beskonačnim
Specifični toplotni kapacitet gasova
Eksperimentalno je utvrđeno da je količina topline potrebna za zagrijavanje tijela proporcionalna masi tijela i razlici između konačne i početne temperature. Q ~ m (T2 - T1
Odnos toplotnih kapaciteta pri konstantnom pritisku i konstantne zapremine.
Uzmimo unutrašnju energiju kao funkciju zapremine i temperature: U = f (V, T) Napišimo ukupni diferencijal ove funkcije
Iz prvog zakona termodinamike
δQ = δL = p dV Adijabatski proces je proces bez razmjene topline sa okolinom. (δQ = 0) Iz prvog zakona termodinamike: δQ = m
Drugi zakon termodinamike
Prvi zakon termodinamike omogućava rješavanje mnogih termodinamičkih problema. Međutim, on ne razmatra pitanje smjera tekućih procesa. Sa stanovišta prvog zakona, bilo koji
Izračun entropije. Gibbsov paradoks.
Zapišimo iz izraza (48) izraz za entropijski diferencijal: (48) Iz jednadžbe stanja id
Drugi zakon termodinamike za nestatičke procese
Postojanje jednovrijedne funkcije stanja, entropije, u ravnotežnom sistemu izražava drugi zakon termodinamike za kvazistatičke procese. Hajde da formulišemo ovaj zakon u odnosu na nestatično
Treći zakon termodinamike
Kada se tijela zagriju i kada se agregatno stanje promijeni iz čvrstog → tekućeg → plinovitog entropija se povećava. Prema tome, minimalna entropija će imati tijelo u čvrstom stanju na
Toplotni ciklusi
Za kontinuiranu proizvodnju korisnog rada u toplotnim mašinama potrebno je imati periodične faze ekspanzije radnog fluida. To je moguće samo ako je tokom rada toplotnog motora radni fluid






