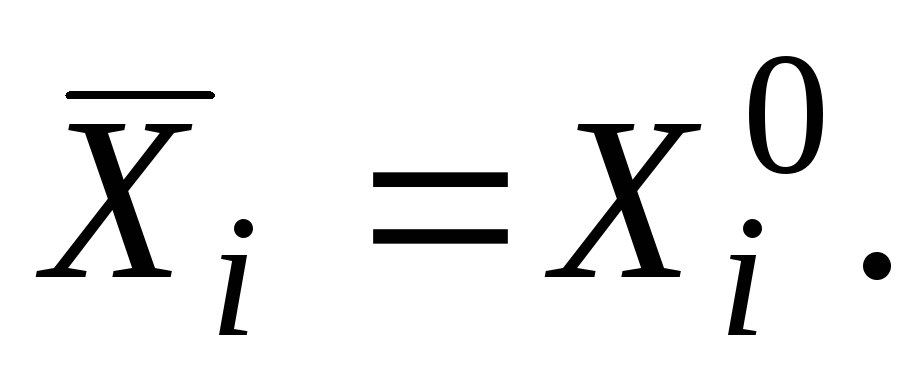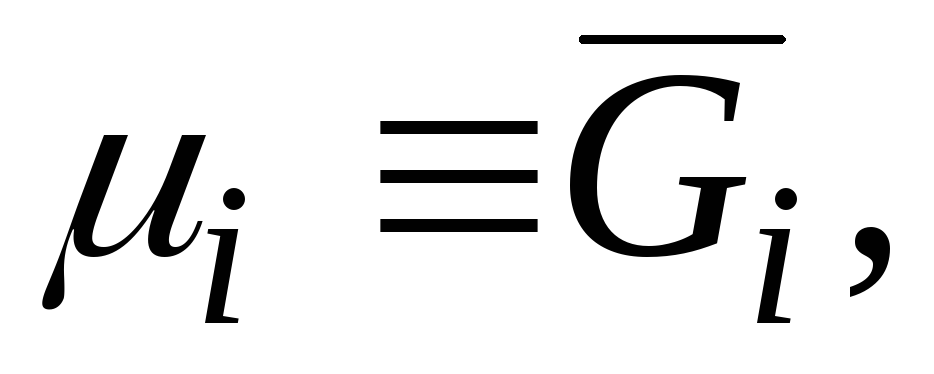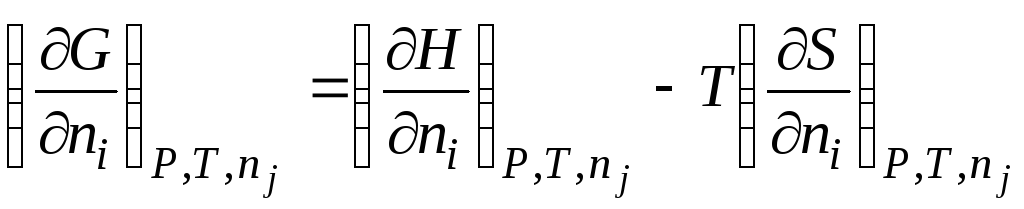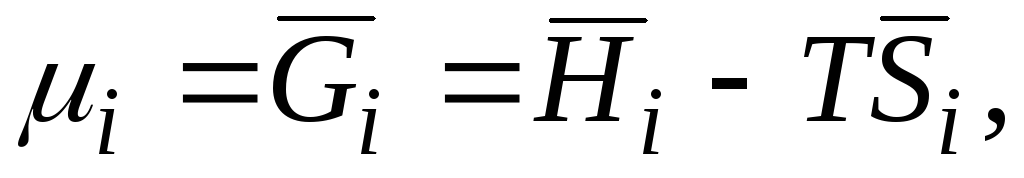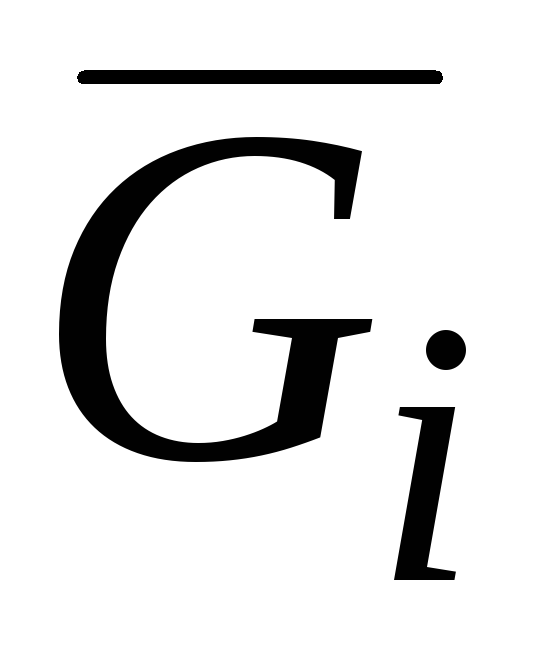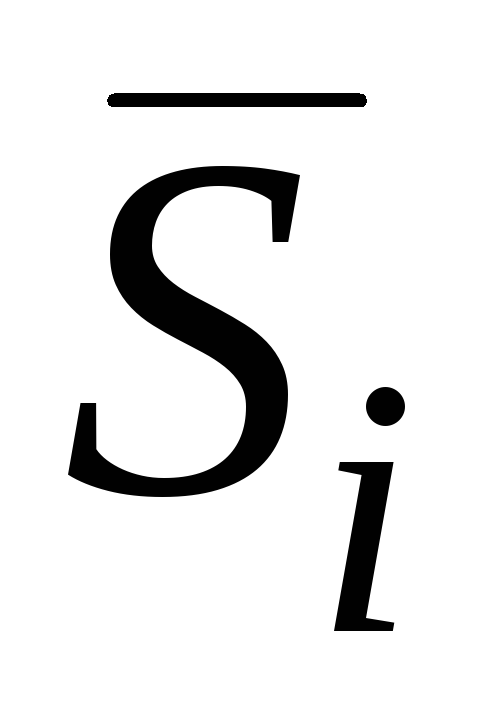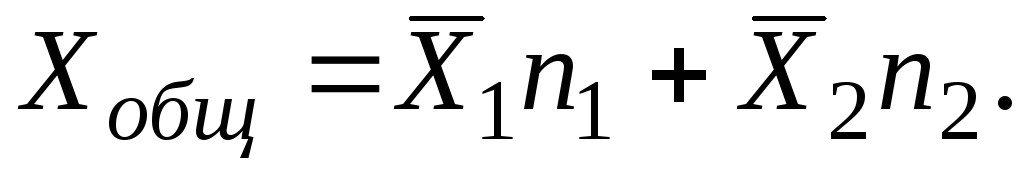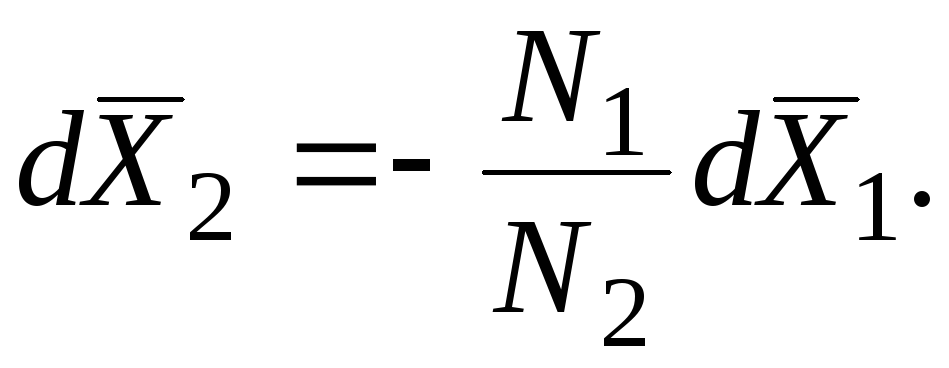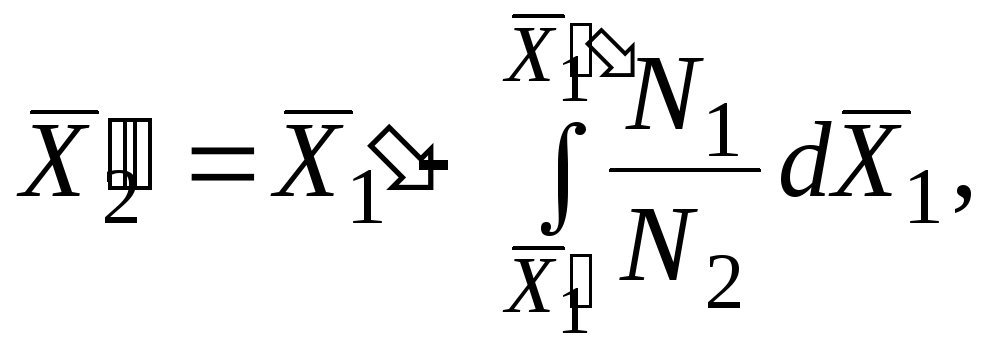Primjeri zadataka. Fizička hemija
Ekstenzivna svojstva proporcionalno količini materije. To uključuje, na primjer, zapreminu, masu, unutrašnja energija, entropija. Dakle, unutrašnja energija dva identična komada metala je dvostruko veća od energije jednog komada. Ekstenzivna svojstva sistema su aditivno sastavljena od ekstenzivnih svojstava njegovih sastavnih delova. Svojstva kao što su temperatura i pritisak koja ne zavise od količine materije nazivaju se intenzivan. Za otopine, intenzivna svojstva su određena sastavom. Na primjer, tlak pare bilo koje komponente iznad otopine ovisi o njezinoj koncentraciji. Vrijednosti intenzivnih svojstava u različitim dijelovima sistema imaju tendenciju izjednačavanja. Mjerenje intenzivne veličine zasniva se na činjenici da je njena promjena uvijek praćena promjenom neke ekstenzivne veličine. Dakle, za mjerenje temperature koristi se promjena volumena tvari, na primjer, žive, tj. ekstenzivno vlasništvo.
G. Lewis je nazvao parcijalnu molarnu vrijednost komponente gi parcijalni izvod neke ekstenzivne veličine gi po broju mladeža n i ova komponenta otopine pri konstantnom pritisku, temperaturi i molskom broju preostalih komponenti:
gi = (∂g/∂n i) p.T.nj(j ≠ i) . (V.1)Usklađenost sa uslovima koje zahteva ova definicija može se postići ako, na primer, zamislimo da se na veoma veliku zapreminu rastvora date koncentracije pri konstantnoj R i T Doda se 1 mol bilo koje komponente. U ovom slučaju, koncentracija otopine se praktično neće promijeniti, a odgovarajuća promjena u svojstvima otopine bit će parcijalna molarna vrijednost dodane komponente.
Na primjer, parcijalni molarni volumen Vi, određen je jednadžbom:
Vi = (∂V/∂n i) p.T.nj(j ≠ i) . (V.2)Ako se otopina formira od komponenti bez promjene volumena, onda je očito da je parcijalni molarni volumen komponente jednak njenom molarnom volumenu, tj. Vi = V
| 0 |
| i |
rastvora komponenti, posmatra se aditivnost zapremine, tj. ne mijenja se, na primjer, za binarno rješenje koje se sastoji od P 1 mol prve komponente i P 2 mola drugog: V = n 1 V
| 0 |
| 1 |
| 0 |
| 2 |
| 0 |
| 1 |
| 0 |
| 2 |
Ako je, na primjer, entalpija aditivna u formiranju otopine, tada je Δ H= 0, pa se stoga rastvor formira bez termičkog efekta. Ako je entalpija polaznih materijala više entalpije rastvora, kada se rastvor formira, oslobađa se toplota. U suprotnom, toplota će se apsorbovati.
Među parcijalnim molarnim količinama, parcijalna molarna Gibbsova energija je od posebne važnosti:
G i = (∂G/∂n i) p.T.nj(j ≠ i) (V.3)koji, kako je navedeno u pogl. II, zv hemijski potencijal i označava se sa μ.
Hemijski potencijal, zajedno sa temperaturom i pritiskom, je intenzivna veličina. Dakle, jednakost temperatura, pritisaka i hemijskih potencijala svih komponenti u različitim delovima sistema izražava uslove termičke, mehaničke i hemijske ravnoteže. Vrijednost G i = μ i odražava tendenciju supstance da napusti datu fazu i predstavlja mjeru njene disperzije.
Razmotrimo dvije susjedne faze - otopinu i paru iznad nje. U svakoj od ovih faza postoji određena komponenta i. U ravnoteži G i rješenje = G i pare.
ako npr. hemijski potencijal u rastvoru je bilo više supstance nego u gasnoj fazi, tada bi došlo do isparavanja ove supstance, pri čemu G i rješenje se smanjuje, a G i par se povećava sve dok se ne uspostavi ravnoteža. U suprotnom, došlo bi do tranzicije komponente i iz pare u rastvor.
Pretpostavimo da parna faza ima svojstva idealnih gasova. Pošto u ovom slučaju nema interakcije između molekula, parcijalna molarna Gibbsova energija gasne komponente ili njenog hemijskog potencijala jednaka je molarnoj Gibbsovoj energiji čiste komponente G i pri pritisku koji je jednak njegovom parcijalnom pritisku u smeši, tj. μ i gas = G i gas = G i gas. Dakle, prema jednačini (II.28):
G i rješenje = μ i rješenje = G i = G
obično se označava μ + RT ln pi(V.4)Parcijalne molarne vrijednosti karakteriziraju svojstva otopina. Oni igraju istu ulogu u termodinamičkim proračunima ravnoteža u rješenjima kao i odgovarajuće funkcije U, H, F, G, S itd. u proračunima koji se odnose na reakcije između čistih supstanci. U tom smislu, preporučljivo je sastaviti tabele parcijalnih molarnih vrijednosti.
Uvod
Tema 6. Rješenja
Proučavanje rastvora je važno područje fizičke hemije, jer i u prirodi i u tehnologiji stalno imamo posla sa rastvorima, a ne čistim supstancama. Na primjer, najčistiji metali dobijeni u savremenoj tehnologiji metodama vakuumskog i zonskog topljenja još uvijek sadrže zanemarljive količine (10-6%) nečistoća, uglavnom metaloida, i u suštini su rješenja.
Većina procesa koji se odvijaju u prirodi, kao i u osnovi različitih tehnoloških procesa, odvijaju se u tečnoj fazi. Dakle hemijske reakcije kod topljenja željeza i čelika javljaju se uglavnom u otopinama. Tečno željezo i čelik su rješenja razni elementi u gvožđu. U visokim pećima i pećima za topljenje čelika stupaju u interakciju s tekućom šljakom - otopinom oksida.
Vodeni rastvori soli, kiselina i baza se široko koriste u hidrometalurgiji za ekstrakciju obojenih metala iz ruda.
Rastvor je homogen, homogen sistem promenljivog sastava, koji se sastoji od dve ili više komponenti. Otopine mogu postojati u bilo kojem agregatnom stanju - čvrstom, tekućem ili plinovitom. Njihova zajednička karakteristika je jednofazna.
Rješenja su vrlo raznolika po prirodi i po prirodi interakcije između čestica njihovih komponenti. Tako, na primjer, otopinu sumporne kiseline u vodi, koja nastaje oslobađanjem velike količine topline, karakterizira jasno izražena kemijska interakcija, a u otopini ukapljenih plemenitih plinova - argona i neona - fizičke sile. U mnogim stvarnim rješenjima, priroda interakcije između čestica je toliko složena da je nemoguće razdvojiti njene kemijske i fizičke aspekte.
Komponente otopine su otapalo (medij) i otopljena supstanca (ili nekoliko supstanci) jednoliko raspoređeni u otapalu u obliku molekula, atoma ili jona. Pod rastvaračem se obično podrazumijeva supstanca koja je u istom agregacijskom stanju kao i otopina u cjelini. Ako je agregatno stanje supstanci koje sačinjavaju rastvor isto, onda je otapalo ono koje prevladava u ovom sistemu. Na primjer, u 5% otopini šećera u vodi, potonja je rastvarač, a šećer otopljena supstanca. Općenito, pojmovi "rastvarača" i "otopljene tvari" su u određenoj mjeri uslovni. Na primjer, u koncentriranim otopinama, razlika između otopljene tvari i rastvarača je manje očigledna. Za 50% rastvor etil alkohola i vode pojmovi su jednaki, a za rastvor koji sadrži 95% alkohola i 5% vode, ova druga je otopljena supstanca. Stoga, koncepte "rastvarača" i "otopljene tvari" treba koristiti kada se primjenjuje na razrijeđene (nekoncentrirane) otopine. Za otopine elektrolita, voda je uvijek rastvarač, čak i ako je vrlo mala.
Sastav otopine ili njegova koncentracija izražava se na različite načine. Najprikladnije je koncentraciju otopine izraziti u molskim frakcijama.
molska frakcija N i je omjer broja molova i ta supstanca ( n i) to ukupan broj mola svih komponenti u datoj količini rastvora Σ n i:
U slučaju vodenih otopina, koncentracija se obično izražava kao broj molova otopljene tvari u 1 litri otopine - molarna koncentracija ( OD m):
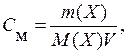 (6.2)
(6.2)
gdje V- zapremina rastvora, dm 3.
Međutim, upotreba molarne koncentracije nije uvijek zgodna, jer koncentracija otopine zbog toplinskog širenja ovisi o temperaturi. U tom smislu često se koristi i molalitet. molalitet ( cm) je broj molova otopljene tvari u 1000 g rastvarača:
 (6.3)
(6.3)
gdje m 2 (X) je masa otopljene tvari, g; M(X) je molarna masa otopljene tvari, g/mol; m 1 je masa rastvarača, g.
Postoji veza između molnog udjela i molaliteta u vodenim otopinama
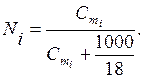 (6.4)
(6.4)
Supstanca, prelazeći u rastvor, postaje komponenta rastvora, gubi svoju individualnost.
Svojstva rastvora mogu se okarakterisati termodinamičkim veličinama V, H, U, F, G itd. Zbog interakcije između molekula komponenti rastvora, ima smisla termodinamičke karakteristike odnositi na rastvor kao celinu, a ne na njegove sastavne supstance. Dakle, rješenje karakterizira dobro definirano, podložno jednostavno merenje zapremine, ali je nemoguće odrediti koje zapremine pojedine komponente zauzimaju u njemu.
U bilo kojoj otopini, na primjer, otopini sumporne kiseline u vodi, zajedno s energijom molekula sumporne kiseline i vode, postoji energija interakcije između ovih tvari, koja karakterizira otopinu i ne može se pripisati nijednoj od komponente. Međutim, još uvijek je važno okarakterizirati u kojoj proporciji ova komponenta doprinosi jednom ili drugom svojstvu rješenja. Takva karakteristika se naziva parcijalna vrijednost.
G. Lewis je parcijalnu molarnu količinu komponente nazvao parcijalnim derivatom neke ekstenzivne veličine g prema broju molova ove komponente otopine pri konstantnom pritisku, temperaturi i broju molova preostalih komponenti:
![]() (6.5)
(6.5)
Usklađenost sa uslovima koje zahteva ova definicija može se postići ako se, na primer, na veoma veliku zapreminu rastvora date koncentracije pri konstantnoj i T dodajte 1 mol bilo koje komponente. U ovom slučaju, koncentracija otopine se praktično neće promijeniti, a odgovarajuća promjena u svojstvima otopine bit će parcijalna molarna vrijednost dodane komponente.
Na primjer, parcijalni molarni volumen je dat jednadžbom
![]() (6.6)
(6.6)
Ako se otopina formira od komponenti bez promjene volumena, onda je očito da je parcijalni molarni volumen jednak njegovom molarnom volumenu, tj. gdje indeks "nula" znači da je tvar u čistom stanju. Za razliku od molarnog volumena, parcijalni molarni volumen može biti negativna vrijednost, na primjer, ako zbog molekularne interakcije, kada se komponenta doda u otopinu, dođe do smanjenja volumena. Ako se aditivnost uoči prilikom formiranja otopine iz komponenti, tada, na primjer, za binarno rješenje koje se sastoji od n 1 molovi prve komponente i n 2 krtice drugog:
![]() (6.7)
(6.7)
gdje i su molni udjeli čistih tvari.
Očigledno, u ovom slučaju, kada se formira rješenje
Ako je, na primjer, tijekom formiranja otopine entalpija aditivna, tada se, posljedično, otopina formira bez toplinskog efekta. Ako je entalpija početnih materijala veća od entalpije otopine, tada se tijekom formiranja otopine oslobađa toplina. U suprotnom, toplota će se apsorbovati.
Među parcijalnim molarnim količinama, parcijalna molarna vrijednost je od posebnog značaja. slobodna energija
![]() (6.8)
(6.8)
koji se takođe često naziva hemijskim potencijalom i označava
Hemijski potencijal, zajedno sa temperaturom i pritiskom, je intenzivna veličina. Dakle, jednakost temperatura, pritisaka i hemijskih potencijala svih komponenti u različitim delovima sistema izražava uslove termičke, mehaničke i hemijske ravnoteže (videti odeljak 2.12).
Vrijednost odražava tendenciju tvari da napusti ovu fazu i mjera je njene disperzije. Razmotrimo dvije susjedne faze - otopinu i paru iznad nje. U svakoj od ovih faza postoji određena komponenta i. U ravnoteži
Kada bi, na primjer, hemijski potencijal supstance u rastvoru bio veći nego u gasnoj fazi, došlo bi do isparavanja te supstance, pri čemu bi ![]() opada i raste sve dok se ne uspostavi ravnoteža. U suprotnom, došlo bi do tranzicije komponente i iz pare u rastvor.
opada i raste sve dok se ne uspostavi ravnoteža. U suprotnom, došlo bi do tranzicije komponente i iz pare u rastvor.
Parcijalne molarne vrijednosti karakteriziraju svojstva otopina. Oni igraju istu ulogu u termodinamičkim proračunima ravnoteže u rješenjima kao i odgovarajuće funkcije ( U, H, F, G, S itd.) u proračunima koji se odnose na reakcije između čistih supstanci. U tom smislu, preporučljivo je sastaviti tabele parcijalnih molarnih količina. Da bi se odredila parcijalna molarna vrijednost date komponente, potrebno je pronaći ovisnost odgovarajućeg ekstenzivnog svojstva o sastavu otopine pri konstantnoj R ukupno, T i brojeve molova preostalih komponenti i razlikovati prema broju molova ove komponente. Za binarna rješenja, takvo određivanje se obično vrši grafički korištenjem metode segmenta. Da biste to učinili, izračunajte svojstvo jednog mola otopine.
Mol otopine je količina pri kojoj je broj molova svake komponente jednak njenom molskom udjelu. Na primjer, jedan mol otopine ugljika u tekućem željezu, koji sadrži 0,1 mol ugljika i 0,9 mola željeza. Jer atomska masa ugljik je 12, a željezo 55,85, tada će masa jednog mola takve otopine biti 12 × 0,1 + 55,85 × 0,9 = 51,465 g.
Svojstvo rješenja g, koji se odnosi na jedan mol, označen je indeksom . Na primjer, označava se volumen jednog mola otopine
Grafička metoda za određivanje parcijalnih molarnih količina prikazana je na Sl. 6.1. Molarni udjeli prve i druge komponente su nacrtani duž apscisne ose ( N 1 i N 2). Dot O odgovara prvoj čistoj komponenti; na ovom mjestu N 1= 1 i N 2= 0. Tačka Oko 1 odgovara drugoj čistoj komponenti; na ovom mjestu N 1= 0 i N 2= 1. Svaka tačka na pravoj OO 1 odgovara rastvoru određenog sastava.
Vrijednost bilo kojeg svojstva jednog mola otopine iscrtava se na y-osi. Kriva AB izražava zavisnost svojstva od sastava rješenja. Ako se tokom formiranja rastvora njegovo svojstvo aditivno sastoji od svojstava komponenti, tada će se umesto krive, zavisnost izraziti pravom linijom. Segmenti OA i O 1 V predstavljaju, respektivno, molarna svojstva čistih komponenti i
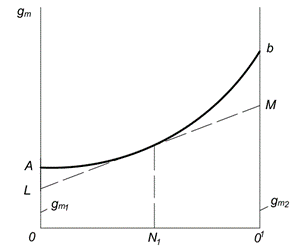
Rice. 6.1. Grafička metoda za određivanje parcijalnih molarnih vrijednosti
Da biste pronašli parcijalne molarne vrijednosti komponenti u otopini date koncentracije, na primjer, treba povući tangentu LM do krivine AB u tački koja odgovara ordinati vraćenoj od segmenta odsječenog tangentom na osi ordinata OL i oko 1M, jednake su parcijalnim količinama i
Pošaljite svoj dobar rad u bazu znanja je jednostavno. Koristite obrazac ispod
Studenti, postdiplomci, mladi naučnici koji koriste bazu znanja u svom studiranju i radu biće vam veoma zahvalni.
Hostirano na http://www.allbest.ru/
Rad na kursu
Određivanje parcijalnih molarnih količina
Uvod
2.1 Analitičke metode
2.2 Grafičke metode
3. Eksperimentalni dio
3.1 Instrumenti i reagensi
4. Rezultati i diskusija
Zaključak
Bibliografija
Aplikacija
rezultate
Uvod
U prirodi postoji bezbroj sistema koji su jednolična mješavina jedne tvari u drugoj ili mješavina više tvari. Sve prirodne mješavine mogu se podijeliti u dvije grupe:
1) mješavine u kojima postoji fizički interfejs između komponenti. Takve smjese se nazivaju heterogene. Heterogeni sistemi se sastoje od faza koje se međusobno razlikuju hemijski sastav i termodinamička svojstva;
2) smeše u kojima nema fizičkog interfejsa između komponenti. Stoga, u svim svojim dijelovima, takvi sistemi imaju ista fizička i hemijska svojstva. Takvi sistemi se nazivaju homogeni ili rastvori.
Rješenje je homogen sistem koji se sastoji od dva ili više komponente, čiji se sastav može kontinuirano mijenjati u određenim granicama.
Rastvori mogu biti u tri agregatna stanja: gasovito, tečno i čvrsto. U praksi se najčešće susreće kod tečnih rastvora. U tečnom rastvoru razlikuju se otapalo i otopljena supstanca, iako su sa termodinamičkog gledišta sve komponente rastvora ekvivalentne. Pod rastvaračem se podrazumeva supstanca koja je prisutna u rastvoru u većoj količini. U ovom radu razmatraju se tečne otopine.
Struktura i fizička svojstva tečnosti zavise od hemijskog identiteta čestica koje ga formiraju i od prirode i intenziteta sila koje deluju između njih. U tečnim sistemima se pojavljuju različite vrste interakcije.
Po strukturi tečno stanje je između čvrsto stanje sa strogo definisanom periodičnom strukturom kroz kristal i gasom u kome nema strukture i kretanje čestica je nasumično. Dakle, tečnost se karakteriše, s jedne strane, prisustvom određene zapremine, as druge strane, odsustvom određenog oblika. U tečnosti blizu temperature očvršćavanja, urednost unutrašnje strukture postaje izraženija. Naprotiv, kako se tečnost približava tački ključanja, poremećaj u relativnu pozicijučestice.
Tečni rastvori se mogu dobiti otapanjem gasova, tečnosti ili čvrste materije u odgovarajućem tečnom rastvaraču. Kada se formira tečni rastvor, kada se u rastvor unese tečni rastvarač određene strukture, formira se nova struktura sa drugačijim rasporedom čestica nego u otapalu. U ovom slučaju se mijenjaju sile međumolekularne interakcije.
U tečnom rastvoru, osim interakcije, dolazi do interakcije između istoimenih molekula i između molekula suprotnih imena. Interakcija molekula može biti praćena njihovim raspadom na ione. Mogućnost i stepen razgradnje na jone određen je prirodom otopljene supstance i prirodom rastvarača. Raspad na ione je povezan ili sa fenomenom disocijacije (odvajanja) ili sa fenomenom jonizacije (formiranje jona). Dakle, kada se jonska jedinjenja rastvore, dolazi do disocijacije.
Kao rezultat interakcije između formiranih iona i molekula otapala, nastaju solvati (u vodenim otopinama - hidrati). Skup molekula rastvarača koji okružuju ion je solvatna ljuska. Postoje primarne i sekundarne solvatne ljuske. Primarna solvatna ljuska je ljuska nastala kao rezultat djelovanja jona na najbliže molekule otapala, koji gube svoje neovisno kretanje i kreću se zajedno s ionom. Na primjer, primarna solvacijska ljuska sadrži, prema kvantnomehaničkim proračunima, od 5 do 7 molekula vode po ionu.
Interakcija između molekula često dovodi do stvaranja drugih, složenijih molekula – kompleksa.
Dakle, rješenja su vrlo složeni sistemi, u kojem otopljena supstanca može biti u obliku pojedinačnih molekula ili pridruženih tvari, koja se sastoji od nekoliko molekula, ili djelomično ili potpuno disocirana na ione. S tim u vezi, otopine se dijele na otopine bez elektrolita i otopine elektrolita.
Otapanje je praćeno oslobađanjem ili apsorpcijom toplote. Kada se tvar otopi, veze između molekula (atoma ili jona) u otopljenoj tvari i otapalu se prekidaju, što je povezano s potrošnjom energije. Istovremeno teče proces solvatacije, tj. postoje veze između čestica otopljene tvari i rastvarača. Pri tome se oslobađa energija. Ukupni energetski učinak rastvaranja, ovisno o odnosu količine oslobođene i apsorbirane energije, može biti pozitivan ili negativan.
Pored energetskog efekta, otapanje je praćeno promjenom volumena pomiješanih komponenti. Na primjer, pri otapanju alkohola u vodi, volumen otopine se smanjuje za oko 3,5% u odnosu na ukupan volumen uzetih tvari zbog stvaranja solvata.
Kada se otopi, ponekad se opaža promjena boje otopine.
Svrha ovog rada je određivanje integralne i parcijalne molarne topline rastvaranja razne supstance i izvođenje interpolacione jednačine za zavisnost integralne toplote rastvaranja o sastavu rastvora.
Radni zadaci:
1) Koristeći kalorimetrijska mjerenja, odrediti vrijednosti integralne toplote rastvaranja za različite koncentracije dobijenog rastvora;
3) nacrtajte zavisnost toplote rastvaranja od sastava rastvora.
1. Parcijalne molarne veličine i njihov značaj u termodinamici otopina
Parcijalne molarne veličine su termodinamičke veličine koje se koriste za opisivanje koncentracijskih ovisnosti svojstava otopina. Neka je M neka ekstenzivna funkcija stanja sistema od h komponenti, tj. osobina koja zavisi od mase sistema (zapremina, unutrašnja energija, entalpija, entropija, Gibbsova energija, Helmholcova energija, toplotni kapacitet, itd.) . Za i-tu komponentu, parcijalna molarna vrijednost Z određena je relacijom:
one. jednak je izvodu M u odnosu na broj molova komponente i at konstantna temperatura T, pritisak p i molni brojevi svih ostalih komponenti. Dakle, parcijalni molarni volumen
gdje je V zapremina sistema; parcijalna molarna Gibbsova energija (hemijski potencijal)
gdje je G Gibbsova energija sistema.
Parcijalna molarna vrijednost karakterizira promjenu vrijednosti M kada se 1 mol komponente i doda beskonačno velikoj količini rastvora pod uslovima konstantnosti T, p i broja molova svih ostalih komponenti. Ako je molarni udio x i komponente jednak jedan, tada parcijalna molarna vrijednost Z postaje molarna vrijednost M m za pojedinačnu supstancu (na primjer, parcijalni molarni volumen komponente se pretvara u molarni volumen). Vrijednost Z je određena ne samo prirodom i-te komponente, već i svojstvima sistema u cjelini, budući da molekuli i-te komponente stupaju u interakciju sa svim ostalim molekulima; implicitno, ova vrijednost uzima u obzir sve promjene u svojstvima sistema kada se uvede i-ta komponenta.
U stvarnom rješenju, općenito, sve parcijalne molarne količine zavise od sastava, tlaka i temperature. Ako je rješenje idealno, tada su pri datim T i p parcijalni molarni volumen, unutrašnja energija, entalpija i toplinski kapacitet konstantni u cijelom rasponu koncentracije i poklapaju se s odgovarajućim molarnim vrijednostima čistih komponenti. Hemijski potencijal m i id i parcijalna molarna entropija S i id povezani su s odgovarajućim molarnim vrijednostima čiste tvari - Gibbsovom energijom i entropijom relacijama:
gdje je R gasna konstanta.
Ovisnost parcijalnih molarnih veličina o T i p određena je istim termodinamičkim odnosima kao i za odgovarajuća ekstenzivna svojstva. Dakle, za hemijski potencijal m i ispunjavaju se relacije slične onima koje važe za Gibbsovu energiju, i to:
Funkcija M za sistem u cjelini je zbir parcijalnih molarnih vrijednosti komponenti pomnoženih s odgovarajućim brojevima molova. Konkretno, Gibbsova energija sistema. Molarna (specifična) vrijednost: . Zavisnosti molarne vrijednosti M m od T, p, x 1 , ... , x n-1 koriste se za pronalaženje parcijalnih molarnih veličina:
Promjene parcijalnih molarnih veličina sa promjenom stanja sistema međusobno su povezane Gibbs-Duhemovom jednačinom, koja se u generaliziranom obliku piše na sljedeći način:
Na T, p = const (izobarično-izotermni uslovi):
Prema ovoj jednačini, u binarnom sistemu, parcijalne molarne količine M 1 i M 2 mijenjaju se u suprotnim smjerovima kada se sastav mijenja. Ekstremi na krivuljama M 1 (x 1) i M 2 (x 1), ako ih ima, uočeni su za isti sastav i suprotni su po tipu. Na primjer, za hemijske potencijale
Za T, p = konst
Ovaj odnos se koristi za izračunavanje hemijskog potencijala komponente rastvora na osnovu koncentracijske zavisnosti hemijskih potencijala preostalih komponenti, a koristi se i za proveru termodinamičke konzistentnosti eksperimentalnih podataka o zavisnosti hemijskih potencijala o sastavu, temperaturi, itd.
2. Metode za određivanje parcijalnih molarnih veličina
Za određivanje parcijalnih molarnih vrijednosti neophodna je ovisnost općeg ekstenzivnog svojstva otopine o njegovom sastavu ili ovisnost parcijalne molarne vrijednosti jedne od komponenti o sastavu otopine.
Metode za određivanje parcijalnih molarnih veličina dijele se na analitičke i grafičke.
2.1 Analitičke metode
Ako je ovisnost općeg ekstenzivnog svojstva rješenja o broju molova svake komponente poznata, na primjer, u obliku interpolacijske jednačine, tada se parcijalne molarne količine određuju diferenciranjem interpolacijske jednačine za ekstenzivno svojstvo sa u odnosu na broj molova ove komponente.
Zamjenjujući odgovarajuću vrijednost u rezultirajuću jednadžbu, izračunajte parcijalnu molarnu vrijednost ove komponente za rješenje određenog sastava.
U velikom broju slučajeva, fizičko-hemijske metode omogućavaju pronalaženje samo jedne od funkcija - . Na primjer, iz tlaka pare otopina nehlapljivih otopljenih tvari može se pronaći samo parcijalna vrijednost rastvarača. Ako je poznata ovisnost parcijalne molarne vrijednosti jedne komponente o sastavu otopine, parcijalna molarna vrijednost druge komponente može se izračunati pomoću Gibbs-Duhemove jednadžbe.
Neka je za binarno rješenje molski udio rastvarača x 1, a molski udio otopljene tvari x 2 ili x.
Neka je, na primjer, poznato u cijelom rasponu vrijednosti x. Iz jednadžbe
slijedi da:
Pogodno je integrirati iz sastava x = 1 na proizvoljnu vrijednost x = b:
Ovo je molarna vrijednost za čistu drugu komponentu, koja se može mjeriti bez obzira na svojstva rastvora koji se proučava. U ovom slučaju potrebno je znati graničnu vrijednost veličine (0), tj. za x>1.
2.2 Grafičke metode
Metoda grafičke diferencijacije
Da bi se odredile parcijalne molarne vrijednosti prema eksperimentalnim podacima, crta se graf ovisnosti općeg ekstenzivnog svojstva otopine o broju molova date komponente.
Tangent ugla tangente na krivu u bilo kojoj tački odgovarat će parcijalnoj molarnoj vrijednosti ove komponente u otopini ovog sastava, budući da
Ova metoda nije dovoljno precizna zbog mogućih grešaka pri crtanju tangenata i omogućava vam da odredite samo jednu od parcijalnih molarnih veličina.
Metoda segmenta.
Segmentna metoda se koristi za određivanje parcijalnih molarnih vrijednosti binarnih otopina. Eksperimentalno se utvrđuje ovisnost ekstenzivnog svojstva Z od sastava za jedan mol otopine i crta se grafik u koordinatama Z - x, gdje je x molski udio druge komponente. Tip grafikona može biti bilo koji. Zadatak je pronaći vrijednosti i za sve vrijednosti 0 ? x? 1. Iz definicije = + = + . Postoje dvije nepoznanice u jednačini - i i vrijednost poznata iz iskustva. Neophodna za definiciju i druga jednačina se dobija diferencijacijom po x.
Uzimajući u obzir prethodne jednačine, zbir posljednja dva člana je jednak 0, a zatim
Kvalitativna analiza grafa zavisnosti pokazuje da su segmenti odsečeni tangentom na krivulju željene vrednosti i. Kako je apscisa jedan segment, tangenta nagiba jednaka je segmentu, a to je razlika u vrijednostima.
Za rješenje bilo kojeg sastava
Vrijednosti i mogu se naći iz eksperimentalne krivulje.
Grafičko određivanje parcijalne molarne vrijednosti jedne komponente iz poznatih vrijednosti parcijalnih molarnih vrijednosti druge komponente.
Jednačina
može se koristiti za grafičko određivanje parcijalnih molarnih vrijednosti. Kada je grafička integracija zgodna za izgradnju grafa u koordinatama. onda:
se lako određuje površinom ograničenom krivuljom ovisnosti o i osom apscise. Ako je poznato iz nezavisnih izvora, onda je moguće pronaći ukupnu vrijednost
2.3 Izvođenje interpolacione zavisnosti integralne toplote rastvaranja o sastavu
Izrazimo ovisnost integralne topline rastvaranja od broja molova otopljene tvari empirijskom jednadžbom
gdje su a,b,c empirijske konstante. Onda
Napravimo graf u koordinatama, ekstrapolirajmo njegove tačke. Odsječeni segment na y-osi jednak je b, a tangenta nagiba tangente na zakrivljenu tačku jednaka je 2c. Poznavajući integralnu toplinu rastvaranja za rješenje sa datim brojem molova otopljene tvari n 2, nalazimo konstantu a u jednadžbi.
3. Eksperimentalni dio
3.1 Instrumenti i reagensi
1. ULC "Termostat" modul povezan sa računarom.
2. Čaša od 100 ml.
5. NaNO 3 hemijski čist.
7. NH 4 Cl hemijski čist.
3.2 ULC kontrola pomoću računara
1. Univerzalni kontroler se povezuje na PC preko COM porta pomoću posebnog priključnog kabla.
2. Kada je kontroler uključen, potrebno je pokrenuti kontrolni program ULC "Hemija" - elsms2.exe.
3. U prozoru za inicijalizaciju koji se pojavi (“Welcome to ULC”), morate odabrati opciju za rad sa ULC-om - “Rad sa kontrolerom” ili “Učitavanje posla” i ući u ULC kontrolni program pritiskom na dugme “Enter” . Kada odaberete Učitaj zadatak, možete učitati prethodno sačuvanu laboratoriju.
5. Tokom eksperimenta se meri temperatura, tako da je potrebno da podesite interval merenja i broj merenja u odgovarajućem prozoru.
6. S obzirom da se merenje vrši uz mešanje, potrebno je podesiti intenzitet mešanja (npr. 3) i uključiti mešalicu dugmetom „Mešalica“.
7. U toku rada može se izvesti nekoliko eksperimenata, stoga je za svaki eksperiment potrebno navesti, na primjer, težinu uzorka. (Tada će u gornjem desnom uglu grafikona biti naznačena težina uzorka.) Da biste to učinili, u grupi elemenata "Dodatni parametar" odaberite stavku "Općenito" i u polju "Vrijednost" navedite težinu uzorka. Dimenzija je navedena u polju "Dimenzija".
8. Mjerenje se pokreće uključivanjem tipke "Mjerenje". U tom slučaju će se pojaviti prozor statusa mjerenja - "Razmjena podataka sa kontrolerom".
9. Mjerenje treba završiti nakon što se sol otopi, kada je promjena temperature mala i ujednačena. Merenje se završava pritiskom na dugme "STOP". U tom slučaju, eksperimentalni podaci se automatski pohranjuju i instalacija se prebacuje u kontrolni način. Da biste izvršili sljedeća mjerenja, potrebno je pritisnuti dugme "Trenutno stanje" i izvršiti rad u skladu sa paragrafima. 5 - 8.
3.3 Kako obaviti posao
Određivanje integralnih toplina otapanja počinje određivanjem konstante kalorimetra. Da biste to učinili, čaša napunjena sa 100 cm3 destilirane vode stavlja se u kalorimetar i zatvara poklopcem s učvršćenim senzorom temperature. U otvor poklopca se ubacuje posebna epruveta u koju se prethodno ulije 2 g usitnjene soli poznate topline rastvaranja (NH 4 Cl). Izvedite kalorimetrijski eksperiment i zabilježite promjenu temperature. Zatim se rastvor izlije iz čaše, čaša se ispere, u nju se ulije 100 ml destilovane vode i stavi u kalorimetar. Provedite otapanje 2 g ispitivane soli, uz fiksiranje promjene temperature. Na sličan način izvršite otapanje 4, 6, 8, 10, 12, 16, 20 g proučavane soli.
4. Rezultati i diskusija
Određivanje parcijalnih molarnih toplota rastvaranja vrši se jednadžbom toplotnog bilansa:
gdje su i masa vode i soli, respektivno, g;
c je toplotni kapacitet rezultirajućeg rastvora, J/(HMA). Pri niskim koncentracijama, toplinski kapacitet otopine može se približno uzeti jednak toplinskom kapacitetu vode. Pri visokim koncentracijama, toplinski kapacitet otopine može se odrediti iz referentnih podataka. Konstanta kalorimetra određena je formulom:
Određivanje parcijalne molarne toplote KCl:
Određivanje parcijalne molarne toplote NaCl:
Određivanje parcijalne molarne toplote NaNO 3:
, (eksperiment je izveden istog dana)
Određivanje parcijalne molarne topline KNO 3:
Zaključak
Koristeći kalorimetrijska mjerenja, odredili smo vrijednost integralnih toplina rastvaranja za različite koncentracije rezultirajućeg rastvora, izračunali parcijalne toplote rastvaranja, nacrtali zavisnost toplote rastvaranja od sastava rastvora.
Bibliografija
parcijalni molarni interpolacijski integral
1. Stromberg A.G., Semchenko D.P. Fizička hemija. - M.: Hemija, 1999.
2. Kratak priručnik fizičkih i hemijskih veličina / ur. AA. Ravdel, A.M. Ponomereva. - L.: Hemija, 1983.
3. Fizička hemija: I.A. Semjohin - Moskva, Izdavačka kuća MSU, 2001
4. Termodinamička svojstva elektrolita: Vasiliev V.P. - M. Hemija 1982.
5. Fizička hemija. Teorijsko i praktično uputstvo: Nikolsky B.P. - 1987
6. Osnove fizičke hemije: Gorškov V.I. - 1993
7. Kratki kurs Fizička hemija: Kochergin S.M. - 1978
8. Fizička hemija: Zhukhovitsky A.A. - 1987
9. Fizički i koloidna hemija: Kuznjecov V.V. - 1968
10. http://www.xumuk.ru
Aplikacija
rezultate
NH 4 Cl 2g (određivanje konstante kalorimetra) DT = -1,207
KCl 2g DT= -0,9746
KCl 4g DT= -2,333
KCl 6g DT= -2,851
KCl 8g DT = -3,843
KCl 10g DT= -4,738
KCl 12g DT= -5,706
KCl 16g DT = -7,459
KCl 20g DT= -9,314
NH 4 Cl 2g (određivanje kolorimetarske konstante) DT \u003d -1,098
NaCl 2g DT= -0,2461
NaCl 4g DT= -0,5072
NaCl 6g DT= -0,6789
NaCl 8g DT= -0,8499
NaCl 10g DT= -1,008
NaCl 12g DT= -1,125
NaCl 16g DT = -1,303
NaCl 20g DT= -1,397
NaNO 3 2g DT = -0,7792
NaNO 3 4g DT= -1,616
NaNO 3 6g DT = -2,333
NaNO 3 8g DT = -3,143
NaNO 3 10g DT= -3,745
NaNO 3 12g DT = -4,222
NaNO 3 16g DT = -5,253
NaNO 3 20g DT= -6.436
NH 4 Cl 2g (određivanje kolorimetarske konstante) DT \u003d -1,162
KNO 3 2g DT= -1,164
KNO 3 4g DT= -2.334
KNO 3 6g DT= -3,415
KNO 3 8g DT= -0,725
KNO 3 10g DT= -4.878
KNO 3 12g DT= -5.954
KNO 3 16g DT= -7.369
NH 4 Cl (određivanje kolorimetarske konstante) DT= -1,085
KNO 3 20g DT= -4.575
Dijagram DH naspram n i (KCl)
Dijagram DH naspram n i (NaCl)
Dijagram DH naspram n i (NaNO 3)
Dijagram DH naspram n i (KNO 3)
Hostirano na Allbest.ru
...Slični dokumenti
Glavni pravci razvoja teorije rješenja. Termodinamički uslovi formiranje rastvora. Metode za određivanje parcijalnih molarnih veličina. Raoultov zakon, krajnje razvodnjena i neidealna rješenja. Azeotropne smjese i Gibbs-Konovalov zakoni.
seminarski rad, dodan 24.12.2014
Određivanje zapremine vazduha potrebnog za potpuno sagorevanje date količine propana. Proračun promjene entalpije, entropije i Gibbsove energije, korištenjem posljedica Hessovog zakona. Definicija molarne mase ekvivalenti oksidacionog agensa i redukcionog sredstva.
test, dodano 08.02.2012
Razmatranje teoretskih podataka o parcijalnim molarnim svojstvima komponenti otopine. Određivanje zapremine, entropije, entalpije i toplotnog kapaciteta u binarnom rastvoru. Proračun masene gustine vodenih otopina ispitivane tvari različitih koncentracija.
priručnik za obuku, dodan 24.05.2012
Međusobna povezanost parcijalnih katodnih i anodnih reakcija na bakrenoj elektrodi u otopinama s oksidansom bez kisika pri znakovno-alternirajućoj polarizaciji. Anodno otapanje bakra u hloridnim i sulfatnim medijima. Otapanje u zakiseljenom sulfatnom mediju.
rad, dodato 13.12.2015
Mjerenje električne provodljivosti razrijeđenih otopina litijum tetrafluoroborata u propilen karbonatu. Proračun graničnih molarnih električnih provodljivosti i asocijacijskih konstanti. Definicija kvantitativne karakteristike jonsko-molekularne interakcije.
seminarski rad, dodan 28.10.2011
Priprema polimernih otopina: proces rastvaranja polimera; filtriranje i odzračivanje rastvora. Faze proizvodnje filmova sa polimernim rastvorom. Opšti zahtjevi za plastifikatore. Priprema otopine za kalupljenje. Formiranje tečnog filma.
seminarski rad, dodan 04.01.2010
Reaktor idealne zapremine. Reaktor za potpuno miješanje. Promjena brzine oksidacije SO. Proračun promjene temperature kroz adijabatski koeficijent. Proračun ravnotežnih koncentracija supstanci, konstante ravnoteže. proračun parcijalni pritisci.
seminarski rad, dodan 20.11.2012
Definicija rješenja, njihove vrste ovisno o tome stanje agregacije rastvarača, prema veličini čestica otopljene tvari. Načini izražavanja koncentracije. Faktori koji utiču na rastvorljivost. mehanizam rastvaranja. Raoultov zakon i njegova posljedica.
prezentacija, dodano 08.11.2013
Proračun konstante ravnoteže procesa rasta monokristala. Proces sublimacije Cd i Te komponenti. Proračun parcijalnih pritisaka pare komponenti. Šematski dijagram reaktora i raspodjela temperature. Procjena mogućnosti oksidacije komponenti.
rad, dodato 11.12.2016
Klasifikacija grešaka prema načinu izražavanja, izvoru nastanka iu zavisnosti od uslova eksperimenta. Procjena općih parametara i raspodjela slučajne varijable. Metode za otklanjanje grubih grešaka. Poređenje dvije varijanse.
Formiranje rastvora iz komponenti je spontani proces. Stoga je termodinamički uvjet za formiranje otopine pri P= konst i T= konst je gubitak Gibbsove energije Δ G < 0. Такой процесс будет протекать самопроизвольно до тех пор, пока в системе не установится равновесие: растворяемый компонент (т, ж, г) растворяемый компонент (раствор). При равновесии ΔG= 0. Izuzetak su termodinamički nestabilne prezasićene otopine. Sa stajališta termodinamike, otopina se naziva zasićena kada je kemijski potencijal čiste otopljene tvari (čvrste, tekuće, plinovite) jednak kemijskom potencijalu ove tvari u otopini.
Smanjenje Gibbsove energije tokom formiranja rastvora može biti posledica doprinosa i entalpije i entropije, jer Δ G= Δ H– TΔ S.
Karakteristika termodinamičkog pristupa rastvorima je da ne zahteva ideje o molekularnom mehanizmu interakcije u rastvorima. Glavno pitanje u ovom pristupu je utvrđivanje zavisnosti svojstava rastvora o sastavu i svojstvima njegovih komponenti. Za uspostavljanje takve zavisnosti koriste se parcijalne molarne količine.
§ 5.5. Parcijalne molarne količine
Većina svojstava koja se mogu kvantificirati mogu se podijeliti u dvije grupe, ekstenzivne i intenzivne.
opsežna svojstva su proporcionalna količini supstanci. To uključuje, na primjer, volumen ( V često), masa, unutrašnja energija ( U često), entropija ( S često), entalpija ( H često), Gibbsova energija ( G često) i dr. Dakle, unutrašnja energija dva identična komada metala je dvostruko veća od energije jednog komada. Ekstenzivna svojstva sistema se dodaju aditivno iz ekstenzivnih svojstava njegovih sastavnih dijelova.
intenzivan nazivaju svojstva koja ne zavise od količine supstance (kao što su temperatura i pritisak). Za otopine, intenzivna svojstva su određena sastavom. Na primjer, tlak pare komponente iznad otopine ovisi o njenoj koncentraciji. Vrijednosti intenzivnih svojstava u različitim dijelovima sistema teže da se izjednače. Mjerenje intenzivne veličine zasniva se na činjenici da je njena promjena uvijek praćena promjenom neke ekstenzivne veličine. Dakle, za mjerenje temperature koristi se promjena volumena tvari, na primjer, žive, tj. ekstenzivno vlasništvo.
Razmotrimo dvokomponentnu otopinu koja se sastoji od rastvarača i otopljene tvari. Bilo koje od njegovih ekstenzivnih svojstava X često, zavisi od broja mladeža P 1 rastvarač, mol P 2 rastvorena materija, pritisak R i temperaturu T:
Označite
|
|
Parcijalna molarna vrijednost i-ta komponenta rastvora (  ) naziva se parcijalni izvod neke ekstenzivne veličine ( X često) po broju molova ove komponente ( n i) at konstantan pritisak, temperaturu i broj molova ostalih komponenti.
) naziva se parcijalni izvod neke ekstenzivne veličine ( X često) po broju molova ove komponente ( n i) at konstantan pritisak, temperaturu i broj molova ostalih komponenti.
Ista ideja se može izraziti u drugom obliku: parcijalnom molarnom količinom i-ta komponenta je promjena ovog opsežnog svojstva otopine kada se doda jedan mol i komponentu na veliku količinu rastvora pri konstantnom pritisku i temperaturi. Velika količina otopine znači da se dodavanjem jednog mola i komponenta praktično ne mijenja sastav otopine.
Za čistu tvar, parcijalna molarna vrijednost jednaka je svojstvu čiste tvari
|
|
gdje indeks "nula" znači da je supstanca u čistom stanju.
Termodinamička svojstva otopine G često ,
H često ,
S često ,
V često itd. odgovaraju parcijalnim molarnim količinama i-ta komponenta:  je parcijalna molarna Gibbsova energija;
je parcijalna molarna Gibbsova energija; 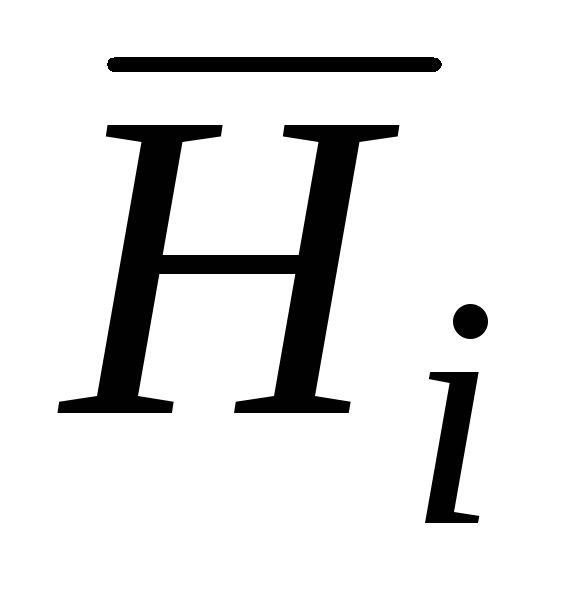 je parcijalna molarna entalpija;
je parcijalna molarna entalpija; 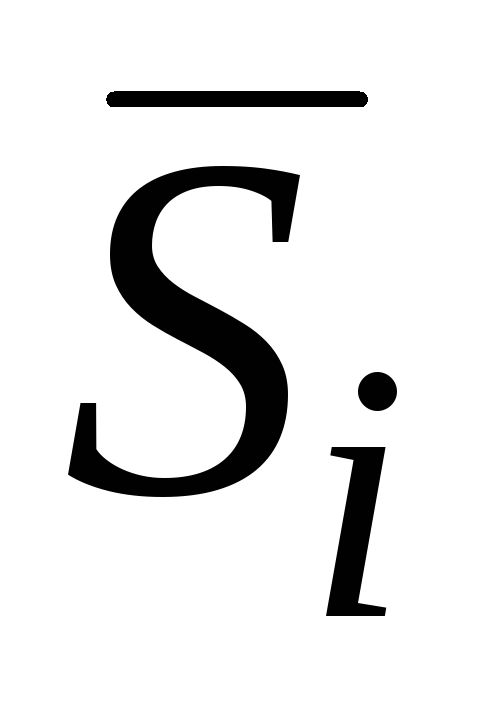 je parcijalna molarna entropija;
je parcijalna molarna entropija;  - parcijalni molarni volumen itd.
- parcijalni molarni volumen itd.
Među parcijalnim molarnim veličinama, najvažnija je parcijalna molarna Gibbsova energija 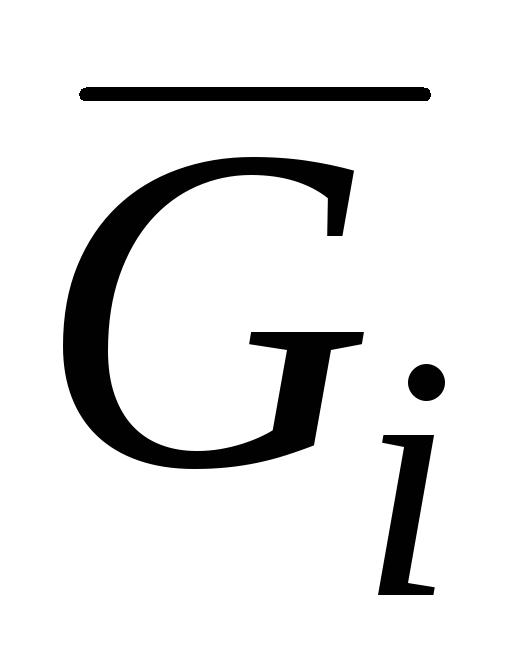 , što je identično hemijskom potencijalu:
, što je identično hemijskom potencijalu:
|
|
što slijedi iz poređenja jednačina (3.3) i (5.6) .
Praktični značaj parcijalnih molarnih veličina leži u činjenici da se između njih održavaju isti termodinamički odnosi u obliku kao i između običnih termodinamičkih veličina.
Na primjer, ako je Gibbsova energija u jednadžbi () (G= H– TS) uzeti derivaciju u odnosu na broj molova n i sa postojanošću P, T i n j, dobijamo
|
| |||||
|
μ i
|
hemijski potencijal i-th komponenta; parcijalna molarna Gibbsova energija i-th komponenta; parcijalna molarna entalpija i-th komponenta; parcijalna molarna entropija i-th komponenta. |
||||
Dakle, uz pomoć parcijalnih molarnih veličina, na rješenja se može primijeniti čitav matematički aparat kemijske termodinamike za čistu tvar. To omogućava da se termodinamičkim jednadžbama izraze bilo koja svojstva ravnoteže otopine, koja uključuju pritisak pare komponenti iznad otopine, smanjenje točke smrzavanja i povećanje točke ključanja otopine, topljivost tvari, osmotski pritisak, raspodela supstance između dva rastvarača koja se ne mešaju, itd.
Da bismo izveli odnose između parcijalnih molarnih vrijednosti komponenti rješenja, integriramo jednačinu (5.7) pri konstantnom sastavu rastvora. Ovaj uvjet znači da se obje komponente dodaju otopini u malim porcijama i u takvom omjeru da se sastav otopine ne mijenja (tj. dodaju se male količine otopine iste koncentracije). Tada će parcijalne molarne količine ostati konstantne. Gde
|
|
Konstanta integracije u ovoj jednačini jednaka je nuli, budući da je at P 1 = 0 i P 2 = 0 svojstva maltera X često je takođe jednako nuli.
Dakle, bilo koje opsežno svojstvo može se pronaći iz svojstava komponenti za bilo koju otopinu dodavanjem aditiva, ako se koriste ne molarne, ali parcijalne molarne vrijednosti.
Ako se, međutim, i količina i sastav otopine mijenjaju istovremeno, tada promjena svojstva X često može se naći diferenciranjem jednačine (5.10) :
Odvajamo obje strane jednačine (5.10) i (5.12) na P 1 + P 2. S obzirom na to
odnosno dobijamo
mol rastvora naziva se njegova količina, u kojoj je broj molova svake komponente jednak njenom molskom udjelu.
Za rješenje od i sabiranje komponenti mora se obaviti preko svih i komponente:
Parcijalne molarne veličine koje karakteriziraju promjenu ekstenzivnih svojstava otopine mogu biti, za razliku od samih svojstava, i pozitivne i negativne. Ako se otopina formira od komponenti bez promjene volumena, onda je očito da je parcijalni molarni volumen komponente jednak njenom molarnom volumenu. Ako zbog jake molekularne interakcije, kada se komponenta doda u otopinu, dođe do smanjenja volumena, tada će parcijalni molarni volumen biti negativna vrijednost.
Parcijalne molarne vrijednosti binarnih sistema mogu se odrediti analitičkim i grafičkim metodama. Najčešće korišteni grafička metoda segmentima. Da bi se to postiglo, prema eksperimentalnim podacima, gradi se grafička zavisnost ekstenzivnog svojstva, na primjer, molarni volumen otopine od sastava (slika 5.1.).
Zatim, sa datom kompozicijom (na primjer, u tački ALI) nacrtajte tangentu na krivu. Presjek ove tangente sa ordinatnim osa u tačkama AT i OD daje vrijednosti parcijalnih molarnih veličina 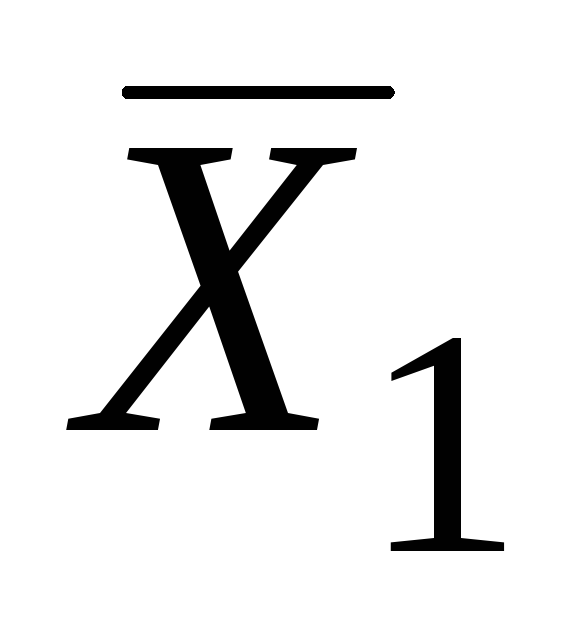 i
i 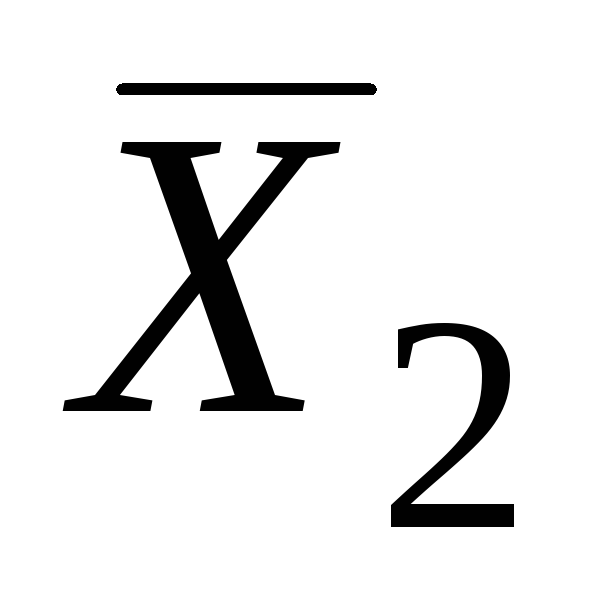 .
.
Parcijalne molarne vrijednosti mogu se odrediti i iz ovisnosti o svojstvima otopine X o broju molova otopljene komponente pri konstantnoj temperaturi tlaka i količini rastvarača. Tangenta nagiba tangente na krivulju na grafu X često = f(n 2) jednak je parcijalnoj molarnoj vrijednosti.

Parcijalna molarna vrijednost jedne komponente može se izračunati iz jednačine (5.14) , znajući parcijalnu molarnu veličinu drugog:
|
Integracijom ove jednačine dobijamo
| ||||
|
|
parcijalne molarne vrijednosti za različite sastave sistema. |
|||
Vrijednost integrala se nalazi iz grafikona ucrtanog u koordinatama  .
.