Standart qiymatlarning Gibbs energiya jadvali. Moddalar hosil bo'lishning standart entalpiyalari, standart entropiyalar va moddalar hosil bo'lishning standart Gibbs energiyalari.
DH o6p, m (298 K) moddaning hosil bo'lishining standart molyar entalpiyasi - 298 K haroratda va bosim ostida ularning standart holatlarida uning tarkibiy elementlaridan bir mol moddaning hosil bo'lishi paytida entalpiyaning o'zgarishi. bitta atmosfera.
Keling, ushbu ta'rifni yuqorida keltirilgan misollar bilan taqqoslaylik. Biz ishonch hosil qildik
vodorodning oksidlanishi kamida uch xil bilan ifodalanishi mumkin stoxiometrik tenglamalar. Shunday qilib, biz kamida uchta turli xil standart molyar entalpiyalarni bilamiz:
a) DH°t (298 K, 2H20(l.)) = - 571,6 kJ/mol
b) DH°t (298 K, H20(l.)) = - 285,8 kJ/mol
c) DH°t (298 K, H2O(T.)) = - 241,8 kJ/mol
Ushbu qiymatlardan qaysi biri suv hosil bo'lishining standart molyar entalpiyasiga to'g'ri keladi? (c) qiymati unga mos kela olmaydi, chunki 298 K da suvning standart holati bug '(gazsimon) holat emas, H20(g) belgisiga mos keladi. Suv hosil bo'lishining standart molyar entalpiyasi qolgan ikkita qiymatdan biriga ega bo'lishi mumkin, ularning orasidagi farq reaktsiya tenglamasi qanday yozilishi bilan belgilanadi. Biroq, hosil bo'lishning standart molyar entalpiyasining yuqoridagi ta'rifi uning hosil bo'lgan moddaning har bir moliga entalpiya o'zgarishiga mos kelishini ko'rsatganligi sababli (b) variantni tanlash kerak. Shunday qilib, suv hosil bo'lishining standart molyar entalpiyasi\u003d - 285,8 kJ / mol.
Jadvalda. 5.1-jadvalda ba'zi umumiy moddalarning standart holatlarida hosil bo'lishining standart molyar entalpiyalari keltirilgan. E'tibor bering, jadval nafaqat moddalarni, balki ba'zi ionlarni ham o'z ichiga oladi. Ionlar va ko'pgina birikmalarni ularni hosil qiluvchi elementlardan to'g'ridan-to'g'ri sintez qilib bo'lmaydi. Biroq, ularning standart shakllanish entalpiyalarini Hess qonuni yordamida hisoblash mumkin (bu haqda biz 5.3-bo'limda bilib olamiz).
Ko'pgina birikmalar manfiy hosil bo'lish entalpiyasi bilan tavsiflanadi. Shuning uchun ular ekzotermik birikmalar deb ataladi. Faqat bir nechta birikmalar ijobiy hosil bo'lish entalpiyasiga ega. Ular endotermik birikmalar deb ataladi. Endotermik birikmaga benzol misol bo'la oladi.
Qattiq birikmalarning hosil bo'lish entalpiyalari, qoida tariqasida, gazlarning hosil bo'lish entalpiyalariga qaraganda kattaroq (mutlaq qiymatda) salbiy qiymatlarga ega ekanligiga e'tibor qaratish lozim. Modda yoki ion hosil bo'lishining standart molyar entalpiyasi ma'lum birikma hosil qiluvchi elementlarga nisbatan uning barqarorligi o'lchovidir. Murakkab hosil bo'lish entalpiyasining manfiy qiymati (mutlaq qiymatda) qanchalik ko'p bo'lsa, bu birikma shunchalik barqaror bo'ladi.
Ta'rifga ko'ra, har qanday elementning standart holatida 298 K da hosil bo'lishining standart molyar entalpiyasi nolga teng. Masalan, DH (298 K, 02(g)) = 0.
5.1-jadval. Shakllanishning standart molyar entalpiyalari
Modda |
DN(298 K), kJ/mol |
Modda |
D298 K), kJ/mol |
Benson bo'yicha ideal gaz xossalarini hisoblash uchun guruh komponentlari
Sikloalkanlar
Asetilen uglevodorodlari
aromatik uglevodorodlar
Shakllanish entalpiyasi
Shakllanish entalpiyasini bashorat qilish
Benson usulida organik birikmalarni birinchi muhitga ega atomlardan bashorat qilish
Ideal gaz holati uchun Benson usulining ba'zi ko'p valentli guruhlari
KIRISH
Kimyoviy texnologiya jarayonlari va ularni amalga oshirish uchun uskunalarni ishlab chiqishning eng yaxshi yechimi faqat kimyoviy birikmalarning fizik-kimyoviy va termodinamik xususiyatlari to'g'risida ishonchli ma'lumotlar bilan mumkin. Bunday ma'lumotlar ko'pincha dizayn kiritishning 50-90% ni tashkil qiladi.
Amaliyot uchun eksperimental ma'lumotlar afzalroqdir. Yillar davomida bunday ma'lumotlarning katta miqdori to'plandi va qayta ishlandi. Ushbu ma'lumot ko'plab kompilyatsiya va ma'lumotnomalarda mavjud. Ulardan ba'zilarida termodinamik va fizik-kimyoviy xususiyatlarning hozirgi vaqtda ma'lum bo'lgan barcha qiymatlari berilgan va ularning tanqidiy tahlili berilgan. Boshqalar faqat mualliflar tomonidan tavsiya etilgan qiymatlarni o'z ichiga oladi, ko'pincha o'rtacha qiymatlar yoki to'plangan ma'lumotlarning butun majmuasini statistik ishlov berish natijasidir. Biroq, texnologiyaning jadal rivojlanishi va sohaga tobora ko'proq yangi moddalar va materiallarning kiritilishi ma'lumotlarga bo'lgan ehtiyoj va ularning mavjudligi o'rtasida sezilarli farqni keltirib chiqaradi. Davlat va kompozitsiyalarning keng parametrlarida eksperimental qiymatlarni aniqlash ko'pincha qiyin, ba'zan esa imkonsizdir.
Shu sababli, muhandis ko'pincha moddalarning xususiyatlarini hisoblash va bashorat qilishning turli usullariga tayanishga majbur bo'ladi. Shuni yodda tutish kerakki, "hisoblash" va "prognoz" atamalari ko'pincha bir-birining o'rnida ishlatiladi, garchi ularning ikkinchisi natija faqat qisman to'g'ri bo'lishi mumkinligini halol tan oladi. Hisob-kitoblar nazariyaga, eksperimental qiymatlarning korrelyatsiyasiga yoki ikkalasining kombinatsiyasiga asoslangan bo'lishi mumkin.
Shakllanish entalpiyasi
Shakllanish entalpiyasi ko'pgina nazariy va amaliy muammolarni hal qilishda qo'llaniladigan asosiy xususiyatdir. Reagentlarning hosil bo'lish entalpiyalarini bilish, reaksiya zonasida adiabatik harorat farqini baholashda, reaktor dizayni va kimyoviy jarayonning texnologik xususiyatlariga talablarni shakllantirishda zarur bo'lgan qiziqish reaktsiyalarining issiqlik effektlarini hisoblash imkonini beradi. Moddalarning hosil bo'lish entalpiyalari jarayonlarning miqdoriy termodinamik tahlilini o'tkazishda, reagentlarning nazariy konversiya darajasini aniqlashda, o'tkazish shartlarini tanlashda zarurdir. kimyoviy transformatsiya va h.k. Amalga oshirilgan termodinamik tahlilning sifati ko'p jihatdan moddalarning hosil bo'lish entalpiyalari haqidagi ma'lumotlarning ishonchliligiga bog'liq.
Entalpiya birliklari kJ/mol va J/mol. O'tgan yillardagi ma'lumotnomalarda, hosil bo'lish entalpiyalari ko'pincha kkal / mol (1 kal = 4,184 J, 1 kkal = 4,184 kJ) ko'rsatilgan.
Tor ma'noda bog'lanishning hosil bo'lish entalpiyasi () hisoblanadi standart elementlardan berilgan moddaning hosil bo'lish reaksiyasidagi entalpiya o'zgarishi yoki oddiy moddalar. Oddiy moddalar - bu tabiiy fazada va kimyoviy holatda hisoblangan haroratda bo'lgan kimyoviy elementlar.
Moddaning standart holati sifatida ushbu modda 1 atm (101325 Pa) standart bosimda barqaror bo'lgan holat tanlanadi. Moddaning kondensatsiyalangan holati uning bosimi bo'lgan haroratgacha standartdir to'yingan bug ' 1 atm ga etadi. Ushbu haroratlardan yuqori bo'lgan ideal gaz holati standart sifatida tanlanadi.
Ko'pgina organik birikmalarning molekulalarini hosil qilishda ishtirok etadigan oddiy moddalar uchun 298,15 K da standart holat:
uglerod uchun - grafit;
vodorod, kislorod, azot, ftor va xlor uchun - ideal diatomik gaz;
brom uchun, ikki atomli suyuqlik;
yod va oltingugurt uchun - mos ravishda kristalli holat, diatomik va monotomik.
Mutlaq entalpiya qiymatlarini aniqlab bo'lmaydi, chunki ular mutlaq qiymatlarni o'z ichiga oladi ichki energiya. Birikmalarning hosil bo'lish entalpiyalarini aniqlash zarurati xalqaro kelishuvga erishishni talab qildi, unga ko'ra standart holatdagi elementlar va oddiy moddalarning qiymatlari nolga tenglashtirildi.
Murakkab molekulyar tuzilishga ega bo'lgan moddalarning kattaligi va belgisi har xil bo'lishi mumkin. Bu quyidagicha izohlanadi. Erkin atomlardan moddaning paydo bo'lishi har doim energiyaning chiqishi bilan birga keladi, natijada olingan moddalar manfiydir. Biroq, modda ikki atomli molekulalardan (H 2, O 2, N 2, Cl 2 va boshqalar) tashkil topgan oddiy moddalardan yoki kondensatsiyalangan holatda (uglerod, brom va boshqalar) hosil bo'lganda, ma'lum miqdorda energiya hosil bo'ladi. bu oddiy moddalar molekulalaridagi aloqalarni uzish yoki ularni gazsimon holatga o'tkazish uchun talab qilinadi. Natijada, hosil bo'lish entalpiyasi ham ijobiy, ham salbiy bo'lishi mumkin va nolga teng.
Umumiy holda, qiymat va belgi moddaning termodinamik barqarorligi to'g'risida hech qanday bayonot uchun asos bermaydi, chunki u nafaqat entalpiyaga, balki bu hosil bo'lganda erkin energiyaning o'zgarishining entropiya komponentiga ham bog'liq. modda. Shunga qaramay, bir xil homolog guruh vakillarining yoki o'xshash molekulyar tuzilishga ega birikmalarning termodinamik barqarorligini solishtirish uchun, birinchi yaqinlashishda ularning hosil bo'lish entalpiyalarini tahlil qilish juda ma'lumotli bo'lishi mumkin. Bunday holda, hosil bo'lish entalpiyasi past bo'lgan modda ko'proq termodinamik barqarorlikka ega.
Ko'pgina birikmalar uchun ularning oddiy moddalardan hosil bo'lish reaktsiyalarini amalda bajarib bo'lmaydi. Organik birikmalarning hosil bo'lish entalpiyalari to'g'risidagi faktik ma'lumotlarning asosiy manbai kaloriyametrik usul bilan olingan ularning yonish entalpiyalari () bo'yicha eksperimental ma'lumotlardir. Bugungi kunga qadar to'plangan va tavsiya etilgan qiymatlar va kompilyatsiyalarda mavjud. Hozirgacha ma'lumot to'g'risida ma'lumot faqat kalorimetrik ma'lumotlar bilan ta'minlangan. Zamonaviy empirik prognozlash usullari ham faqat kalorimetrik ma'lumotlarga asoslanadi. Shu bilan birga, shuni ta'kidlash kerakki, kimyoviy muvozanatni o'rganish natijalarida ishtirok etadigan moddalar doirasi, o'tkazilgan tadqiqotlar hajmi va olingan termodinamik xususiyatlarning aniqligi bo'yicha yagona bo'lgan ma'lumotlar mavjud. Bizning fikrimizcha, ushbu ma'lumotlardan samarali foydalanish organik moddalarni massaviy hisoblash usullarining prognostik imkoniyatlarini sezilarli darajada kengaytiradi.
SHAKLLANISH ENTALPİYASINI PROGNOZ BERISH
Organik birikmalarning hosil bo'lish entalpiyalarini bashorat qilishning asosiy usullari, ya'ni ular moddaning 1 atm bosimdagi ideal gaz holatidagi xususiyatini tavsiflaydi. va odatda standart deb ataladigan 298,15 K harorat. Ommaviy hisoblash usullari orasida molekulyar mexanika va qo'shimchalar usullariga alohida e'tibor berilishi kerak (lat. qo'shimcha- qo'shimcha). Ko'pgina yarim empirik usullar kerakli prognoz sifatini ta'minlamaydi. Empirik bo'lmagan usullar moddalarning hosil bo'lish entalpiyalariga to'g'ridan-to'g'ri kirish imkonini bermaydi va bundan tashqari, murakkab molekulyar tuzilishga ega bo'lgan organik moddalarning xususiyatlarini hisoblash uchun hali ham mavjud emas.
Molekulyar mexanika usullari guruhida biz MMX usulidan foydalanish bo'yicha katta tajriba to'pladik. kuch maydoni Ellinger). Usul alkanlarni qo'llashda o'zini yaxshi isbotladi. Biroq, hatto aromatik birikmalar uchun ham, uni hosil bo'lish entalpiyalarini hisoblash uchun emas, balki molekuladagi o'rinbosarlarning o'zaro ta'sirining ta'sirini baholash uchun ishlatish tavsiya etiladi, ya'ni. izomerlarning hosil bo'lish entalpiyalaridagi farqlar uchun. Ko'pgina organogalogen, kislorod, azot va oltingugurt o'z ichiga olgan birikmalar uchun usul noxolis baholarni beradi. Biroq, bu usul mulkni ekspress baholash uchun barcha holatlarda qo'llanilishi kerak. Boshqa har qanday usul singari, u natijalarni boshqa prognozlash usuli bilan olingan ma'lumotlar bilan qo'llab-quvvatlashni talab qiladi. Molekulyar mexanika usuli mukammal interfeysga ega va molekulalarning tuzilishi va ularning geometrik parametrlari haqida ma'lumot manbai sifatida juda samarali.
Prognozlash uchun ma'lumotnomalar mavjud bo'lmaganda, hozirgi vaqtda turli xil qo'shimcha usullar keng qo'llaniladi. Ideal gaz holatida organik moddalarning xususiyatlarini bashorat qilishning asosiy qo'shimcha usullari yaratilganidan beri sezilarli vaqt o'tdi, ammo molekulyar modellashtirishning tobora ommalashib borayotgan usullariga qaramay, ular o'z ahamiyatini saqlab qoldi. Bu usullar molekuladagi bir xil turdagi fragmentlar sonining o'zgarishi bilan xossa chiziqli ravishda o'zgargan hollarda samarali bo'ladi. Qattiq qo'shimchalar, masalan, moddaning molekulyar og'irligi. Organik birikmalarning hosil bo'lish entalpiyalari uchun qo'shimcha yondashuv ko'p hollarda hisoblashda faqat bir oz yaqinlikdir. Gap shundaki, gomologik guruhda ham u molekuladagi uglerod atomlari sonining o'zgarishi bilan chiziqli bo'lmagan holda o'zgaradi (1.1-rasm).
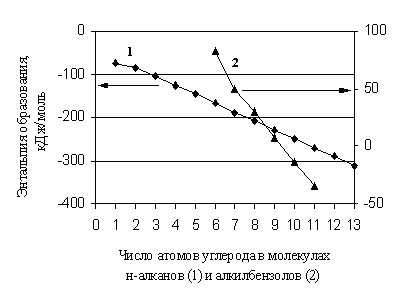
Guruch. 1.1. n-alkanlar va alkilbenzollar hosil boʻlish entalpiyasining ularning molekulalaridagi uglerod atomlari soniga bogʻliqligi.
Shunday qilib, gomologik farq, ayniqsa, gomologik guruhlarning birinchi a'zolari uchun doimiy qiymat emas. Xuddi shu tarzda, organik moddalar molekulalarida bir xil turdagi o'rinbosarlar sonining ko'payishi bilan ko'pincha qo'shimchalardan og'ish haqida gapirish kerak. Biroq, qo'shilmaganlik uchun tuzatishlar kiritilganda, ushbu guruhning usullari, agar ularning tafsilotlari darajasi va chuqurligi etarli bo'lsa va zamonaviy tajribaning aniqligiga mos keladigan bo'lsa, qoniqarli ishlaydi.
Qabul qilingan mafkuraga qarab, qo'shimcha usullarda strukturaviy va miqdoriy axborot tashuvchilar atomlar, atomlar guruhlari yoki molekulani tashkil etuvchi bog'lanishlar bo'lishi mumkin. Ko'pgina prognozlash usullari shunday yaratilganki, shakllanish entalpiyalari bo'yicha ma'lumotlar bazasi kengayib borishi bilan qisman hissalarning qiymatlari nisbatan osonlik bilan aniqlanishi yoki yangi tuzatishlar kiritilishi mumkin.
Moddalarning hosil bo'lish entalpiyalarini bashorat qilishning umumiy yondashuvi, agar kerak bo'lsa, boshqa haroratlarda hosil bo'lishning ideal gaz entalpiyalariga o'tish bilan hisoblashni o'z ichiga oladi yoki k , ya'ni. real holatdagi materiya xususiyatiga.
Turli xil qo'shimchalarni hisoblash usullaridan ikkitasini ko'rib chiqamiz; Birinchi muhitga ega atomlar uchun Bensonning guruh usuli va bog'lanish uchun Tatevskiy usuli.
Benson usulida organik birikmalarni birinchi muhitga ega atomlar uchun bashorat qilish
Shuni tan olish kerakki, organik moddalarning hosil bo'lish entalpiyalarini bashorat qilish uchun barcha xilma-xil qo'shimcha sxemalar ichida Benson usuli uzoq vaqt davomida eng keng tarqalgan. Bu, ehtimol, bu usul aralashmalarning eng keng doirasini qamrab olganligi bilan izohlanadi. Hech qanday texnik vositalarni jalb qilmasdan aralashmalarning katta qismini tezkor baholash uchun usul, ehtimol, teng bo'lmaydi. Ko'rinib turibdiki, uning universalligining bahosi prognozning to'g'riligidir. Shuning uchun, usuldan foydalanganda, uning muqarrar cheklovlaridan xabardor bo'lish kerak. Biz potentsial foydalanuvchilarning e'tiborini usulni keng ko'lamli sinovdan o'tkazishimiz natijasi bo'lgan asosiylariga qaratishga harakat qilamiz.
Benson usuli odatda guruh usuli deb ataladi, garchi atom birinchi hamrohlari bilan. Usul muallif tomonidan moddalarning quyidagi ideal gaz xossalarini hisoblash uchun ishlab chiqilgan: issiqlik sig'imi 100 darajaga karrali haroratlarda, hosil bo'lish entalpiyasi va entropiya.
Tizimning entalpiyasi. standart shartlar. Moddaning hosil bo'lish entalpiyasi. Reaksiya entalpiyasi. Endotermik va ekzotermik reaksiyalar.
Tizimning entalpiyasi (yunoncha entalpo I issiqlikdan) psᴛᴏ mustaqil entropiya parametrlari S va bosimi P bo'lgan termodinamik tizim holatining bir qiymatli H funktsiyasi bo'lib, u H munosabati bilan ichki energiya U bilan bog'liq. =U+PV, bu erda V - sistemaning hajmi.Kimyoda ko'pincha izobar jarayonlar (P = const) deb hisoblanadi va bu holda issiqlik effekti tizim entalpiyasining o'zgarishi yoki deyiladi. jarayonning entalpiyasi: Qp = ∆H; ∆H=∆U+P∆V. Entalpiya energiya (kJ) o'lchamiga ega. Uning qiymati moddaning miqdori bilan mutanosibdir; moddaning birlik miqdorining entalpiyasi (mol) kJ∙mol–1 da oʻlchanadi.Termodinamik tizimda kimyoviy jarayonning ajralib chiqqan issiqligi manfiy (ekzotermik jarayon, DH) hisoblanadi.< 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH >0. Jarayonning entalpiyasini ko'rsatuvchi kimyoviy reaksiyalar tenglamalari termokimyoviy deyiladi. DH entalpiyasining raqamli qiymatlari kJ da vergul bilan ko'rsatilgan va barcha reaktivlarning stexiometrik koeffitsientlarini hisobga olgan holda butun reaktsiyaga ishora qiladi. Chunki reaktivlar har xil bo'lishi mumkin agregatsiya holatlari, keyin qavs ichida pastki o'ng indeks bilan ko'rsatiladi: (t) - qattiq, (k) - kristalli, (g) - suyuq, (d) - gazsimon, (p) - erigan. Masalan, gazsimon H2 va Cl2 ning o'zaro ta'sirida ikki mol gazsimon HCl hosil bo'ladi. Termokimyoviy tenglama quyidagicha yoziladi: gazsimon H2 va O2 o'zaro ta'sirlashganda, hosil bo'lgan H2O uchta agregatsiya holatida bo'lishi mumkin, bu entalpiya o'zgarishiga ta'sir qiladi: 298K. standart holat termodinamik funktsiya, masalan, entalpiya, pastki va yuqori belgilar bilan ko'rsatiladi: pastki belgisi odatda o'tkazib yuboriladi: D.
Hosil bo'lish entalpiyasi (hosil bo'lish issiqligi), berilgan boshlang'ich moddalardan berilgan moddaning (yoki eritmaning) hosil bo'lish reaksiyasi entalpiyasi. Kimyoviy birikma hosil bo`lish entalpiyasi oddiy moddalardan berilgan birikma hosil bo`lish reaksiyasi entalpiyasi deyiladi. Oddiy moddalar sifatida tanlaydi kimyoviy elementlar ma'lum haroratda ularning tabiiy fazasida va kimyoviy holatida. Shunday qilib, 298 K da xlor uchun C12 molekulalaridan tashkil topgan gazsimon xlor oddiy modda, kaliy uchun esa metall kaliy. 298 K da qattiq KCl hosil bo lish entalpiyasi reaksiya entalpiyasidir: K(qattiq) + 1/2Cl2= KCl(qattiq) 500 K da KCl(qattiq) hosil bo lish entalpiyasi reaksiyaga mos keladi: K( suyuqlik) + 1/2Cl2 = KCl (qattiq), chunki kaliy uchun tabiiy faza holati (oddiy modda) endi kristall emas, balki suyuqlikdir (erish harorati K 336,66 K).
Shakllanish entalpiyasi har qanday haroratda aniqlanishi kerak. Standart hosil bo'lish entalpiyalari oddiy moddalar ham, hosil bo'lgan birikma ham 1 atm (1,01 x 105 Pa) bosim ostida bo'lgan hosil bo'lish reaktsiyalariga mos keladi. Ta'rifga ko'ra, har qanday haroratda barcha oddiy moddalar uchun = 0. Ko'pchilik kimyoviy moddalar uchun. ulanish. shakllanish entalpiyasi - salbiy. miqdorlar.
Hosil bo'lish entalpiyasining o'lchov birliklari J/g, J/mol.Eritmalar (erimalar) termodinamikasida hosil bo'lish entalpiyasi deganda 1 mol (1 g) ning izotermik-izobarik hosil bo'lishi jarayonida entalpiyaning o'zgarishi tushuniladi. ) sof komponentlardan berilgan tarkibning eritmasi (eritma). Shunday qilib, ikki komponentli KF-A1F3 tizimida 50% molyar tarkibli eritma hosil bo'lish entalpiyasi jarayonga to'g'ri keladi: 1/2KF (suyuqlik) + 1/2A1F3 (suyuqlik) = KF-A1F3 (eritma, 50). mol.%).
Endotermik reaksiyalar (boshqa yunoncha ἔndion - ichkarida va ththrmē - issiqlik) - issiqlikning yutilishi bilan kechadigan kimyoviy reaktsiyalar. Endotermik reaksiyalar uchun entalpiya va ichki energiyaning oʻzgarishi musbat boʻladi (DH > 0, DU > 0), demak, reaksiya hosilalari dastlabki komponentlarga qaraganda koʻproq energiyani oʻz ichiga oladi.Endotermik reaksiyalarga quyidagilar kiradi: metallarning oksidlardan qaytarilishi, elektroliz ( elektr energiyasi yutiladi ), elektrolitik dissotsilanish (masalan, tuzlarning suvda erishi), ionlanish, fotosintez Endotermik reaksiyalar ekzotermik reaksiyalarga qarama-qarshidir.
Ekzotermik reaksiya - bu issiqlik chiqishi bilan kechadigan kimyoviy reaktsiya. Endotermik reaksiyaga qarama-qarshi.Kimyoviy tizimdagi umumiy energiya miqdorini oʻlchash yoki hisoblash nihoyatda qiyin. Boshqa tomondan, DH entalpiyasining o'zgarishi kimyoviy reaksiya o'lchash yoki hisoblash ancha oson. Ushbu maqsadlar uchun kaloriyametrlar qo'llaniladi. DH ning o'lchangan qiymati molekulalarning bog'lanish energiyasi bilan quyidagicha bog'liq: DH = bog'lanishning uzilishiga sarflangan energiya - reaksiya mahsulotlarining bog'lari hosil bo'lganda ajralib chiqadigan energiya Ekzotermik reaktsiyalar uchun bu formula manfiy qiymat beradi. DH, chunki kattaroq qiymat kichikroq qiymatdan ayiriladi. Vodorodning yonishi paytida, masalan: 2H2 + O2 → 2 H2O, bir mol O2 uchun entalpiya o'zgarishi DH = -483,6 kJ ni tashkil qiladi.
Atmosfera kislorodida yoqilg'ining yonishi.
Porox yonishi.
Suvga konsentrlangan sulfat kislota qo'shish.
Tirik organizmlarda yog'lar va uglevodlarning oksidlanishi.
Adiabatik yonish
Tizimning entalpiyasi. standart shartlar. Moddaning hosil bo'lish entalpiyasi. Reaksiya entalpiyasi. Endotermik va ekzotermik reaksiyalar. - tushuncha va turlari. "Tizim entalpiyasi. Standart shartlar. Moddaning hosil boʻlish entalpiyasi. Reaksiya entalpiyasi. Endotermik va ekzotermik reaksiyalar" toifasining tasnifi va xususiyatlari. 2014, 2015 yil.
Kimyoviy termodinamika va kimyoviy muvozanatning asosiy tenglamalari
1.Q=DE+W-termodinamikaning birinchi qonuni tenglamasi
2.W=PDV
3. Q v = DE v -izoxorik jarayonning issiqligi
4. Q p = DH p -izobarik jarayonning issiqligi
5. DH p = DE + PDV -izobar jarayonlar uchun termodinamikaning birinchi qonuni tenglamasi
6. DH = å n DH 0 298 arr. ishlab chiqarish. reaksiyaga kirishish. - å n DH 0 298 arr. ref. moddalar - P Gess qonunining birinchi natijasi
7. DH = å n DH 0 298 yonishi. Chiqish. ichida. - å n DH 0 298 yonib ketgan ishlab chiqarish. reaktsiyalar - ichidaGess qonunining ikkinchi natijasi
8.Q=W-biotizimlar uchun termodinamikaning birinchi qonuni tenglamasi
9.DS = ¾¾ -entropiya tizim holatining funktsiyasi sifatida
10.DS ³ 0 -termodinamikaning ikkinchi qonuni tenglamasi
11 S = å n S 0 298 davomi. R. - å n S 0 298 ref. ichida. -reaksiya entropiyasini hisoblash
12. DG 0 = DH 0 - TDS 0 -Gibbs energiyasini hisoblash uchun tenglamalar
13. DG 0 = å n DG 0 298 ishlab chiqarish. R. - å n DG 0 298 ref. ichida.(x)
14. DG 0 \u003d - 2.3RT lg Ks - standart sharoitda kimyoviy reaksiya izotermasi tenglamasi
15. - kimyoviy reaksiya izotermasi tenglamasi
16. - moddaning muvozanat konsentrasiyalari bilan ifodalangan kimyoviy muvozanat konstantasi
17. - muvozanat bilan ifodalangan kimyoviy muvozanat konstantasi qisman bosimlar moddalar
18. - izobar tenglamasi
19. - konstantalar qiymatlaridan issiqlik effektini hisoblash
1-jadval
| Modda | Shakllanishning standart entalpiyasi kJ/mol | Standart entropiya J/mol×K | Standart Gibbs hosil bo'lish energiyasi kJ/mol |
| noorganik moddalar | |||
| C (grafit) | +6 | ||
| CO (g) | -110 | +198 | -137 |
| CO 2 (g) | -393,5 | +214 | -394 |
| Cl 2 (g) | +223 | ||
| Cl 2 O (g) | +76 | +266 | +94 |
| FeSO 3 (televizor) | -753 | +96 | -680 |
| H 2 (g) | +131 | ||
| HCl (g) | -92 | +187 | -95 |
| Salom (g) | +24 | +206 | -1 |
| HNO 2 (eritma) | -119 | +153 | -56 |
| HNO 3 (l) | -174 | +156 | -81 |
| H 2 O (l) | -286 | +70 | -237 |
| H 2 O 2 (l) | -187 | +110 | -120 |
| H 2 S (g) | -21 | +206 | -34 |
| H 2 SO 4 (l) | -814 | +157 | -690 |
| KNO 3 (TV) | -495 | +133 | -395 |
| KOH (eritma) | -477 | +92 | -441 |
| N 2 (d) | +192 | ||
| NH 3 (g) | -46 | +192 | -16 |
| H 2 O (g) | +82 | +220 | +104 |
| YO'Q (g) | +91 | +211 | +87 |
| NO 2 (g) | +33 | +240 | +51 |
| N 2 O 3 (g) | +11 | +356 | +115 |
| Na 2 O 2 (TV) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (TV) | -1117 | +225 | -1043 |
| O 2 (g) | +205 | ||
| SO 2 (g) | -297 | +248 | -300 |
| SO 3 (g) | -396 | +257 | -371 |
| organik moddalar | |||
| Metan (g) | -75 | +186 | -51 |
| Etan (g) | -85 | +229 | -33 |
| Etilen (g) | +52 | +219 | +68 |
| Asetilen (g) | +227 | +201 | +209 |
| Benzol (w) | +49 | +173 | +125 |
| Siklogeksan (l) | -156 | +204 | +27 |
| Xlorometan (g) | -86 | +234 | -63 |
| Dixlorometan (g) | -95 | +270 | -69 |
| Trixlorometan (g) | -101 | +296 | -69 |
| Uglerod tetraklorid (g) | -100 | +310 | -58 |
| Metanol (w) | -239 | +127 | -166 |
| Etanol (w) | -277 | +161 | -174 |
| Dietil efir (l) | -279 | +253 | -123 |
| Asetaldegid (g) | -166 | +264 | -133 |
| Aseton (w) | -247 | +199 | -154 |
| Piruvat ioni (eritma) | + | -559 | |
| L-laktik kislota (eritma) | -686 | +222 | -539 |
| Saxaroza (TV) | -2222 | +360 | -1545 |
| D-glyukoza (eritma) | -1264 | +269 | -917 |
| Nitrobenzol (w) | +16 | +224 | +146 |
| Anilin (w) | +31 | +191 | +149 |
| L-leysin (eritma) | -643 | +208 | -362 |
| Glitsin (eritma) | -523 | +159 | -380 |
| D, L-leysilglisin (eritma) | + | -464 | |
| Glitsilglisin (eritma) | -734 | +231 | -492 |
Organik moddalarning yonishning standart entalpiyalari, kJ/mol
Maxsus issiqlik organizmdagi moddalarning to'liq oksidlanishi, kJ/g.
O'quv vazifalari:
Vazifa 1 Inson tanasida etil spirtining oksidlanish reaktsiyasi ikki bosqichda davom etadi. Birinchisi, etil spirtining alkogol dehidrogenaza fermenti ishtirokida atsetaldegidga oksidlanishi tenglama bo'yicha davom etadi: C 2 H 5 OH + ½ O 2 \u003d CH 3 COH + H 2 O.
Reaksiyaning DH 0 ni Gess qonunining birinchi xulosasidan foydalanib hisoblang, agar
DN 0 arr. (C 2 H 5 OH) \u003d - 278 kJ / mol;
DN 0 arr. (CH 3 COH) \u003d - 166 kJ / mol;
DN 0 arr. (H 2 O) \u003d - 286 kJ / mol.
Yechim: DH 0 = å n DH 0 - å n DN 0 teskari ref.in.in; DH = (-166+ (-286)-(-278)) = - 174 kJ/mol
Javob: reaksiyaning issiqlik ta'siri DH = -174 kJ / mol, ya'ni. ekzotermik jarayon.
Vazifa 2. Glyukozaning yonish issiqligi -2810 kJ/mol, etil spirtining yonish issiqligi -1366 kJ/mol. Ushbu ma'lumotlarga asoslanib, glyukoza fermentatsiyasining biokimyoviy jarayonining termal ta'sirini hisoblang:
C 6 H 12 O 6 \u003d 2C 2 H 5 OH + 2CO 2
Yechim: Ushbu reaksiyaning issiqlik effektini Gess qonunining ikkinchi natijasini qo'llash orqali hisoblash mumkin:
DH = ån DH 0 yonish. Chiqish. moddalar - å n DH 0 yonishi. ishlab chiqarish. reaktsiyalar
DH \u003d -2810 - 2 ∙ (-1366) \u003d - 78 kJ / mol
Javob: fermentatsiya jarayonining termal ta'siri - 78 kJ / mol.
Vazifa 3. Reaksiyaning standart entropiyasini hisoblang:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
glitsin glitsin glitsilglisin
Agar S 0 (glisilglisin) = 231 J / mol × K;
S 0 (glisin) \u003d 159 J / mol × K;
S 0 (H 2 O) \u003d 70 J / mol × K;
Yechim:
DS \u003d S 0 298 (hl-hl) + S 0 298 (H 2 O) - 2 S 0 298 (glisin) \u003d (231 + 70) - (159 + 159) \u003d -17 J / mol × K
Javob: DS 0 298 \u003d - 17 J / mol × K, ya'ni. entropiya kamayadi.
Vazifa 4. Uglevodlar, oqsillar va yog'larning yonish issiqligi 17, 17 va 39 kJ.
mos ravishda. Erkak talabalar uchun oqsillar, yog'lar va uglevodlarga o'rtacha kunlik ehtiyoj 113, 106 va 451 g. Erkak talabalarning kunlik energiyaga bo'lgan ehtiyoji qanday?
Yechim: Uglevodlar, oqsillar va yog'larning oksidlanishida qancha energiya ajralib chiqishini hisoblang
DH = (451 × 17) + (113 × 17) + (106 × 39) = 13722 kJ.
Javob: Kundalik energiya talabi 13722 kJ.
Vazifa 5. Agar reaktsiya endotermik bo'lsa va issiqlik effekti 2830 J/mol bo'lsa, nima uchun 40 0 C da oqsil denaturatsiyasi jarayoni o'z-o'zidan sodir bo'ladi? Bu reaksiya uchun DS qiymati 288 J/mol∙K ni tashkil qiladi
Yechim: Jarayonning yo'nalishini aniqlash uchun quyidagi tenglama bilan hisoblangan Gibbs energiyasining o'zgarishining kattaligini bilish kerak: DG 0 = DH 0 - TDS 0. Hisoblash shuni ko'rsatadiki, DG< 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Javob: Chunki DG< 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Vazifa 6. Standart sharoitda glikoliz reaksiyasi uchun jarayonlarning stixiyaliligi mezoni bo‘lgan Gibbs energiyasini hisoblang: C 6 H 12 O 6 (eritma) ® 2C 3 H 6 O 3 (eritma) (sut kislotasi).
Yechim:
Termodinamik qiymatlar jadvalidan kimyoviy jarayon ishtirokchilari uchun standart Gibbs energiyasini yozamiz: ∆G 0 (C 6 H 12 O 6) = -917 kJ / mol; ∆G 0 (C 3 H 6 O 3) = -539 kJ / mol. Gess qonunining 1 ta xulosasidan foydalanib, biz Gibbs energiyasini hisoblaymiz:
DG 0 = 2×DG 0 (C 3 H 6 O 3) - DG 0 (C 6 H 12 O 6)
DG 0 \u003d 2 (-539) - (-917) \u003d -161 kJ / mol
Javob: chunki ∆G0< 0, то реакция протекает самопроизвольно в oldinga yo'nalish.
Vazifa 7. Ushbu reaksiya uchun hosil bo'lish entalpiyalari va mutlaq entropiyalarning standart qiymatlari yordamida Gibbs energiyasining 25 0 C da o'zgarishini hisoblang: CO + 2H 2 = CH 3 OH
DN 0 arr CH 3 OH \u003d -293 kJ / mol S 0 (CH 3 OH) \u003d 127 J / mol × K
DH 0 arr CO \u003d - 110 kJ / mol. S 0 (CO) \u003d 198 J / mol × K
S 0 (H 2) \u003d 131 J / mol × K
Yechim: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 arr. pr.reak. - ånDH 0 arr. ref. moddalar
DH 0 \u003d - 293 - (-110) \u003d - 183 kJ / mol
DS 0 = å n S 0 davom. p - å n S 0 natija. moddalar
DS 0 \u003d 127 - (198 + 2 (131) \u003d - 333 J / mol × K
DG 0 \u003d - 183,5 kJ / mol - (298K × 0,333 kJ / mol × K) \u003d - 83,8 kJ / mol
Javob: DG 0 \u003d - 83,8 kJ / mol
Vazifa 8. ATP + AMP ↔ 2ADP reaksiyasi uchun 310 K da muvozanat konstantasini hisoblang, agar erkin energiya Gibbs reaksiyasi DG°=-2,10kJ/mol.
Yechim: muvozanatda DG 0 = - 2.3RT log Ks
K c \u003d 10 0,354 \u003d 2,26
Javob: Kc = 2,26
Vazifa 9. Reaksiyaning muvozanat konstantasi: PCl 5 (g) "PCl 3 (g) + Cl 2 (g) 250 0 C da 2 ga teng. Quyidagi konsentratsiyalarda reaktsiya qaysi yo'nalishda boradi: C (PCl 5) \u003d C (PCl 3) \u003d 2 mol/l; C (Cl 2) \u003d 4 mol / l?
Yechim: Reaksiya yo‘nalishini aniqlash uchun izoterm tenglamasidan foydalanamiz
Ps hisoblang
Chunki P s > K s, keyin DG > 0
Xulosa: reaksiya oldinga yo'nalishda o'z-o'zidan keta olmaydi, chunki DG>0.
Vazifa 10. 627 0 S haroratda 2SO 2 (g) + O 2 (g) Û 2SO 3 (g) reaktsiyasining muvozanat konstantasi 2,3 ∙ 10 -7, DH 0 = 376,5 kJ / mol. 727 0 S da muvozanat konstantasini hisoblang.
Yechim: kimyoviy reaksiya izobar tenglamasidan foydalanamiz:
T 1 \u003d 273 + 627 \u003d 900 K
T2 = 273 + 727 = 1000K
Javob: 727 0 S da muvozanat konstantasi 3,56 × 10 -5 ga teng.
11-topshiriq. H 2 O (g) + CO (g) ® CO 2 (g) + H 2 (g) reaktsiyasi uchun kimyoviy muvozanat konstantalari: 800 0 C da Kp = 2,87, 1000 0 C da Kp = 1,39. Ushbu reaksiyaning issiqlik effektini hisoblang.
Yechim: Kimyoviy reaksiyaning izobar tenglamasini qo'llagan holda, biz DH ni hisoblaymiz
T 1 = 800 + 273 = 1073 K ni olaylik
T 2 \u003d 1000 + 273 \u003d 1273 K
Javob: DH = -39,16 kJ/mol.
Mustaqil hal qilish uchun vazifalar:
Vazifa 1. 1 mol suvni bug'lantirish uchun 40 kJ sarflanadi. Teri orqali 720 g suv chiqqanda bir sutkada qancha issiqlik yo'qoladi?
Javob: 1600 kJ
Vazifa 2. Vodorod periks (H 2 O 2) massa ulushi 3% bo'lgan eritma shaklida. tibbiyotda yaralarni davolash uchun ishlatiladi. Vodorod peroksidning katalaza fermenti ishtirokida parchalanish jarayoni o'z-o'zidan sodir bo'lishini isbotlang, bunda boshlang'ich moddalar va reaktsiya mahsulotlarining hosil bo'lishining standart entropiyasining qiymatlarini hisoblash uchun:
S 0 298 (H 2 O 2) =110 J/mol×K; S 0 298 (H 2 O) \u003d 70 J / mol × K; S 0 298 (O 2) = 205 J / mol × K.
Javob: D S = 62,5 J/mol × K
Vazifa 3. 2 m 3 hajmli metan yoqilganda 79600 kJ issiqlik ajralib chiqadi. Metanning standart yonish issiqligini hisoblang.
Javob: 891,52 kJ/mol
Vazifa 4. Quyidagi ma'lumotlarga ko'ra glyukoza oksidlanish jarayoni uchun standart Gibbs energiyasini hisoblang: DH 0 arr (C 6 H 12 O 6) \u003d - 1264,4 kJ / mol; DH 0 arr (CO 2) \u003d - 393 kJ / mol;
DH 0 arr (H 2 O) \u003d - 286 kJ / mol. Butun reaksiyaga kirishuvchi sistema entropiyasining o‘zgarishi 0,259 kJ/mol×K ni tashkil qiladi
Javob: DG \u003d - 2886,8 kJ / mol.
Vazifa 5. Yonishning kerakli standart entalpiyalaridan foydalangan holda etanol hosil bo'lishining standart entalpiyasini hisoblang.
Javob: DN 0 arr. = -273 kJ/mol
Vazifa 6. 25°C da N 2 0 4 (g) ↔ 2N0 2 (g) reaksiyaning muvozanat konstantasi 0,1 ga teng. Quyidagi moddalar konsentratsiyasida reaksiya qaysi yo‘nalishda boradi:
a) C (N0 2) \u003d C (N 2 0 4) \u003d 0,1 mol / l;
b) C (N0 2) \u003d 0,01 mol / l; C (N 2 0 4) \u003d 0,02 mol / l?
Vazifa 7. 444 0 C da H 2 + I 2 ® 2HI reaktsiyasi uchun muvozanat konstantasi 50 ga teng. Agar boshlang'ich aralashma quyidagi tarkibga ega bo'lsa, jarayonning yo'nalishini aniqlang: C (H 2) \u003d 2 mol / l, C ( HI) \u003d 10 mol / l.
Javob: Muvozanat holati, chunki ∆G=0.
8-topshiriq. Bu reaksiya uchun DG 0 298 4,478 kJ/mol bo‘lsa, muvozanat konstantasini hisoblang.
Javob: 6,1
Vazifa 9. Dorivor moddaning avtoklavda parchalanishining muvozanat konstantasi 413K da 0,396∙10 5 Pa, 443K da esa 1,286∙10 5 Pa ga teng. Reaksiyaning issiqlik effektini hisoblang.
Javob: 59,6 kJ/mol.
Vazifa 10. DG° qiymatidan foydalanib, a sifatida foydalanilganda bemorning zaharlanish xavfi mavjudligini aniqlang dori azot oksidi (I), toksik azot oksidi (II) reaksiya natijasida hosil bo'lishi mumkin: 2N 2 O + O 2 = 4NO. Barcha moddalar mavjud gazsimon holat. Ma'lumot uchun jadvalga qarang.






