Maddenin sıvı hali sıvıların özelliğidir. Terimler, tanımlar ve parametreler. Kılcal damarların dairesel bir kesiti varsa, o zaman
Sıvı halde, parçacıklar arasındaki mesafe gaz halinde olduğundan çok daha küçüktür. Parçacıklar hacmin büyük bir kısmını kaplar, sürekli olarak birbirleriyle temas halindedir ve birbirlerine çekilirler. Parçacıkların bazı sıralaması (kısa menzil sırası) gözlenir. Parçacıklar birbirine göre hareket ediyor.
Sıvılarda, partiküller arasında van der Waals etkileşimleri ortaya çıkar: dispersiyon, oryantasyon ve indüksiyon. Belirli kuvvetler tarafından birleştirilen küçük parçacık gruplarına denir. kümeler. Özdeş parçacıklar olması durumunda, bir sıvıdaki kümelere denir. ortaklar
Kayaya daldırıldığında, kaya hacmine eşit hacimde su yer değiştirir. Karşılaştırıldığında, bir tahta blok daha incelikli bir şekilde hareket eder, kendi ağırlığına eşit bir hacimde suyun yerini alıncaya kadar yerçekimi kuvveti altında suya batar.
Sıvıların buharlaşması ve yoğunlaşması
Tüm kuvvetler dengelendiğinde, ağaç alçalmayı durdurur. Bu daha sonra eski Yunan matematikçi, fizikçi, astronom ve filozof Arşimet tarafından tasarlandığı için Arşimet İlkesi olarak adlandırılır. Arşimet. Prensip ayrıca, tahta bloğu destekleyen kuvvetlerin, kaldırma kuvveti merkezi olarak adlandırılan bir noktada doruğa ulaşarak, üzerine ve içine doğru odaklanacağını belirtir. Her zaman yüzen bir cismin kütle merkezinin üzerinde, kaldırma merkezinin konumu cismin stabilitesini gösterebilir.
Sıvılarda hidrojen bağlarının oluşumu parçacıkların sırasını arttırır. Bununla birlikte, hidrojen bağları ve van der Waals kuvvetleri kırılgandır - sıvı haldeki moleküller sürekli kaotik hareket halindedir. kahverengi hareket.
Sıvı hal için moleküllerin Maxwell-Boltzmann'ın hızlarına ve enerjilerine göre dağılımı geçerlidir.
Kaldırma merkezi ile kütle merkezi arasındaki mesafe ne kadar büyükse, nesne o kadar kararlıdır, yani alabora olma olasılığı o kadar düşüktür. Bir diğer Karakteristik özellik sıvılar, daha yoğun bir sıvı daha az yoğun bir sıvıya dökülürse ve ikisi karışmazsa, daha az yoğun sıvıyı üstte ve daha yoğun sıvıyı altta bırakarak ayrılacaklardır. Bunun klasik örneği, yağ ve su ile meydana gelen ayrışmadır.
Denizaltılar, iş yerinde yüzdürmenin harika bir örneğidir. Okyanus yüzeyinde seyahat ederken, bir denizaltı, suyunkinden biraz daha az ortalama yoğunluğa sahiptir. Ancak dalmaya gittiğinde denizaltının su alması gerekir. Bu daha sonra yoğunluğunu suyun ötesinde arttırır ve akma kabiliyeti ile sonuçlanır.
Sıvıların özellikleri, yakın aralıklı moleküllerin geometrisine ve polaritesine bağlı olduğundan, sıvıların teorisi gazlarınkinden çok daha az gelişmiştir. Ek olarak, sıvıların belirli bir yapısının olmaması, tanımlarını resmileştirmeyi zorlaştırır - çoğu ders kitabında sıvılara gazlardan ve kristal katılardan çok daha az yer verilir.
Denizaltının tekrar yüzeye çıkabilmesi için su depolarından geçmesi gerekir. Bu görevi, içlerine hava üfleyerek gerçekleştirir, bu da suyun yerini alır ve denizaltının yoğunluğunu azaltır. Sıvı basıncı ve yüzey gerilimi.
Düştüğü derinlik ne olursa olsun, bariz bir gerçek olmasa da, denizaltının gerçek yüzdürme gücü hiçbir şekilde değişmez. Bunun nedeni, suyun temelde sıkıştırılamaz olması ve yoğunluğunun her derinlikte hemen hemen aynı olmasıdır. Ancak yoğunluk değişemese de, su basıncının dayattığı bir son nokta vardır, bir nesnenin üzerindeki su kütlesi, eklenen derinlikle doğrusal olarak artar.
Sıvılar ve gazlar arasında keskin bir sınır yoktur - içinde tamamen kaybolur. kritik noktalar . Her gaz için, üzerinde herhangi bir basınçta sıvı olamayacağı sıcaklık bilinmektedir; Bununla kritik sıcaklık, sıvı ile sıvı arasındaki sınır (menisküs) doymuş buhar. Kritik bir sıcaklığın ("mutlak kaynama noktası") varlığı, 1860 yılında D.I. Mendeleev tarafından belirlendi.
Yani bir denizaltının derinliğini ikiye katlarsanız, basıncı da ikiye katlarsınız. Anlaması o kadar zor bir kavram olmasa da, tamamen açık olmayan şey, su basıncının yönden bağımsız olarak aynı olduğudur. Örneğin, bir su deposunu suya batırarak üstüne bastıracak olsanız, ancak tank daha derine indikçe, tankın her tarafına ve altına etki eden basıncın aynı olduğu fikrini görmezden gelseniz. tankın üst kısmına bastırırken tankın ne kadar ağırlaştığına şaşıracaksınız.
Bununla birlikte, tankın altındaki bir vanayı açarsanız, su akışta dışarı akar ve tankın hem içindeki hem de dışındaki toplam basıncı azaltır. Ayrıca su artık hareket ettiği için kinetik enerjiye sahiptir. Ve Torricelli ilkesine göre, daha fazla baskı vana üzerinde, daha fazla kinetik enerji akış ve hızı o kadar büyük olur.
Tablo 7.2 - Bazı maddelerin kritik parametreleri (t k, p k, V k)
| Madde | t için, C hakkında | pk, atm | V ila, cm3 / mol | t erime o C | C hakkında balya |
| O | -267,9 | 2,26 | 57,8 | -271,4 | -268,94 |
| H2 | -239,9 | 12,8 | 65,0 | -259,2 | -252,77 |
| N 2 2 | -147,0 | 33,54 | 90,1 | -210,01 | -195,82 |
| O 2 2 | -118,4 | 50,1 | -218,76 | -182,97 | |
| CH 4 | -82,1 | 45,8 | 99,0 | -182,49 | -161,58 |
| CO2 | +31,0 | 72,9 | 94,0 | -56,16 | -78.48(alt) |
| NH3 | 132,3 | 111,3 | 72,5 | -77,76 | -33,43 |
| Cl2 | 144,0 | 76,1 | -101,0 | -34,06 | |
| SO2 | 157,5 | 77,8 | -75,48 | -10,02 | |
| H2O | 374,2 | 218,1 | 0,0 | 100,0 |
Baskı yapmak doymuş buharlar – kısmi basıncı, buharın buharlaşma ve yoğuşma oranlarının eşit olduğu:
Sıvının ana özelliklerinin aşağıdaki gibi olduğunu hatırlayın. Akma kabiliyetine sahip olan ve deformasyon sonrası eski şeklini yeniden şekillendirme kabiliyetine sahip olmayan sıvı benzeri maddelerdir. İçine döküldükleri herhangi bir kap şeklini alabilirler.
Renk tutarlılığı ve yoğunluğu açısından katılara benzer özelliklere sahiptirler. Ortak bir seviye arama eğilimleri vardır. Çevremizde gördüğümüz canlı veya cansız her şey maddeden oluşur. "Madde", "boşluk olan ve yer kaplayan herhangi bir madde" olarak tanımlanabilir. Maddenin farklı biçimleri vardır. Maddenin üç farklı formu vardır; katılar, sıvılar ve gazlar. Moleküllere bağlı olan, her formun belirli özelliklerine bağlı olarak birbirlerinden farklılık gösterirler. değişik formlarÖnemli olmak.
burada A ve B sabitlerdir.
kaynama sıcaklığı bir sıvının doymuş buhar basıncının atmosfer basıncına eşit olduğu sıcaklıktır.
sıvılar var akışkanlık- küçük kesme kuvvetlerinin etkisi altında hareket etme yeteneği; sıvı, yerleştirildiği hacmi kaplar.
Bir akışkanın akmaya karşı gösterdiği dirence denir viskozite[Pa. İle birlikte].
Her maddenin özellikleri; katı, sıvı veya bu moleküller arasındaki farklı çekime bağlıdır. Bu yazıda, iki madde, sıvı ve gaz formu arasındaki farkları tartışacağız. Sıvıları ve gazları en temel düzeyde ayırt edebileceğimiz dört ana ayrım noktası vardır; şekil, hacim, sertlik ve akma yeteneği.
Sıvılar Sıvıların molekülleri orta düzeyde bir çekim kuvvetine sahiptir; Moleküller arasındaki kuvvet daha az katı ve daha fazla gazdır. Bu, sıvılar içinde moleküllerin daha kolay ve daha serbest hareketine yol açar. Moleküler hareket, tanımlanmış ve sabit bir hacme sahip sıvılarla sonuçlanır. Sıvılar, boşlukları doldurmak için hareket eden moleküller olarak depolandıkları kabın şeklini alırlar. Belirli bir şekilleri yoktur ve akma kabiliyetine sahiptirler. Sıvılar akabilir; bu nedenle "sıvı" olarak da adlandırılırlar.
Yüzey gerilimi [J / m 2] - bir yüzey birimi oluşturmak için gereken iş.
sıvı kristal hali- sıvı haldeki maddeler, yüksek derecede düzen, kristaller ve sıvı arasında bir ara pozisyon işgal eder. Akışkanlıkları vardır, ancak aynı zamanda uzun menzilli bir düzenleri vardır. Örneğin - kahverengi asit, azolitler, steroidlerin türevleri.
Sıvılar sert değildir. Örneğin, 0 santigrat derecenin altında donduğunda buz üzerinde katılaşır. Bazı sıvı örnekleri su, yağlar, süt, meyve suları vb. Gazlar Gazlardaki moleküller, aralarında çok zayıf bir çekici kuvvete sahiptir ve çok gevşek bir şekilde paketlenir. Dolayısıyla belirli bir şekilleri yoktur ve kap şeklini alırlar. Gazların da moleküler yapıları nedeniyle belirli bir hacmi yoktur ve depolandıkları kabın hacmi haline gelirler. Gazlar kolayca akabilir; sadece tütsü yakılarak gösterilebilirler.
boşluk sıcaklığı- sıvı kristallerin (LC) normal sıvı durumuna geçtiği sıcaklık.
7.5 Katılar
AT katı hal parçacıklar birbirine o kadar yakındır ki aralarında güçlü bağlar oluşur, ileri hareket ve konumu etrafında dalgalanmalar devam ediyor. Katılar amorf ve kristal halde olabilir.
Sıvı filmlerin özellikleri
Tütsü kokusu odanın bir bölümünden diğerine geçer. Moleküller arasında çok fazla boşluk olduğu için kolayca sıkıştırılabilirler. Sıvılar, katılara ve daha fazla gaza göre moleküller arasında daha az çekici kuvvete sahiptir; Gazlar, maddenin üç halinin en küçüğü olan moleküller arasında çok zayıf bir çekim kuvvetine sahiptir. Sıvıların belirli bir hacmi vardır; gazların belirli bir hacmi yoktur. Sıvılar kolayca sıkıştırılamaz; gazlar kolayca sıkıştırılabilir.
Dünyadaki her şey maddeden yapılmıştır, ancak bu madde her zaman aynı değildir. Madde dört farklı evrede var olabilir ve Kinetik teori madde bu evreler arasındaki farkları anlamamıza yardımcı olur. Katılar, sıvılar, gazlar ve plazmalar: Bu kelimeler size aşina olmalıdır çünkü bunlar maddenin farklı olabilen, farklı formlarla ilgilenebilen dört fazıdır. Mevcut olan, birçok maddenin birden fazla faz olarak var olabilmesidir. Örneğin suyu ele alalım: su katı, sıvı ve gaz olarak var olabilir.
7.5.1 Amorf haldeki maddeler
Amorf durumda, maddeler düzenli bir yapıya sahip değildir.
camsı durum - bir sıvının derin aşırı soğutulması sonucu elde edilen bir maddenin katı amorf hali. Bu durum dengesizdir, ancak gözlükler uzun süre var olabilir. Cam yumuşaması belirli bir sıcaklık aralığında gerçekleşir - sınırları soğutma hızına bağlı olan cam geçiş aralığı. Bir sıvının veya buharın soğuma hızındaki bir artışla, belirli bir maddenin camsı halde elde edilme olasılığı artar.
Bu durumlar arasındaki fark, enerji miktarıdır. Katı parçacıklar en az enerjiye sahiptir, bu da parçacıklarının bu kadar yakından ilişkili olmasının bir parçasıdır. Sıvılar katılardan daha fazla enerjiye sahiptir, bu nedenle bulundukları kabın şeklini alırlar, ancak sadece yüzeye kadar.
Sıvının mekanik özellikleri
Gazlar sıvılardan bile daha fazla enerjiye sahiptir. Özellikle parçacıkları kaplarının tüm alanını doldurmak için yayıldığından. Gaz parçacıklarının o kadar çok enerjisi vardır ki, hareketsiz kalamazlar. Kendileriyle gaz parçacıklarının geri kalanı arasında mümkün olduğunca fazla mesafe bırakarak her yöne uçarlar.
XX yüzyılın 60'lı yıllarının sonunda, amorf metaller (metalik camlar) elde edildi - bunun için erimiş metali 106 - 108 derece / s hızında soğutmak gerekiyordu. Çoğu amorf metal ve alaşım 300 °C'nin üzerinde ısıtıldığında kristalleşir. En önemli uygulamalardan biri mikroelektronik (metal-yarı iletken arayüzündeki difüzyon bariyerleri) ve manyetik depolama cihazlarıdır (FMD kafaları). İkincisi, benzersiz manyetik yumuşaklıktan kaynaklanmaktadır (manyetik anizotropi, geleneksel alaşımlardan iki kat daha azdır).
Plazmalar iyonize gazlardır ve Dünya'da doğal formlarında nadirdir. Onları neon tabelalar ve floresan ampuller gibi yapay şeyler olarak gördünüz. Ama evrenin geri kalanında, plazma aslında maddenin en yaygın aşamasıdır! Çoğu yıldız, kutup bölgelerinde gördüğünüz aurora borealis gibi plazmadır. Plazma yalnızca belirli koşullar altında bulunur, bu nedenle bu eğitim için bununla ilgili tartışmamızı burada sonlandıracağız.
Kinetik madde teorisi, tüm maddelerin rastgele hareket eden ve aralarında boşluk bulunan küçük parçacıklardan oluştuğunu belirtir. Bu, faz malzemesi ne olursa olsun, tek tek hareket eden parçacıklardan oluştuğu anlamına gelir.
amorf maddeler izotropik, yani her yönde aynı özelliklere sahiptir.
7.5.2 Kristal haldeki maddeler
katı kristal maddeler, kırınım yoluyla çalışılmalarına izin veren, tekrarlayan elementlerle düzenli bir yapıya sahiptir. röntgen(1912'den beri kullanılan X-ışını kırınım analizi yöntemi.
Bu teori kulağa oldukça basit geliyor ama aslında fiziksel özellikler madde ve eylemleri. Bir katının parçacıklarının gerçekten hareket ettiğini öğrenmek sizi şaşırtabilir, bu sizin için yeterli değildir. Bu tür titreşimli hareket, hangi kaba koyarsanız koyun katının şeklini değiştirmemesinin nedenidir.
Sıvı parçacıkların katı parçacıklardan daha fazla enerjiye sahip olduğunu hatırlıyor musunuz? Bu durumdaki ekstra enerji, parçacıkların daha serbest hareket etmesine izin verir ve katı parçacıklardan daha fazla yayılır, bu da bu parçacıklar arasında daha fazla boşluk yaratır. Bu nedenle sıvı yüzeyine kadar bulunduğu kabın şeklini alacaktır.
Tek kristaller (tek bileşikler) anizotropi ile karakterize edilir - özelliklerin uzaydaki yöne bağımlılığı.
Parçacıkların düzenli düzeni sağlam vücut kristal kafes olarak gösterilmiştir. kristal maddeler denilen belirli bir sıcaklıkta erir. erime noktası.
Ve gazlar sıvılardan bile daha fazla enerjiye sahip oldukları için parçacıkları çok daha fazla hareket eder. Bu nedenle gaz, bir sıvı gibi sadece yüzeyini değil, tüm kabı dolduracak şekilde genişleyecektir. Katı bir cismin parçacıkları sadece çok fazla hareket etmemekle kalmaz, aynı zamanda güçlü çekici kuvvetlerle birbirlerine çok güçlü bir şekilde dokunurlar. Bu kuvvetler parçacıkları yerinde tutar ve katıya sabit bir boyut ve şekil veren şeydir.
Öte yandan, gaz parçacıkları o kadar uzaktır ki, aralarındaki çekim kuvvetleri ihmal edilebilir olarak kabul edilir. Bir gazın parçacıkları birbirinden bağımsız kabul edilir, yani gaz zıttır. Katı madde ve sabit bir boyutu veya şekli yoktur.
Kristaller, enerji, kristal kafes sabiti ve koordinasyon sayısı ile karakterize edilir.
kalıcı kafes karakteristik eksenler yönünde kristaldeki düğümleri işgal eden parçacıkların merkezleri arasındaki mesafeyi karakterize eder.
koordinasyon numarası genellikle bir kristaldeki belirli bir parçacığa doğrudan bitişik parçacıkların sayısı olarak adlandırılır (bkz. Şekil 7.2 - hem sezyum hem de klor için koordinasyon sayısı sekiz)
Sıvı parçacıkların hareketi katı ile gaz arasında olduğundan, parçacıkları arasındaki çekim kuvvetleri de diğer iki fazın orta aralığındadır. Sıvı parçacıklar, katı parçacıklardan daha fazla özgürlüğe sahiptir, bu nedenle sıvı serbestçe akabilir. Bu, bir gaz gibi bir sıvının sabit bir şekle sahip olmadığı anlamına gelir. Ancak parçacıklar bir gazın parçacıkları kadar serbest olmadığından sıvının hacmi sabittir.
Maddenin kinetik teorisi, maddelerin belirli koşullar altında neden faz değiştirebildiğini açıklamada da yararlıdır. Suyun katı, sıvı veya gaz halinde olabileceğini biliyorsunuz ama nasıl çalışıyor? Bir maddeye enerji eklendiğinde veya çıkarıldığında, genellikle ısı şeklinde bir faz değişimi meydana gelir.
Kristal kafesin enerjisi Bir mol kristali yok etmek ve etkileşim sınırlarının ötesindeki parçacıkları uzaklaştırmak için gereken enerjiye denir.
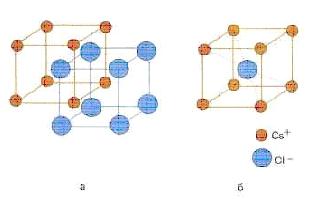
Şekil 7.2 - Sezyum klorür CsCl kristalinin yapısı (a) ve bu kristalin vücut merkezli kübik birim hücresi (b)
7.5.3 Kristal yapılar
Simetrisinin tüm özelliklerini ifade eden bir kristalin en küçük yapısal birimi, temel hücre. Hücrenin üç boyutlu olarak tekrarlanmasıyla bir kristal kafes elde edilir.
Yedi temel hücre vardır: kübik, dört yüzlü, altıgen, eşkenar dörtgen, ortorhombohedral, monoklinik ve triklinik. Temel birim hücrelerin yedi türevi vardır, örneğin vücut merkezli, kübik, yüz merkezli.
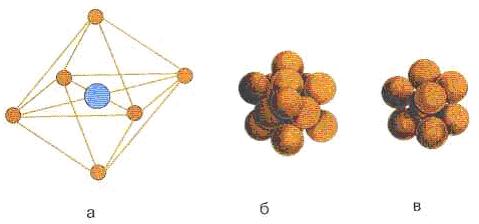
a - NaCl kristalinin birim hücresi; b - NaCl'nin yoğun yüz merkezli kübik ambalajı; c - CsCl kristalinin vücut merkezli kübik yerleşimi Şekil Şekil 7.3 - Birim hücre
izomorfik maddeler- aynı kristal yapıları oluşturan benzer kimyasal yapıya sahip maddeler: CaSiO 4 ve MgSiO 4
polimorfizm– iki veya daha fazla halde bulunan bileşikler kristal yapılar, SiO 2 gibi (altıgen kuvars, eşkenar dörtgen tridimit ve kübik kristoballit gibi.)
allotropik modifikasyonlar- polimorfik modifikasyonlar basit maddeler, örneğin karbon: elmas, grafit, karabina, fulleren.
Kristal kafes düğümlerindeki parçacıkların doğası gereği ve Kimyasal bağlar aralarında, kristaller alt bölümlere ayrılır:
1) moleküler- düğümlerde, van der Waals kuvvetlerinin etki ettiği, düşük enerjili moleküller vardır: buz kristalleri;
2) atomik olarak- kovalent kristaller- kristallerin düğümlerinde birbirleriyle güçlü oluşturan atomlar bulunur kovalent bağlar, yüksek bir kafes enerjisine sahipler, örneğin elmas (karbon);
3) iyonik kristaller- bu tip kristallerin yapısal birimleri, aralarında pozitif ve negatif yüklü iyonlardır. elektriksel etkileşim yeterince yüksek bir enerji ile karakterize edilen, örneğin NaCL, KCL;
4) metal kristaller- ışığa göre yüksek elektriksel iletkenliğe, ısıl iletkenliğe, dövülebilirliğe, plastisiteye, metalik parlamaya ve yüksek yansıtıcılığa sahip maddeler; kristallerdeki bağ metaliktir, metalik bağın enerjisi kovalent ve moleküler kristallerin enerjileri arasında orta düzeydedir;
5) karışık bağ kristalleri– iki veya daha fazla bağ türünün üst üste bindirilmesiyle tanımlanabilen parçacıklar arasında karmaşık etkileşimler vardır, örneğin klatratlar (bileşikler dahildir) – bir kristalin boşluğuna moleküllerin (konukların) dahil edilmesiyle oluşur farklı tipteki partiküllerden (konakçılar) oluşan çerçeve: gaz klatratları CH dört . 6H 2 O, üre klatratları.
Gazlar ve kristaller arasında bir ara pozisyon işgal eden sıvı, bu cisimlerin her iki tipinin özelliklerini birleştirir..
1. Katı, sıvı gibi biraz sıkıştırılabilir Moleküllerin yoğun dizilişi nedeniyle. (Ancak, su sıkışmadan tamamen kurtulabilseydi, o zaman dünya okyanusundaki su seviyesi 35 m yükselir ve su 5.000.000 km2 araziyi sular altında bırakırdı.)
2. Katı, sıvı gibi hacim tasarrufu sağlar ama gaz gibi gemi şeklini alır .
3. kristaller için tipik uzun menzilli sipariş atomların dizilişinde (kristal kafes), gazlar için- tam dolu kaos. sıvı için ara durum var kısa menzilli sipariş , yani sadece en yakın moleküllerin dizilimi düzenlenir. Bu molekülden 3-4 etkin moleküler çap mesafesinde uzaklaşıldığında sıra bulanıklaşır. Bu nedenle sıvılar, çok küçük kristallerden (yaklaşık 10 9 m), keyfi olarak birbirine göre yönlendirilmiş. Bu nedenle, çoğu sıvının özellikleri her yönde aynıdır (ve kristallerde olduğu gibi anizotropi yoktur).
4. Çoğu sıvı artan sıcaklıkla katılar gibi seslerini artırmak , yoğunluğunu azaltırken (kritik bir sıcaklıkta, bir sıvının yoğunluğu, buharının yoğunluğuna eşittir). su farklı tanınmış anomali , +4 С'de suyun maksimum yoğunluğa sahip olması gerçeğinden oluşur. Bu anormallik, su moleküllerinin kısmen birkaç molekülden (kümeler) oluşan ve kendine özgü büyük moleküller oluşturan gruplar halinde bir araya gelmesiyle açıklanır. H 2 Ö, (H 2 Ö) 2 , (H 2 Ö) 3 … farklı yoğunlukta. Farklı sıcaklıklarda, bu molekül gruplarının konsantrasyonlarının oranı farklıdır.
Mevcut amorf cisimler (cam, kehribar, reçineler, bitüm...), genellikle çok yüksek viskoziteye sahip aşırı soğutulmuş sıvılar olarak kabul edilir. Her yönde aynı özelliklere sahiptirler (izotropik), parçacıkların düzenlenmesinde kısa menzilli düzendedirler, erime noktaları yoktur (ısıtıldığında, madde yavaş yavaş yumuşar ve sıvı hale geçer).
Teknolojide kullanılır manyetik sıvılar - bunlar, katı bir ferromanyetik malzemenin (örneğin, Fe 2 Ö 3). Manyetik sıvının hareketi ve viskozitesi bir manyetik alan tarafından kontrol edilebilir. güçlü manyetik alanlar manyetik sıvı anında sertleşir.
Molekülleri ipliksi bir şekle veya düz plakaların şekline sahip olan bazı organik maddeler, hem anizotropi hem de akışkanlık özelliklerine sahip özel bir durumda olabilir. Onlar aranmaktadır sıvı kristaller . Bir sıvı kristalin moleküllerinin yönünü değiştirmek için (bu durumda, şeffaflığı değişir), entegre devrelerden doğrudan sinyal temini ile sağlanabilen yaklaşık 1 V'luk bir voltaj ve mikrowatt mertebesinde bir güç gereklidir. ek amplifikasyon olmadan. Bu nedenle, sıvı kristaller elektronik saat göstergelerinde, hesap makinelerinde ve ekranlarda yaygın olarak kullanılmaktadır.
Donarken suyun hacmi %11 artar ve su kapalı bir alanda donarsa 2500 atmosferlik bir basınca ulaşılabilir (su boruları, kayalar tahrip olur...).
para çekme En büyüklerinden biri: 1) dielektrik sabiti(bu nedenle su iyi bir çözücüdür, özellikle iyonik bağları olan tuzlar - tüm periyodik tablo Dünya Okyanusunda bulunur); 2) füzyon ısısı(ilkbaharda karın yavaş erimesi); 3) sıcaklık buharlaşma; 4) yüzey gerilimi; 5) ısı kapasitesi(ılıman kıyı iklimi).
var ışık (1 gr/cm3) ve ağır (1.106 g/cm3) su . Hafif su ("canlı") - biyolojik olarak aktif - protium oksittir H 2 Ö. Ağır su ("ölü") - organizmaların hayati aktivitesini bastırır - döteryum oksittir D 2 Ö. Protium (1 amu), döteryum (2 amu) ve trityum (3 amu) hidrojen izotoplarıdır. Ayrıca 6 oksijen izotopu vardır: 14'ten Ö 19'a kadar Ö bir su molekülünde bulunabilir.
Su arıtımında manyetik alan özellikleri değişir: ıslanabilirlik değişir katılar, çözünmeleri hızlanır, çözünmüş gazların konsantrasyonu değişir, buhar kazanlarında kireç oluşumu önlenir, betonun sertleşmesi 4 kat hızlanır ve mukavemeti %45 artar, insanlar üzerinde biyolojik bir etkisi vardır (manyetik bilezikler) ve küpeler, magnetolights vb.) ve bitkiler (çimlenme ve mahsul verimi artar).
gümüş su su, gümüş iyonları tarafından mikrop ve bakterilerden nötralize edildiğinden uzun süre (yaklaşık altı ay) saklanabilir (astronotikte, gıdaların konserve edilmesinde, havuzlarda suyun dezenfekte edilmesinde, gastrointestinal hastalıkların önlenmesi ve bunlarla mücadelede tıbbi amaçlar için kullanılır) inflamatuar süreçler).
İçme suyu dezenfeksiyonu şehir su borularında suyun klorlanması ve ozonlanması ile gerçekleştirilir. Ultraviyole radyasyon ve ultrason kullanarak fiziksel dezenfeksiyon yöntemleri de vardır.
Gazların çözünürlüğü Sudaki sıcaklık, basınç, tuzluluk, sulu çözeltideki diğer gazların varlığına bağlıdır. 0 С'de 1 litre suda aşağıdakiler çözülebilir: helyum - 10 ml, karbon dioksit - 1713 ml, hidrojen sülfür - 4630 ml, amonyak - 1300000 ml (amonyak). Büyük derinliklere dalarken, tüplü dalgıçlar özel solunum karışımları kullanırlar, böylece yükseldiklerinde içindeki nitrojenin çözünmesi nedeniyle "karbonatlı kan" almazlar.
Herşey canlı organizmalar%60-80 su. İnsan ve hayvanların kanı, tuz bileşiminde okyanus suyuna benzer. İnsan ve hayvanlar vücutlarında suyu sentezleyebilir, gıda ürünlerinin ve dokuların yanması sırasında oluşturabilir. Örneğin bir devede hörgücün içerdiği yağ oksidasyon sonucu 40 litre su verebilir.
saat elektroliz iki tür su elde edilebilir: 1) antiseptik görevi gören asidik su (“ölü”) (asidik mide suyunda kaç patojenik mikropun öldüğüne benzer); 2) biyolojik süreçleri aktive eden alkali su (“canlı”) (verimliliği arttırır, yaraları daha hızlı iyileştirir, vb.).
Suyun diğer özelliklerini (yapılandırılmış, enerji bilgilendirici vb.) İnternetten öğrenebilirsiniz.
TRIZ görevi 27. Su işçisi
Çoğu zaman, çeşitli mekanizmalar "katı hal" özelliğine sahiptir. çalışma organları. Çalışma gövdesinin su (sıvı) olduğu teknik cihazlara örnekler verin. Böyle bir çalışma organı hangi teknik sistemlerin gelişim yasalarına karşılık gelir?
TRIZ görevi 28. Elekte su
ünlü problemde elek içinde su nasıl taşınır? açık bir ifade var fiziksel çelişki: Elekte dökme katıların elenmesi için delikler olmalı ve suyun dışarı akmaması için delik olmamalıdır. Bu sorunun olası çözümlerinden biri Ya.I. Perelman, elek ağının suyla ıslanmaması için eleğin erimiş parafine indirilmesinin önerildiği "Eğlenceli Fizik" te. Temelli teknik ortadan kaldırmak için teknikler ve fiziksel çelişkiler Bu sorunu çözmek için 10-20 başka yol önerin.






