1 atom çekirdeği bileşimi. Atom çekirdeği. Elektrik kuadrupol momenti
küme bozulması
Atom çekirdeği- ana kütlesinin yoğunlaştığı atomun merkezi kısmı (% 99.9'dan fazla). Çekirdek pozitif yüklüdür, çekirdeğin yükü atomun atandığı kimyasal elementi belirler. Çeşitli atomların çekirdeklerinin boyutları, atomun kendisinden 10 bin kat daha küçük olan birkaç femtometredir.
Bir diğer ilginç gerçek daha büyük elementler için, nötronların protonlara oranı genellikle 5 civarındadır, ancak daha yüksek değildir. Bu, eğer protonları ve nötronları zincir boyunca eşit olarak dağılmış olsaydı, o zaman bir çift proton arasında bir veya iki nötron olacağını, ancak asla arka arkaya üç nötron olmayacağını gösterir.
İki ve üç nötron, protonlar arasında böyle görünecek. Görüldüğü gibi, iki nötron olduğunda, protonların kendilerini dış negatif yüklerine bağlayabildiği ve böylece onları sabit tutabildiği görülüyor. Üç nötron olduğunda, ortalama bir nötron sağlamak zordur ve ayrıca birbirine yakın çok sayıda negatif yük vardır. Bu nedenle, üç nötronlu durumun istikrarlı olması pek olası değildir.
Belirli sayıda proton ve nötron içeren bir parçacık sınıfı olarak kabul edilen atom çekirdeğine genel olarak nüklid.
Çekirdekteki proton sayısına yük numarası denir - bu sayı, periyodik tablodaki atomun ait olduğu elementin sıra sayısına eşittir. Çekirdekteki proton sayısı, nötr bir atomun elektron kabuğunun yapısını ve dolayısıyla karşılık gelen elementin kimyasal özelliklerini belirler. Bir çekirdekte bulunan nötron sayısına denir. izotop numarası. Proton sayıları aynı, nötron sayıları farklı olan çekirdeklere izotop denir. Nötron sayıları aynı, proton sayıları farklı olan çekirdeklere izoton denir. İzotop ve izoton terimleri, belirtilen çekirdekleri içeren atomlarla ilgili olarak ve ayrıca bir kimyasal elementin kimyasal olmayan çeşitlerini karakterize etmek için de kullanılır. Bir çekirdekteki toplam nükleon sayısı, kütle numarası () olarak adlandırılır ve periyodik tabloda belirtilen bir atomun ortalama kütlesine yaklaşık olarak eşittir. Aynı olan nüklidler kütle Numarası, ancak farklı proton-nötron bileşimlerine izobarlar denir.
Bazı kurallar kararlı izotopların oluşumunu yönetiyor gibi görünüyor.
- Bir proton, zincirin sonundaki başka bir protona doğrudan bağlanamaz.
- Nötron zincirin sonunda olamaz.
- Bir dizide ikiden fazla nötron olamaz.
- Büyük öğeler gerektirir daha fazla nötron ve kurala uyun.
Herhangi bir kuantum sistemi gibi, çekirdekler de yarı kararlı bir uyarılmış durumda olabilir ve bazı durumlarda böyle bir durumun ömrü yıl olarak hesaplanır. Çekirdeklerin bu tür uyarılmış durumlarına nükleer izomerler denir.
Kısa keşif tarihi
Yüklü parçacıkların saçılması, bir noktada yoğunlaşan ve karşıt elektriğin düzgün bir küresel dağılımı ile çevrili merkezi bir elektrik yükünden oluşan bir atomun varsayılmasıyla açıklanabilir. eşit boyut. Atomun böyle bir yapısı ile, α- ve β-parçacıkları, atomun merkezinden yakın bir mesafeden geçtiklerinde, böyle bir sapma olasılığı küçük olmasına rağmen, büyük sapmalar yaşarlar.
Nükleer kuvvetlerin özellikleri, tanımları ve kökenleri
Hidrojen-3, kural 2'yi ihlal ediyor çünkü temelde kararlı. Bu kararlılık mümkündür çünkü helyum-3'ün proton genişlemesi bir elektron için yeterlidir. Kural 1 ile ilgili olarak, bu sadece zincirin sonundaki protonlar için geçerlidir, zincir için değil, çünkü bir çift proton çevreleyen nötronlar tarafından korunabilir.
Kural 3'e ek olarak, dizideki bu iki nötron, zincirin sonuna yakın olmamalıdır, çünkü onları yerinde tutmak için yeterli proton protonu yoktur. Yani sıralı nötronlar zincire yerleştirilmelidir. Bu, zincirleri yeterince uzun olmadığı için neden daha küçük elementlerin sıralı nötronlara sahip olmasına izin verilmediğini gösterir.
Böylece, Rutherford atom çekirdeğini keşfetti, o andan itibaren nükleer fizik başladı, atom çekirdeğinin yapısını ve özelliklerini inceledi.
Elementlerin kararlı izotoplarının keşfinden sonra, en hafif atomun çekirdeğine, tüm çekirdeklerin yapısal bir parçacığının rolü verildi. 1920'den beri, hidrojen atomunun çekirdeğinin resmi bir terimi vardı - proton. Birçok belirgin kusuru olan çekirdeğin yapısının ara proton-elektron teorisinden sonra, her şeyden önce, 1932'de James Chadwick, çekirdeğin dönüşlerinin ve manyetik momentlerinin ölçümlerinin deneysel sonuçlarıyla çelişiyordu, 1932'de James Chadwick elektriksel olarak nötr yeni bir parçacık keşfetti. , nötron denir. Aynı yıl, Ivanenko ve bağımsız olarak Heisenberg, çekirdeğin proton-nötron yapısı hakkında bir hipotez ortaya koydu. Bu hipotez, nükleer fiziğin ve uygulamalarının sonraki tüm gelişim süreci tarafından tamamen doğrulandı.
Önceki gözlemler tüm izotopları tam olarak açıklamaz. Örneğin, helyum-8, helyum-7'den daha kararlıdır ve lityum-11, lityumdan daha kararlıdır. Her iki durumda da, daha büyük izotopun daha fazla nötronu vardır ve daha az kararlılık bekleriz. Lityum durumunda, ilginç bir çalışma, lityum-11 ve lityum-12 çekirdeklerinin lityumdan çok daha büyük olduğunu buldu. Ekstra nötronların bir şekilde zincirin geri kalanından ayrılması ve belirli bir mesafede yüzmesi mümkündür. Örneğin, lityum-11, lityum-9 ve belirli bir mesafede tutulan iki nötrondan yapılabilir.
Nükleer Fizik
İlk kez, atom çekirdeğinin yükleri 1913'te Henry Moseley tarafından belirlendi. Onların deneysel gözlemler bilim adamı, X-ışını dalga boyunun, elementten elemente değişen ve hidrojen için bire eşit olan belirli bir sabite bağımlılığını yorumladı:
Bunun nasıl olabileceği açık değildir. Atom modeli teorileri: John Dalton Matter bölünemez atomlardan oluşur, yok edilemezler. Belirli bir elementin tüm atomları, fiziksel ve kimyasal özelliklerinde aynıdır. Farklı elementlerin atomları fiziksel ve kimyasal özellikler. Farklı elementlerin atomları, tam sayılar arasında basit oranlarda birleştirilir ve moleküller oluşturur. kimyasal reaksiyonlar atomların ayrılması veya yeniden düzenlenmesinin bir kombinasyonundan oluşur. Sınırlamalar: Atomların neden ve nasıl bir araya gelerek karmaşık atomları oluşturduğunu açıklayamıyordu. Bileşiklerin atomlarında atomları bir arada tutan kuvvetlerin doğası. Atomlar neden serbest halde var olamazlar ve neden bileşiklerin atomları serbestçe var olabilir? Görünüşe göre çikolatalı dondurma daha sonra yanlış çıktı. Sınırlamalar: Rutherford'un deneyi tarafından açıklanan saçılma deneyinin sonucunu açıklayamadı. Desteğinde hiçbir deneysel kanıt yoktu. Bu temelde termiyonik radyasyon, fotoelektrik radyasyon ve iyonlaşma açıklanmıştır. Bunun nedeni, α-parçacıklarının folyo atomları tarafından saçılmasıdır. Atomun kararlılığına gelince Çekirdeğin etrafında dönen elektronlar merkezcil ivmeye sahiptir. Elektrodinamiğe göre, hızlandırılmış yüklü parçacıklar enerjiyi elektromanyetik dalgalar şeklinde yayar. Bu nedenle, dönen elektronlar tarafından sürekli olarak elektromanyetik dalgalar yayılmalıdır. Bu sürekli elektron enerjisi kaybı nedeniyle, yörüngelerinin yarıçapları sürekli olarak azalmalı ve sonunda elektron çekirdeğe düşmelidir. Böylece atom kararlı kalamaz. Rutherford'un modeli de çizginin spektrumunu açıklamadı. Rutherford Niels Modelinin Dezavantajları David Bohr Atom Modeli Teorileri: Bohr Teorisi Sabit dairesel yörüngeler: Elektronlar çekirdek etrafında eşmerkezli dairesel yörüngelerde hareket ederler. Kararlı yörüngelerde dönerken, elektronlar yörüngenin merkezine doğru ivmelenmelerine rağmen enerji yaymazlar. Sabit yörüngelerin her biri, sabit enerji olarak adlandırılan belirli bir miktarda enerji ile ilişkilidir. Bir elektronun bir enerji seviyesinden diğerine atlaması. Zeeman ve Stark etkisi için açıklama yok: elektrik ve manyetik alanların etkisi spektral atomlar. Bir atoma bir manyetik alan uygulandığında, yaygın olarak gözlemlenen spektral çizgileri bölünür. Bu etki Zeeman etkisi olarak bilinir. spektral çizgiler ayrıca bir elektrik alan varlığında bölünür. Bu etki Stark etkisi olarak bilinir. Atomların sınıflandırılması: İzomerler, aynı moleküler formüle ancak farklı kimyasal yapılara sahip moleküllerdir. Bu kural daha büyük çekirdekler için daha doğrudur. Doğal elementlerin bilinen tüm izotopları için sadece 250 tanesi kararlıdır . Bütün bu kararlı izotoplar atomik numara 1 ile arasında. Çekirdeğin kütlesi, onu oluşturan tüm proton ve nötronların kütlesinden daha az olacaktır. Aradaki fark, çekirdek yok edildiğinde enerjiye dönüşen kütle kusuru olarak adlandırılır. Nükleonları bir arada tutan enerji miktarına bağlanma enerjisi denir. Bu enerji miktarı, kararlı çekirdekler için kararsız çekirdeklerden daha yüksektir. Atom kütlesi ve enerji birimleri. Elektronların yörüngelerdeki konumu.
- Her madde, element adı verilen temel nesnelerden oluşur.
- Çekirdek, nükleon adı verilen proton ve nötronlardan oluşur.
- Bir atomun kütlesinin çoğu Çekirdeğe aittir.
Ve - kalıcı.
Moseley, karakteristik X-ışını radyasyonunun dalga boyunu belirleyen ve elementin seri numarasıyla çakışan deneylerinde bulunan atomik sabitin yalnızca bir yük olabileceği sonucuna varmıştır. atom çekirdeği hangi olarak bilinir hale geldi Moseley yasası .
Ağırlık
Nötron sayısındaki farklılık nedeniyle, bir elementin izotopları, çekirdeğin önemli bir özelliği olan farklı kütlelere sahiptir. AT nükleer Fizikçekirdek kütlesi genellikle atomik kütle birimlerinde ölçülür ( a. yemek.), bir için a. e. m. 12 C nüklidin kütlesinin 1/12'sini alın. Genellikle bir nüklid için verilen standart kütlenin, nötr bir atomun kütlesi olduğuna dikkat edilmelidir. Çekirdeğin kütlesini belirlemek için, tüm elektronların kütlelerinin toplamını atomun kütlesinden çıkarmak gerekir (elektronların çekirdeğe bağlanma enerjisini de hesaba katarsak daha doğru bir değer elde edilir) .
Ama atomlarda elektronlar, çekirdekteki protonların hemen yanındadır. Elektronlar neden doğrudan çekirdeğe saklanmaz ve protonlara yapışmaz? Elektronlar çekirdeğe düşmelidir. Dördüncü sınıfta oturan herkes, saçınıza veya süveterinize bir balon sürdüğünüzde onu duvara yapıştırabileceğinizi bilir. Bunu yapabilirsiniz çünkü sürtünme balonun çok fazla elektron biriktirmesine neden olmuştur. Elektronlar protonlara çekilir ve diğer elektronlar tarafından itilir, bu nedenle balon duvara yakın itildiğinde, duvardaki elektronlar içeri girer ve açıkta kalan protonları bırakır.
Ek olarak, kütlenin enerji eşdeğeri genellikle nükleer fizikte kullanılır. Einstein ilişkisine göre, her kütle değeri, toplam enerji:
, boşlukta ışığın hızı nerede.arasındaki oran. e.m. ve joule cinsinden enerji eşdeğeri:
Bu yarı çıplak protonlar balondaki elektronlara karşı dayanılmazdı ve elektronlar balonu da alarak protonlara doğru koştu. Soru şu ki, bu elektronlar neden ilk etapta saçınızdan balona doğru hareket etti? Protonlara bu kadar hayran olsalardı, birçoğu saçınızda olurdu. Çiftin yüksüz atomları elektron ve proton sayılarına eşittir. Elektronlar atom çekirdeğine yaklaşmalıdır.
Klasik fizikte elektronlar, protonun yükü tarafından çekilmeseler bile çekirdeğe düşmelidir. İlk atom modellerinde, tıpkı bir gezegenin güneşin etrafında dönmesi gibi, çekirdeğin etrafında dönen elektronlar vardı. Bir daire içinde yörüngede dolanmak, çok fazla yön değişikliği yaratmak anlamına gelir, bu da hızlanma anlamına gelir. Ne zaman elektrik şarjı ivmeye maruz kaldığında elektromanyetik radyasyon yayar. Elektromanyetik radyasyon enerjidir ve bir elektron iki tür enerjiden birini kaybedebilir: kinetik enerji veya potansiyel enerji.
yarıçap
Ağır çekirdeklerin bozunmasının analizi, Rutherford'un tahminini iyileştirdi ve çekirdeğin yarıçapını basit bir ilişki ile kütle numarasıyla ilişkilendirdi:
,sabit nerede.
Çekirdeğin yarıçapı tamamen geometrik bir özellik olmadığı ve öncelikle nükleer kuvvetlerin etki yarıçapı ile ilişkili olduğu için, değer, analiz sırasında değerin elde edildiği sürece, ortalama değer m'ye, dolayısıyla yarıçapa bağlıdır. çekirdeğin metre cinsinden:
Her iki durumda da, çekirdeğe çarpacak. Kinetik ve potansiyel enerji çözümü. Uzayda yüzen bir elektronik düşünelim. Kinetik ve potansiyel enerjisini nasıl ölçeriz? Uzakta bir proton hayal ederek başlayın. Birlikte birleşebilir ve bir hidrojen atomu oluşturabilirler. Birbirlerine olan ilerlemelerini enerji açısından ölçtüğümüzde, klasik fizikte gördüklerimizin çoğunu göreceğiz.
Protona yaklaşan bir elektronun kinetik enerjisi ve potansiyel enerjisi olacaktır. Uzakta olduğunda, nispeten büyük bir miktarı olacaktır. potansiyel enerji, tıpkı yerden yüksekte bulunan nesnelerin çok büyük miktarda potansiyel enerjiye sahip olması gibi. Protona doğru hareket ederken, bu potansiyel enerjinin bir kısmını kaybeder. Bazıları elektromanyetik enerji olarak yayılır. Bazıları kinetik enerjiye dönüştürülür. Kinetik enerji elektron sıçramasını tutar ve çekirdekte kalmasını ve protonla birleşmesini engeller.
Çekirdek anları
Onu oluşturan nükleonlar gibi, çekirdeğin de kendi momentleri vardır.
Döndürmek
Nükleonların kendilerine eşit mekanik momentleri veya spinleri olduğundan, çekirdeklerin de mekanik momentleri olmalıdır. Ek olarak, nükleonlar, her nükleonun belirli bir açısal momentumu ile de karakterize edilen yörünge hareketinde çekirdeğe katılır. Yörünge momentleri yalnızca tamsayı değerleri alır (Dirac sabiti). Nükleonların tüm mekanik momentleri, hem spinler hem de yörüngeler, cebirsel olarak toplanır ve çekirdeğin spinini oluşturur.
Burada, güverte protonlarla birleştirilmeyen elektronlar lehine biraz katlanmış durumda. Elektron çekirdekteyse kinetik enerji sonsuzdur. Elektron çekirdekte ise potansiyel enerji negatif sonsuzdur. Herhangi bir noktadaki kinetik enerjiyi hesaplamak isterseniz, bu potansiyel enerjinin yarısıdır. Başka bir deyişle, kinetik enerji daha fazla ağırlığa sahiptir ve elektron çekirdeğin dışında kalır.
Elektronları, büyük bir madde parçasının etrafında dönen küçük madde parçaları olarak düşünmekte bir sorun var. Aslında bu şekilde davranmıyorlar. Elektron bir gezegen olarak düşünülemez ve bunun yerine bir tür olasılık bulutu olarak düşünülmelidir. Ve bunun hakkında düşünmenin en yararlı yolu olduğu anlamında değil - elektronun gerçekte ne olduğu budur. Bir elektronun davranışını anlamak için, bu bulutun nerede en yoğun olacağını veya nerede olacağını düşünmeliyiz. büyük ihtimalle elektron veya maksimum negatif yükün olduğu yer.
Bir çekirdekteki nükleonların sayısının çok büyük olabilmesine rağmen, çekirdeğin dönüşleri genellikle küçüktür ve aynı adı taşıyan nükleonların etkileşiminin özelliği ile açıklanan birkaç taneden fazla değildir. Tüm eşleşmiş protonlar ve nötronlar, yalnızca dönüşleri birbirini yok edecek şekilde etkileşir, yani çiftler her zaman antiparalel dönüşlerle etkileşir. Bir çiftin toplam yörünge momentumu da her zaman sıfırdır. Sonuç olarak, çift sayıda proton ve çift sayıda nötrondan oluşan çekirdeklerin mekanik bir momentumu yoktur. Sıfır olmayan dönüşler sadece bileşimlerinde eşleşmemiş nükleonlara sahip çekirdekler için mevcuttur, böyle bir nükleonun dönüşü kendi yörünge momentumuna eklenir ve bir yarı tamsayı değerine sahiptir: 1/2, 3/2, 5/2. Tek-tek bileşimli çekirdeklerin tamsayı dönüşleri vardır: 1, 2, 3, vb.
atom çekirdeğinin bölünmesi
Uzayın her küçük hacmini bir olasılık ölçer ile ölçseydiniz, bunu yapmanız dışında, proton-hidrojen çekirdeğine olan yolculuğa tekrar bakalım. Çekirdekten uzakta, bir olasılık ölçer, pratik olarak hiçbir negatif yük olasılığını kaydetmez. Yavaşça yaklaşırken, sayaç çekirdekteki en yüksek olasılığı kaydedene kadar yükselir ve yükselir. Bu, yukarıda anladığımızla ve gerçeklikle çelişiyor gibi görünüyor.
Buradaki hile, çekirdekten belirli bir uzaklıkta bulunan bir çizgi üzerindeki küçük bir alanın en iyi yol Bir elektronun herhangi bir uzay hacminde olma olasılığını ölçmek. Elektronun çekirdeğin üstünde, altında, solunda veya sağında olup olmadığı umurumuzda değil. Sadece biraz uzakta olmasını istiyoruz. Bu, çekirdeğin etrafındaki küresel "kabuk" üzerinde herhangi bir yerde olabileceği anlamına gelir. İstediğimiz şey bu kabuğun hacmi.
manyetik moment
Spin ölçümleri, doğrudan ilişkili manyetik momentlerin varlığı ile mümkün olmuştur. Manyetonlarda ölçülürler ve farklı çekirdekler için -2 ila +5 nükleer magneton arasındadırlar. Nispeten büyük nükleon kütlesi nedeniyle, çekirdeklerin manyetik momentleri elektronlarınkiyle karşılaştırıldığında çok küçüktür, bu nedenle onları ölçmek çok daha zordur. Spinler gibi, manyetik momentler de spektroskopik yöntemlerle ölçülür, en doğru olanı nükleer manyetik rezonans yöntemidir.
Spin gibi çift çiftlerin manyetik momenti sıfıra eşittir. Eşlenmemiş nükleonlara sahip çekirdeklerin manyetik momentleri, bu nükleonların içsel momentleri ve eşlenmemiş protonun yörünge hareketiyle ilişkili moment tarafından oluşturulur.
Elektrik kuadrupol momenti
Birliğe eşit veya daha büyük bir dönüşe sahip atom çekirdekleri, tam olarak küresel olmadıklarını gösteren sıfır olmayan dört kutuplu momentlere sahiptir. Çekirdek dönme ekseni boyunca uzatılmışsa (iğne biçimli gövde), çekirdek dönme eksenine dik bir düzlemde gerilmişse (lentiküler gövde) dört kutuplu moment artı işaretine sahiptir. Pozitif ve negatif dört kutuplu momentlere sahip çekirdekler bilinmektedir. Elektrik alanında küresel simetri olmamasısıfır olmayan bir dört kutuplu momente sahip bir çekirdek tarafından yaratılan, atom elektronlarının ek enerji seviyelerinin oluşumuna ve atomların spektrumlarında, aralarındaki mesafeler dört kutuplu momente bağlı olan aşırı ince yapı çizgilerinin ortaya çıkmasına neden olur. .
bağ enerjisi
Çekirdek kararlılığı
Kütle numaraları 50-60'tan büyük veya daha az olan nüklidler için ortalama bağlanma enerjisindeki bir azalma gerçeğinden, küçük çekirdekli çekirdekler için füzyon işleminin enerjik olarak uygun olduğu - termonükleer füzyon, kütlede bir artışa yol açar. sayı ve büyük olan çekirdekler için - fisyon süreci. Şu anda, enerjinin serbest bırakılmasına yol açan bu süreçlerin her ikisi de gerçekleştirilmiştir, ikincisi modern nükleer enerjinin temelidir ve birincisi geliştirme aşamasındadır.
Ayrıntılı çalışmalar, çekirdeklerin kararlılığının, parametreye - nötron ve proton sayısının oranına - önemli ölçüde bağlı olduğunu göstermiştir. Ortalama olarak, en kararlı çekirdekler için, bu nedenle, hafif nüklidlerin çekirdekleri en kararlıdır ve artan kütle sayısı ile protonlar arasındaki elektrostatik itme giderek daha belirgin hale gelir ve kararlılık bölgesi ( açıklayıcı şekle bakın).
Doğada meydana gelen kararlı nüklidlerin tablosunu düşünürsek çift ve tek değerlere göre dağılımlarına dikkat edebiliriz ve . Bu niceliklerin çift değerlerine sahip tüm çekirdekler, hafif nüklidlerin çekirdeğidir , , , . Tek A'ya sahip izobarlar arasında, kural olarak, yalnızca biri kararlıdır. Çiftler söz konusu olduğunda, genellikle iki, üç veya daha fazla kararlı izobar vardır, bu nedenle çift-çift olanlar en kararlı, en az - tek-tek olanlardır. Bu fenomen, hem nötronların hem de protonların antiparalel çiftlerde kümelenme eğiliminde olduğunu gösterir.
1920'lere gelindiğinde fizikçiler, 1911'de E. Rutherford tarafından keşfedilen atom çekirdeklerinin ve atomların kendilerinin karmaşık bir yapıya sahip olduğundan artık şüphe duymuyorlardı. O zamana kadar birikmiş sayısız deneysel gerçekle buna ikna oldular: radyoaktivitenin keşfi, çekirdeğin nükleer modelinin deneysel kanıtı, elektron için e / m oranının ölçümü, a-parçacığı ve so- için. H-parçacığı olarak adlandırılan - hidrojen atomunun çekirdeği, yapay radyoaktivitenin keşfi ve nükleer reaksiyonlar, atom çekirdeği yüklerinin ölçümü vb. Artık kesin olarak kanıtlanmıştır. o atom çekirdeği çeşitli unsurlar Proton ve nötron olmak üzere iki parçacıktan oluşurlar.
Bu parçacıkların ilki, tek bir elektronun çıkarıldığı bir hidrojen atomudur. Bu parçacık, içindeki e / m oranını ölçmeyi başaran J. Thomson'ın (1907) deneylerinde zaten gözlemlendi. 1919'da E. Rutherford, birçok elementin atom çekirdeğinin fisyon ürünlerinde hidrojen atomunun çekirdeğini keşfetti. Rutherford bu parçacığa proton adını verdi. Protonların tüm atom çekirdeğinin bir parçası olduğunu öne sürdü. Rutherford'un deneylerinin şeması, Şek. on bir.
Rutherford'un cihazı, içinde bir a-parçacık kaynağı olan bir K kabının bulunduğu, boşaltılmış bir odadan oluşuyordu. Bölme penceresi, kalınlığı α parçacıklarının içinden geçemeyeceği şekilde seçilen metal folyo Ф ile kaplandı. Pencerenin dışında çinko sülfürle kaplanmış perde E vardı. Mikroskobu M kullanarak, ağır yüklü parçacıkların ekrana çarptığı noktalarda sintilasyonları gözlemlemek mümkün oldu. Bölme düşük basınçta nitrojen ile doldurulduğunda, ekranda F folyoya nüfuz edebilen ve α-parçacıklarının akışını neredeyse tamamen bloke eden bazı parçacıkların akışının görünümünü gösteren ışık parlamaları belirdi.
Rutherford, E ekranını kamera penceresinden uzaklaştırarak ölçtü. ücretsiz yol demek Havada gözlenen parçacıklar. Yaklaşık olarak 28 cm'ye eşit olduğu ortaya çıktı, bu da daha önce J. Thomson tarafından gözlemlenen H-parçacıklarının yol uzunluğunun tahminiyle çakıştı. Elektrik ve manyetik alanlar tarafından nitrojen çekirdeğinden fırlatılan parçacıklar üzerindeki etki üzerine yapılan çalışmalar, bu parçacıkların pozitif bir temel yüke sahip olduğunu ve kütlelerinin bir hidrojen atomunun çekirdeğinin kütlesine eşit olduğunu göstermiştir. Daha sonra, deney bir dizi başka gaz halinde madde ile gerçekleştirildi. Her durumda, α-parçacıklarının, bu maddelerin çekirdeklerinden H-parçacıklarını veya protonları nakavt ettiği bulundu. Modern ölçümlere göre, pozitif yük proton, temel yüke tam olarak eşittir e = 1.60217733 10 –19 C, yani modülde eşittir negatif yük elektron. Şu anda, proton ve elektron yüklerinin eşitliği 10-22 doğrulukla doğrulanmıştır. Birbirine benzemeyen iki parçacığın yüklerinin böyle bir çakışması şaşırtıcıdır ve modern fiziğin temel gizemlerinden biri olmaya devam etmektedir.
Şekil 11. Rutherford'un nükleer fisyon ürünlerindeki protonları saptama deneylerinin şeması. K - radyoaktif bir a-parçacık kaynağı, F - metal folyo, çinko sülfür ile kaplanmış E - ekran, M - mikroskop içeren kurşun kap.
proton kütlesi, modern ölçümlere göre, mp = 1.67262 10 -27 kg'a eşittir. Nükleer fizikte, bir parçacığın kütlesi genellikle, kütle numarası 12:1 a.u olan bir karbon atomunun kütlesinin 1/12'sine eşit atomik kütle birimleri (a.m.u.) olarak ifade edilir. em = 1.66057 10 -27 kg.
Bu nedenle, m p \u003d 1.007276 a. e. m Birçok durumda, bir parçacığın kütlesini, E = mc 2 formülüne göre eşdeğer enerji değerlerinde ifade etmek uygundur. 1 eV = 1.60218 10 -19 J olduğundan, enerji birimlerinde proton kütlesi 938.272331 MeV'dir. Böylece Rutherford deneyinde, hızlı α-parçacıklarının çarpması sırasında nitrojen ve diğer elementlerin çekirdeklerinin bölünmesi olgusu keşfedildi ve protonların atom çekirdeğinin bir parçası olduğu gösterildi. Protonun keşfinden sonra atom çekirdeğinin sadece protonlardan oluştuğu öne sürülmüştür. Bununla birlikte, bu varsayımın savunulamaz olduğu ortaya çıktı, çünkü çekirdeğin yükünün kütlesine oranı, çekirdeğin bileşimine yalnızca protonlar dahil edilmiş olsaydı olacağı gibi, farklı çekirdekler için sabit kalmaz. Daha ağır çekirdekler için bu oranın hafif olanlara göre daha küçük olduğu, yani daha ağır çekirdeklere geçerken çekirdeğin kütlesi yükten daha hızlı büyür. 1920'de Rutherford, çekirdeğin bileşiminde, elektriksel olarak nötr bir oluşum olan, kütlesi yaklaşık olarak bir protonun kütlesine eşit olan bir parçacık olan, katı bir şekilde bağlı bir kompakt proton-elektron çiftinin varlığını varsaydı. Bu varsayımsal parçacık için bir isim bile buldu - nötron.
Çok güzeldi, ama sonradan ortaya çıktığı gibi, hatalı bir fikirdi. Elektron bir çekirdeğin parçası olamaz. Belirsizlik ilişkisine dayanan kuantum-mekanik hesaplama, çekirdekte, yani R ≈ 10-13 cm büyüklüğünde bir bölgede lokalize olan bir elektronun devasa bir alana sahip olması gerektiğini göstermektedir. kinetik enerji, birçok büyüklük sırası olan nükleer bağlanma enerjisi parçacık başına. Ağır bir nötr parçacığın varlığı fikri Rutherford'a o kadar çekici geldi ki, James Chadwick liderliğindeki bir grup öğrencisini hemen böyle bir parçacığı aramaya davet etti. On iki yıl sonra, 1932'de Chadwick, berilyum α-parçacıkları ile ışınlandığında meydana gelen radyasyonu deneysel olarak araştırdı ve bu radyasyonun, kütlesi yaklaşık olarak bir protonun kütlesine eşit olan bir nötr parçacık akımı olduğunu buldu. Nötron bu şekilde keşfedildi. Şek. Şekil 12, nötronları tespit etmek için kurulumun basitleştirilmiş bir diyagramını göstermektedir.
Berilyum, radyoaktif polonyum tarafından yayılan a-parçacıkları ile bombalandığında, 10-20 cm kalınlığında bir kurşun tabakası gibi bir engelin üstesinden gelebilecek güçlü nüfuz edici radyasyon ortaya çıkar.Bu radyasyon, Joliot-Curie eşleri Irene ve Chadwick ile neredeyse aynı anda gözlemlendi. Frederic (Irene, Pierre Curie'nin kızıdır), ancak bunların yüksek enerjili gama ışınları olduğunu varsaydılar. Berilyum radyasyonunun yoluna bir parafin levha yerleştirilirse, bu radyasyonun iyonlaştırıcı gücünün keskin bir şekilde arttığını bulmuşlardır. Berilyum radyasyonunun, bu hidrojen içeren maddede büyük miktarlarda bulunan protonları parafinden çıkardığını kanıtladılar. Protonların havadaki serbest yoluna dayanarak, bir çarpışmada protonlara gerekli hızı verebilen γ-kuantanın enerjisini tahmin ettiler.
Çok büyük olduğu ortaya çıktı - yaklaşık 50 MeV. 1932'de J. Chadwick, berilyumun α-parçacıkları ile ışınlanmasından kaynaklanan radyasyonun özelliklerinin kapsamlı bir çalışması üzerine bir dizi deney yaptı. Chadwick, deneylerinde iyonlaştırıcı radyasyonu incelemek için çeşitli yöntemler kullandı. Şek. Şekil 12, yüklü parçacıkları algılamak için tasarlanmış bir Geiger sayacını göstermektedir. İçeride metal bir tabaka (katot) ile kaplanmış bir cam tüp ve tüpün ekseni (anot) boyunca uzanan ince bir iplikten oluşur. Tüp, düşük basınçta bir soy gazla (genellikle argon) doldurulur. Bir gazın içinden uçan yüklü bir parçacık, moleküllerin iyonlaşmasına neden olur. İyonizasyon sonucu oluşan serbest elektronlar hızlandırılır. Elektrik alanı anot ve katot arasında darbe iyonizasyonunun başladığı enerjilere. Bir iyon çığı belirir ve sayaçtan kısa bir deşarj akımı darbesi geçer. Parçacıkları incelemek için bir başka önemli araç, hızlı yüklü bir parçacığın bir iz (iz) bıraktığı sözde bulut odasıdır. Parçacık yörüngesi doğrudan gözlemlenebilir veya fotoğraflanabilir.
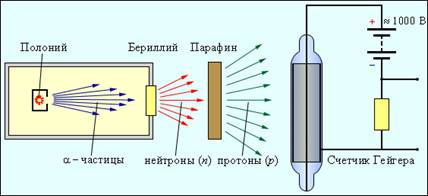
Şekil 12. Nötron tespiti için kurulum şeması.
1912'de oluşturulan bulut odasının hareketi, aşırı doymuş buharın, yüklü bir parçacığın yörüngesi boyunca odanın çalışma hacminde oluşan iyonlar üzerinde yoğunlaşmasına dayanır. Bir bulut odası kullanarak, yüklü bir parçacığın yörüngesinin eğriliği elektrik ve manyetik alanlar. J. Chadwick, deneylerinde berilyum radyasyonu ile çarpışma yaşayan nitrojen çekirdeklerinin bulut odasındaki izlerini gözlemledi. Bu deneylere dayanarak, nitrojen çekirdeklerini deneyde gözlemlenen hız konusunda bilgilendirebilen γ-kuantumun enerjisinin bir tahminini yaptı. 100-150 MeV'ye eşit olduğu ortaya çıktı. Böyle büyük bir enerji berilyum tarafından yayılan γ-kuantaya sahip olamaz. Bu temelde, Chadwick, berilyumdan, α-parçacıklarının etkisi altında, kütlesiz γ-kuantanın uçmadığını, daha ziyade ağır parçacıkların uçtuğu sonucuna varmıştır.
Bu parçacıklar oldukça nüfuz edici olduklarından ve Geiger sayacındaki gazı doğrudan iyonize etmedikleri için elektriksel olarak nötrdüler. Varlığı bu şekilde kanıtlanmıştır. nötron- Rutherford tarafından Chadwick'in deneylerinden 10 yıl önce tahmin edilen parçacıklar. nötron temel parçacık. Başlangıçta Rutherford tarafından önerildiği gibi, kompakt bir proton-elektron çifti olarak temsil edilmemelidir. Modern ölçümlere göre, nötron kütlesi m n \u003d 1.67493 10 -27 kg \u003d 1.008665 a.u. e. m. Enerji birimlerinde, nötron kütlesi 939.56563 MeV'dir. Bir nötronun kütlesi, bir protonun kütlesinden yaklaşık olarak iki elektron kütlesi daha fazladır. Nötronun keşfinden hemen sonra, Rus bilim adamı D. D. Ivanenko ve Alman fizikçi V. Heisenberg, atom çekirdeğinin proton-nötron yapısı hakkında, sonraki çalışmalarla tamamen doğrulanan bir hipotez ortaya koydu.
Protonlar ve nötronlar denir nükleonlar. Atom çekirdeğini karakterize etmek için bir dizi gösterim sunulmuştur. Atom çekirdeğini oluşturan proton sayısı Z sembolü ile gösterilir ve buna denir. Görev numarası veya atom numarası (bu, Mendeleev'in periyodik tablosundaki seri numarasıdır). Nükleer yük Ze'dir, burada e temel ücret. Nötron sayısı N sembolü ile gösterilir. Toplam sayısı nükleonlar (yani protonlar ve nötronlar) denir. kütle Numarası A: A=Z+N.
Kimyasal elementlerin çekirdekleri sembolü ile gösterilir, burada X elementin kimyasal sembolüdür. Örneğin, - hidrojen, - helyum, - oksijen, - karbon, - uranyum. Aynı kimyasal elementin çekirdeği, nötron sayısında farklılık gösterebilir. Bu tür çekirdeklere denir izotoplar. Çoğu kimyasal elementin birkaç izotopu vardır. Örneğin hidrojenin üç izotopu vardır: - sıradan hidrojen, - döteryum ve - trityum. Karbonun 6, oksijenin 3 izotopu vardır. Kimyasal elementler içinde doğal şartlar genellikle izotopların bir karışımıdır. İzotopların varlığı, Mendeleev'in periyodik tablosundaki doğal bir elementin atom kütlesinin değerini belirler. Yani örneğin akraba atom kütlesi doğal karbon 12.011'dir.






