Nötronun kütle numarası aynıdır. Petrol ve gazın büyük ansiklopedisi
Fizik 9. Sınıf
Konu: Atomun yapısı ve atom çekirdeği. Atom çekirdeğinin enerjisinin kullanımı
56. Ders Kütle Numarası. Şarj
sayı. nükleer kuvvetler
Yeryutkin Evgeny Sergeevich
Fizik öğretmeni en yüksek kategori GOU SOSH №1360
Moskova
Merhaba! Bugünün dersi atom çekirdeğinin yapısı, yük numarası, kütle numarası ile ilgili bir soruya ayrılacak, ayrıca ne olduğu hakkında konuşacağız. nükleer kuvvetler. Dersimiz, daha önce çalışılan tüm konularda bazı ara sonuçların bir özetidir. Atomun yapısı ve çekirdeğin yapısı ile ilgili soruları incelediğimizi söylemek isterim. Bu nedenle, bugün bunun hakkında konuşacağız. Önceki konuların bazı özeti, önceki sorular. İlk soruya geçmeden önce bunun hakkında konuşacağız. Bir önceki derste, Rutherford'un deneylerinde proton gibi bir parçacığın var olduğunu belirlediğini söylemiştik. Bir süre sonra, 1932'de Chadwick, nötron adı verilen başka bir parçacık olduğunu keşfetti. Bu keşiften sonra birbirinden bağımsız iki kişi, Rus bilim adamı Ivanenko ve Alman bilim adamı Heisenberg, atom çekirdeğinin yapısı için bir proton-nötron modeli önerdiler. Bu Ivanenko-Heisenberg teorisine göre, herhangi bir atomun çekirdeği proton ve nötron içerir. Bu protonlar ve nötronlar birlikte, bir atomun çekirdeğinde bulunanlara nükleon adı verilmesine karar verildi. Böylece, "nükleon" (Latince "çekirdek"ten) - proton ve nötronların ortak adı. Yükü olan parçacıklara ve yükü olmayan parçacıklara nötronlar, tüm bu parçacıkların hepsine birlikte nükleon denir. Başka bir şeyden bahsedelim. Nükleer yük fikri ilk olarak 1913 yılında İngiliz bilim adamı Henry Moseley tarafından ortaya atıldı. Atom elektriksel olarak nötr olduğundan, sıranın eleman numarası, temel ile çarpılır elektrik şarjı, bu çekirdeğin yüküdür. Moseley bu sonuca nasıl ulaştı? Gerçek şu ki, bir atomdaki elektron sayısı seri numarasına karşılık gelir. Bu, tüm elektronların yükünün, seri numarasının ve bir elektronun yükünün ürünü olduğu anlamına gelir. Çekirdek yoğun olduğu için pozitif yük, aynı şey çekirdek için de söylenebilir. Nasıl geldiğine bir göz atalım Moseley tam olarak şarj numarası dediğimiz şeye. Bak:
qben = Z . | e|
qben- nükleer yük
e - elektron yükü
Zçekirdekteki proton sayısı, yük sayısı
Bu açıklamaya göre bir sayının yükü, seri numarasının ve temel elektrik yükünün ürünü olarak tanımlanır. Bu durumda e - bu elektronun yüküdür, buna temel elektrik yükü denir ve modulo alınır, çünkü çekirdeğin yükünün pozitif olduğu açıktır. Bu durumda seri numarası şarj numarası olarak adlandırılmaya başlandı, seri numarası çekirdekteki proton sayısına karşılık gelen sayıdır. Böylece seri numarasından bahsettiğimizde çekirdekteki proton sayısından da bahsedebiliriz. Bahsedilecek bir sonraki sayı kütle numarasıdır. Bu sayı A harfi ile gösterilir ve aynı sayı periyodik tablodan alınır ve tam sayılara yuvarlanır. O zaman tüm dünyada Ivanenko-Heisenberg denklemi olarak adlandırılan denklemden bahsedebiliriz. Bu denklem üç sayıdan oluşur: kütle numarası, yük sayısı ve nötron sayısı. Nasıl yazıldığını ve bu miktarların nasıl ifade edildiğini görelim.
Ivanenko-Heisenberg denklemi
bir =Z + N
A kütle numarasıdır
Zeleman numarasıdır,
Nçekirdekteki nötron sayısıdır
Bakın: A kütle numarası ne kadar olduğunu söyler nükleonlarçekirdeğe girer. Periyodik tabloya göre kütle numarasının belirlendiği ortaya çıktı. kimyasal element, bir atomun çekirdeğindeki nükleon sayısını belirleriz.
Z, dediğimiz gibi, çekirdekteki seri numarası ve proton sayısı olacaktır. Bu durumda N, nötron sayısıdır. Böylece kütle numarası ve seri numarasını bilerek bu denklemden nötron sayısını, proton sayısını belirleyebiliriz. Burada önemli bir noktaya dikkat etmek gerekiyor. Gerçek şu ki, 1913'te başka bir bilim adamı Soddy (bu adamın Rutherford'la çalıştığını hatırlarsınız) ilginç bir şey ortaya koydu. Tamamen aynı kimyasal özelliklere sahip ancak farklı kütle numaralarına sahip kimyasal elementler olduğu bulundu. Aynı özelliklere sahip elementler Kimyasal özellikler, ancak farklı kütle numaralarıyla izotoplar olarak bilinir hale geldi. izotoplar - Bunlar aynı kimyasal özelliklere sahip kimyasal elementlerdir, ancak farklı ağırlık atom çekirdeği.
İzotopların farklı radyoaktiviteye sahip olduğunu da eklemek gerekir. Bütün bunlar birlikte bu konunun araştırılmasına yol açtı. Hafif ve ağır kimyasal elementlerin izotoplarını gösterir. Bakalım. Hemen hemen tüm kimyasal elementlerin izotopları olduğunu göstermek için periyodik tablonun özellikle farklı alanlarını seçtik.
izotoplar:
H - protiyumsen
H - döteryumsen
H - trityum
Hidrojen bu izotoplardan üçüne sahiptir. İlk izotop H'ye protium denir. Lütfen seri numarasının aşağıya yerleştirildiğini, bunun Z sayısı olduğunu ve kütle numarasının üstte yazıldığını unutmayın - bu A sayısıdır. A'nın üstünde, Z'nin altında ve bunun, bunun çekirdeğinde olduğu anlamına geldiğini anlarsak. protium atomu evrende en yaygın olan, en basit kimyasal elementtir. Sadece 1 proton vardır ve bu çekirdekte hiç nötron yoktur. İkinci bir hidrojen türü var - döteryum. Muhtemelen birçoğu bu kelimeyi duymuştur. Lütfen dikkat: seri numarası 1 ve kütle numarası 2'dir. Yani döteryum çekirdeği zaten 1 proton ve bir nötrondan oluşmaktadır. Ve hidrojenin başka bir izotopu var. Buna trityum denir. Trityum sadece (seri numarası bir) ve kütle numarası bu izotopun çekirdeğinde 2 nötron olduğunu gösterir. Diğer bir element ise uranyumdur. Periyodik tablonun oldukça diğer tarafı. Bunlar zaten ağır elementlerdir. Uranyumun 2 ortak izotopu vardır. Bu uranyum 235. Seri numarası 92 ve kütle numarası 235. Bir elementin çekirdeğinin diğerinden nasıl farklı olduğu hakkında hemen konuşabilirsiniz. İkinci izotop: ayrıca seri numarası 92 ve kütle numarası 238. söz konusu izotoplar, özellikle uranyum hakkında asla seri numarası söylemeyin. Sadece “uranyum” diyorlar, kimyasal elementin adını veriyorlar ve kütle numarası 238 diyorlar. Veya uranyum 235. Bu kimyasal elementin bugün ülkemizin enerjisi için ne kadar önemli olduğunu bildiğimiz için bu konuyu tartışıyoruz. bir bütün olarak dünya enerjisi için genel.
Dokunmamız gereken bir sonraki soru, söylenenlerden kaynaklanmaktadır. Bu parçacıklar, bu nükleonlar çekirdeğin içinde nasıl tutulur? Özellikle ağır elementler için farklı kimyasal elementler, farklı izotoplar olarak adlandırdık, burada nükleonlar yani. protonlar ve nötronlar, çok. Nasıl, nasıl çekirdeğin içinde tutulurlar? Küçük mesafeli bir çekirdekte, çekirdeğin boyutunun çok çok küçük olduğunu, çok sayıda nükleon parçacığının toplanabileceğini biliyoruz. Bu nükleonlar orada nasıl bu kadar yoğun, hangi kuvvetler tarafından sıkı sıkıya tutuluyor? Gerçekten de, elektrostatik itme nedeniyle, bu parçacıkların çok hızlı bir şekilde parçalanması, dağılması gerekir. Sadece zıt yüklerin, zıt yüklerle yüklü parçacıkları çektiğini biliyoruz. Parçacıklar aynı isimle yüklüyse, itmeleri gerektiği açıktır. Çekirdeğin içinde protonlar bulunur. Pozitif yüklüdürler. Çekirdek boyutu çok küçüktür. Aynı çekirdekte nötronlar da vardır, bu da bu parçacıkları ve diğer parçacıkları bir arada tutan kuvvetlerin olması gerektiği anlamına gelir. Bu kuvvetlere nükleer kuvvetler denir. Nükleer kuvvetler, nükleonlar arasında hareket eden çekici kuvvetlerdir.. Bu kuvvetlerin kendilerine has özellikleri olduğunu söyleyebiliriz.
Konuşmamız gereken ilk özellik, nükleer kuvvetler, elektrostatik itme kuvvetlerini aşmalıdır. Ve bu böyle, onları belirlemek mümkün olduğunda, elektrostatik itme kuvvetlerinden 100 kat daha büyük oldukları ortaya çıktı. Bir diğer çok önemli not da şudur. nükleer kuvvetler kısa bir mesafede çalışır. Örneğin, 10-15 m - bu çekirdeğin çapıdır, bu kuvvetler etki eder. Ancak çekirdeğin boyutu, biraz gibi görünen 10-14'e çıkar çıkmaz, bu, çekirdeğin mutlaka bozunacağı gerçeğine yol açar. Bu mesafede, nükleer kuvvetler artık aktif değildir. Ve elektrostatik itme kuvvetleri hareket etmeye devam ediyor ve çekirdeğin bozunmasından sorumlu olan onlardır.
Nükleer kuvvetler hakkında söylenecek başka bir şey de şudur: onlar merkezi değil, yani bu parçacıkları birbirine bağlayan düz çizgi boyunca hareket etmezler. Ve nükleer kuvvetlerin parçacığın bir yükü olup olmamasına bağlı olmadığı gerçeği, çünkü hem protonlar hem de nötronlar çekirdeğe girer. Bu parçacıklar bir arada. Böylece, sonuç şudur: bu parçacıklar, nükleonlar, nükleer kuvvetler nedeniyle çekirdekte tutulur ve bu kuvvetler sadece çekirdeğe etki eder. Nükleer kuvvetlerin nükleer istikrar açısından da önemli olduğu belirtilebilir. Bu elementin varlığının uzun ömürlülüğünden sorumludur. Sonuç olarak, bir şeyi daha not edebiliriz: enerji hakkında konuştuğumuzda, nükleer güçlerin ana rolü tam olarak burada oynayacakları. Bundan sonraki derslerde bunun hakkında konuşacağız. Güle güle.
ders için görev.
1. Demir çekirdeklerinin nükleon bileşimini belirleyin(nükleon, proton, nötron sayısı).
2. Bir kimyasal elementin atomunun çekirdeğinde 22 proton ve 26 nötron vardır. Bu kimyasal elementi adlandırın.
3. Çekirdekteki iki nötron arasındaki yerçekimi etkileşiminin gücünü tahmin edin. Bir nötronun kütlesi yaklaşık olarak 1.7*10'a eşittir. -27 kg, nötronlar arasındaki mesafeyi 10'a eşit alın -15 m, yerçekimi sabitinin değeri 6.67 * 10-11 (N * m 2) / kg 2.
Kütle Numarası
Kütle numarasını bilmek, çekirdeğin ve atomun kütlesini tahmin etmenizi sağlar. Kütle numarası biliniyorsa, o zaman kütle M bir atom ve çekirdeği aşağıdaki bağıntıdan tahmin edilir M ≈ bir m N, nerede m N ≈ 1.67 10 −27 kg, bir nükleonun, yani bir protonun veya bir nötronun kütlesidir. Örneğin, bir alüminyum-27 atomu ve çekirdeği 27 nükleon (13 proton ve 14 nötron) içerir. Kütlesi yaklaşık olarak 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg'a eşittir. Çekirdeğin kütlesini daha doğru bir şekilde elde etmek gerekirse, çekirdekteki nükleonların nükleer çekim kuvvetleri tarafından bağlı olduğu ve bu nedenle ilişkiye uygun olarak dikkate alınmalıdır. E=mc 2 Çekirdeğin kütlesi azalır. Çekirdeğin etrafındaki yörüngelerdeki toplam elektron kütlesi de bir atomun kütlesine eklenmelidir. Ancak tüm bu düzeltmeler %1'i geçmez.
| 238 92 sen | → | 234 90 Th | + | 4 2 O |
sol tarafta ilk çekirdeğin kütle numarası 238, reaksiyonun sağ tarafında ise kütle numarası 234 ve 4 olan toplam 238 olan iki çekirdek var. (helyum-4 çekirdeği) 4'tür, alfa bozunması, bozunan çekirdeğin kütle numarasını 4 birim azaltır. Herhangi bir beta bozunması türü (beta eksi bozunması, pozitron bozunması, elektron yakalama, her tür çift beta bozunması) kütle numarasını değiştirmez, çünkü bu süreçte sadece çekirdeğin bazı nükleonlarının bir türden diğerine (protonlar) dönüşümü nötronlara veya geri). İzomerik geçiş de kütleyi değiştirmez çekirdek numarası.
Notlar
Ayrıca bakınız
Wikimedia Vakfı. 2010 .
Diğer sözlüklerde "Kütle numarası" nın ne olduğunu görün:
- (nükleon sayısı, A sembolü), ATOM NÜKLEERİNDEKİ toplam NÜKLEON (NÖTRON ve PROTON) sayısı. Genellikle elementin kimyasal sembolünden önce bir üst simge olarak yazılır. Böylece, en hafif element olan hidrojen, çekirdekte sadece bir protona sahiptir ve ... ... Bilimsel ve teknik ansiklopedik sözlük
'deki toplam nükleon sayısı (nötronlar ve protonlar). çekirdek. Aynı kimyasalın izotopları için farklıdır. öğe. Fiziksel Ansiklopedik Sözlük. M.: Sovyet Ansiklopedisi. Genel Yayın Yönetmeni A. M. Prokhorov. 1983. KİTLE SAYISI... Fiziksel Ansiklopedi
Atom çekirdeğindeki nükleon sayısı. Genellikle bir kimyasal elementin sembolünün sol üst köşesinde gösterilir (örneğin, 10V) ... Büyük Ansiklopedik Sözlük
KÜTLE NUMARASI- atom çekirdeğindeki toplam nükleon sayısı (protonlar ve nötronlar), A ile gösterilir ve örneğin ilgili elementin sembolünün sol üst köşesindeki indeks ile gösterilir. 32S, kütle numarası 32 (A = 32) olan bir kükürt izotopu anlamına gelir. İzotopun kütlesi bütüne eşittir ... ... Büyük Politeknik Ansiklopedisi
kütle Numarası- — [Ya.N. Luginsky, M.S. Fezi Zhilinskaya, Yu.S. Kabirov. İngilizce Rusça Elektrik Mühendisliği ve Güç Mühendisliği Sözlüğü, Moskova] Elektrik mühendisliği konuları, temel kavramlar EN kütle numarası ... Teknik Çevirmenin El Kitabı
Atom çekirdeğindeki nükleon sayısı. Genellikle bir kimyasal elementin sembolünün sol üst köşesinde gösterilir (örneğin, 10V). * * * KİTLE NUMARASI KİTLE NUMARASI, bir atom çekirdeğindeki nükleon sayısı. Genellikle kimyasal element sembolünün sol üst köşesinde gösterilir ... ... ansiklopedik sözlük
kütle Numarası- masės skaičius statüleri T sritis Standartizacija ve metrologija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: tür. kütle Numarası; nükleer sayı; nükleon sayısı vok. Massenzahl, f; Nukleonenzahl, f rus. kütle numarası, n; sayı… … Penkiakalbis aiskinamasis metrologijos terminų žodynas
kütle Numarası- masės skaičius statusas T sritis chemija apibrėžtis Atomo branduolio nukleonų skaičius. atitikmenys: tür. kütle Numarası; nükleer sayı; nükleon sayısı İng. kütle Numarası... Chemijos terminų aiskinamasis žodynas
kütle Numarası- masės skaičius statusas T sritis fizika atitikmenys: angl. kütle Numarası; nükleer sayı; nükleon sayısı vok. Massenzahl, f; Massezahl, f; Nukleonenzahl, f rus. kütle numarası, n prak. kitlesel isim, m; nombre de nucleons, m … Fizikos terminų žodynas
Bir atom çekirdeğindeki nükleonların (protonlar ve nötronlar) sayısı; A harfi ile gösterilir ve genellikle elementin sembolünün yanında sol üstte gösterilir, örneğin 32S, A \u003d 32 ile bir kükürt izotopu anlamına gelir. M. h. Ve temel birimlerde ifade edilen nükleer yük Z ... Büyük Sovyet Ansiklopedisi
Bir atomun merkezi, kütlesinin çoğunu ve tüm pozitif yükünü içerir. Atomun bu bölgesine çekirdek denir.
Bir atomun boyutları m'dir ve çekirdeğin boyutları 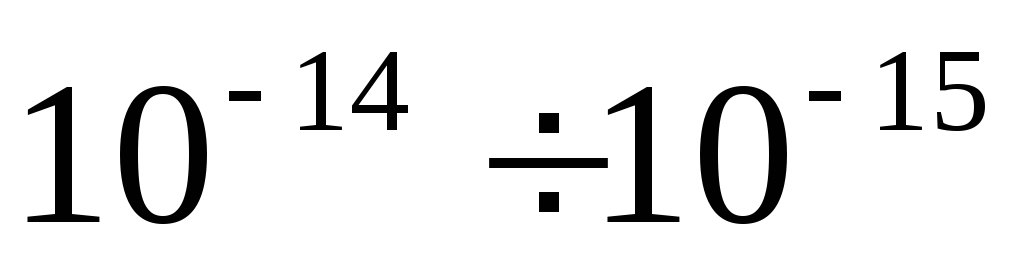 m Çekirdeğin kütlesi, atomun kütlesinin %99,95'idir. nötr bir atomda Z elektronlar. Nükleer yük pozitiftir ve temel yükün katıdır.
m Çekirdeğin kütlesi, atomun kütlesinin %99,95'idir. nötr bir atomda Z elektronlar. Nükleer yük pozitiftir ve temel yükün katıdır. 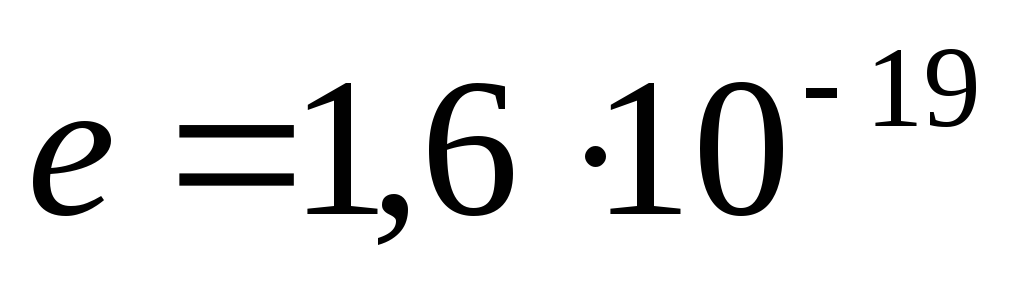 Cl. Nükleer yük şu şekilde temsil edilebilir:
Cl. Nükleer yük şu şekilde temsil edilebilir: 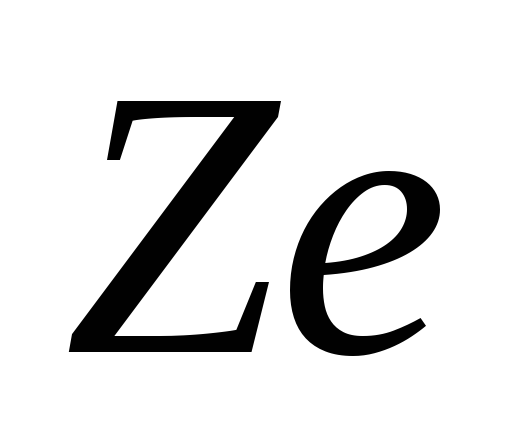 , nerede Z- yük sayısı, periyodik tablonun kimyasal numarası ile çakışır ve çekirdeğe giren proton sayısına eşittir.
, nerede Z- yük sayısı, periyodik tablonun kimyasal numarası ile çakışır ve çekirdeğe giren proton sayısına eşittir.
Çekirdeğin ikinci en önemli özelliği kütlesidir. Çekirdeğin kütlesi, çekirdeğe giren protonların kütlelerinin toplamından daha büyük olduğu ortaya çıktı.
Çekirdeğin nötr parçacıklar içerdiği öne sürüldü. 1932'de Chadwig nötronları keşfetti. Ivanenko ve Heisenberg, çekirdeğin proton-nötron teorisini önerdi. Çekirdek proton ve nötronlara bölünür. Bunlara nükleon denir. Toplam sayısıçekirdekteki nükleonlar kütle numarası denirA
.
Toplam nötron sayısı N=A-Z'dir. Bir protonun kalan kütlesi 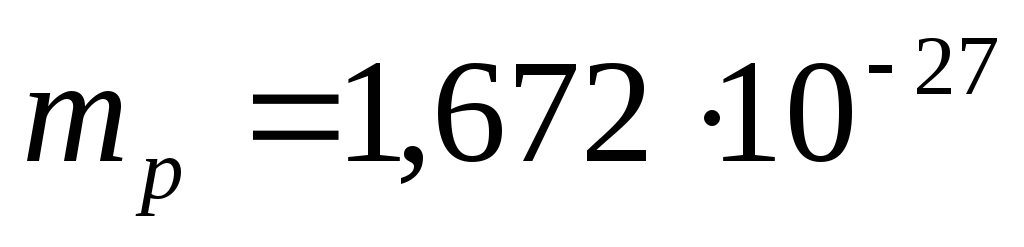 kg, nötron kütlesi
kg, nötron kütlesi 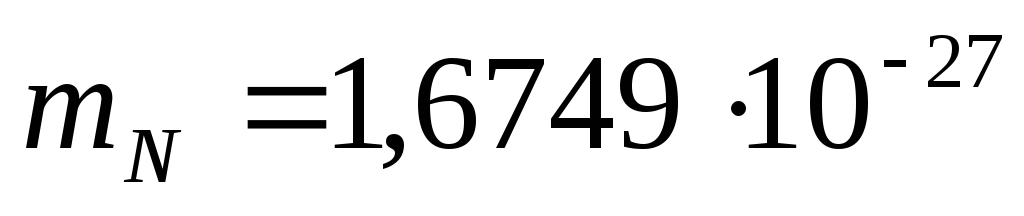 kilogram.
kilogram.
Kimyasal bir elementin çekirdeği, nötr atomla aynı sembolle gösterilir. 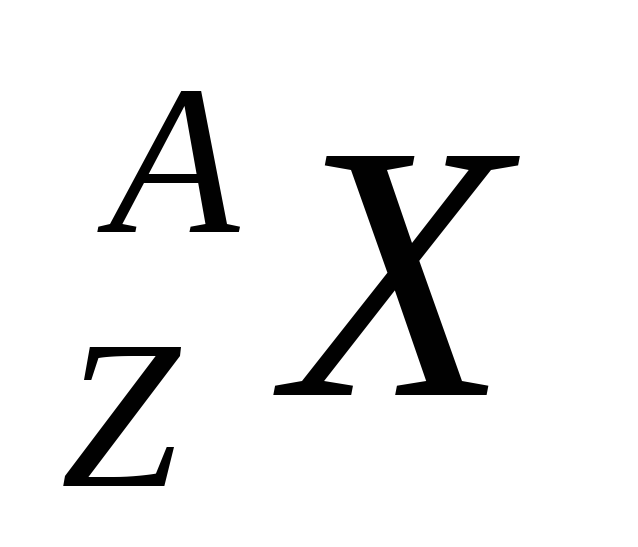 , nerede Z- atom numarası (nükleer yük), A- kütle numarası (çekirdekteki nükleon sayısı). Yük sayısı aynı fakat kütleleri farklı olan çekirdeklere izotop denir (izotopların nötron sayısı farklıdır). Aynı kütle numarasına sahip ancak farklı yüklere sahip çekirdeklere izobar denir.
, nerede Z- atom numarası (nükleer yük), A- kütle numarası (çekirdekteki nükleon sayısı). Yük sayısı aynı fakat kütleleri farklı olan çekirdeklere izotop denir (izotopların nötron sayısı farklıdır). Aynı kütle numarasına sahip ancak farklı yüklere sahip çekirdeklere izobar denir.
28. Nükleer kuvvetlerin özellikleri.
Nükleer kuvvetlerin özellikleri:
29. Radyoaktivite. Alfa ve beta bozunması. Yer değiştirme kuralları.
Radyoaktivite denir belirli parçacıkların emisyonu ile birlikte bir kimyasal elementin kararsız izotoplarının başka bir elementin izotoplarına dönüştürülmesi. Doğal radyoaktivite, doğal olarak oluşan kararsız izotoplarda gözlenen radyoaktiviteyi ifade eder. Yapay radyoaktivite, nükleer reaksiyonlar sonucunda elde edilen izotopların radyoaktivitesi olarak adlandırılır.
Radyoaktif radyasyon karmaşık bir bileşime sahiptir. Bir manyetik alanda, dar bir radyoaktif radyasyon demeti üç bileşene ayrılır:

 -parçacıklar -
bir yük ile helyum çekirdeklerinin akışı Z=2
e ve kütle numarası A=4
(
-parçacıklar -
bir yük ile helyum çekirdeklerinin akışı Z=2
e ve kütle numarası A=4
(![]() ). Hız
). Hız  -parçacıklar eşittir
-parçacıklar eşittir 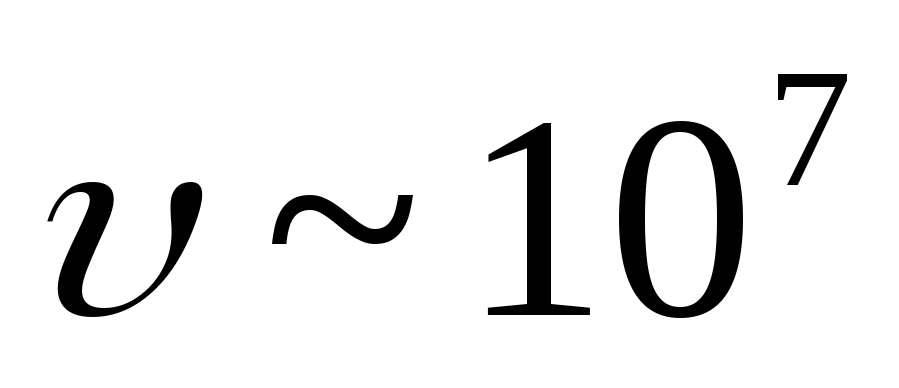 Hanım. Maddeye girmek
Hanım. Maddeye girmek  -parçacıklar atomlar ve moleküller ile aktif olarak etkileşime girer, iyonize eder ve heyecanlandırır. enerji ne zaman
-parçacıklar atomlar ve moleküller ile aktif olarak etkileşime girer, iyonize eder ve heyecanlandırır. enerji ne zaman  -parçacık termal harekete indirgenir, iki elektron yakalar ve bir helyum atomuna dönüşür ( O). Ondan önce, koşu denilen bir yoldan geçer. Madde ile güçlü etkileşimi nedeniyle menzil kısadır. Bir yaprak kağıt veya giysi tutuyor
-parçacık termal harekete indirgenir, iki elektron yakalar ve bir helyum atomuna dönüşür ( O). Ondan önce, koşu denilen bir yoldan geçer. Madde ile güçlü etkileşimi nedeniyle menzil kısadır. Bir yaprak kağıt veya giysi tutuyor  -parçacıklar. 0,05 mm kalınlığındaki alüminyum levha da geciktirir
-parçacıklar. 0,05 mm kalınlığındaki alüminyum levha da geciktirir  -parçacıklar. iyonlaşma yeteneği
-parçacıklar. iyonlaşma yeteneği  -parçacıklar büyük ve eşittir
-parçacıklar büyük ve eşittir 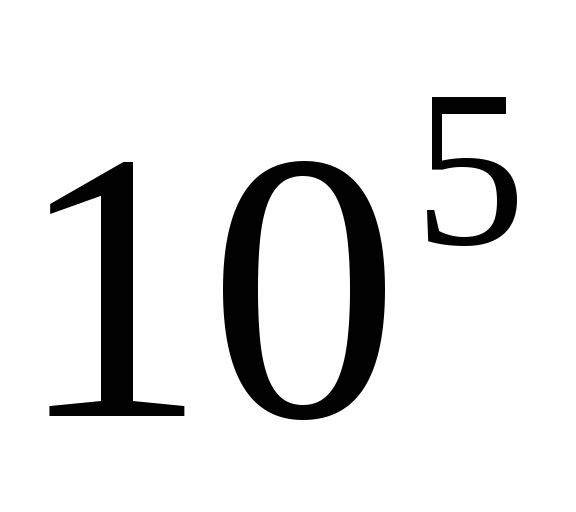 koşu boyunca buhar.
koşu boyunca buhar.
 -parçacıklar
bir hızda çekirdekten kaçan bir elektron akışıdır.
-parçacıklar
bir hızda çekirdekten kaçan bir elektron akışıdır. 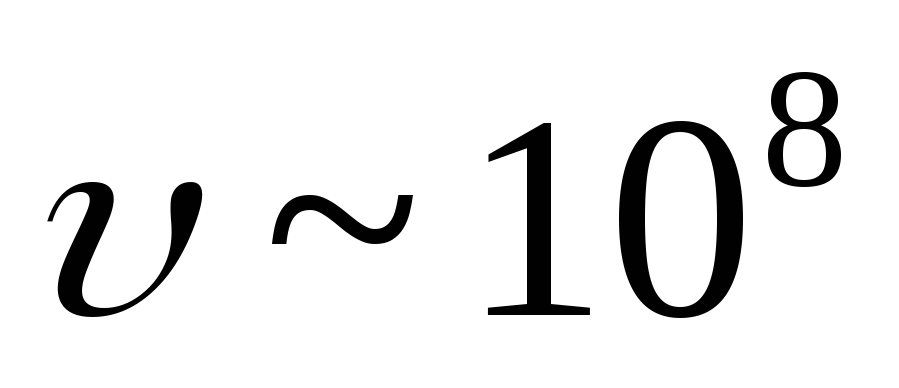 Hanım. Bir nötron bir proton olduğunda çekirdek bir elektron yayar:
Hanım. Bir nötron bir proton olduğunda çekirdek bir elektron yayar:
nerede  - elektron sembolü,
- elektron sembolü, 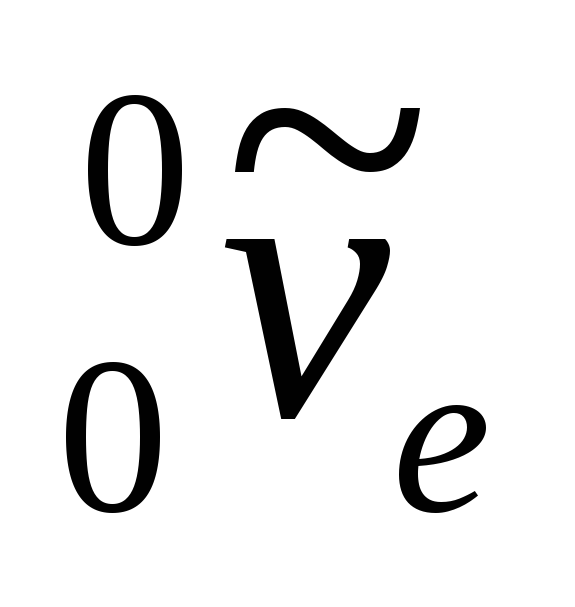 - elektron antinötrino.
- elektron antinötrino.
iyonlaşma yeteneği  parçacıklardan yüzlerce kez daha küçük
parçacıklardan yüzlerce kez daha küçük  -parçacıklar ve nüfuz etme gücü daha büyüktür.
-parçacıklar ve nüfuz etme gücü daha büyüktür.  - radyasyon, 2 mm kalınlığında bir alüminyum tabakası tarafından geciktirilir.
- radyasyon, 2 mm kalınlığında bir alüminyum tabakası tarafından geciktirilir.
Atom çekirdeği çalışmaları, aşağıdaki deneysel gerçeklerin belirlenmesinden sonra başlamıştır: 1) 1896'da Fransız bilim adamı Henri Becquerel tarafından doğal radyoaktivitenin keşfi; 2) 1910'da İngiliz bilim adamı Soddy tarafından kimyasal elementlerin izotopinin keşfi; 3) 1911'de büyük İngiliz fizikçi Ernest Rutherford tarafından önerilen atomun nükleer modeli.
Radyoaktiviteyi araştıran Rutherford, 1908'de radyoaktif bozunma sırasında bazı kimyasal elementlerin atomlarının diğer elementlerin atomlarına dönüşmesinin gerçekleştiği sonucuna vardı. Daha sonra, birkaç megaelektron voltluk bir enerjiye sahip a-parçacıklarının ince altın filmlerinden geçişini incelerken, Rutherford atomun nükleer modelini keşfetti, bundan sonra radyoaktivite sırasında bazı elementlerin çekirdeklerinin dönüştürüldüğü netleşti. diğer elementlerin çekirdekleri.
İzotopinin keşfi başka bir rol oynadı. Atom ağırlıkları, yani kimyasal olarak saf elementlerin atom kütleleri, bir kural olarak, a.m.u olarak ifade edilir. tam sayılara çok yakın olmayan sayılar. Örneğin, borun (B) atom ağırlığı 10.82'dir; Ne - 20.183; Cl - 35.457; Fe -56.85 ;… . İzotopinin keşfiyle birlikte, kimyasal olarak saf bir elementin, atom ağırlıkları bakımından birbirinden farklı izotopların bir karışımı olduğu kanısına varıldı. İzotopların atom ağırlıkları, elementlerin atom ağırlıklarından daha tam sayılara daha yakın olduğu ortaya çıktı ve daha yakın, izotop daha hafif, yani. atom ağırlığı ne kadar düşükse. Bu, bilim adamlarını çekirdeğin atom ağırlıkları bire yakın parçacıklardan oluştuğu fikrine götürdü. Bu koşul, atom ağırlığı birliğe (1.008) yakın olan bir proton olan hidrojen atomunun çekirdeği tarafından iyi karşılanır. Ek olarak, protonun yükü pozitif olduğu için, çekirdeğin bileşiminin mutlaka protonları içermesi gerektiği fikri ortaya çıktı. Çekirdeği oluşturan diğer parçacıkların anlaşılması uzun zaman aldı. Doğal β-aktivitesi olgusu, elektronların çekirdeğin bileşimine dahil edildiğini gösteriyor gibiydi. Bu nedenle, çekirdeğin bir proton-elektron modeli önerildi. Ancak, proton-elektron modelinin savunulamaz olduğu ortaya çıktı. Bu modele göre, çift sayıda proton ve elektrondan oluşan bir çekirdeğin dönüşü tamsayı olmalıdır (bir protonun dönüşü, bir elektronun dönüşü gibi ½ ħ'dir) ve pratikte, yarı tamsayı sayılardır. da gözlemlendi. Model, çekirdeğin manyetik momentinin neden elektronun manyetik momentinden 2000 kat daha az olduğunu açıklamadı. Son olarak, proton-elektron modelinin Heisenberg ilkesiyle çeliştiği ortaya çıktı. Çekirdeğin boyutunu bilerek, çekirdeğin bir parçası olan elektronun momentumunun büyüklüğünü ve dolayısıyla enerjisinin büyüklüğünü tahmin etmek mümkündür. Bu tür tahminler, bir çekirdekteki elektronun enerjisinin yaklaşık 200 MeV olduğunu verir. Deneye göre, çekirdekteki bir parçacığın bağlanma enerjisi 7 - 8 MeV'dir. Ek olarak, 200 MeV'lik enerji, β-bozunma sırasında çekirdeğin yaydığı elektronların enerjisinden birçok kat daha fazladır.
1932'de Rutherford'un çalışanı Chadwick, yeni bir temel parçacık- nötron. Bir nötronun kütlesi yaklaşık olarak bir protonun kütlesine eşittir, onu biraz aşar ve elektrik yükü 0'dır. Nötronun keşfinden kısa bir süre sonra, 1934'te Sovyet fizikçi D.D. Ivanenko, proton hakkında bir hipotez ortaya koydu. çekirdeğin nötron yapısı. Aynı hipotez Heisenberg tarafından bağımsız olarak önerildi.
Şu anda çekirdeğin proton-nötron yapısı evrensel olarak kabul edilir ve çekirdek ve tüm nükleer fizik hakkındaki modern fikirlerin temelini oluşturur.
Modern verilere göre, proton (p) pozitif bir yüke sahiptir, yüke eşit elektrot qp= 1.6. 10 -19 C ve dinlenme kütlesi m p= (1.0075957 ±0.000001) amu = (1836.09±0.01) ben.
Nötron (n) - durgun kütleli nötr parçacık mn= (1.008982 ±0.000003)a.m.u. = (1838.63 ± 0.01) ben, burada 1amu = 1.667 . C12 atomunun kütlesinin 10 -27 kg - 1/12'si;
ben= 9.106. 10-31 kg – bir elektronun kalan kütlesi.
Modern fizikte, proton ve nötronun aynı parçacığın iki yük durumu olduğuna inanılır. nükleon(lat. çekirdekten - çekirdek). Yani proton, nükleonun proton durumudur, nötron, nükleonun nötron durumudur. Atom çekirdeğindeki toplam nükleon sayısına ne denir kütle numarası A
Atom çekirdeği, Ze yükü ile karakterize edilir. , nerede Z, çekirdeğin yük sayısıdır,çekirdekteki proton sayısına eşittir ve Mendeleev'in periyodik element sistemindeki kimyasal elementin seri numarasına denk gelir. Periyodik tablonun şu anda bilinen 107 elementi, Z = 1'den Z = 107'ye kadar olan çekirdeklerin yük sayılarına sahiptir. Z, çekirdekteki proton sayısına eşit olduğundan, çekirdekteki nötron sayısı: N = A - Z . nükleer Fizikçekirdeği nötr atomla aynı sembolle belirtmek gelenekseldir: , burada X- sembol
kimyasal element, Z- atom numarası (çekirdekteki proton sayısı), ANCAK- kütle numarası (çekirdekteki nükleon sayısı).
Atom nötr olduğundan, çekirdeğin yükü atomdaki elektron sayısını belirler. Elektronların sayısı, atomdaki durumlar üzerindeki dağılımlarını belirler ve bu da atomun kimyasal özelliklerini belirler. Sonuç olarak, nükleer yük, belirli bir kimyasal elementin özelliklerini belirler, yani bir atomdaki elektronların sayısını, konfigürasyonlarını belirler. elektron kabukları, atom içi elektrik alanının büyüklüğü ve doğası.
Aynı Z'ye sahip ancak farklı çekirdekler ANCAK(yani, farklı sayıda nötron içeren) izotoplar olarak adlandırılır ve çekirdekler aynı ANCAK, ancak farklı Z izobarları. Örneğin, hidrojen ( Z= 1) üç izotopu vardır; - protiyum ( Z =1, N= 0) ; - döteryum, ( Z =1, N= 1); - trityum ( Z =1, N= 2) Çoğu durumda, aynı kimyasal elementin izotopları aynı kimyasala sahiptir ve hemen hemen aynıdır. fiziksel özellikler(istisna, hidrojen izotoplarıdır), esas olarak belirli bir elementin tüm izotopları için aynı olan elektron kabuklarının yapısı tarafından belirlenir.
Aşağıdaki çekirdekler, izobar çekirdeklerin bir örneği olarak hizmet edebilir: , , . Şu anda, ikisinden de farklı olan 2500'den fazla çekirdek bilinmektedir. Z, veya A, ya da her ikisi de.
Rutherford gösterdi ki atom çekirdeği yaklaşık 10 -14 - 10 -15 m boyutlarındadır (karşılaştırma için atomun doğrusal boyutları yaklaşık 10-10 m'dir). Çekirdek yarıçapı - ampirik formülle verilir R = R 0 A 1/3 nerede R0= (1.3 ÷ 1.7) 10 -15 m Ancak, bu kavramı kullanırken, örneğin çekirdek sınırının bulanık olması nedeniyle, belirsizliği nedeniyle dikkatli olunmalıdır. Çekirdeğin hacmi, çekirdekteki nükleon sayısı ile orantılıdır. Sonuç olarak, nükleer maddenin yoğunluğu tüm çekirdekler için yaklaşık olarak aynıdır: ρ » 10 17 kg/m 3 .
Kütle Numarası
Kütle numarasını bilmek, çekirdeğin ve atomun kütlesini tahmin etmenizi sağlar. Kütle numarası biliniyorsa, o zaman kütle M bir atom ve çekirdeği aşağıdaki bağıntıdan tahmin edilir M ≈ bir m N, nerede m N ≈ 1.67 10 −27 kg, bir nükleonun, yani bir protonun veya bir nötronun kütlesidir. Örneğin, bir alüminyum-27 atomu ve çekirdeği 27 nükleon (13 proton ve 14 nötron) içerir. Kütlesi yaklaşık olarak 27 1,67 10 −27 kg ≈ 4,5 10 −26 kg'a eşittir. Çekirdeğin kütlesini daha doğru bir şekilde elde etmek gerekirse, çekirdekteki nükleonların nükleer çekim kuvvetleri tarafından bağlı olduğu ve bu nedenle ilişkiye uygun olarak dikkate alınmalıdır. E=mc 2 Çekirdeğin kütlesi azalır. Çekirdeğin etrafındaki yörüngelerdeki toplam elektron kütlesi de bir atomun kütlesine eklenmelidir. Ancak tüm bu düzeltmeler %1'i geçmez.
92 238 U → 90 234 T h + 2 4 H e (\displaystyle (\mathsf (_(92)^(238)U\rightarrow _(90)^(234)Th+_(2)^(4)O) )))Sol tarafta ilk çekirdeğin kütle numarası 238, reaksiyonun sağ tarafında ise kütle numarası 234 ve 4 olan toplam 238 olan iki çekirdek var. alfa parçacığı (helyum-4 çekirdeği) 4'tür, alfa bozunması, çürüyen çekirdeğin kütle numarasını 4 birim azaltır. Herhangi bir tür






