Çfarë do të thotë g mole. Një nishan është një njësi e sasisë së një lënde. Masa molare
Mësimi i kimisë në klasën 8 me temën “Sasia e substancës. molë"
Objektivat e mësimit:
- të njohë nxënësit me një sasi të re fizike - sasinë e një lënde, me njësinë e saj matëse - një nishan; mësoni të përdorni sasinë e materies dhe nishanit.
Jepni konceptin e masës molare, vazhdoni formimin e konceptit të sasisë së substancës, aftësisë për të përdorur këtë vlerë, pasuroni përmbajtjen formula kimike.
Detyrat:
Të formohen gjatë orës së mësimit konceptet “sasia e substancës”, “numri i Avogadros”.
Për të formuar aftësinë për të zgjidhur problemet duke përdorur konceptet e "sasia e substancës", "numri i Avogadros".
Vazhdoni të zhvilloni aftësi eksperimentale në punën me substanca, aftësinë për të vëzhguar, analizuar, nxjerrë përfundime, për të nxjerrë në pah informacionin e nevojshëm.
Rezultati i planifikuar:
Nxënësit njohin konceptet "sasia e substancës", "numri i Avogadros", ata mund të zgjidhin probleme llogaritëse duke përdorur këto koncepte
Lloji i mësimit: TIK e kombinuar - një orë mësimi duke përdorur metoda mësimore ndërvepruese.
Plani i mësimit.
I fazë. Koha e organizimit
Përshëndetje, duke krijuar një humor pozitiv emocional.
Kontrollimi i studentëve për klasë.
Mirëdita djema!(shenja mungon)
Më vjen mirë që të shoh. Unë shoh fytyra të zgjuara, të sjellshme para meje. Për të kuptuar se si do të punojmë sot, dua të di se në çfarë humori jeni. Nëse jeni në humor të mirë, më buzëqeshni. Shikoni njëri-tjetrin, buzëqeshni!
Jam i sigurt se mësimi i sotëm do të na sjellë kënaqësi dhe do të jetë i frytshëm dhe disponimi juaj nuk do të përkeqësohet deri në fund të mësimit.
II fazë. Përditësimi i njohurive dhe aftësive të nevojshme, duke përfshirë verifikimin detyre shtepie(rrëshqitje 2)
Ku në tabelën periodike janë elementet që u korrespondojnë substanca të thjeshta metale?
Ku gjenden jometalet në tabelën periodike?
Cilat janë të përgjithshmet vetitë fizike metale?
Çfarë është alotropia?
Jepni shembuj të alotropisë?
Plotësoni fjalitë: (rrëshqitje 3)
I njohur 22 jo metalike
Kristalet e jodit vjollcë ngjyrat
jometal i lëngshëm bromin
Format e karbonit diamanti dhe grafiti
Pas formimit të një stuhie në ajër ozonit
Nga fjalitë e mëposhtme, shkruani numrat që u korrespondojnë metaleve në një kolonë dhe numrat që u korrespondojnë jometaleve në një kolonë tjetër. (rrëshqitje 4)
1. Gjendja agregate: e ngurtë.
2. Keni një shkëlqim metalik.
3. Mos keni një shkëlqim metalik.
5. Përçues elektrik.
6. I gaztë.
7. Në gjendje të ngurtë - i brishtë.
8.Plastike.
9. Mos përçoni nxehtësinë.
Metalet
1,2,4,5,8
jometalet
1,3, 6,7, 9
(rrëshqitja 5) Vlerësoni gjendjen tuaj përpara një teme të re.
III fazë. Shpjegimi i materialit të ri. (rrëshqitja 6)
Ngjitësi u derdh - fjalët u mbërthyen së bashku. Ndani fjalët nga njëra-tjetra me viza.
sheqer|nishan|ujë|sasi|një|substancë|
Mësuesi/ja komunikon qëllimet dhe objektivat e orës së mësimit.
Regjistrimi i temës së mësimit (rrëshqitje 7)
Mësuesi/ja u kujton nxënësve se kimia është shkenca e substancave dhe e shndërrimeve të tyre. Për të marrë një sasi të caktuar produkti (në laborator kimik ose në fabrikë) është e nevojshme të merren të përcaktuara në mënyrë strikte sasi fillestare substancave.
Kimistët, duke kryer eksperimente, vunë re se përbërja e produkteve të disa reaksioneve varet nga raportet në të cilat janë marrë reaktantët.
(rrëshqitje 8) Për shembull, nëse qymyri digjet më tepër se oksigjeni, prodhohet dioksidi i karbonit:
C + O 2 → CO 2
Dhe nëse merrni 2 herë më pak, ju merrni monoksid karboni:
C + 0,5O 2 → CO 2
Në rastin e parë, 1 molekulë oksigjeni ka reaguar me 1 atom karboni, dhe në rastin e dytë, një molekulë oksigjeni ka reaguar me dy atome karboni.
Shtrohet pyetja: si të matet një numër i caktuar atomesh ose molekulash?
Është e lehtë të matet masa e një lënde (duke përdorur peshore) ose vëllimi i një gazi ose lëngu (duke përdorur mjete matëse). Kështu që ju duhet sasi fizike, i cili ju lejon të konvertoni numrin e atomeve ose molekulave në masë ose vëllim.
Le të bëjmë llogaritje të thjeshta: masa e atomit më të lehtë - hidrogjeni është 1.66 10 -24 g, kjo masë merret si një njësi e masës atomike relative: Ar(H) = 1. Tani supozojmë se kemi 1 g atome hidrogjeni. Sa atome do të ketë në këtë masë? Për të llogaritur, duhet të ndani masën e një pjese të hidrogjenit me masën e 1 atomit të hidrogjenit: 1 g: 1,66 11 -24 g ≈ 6,02 10 23 atome.
Në masën (në gram) të çdo elementi, numerikisht e barabartë me relativen masë atomike, do të përmbajë të njëjtin numër atomesh të këtij elementi.
Masa (në gram) e çdo substance, numerikisht e barabartë me peshën e saj molekulare relative, do të përmbajë të njëjtin numër molekulash. Kjo është një vlerë konstante, quhet numri i Avogadro-s, i shënuar me N A.
(rrëshqitje 9)
(rrëshqitje 10)Çfarë lidhjesh ngjall vizatimi? (mol). Njësia për matjen e sasisë së një substance quhej " nishan"
Sasia e një lënde që përmban 6,02 10 23 njësi strukturore të një substance quhet molem .(rrëshqitje 11)
Mbështetur në shembujt e shqyrtuar, mësuesi shton se në mol matet edhe numri i grimcave të tjera: atome, jone, elektrone etj.
(rrëshqitje 12/1)1 mol e çdo substance në çdo gjendja e grumbullimit përmban N A = 6∙10 23 molekulat e saj.
nishan - njësi sasia e substancës .
Sasia e një substance është një sasi fizike e futur për të lidhur numrin e njësive strukturore të një lënde dhe masën ose vëllimin e saj.
(rrëshqitje 12/2) Sasia e një lënde shënohet n(en) ose (nu) (i vjetëruar), i matur në nishan.
n[mol]
(rrëshqitje 13)Rrëshqitje e përgjithshme e sasisë së substancës.
(rrëshqitje 14-15) 1 mol e çdo substance ka një masë numerikisht të barabartë me masën molekulare relative, por ka një njësi prej g / mol
Kjo masë quhet molare , të shënuar nga M.
Mr = M [g/mol]
Si mund të shihni 1 mol të një substance?
Merrni një lugë gjelle, mbusheni me ujë dhe hidheni në një gotë. Kjo do të jetë afërsisht 1 mol ujë. Hidhni një lugë tjetër ujë në një gotë. Tani ka 2 nishane të kësaj substance në gotë. Le të shtojmë edhe një lugë. Sasia e ujit do të bëhet e barabartë me 3 mol.
(rrëshqitje 16)Trego para klasës disa substanca sasinë prej 1 mol: 56 g pluhur hekuri ( Fe ), 58 g kripë ( NaCl ), 342 g sheqer ( C 12 H 22 O 11 )
(rrëshqitje 17-18)Përcaktimi i masës molare të substancave të caktuara
(rrëshqitje 19) Sasia e substancës dhe masa janë të lidhura me lidhjen e mëposhtme:
m = n M
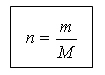
Sasia e substancës dhe numri i njësive strukturore N lidhen me relacionin e mëposhtëm:
N = N A n
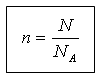
- Pra, si ta llogarisim numrin e grimcave që përmbahen në tre mol ujë? (rrëshqitje 20)
Është e nevojshme të shumëzohet sasia e substancës së marrë (në këtë rast, uji) me konstantën Avogadro:
N(H 2 O) \u003d 3 mol 6 10 23 molekula \u003d 18 10 23
(rrëshqitja 22) Vlerësoni gjendjen tuaj në mësim
IV fazë. Konsolidimi. Zgjidhja e problemeve.
Gjeni masën e 10 moleve të azotit? (rrëshqitje 23)
Zgjidhje:
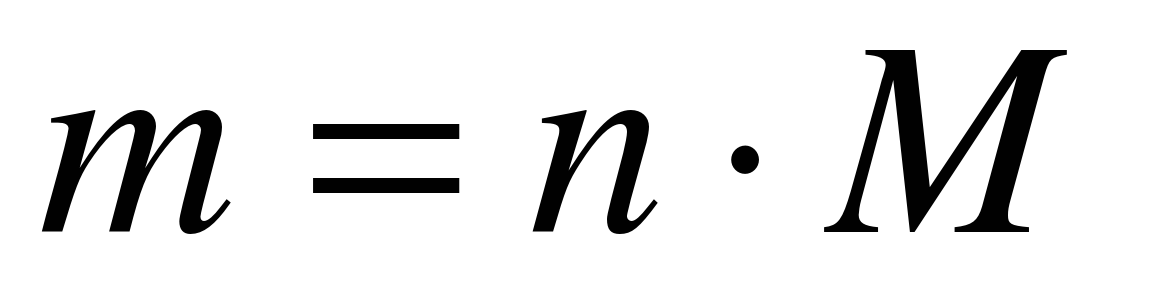
M (N 2) \u003d 28 g / mol
m (N 2) \u003d 10 mol * 28 g / mol
Përgjigje: m (N 2) \u003d 280 g
E dhënë:
n (N 2) \u003d 10 mol
Gjej:
m (N 2) - ?
(rrëshqitje 24)V fazë.Detyre shtepie
§15, p.sh. 1-3
Përgjigju pyetjes:
Sa molekula sheqeri përmban një copë sheqer i rafinuar duke ditur që masa e njërës copë është 1.3 g?
Nishan, masë molare
AT proceset kimike përfshihen grimcat më të vogla - molekulat, atomet, jonet, elektronet. Numri i grimcave të tilla, edhe në një pjesë të vogël të materies, është shumë i madh. Prandaj, për të shmangur veprimet matematikore me numra të mëdhenj, për të karakterizuar sasinë e një substance të përfshirë në reaksion kimik, përdoret një njësi e veçantë - nishan.
Një mol është një sasi e tillë e një lënde që përmban një numër të caktuar grimcash (molekula, atome, jone) të barabartë me konstantën Avogadro.
Konstanta e Avogadro NA përcaktohet si numri i atomeve që përmbahen në 12 g të një izotopi 12
NGA:
Kështu, 1 mol i një substance përmban 6.02 1023
grimcat e kësaj substance.
Bazuar në këtë, çdo sasi e substancës mund të shprehet me një numër të caktuar molesh ν (nu). Për shembull, një mostër e një substance përmban 12.04 1023
molekulat. Prandaj, sasia e substancës në këtë mostër është:
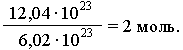
Në përgjithësi:
ku N është numri i grimcave të një substance të caktuar;
N A- numri i grimcave që përmban 1 mol të një substance (konstanta e Avogadros).
Masa molare substancat (M)
është masa që ka 1 mol i një lënde të caktuar.
Kjo vlerë, e barabartë me raportin e masës m të një lënde me sasinë e substancës ν, ka dimensionin kg/mol ose g/mol. Masa molare, e shprehur në g/mol, është numerikisht e barabartë me masën relative molekulare Mr (për substancat struktura atomikeështë masa atomike relative e Ar).
Për shembull, masa molare e metanit CH 4
përkufizohet si më poshtë:
Z.(CH 4
) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH 4 )=16 g/mol, d.m.th. 16 g CH4 përmbajnë 6.02 1023 molekulat.
Masa molare e një lënde mund të llogaritet nëse dihet masa e saj m dhe sasia (numri i moleve) ν, duke përdorur formulën:
Prandaj, duke ditur masën dhe masën molare të një substance, ne mund të llogarisim numrin e moleve të saj:
ose gjeni masën e një lënde me numrin e moleve dhe masën molare:
m = νM
Duhet theksuar se vlera e masës molare të një lënde përcaktohet nga përbërja e saj cilësore dhe sasiore, d.m.th. varet nga z dhe Ar. Prandaj, substanca të ndryshme me të njëjtin numër nishanësh kanë masa të ndryshme m.

Shembull
Llogaritni masat e metanit CH4
dhe etani C2
H6
marrë në masën ν = 2 mol secili.
Zgjidhje
Masa molare e metanit M(CH 4
) është e barabartë me 16 g/mol;
masa molare e etanit M(C2
H6
) = 2 12+6=30 g/mol.
Nga këtu:
M(CH 4
) = 2 mol 16 g/mol = 32 g;
m(C2
H6
) \u003d 2 mol 30 g / mol \u003d 60 g.
Kështu, një nishan është një pjesë e një lënde që përmban të njëjtin numër grimcash, por që ka një masë të ndryshme për substanca të ndryshme, pasi grimcat e materies (atomet dhe molekulat) nuk janë të njëjta në masë.
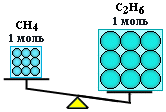
n(CH4 ) = n(С2 H6 ), por m(CH4 ) < m(С 2 H6 )
Llogaritja e ν përdoret pothuajse në çdo problem llogaritës.






