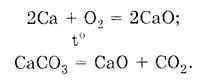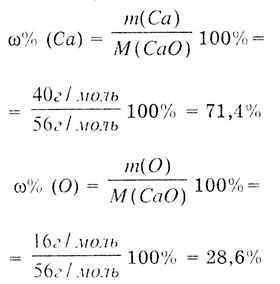Ligji i ruajtjes së masës në formulimin e kimisë. Ligji i ruajtjes së masës dhe energjisë. Arritja më e madhe e shkencës botërore
Ligji i ruajtjes së masës.
Masa e substancave që hyjnë në një reaksion kimik është e barabartë me masën e substancave të formuara si rezultat i reaksionit.
Ligji i ruajtjes së masës është një rast i veçantë i ligjit të përgjithshëm të natyrës - ligji i ruajtjes së materies dhe energjisë. Bazuar në këtë ligj, reaksionet kimike mund të shfaqen duke përdorur ekuacione kimike, duke përdorur formulat kimike të substancave dhe koeficientët stoikiometrikë që pasqyrojnë sasitë relative (numrin e moleve) të substancave të përfshira në reaksion.
Për shembull, reaksioni i djegies së metanit shkruhet si më poshtë:
Ligji i ruajtjes së masës së substancave
(M.V. Lomonosov, 1748; A. Lavoisier, 1789)
Masa e të gjitha substancave të përfshira në një reaksion kimik është e barabartë me masën e të gjitha produkteve të reaksionit.
Teoria atomike-molekulare e shpjegon këtë ligj si më poshtë: si rezultat i reaksioneve kimike, atomet nuk zhduken dhe nuk lindin, por ato riorganizohen (d.m.th., një transformim kimik është procesi i prishjes së disa lidhjeve midis atomeve dhe formimit të të tjera, si rezultat i të cilave nga molekulat e substancave origjinale, përftohen molekula të produkteve të reaksionit). Meqenëse numri i atomeve para dhe pas reagimit mbetet i pandryshuar, masa e tyre totale gjithashtu nuk duhet të ndryshojë. Masa kuptohej si një sasi që karakterizon sasinë e materies.
Në fillim të shekullit të 20-të, formulimi i ligjit të ruajtjes së masës u rishikua në lidhje me ardhjen e teorisë së relativitetit (A. Einstein, 1905), sipas së cilës masa e një trupi varet nga shpejtësia e tij dhe , pra, karakterizon jo vetëm sasinë e materies, por edhe lëvizjen e saj. Energjia E e marrë nga trupi lidhet me rritjen e masës së tij m nga relacioni E = m c 2 , ku c është shpejtësia e dritës. Ky raport nuk përdoret në reaksionet kimike, sepse 1 kJ energji korrespondon me një ndryshim në masë prej ~10 -11 g dhe m vështirë se mund të matet. AT reaksionet bërthamore, ku Е është ~10 6 herë më e madhe se në reaksionet kimike, duhet të merret parasysh m.
Bazuar në ligjin e ruajtjes së masës, është e mundur të hartohen ekuacione për reaksionet kimike dhe të përdoren për të bërë llogaritjet. Është baza e analizës kimike sasiore.
Ligji i qëndrueshmërisë së përbërjes
Ligji i qëndrueshmërisë së përbërjes ( J.L. Proust, 1801 -1808.) - çdo përbërje specifike kimikisht e pastër, pavarësisht nga mënyra e përgatitjes së tij, përbëhet nga e njëjta elementet kimike, dhe raportet e masave të tyre janë konstante, dhe numra relativ ato atomet shprehur si numra të plotë. Ky është një nga ligjet themelore kimisë.
Ligji i qëndrueshmërisë së përbërjes nuk vlen bertolidet(komponime me përbërje të ndryshueshme). Megjithatë, në mënyrë konvencionale, për thjeshtësi, përbërja e shumë bertolideve regjistrohet si konstante. Për shembull, përbërja oksid hekuri (II). shkruhet si FeO (në vend të formulës më precize Fe 1-x O).
|
LIGJI I PËRBËRJES SË KONSTAT |
|
Sipas ligjit të qëndrueshmërisë së përbërjes, çdo substancë e pastër ka një përbërje konstante, pavarësisht nga mënyra e përgatitjes së saj. Pra, oksidi i kalciumit mund të merret në mënyrat e mëposhtme:
Pavarësisht se si përftohet substanca CaO, ajo ka një përbërje konstante: një atom kalciumi dhe një atom oksigjeni formojnë molekulën e oksidit të kalciumit CaO. Përcaktoni masën molare të CaO:
Ne përcaktojmë pjesën masive të Ca me formulën:
Përfundim: Në oksidin kimikisht të pastër, pjesa masive e kalciumit është gjithmonë 71.4% dhe oksigjeni 28.6%. |
Ligji i raporteve të shumëfishta
Ligji i raporteve të shumëfishta është një nga stoikiometrike ligjet kimisë: nëse dy substancave (thjeshtë ose komplekse) formojnë më shumë se një përbërje me njëra-tjetrën, atëherë masat e një lënde për të njëjtën masë të një substance tjetër lidhen si numra të plotë, zakonisht të vogla.
Shembuj
1) Përbërja e oksideve të azotit (në përqindje në masë) shprehet me numrat e mëposhtëm:
|
Oksidi i azotit N 2 O |
Oksidi nitrik NR |
Anhidridi i azotit N 2 O 3 |
Dioksidi i azotit NR 2 |
Anhidridi nitrik N 2 O 5 |
|
|
O/N private |
Duke pjesëtuar numrat e rreshtit të poshtëm me 0.57, shohim se ato janë të lidhura si 1:2:3:4:5.
2) Klorur kalciumi Format me ujë 4 hidrat kristalor, përbërja e së cilës shprehet me formulat: CaCl 2 H 2 O, CaCl 2 2H 2 O, CaCl 2 4H 2 O, CaCl 2 6H 2 O, pra në të gjitha këto përbërje, masa e ujit për molekulën CaCl 2 është të lidhura si 1:2:4:6.
Ligji i marrëdhënieve vëllimore
(Gay-Lussac, 1808)
"Vëllimet e gazeve që hyjnë në reaksione kimike dhe vëllimet e gazeve të formuara si rezultat i reaksionit janë të lidhura me njëri-tjetrin si numra të plotë të vegjël."
Pasoja. Koeficientët stekiometrikë në ekuacionet e reaksioneve kimike për molekulat e substancave të gazta tregojnë në çfarë raportesh vëllimore reagojnë ose fitohen substancat e gazta.
2CO + O 2 2CO 2
Kur dy vëllime monoksidi të karbonit (II) oksidohen me një vëllim oksigjeni, formohen 2 vëllime dioksid karboni, d.m.th. vëllimi i përzierjes fillestare të reaksionit zvogëlohet për 1 vëllim.
b) Në sintezën e amoniakut nga elementët:
n 2 + 3h 2 2nh 3
Një vëllim azoti reagon me tre vëllime hidrogjeni; në këtë rast, formohen 2 vëllime amoniaku - vëllimi i masës fillestare të reaksionit të gaztë do të ulet me 2 herë.
Ekuacioni Klaiperon-Mendeleev
Nëse shkruajmë ligjin e kombinuar të gazit për çdo masë të çdo gazi, atëherë marrim ekuacionin Claiperon-Mendeleev:
ku m është masa e gazit; M është pesha molekulare; p - presioni; V - vëllimi; T - temperatura absolute (°K); R është konstanta universale e gazit (8,314 J / (mol K) ose 0,082 l atm / (mol K)).
Për një masë të caktuar të një gazi të caktuar, raporti m/M është konstant, kështu që ligji i kombinuar i gazit rrjedh nga ekuacioni Claiperon-Mendeleev.
Çfarë vëllimi do të marrë në një temperaturë prej 17 ° C dhe një presion prej 250 kPa monoksid karboni (II) që peshon 84 g?
Numri i moleve të CO është:
(CO) \u003d m (CO) / M (CO) \u003d 84 / 28 \u003d 3 mol
Vëllimi i CO në n.c. është
3 22,4 l = 67,2 l
Nga ligji i kombinuar i gazit të Boyle-Mariotte dhe Gay-Lussac:
(P V) / T = (P 0 V 0) / T 2
V (CO) \u003d (P 0 T V 0) / (P T 0) \u003d (101,3 (273 + 17) 67,2) / (250 273) \u003d 28,93 l
Dendësia relative e gazeve tregon se sa herë 1 mol i një gazi është më i rëndë (ose më i lehtë) se 1 mol i një gazi tjetër.
D A(B) = (B) (A) = M (B) / M (A)
Pesha mesatare molekulare e një përzierjeje gazesh është e barabartë me masën totale të përzierjes pjesëtuar me numrin total të moleve:
M cf \u003d (m 1 + .... + m n) / ( 1 + .... + n) \u003d (M 1 V 1 + .... M n V n) / ( 1 + .. .. + n)
LIGJI I RUAJTJES SË ENERGJISË : në izolim. energjia e sistemit mbetet konstante, vetëm kalimet e një lloji të energjisë në një tjetër janë të mundshme. Në termodinamikën e ruajtjes së energjisë, ligji korrespondon me ligjin e parë të termodinamikës, i cili shprehet me ekuacionin Q \u003d DU + W, ku Q është numri i nxehtësisë që i komunikohet sistemit, DU është ndryshimi në ext. energjia e sistemit, W është puna e bërë nga sistemi. Një rast i veçantë i ligjit të ruajtjes së energjisë është ligji Hessian.
Koncepti i energjisë u rishikua në lidhje me ardhjen e teorisë së relativitetit (A. Einstein, 1905): energjia totale E është proporcionale me masën m dhe lidhet me të nga relacioni E = mc2, ku c është shpejtësia e dritës. Prandaj, masa mund të shprehet në njësi të energjisë dhe të formulojë një ligj më të përgjithshëm të ruajtjes së masës dhe energjisë: në izo-lirë. Në një sistem, shuma e masave dhe e energjisë është konstante, dhe janë të mundshme vetëm transformimet në raporte rreptësisht ekuivalente të disa formave të energjisë në të tjera dhe ndryshime ekuivalente të lidhura në masë dhe energji.
Ligji i ekuivalentëve
substancat ndërveprojnë me njëra-tjetrën në sasi proporcionale me ekuivalentët e tyre. Kur zgjidhni disa probleme, është më i përshtatshëm të përdorni një formulim të ndryshëm të këtij ligji: masat (vëllimet) e substancave që reagojnë me njëra-tjetrën janë në përpjesëtim me masat (vëllimet) e tyre ekuivalente.
ekuivalentët: elementët kimikë kombinohen me njëri-tjetrin në sasi të përcaktuara rreptësisht që korrespondojnë me ekuivalentët e tyre. Shprehja matematikore e ligjit të ekuivalentëve është si vijon: ku m1 dhe m2 janë masat e substancave reaguese ose të formuara, m eq (1) dhe m eq (2) janë masat ekuivalente të këtyre substancave.
Për shembull: një sasi e caktuar metali, masa ekuivalente e të cilit është 28 g / mol, zhvendos 0,7 litra hidrogjen të matur në kushte normale nga një acid. Përcaktoni masën e metalit. Zgjidhja: duke ditur që vëllimi ekuivalent i hidrogjenit është 11,2 l / mol, është një proporcion: 28 g metal është i barabartë me 11,2 l hidrogjen x g metal është i barabartë me 0,7 l hidrogjen. Pastaj x \u003d 0,7 * 28 / 11,2 \u003d 1,75 g.
Për të përcaktuar masën ekuivalente ose ekuivalente, nuk është e nevojshme të vazhdohet nga kombinimi i saj me hidrogjenin. Ato mund të përcaktohen nga përbërja e përbërjes së një elementi të caktuar me ndonjë tjetër, ekuivalenti i të cilit dihet.
Për shembull: kur 5,6 g hekur u bashkua me squfur, u formuan 8,8 g sulfur hekuri. Është e nevojshme të gjendet masa ekuivalente e hekurit dhe ekuivalenti i tij, nëse dihet se masa ekuivalente e squfurit është 16 g/mol. Zgjidhja: nga kushtet e problemit rezulton se në sulfur hekuri, 5,6 g hekur përbën 8,8-5,6 = 3,2 g squfur. Sipas ligjit të ekuivalentëve, masat e substancave ndërvepruese janë në përpjesëtim me masat e tyre ekuivalente, domethënë, 5,6 g hekur është e barabartë me 3,2 g squfur meq (Fe) është e barabartë me 16 g/mol squfur. Nga këtu rrjedh se m3KB(Fe) = 5.6*16/3.2=28 g/mol. Ekuivalenti i hekurit është: 3=meq(Fe)/M(Fe)=28 g/mol:56 g/mol=1/2. Prandaj, ekuivalenti i hekurit është 1/2 mol, domethënë 1 mol hekur përmban 2 ekuivalente.
Ligji i Avogadros
Pasojat e ligjit
Përfundimi i parë i ligjit të Avogadro: një mol i çdo gazi në të njëjtat kushte zë të njëjtin vëllim.
Në veçanti, në kushte normale, d.m.th. në 0 ° C (273 K) dhe 101.3 kPa, vëllimi i 1 mol gazi është 22.4 litra. Ky vëllim quhet vëllimi molar i gazit V m. Ju mund ta rillogaritni këtë vlerë në temperatura dhe presione të tjera duke përdorur ekuacionin Mendeleev-Clapeyron:
![]() .
.
Përfundimi i dytë i ligjit të Avogadro: masa molare e gazit të parë është e barabartë me produktin masë molare të gazit të dytë nga dendësia relative e gazit të parë sipas të dytit.
Ky pozicion kishte një rëndësi të madhe për zhvillimin e kimisë, pasi bën të mundur përcaktimin e peshës së pjesshme të trupave të aftë për të kaluar në gjendje të gaztë ose avullore. Nëse përmes m shënojmë peshën e pjesshme të trupit, dhe përmes dështë graviteti i tij specifik në gjendjen e avullit, pastaj raporti m / d duhet të jetë konstante për të gjithë trupat. Përvoja ka treguar se për të gjithë trupat e studiuar, që kalojnë në avull pa zbërthim, kjo konstante është e barabartë me 28,9, nëse, gjatë përcaktimit të peshës së pjesshme, ne vijmë nga graviteti specifik i ajrit, marrë si njësi, por kjo konstante do të jetë e barabartë me 2, nëse marrim peshën specifike të hidrogjenit si njësi. Duke treguar këtë konstante, ose, çfarë është e njëjtë, vëllimin e pjesshëm të përbashkët për të gjithë avujt dhe gazrat përmes NGA, kemi nga formula nga ana tjetër m = dC. Meqenëse graviteti specifik i avullit përcaktohet lehtësisht, atëherë, duke zëvendësuar vlerën d në formulë shfaqet edhe pesha e pjesshme e panjohur e trupit të dhënë.
Termokimia
efekt termik reaksion kimik
Nga Wikipedia, Enciklopedia e Lirë
Efekti termik i një reaksioni ose ndryshimi kimik entalpi sistemi për shkak të shfaqjes së një reaksioni kimik - sasia e nxehtësisë që lidhet me ndryshimin e variablit kimik të marrë nga sistemi në të cilin u zhvillua reaksioni kimik dhe produktet e reaksionit morën temperaturën e reaktantëve.
Në mënyrë që efekti termik të jetë një sasi që varet vetëm nga natyra e reaksionit kimik në vazhdim, duhet të plotësohen kushtet e mëposhtme:
Reagimi duhet të vazhdojë ose në një vëllim konstant P v (procesi izokorik), ose në presion konstant P p( procesi izobarik).
Asnjë punë nuk bëhet në sistem, përveç punës së zgjerimit që është e mundur me P = const.
Nëse reagimi kryhet në kushte standarde në T \u003d 298,15 K \u003d 25 ° C dhe P \u003d 1 atm \u003d 101325 Pa, efekti termik quhet efekti termik standard i reaksionit ose entalpi standarde reaksionet Δ H r O . Në termokimi, efekti termik standard i një reaksioni llogaritet duke përdorur entalpitë standarde të formimit.
Entalpia standarde e formimit (nxehtësia standarde e formimit)
Nxehtësia standarde e formimit kuptohet si efekti i nxehtësisë i reaksionit të formimit të një mol të një substance nga substanca të thjeshta, komponentët e tij, të cilët janë në stabile shtetet standarde.
Për shembull, entalpia standarde e formimit është 1 mol metani nga karbonit dhe hidrogjeni e barabartë me nxehtësinë e reaksionit:
C (tv) + 2H 2 (g) \u003d CH 4 (g) + 76 kJ / mol.
Entalpia standarde e formimit shënohet Δ H për . Këtu indeksi f do të thotë formim (edukim) dhe rrethi i kryqëzuar, i ngjashëm me diskun Plimsol - të cilës i referohet vlera gjendje standarde substancave. Në literaturë, shpesh gjendet një përcaktim tjetër për entalpinë standarde - ΔH 298,15 0 , ku 0 tregon se presioni është i barabartë me një atmosferë (ose, disi më saktë, në kushtet standarde ), dhe 298.15 është temperatura. Ndonjëherë indeksi 0 përdoret për sasitë që lidhen me substancë e pastër, duke përcaktuar se është e mundur të përcaktohen sasi standarde termodinamike me të vetëm kur është një substancë e pastër që zgjidhet si gjendje standarde . Standardi mund të merret gjithashtu, për shembull, gjendja e materies në jashtëzakonisht i holluar zgjidhje. "Disk Plimsol" në këtë rast nënkupton gjendjen aktuale standarde të materies, pavarësisht nga zgjedhja e tij.
Entalpia e formimit të substancave të thjeshta supozohet të jetë zero, dhe vlera zero e entalpisë së formimit i referohet gjendjes së grumbullimit, e cila është e qëndrueshme në T = 298 K. Për shembull, për jodit në gjendje kristalore Δ H I2(tv) 0 = 0 kJ/mol, dhe për lëng jodit Δ H I2(l) 0 = 22 kJ/mol. Entalpitë e formimit të substancave të thjeshta në kushte standarde janë karakteristikat e tyre kryesore energjetike.
Efekti termik i çdo reaksioni gjendet si diferenca midis shumës së nxehtësisë së formimit të të gjitha produkteve dhe shumës së nxehtësisë së formimit të të gjithë reaktantëve në këtë reaksion (pasojë Ligji i Hesit):
Δ H reaksionet O = ΣΔ H f O (produkte) - ΣΔ H f O (reagentë)
Efektet termokimike mund të përfshihen në reaksionet kimike. Ekuacionet kimike në të cilat tregohet sasia e nxehtësisë së çliruar ose të absorbuar quhen ekuacione termokimike. Reaksionet e shoqëruara me lëshimin e nxehtësisë në mjedis kanë efekt termik negativ dhe quhen ekzotermike. Reaksionet e shoqëruara me thithjen e nxehtësisë kanë efekt termik pozitiv dhe quhen endotermike. Efekti termik zakonisht i referohet një mol të materialit fillestar të reaguar, koeficienti stoikiometrik i të cilit është maksimal.
Varësia nga temperatura e efektit termik (entalpi) të reaksionit
Për të llogaritur varësinë nga temperatura e entalpisë së reaksionit, është e nevojshme të dihet molari kapaciteti i nxehtësisë substancat e përfshira në reaksion. Ndryshimi në entalpinë e reaksionit me rritjen e temperaturës nga T 1 në T 2 llogaritet sipas ligjit Kirchhoff (supozohet se në këtë interval të temperaturës kapacitetet molare të nxehtësisë nuk varen nga temperatura dhe nuk ka transformimet fazore):
![]()
Nëse transformimet fazore ndodhin në një interval të caktuar të temperaturës, atëherë në llogaritjen është e nevojshme të merren parasysh nxehtësitë e transformimeve përkatëse, si dhe ndryshimi në varësinë nga temperatura e kapacitetit të nxehtësisë së substancave që kanë pësuar transformime të tilla:
ku ΔC p (T 1 ,T f) është ndryshimi i kapacitetit të nxehtësisë në intervalin e temperaturës nga T 1 në temperaturën e tranzicionit fazor; ΔC p (T f ,T 2 ) është ndryshimi i kapacitetit të nxehtësisë në intervalin e temperaturës nga temperatura e tranzicionit fazor në temperaturën përfundimtare, dhe T f është temperatura e tranzicionit fazor.
Entalpi standarde e djegies
Entalpia standarde e djegies - Δ H Gor o, efekti termik i reaksionit të djegies së një mol të një lënde në oksigjen në formimin e oksideve në shkallën më të lartë të oksidimit. Nxehtësia e djegies së substancave jo të djegshme supozohet të jetë zero.
Entalpia standarde e tretjes
Entalpia standarde e tretjes - Δ H tretësirë, efekti termik i procesit të tretjes së 1 mol të një lënde në një sasi pafundësisht të madhe tretësi. Përbëhet nga nxehtësia e shkatërrimit rrjetë kristali dhe ngrohtësi hidratimi(ose ngrohtësi zgjidhje për tretësirat jo ujore), të lëshuara si rezultat i bashkëveprimit të molekulave të tretësit me molekulat ose jonet e substancës së tretur me formimin e komponimeve me përbërje të ndryshueshme - hidratet (solvatet). Shkatërrimi i rrjetës kristalore, si rregull, është një proces endotermik - Δ H resh > 0, dhe hidratimi i joneve është ekzotermik, Δ H hidra< 0. В зависимости от соотношения значений ΔH resh dhe Δ H entalpia hidrike e tretjes mund të ketë vlera pozitive dhe negative. Pra shpërbërja e kristalit hidroksid kaliumi shoqëruar me çlirimin e nxehtësisë
Δ H zgjidhje KOH o \u003d Δ H resh o + Δ H hydrK + o + Δ H hidroOH −o = −59 kJ/mol
Nën entalpinë e hidratimit - Δ H hydr, i referohet nxehtësisë që lirohet gjatë kalimit të 1 mol jonesh nga vakum në tretësirë.
Entalpia standarde e neutralizimit
Entalpia standarde e neutralizimit - Δ H neutral në lidhje me entalpinë e reaksionit të bashkëveprimit të acideve dhe bazave të forta me formimin e 1 mol ujë në kushte standarde:
HCl + NaOH = NaCl + H2O
H + + OH - \u003d H 2 O, ΔH neutral ° \u003d -55,9 kJ / mol
Entalpia standarde e neutralizimit për tretësirat e koncentruara elektrolite të forta varet nga përqendrimi i joneve, për shkak të ndryshimit të vlerës së joneve të hidratimit ΔH ° kur hollohen.
Entalpia
Entalpiaështë një veti e materies që tregon sasinë e energjisë që mund të shndërrohet në nxehtësi.
Entalpiaështë një veti termodinamike e një lënde që tregon nivelin e energjisë së ruajtur në strukturën e saj molekulare. Kjo do të thotë se ndërsa lënda mund të ketë energji bazuar në temperaturën dhe presionin, jo e gjithë ajo mund të shndërrohet në nxehtësi. Një pjesë e energjisë së brendshme gjithmonë mbetet në substancë dhe ruan strukturën e saj molekulare. Pjesë energjia kinetike substanca nuk është e disponueshme kur temperatura e saj i afrohet temperaturës së ambientit. Prandaj, entalpia është sasia e energjisë që është e disponueshme për shndërrim në nxehtësi në një temperaturë dhe presion të caktuar. Njësitë e entalpisë- Njësi termike britanike ose xhaul për energjinë dhe Btu/lbm ose J/kg për energji specifike.
Sasia e entalpisë
sasi entalpi substancë në bazë të temperaturës së saj të dhënë. Temperatura e dhënëështë vlera e zgjedhur nga shkencëtarët dhe inxhinierët si bazë për llogaritjet. Kjo është temperatura në të cilën entalpia e një substance është zero J. Me fjalë të tjera, substanca nuk ka energji të disponueshme që mund të shndërrohet në nxehtësi. Kjo temperaturë në substanca të ndryshme të ndryshme. Për shembull, kjo temperaturë e ujit është pika e trefishtë (0°C), azoti është -150°C dhe ftohësit me bazë metani dhe etani janë -40°C.
Nëse temperatura e një lënde është mbi temperaturën e saj të dhënë, ose ndryshon gjendjen në të gaztë në një temperaturë të caktuar, entalpia shprehet si një numër pozitiv. Në të kundërt, në një temperaturë nën një entalpi të caktuar të një substance shprehet si një numër negativ. Entalpia përdoret në llogaritjet për të përcaktuar ndryshimin në nivelet e energjisë midis dy gjendjeve. Kjo është e nevojshme për të vendosur pajisjen dhe për të përcaktuar Koeficient dobia e procesit.
Entalpia shpesh përkufizohet si energjia totale e materies, pasi është e barabartë me shumën e energjisë së saj të brendshme (u) në një gjendje të caktuar, së bashku me aftësinë e saj për të bërë punë (pv). Por në realitet, entalpia nuk tregon plot energji substanca në një temperaturë të caktuar mbi zero absolute (-273°C). Prandaj, në vend që të përkufizohet entalpia si nxehtësia totale e një substance, është më e saktë të përkufizohet si sasia totale e energjisë në dispozicion të një lënde që mund të shndërrohet në nxehtësi. H=U+pV
Energjia e brendshme
Energjia e brendshme e një trupi (e shënuar si E ose U) është shuma e energjive të ndërveprimeve molekulare dhe lëvizjeve termike të një molekule. Energjia e brendshme është një funksion me një vlerë të vetme të gjendjes së sistemit. Kjo do të thotë se sa herë që sistemi është në një gjendje të caktuar, ai energjia e brendshme merr vlerën e natyrshme në këtë gjendje, pavarësisht nga historia e sistemit. Rrjedhimisht, ndryshimi i energjisë së brendshme gjatë kalimit nga një gjendje në tjetrën do të jetë gjithmonë e barabartë me diferencën midis vlerave të saj në gjendjen përfundimtare dhe fillestare, pavarësisht nga rruga përgjatë së cilës është bërë kalimi.
Energjia e brendshme e një trupi nuk mund të matet drejtpërdrejt. Mund të përcaktohet vetëm ndryshimi në energjinë e brendshme:
E ngjitur në trup ngrohjes, matur në xhaule
- Puna, e kryer nga trupi kundër forcave të jashtme, të matura në joule
Kjo formulë është një shprehje matematikore ligji i parë i termodinamikës
Për proceset kuazi-statike qëndron lidhja e mëposhtme:
-temperatura, matur në kelvinët
-entropia, e matur në xhaul/kelvin
-presioni, matur në Paskale
-potencial kimik
Numri i grimcave në sistem
Gazrat ideale
Sipas ligjit të Xhulit, të nxjerrë në mënyrë empirike, energjia e brendshme gaz ideal pavarësisht nga presioni apo vëllimi. Bazuar në këtë fakt, ne mund të marrim një shprehje për ndryshimin e energjisë së brendshme gaz ideal. Sipas përkufizimit kapaciteti molar i nxehtësisë në një vëllim konstant 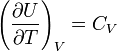 . Meqenëse energjia e brendshme e një gazi ideal është vetëm një funksion i temperaturës, atëherë
. Meqenëse energjia e brendshme e një gazi ideal është vetëm një funksion i temperaturës, atëherë
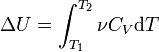 .
.
E njëjta formulë është gjithashtu e vërtetë për llogaritjen e ndryshimit në energjinë e brendshme të çdo trupi, por vetëm në proceset me një vëllim konstant ( proceset izohorike); në përgjithësi C V (T,V) është një funksion i temperaturës dhe vëllimit.
Nëse neglizhojmë ndryshimin e kapacitetit të nxehtësisë molare me një ndryshim në temperaturë, marrim:
Δ U = ν C V Δ T,
ku ν është sasia e substancës, Δ T- ndryshimi i temperaturës.
ENERGJIA E BRENDSHME E NJE SUBSTANCE, TRUP, SISTEM
(greqisht: ένέργια - aktivitet, energji). Energjia e brendshme është pjesë energjia totale e trupit (sistemeve tel): E = E k + E fq + U, ku E k - energjia kinetike makroskopike lëvizjet sistemet, E fq - energji potenciale, për shkak të pranisë së forcës së jashtme fusha(gravitacionale, elektrike, etj.), U- energjia e brendshme. Energjia e brendshme substancave, trupa, sisteme trupash - funksionin shteteve, i përcaktuar si rezerva totale e energjisë e gjendjes së brendshme të një substance, trupi, sistemi, që ndryshon (lirohet) në procesi kimike reagimet, transferimi i nxehtësisë dhe performanca puna. Përbërësit e energjisë së brendshme: (a) energjia kinetike e termike probabilistike lëvizja e grimcave (atomeve, molekulave, jonet etj.), që përbën një substancë (trup, sistem); (b) energjia potenciale e grimcave për shkak të tyre ndërmolekulare ndërveprim; (c) energjia e elektroneve në predha elektronike, atomet dhe jonet; (d) energjia intranukleare. Energjia e brendshme nuk është e lidhur me procesin e ndryshimit të gjendjes së sistemit. Me çdo ndryshim në sistem, energjia e brendshme e sistemit, së bashku me mjedisin e tij, mbetet konstante. Domethënë, energjia e brendshme as humbet dhe as nuk fitohet. Në të njëjtën kohë, energjia mund të lëvizë nga një pjesë e sistemit në tjetrën ose të shndërrohet nga njëra forma tek një tjetër. Kjo është një nga shprehjet ligji ruajtja e energjisë - ligji i parë i termodinamikës. Një pjesë e energjisë së brendshme mund të shndërrohet në punë. Kjo pjesë e energjisë së brendshme quhet energji e lirë - G. (Në përbërjet kimike quhet kimik potencial). Pjesa tjetër e energjisë së brendshme, e cila nuk mund të shndërrohet në punë, quhet energji e lidhur - W b .
Entropia
Entropia (nga grekeἐντροπία - kthesë, shndërrim) në shkencat natyrore- masa e çrregullimit sistemeve, i përbërë nga shumë elementet. Në veçanti, në fizikës statistikore - masë probabilitetet realizimi i çdo gjendje makroskopike; në teoria e informacionit- një masë e pasigurisë së çdo përvoje (testi), e cila mund të ketë rezultate të ndryshme, dhe si rrjedhim numri informacion; në shkenca historike, për shpjegime fenomen historia alternative (invarianca dhe ndryshueshmëria proces historik).
Pas vërtetimit të ekzistencës së atomeve dhe molekulave zbulim i madh teoria atomike-molekulare ishte ligji i ruajtjes së masës, i cili u formulua në formën e një koncepti filozofik nga shkencëtari i madh rus Mikhail Vasilyevich Lomonosov (1711-1765) në 1748 dhe u konfirmua eksperimentalisht nga ai vetë në 1756 dhe në mënyrë të pavarur nga kimisti francez. A.L. Lavoisier në 1789
Masa e të gjitha substancave që hyjnë në një reaksion kimik është e barabartë me masën e të gjitha produkteve të reaksionit.
Eksperimentet mbi djegien e substancave, të cilat u kryen para Lomonosov, sugjeruan që masa e substancave në procesin e reagimit nuk ruhet. Kur nxehej në ajër, merkuri shndërrohej në shkallë të kuqe, masa e së cilës ishte më e madhe se ajo e metalit. Masa e hirit të formuar gjatë djegies së drurit, përkundrazi, është gjithmonë më pak se masa e substancës origjinale.
Lomonosov kreu një eksperiment të thjeshtë i cili tregoi se djegia e një metali është një reaksion shtesë, dhe rritja e masës së metalit ndodh për shkak të shtimit të një pjese të ajrit. Ai kalcinoi metalet në një enë qelqi të mbyllur dhe zbuloi se masa e enës nuk ndryshonte, megjithëse po ndodhte një reaksion kimik. Pas hapjes së enës, ajri hyri në të dhe masa e anijes u rrit. Kështu, me një matje të saktë të masës së të gjithë pjesëmarrësve në reaksion, rezulton se masa e substancave në një reaksion kimik ruhet. Ligji i ruajtjes së masës kishte një rëndësi të madhe për teorinë atomike dhe molekulare. Ai konfirmoi se atomet janë të pandashëm dhe nuk ndryshojnë gjatë reaksioneve kimike. Molekulat shkëmbejnë atome gjatë reaksionit, por numri total atomet e secilit lloj nuk ndryshojnë, dhe për këtë arsye masa totale e substancave në procesin e reaksionit ruhet.
Ligji i ruajtjes së masës është një rast i veçantë i një ligji të përgjithshëm të natyrës - ligji i ruajtjes së energjisë, i cili thotë se energjia e një sistemi të izoluar është konstante. Energjia është një masë e lëvizjes dhe ndërveprimit lloje te ndryshmeçështje. Për çdo proces në sistem i izoluar energjia as nuk prodhohet dhe as nuk shkatërrohet, ajo mund të ndryshojë vetëm nga një formë në tjetrën.
Një formë e energjisë është e ashtuquajtura energji e pushimit, e cila lidhet me masën nga relacioni i Ajnshtajnit
E 0 \u003d m 0 s 2,
ku c është shpejtësia e dritës në vakum (c = 3 10 8 m/s). Ky raport tregon se masa mund të shndërrohet në energji dhe anasjelltas. Kjo është pikërisht ajo që ndodh në të gjitha reaksionet bërthamore, dhe për këtë arsye ligji i ruajtjes së masës në proceset bërthamore shkelet. Megjithatë, ligji i ruajtjes së energjisë mbetet i vlefshëm në këtë rast, nëse marrim parasysh energjinë e mbetur.
Në reaksionet kimike, ndryshimi në masë i shkaktuar nga çlirimi ose thithja e energjisë është shumë i vogël. Efekti tipik termik i një reaksioni kimik është, sipas madhësisë, 100 kJ/mol. Le të llogarisim se si ndryshon masa në këtë rast:
∆m = ∆E/s 2 = 10 5 / (3 10 8) 2 ~ 10 -12 kg/mol = 10 -9 g/mol.
Tema: Ide kimike fillestare
Mësimi: Thelbi i një reaksioni kimik. Ligji i ruajtjes së masës së substancave
Pyetja e thelbit transformimi kimik mbeti një mister për shkencëtarët e natyrës për një kohë të gjatë. Vetëm me zhvillimin e teorisë atomiko-molekulare u bë e mundur të supozohej se si ndodhin reaksionet kimike në nivelin e atomeve dhe molekulave.
Sipas teorisë atomo-molekulare, substancat përbëhen nga molekula, dhe molekulat përbëhen nga atomet. Gjatë një reaksioni kimik, atomet që përbëjnë substancat origjinale nuk zhduken dhe atomet e reja nuk shfaqen.
Pastaj, mund të supozojmë se si rezultat i një reaksioni kimik, produktet e reaksionit formohen nga atomet që më parë ishin pjesë e substancave origjinale. Këtu është një model i një reaksioni kimik:
Oriz. 1. Modeli i një reaksioni kimik nga këndvështrimi i AMT
Pas analizimit të këtij modeli, ne mund të parashtrojmë një hipotezë (supozim i bazuar shkencërisht):
Masa totale e produkteve të reaksionit duhet të jetë e barabartë me masën totale të materialeve fillestare.
Edhe Leonardo da Vinçi tha: "Dituria, e pa verifikuar nga përvoja, nëna e çdo sigurie, është e pafrytshme dhe plot gabime". Kjo do të thotë se një hipotezë nuk do të bëhet kurrë ligj nëse nuk konfirmohet eksperimentalisht.
Metoda eksperimentale në kimi filloi të përdoret gjerësisht pas kërkimeve të R. Boyle në shekullin e 17-të. Natyralisti anglez kalcinoi metalet në enë të pambyllura - përgjigjet dhe zbuloi se pas kalcinimit, masa e metalit u bë më e madhe.
Në bazë të këtyre eksperimenteve, ai nuk mori parasysh rolin e ajrit dhe nxori përfundimin e gabuar se masa e substancave ndryshon gjatë reaksioneve kimike.
M.V. Lomonosov, ndryshe nga R. Boyle, i kalcinoi metalet jo në ajër të hapur, por në retorte të mbyllura dhe i peshonte ato para dhe pas kalcinimit. Ai vërtetoi se masa e substancave para dhe pas reaksionit mbetet e pandryshuar dhe se kur kalcinohet, ajri i shtohet metalit (oksigjeni ende nuk ishte zbuluar në atë kohë). Por Lomonosov nuk i publikoi rezultatet e hulumtimit të tij.
Në 1774, eksperimentet e R. Boyle u përsëritën nga A. Lavoisier me të njëjtat rezultate si Lomonosov. Por ai bëri një vëzhgim të ri, shumë të rëndësishëm, domethënë, se vetëm një pjesë e ajrit në repartin e mbyllur ishte kombinuar me metalin dhe se rritja e peshës së metalit që ka kaluar në peshore është e barabartë me uljen. në peshën e ajrit në retort. Megjithatë, një pjesë e metalit mbeti në formë të lirë.
Kështu, në mënyrë të pavarur nga njëri-tjetri, M.V. Lomonosov dhe A. Lavoisier konfirmuan vlefshmërinë e supozimit për ruajtjen e masës së substancave si rezultat i një reaksioni kimik.
Ky supozim u bë ligj vetëm pas një studimi dhjetëvjeçar nga kimisti gjerman G. Landolt në fillim të shekullit të 20-të. Sot ligji i ruajtjes së masës formulohet kështu:
Masa e substancave që marrin pjesë në reaksion është e barabartë me masën e produkteve të reaksionit.
Korrektësia e ligjit të ruajtjes së masës së substancave mund të konfirmohet duke përdorur eksperimentin e mëposhtëm. Në enën e parë Landolt përgatisni tretësirë të jodur kaliumit dhe nitratit të plumbit. Në enën e dytë do të zhvillohet reaksioni i klorurit të hekurit me tiocianatin e kaliumit. Mbyllni fort prizat. Ne balancojmë peshoren. A do të ruhet ekuilibri pas përfundimit të reaksioneve? Në enën e parë, precipiton një precipitat i verdhë i jodidit të plumbit; në të dytën, formohet tiocianati i ferrit me ngjyrë të kuqe të errët. Në enët e Landolt u zhvilluan reaksione kimike: u formuan substanca të reja. Por ekuilibri nuk u prish (Fig. 2). Masa e lëndëve fillestare është gjithmonë e barabartë me masën e produkteve të reaksionit.

Oriz. 2. Një eksperiment që konfirmon korrektësinë e ligjit të ruajtjes së masës së substancave
Le të japim një shembull të një eksperimenti tjetër që vërteton saktësinë e ligjit të ruajtjes së masës së substancave në reaksionet kimike. Brenda balonës, kur tapa të mbyllet, një qiri do të digjet. Le të balancojmë peshoren. Le t'i vëmë zjarrin qiririt dhe ta ulim në balonë. Mbylleni balonën fort me një tapë. Djegia e një qiri është procesi kimik. Pasi ka konsumuar oksigjenin në balonë, qiri fiket, reaksioni kimik përfundon. Por ekuilibri i peshave nuk është i shqetësuar: masa e produkteve të reaksionit mbetet e njëjtë me masën e substancave fillestare (Fig. 3).

Oriz. 3. Eksperimentoni me një qiri të ndezur në një balonë
Zbulimi i ligjit të ruajtjes së masës së substancave pati një rëndësi të madhe për zhvillimin e mëtejshëm të kimisë. Bazuar në ligjin e ruajtjes së masës së substancave, bëhen llogaritjet më të rëndësishme dhe përpilohen ekuacionet e reaksioneve kimike.
1. Përmbledhje detyrash dhe ushtrimesh në kimi: klasa e 8-të: tek teksti shkollor nga P.A. Orzhekovsky dhe të tjerët "Kimi, klasa 8" / P.A. Orzhekovsky, N.A. Titov, F.F. Hegeli. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Fletorja e Kimisë: Klasa e 8-të: tek teksti shkollor nga P.A. Orzhekovsky dhe të tjerë.“Kimia. Klasa 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; nën. ed. prof. P.A. Orzhekovsky - M .: AST: Astrel: Profizdat, 2006. (f. 15-16)
3. Kimia: Klasa e 8-të: Teksti mësimor. për gjeneralin institucionet / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005.(§6)
4. Kimia: inorg. kimia: tekst shkollor. për 8 qeliza. të përgjithshme institucionet / G.E. Rudzitis, FuGyu Feldman. - M .: Arsimi, SHA "Librat shkollorë të Moskës", 2009.
5. Enciklopedi për fëmijë. Vëllimi 17. Kimia / Kapitulli. redaktuar nga V.A. Volodin, drejtues. shkencore ed. I. Leenson. – M.: Avanta+, 2003.
Burime shtesë në internet
1. Një koleksion i vetëm i burimeve arsimore dixhitale ().
2. Versioni elektronik i revistës "Kimi dhe Jeta" ().
Detyre shtepie
Me . 16 №№ 3,5 nga Fletore pune në kimi: klasa e 8-të: tek teksti shkollor nga P.A. Orzhekovsky dhe të tjerë.“Kimia. Klasa 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovsky; nën. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
1. Ligji i ruajtjes së masës dhe energjisë.
Ky është një ligj i kombinuar. Ai përfshin dy ligje.
I. Ligji i ruajtjes së masës : Masa e substancave të përfshira në reaksion është e barabartë me masën e produkteve të reaksionit.
Ky ligj u zbulua nga M. V. Lomonosov në 1748 dhe u plotësua nga A. L. Lavoisier në 1789.
Gjatë reaksionit, masa e secilit 1 element.
Ky ligj ju lejon të bëni ekuacione të reaksioneve kimike dhe të kryeni llogaritjet në bazë të tyre. Nuk është absolute (shih më poshtë). Ligji i ruajtjes së energjisë është absolut.
2. Ligji i ruajtjes së energjisë: Energjia nuk lind nga asgjëja dhe nuk zhduket, por vetëm kalon nga një formë në tjetrën.
Ky ligj është rezultat i punës së A. Ajnshtajnit. Ai vendosi lidhjen midis energjisë dhe masës së materies (1905):
E \u003d ts 2,(6)
ku Me- shpejtësia e dritës në vakum, e barabartë me -300,000 km/s. Meqenëse energjia lirohet ose absorbohet si rezultat i një reaksioni kimik, atëherë, në përputhje me ekuacionin e Ajnshtajnit, ndryshon edhe masa e substancave. Megjithatë, ky ndryshim është aq i vogël sa nuk merret parasysh në praktikë (i ashtuquajturi defekt masiv).
Formimi i një mol klorur hidrogjeni nga substanca të thjeshta shoqërohet me një efekt termik prej 92,3 kJ / mol, që korrespondon me një humbje të masës së substancës ("defekt masiv") prej rreth 10 -9 g.
Ligjet e mëposhtme janë të vlefshme vetëm për përbërjet me përbërje molekulare konstante- daltonidet. Ato ndryshojnë nga komponimet që kanë një përbërje të ndryshueshme molekulash - bertolidet.
Lidhjet e metaleve përmbajnë komponime të tipit M t M l, ku t dhe n- variablat.
2. Ligji i qëndrueshmërisë së përbërjes (J. L. Proust, 1801).
Raporti midis masave elementet kimike, të cilat bëjnë pjesë në këtë përbërje, është një vlerë konstante, e pavarur nga mënyra e përgatitjes së tij.
3. Ligji i raporteve të shumëfishta (J. Dalton, 1803).
Nëse dy elementë formojnë disa komponimet kimike, atëherë masat e njërit prej elementeve për një masë të caktuar të tjetrit lidhen me njëra-tjetrën si numra të plotë të vegjël.
Në monoksid karboni (II) CO: M (C) / M (O) \u003d 12/16 \u003d 3/4, në monoksid karboni (IV) CO 2: M (C) / M (2 O) \u003d 12 /32 \u003d 3 /tetë. Prandaj, masat e karbonit për një masë të caktuar oksigjeni në këto komponime lidhen si:
3 / 4: 3 / 8 =2:1
4. Ligji i raporteve të thjeshta vëllimore (J. L. Gay-Lussac, 1808).
Vëllimet e gazeve të reaguara janë të lidhura me njëri-tjetrin dhe me vëllimet e gazrave të formuar si numra të plotë të vegjël.
Në reagimin e formimit të amoniakut në përputhje me koeficientët stoikiometrikë në ekuacionin e reaksionit:
H 2 + 3N 2 = 2NH 3 marrim se V (N 2) : V (H 2) : V (NH 3) = 1:3:2.
5. Ligji i Avogadros (1811). Vëllime të barabarta të gazrave të ndryshëm në të njëjtat kushte (p dhe T) përmbajnë të njëjtin numër molekulash.
Ky ligj rrjedh nga analiza e ekuacionit të gjendjes së gazit ideal Mendeleev-Clapeyron:
pV = nRT.
Ky ekuacion mund të shkruhet për dy gaze: p 1 V 1= V 1 RT 1, f 2 V 2= V 2 RT 2 .
Nëse është e barabartë p 1 \u003d p 2, T 1 \u003d T 2 dhe V i = V 2 sasitë e substancave të gazeve do të jenë të barabarta: n 1= n 2 ose, duke pasur parasysh numrin e Avogadro:
n 1 N A \u003d n 2 N A,
d.m.th., numri i molekulave të këtyre gazeve gjithashtu do të jetë i barabartë.
Ligji i Avogadros ka pasojat:
1. I njëjti numër molekulash të çdo gazi në të njëjtat kushte zë të njëjtin vëllim.
2. Masat e gazeve të marra në vëllime të barabarta në të njëjtat kushte (p, T) janë të lidhura me njëra-tjetrën si masat e tyre molare:
t 1 / t 2 \u003d M 1 / M 2.(7)
Kjo pasojë rrjedh nga barazia e sasive të substancave të këtyre gazeve (shih më lart): ν 1 = ν 2 .
Duke zëvendësuar në vend të sasisë së një lënde raportin e masës së saj me masën molare (ekuacioni 2) marrim:
t 1 / M 1 \u003d t 2 / M 2
t 1 / t 2 \u003d M g / M 2.
Pasoja e dytë na lejon të nxjerrim një ekuacion për përcaktimin e masës molare të një gazi të panjohur nga një vlerë e njohur e densitetit relativ të këtij gazi nga një gaz tjetër i njohur.
Pasi zëvendësojmë në numëruesin dhe emëruesin e anës së majtë të ekuacionit 7 vëllime të gazit të parë dhe të dytë, të cilët janë të barabartë, marrim:
t 1· V 2 / t 2 V 1 \u003d M 1 / M 2.
Raporti i masës së një lënde me vëllimin e saj zëvendësohet nga dendësia (shih ekuacionin 5):
R 1 / R 2 \u003d M 1 / M 2
dhe marrim një ekuacion për llogaritjen e peshës molekulare të gazit të parë nga i dyti:
M 1= (ρ 1 / ρ 2) M 2 = D 1/2 M 2(8)
Ose në pamje e përgjithshme:
M=D G M g(9)
ku D G- dendësia relative e gazit të parë në raport me të dytin.
Nëse dihet dendësia e hidrogjenit të një gazi të caktuar, atëherë përdoret ekuacioni i mëposhtëm:
M \u003d 2DH 2.(10)
Nëse dihet dendësia e gazit në ajër, atëherë përdoret ekuacioni:
M = 29D ajër. (11)