Transformimi i elementeve kimike. E bukur! Kimi
Nga 26 elementët e transuraniumit të njohur aktualisht, 24 nuk gjenden në planetin tonë. Ato u krijuan nga njeriu. Si sintetizohen elementët e rëndë dhe tepër të rëndë?
Lista e parë e tridhjetë e tre elementëve të supozuar, "Tabela e substancave që u përkasin të gjitha mbretërive të natyrës, e cila mund të konsiderohet më e thjeshta pjesë përbërëse tel”, botuar nga Antoine Laurent Lavoisier në 1789. Së bashku me oksigjenin, azotin, hidrogjenin, shtatëmbëdhjetë metale dhe disa elementë të tjerë realë, drita, kalori dhe disa okside figuronin në të. Dhe kur Mendelejevi doli me Tabelën Periodike 80 vjet më vonë, kimistët dinin 62 elementë. Nga fillimi i shekullit të 20-të, besohej se kishte 92 elementë në natyrë - nga hidrogjeni në uranium, megjithëse disa prej tyre ende nuk ishin zbuluar.
Megjithatë, tashmë në fundi i XIX Për shekuj me radhë, shkencëtarët kanë supozuar ekzistencën e elementeve që ndjekin uraniumin (transurane) në tabelën periodike, por ato nuk mund të zbuloheshin. Tani dihet se korja e tokës përmban sasi të vogla të elementeve të 93-të dhe 94-të - neptunium dhe plutonium. Por historikisht, këta elementë fillimisht u morën artificialisht dhe vetëm më pas u zbuluan në përbërjen e mineraleve.
Nga 94 elementët e parë, 83 kanë izotope të qëndrueshme ose jetëgjata, gjysma e jetës së të cilave është e krahasueshme me moshën e sistemit diellor (ata erdhën në planetin tonë nga një re protoplanetare). Jeta e 11 elementëve të mbetur natyrorë është shumë më e shkurtër, dhe për këtë arsye ato lindin në koren e tokës vetëm si rezultat i zbërthimeve radioaktive në kohë të shkurtër. Por çfarë ndodh me të gjithë elementët e tjerë, nga 95-ta në 118? Nuk ka asnjë në planetin tonë. Të gjitha janë marrë artificialisht.
Së pari artificiale
Krijimi i elementeve artificiale ka një histori të gjatë. Mundësia themelore e kësaj u bë e qartë në vitin 1932, kur Werner Heisenberg dhe Dmitri Ivanenko arritën në përfundimin se bërthamat atomike përbëhen nga protone dhe neutrone. Dy vjet më vonë, grupi i Enrico Fermit u përpoq të prodhonte transuranium duke rrezatuar uranium me neutrone të ngadalta. Supozohej se bërthama e uraniumit do të kapte një ose dy neutrone, pas së cilës do t'i nënshtrohet kalbjes beta me lindjen e elementeve të 93-të ose 94-të. Ata madje nxituan të shpallin zbulimin e transuraneve, të cilat Fermi i quajti ausonium dhe hesperium në fjalimin e tij Nobel të vitit 1938. Megjithatë, radiokimistët gjermanë Otto Hahn dhe Fritz Strassmann, së bashku me fizikanen austriake Lise Meitner, shpejt treguan se Fermi e kishte gabim: këto nuklide tashmë ishin izotope. elementet e njohur, që rezulton nga ndarja e bërthamave të uraniumit në çifte fragmentesh me përafërsisht të njëjtën masë. Ishte ky zbulim, i bërë në dhjetor 1938, që bëri të mundur krijimin e një reaktori bërthamor dhe Bombë atomike.Elementi i parë i sintetizuar nuk ishte fare transurani, por ekamargani i parashikuar nga Mendelejevi. U kërkua në xehe të ndryshme, por pa sukses. Dhe në vitin 1937, ekamargani, i quajtur më vonë teknetium (nga greqishtja ??? - artificial) u mor duke granatuar një objektiv molibdeni me bërthama deuterium të shpërndara në ciklotron në Laboratorin Kombëtar Lawrence Berkeley.
Predha të lehta
Elementet nga 93 deri në 101 janë marrë nga ndërveprimi i bërthamave të uraniumit ose transuraniumeve që e pasojnë atë me neutronet, deuteronet (bërthamat e deuteriumit) ose grimcat alfa (bërthamat e heliumit). Suksesi i parë këtu u arrit nga amerikanët Edwin Macmillan dhe Philip Abelson, të cilët në vitin 1940 sintetizuan neptunium-239, pasi kishin përpunuar idenë e Fermit: kapja e neutroneve të ngadalta nga uraniumi-238 dhe zbërthimi i mëvonshëm beta i uraniumit-239.Elementi tjetër, i 94-të, plutoniumi, u zbulua për herë të parë kur studioi zbërthimin beta të neptunium-238, i marrë nga bombardimi me deuteron i uraniumit në ciklotronin UC Berkeley në fillim të vitit 1941. Dhe së shpejti u bë e qartë se plutoniumi-239, nën veprimin e neutroneve të ngadalta, ndahet jo më keq se uraniumi-235 dhe mund të shërbejë si mbushje e një bombe atomike. Prandaj, të gjitha informacionet në lidhje me marrjen dhe vetitë e këtij elementi u klasifikuan, dhe artikulli nga Macmillan, Glenn Seaborg (për zbulimet e tyre ata ndanë Çmimi Nobël 1951) dhe kolegët e tyre me një mesazh për transuraniumin e dytë u shfaqën në shtyp vetëm në 1946.
Autoritetet amerikane vonuan gjithashtu për gati gjashtë vjet publikimin e zbulimit të elementit të 95-të, americium, i cili në fund të vitit 1944 u izolua nga grupi Seaborg nga produktet e bombardimit neutron të plutoniumit në një reaktor bërthamor. Disa muaj më parë, fizikanët e të njëjtit ekip kishin marrë izotopin e parë të elementit 96, me një peshë atomike 242, të sintetizuar duke bombarduar uranium-239 me grimca alfa të përshpejtuara. U emërua curium në njohje të meritave shkencore të Pierre dhe Marie Curie, duke hapur kështu traditën e emërtimit të transuraniumeve për nder të klasikëve të fizikës dhe kimisë.
Ciklotroni 60 inç në Universitetin e Kalifornisë ishte vendi i krijimit të tre elementëve të tjerë, të 97-të, të 98-të dhe të 101-të. Dy të parët u emëruan sipas vendit të tyre të lindjes - berkelium dhe kaliforni. Berkeliumi u sintetizua në dhjetor 1949 gjatë bombardimeve të americiumit me grimca alfa, dhe kaliforniumi dy muaj më vonë me të njëjtin bombardim të kuriumit. Elementet 99 dhe 100, einsteinium dhe fermium, u zbuluan gjatë analizave radiokimike të mostrave të mbledhura në zonën Eniwetok Atoll, ku më 1 nëntor 1952, amerikanët shpërthyen ngarkesën termonukleare Mike dhjetë megaton, guaska e së cilës ishte prej uranium- 238. Gjatë shpërthimit, bërthamat e uraniumit thithën deri në pesëmbëdhjetë neutrone, pas së cilës ata iu nënshtruan zinxhirëve të prishjes beta, gjë që çoi në formimin e këtyre elementeve. Elementi 101, mendelevium, u mor në fillim të vitit 1955. Trupi alfa Seaborg, Albert Ghiorso, Bernard Harvey, Gregory Choppin dhe Stanley Thomson bombarduan rreth një miliard (shumë pak, por thjesht nuk kishte më) atome të einsteiniumit të depozituar elektrolitikisht në fletë ari. Megjithë densitetin jashtëzakonisht të lartë të rrezes (60 trilion grimca alfa në sekondë), u përftuan vetëm 17 atome të mendeleviumit, por në të njëjtën kohë u bë e mundur të krijohej rrezatimi dhe Vetitë kimike.
jone të rënda
Mendeleviumi ishte transuraniumi i fundit i prodhuar duke përdorur neutrone, deuterone ose grimca alfa. Për të marrë elementët e mëposhtëm, kërkoheshin objektiva nga elementi numër 100 - fermium, të cilat atëherë nuk mund të bëheshin (madje edhe tani në reaktorët bërthamorë fermiumi përftohet në sasi nanograme).Shkencëtarët shkuan në anën tjetër: ata përdorën atome të jonizuara për të bombarduar objektivat, bërthamat e të cilave përmbajnë më shumë se dy protone (ata quhen jone të rëndë). Për të përshpejtuar rrezet jonike, kërkoheshin përshpejtues të specializuar. Makina e parë e tillë HILAC (Përshpejtuesi Linear Ion i Rëndë) u lançua në Berkeley në 1957, e dyta, ciklotroni U-300, u lëshua në Laborator. reaksionet bërthamore Instituti i Përbashkët për Kërkime Bërthamore në Dubna në 1960. Më vonë, instalimet më të fuqishme U-400 dhe U-400M u nisën në Dubna. Një tjetër përshpejtues UNILAC (Përshpejtuesi Linear Universal) ka funksionuar që nga fundi i vitit 1975 në Qendrën Gjermane të Helmholtz për Kërkimin e Joneve të Rënda, në Vixhausen, një nga rrethet e Darmstadt.
Bombardimi i rëndë i joneve i objektivave të plumbit, bismutit, uraniumit ose transuraniumit prodhon bërthama shumë të ngacmuara (të nxehta) që ose shkëputen ose çlirojnë energjinë e tyre të tepërt duke emetuar (avulluar) neutrone. Ndonjëherë këto bërthama lëshojnë një ose dy neutrone, pas së cilës ato i nënshtrohen transformimeve të tjera, siç është kalbja alfa. Kjo lloj sinteze quhet e ftohtë. Në Darmstadt, me ndihmën e tij, u përftuan elementë me numra nga 107 (borium) deri në 112 (kopernicium). Në të njëjtën mënyrë, në vitin 2004, fizikanët japonezë krijuan një atom të elementit të 113-të (një vit më parë ai u mor në Dubna). Gjatë shkrirjes së nxehtë, bërthamat e porsalindur humbasin më shumë neutrone- nga tre në pesë. Elementet nga 102 (nobelium) deri në 106 (seaborgium, për nder të Glenn Seaborg, nën udhëheqjen e të cilit u krijuan nëntë elementë të rinj) u sintetizuan në këtë mënyrë në Berkeley dhe në Dubna. Më vonë, në Dubna, gjashtë nga peshat super të rënda u bënë në këtë mënyrë - nga 113 deri në 118. Unioni Ndërkombëtar i Kimisë së Pastër dhe të Aplikuar (IUPAC, International Union of Pure and Applied Chemistry) deri më tani ka miratuar vetëm emrat e elementeve të 114-të (flerovium) dhe 116-të (livermorium).
Vetëm tre atome
Elementi i 118 me emrin e përkohshëm ununoctia dhe simbolin Uuo (sipas rregullave të IUPAC, emrat e përkohshëm të elementeve janë formuar nga rrënjët latine dhe greke të emrave të shifrave të numrit të tyre atomik, un-un-oct (ium ) - 118) u krijua nga përpjekjet e përbashkëta të dy grupeve shkencore: Dubninskaya nën drejtimin e Yuri Oganesyan dhe Laboratori Kombëtar i Livermore nën drejtimin e Kenton Moody, një student i Seaborg. Ununoctium në tabelën periodike ndodhet nën radon dhe për këtë arsye mund të jetë një gaz fisnik. Megjithatë, vetitë e tij kimike ende nuk janë sqaruar, pasi fizikantët kanë krijuar vetëm tre atome të këtij elementi me numri masiv 294 (118 protone, 176 neutrone) dhe një gjysmë jetë prej rreth një milisekonda: dy në 2002 dhe një në 2005. Ato u morën duke bombarduar një objektiv kaliforniumi-249 (98 protone, 151 neutrone) me jone të një izotopi të rëndë kalciumi me një masë atomike prej 48 (20 protone dhe 28 neutrone), të përshpejtuar në përshpejtuesin U-400. Numri total"Plumbat" e kalciumit arritën në 4.1x1019, kështu që performanca e "gjeneratorit ununoctium" Dubna është jashtëzakonisht e ulët. Megjithatë, sipas Kenton Moody, U-400 është e vetmja makinë në botë që mund të sintetizojë elementin e 118-të.“Çdo seri eksperimentesh mbi sintezën e transuraniumeve shton informacione të reja rreth strukturës së lëndës bërthamore, e cila përdoret për të modeluar vetitë e bërthamave super të rënda. Në veçanti, puna për sintezën e elementit të 118-të bëri të mundur hedhjen e disa modeleve të mëparshme, kujton Kenton Moody. “Ne e bëmë objektivin nga kaliforni, pasi elementët më të rëndë nuk ishin në dispozicion në sasinë e kërkuar. Kalciumi-48 përmban tetë neutrone shtesë në krahasim me izotopin e tij kryesor kalcium-40. Kur bërthama e saj u bashkua me një bërthamë kaliforniumi, u formuan bërthama me 179 neutrone. Ata ishin në gjendje shumë të emocionuar dhe për këtë arsye veçanërisht të paqëndrueshme, nga të cilat dolën shpejt, duke hedhur neutrone. Si rezultat, ne morëm një izotop të elementit të 118-të me 176 neutrone. Dhe këta ishin atome reale neutrale me një grup të plotë elektronesh! Nëse do të jetonin pak më gjatë, mund të gjykohen edhe vetitë e tyre kimike.
Metuselahu numër 117
Elementi 117, i njohur gjithashtu si ununseptium, u mor më vonë - në mars 2010. Ky element u prodhua në të njëjtën makinë U-400, ku, si më parë, jonet e kalciumit-48 u qëlluan në një objektiv nga berkelium-249, i sintetizuar në Laboratorin Kombëtar Oak Ridge. Përplasja e bërthamave të berkeliumit dhe kalciumit prodhoi bërthama joseptium-297 shumë të ngacmuara (117 protone dhe 180 neutrone). Eksperimentuesit arritën të merrnin gjashtë bërthama, pesë prej të cilave avulluan nga katër neutrone secila dhe u shndërruan në ununseptium-293, dhe pjesa e mbetur emetoi tre neutrone dhe krijoi ununseptium-294.Krahasuar me ununoctius, ununseptius doli të ishte një Methuselah i vërtetë. Gjysma e jetës së izotopit më të lehtë është 14 milisekonda, dhe ai më i rëndë është 78 milisekonda! Në vitin 2012, fizikanët e Dubna-s morën pesë atome të tjera të ununseptium-293, dhe më vonë disa atome të të dy izotopeve. Në pranverën e vitit 2014, shkencëtarët nga Darmstadt raportuan shkrirjen e katër bërthamave të elementit të 117-të, dy prej të cilave kishin një masë atomike prej 294. Gjysma e jetës së këtij unseptium "të rëndë", të matur nga shkencëtarët gjermanë, ishte rreth 51 milisekonda. (kjo është në përputhje të mirë me vlerësimet e shkencëtarëve nga Dubna) .
Tani në Darmstadt ata po përgatisin një projekt për një përshpejtues të ri linear të joneve të rënda në magnet superpërçues, i cili do të lejojë sintezën e elementeve të 119-të dhe 120-të. Plane të ngjashme po zbatohen në Dubna, ku po ndërtohet një ciklotron i ri DS-280. Është e mundur që në vetëm pak vite të bëhet e mundur sinteza e transuraniumeve të reja super të rënda. Dhe krijimi i elementit të 120-të apo edhe të 126-të me 184 neutrone dhe zbulimi i ishullit të stabilitetit do të bëhet realitet.
Jetë të gjatë në ishullin e stabilitetit
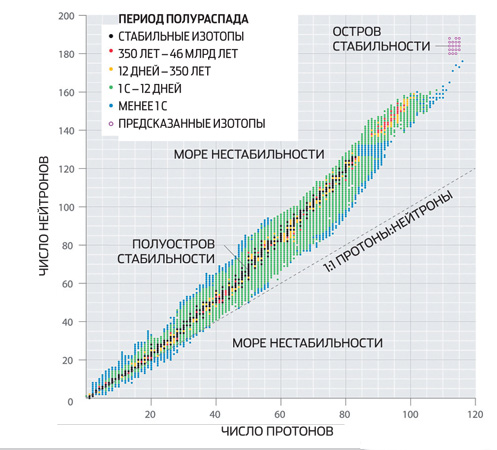 Brenda bërthamave ka predha proton dhe neutron, disi të ngjashme me predha elektronike të atomeve. Bërthamat me predha të mbushura plotësisht janë veçanërisht rezistente ndaj transformimeve spontane. Numrat e neutroneve dhe protoneve që korrespondojnë me predha të tilla quhen numra magjikë. Disa prej tyre përcaktohen në mënyrë eksperimentale - këto janë 2, 8, 20 dhe 28.
Brenda bërthamave ka predha proton dhe neutron, disi të ngjashme me predha elektronike të atomeve. Bërthamat me predha të mbushura plotësisht janë veçanërisht rezistente ndaj transformimeve spontane. Numrat e neutroneve dhe protoneve që korrespondojnë me predha të tilla quhen numra magjikë. Disa prej tyre përcaktohen në mënyrë eksperimentale - këto janë 2, 8, 20 dhe 28.
Modelet e guaskës bëjnë të mundur llogaritjen teorikisht të "numrave magjikë" të bërthamave super të rënda, megjithëse pa një garanci të plotë. Ka arsye për të pritur që numri neutron 184 do të dalë magjik. Numrat e protoneve 114, 120 dhe 126 mund të korrespondojnë me të, dhe ky i fundit, përsëri, duhet të jetë magjik. Nëse është kështu, atëherë izotopet e elementeve 114, 120 dhe 126, që përmbajnë 184 neutrone secila, do të jetojnë shumë më gjatë se fqinjët e tyre në tabelën periodike - minuta, orë apo edhe vite (kjo zonë e u200btabela zakonisht quhet ishulli i stabilitetit). Shkencëtarët i lidhin shpresat e tyre më të mëdha në izotopin e fundit me një bërthamë magjike të dyfishtë.
Metoda Dubna
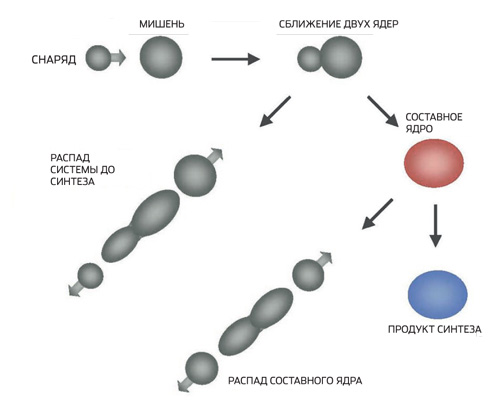
"Elementet 113 deri në 118 u krijuan në bazë të një metode të mrekullueshme të zhvilluar në Dubna nën drejtimin e Yuri Oganesyan," shpjegon Alexander Yakushev, një anëtar i ekipit Darmstadt. - Në vend të nikelit dhe zinkut, të cilat u përdorën për granatimet e objektivave në Darmstadt, Oganesyan mori një izotop me një masë atomike shumë më të ulët - kalcium-48. Çështja është se përdorimi i bërthamave të lehta rrit probabilitetin e shkrirjes së tyre me bërthamat e synuara. Bërthama e kalciumit-48 është gjithashtu dyfish magjike, pasi ajo përbëhet nga 20 protone dhe 28 neutrone. Prandaj, zgjedhja e Oganesyan kontribuoi shumë në mbijetesën e bërthamave komplekse që lindin gjatë granatimeve të objektivit. Në fund të fundit, bërthama mund të hedhë disa neutrone dhe të krijojë një transuranium të ri vetëm nëse nuk ndahet në fragmente menjëherë pas lindjes. Për të sintetizuar elementë tepër të rëndë në këtë mënyrë, fizikanët e Dubninsk bënë objektiva nga transuraniumet e prodhuara në SHBA - së pari plutonium, pastaj americium, curium, Kaliforni dhe në fund berkelium. Kalciumi-48 në natyrë është vetëm 0.7%. Ajo nxirret në ndarës elektromagnetikë, kjo është një procedurë e shtrenjtë. Një miligram i këtij izotopi kushton rreth 200 dollarë. Kjo sasi është e mjaftueshme për një ose dy orë granatime të objektivit dhe eksperimentet zgjasin me muaj. Vetë objektivat janë edhe më të shtrenjta, duke arritur një milion dollarë. Pagesa e faturave të energjisë elektrike kushton gjithashtu një qindarkë - përshpejtuesit e rëndë të joneve konsumojnë megavat energji. Në përgjithësi, sinteza e elementëve tepër të rëndë nuk është një kënaqësi e lirë.”
I. Pozicioni i hidrogjenit në sistemin periodik
Hidrogjeni - elementi kimik më i zakonshëm, përveç që është më i lehtë. Numri i tij serik është 1. Në tabelën periodike është në periudhën e parë. Duke pasur parasysh vetitë e tij, ai vendoset në të dy grupet 1A dhe 7A. Shtrohet pyetja - pse?
Bërthama e hidrogjenit përbëhet nga një proton, rreth të cilit rrotullohet një elektron. Formula elektronike 1s 1 . Molekula e hidrogjenit përbëhet nga dy atome të lidhura nga një lidhje kovalente jo polare. H 2 është gazi më i lehtë. Është pa ngjyrë dhe pa erë.
Hidrogjeni është një substancë kimikisht aktive. Ai mund të veprojë si agjent reduktues dhe agjent oksidues.
1) me disa metale formon hidride
2Na+H 2 =2NaH, këtu hidrogjen - oksidues
H
0
+ 1
e
-
→
H
-1
Një proces i ngjashëm ndodh gjatë bashkëveprimit të halogjenëve - jometaleve të grupit 7A
2Na + Cl 2 \u003d 2NaCl
Prandaj, hidrogjeni vendoset në grupin 7A
2) me jometale që shfaqin veti oksiduese më të forta se hidrogjeni
H 2 + Cl 2 = 2HCl këtu hidrogjen - agjent reduktues H 0 - 1 e - → H +1
Një proces i ngjashëm ndodh kur ndërveprojmë metale alkali-metalet e grupit 1A
2K + Cl 2 \u003d 2KCl
Prandaj, hidrogjeni vendoset në grupin 1A
II. Pozicioni në sistemin periodik elementet kimike D. I. Mendeleev lantanide dhe aktinide
Film edukativ: “Vetitë e lantanideve dhe aktinideve”
AT periudha e gjashtë pas lantanit janë 14 elementë me numra serialë 58-71, të quajtur lantanide (Fjala "lantanide" do të thotë "si lantanium", dhe "aktinide" do të thotë "si aktinium"). Ndonjëherë ato quhen lantanide dhe aktinide, që do të thotë pranë lantanit; pas aktiniumit) . Lantanidet vendosen veçmas në fund të tabelës, dhe në qelizë një yll tregon sekuencën e vendndodhjes së tyre në sistem: La-Lu. Vetitë kimike të lantanideve janë shumë të ngjashme. Për shembull, ato janë të gjitha metale reaktive që reagojnë me ujin për të formuar hidroksid dhe hidrogjen. Në lantanum (Z = 57), një elektron hyn në nënnivelin 5d, pas së cilës mbushja e këtij nënniveli ndalon dhe niveli 4f fillon të mbushet, shtatë orbitale prej të cilave mund të zënë 14 elektrone. Kjo ndodh për atomet e të gjitha lantanideve me Z = 58 - 71. Meqenëse këta elementë mbushin nënnivelin e thellë 4f niveli i tretë i jashtëm, ato kanë veti kimike shumë të ngjashme.
Nga kjo rezulton se lantanidet kanë një fort të theksuar analogji horizontale.
AT periudha e shtatë 14 elemente me numra serialë 90-103 përbëjnë familjen aktinidet. Ato vendosen gjithashtu veçmas - nën lantanide, dhe në qelizën përkatëse dy yje tregojnë sekuencën e vendndodhjes së tyre në sistem: Ac-Lr. Në aktinium dhe aktinide, mbushja e niveleve me elektrone është e ngjashme me lantanin dhe lantanidet. Megjithatë, ndryshe nga lantanidet, analogjia horizontale për aktinidet shprehet dobët. Ata shfaqin më shumë gjendje oksidimi të ndryshme në përbërjet e tyre. Për shembull, gjendja e oksidimit të aktiniumit është +3, dhe uraniumit është +3, +4, +5 dhe +6. Studimi i vetive kimike të aktinideve është jashtëzakonisht i vështirë për shkak të paqëndrueshmërisë së bërthamave të tyre.
Të gjitha aktinidet janë radioaktive. Ekzistojnë dy grupe të mbivendosura të aktinideve: "elementet e transuraniumit"- të gjithë elementët e mëposhtëm në tabelën periodike për uraniumin dhe "elementet e transplutoniumit"- të gjithë pas plutoniumit. Të dy grupet nuk kufizohen në kornizën e treguar dhe, kur tregohet prefiksi "trans-", ato mund të përfshijnë elementë që ndjekin lawrencium - rutherfordium, etj. Kjo për faktin se elementë të tillë sintetizohen në sasi jashtëzakonisht të vogla. Krahasuar me lantanidet, të cilat (përveç prometiumit) gjenden në natyrë në sasi të konsiderueshme, aktinidet janë më të vështira për t'u sintetizuar. Por ka përjashtime, për shembull, uraniumi dhe toriumi janë më të lehtat për t'u sintetizuar ose gjetur në natyrë, të ndjekur nga plutoniumi, americium, aktinium, protactinium dhe neptunium.
III. Pozicioni në sistemin periodik të elementeve kimike të D. I. Mendeleev elemente të përftuara artificialisht
Deri në vitin 2008, njihen 117 elementë kimikë (me numra serialë nga 1 në 116 dhe 118), nga të cilët 94 gjenden në natyrë (disa janë vetëm në sasi të vogla), 23 të tjerët janë marrë artificialisht si rezultat i reaksioneve bërthamore (shih Shtojcat). 112 elementët e parë kanë emra të përhershëm, pjesa tjetër janë të përkohshme.
Faqe 1
Elementet e fituara artificialisht që pasojnë uraniumin quhen transuranium.
Elementet e fituara artificialisht shënohen me një mbishkrim; për ta vlerat e të afërmve masat atomike(pa specifikim të saktësisë) ose numrat në masë të izotopeve më jetëgjatë. Indeksi i poshtëm në të majtë të simbolit të elementit tregon numrin e tij serial në sistemin periodik. Simbolet e elementeve jo të zakonshme janë të mbyllura në kllapa. Në fund të tabelës vendosen elementët me numra serialë 106 dhe 107, të cilët ende nuk kanë simbole.
Elementet e fituara artificialisht: Astatine - Nr. 85, Teknetium - Nr. 43, francium - Nr. 87 (shih f.
Të gjithë këta elementë të përftuar artificialisht nuk janë gjetur ende në natyrë, por janë me interes të madh shkencor. Disa prej tyre tashmë janë përdorur në teknologji.
| Nivelet e energjisë 5 / dhe. |
Emërtoni elementet e fituara artificialisht të njohura për ju, tregoni vendin e tyre në tabelën e tabelës periodike të elementeve kimike të D. I. Mendeleev dhe vizatoni diagrame që pasqyrojnë rregullimin e elektroneve në orbitale në atomet e këtyre elementeve.
Elementet e reja të marra artificialisht që u korrespondojnë atyre morën emer i perbashket elementet transuranike.
Në tabelë. 1 tregon emrat (rusisht dhe latinisht) të elementeve, shenjat kimike, numrat e tyre serial në sistemin periodik të elementeve të D. I. Mendeleev, masën atomike relative dhe vitin e zbulimit. Masat atomike jepen sipas Tabelës Ndërkombëtare të vitit 1981. Elementet e fituara artificialisht janë shënuar me yll; i lashte Numrat masiv të izotopeve me gjysmëjetën më të gjatë për një element radioaktiv të caktuar jepen në kllapa katrore. Emrat dhe simbolet kimike të elementeve të dhëna në kllapa nuk pranohen përgjithësisht.
Në tabelë. 1 jep emrat (rusisht dhe latinisht) të elementeve, numrat e tyre serial në sistemin periodik të elementeve të D. I. Mendeleev, masën atomike relative dhe vitin e zbulimit. Masat atomike (me katër shifra domethënëse) jepen sipas Tabelës Ndërkombëtare të vitit 1977. Një yll tregon elemente të përftuara artificialisht, të lashta.
elemente artificiale
Kur uraniumi bombardohet me neutrone termike, prej tij formohen elemente më të lehta me numra serialë 35-65: kjo na bëri të shpresojmë se midis fragmenteve do të gjendeshin edhe izotopet e elementeve 43 dhe 61. Nëse kujtojmë gjendjen e çështjes së marrjes elementet 43, 61, si dhe 85 dhe 87 në vitin 1930, ishte e mundur të kapej një përparim i dukshëm. Fillimisht u vërtetua dyshimi se elementët 43 dhe 61 janë substanca të paqëndrueshme që “u shuan”. Sa i përket elementeve 85 dhe 87, ato janë njohur prej kohësh si substanca radioaktive të kalbura.
Në vitin 1934, fizikani Josef Mattauch gjeti një rregull të madh që lejon të vlerësohet qëndrueshmëria e bërthamave të izotopit. Sipas rregullit të Mattauch, një izotop i dytë i qëndrueshëm nuk mund të ekzistojë nëse ngarkesa e bërthamës së tij ndryshon vetëm për një nga ngarkesa e bërthamës së një izotopi të njohur të qëndrueshëm me të njëjtin numër masiv. Ky model plotëson rregullin Harkins, sipas të cilit elementët me një numër atomik tek (d.m.th., një numër tek protonet dhe elektrone) janë shumë më pak të zakonshëm në Tokë, pasi qëndrueshmëria e bërthamave të tyre është e ulët.
Në lidhje me elementet 43 dhe 61, rregulli Mattauch mund të shprehet si më poshtë. Bazuar në pozicionin e tyre në sistemin periodik, numri masiv i elementit 43 duhet të jetë rreth 98, dhe për elementin 61 rreth 147. Megjithatë, izotopet e qëndrueshme njiheshin tashmë për elementët 42 dhe 44, si dhe për elementët 60 dhe 62 me masë. nga 94 në 102 dhe, përkatësisht, nga 142 në 150. Meqenëse një izotop i dytë i qëndrueshëm me të njëjtin numër masiv nuk mund të ekzistojë, elementët 43 dhe 61 duhet të kenë vetëm përfaqësues të paqëndrueshëm. Nuk ka dyshim se dikur elementët 43 dhe 61 ishin në Tokë në sasi të mjaftueshme.
Kur e bëri tonë sistem diellor, atëherë të gjithë elementët u formuan duke kombinuar protonet dhe neutronet. Sidoqoftë, gjatë ekzistencës së Tokës - 4.6 miliardë vjet - përfaqësuesit e tyre të paqëndrueshëm gradualisht u zhdukën plotësisht. Përjashtimet e vetme janë ato elementet radioaktive, të cilat mund të rimbushen vazhdimisht brenda kufijve të serisë radioaktive natyrore, sepse substancat e tyre fillestare janë Urani ose torium- ekzistojnë ende në Tokë, falë gjysmëjetës së tyre, që numëron miliarda vjet. Elementet 43 dhe 61 nuk i përkasin këtyre serive natyrore radioaktive. Vetëm nëse ekziston një izotop jetëgjatë i këtyre elementeve, mund të shpresohet të gjehen gjurmët e tij radiokimike.
Ndërsa disa dijetarë ishin ende transuranet e rreme, studiues të tjerë arritën të gjenin elementët e lakmuar 43 dhe 87. Ja historia e zbulimit të tyre...
Në vitin 1936 Emilio Segre pas martesës, ai la Fermin dhe kolegët e tij dhe shkoi në Palermo, ish-kryeqyteti i Siçilisë. Në universitetin e atjeshëm, atij iu ofrua katedra e fizikës. Në Palermo, për keqardhjen e tij të madhe, Segre nuk ishte në gjendje të vazhdonte kërkimin e filluar me Fermi. Universiteti nuk kishte asnjë pajisje për kërkime radioaktive. Duke marrë një vendim të shpejtë, shkencëtari italian shkoi në Amerikë për t'u njohur me Universitetin e Kalifornisë në Berkeley, i cili ishte i famshëm për pajisjet më të mira. Në atë kohë ishte i vetmi në botë ciklotron. "Ato burime radioaktiviteti që pashë ishin vërtet të mahnitshme për një person që më parë kishte punuar vetëm me burimet Ra-Be.“, kujton fizikani.
Segre ishte veçanërisht i interesuar pllakë devijuese e ciklotronit. Ajo duhej të drejtonte rrjedhën e grimcave të përshpejtuara në drejtimin e kërkuar. Për shkak të përplasjeve me grimcat me energji të lartë - përshpejtuar deuteronet Kjo pjatë u nxeh shumë. Prandaj, duhej të bëhej prej metali zjarrdurues - molibden. Pikërisht ky molibden metalik i bombarduar nga deuteronët i kushtoi vëmendjen mysafirit nga Italia. Segre sugjeroi që nga molibden, elementi 42, si rezultat i bombardimeve me deuterone, mund të formoheshin izotope të elementit ende të panjohur 43. Ndoshta, sipas ekuacionit:
96 Mo + D = 97 X + n
Natyrore molibdenështë një përzierje e gjashtë izotopeve të qëndrueshme. Segre sugjeroi se ndoshta një nga gjashtë izotopet radioaktive të mundshme të elementit 43 në të cilin teorikisht mund të shndërrohej molibden - të paktën një - doli të jetë mjaftueshëm jetëgjatë për t'i bërë ballë një udhëtimi detar në Siçili. Sepse fizikani italian synonte të kërkonte elementin 43 vetëm në një institut në atdheun e tij.
Studiuesi u nis në udhëtimin e tij të kthimit, duke pasur në xhep një copë pllakë molibdeni nga ciklotroni i Berklit. Në fund të janarit 1937, ai filloi kërkimet me mbështetjen e mineralogistit dhe kimistit analitik Perrier. Ata vërtet gjetën atome radioaktive që, nga vetitë e tyre kimike, mund të vendoseshin midis manganit dhe reniumit. Sasitë e ekamarganezit, të cilat u rilindën përsëri artificialisht në Tokë falë gjenisë kërkimore të njeriut, ishin të paimagjinueshme: nga 10 -10 në 10 -12 g të elementit të 43-të!
Kur, në korrik 1937, Segre dhe Perrier raportuan për sintezën e elementit të parë artificial, të zhdukur prej kohësh në Tokë, ishte një ditë që hyri në histori. Për elementin 43, më vonë u gjet një emër shumë i saktë: teknetium, që rrjedh nga greqishtja teknetos- artificiale. A do të jetë ndonjëherë e mundur ta merrni atë në sasi të konsiderueshme dhe ta mbani në duar? Shumë shpejt u bë e mundur t'i përgjigjesh kësaj pyetjeje në mënyrë pozitive, kur u zbulua se nga ndarja e uraniumit lindin 43 izotope me rendiment relativisht të lartë. Një izotop me një numër masiv prej 101 dhe një gjysmë jetë prej 14 minutash tërhoqi vëmendje të veçantë. Supozohej se substanca Fermi me një gjysmë jetë prej 13 minutash, elementi imagjinar 93, duhet të ishte një izotop i elementit 43.
Seritë radioaktive natyrore kanë formën përfundimtare- askush nuk guxoi të dyshonte më, veçanërisht pas identifikimit masiv spektrografik të uraniumit-235 nga Dempster. Megjithatë, kishte një pikë të dobët në serinë uranium-aktinium. Kanë kaluar më shumë se njëzet vjet që kur u vu re “pasaktësia” në këtë serial, i cili thuajse u la në harresë.
Në vitin 1913/1914, kjo mospërputhje u ndesh nga kimisti anglez Cranston dhe studiuesit austriakë të radioaktivitetit Mayer, Hess dhe Panet gjatë studimit të aktiniumit. Si një emetues beta aktinium dihet se kthehet në radioaktinium, pra te izotopi torium. Kur shkencëtarët studiuan procesin e transformimit, ata gjithmonë vëzhguan rrezatim të dobët alfa. Ky aktivitet i mbetur (rreth 1%) u gjet gjithashtu nga Otto Hahn në eksperimentet për të marrë aktinium të pastër. " Nuk arrija t'i kushtoja rëndësi kësaj sasie të vogël.", raportoi më vonë Khan. Ai besonte se kjo ka shumë të ngjarë të ishte një papastërti.
Shumë vite më vonë. Shkencëtarja franceze Marguerite perey, një punonjës i Institutit të famshëm të Radiumit në Paris, ndoqi përsëri këtë shteg, pastroi me shumë kujdes fraksionet anemone dhe në shtator 1939 ajo ishte në gjendje të raportonte për izolimin e suksesshëm të një izotopi të ri radioaktiv. Ishte elementi 87 i munguar prej kohësh, ai nënprodukt që lëshon alfa që jep aktivitetin e mbetur prej 1% të aktiniumit. Madame Perey gjeti një pirun në rreshtin tashmë të mbushur, sepse izotopi i elementit 87 shndërrohet në aktinium X në të njëjtën mënyrë si radioaktiniumi i njohur. Me sugjerimin e Perey, u emërua elementi 87 Franca për nder të atdheut të saj.
Vërtetë, kimistët deri më sot nuk kanë arritur sukses të madh në studimin e elementit 87. Në fund të fundit, të gjithë izotopet e franciumit janë jetëshkurtër dhe prishen brenda milisekondave, sekondave ose minutave. Për këtë arsye, elementi deri më tani ka mbetur “jointeresant” për shumë studime kimike dhe përdorim praktik. Nëse është e nevojshme, ajo merret artificialisht. Sigurisht, franciumi mund të "merret" edhe nga burimet natyrore, por kjo është një ndërmarrje e dyshimtë: 1 g uranium natyror përmban vetëm 10 -18 g francium!
Kur u zbulua sistemi periodik, mungonin 23 elementë, tani vetëm dy: 61 dhe 85. Si vazhdoi gjuetia për elementë? Në verën e vitit 1938, Emilio Segre shkoi përsëri në Berkeley. Ai synonte të studionte izotopet jetëshkurtër të elementit 43. Sigurisht që studime të tilla duhej të ishin ndërmarrë aty për aty. Izotopet me gjysmë jetë të shkurtër nuk do t'i “mbijetonin” udhëtimit drejt Italisë. Sapo mbërriti në Berkeley, Segre mësoi se kthimi në Italinë fashiste ishte bërë i pamundur për të për shkak të terrorit racor. Segré mbeti në Berkeley dhe vazhdoi punën e tij atje.
Në Berkeley, me një ciklotron më të fuqishëm, grimcat alfa mund të përshpejtohen në energji të larta. Pas tejkalimit të të ashtuquajturit pragu i ndërveprimit të Kulombit, këto grimca alfa ishin në gjendje të depërtonin edhe në bërthamat e atomeve të rënda. Tani Segre pa një mundësi për t'u kthyer bismut, elementi 83, në elementin e panjohur 85. Së bashku me amerikanët Corson dhe Mackenzie, ai bombardoi bërthamat e bismutit me grimca alfa me një energji prej 29 MeV për të kryer procesin e mëposhtëm:
209 Bi + 4 He = 211 X + 2 n
Reagimi ka ndodhur. Kur studiuesit përfunduan punën e tyre të parë të përbashkët, më 1 mars 1940, ata shprehën vetëm me kujdes idenë " për prodhimin e mundshëm të një izotopi radioaktiv të elementit 85"Menjëherë pas kësaj, ata tashmë ishin të sigurt: elementi 85 ishte marrë artificialisht përpara se të gjendej në natyrë. Ky i fundit pati fatin ta bënte vetëm pak vite më vonë anglezja Ley-Smith dhe zvicerani Minder nga instituti në Bernë. Ata arriti të tregojë se elementi 85 është formuar në serinë radioaktive të toriumit si rezultat i një procesi anësor. element i hapur ata zgjodhën emrin Anglo-Helvetium, i cili u kritikua si marrëzi verbale. Studiuesja austriake Karlik dhe bashkëpunëtori i saj Bernert shpejt gjetën elementin 85 në seritë e tjera të radioaktivitetit natyror, gjithashtu si një nënprodukt. Megjithatë, e drejta për t'i dhënë një emër këtij elementi, që gjendet vetëm në gjurmë, i mbeti Segre-t dhe bashkëpunëtorëve të tij: tani quhet astatine, që në greqisht do të thotë i përhershëm. Në fund të fundit, izotopi më i qëndrueshëm i këtij elementi ka një gjysmë jetë prej vetëm 8.3 orë.
Në këtë kohë, profesor Segre po përpiqej gjithashtu të sintetizonte elementin 61. Ndërkohë, u bë e qartë se të dy fqinjët e këtij elementi në sistemin periodik, neodymium dhe samarium, janë radioaktivë të dobët. Në fillim kjo dukej befasuese, pasi në atë kohë besohej se radioaktiviteti ishte i natyrshëm në elementët më të rëndë. Neodymium, elementi i 60-të, lëshonte rreze beta, dhe për këtë arsye duhej të kthehej në elementin 61. Fakti që ky element kimik i panjohur deri më tani nuk mund të izolohej ndoshta ishte për shkak të prishjes së tij të shpejtë radioaktive. Çfarë duhet bërë? Edhe këtu, rruga për të dalë ishte marrja artificiale e elementit të dëshiruar. Meqenëse elementi 61 nuk mund të gjendej në natyrë, fizikanët u përpoqën ta sintetizonin atë.
Në 1941/42, shkencëtarët Lowe, Poole, Quill dhe Kurbatov nga Universiteti Shtetëror tokë e rrallë e bombarduar në Ohio neodymium deuteronët e përshpejtuar në një ciklotron. Ata zbuluan izotopet radioaktive element i ri, i cili u quajt ciklonium. Megjithatë, në film kishte mbetur vetëm një gjurmë.
Cilat ishin sukseset e Emilio Segre? Ai rrezatoi me rreze alfa praseodymium- elementi 59. Megjithatë, përpunimi i izotopeve të elementit 61 të sintetizuar pa kushte prej tij doli të ishte shumë i ndërlikuar. Izolimi i tyre nga elementët e tjerë të tokës së rrallë dështoi.
Një studim jo-përfundimtar u raportua nga Finlanda. Në vitin 1935, kimisti Eremetse filloi të analizonte koncentratet e një përzierje oksidesh. samarium dhe neodymium mbi përmbajtjen natyrore të elementit të 61-të në to. Për këtë qëllim u përpunuan disa tonë apatit.
Etapa e parë e luftës për elementin e 61-të pati një barazim. Nuk mund ta pranoja as titullin e propozuar" ciklonia".
SISTEMATIZIMI, GJENERALIZIMI DHE THELLIMI I NJOHURIVE NË KURSIN E KIMISË
Kapitulli II. Ligji periodik dhe sistemi periodik D.I. Mendeleev bazuar në mësimet
për strukturën e atomit
Detyrat për §§1-3 (f. 70)
Pyetja 1
Krahasoni formulimin e ligjit periodik të dhënë nga D.I. Mendeleev, me një formulim modern. Shpjegoni pse ishte i nevojshëm ky ndryshim në formulim.
Formulimi i ligjit periodik i dhënë nga D.I. Mendeleev, tha: vetitë e elementeve kimike janë në varësi periodike nga masat atomike të këtyre elementeve. Formulimi modern thotë: vetitë e elementeve kimike janë në një varësi periodike nga ngarkesa e bërthamës së këtyre elementeve. Një sqarim i tillë kërkohej, pasi në kohën kur Mendeleev vendosi ligjin periodik, struktura e atomit nuk dihej ende. Pas sqarimit të strukturës së atomit dhe vendosjes së ligjeve që rregullojnë shpërndarjen e elektroneve mbi nivelet elektronike, u bë e qartë se përsëritja periodike e vetive të elementeve shoqërohet me përsëritjen e strukturës së predhave elektronike.
Pyetja numër 2
Pse numri i elementeve në periudha korrespondon me një seri numrash 2 - 8 - 18 - 32? Shpjegoni këtë model, duke marrë parasysh rregullimin e elektroneve përgjatë nivelet e energjisë.
Elektronet në një atom mund të zënë orbitalet s-, p-, d- dhe f. Një nivel elektronik mund të ketë një orbitale s, tre orbitale p, pesë orbitale d, shtatë orbitale f. në një orbitale
nuk mund të ketë më shumë se dy elektrone. Kështu, nëse mbushen vetëm s-orbitalet, ka 2 elektrone në nivelin e elektroneve. Nëse orbitalet s dhe p janë të mbushura, ka 2 + 6 = 8 elektrone në një nivel elektronik. Nëse plotësohen orbitalet s-, p- dhe d, në nivelin elektronik ka 2 + 6 + 10 = 18 elektrone. Së fundi, nëse plotësohen orbitalet s-, p-, d- dhe f, ka 2 + 6 + 10 + 14 = 32 elektrone në nivelin e elektroneve. Kështu, numri i elementeve në periudha korrespondon me numrin maksimal të mundshëm të elektroneve në nivelin elektronik.
Pyetja nr 3
Bazuar në teorinë e strukturës së atomeve, shpjegoni pse grupet e elementeve ndahen në kryesore dhe dytësore.
Në elementet e nëngrupeve kryesore të sistemit periodik të elementeve, orbitalet e nivelit të jashtëm elektronik janë të mbushura me elektrone. Në elementet e nëngrupeve anësore, orbitalet e nivelit elektronik të parafundit janë të mbushura me elektrone.
Pyetja numër 4
Me çfarë kriteresh dallohen momentet s-, p-, d- dhe f?
Në atomet e elementeve s mbushen orbitalet s; në atomet e elementeve p mbushen orbitalet; në atomet e elementeve d
– d-orbitalet dhe në atomet e elementeve f – f-orbitalet.
Pyetja numër 5
Duke përdorur tabelën e sistemit periodik të elementeve kimike D.I. Mendeleev, hartoni një diagram të renditjes së elektroneve në orbitale dhe niveleve të energjisë në atomet e elementeve vanadium V, nikel Ni dhe arseniku As. Cilat prej tyre janë elemente p dhe cilat janë elemente d dhe pse?
Atomi i vanadiumit:
1s2 2s2 2p6 3s2 3p6 3d3 4s2
Atomi i nikelit: 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Atomi i arsenikut: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Në atomet e vanadiumit dhe nikelit, nënniveli 3d është i mbushur, kështu që ato quhen elemente d. Në atomin e arsenikut, nënniveli 4p është i mbushur, domethënë, arseniku është një element p.
Pyetja numër 6
Shpjegoni pse shenjë kimike hidrogjeni zakonisht vendoset në nëngrupin kryesor të grupit I dhe në nëngrupin kryesor të grupit VII.
Atomi i hidrogjenit ka një s-elektron në shtresën e jashtme (dhe të vetme) elektronike, si në atomet e metaleve alkali. Prandaj, hidrogjeni vendoset në grupin e parë të sistemit periodik. Nga ana tjetër, për të mbushur shtresën e jashtme elektronike, atomit të hidrogjenit i mungon një elektron, si atomet e halogjenit, kështu që hidrogjeni vendoset edhe në nëngrupin kryesor të grupit VII të sistemit periodik.
Pyetja numër 7
Në bazë të modeleve të shpërndarjes së elektroneve në orbitale, shpjegoni pse lantanidet dhe aktinidet kanë veti kimike të ngjashme.
Në atomet e lantanideve dhe aktinideve, niveli i tretë elektronik nga jashtë është i mbushur. Meqenëse vetitë kimike varen kryesisht nga elektronet e shtresës së jashtme, lantanidet dhe aktinidet janë shumë të ngjashme në veti.
Pyetja numër 8
Emërtoni elementet e fituara artificialisht të njohura për ju, tregoni vendin e tyre në tabelën e tabelës periodike të elementeve kimike të D.I. Mendeleev dhe vizatoni diagrame, nga
duke pasqyruar renditjen e elektroneve në orbitale në atomet e këtyre elementeve.
Ato nuk ndodhin në natyrë dhe mund të merren vetëm artificialisht teknetium (nr. 43), prometium (nr. 61), astatine (nr. 85), francium (nr. 87) dhe elementë transuranium, domethënë elementë që janë në sistemi periodik pas uraniumit (me numrat 93 e më shumë).
Qarqet elektronike teknetium, promethium, astatine dhe francium:
43 Tc 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2
61 pm 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2
85 Në 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p5
Qarku elektronik i elementit të parë të transuraniumit - neptunium:
93 Np
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2
Pyetja numër 9
Shpjegoni thelbin e konceptit të "valencës" nga këndvështrimi i ideve moderne për strukturën e atomeve dhe formimin e një lidhjeje kimike.
Valenca është e barabartë me numrin lidhjet kimike që një atom i një elementi të caktuar mund të formohet me atomet e elementeve të tjerë. Elektronet e nivelit të jashtëm elektronik marrin pjesë në formimin e lidhjeve kimike. Valenca mund të përkufizohet gjithashtu si numri i elektroneve që një atom i një elementi kimik të caktuar mund të sigurojë për të formuar lidhje kimike me atomet e elementeve të tjerë.
Pyetja numër 10
Pse vlera numerike e valencës nuk përkon gjithmonë me numrin e elektroneve në nivelet e jashtme të energjisë?
Formimi i lidhjeve kimike është i mundur në prani të elektroneve të paçiftuara në atom. Në shumë elementë, jo të gjitha elektronet në nivelin e jashtëm elektronik janë të paçiftuar.
Për shembull, atomet e oksigjenit dhe squfurit kanë gjashtë elektrone në nivelin e jashtëm, por vetëm dy prej tyre janë të paçiftuar:
16S↓ | ||||||||||||||
Sidoqoftë, në atomin e squfurit në nivelin e jashtëm elektronik ka ende orbitale boshe 3d, tek të cilat mund të kalojnë elektronet nga orbitalet 3s dhe 3p, si rezultat, gjashtë elektrone të paçiftuara bëhen në atomin e squfurit:
16S↓ | ||||||||||||||
Prandaj, valenca maksimale e squfurit është gjashtë, domethënë përkon me numrin e elektroneve në nivelin e jashtëm elektronik. Nuk ka orbitale d në atomin e oksigjenit në nivelin e dytë, prandaj nuk ka mundësi për çiftimin e elektroneve, dhe valenca e oksigjenit nuk mund të jetë më shumë se dy, domethënë nuk është e barabartë me numrin e elektroneve në nivelin e jashtëm. .
Pyetja numër 11
Pse valenca maksimale e elementeve të periudhës së dytë nuk mund të kalojë numrin 4?

Në atomet e elementeve të periudhës së dytë, nuk mund të ketë më shumë se 4 elektrone të paçiftuara, pasi niveli i dytë elektronik ka një orbitale s dhe tre orbitale p. Valenca është e barabartë me numrin e elektroneve të paçiftuara, kështu që valenca e elementeve të periudhës së dytë nuk mund të jetë më shumë se 4.
Pyetja numër 12
Bëni qarqe elektronike që pasqyrojnë valencën e azotit në acidin nitrik dhe valencën e karbonit dhe oksigjenit në monoksidin e karbonit (II).
a) molekula e monoksidit të karbonit. Struktura e predhave elektronike të atomeve të karbonit dhe oksigjenit:
Në një molekulë të monoksidit të karbonit, dy lidhje formohen nga dy elektrone të paçiftuara në atomin e karbonit dhe dy elektrone të paçiftuara në atomin e oksigjenit. Atomi i oksigjenit ka një palë tjetër elektronesh në orbitalin 2p, dhe atomi i karbonit ka një orbitale të lirë 2p. Një çift elektronesh kalon nga një atom oksigjeni në një atom karboni, duke formuar një lidhje dhurues-pranues. Formula elektronike e monoksidit të karbonit (II) mund të përfaqësohet si më poshtë:
(shigjeta tregon lidhjen dhurues-pranues).
b) molekula e acidit nitrik. Qarqet elektronike të atomeve të hidrogjenit, oksigjenit dhe azotit:
Atomi i hidrogjenit formon një lidhje me atomin e oksigjenit për shkak të një elektroni të vetëm. Elektroni i dytë i atomit të oksigjenit është i përfshirë në formimin e një lidhjeje me atomin e azotit:
Atomi i azotit ka dy elektrone të paçiftëzuara të mbetura dhe formon dy lidhje me atomin e dytë të oksigjenit:
HONO
Në atomi i azotit ka ende një çift elektronik Orbitalet 2s.
AT Në atomin e tretë të oksigjenit, ndodh çiftimi i elektroneve dhe formohet një orbital i lirë:
Një çift elektronesh nga atomi i azotit kalon në orbitalin e zbrazur të atomit të oksigjenit dhe formohet një lidhje dhuruese-pranuese:
Pyetja numër 13
Pse, sipas koncepteve moderne, koncepti i valencës nuk është i zbatueshëm për përbërjet jonike?
Valenca është e barabartë me numrin e lidhjeve të formuara nga një atom dhe varet nga numri i elektroneve në nivelin e jashtëm elektronik. Përbërjet jonike përbëhen nga jone të ngarkuar pozitivisht dhe negativisht që mbahen së bashku nga tërheqja elektrike. Në përbërjet jonike, numri i lidhjeve ndërmjet joneve varet
sitë në strukturën e rrjetës kristalore, mund të jenë të ndryshme dhe nuk kanë lidhje me numrin e elektroneve në nivelin e jashtëm elektronik.
Pyetja numër 14
Cilat modele vërehen në ndryshimin e rrezeve atomike në periudhat nga e majta në të djathtë dhe në kalimin nga një periudhë në tjetrën?
Në periudha, rrezet atomike zvogëlohen nga e majta në të djathtë. Kjo është për shkak të faktit se ngarkesa e bërthamës rritet dhe elektronet tërhiqen më fort nga bërthama, guaskë elektronike sikur po tkurret. Në grupe, rrezet e atomeve rriten nga lart poshtë, me rritjen e numrit të predhave të elektroneve.
Pyetja numër 15
Kujtoni formulimin e ligjit periodik të dhënë nga D.I. Mendeleev dhe formulimi modern i këtij ligji. Në shembuj specifikë, konfirmoni se jo vetëm vetitë e elementeve kimike ndryshojnë periodikisht, por edhe format dhe vetitë e përbërjeve të tyre.
Formulimi i ligjit periodik i dhënë nga D.I. Mendeleev, tha: vetitë e elementeve kimike janë në varësi periodike nga masat atomike të këtyre elementeve. Formulimi modern thotë: vetitë e elementeve kimike janë në një varësi periodike nga ngarkesa e bërthamës së këtyre elementeve. Vetitë e përbërjeve të elementeve kimike gjithashtu ndryshojnë periodikisht. Për shembull, oksidet e të gjitha metaleve të nëngrupit kryesor të grupit I (Li2O, Na2O, K2O, Rb2O, Cs2O) shfaqin veti themelore, dhe oksidet e të gjithë elementëve të nëngrupit kryesor të grupit IV (CO2, SiO2 , GeO2 SnO2, PbO2) - veti acidike .
3 detyra numër 1
Me djegien e plotë të 0,68 g të një lënde të panjohur, u përftuan 1,28 g oksid squfuri (IV) dhe 0,36 g ujë. Gjej formula kimike substancë e djegur.
Llogaritni masat molare të ujit dhe oksidit të squfurit (IV):
M (H2 O) \u003d 1 2 + 16 \u003d 18 g / mol
M(SO2) \u003d 32 + 16 2 \u003d 64 g / mol
Le të llogarisim sasinë e substancës së ujit dhe oksidit të squfurit (IV) të formuar gjatë djegies së substancës:
ν(H2O) = | m(H2O) | ||||||||
M(H2O) | |||||||||
ν(SO2) = | |||||||||
M(SO2) | |||||||||
Sepse në reaksionin fitohen SO2 dhe H2 O, atëherë në substancën fillestare mund të përmbahen vetëm S, H dhe O. Atëherë substanca fillestare mund të paraqitet skematikisht me formulën Sx Hy Oz. Atëherë do të shkruhet ekuacioni i reaksionit
x+y | |||||||||
0,02 mol ujë përmban 0,02 2 = 0,04 mol atome hidrogjeni. 0,02 mol oksid squfuri përmban 0,02 mol atome hidrogjeni. Llogaritni masën e hidrogjenit dhe squfurit në substancë:
m (H) \u003d n (H) M (H) \u003d 0,04 mol 1 g / mol \u003d 0,04 g.
m(S) = n(S) M(S) = 0,02 mol 32 g/mol = 0,64 g
Masa e squfurit dhe hidrogjenit është 0,64 + 0,04 = 0,68 g, domethënë është e barabartë me masën e substancës, që do të thotë se substanca nuk përmban elementë të tjerë përveç squfurit dhe hidrogjenit. Ka 0,02 mol squfur për 0,04 mol hidrogjen, domethënë 1 atom squfuri për 2 atome hidrogjeni, formula më e thjeshtë e substancës H2 S është sulfuri i hidrogjenit.
Përgjigje: sulfuri i hidrogjenit H2S.
3 detyra numër 2
20 g sulfur hidrogjeni kaluan përmes një tretësire që përmban 10 g hidroksid natriumi. Çfarë kripe u formua në këtë rast? Përcaktoni masën dhe sasinë e tij.
Formimi i dy kripërave është i mundur - sulfuri i natriumit sipas ekuacionit (1) dhe hidrosulfidi i natriumit sipas ekuacionit (2).
2NaOH + H2S = Na2S + 2H2O | |
NaOH + H3 8 \u003d NaHS + H2 O |
Llogaritni masat molare të hidroksidit të natriumit dhe sulfurit të hidrogjenit:
M(NaOH) = 23 + 16 + 1 = 40 g/mol
M(H2 S) = 1 2 + 32 = 34 g/mol
Llogaritni sasinë e substancës së hidroksidit të natriumit dhe sulfurit të hidrogjenit:
Sipas ekuacionit (2), 1 mol hidroksid natriumi reagon me 1 mol sulfur hidrogjeni, që do të thotë se për të reaguar me 0,59 mol sulfur hidrogjeni nevojiten 0,59 mol hidroksid natriumi dhe sipas kushtit është marrë vetëm 0,25 mol. . Rrjedhimisht, sulfuri i hidrogjenit merret në tepricë, dhe formohet hidrosulfidi i natriumit, llogaritja kryhet duke përdorur hidroksid natriumi. Nga 1 mol hidroksid natriumi, sipas ekuacionit, formohet 1 mol hidrosulfid natriumi, prandaj nga 0,25 mol hidroksid natriumi, fitohet 0,25 mol hidrosulfid natriumi.
Llogaritni masë molare hidrosulfidi i natriumit:
M(NaHS) = 23 + 1 + 32 = 56 g/mol
Llogaritni masën e hidrosulfidit të natriumit:
m(NaHS) = ν (NaHS) M(NaHS) = 0,25 mol 56 g/mol = 14 g.
Përgjigje: Do të fitohet 0,25 mol (14 g) hidrosulfid natriumi.
3 detyra numër 3
Sa oksid alumini në gram mund të merret nga 100 g klorur alumini të hidratuar AlCl3 6H2 O?






