Care este căldura de fuziune. Marea enciclopedie a petrolului și gazelor
Este un fapt binecunoscut că o substanță poate fi într-una dintre stările - gazos, lichid, solid. Și se poate muta de la unul la altul. Cel mai simplu exemplu - o bucată de gheață se topește, se transformă într-un lichid și apoi în abur. In tot acest proces de transformare in abur, etapa de topire este foarte interesanta si unul dintre parametrii sai este caldura specifica de topire.
Dacă vă amintiți cum are loc topirea, atunci pot fi distinse mai multe etape. Să luăm ca exemplu conducerea. În prima etapă, plumbul este încălzit, temperatura crește la 327 (punctul de topire). După ce a început topirea, nu se întâmplă nimic mult timp.
Temperatura plumbului, în ciuda căldurii furnizate acestuia, rămâne constantă și rămâne astfel până la finalizarea întregului proces. Și numai după aceea, cu încălzirea continuă, temperatura începe să crească din nou. Din imaginea observată rezultă câteva concluzii. Într-un corp solid, toate moleculele sunt într-o anumită ordine și sunt conectate rigid cu moleculele învecinate.
Pentru ca acestea să se deplaseze liber în alt loc, legăturile cu moleculele vecine trebuie rupte, ceea ce se întâmplă în timpul procesului de topire. Pentru a face acest lucru, organismul trebuie să transfere o anumită rată de căldură, numită căldură de fuziune. Fiecare substanță va necesita o cantitate diferită de căldură. Motivul se datorează unei astfel de proprietăți a unei substanțe precum căldura specifică de fuziune, care este definită ca cantitatea de căldură consumată pentru a topi un kilogram de substanță. Unitatea de măsură este Joule/kilogram.
După cum sa menționat deja, pentru fiecare material această valoare este diferită. plumbul de topire este diferit de aceeași valoare pentru gheață. Și aici apare un moment foarte curios. Căldura specifică de topire a oțelului este în medie de 85 kJ/kg, iar pentru apă (gheață) același parametru este în medie de 335 kJ/kg. Pentru gheață, o valoare mare a acestui parametru poate fi considerată un mare cadou de la natură.
Într-adevăr, datorită acestui lucru, toată zăpada, gheața nu se topește instantaneu, dar totul se întâmplă pentru o lungă perioadă de timp. Altfel, zăpada s-ar topi foarte repede, iar inundațiile ar fi mai abundente și mai distructive. În plus, astfel de proprietăți unice ale apei contribuie la stabilizarea climei de pe planetă.
Există tabele cu date despre căldura specifică de topire a materialelor individuale. Cunoscând această valoare, se calculează câtă căldură este necesară pentru a topi materialul și se determină cât de mult combustibil este necesar pentru a efectua topirea. Dacă corpul este încălzit până la punctul de topire, atunci căldura este necesară numai pentru topire, iar dacă temperatura sa este sub punctul de topire, atunci este necesară căldură pentru a încălzi substanța la
Astfel de calcule sunt extrem de utile în industrie pentru calcularea costurilor de producție.
Apropo, atunci când substanța topită se răcește, are loc procesul invers de topire - cristalizare. În acest caz, atunci când substanța se răcește, legăturile rupte dintre molecule sunt restaurate și se eliberează căldură.
Având în vedere procesul de topire a unei substanțe și fenomenele care au loc în acest proces, a fost definit un concept precum căldura specifică de fuziune. Acest indicator a fost comparat pentru diferite substanțe și s-a determinat modul în care valoarea mare a acestui parametru în gheață are un efect benefic asupra climei planetei.
Pagina 3
Căldura specifică de topire a gheții și evaporare a apei la 273 K sunt de 0,33 și, respectiv, de 2,5 MJ/kg.
Aerul este pompat rapid dintr-un vas termoizolat care conține apă la 0 C, 117% din apă s-a evaporat într-o imprimare și, din cauza evaporării intense, toată apa neevaporată a fost înghețată. Căldura specifică de topire a gheții este de 0 33 MJ/kg.
Care este lucrul maxim Lmax care poate fi obținut de la o mașină care funcționează ciclic, al cărei încălzitor este masa mi a 1 kg de apă la temperatura initiala T 373 K, iar frigiderul - m2 - 1 kg de gheață la o temperatură T2 273 K, până la momentul în care toată gheața s-a topit. Care va fi temperatura apei T în acest moment. Căldura specifică de topire a gheții este q 335 kJ/kg, dependența căldurii specifice a apei de temperatură este neglijată.
Multe calcule ale proceselor de transfer de căldură în care au loc topirea și solidificarea sunt efectuate folosind ecuația echilibru termic. Ca exemplu, luați în considerare modul în care este compilată o astfel de ecuație atunci când se determină căldura specifică de topire a gheții folosind un calorimetru.
Dintr-un vas în care există 100 g de apă la 0 C, aerul este pompat rapid afară; totodată, datorită evaporării intense, apa neevaporată este înghețată. Câtă apă poate fi transformată în gheață în acest fel. Căldura specifică de vaporizare la 0 C / - 597 cal / g; caldura specifica a ghetii de topire A este de 80 cal/g. Considerati vasul a fi izolat termic.
Dintr-un vas în care există o masă de t100 g de apă la o temperatură de 0 C, aerul este pompat rapid; in acelasi timp, datorita evaporarii intensive, apa neevaporata este inghetata. Ce masă de apă poate fi transformată în gheață în acest fel. Căldura specifică de vaporizare la 0 C / - 2 49 MJ / kg; căldura specifică de topire a gheții Х 0 336 MJ/kg Vasul este considerat izolat termic.
Căldura specifică de vaporizare a apei la 0 C este de 2,54 - 10e J/kg, căldura specifică de topire a gheții este de 3 35 105 J/kg.
Gheața rezultată este diferită proprietăți fizice din gheață obișnuită, care are o temperatură de 0 C. Căldura specifică apa în intervalul de temperatură de la - 10 C până la OS este egală cu cl 4 17 103 JDkg K); capacitatea termică specifică a gheții în acest interval de temperatură este c2 2 17 103 JDkg K); căldura specifică a gheţii care se topeşte la 0 C este de 3 32 105 J/kg.
V 2 l de azot lichid se depozitează într-un vas Dewar la o temperatură de tt - 195 C. Determinați căldura specifică de vaporizare a azotului ha, dacă se știe că la o temperatură de t ° C, 40 g de gheață se vor topi în același vas în 22 5 h. Densitatea azotului lichid p 8 - 102 kg/m3; căldura specifică de topire a gheţii X l 3 3 105 J / kg. Să presupunem că rata de alimentare cu căldură în interiorul vasului este proporțională cu diferența de temperatură în exterior și în interiorul vasului.
Determinați masa m de apă care poate fi transformată în gheață la 0 C prin evaporarea eterului, a cărui masă este M 0,1 kg, iar temperatura t este de 20 C. Schimbul de căldură are loc numai între eter și apă. Căldura specifică de evaporare a eterului g 3 8 105 J / kg, căldura specifică de fuziune a gheții A 3, 3 - 105 J / kg, căldura specifică a apei sv 4200 J / kg K, eter se 2100 J / kg K.
O bucată de gheață cu greutatea de 6 kg la o temperatură de - 20 C a fost coborâtă în apă având temperatura de 60 C; masa apei este de 10 kg. Capacitatea termică specifică a gheții este de 2 1 kJ / (kg - K); căldura specifică de topire a gheții - 0 33 MJ/kg.
Determinarea căldurii specifice de topire a corpurilor refractare (corpi cu temperatura ridicata topirea) este o sarcină dificilă. Căldura specifică de fuziune a unui astfel de cristal cu topire scăzută precum gheața poate fi determinată folosind un calorimetru. Folosind - legea conservării energiei, vom compune ecuația bilanţului termic (§ 209), care ne permite să determinăm căldura specifică de topire a gheţii.
Apa, cu anumite precauții, poate fi suprarăcită la o temperatură de 4 - 10 C. Această stare a apei este instabilă și, cu orice perturbare, apa se transformă în gheață cu o temperatură de t ° C. Să presupunem că căldura specifică a apa nu depinde de temperatură și este egală cu 4 2 kJ / (kg - C), iar căldura specifică de topire a gheții g 0 / 34 MJ / kg.
O bucată de gheață luată la o temperatură de - 8 C este coborâtă într-un calorimetru de alamă cu masa de 300 g care conține 1 kg apă la 18 C. Capacitatea termică specifică a apei este de 4 19 kJ / (kg - K), gheață - 2 1 kJ / (kg - K ), alamă - 0 38 kJ / (kg - K); căldura specifică de topire a gheții este de 0 33 MJ/kg.
V2 l de azot lichid se depozitează într-un vas Dewar la o temperatură tl - - 195 C. Densitatea azo p8 lichidă este de 102 kg/m3; căldura specifică de topire a gheții Yal 3 3 - 105 J/kg. Să presupunem că rata de alimentare de ms în interiorul vasului este proporțională cu diferența de temperatură în exterior și în interiorul vasului.
Pe măsură ce temperatura crește solide iar lichidele cresc energie kinetică particulele lor: încep să oscileze într-un ritm mai rapid. La o anumită temperatură, care este destul de definită pentru o anumită substanță, forțele de atracție dintre particule nu mai sunt capabile să le țină la nodurile rețelei cristaline (ordinea cu rază lungă se transformă într-una cu rază scurtă), iar cristalul începe să se topească, adică. materia începe să se lichefieze.
Topire - procesul de schimbare a unei substanțe din stare solidă în stare lichidă.
intarire - procesul de schimbare a unei substanțe din stare lichidă în stare solidă.
În timpul procesului de topire, temperatura cristalului rămâne constantă. Această temperatură se numește punct de topire. Fiecare substanță are propriul punct de topire.
O experienta: De pe stradă (sau de la congelator) aduc puțină zăpadă și observă schimbarea temperaturii acesteia cu un termometru. Ei văd că la început temperatura zăpezii crește, iar apoi, în procesul de topire, rămâne constantă (indicațiile termometrului nu se schimbă). Și numai după ce toată zăpada s-a topit, temperatura apei formate începe să crească din nou.
Constanța temperaturii în timpul topirii este de mare importanță practică, deoarece permite calibrarea termometrelor, realizarea de siguranțe și indicatoare care se topesc la o temperatură strict specificată. Cunoscând punctul de topire diverse substante important din punct de vedere pur casnic: altfel, cine va garanta că această oală sau tigaie nu se va topi pe focul unui arzător cu gaz?
Punctul de topire și temperatura de solidificare egală cu acesta sunt o trăsătură caracteristică a unei substanțe. Mercurul se topește și se solidifică la o temperatură de -39 o C, prin urmare termometrele cu mercur nu sunt folosite în nordul îndepărtat. În locul termometrelor cu mercur la aceste latitudini, se folosesc termometre cu alcool (-114 o C). Cel mai refractar metal este wolfram (3420 o C).
Cantitatea de căldură necesară pentru a topi o substanță este determinată de formula:
, unde m este masa substanței, este căldura specifică de fuziune.
j/kg
Căldura specifică de fuziune - cantitatea de căldură necesară pentru a topi 1 kg dintr-o substanță la punctul său de topire. Fiecare substanță are a ei. Se găsește în tabel.
Punctul de topire al unei substanțe depinde de presiune. Pentru substanțele al căror volum crește la topire, o creștere a presiunii crește punctul de topire și invers. La apă, volumul scade în timpul topirii, iar când presiunea crește, gheața se topește la o temperatură mai scăzută.
În timpul solidificării, atomii se aliniază din nou într-o anumită ordine și se eliberează căldura de solidificare. De îndată ce corpul se solidifică complet, temperatura începe să scadă.
Biletul numărul 5.
Informații conexe:
- A. temperatura, ylgaldylyk, aua kozgalysynyn zhyldamdygy, infrakyzyl saulelen.
- Duritate - capacitatea materialelor de a rezista la rupere fragilă la temperaturi scăzute.
- Diagrama de stare este construită în coordonate temperatură-concentrație.
- Izotermele Van der Waals și compararea lor cu izotermele reale. temperatura critica. Energia internă a gazului van der Waals.
- Evaporare și condensare. Umiditatea relativă și măsurarea acesteia. Fierbere. Temperatura de fierbere. Căldura specifică de vaporizare.
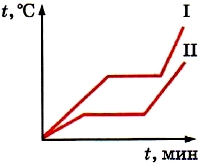
În paragraful anterior, am luat în considerare graficul de topire și solidificare a gheții. Graficul arată că, în timp ce gheața se topește, temperatura acesteia nu se modifică (vezi Fig. 18). Și numai după ce toată gheața s-a topit, temperatura lichidului rezultat începe să crească. Dar la urma urmei, chiar și în timpul procesului de topire, gheața primește energie din combustibilul care arde în încălzitor. Și din legea conservării energiei rezultă că aceasta nu poate dispărea. Care este consumul de energie al combustibilului în timpul topirii?
Știm că în cristale moleculele (sau atomii) sunt aranjați într-o ordine strictă. Cu toate acestea, chiar și în cristale sunt în mișcare termică (oscilează). Când corpul este încălzit viteza medie mișcarea moleculară crește. În consecință, crește și energia lor cinetică medie și temperatura. Pe grafic, aceasta este secțiunea AB (vezi Fig. 18). Ca urmare, gama de vibrații ale moleculelor (sau atomilor) crește. Când corpul este încălzit la temperatura de topire, ordinea în aranjarea particulelor în cristale va fi încălcată. Cristalele își pierd forma. Substanța se topește din stare solidăîn lichid.
În consecință, toată energia pe care o primește un corp cristalin după ce a fost deja încălzit până la punctul de topire este cheltuită pentru distrugerea cristalului. În acest sens, temperatura corpului încetează să crească. Pe grafic (vezi Fig. 18) aceasta este secțiunea BC.
Experimentele arată că pentru transformarea diferitelor substanțe cristaline de aceeași masă într-un lichid la un punct de topire, este necesară o cantitate diferită de căldură.
O mărime fizică care arată cât de multă căldură trebuie transmisă unui corp cristalin cu o masă de 1 kg pentru a-l transfera complet în stare lichidă la punctul de topire se numește căldura specifică topire.
Căldura specifică de fuziune este notată cu λ (litera greacă „lambda”). Unitatea sa este de 1 J/kg.
Determinați căldura specifică de fuziune în experiment. Astfel, s-a constatat că căldura specifică de topire a gheții este de 3,4 10 5 - . Aceasta înseamnă că pentru transformarea unei bucăți de gheață cu o greutate de 1 kg, luată la 0 ° C, în apă de aceeași temperatură, este nevoie de 3,4 10 5 J de energie. Iar pentru a topi o bară de plumb de 1 kg, luată la punctul său de topire, va fi nevoie de 2,5 10 4 J de energie.
Prin urmare, la punctul de topire, energia internă a unei substanțe în stare lichida Mai mult energie interna aceeași masă de materie în stare solidă.
Pentru a calcula cantitatea de căldură Q necesară pentru topire corp cristalin masa m, luată la punctul său de topire și normală presiune atmosferică, trebuie să înmulțiți căldura specifică de fuziune λ cu masa corporală m:
Din această formulă se poate determina că
λ = Q / m, m = Q / λ
Experimentele arată că atunci când se vindecă substanță cristalină se eliberează exact aceeași cantitate de căldură care este absorbită atunci când se topește. Deci, în timpul solidificării apei care cântărește 1 kg la o temperatură de 0 ° C, se eliberează o cantitate de căldură egală cu 3,4 10 5 J. Este necesară exact aceeași cantitate de căldură pentru topirea gheții care cântărește 1 kg la o temperatură. de 0°C.

Când o substanță se solidifică, totul se întâmplă în ordine inversă. Viteza și, prin urmare, energia cinetică medie a moleculelor dintr-o substanță topită răcită, scade. Forțele atractive pot menține acum în mișcare încet moleculele aproape una de alta. Ca rezultat, aranjamentul particulelor devine ordonat - se formează un cristal. Energia eliberată în timpul cristalizării este cheltuită pentru menținere temperatura constanta. Pe grafic, aceasta este secțiunea EF (vezi Fig. 18).
Cristalizarea este facilitată dacă orice particule străine, cum ar fi particulele de praf, sunt prezente în lichid de la bun început. Ele devin centre de cristalizare. În condiții normale, într-un lichid există multe centre de cristalizare, în apropierea cărora are loc formarea de cristale.
Tabelul 4
Căldura specifică de fuziune a anumitor substanțe (la presiunea atmosferică normală)

În timpul cristalizării, energia este eliberată și transferată către corpurile înconjurătoare.
Cantitatea de căldură eliberată în timpul cristalizării unui corp de masă m este, de asemenea, determinată de formulă
În acest caz, energia internă a corpului scade.
Exemplu. Pentru a pregăti ceaiul, turistul a pus în oală gheață cu o greutate de 2 kg și cu o temperatură de 0°C. Câtă căldură este necesară pentru a transforma această gheață în apă clocotită la 100°C? Energia cheltuită pentru încălzirea ceainicului nu este luată în considerare.

Ce cantitate de căldură ar fi nevoie dacă, în loc de gheață, un turist ar lua apă de aceeași masă la aceeași temperatură din groapă?
Să notăm starea problemei și să o rezolvăm.

Întrebări
- Cum se explică procesul de topire a corpului pe baza doctrinei structurii materiei?
- Care este energia combustibilului cheltuită în timpul topirii unui corp cristalin încălzit până la punctul de topire?
- Care este căldura specifică de fuziune?
- Cum se explică procesul de întărire pe baza doctrinei structurii materiei?
- Cum se calculează cantitatea de căldură necesară pentru a topi un corp cristalin luată la punctul de topire?
- Cum se calculează cantitatea de căldură eliberată în timpul cristalizării unui corp care are un punct de topire?
Exercițiul 12
Exercițiu
- Pune două cutii identice pe aragaz. Turnați apă cu o greutate de 0,5 kg într-unul, puneți mai multe cuburi de gheață de aceeași masă în celălalt. Observați cât durează apa din ambele borcane să fiarbă. Scrieți o scurtă descriere a experienței dvs. și explicați rezultatele.
- Citiți paragraful „Corpi amorfe. Topire corpuri amorfe". Pregătește un raport despre el.






