Radijus u hemiji. Bilješke sa predavanja iz opšte hemije
Određivanje atomskih radijusa također uključuje neke probleme. Prvo, atom nije sfera sa strogo definiranom površinom i polumjerom. Podsjetimo da je atom jezgro okruženo oblakom elektrona. Vjerojatnost detekcije elektrona na udaljenosti od jezgre postepeno se povećava do određenog maksimuma, a zatim se postepeno smanjuje, ali postaje jednaka nuli samo beskonačno. velika udaljenost. Drugo, ako ipak izaberemo neki uvjet za određivanje polumjera, takav radijus se još uvijek ne može eksperimentalno izmjeriti.
Eksperiment omogućava određivanje samo međunuklearnih udaljenosti, drugim riječima, dužina veza (pa čak i tada sa određenim rezervama datim u naslovu na slici 2.21). Za njihovo određivanje koristi se analiza difrakcije rendgenskih zraka ili metoda difrakcije elektrona (bazirana na difrakciji elektrona). Pretpostavlja se da je radijus atoma jednak polovini najmanje međunuklearne udaljenosti između identičnih atoma.
Van der Waalsov radijus. Za nevezane atome, polovina najmanje međunuklearne udaljenosti naziva se van der Waalsov radijus. Ova definicija je ilustrovana na Sl. 2.22.
Rice. 2.21. Dužina veze. Zbog činjenice da molekuli stalno vibriraju, međunuklearna udaljenost, odnosno dužina veze, nema fiksnu vrijednost. Ova slika shematski prikazuje linearnu vibraciju jednostavne dvoatomske molekule. Vibracije onemogućavaju definiranje dužine veze jednostavno kao udaljenost između centara dva povezana atoma. Preciznija definicija izgleda ovako: dužina veze je udaljenost između povezanih atoma, mjerena između centara mase dva atoma i koja odgovara minimalnoj energiji veze. Minimalna energija je prikazana na Morseovoj krivulji (vidi sliku 2.1).
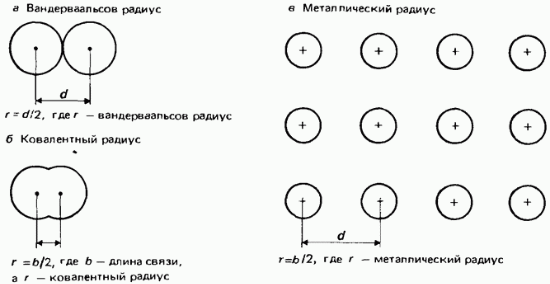
Rice. 2.22. Atomski radijusi, a - van der Waalsov radijus; b - kovalentni radijus; c - metalni radijus.
kovalentni radijusi. Kovalentni radijus je definisan kao polovina međunuklearne udaljenosti (dužine veze) između dva identična atoma, vezani prijatelj sa drugom kovalentnom vezom (slika 2.22, b). Kao primjer, uzmimo molekul hlora s dužinom veze od 0,1988 nm. Pretpostavlja se da je kovalentni radijus hlora 0,0944 nm.
Poznavajući kovalentni radijus atoma jednog elementa, može se izračunati kovalentni polumjer atoma drugog elementa. Na primjer, eksperimentalno utvrđena vrijednost dužine veze je 0,1767 nm. Oduzimajući od ove vrijednosti kovalentni radijus hlora (0,0994 nm), nalazimo da je kovalentni radijus ugljenika 0,0773 nm. Ova metoda proračuna temelji se na principu aditivnosti, prema kojem se atomski radijusi povinuju jednostavnom zakonu sabiranja. Dakle, dužina veze je zbir kovalentnih radijusa ugljika i hlora. Princip aditivnosti primjenjuje se samo na jednostavne kovalentne veze. Dvostruke i trostruke kovalentne veze su kraće (tabela 2.7).
Dužina proste kovalentne veze takođe zavisi od njenog okruženja u molekulu. Na primjer, dužina veze varira od 0,1070 nm kod trosupstituiranog atoma ugljika do 0,115 nm u spoju
metalni radijusi. Pretpostavlja se da je polumjer metala jednak polovini međunuklearne udaljenosti između susjednih jona u metalnoj kristalnoj rešetki (slika 2.22, c). Termin atomski radijus općenito se odnosi na kovalentni polumjer atoma nemetalnih elemenata, dok se termin metalni radijus odnosi na atome metalnih elemenata.
Jonski radijusi. Jonski radijus je jedan od dva dijela međunuklearne udaljenosti između susjednih monoatomskih (jednostavnih) jona u kristalnom jonskom spoju (soli). Određivanje ionskog radijusa također je povezano sa značajnim problemima, budući da se eksperimentalno mjere interionske udaljenosti, a ne sami ionski radijusi. Međuionske udaljenosti zavise od pakovanja jona u kristalnoj rešetki. Na sl. 2.23 prikazuje tri moguća načina pakovanja jona u kristalnu rešetku. Nažalost, eksperimentalno izmjerene međuionske udaljenosti
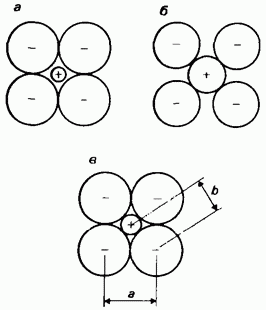
Rice. 2.23. Jonski radijusi, a - anjoni su u kontaktu jedan s drugim, ali kationi nisu u kontaktu sa anionima; b - katjoni su u kontaktu sa anjonima, ali anjoni nisu u kontaktu jedan sa drugim; c - uslovno prihvaćen raspored jona, u kojem su kationi u kontaktu sa anjonima, a anioni su u kontaktu jedan sa drugim. Udaljenost a je određena eksperimentalno. Uzima se kao dvostruki polumjer anjona. Ovo omogućava izračunavanje međujonske udaljenosti b, koja je zbir radijusa anjona i katjona. Znajući međujonsku udaljenost b, može se izračunati radijus kationa.
ne dopuštaju nam da prosuđujemo koji se od ova tri načina pakovanja zapravo provodi u svakom pojedinom slučaju. Problem je pronaći proporciju u kojoj bi međujonsko rastojanje trebalo podijeliti na dva dijela koja odgovaraju radijusima dva jona, drugim riječima, da bi se odlučilo gdje jedan ion zapravo završava, a gdje počinje drugi. Kao što je prikazano, na primjer, na sl. 2.12, karte elektronske gustine soli ne dozvoljavaju ni ovo pitanje. Da bi se prevazišla ova poteškoća, obično se pretpostavlja da je: 1) međujonska udaljenost zbir dva jonska poluprečnika, 2) da su joni sferni i 3) da su susjedne sfere u kontaktu jedna s drugom. Poslednja pretpostavka odgovara metodi pakovanja jona prikazanoj na Sl. 2.23, c. Ako je poznat jedan ionski radijus, drugi ionski radijusi se mogu izračunati na osnovu principa aditivnosti.
Poređenje različitih vrsta radijusa. U tabeli. 2.8 prikazuje vrijednosti radijusa različitih tipova za tri elementa 3. perioda. Lako je vidjeti da najveće vrijednosti pripadaju anionskim i van der Waalsovim radijusima. Na sl. 11.9 upoređuje veličine jona i atoma za sve elemente 3. perioda, sa izuzetkom argona. Veličine atoma određene su njihovim kovalentnim radijusima. Treba napomenuti da su kationi manji od atoma, a anjoni jesu velike veličine nego atomi istih elemenata. Za svaki element svih vrsta radijusa, najmanja vrijednost uvijek pripada kationskom radijusu.
Tabela 2.8. Poređenje atomskih radijusa raznih tipova
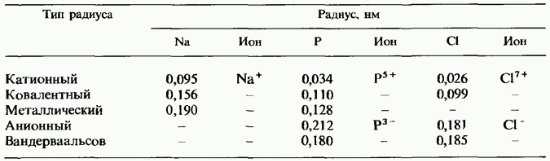
Određivanje radijusa atoma i jona. Primjena rendgenskih zraka u proučavanju kristala omogućava ne samo utvrđivanje unutrašnja struktura potonje, ali i za određivanje veličine čestica,formiranje kristala - atoma ili jona.
Slika 46. Kontaktne čestice u kristalu
Da biste razumjeli kako se izrađuju takvi proračuni, zamislite da su čestice koje čine kristal sferične i u kontaktu jedna s drugom. U ovom slučaju možemo pretpostaviti da je udaljenost između centara dvije susjedne čestice jednaka zbiru njihovih polumjera (slika 46). Ako su čestice jednostavni atomi i izmjeri se udaljenost između njih, tada se također određuje polumjer atoma, očito jednak polovini pronađene udaljenosti. Na primjer, znajući da je za kristale metalnog natrijuma konstanta rešetke d jednak 3,84 angstroma, nalazimo da je radijus r atom natrijuma je jednak.
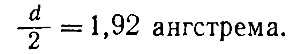
Nešto je teže odrediti radijuse različitih jona. Ovdje više nije moguće jednostavno podijeliti udaljenost između jona na pola, jer veličine iona nisu iste. Ali ako je radijus jednog od jona r 1 je poznat, poluprečnik drugog r 2 se lako nalazi jednostavnim oduzimanjem:
r2 = d - r1
Otuda slijedi da je za izračunavanje polumjera različitih jona iz konstanti kristalnih rešetki potrebno znati polumjer barem jednog jona. Tada pronalaženje radijusa svih ostalih jona više neće predstavljati poteškoće.
Uz pomoć optičkih metoda bilo je moguće prilično precizno odrediti radijuse fluorovih jona F - (1,33 A) i kiseonik O - (1,32 A); ovi radijusi služe kao početne vrijednosti pri izračunavanju radijusa drugih jona. Tako je, na primjer, određivanje konstante rešetke magnezijum oksida MgO pokazalo da je jednaka 2,1 angstroma. Oduzimajući od ovoga poluprečnik jona kiseonika, nalazimo poluprečnik jona magnezijuma:
2,1 - 1,32 = 0,78 Å
Konstanta rešetke natrijum fluorida je 2,31 Å; budući da je radijus jona fluora 1,33 angstroma, radijus jona natrijuma bi trebao biti:
2,31 -1,33 = 0,98 Å
Poznavajući radijus natrijum jona i konstantu rešetke natrijum hlorida, lako je izračunati poluprečnik jona hlora, itd.
Na ovaj način se određuju polumjeri gotovo svih atoma i iona.
Opću ideju o veličini ovih veličina daju podaci dati u tabeli. 7.
Table 7
Radijusi atoma i jona nekih elemenata
| Element | Radijus atoma | Jonski radijus | Simbol jona |
| 1,92 | 0,98 | Na+ | |
| 2,38 | 1,33 | K+ | |
| 2,51 | 1,49 | Rb+ | |
| 2,70 | 1,65 | Cs+ | |
| 1,60 | 0,78 | Mg++ | |
| 1,97 | 1,06 | Ca++ | |
| 2,24 | 1,43 | Ba++ | |
| 0,67 | 1,33 | F- | |
| 1,07 | 1,81 | Cl- | |
| 1,19 | 1,96 | Br- | |
| 1,36 | 2,20 | J- | |
| 1,04 | 1,74 | S— |
Kao što ovi podaci pokazuju, u metalima su radijusi atoma veći od radijusa jona, u metaloidima, naprotiv, radijusi jona su veći od radijusa atoma.
Relativne veličine jona koji formiraju kristal imaju ogroman uticaj na strukturu prostorne rešetke. Tako, na primjer, dva vrlo slična po svojoj kemijskoj prirodi - CsCl i NaCl ipak tvore rešetke različitih tipova, a u prvom slučaju svaki pozitivni ion je okružen sa osam negativnih jona, au drugom - samo sa šest. Ova razlika se objašnjava činjenicom da su veličine jona cezija
i natrijum nisu isti. Brojna razmatranja prisiljavaju nas da prihvatimo da ioni treba da budu locirani u kristalu tako da svaki manji ion, ako je moguće, u potpunosti ispuni prostor između velikih jona koji ga okružuju, i obrnuto; drugim riječima, negativni joni, koji su gotovo uvijek veći od pozitivnih jona, moraju okruživati pozitivne jone što je bliže moguće, inače će sistem biti nestabilan. Budući da je radijus Cs + jona 1,65 Å, a Na + jona samo 0,98 Å, očigledno je da se oko prvog može smjestiti više Cl - jona nego oko drugog.
Broj negativnih jona koji okružuju svaki pozitivni ion u kristalu naziva se koordinacijskim brojem date rešetke. Studija strukture različitih kristala pokazuje da su sljedeći koordinacijski brojevi najčešći: 2, 3, 4, 6, 8 i 12.
Koordinacijski broj ovisi o omjeru radijusa pozitivni jon radijusu negativnog jona: što je ovaj omjer bliži jedinici, veći je koordinacijski broj. Uzimajući u obzir ione kao kuglice koje se nalaze u kristalu prema metodi najbližeg pakiranja, moguće je izračunati u kojem omjeru između radijusa pozitivnih i negativnih iona treba dobiti jedan ili drugi koordinacijski broj.
Ispod su izračunati teoretski najveći koordinacijski brojevi za dati omjer radijusa.
Lako je provjeriti da koordinacijski brojevi za NaCl i CsCl, koji se nalaze iz ove tabele, samo odgovaraju stvarnom rasporedu jona u kristalima ovih supstanci.
Na primjer, u slučaju NaCl, odnos radijusa jona natrijuma (0,98 Å) i radijusa jona hlora (1,81 Å) je 0,98:1,81 = 0,54. Ovaj omjer je u rasponu od 0,41-0,73; stoga, u NaCl rešetki, koordinacijski broj mora biti šest.
Čitate članak na temu Određivanje polumjera atoma i jona
ATOMSKI RADIJUS- karakteristika atoma, koja omogućava približno procjenu međuatomskih (međunuklearnih) udaljenosti u molekulima i kristalima. Pošto atomi nemaju jasne granice, prilikom uvođenja koncepta "A.R." impliciraju da 90-98% atom elektrona zatvoreno u sferu ovog poluprečnika. A. r. imaju reda 0,1 HM, međutim, čak i male razlike u njihovim vrijednostima mogu odrediti strukturu kristala izgrađenih od njih, utjecati na ravnotežnu geometriju molekula, itd. Za mnoge druge. Problemi, najkraće udaljenosti između atoma u molekulima i kondenziranim medijima mogu se smatrati zbirom njihovih A.R., međutim, takva aditivnost je vrlo približna i nije zadovoljena u svim slučajevima. U zavisnosti od toga koje sile deluju između atoma (vidi. međuatomska interakcija), razlikovati metalne, ionske, kovalentne i van der Waalsove A. p.
metalik radijusi se smatraju jednakim polovini najkraće udaljenosti između atoma u kristalu. strukture metalnog elementa, zavise od koordinata. brojevi To. Ako uzmete A. str. na K=12 po jedinici, zatim na K=8, 6 i 4 A. str. isti element odn. jednako 0,98; 0,96; 0,88. Blizina vrijednosti A. p. različiti metali - neophodan (mada ne i dovoljan) uslov za međusobnu topljivost metali vrsta zamjene. Dakle, tečni K i Li se obično ne miješaju i formiraju dva tečna sloja, a K sa Rb i Cs čine kontinuirani niz čvrstih otopina (A. R. Li, K, Pb i Cs su jednaki 0,155; 0,236; 0,248; 0,268 HM) . Aditivnost A. r. omogućava vam da približno predvidite parametre kristala. intermetalne rešetke. veze.
Jonski radijusi se koriste za približne procjene međunuklearnih udaljenosti u ionskim kristalima. Pretpostavlja se da je udaljenost između najbližeg kationa i anjona jednaka zbiru njihovih ionskih radijusa. Preciznost kojom je ispunjena naznačena aditivnost A. R. može se procijeniti na osnovu najkraćih međunuklearnih razmaka u kristalima halogenih alkalnih metala datih u nastavku:
Razlika A. r. joni, dobijeni poređenjem međunuklearnih udaljenosti u KF i NaF, iznosi 0,035 nm (pretpostavlja se da su A. R. joni u kristalima KF u NaF isti), a za jedinjenja KCl i NaCl je 0,033 HM, od jedinjenja KBr i NaBr - 0,031 HM i iz jedinjenja KI i NaI - 0,030 HM. T. o., tipična greška u određivanju međunuklearnih udaljenosti u ionskim kristalima pomoću A. R. ~ 0,001 nm.
Ima ih nekoliko sistema ionskog A. p., koji se razlikuju u vrijednostima A. p. pojedinačni ioni, ali dovode do približno istih međunuklearnih udaljenosti. Po prvi put, rad na određivanju jonskog A. p. urađeno 20-ih godina. 20ti vijek V. M. Goldschmidt (V. M. Goldschmidt), baziran, s jedne strane, na međunuklearnim udaljenostima u kristalima, mjerenim rendgenskim metodama strukturna analiza, a s druge strane, na vrijednostima A. p. i , određeno metodom refraktometrija(0,133 odnosno 0,132 HM). Većina drugih sistema se također oslanja na određene . metode međunuklearnih udaljenosti u kristalima i na određenoj "referentnoj" vrijednosti A. p. def. i ona. In naib. naširoko poznata Paulingovom sistemu, ova referentna vrijednost je A. p. (0.140HM). U sistemu Belov i Bokiya, koji se smatra jednim od najvećih. pouzdan, A. r. 0 2- uzima se jednakim 0,136 HM. Ispod su vrijednosti radijusa određenih jona:
|
u Goldschmidtovom sistemu |
u Paulingovom sistemu |
u Goldschmidtovom sistemu |
u Paulingovom sistemu |
||
Za ionske kristale koji imaju iste koordinate. brojevi, up. odstupanje sume A.R., izračunatog od gore datog A.R., od eksperimentalnih vrijednosti najkraćih međunuklearnih udaljenosti u ionskim kristalima je 0,001-0,002 NM.
U 70-80-im godinama. činjeni su pokušaji da se direktno utvrdi A. p. jona mjerenjem elektronske gustine metodama rendgenska strukturna analiza pod uslovom da se za granicu jona uzme minimum elektronske gustine na liniji koja spaja jezgra. Difrakcija mjerenja za kristale halogenida alkalnih metala omogućila su dobivanje A. r. kationi Li + , Na + , K + , Rb + i Cs + su jednaki. 0,094; 0,117; 0,149; 0,163; 0,186 nm, i A. r. anjoni F - , Cl - , Br - , I - - jednaki odn. 0,116; 0,164; 0,180; 0.205HM. T. o. difrakcija mjerenja dovode do precijenjenih (u poređenju sa tradicionalnim, gore navedenim) vrijednostima A. p. kationa i na podcijenjene vrijednosti I. anjoni. A. R. pronađeni mjerenjem raspodjele elektronske gustine u kristalu ne mogu se prenijeti s jednog spoja na drugo, a odstupanja od njihove aditivnosti su prevelika, pa je takav A. R. ne može se koristiti za predviđanje međunuklearnih udaljenosti.
Kovalentni radijus je definisan kao polovina dužine jedne hemikalije. veze X - X (gdje je X nemetalni element). Za halogene, kovalentni A. R. je polovina međunuklearne udaljenosti X - X u molekulu X 2, za S i Se - polovina udaljenosti X - X u X 8, za ugljenik - polovina najkraće udaljenosti C - C u kristalu dijamanta. Covalent A. r. F, Cl, Br, I, S, Se i C odn. jednako 0,064; 0,099; 0,114; 0,133; 0,104; 0,117 i 0,077 nm. Za H atom A. r. uzeto jednako 0,030 HM (iako je polovina dužine H - H veze u molekulu H 2 0,037 HM). Aditivnost kovalentne arr. omogućava predviđanje najkraćih međunuklearnih udaljenosti (dužina veza) u poliatomskim molekulima. Dakle, prema ovom pravilu, dužina C-Cl veze treba da bude jednaka 0,176 HM, a eksperimentalno dobijena vrednost za ovu vrednost u molekulu CCl 4 je 0,177 HM. Ispod su kovalentni A. r. za atome određenih elemenata, izračunato na osnovu dužina jednostrukih veza:

U molekulima sa dvostrukom ili trostrukom hemijom. veze, koriste smanjene vrijednosti kovalentnog A. p., jer su višestruke veze kraće od pojedinačnih. Ispod su kovalentni radijusi atoma u formiranju višestrukih veza:
Van der Waalsovi radijusi određuju eff. veličine atoma plemenitog gasa. Osim toga, van der Waals A. p. uzeti u obzir polovinu međunuklearne udaljenosti između najbližih atoma istog imena koji nisu međusobno kemijski povezani. veza i pripadnost različitim molekulima (npr. u molekularnim kristalima). Kada se atomi približavaju jedni drugima na udaljenosti manjoj od zbira njihovih van der Waalsovih radijusa, dolazi do snažnog međuatomskog odbijanja. Stoga, van der Waals A. p. karakteriziraju minimalne dopuštene kontakte atoma koji pripadaju različitim molekulima. Ispod su vrijednosti van der Waalsovih atomskih radijusa za neke atome:

Van der Waals A. r. U srijedu. 0,08 nm više kovalentni A. p. Ionic A. r. jer se negativno nabijeni ion (npr. Cl -) praktički poklapa sa van der Waalsovim radijusom atoma u neutralnom stanju.
Poznavanje van der Waalsa A. str. omogućava vam da odredite oblik molekula, konformacije molekula i njihovo pakiranje u molekularne kristale. Prema principu gustog pakovanja, molekuli, formirajući kristal, raspoređeni su tako da "izbočine" jednog molekula ulaze u "šupljine" drugog. Koristeći ovaj princip, moguće je interpretirati dostupne kristalografske podatke i, u nekim slučajevima, predvidjeti strukturu molekularnih kristala.
Lit.: Boky G. B., Hemija kristala, 3. izd., M., 1971; Pauling L., Opća hemija, trans. sa engleskog, M., 1974; Campbell J., Modern General Chemistry, trans. sa engleskog, tom 1, M., 1975; E. Cartmell, G. V. A. Fowles, Valencija i struktura molekula, trans. sa engleskog, M., 1979. V. G. Dashevsky.
Atomski radijus ovisi o broju najbližih susjednih atoma.
Atomski radijusi se dijele na polumjere atoma metala, kovalentne radijuse nemetalnih elemenata i polumjere atoma plemenitog plina.
Atomski radijus, koji je određen ukupnošću interakcija koje djeluju u kristalima, u određenoj mjeri ovisi ili o vrsti veze i cn.
Atomski radijusi / - prijelaznih metala ove grupe - samarija, tulijuma i plutonijuma - su mnogo veći, pa se kriva koja im odgovara nalazi lijevo od krivulja za d - prijelazne metale i pokazuje karakteristične lomove. Inertni plinovi, zbog vrlo slabih molekularnih sila koje vezuju svoje atome u čvrstom stanju, imaju vrlo velike atomske radijuse. Položaj odgovarajuće krive nije povezan sa krivuljama za d - i / - prelazne metale grupe VIII sa pretežno jakom metalnom vezom.
Atomski radijus raste sa povećanjem glavnog kvantnog broja n ovog najvećeg upotrijebljenog nivo energije. Međutim, prosječni radijus raspodjele elektrona za svaki energetski nivo u raznih atoma nije isto, jer zavisi od efektivnog naelektrisanja jezgra. Efektivni nuklearni naboj Z3d (j) je prividni naboj koji djeluje na razmatrani elektron. Vrijednost 2eff je manja od pravog naboja jezgra Z, jer je svaki vanjski elektron djelomično zaštićen od djelovanja jezgra unutrašnjim elektronima. Za najudaljenije elektrone, stepen zaštite pravog nuklearnog naboja drugim elektronima u istom atomu ili ionu može se okarakterizirati zaštitnom konstantom S, koja je definirana kao razlika između pravog i efektivnog nuklearnog naboja.
Atomski radijusi, kao i ionski, mijenjaju se za isti element, ovisno o veličini koordinacijskog broja. U tom smislu, kao što smo naveli, često se označava indeksom, na primjer, rv, kojem koordinacionom broju pripada data vrijednost radijusa.
Atomski radijus je 156 A, ionski radijus Ca2 je 103 A.
Atomski radijus je 2 65 A, ionski radijus Cs je 165 A. U vazduhu se trenutno oksidira paljenjem, formirajući peroksid i superperoksid.
Atomski radijus (metal) 0 280 nm, ionski radijus Fr 0 186 nm.
Atomski radijusi se smanjuju u nizu S C1 Ar, jer se pri prelasku od S do C1 i od C1 do Ar naboj jezgra povećava za jedan. U jednom periodu valentnih elektrona jače privlače jezgro sa povećanim pozitivan naboj, pa se atomski radijusi shodno tome smanjuju. Za izoelektronske (koje imaju isti broj elektrona) atomske i ionske čestice efektivni polumjeri se smanjuju kako raste naboj jezgra (redni broj elementa), jer i u ovom slučaju dolazi do postepenog povećanja privlačenja elektrona u jezgro.
Atomski radijusi se mijenjaju slično s povećanjem broja grupe od I do VI i dalje do grupe cinka. Sa smanjenjem dužine međuatomskih veza i atomskih prečnika, energija međuatomskih veza raste i samim tim se smanjuje koeficijent termičkog širenja a i kompresibilnost metala k.
Atomski radijusi i kompresibilnost elemenata podgrupa B značajno se povećavaju u pravcu IB - - VIIB, a atomski radijusi inertnih gasova su po veličini veoma blizu atomskim radijusima alkalnih metala u odgovarajućim periodima.
Atomski radijusi metala. Atomski radijusi se dijele na polumjere atoma metala, kovalentne radijuse nemetalnih elemenata i polumjere atoma plemenitog plina.
Atomski radijusi r d i Hz koji se zamjenjuju u jednadžbi obično se razlikuju od polumjera koje koristi Pauling; oni su dati u tabeli. 4.2 u zagradama. Međuatomske udaljenosti izračunate pomoću ovih polumjera date su u drugoj koloni tabele. 4.1 u zagradama. Često se nešto bolje slažu s eksperimentalnim vrijednostima od vrijednosti dobivenih iz Paulingovih radijusa, ali razlika je rijetko velika. Schoemaker i Stevensonova šema pati od nedostatka što se ne može proširiti na dvostruke i trostruke veze, te stoga nema dovoljno široku primjenu da bi bila korisna u sljedećoj raspravi.
Atomski radijusi se dijele na polumjere atoma metala, kovalentne radijuse nemetalnih elemenata i polumjere atoma plemenitog plina.
Atomski radijusi imaju periodičnu ovisnost o atomskom broju ili nuklearnom naboju. Općenito, ako je periodični sistem elemenata predstavljen u najpoznatijem - tabelarnom obliku, tada se atomski radijusi, sa istim brojem kvantnih slojeva, smanjuju s lijeva na desno, elektronska školjka kao da se smanjuje. Od vrha do dna, naprotiv, s povećanjem broja kvantnih slojeva, atomski radijusi se povećavaju.
Atomski radijusi se dijele na polumjere atoma metala, kovalentne radijuse i intermolekularne (van der Waalsove) radijuse, koji uključuju radijuse atoma plemenitog plina.
Obično se atomski radijusi u grupama povećavaju od vrha do dna.
Atomski poluprečnik volframa je 1 37 A, molibdena 1 36 A, vanadijuma - 1 32 A i hroma-1 25 A. Iskustvo pokazuje da je taloženje konjugata to izraženije što je atomski radijus elementa bliži atomskom poluprečniku od volframa.
Atomski radijusi halogena rastu u seriji F c C1 Br I. U istom nizu se povećavaju tačke ključanja i topljenja, a boja halogena se produbljuje.
Shema kristala - Ponavljanje ove operacije nekoliko puta oud. Atomski radijus silicijuma (sa koordinacionim brojem 4 i kovalentnom vezom) je 1175 A. Zbog relativno velikog radijusa atoma silicijuma, silicijum ima veću metaličnost od ugljenika. U jedinjenjima, silicijum je pretežno četvorovalentan.
Atomski radijus bora je 0,97, a radijus jona B3 je procijenjen na 0,20 A.
Atomski radijus bora je 0,97, a radijus jona B3 je procijenjen na 0,20 A.
Dijagram stanja željeza.| Promjena toplotnog kapaciteta gvožđa sa temperaturom [kcalKz - atom deg. Atomski poluprečnik Fe je 1 26 A, a radni rad elektrona iz metala je 4 7 ey. Kao što je prikazano na sl. XIV-15, gvožđe ima četiri alotropna oblika pri normalnom pritisku. Koeficijent toplinskog širenja željeza raste do 500 C, nakon čega se smanjuje na 769 C, a zatim ponovo raste na 911 C. Formiran na običnoj temperaturi pod pritiskom od oko 133 hiljade atm, e-oblik gvožđa karakteriše heksagonalna zbijena struktura sa rf (FeFe) 2 40 A, visoke gustine (9 1 g/cm3) i povećane (približno 25 puta) električni otpor.
Standardni atomski radijusi Co i Ni su 125 i 124 A, a radna funkcija elektrona karakteristična za metale je 42 i 50 eV, respektivno. Alotropija ovih elemenata je mnogo manje proučavana od željeza. Za kobalt, kada se zagreje (oko 450 C), heksagonalno zatvoreno pakovanje se menja u kocku sa centriranim površinama, dok je za nikl (oko 358 C) obrnuto. Šta je uzrokovalo tako suprotno ponašanje oba metala nije jasno.
Atomski radijus Fe je 1 26 A, a radna funkcija elektrona iz metala je 4 7 eV. Kao što je prikazano na sl. X1V - 15, pri normalnom pritisku gvožđe ima četiri alotropna oblika. Od toga a, (5 i b) kristaliziraju kao centrirana kocka, dok y kristalizira kao kocka sa centriranim plohama.Koeficijent toplinske ekspanzije željeza raste na 500 C, nakon čega se smanjuje na 769 C, a zatim ponovo raste na 911 C.
Standardni atomski radijusi Co i Ni su 125 i 124 A, a radna funkcija elektrona karakteristična za metale je 42 odnosno 50 ea. Alotropija ovih elemenata je mnogo manje proučavana od željeza. Za kobalt, kada se zagreje (oko 450 C), heksagonalno zatvoreno pakovanje se menja u kocku sa centriranim površinama, dok je za nikl (oko 358 C) obrnuto. Šta je uzrokovalo tako suprotno ponašanje oba metala nije jasno. Za kobalt je registrovana još jedna polimorfna transformacija - na 1125 C.
Atomski radijus Li se značajno razlikuje od atomskih radijusa njegovih elektronskih kolega, pa Li sa njima formira eutektičke legure.
Atomski radijus vanadijuma je primjetno manji od niobijuma, a kada se prelazi od niobija do tantala, atomski radijus se praktički ne mijenja, unatoč činjenici da tantal ima novi elektronski sloj. Anomalno mala vrijednost atomskog radijusa tantala je posljedica, kao u slučaju hafnija, efekta kontrakcije lantanida. Niobij i tantal u oksidacionom stanju 5 također imaju iste ionske radijuse, što uzrokuje veliku sličnost hemijska svojstva ovih elemenata.
Atomski radijusi niobija i tantala se skoro poklapaju (tabela 33), ionski radijusi istog oksidacionog stanja su takođe veoma bliski jedan drugom, pa su njihova jedinjenja veoma slična po svojstvima. Metali podgrupe VB su vatrostalni, imaju dobra mehanička svojstva, jako zavise od sadržaja nečistoća vodonika, ugljenika, kiseonika i azota. Ove nečistoće povećavaju tvrdoću, čine metale krhkim i manje duktilnim. Otopljeni vakuumski elektronski snop, niobijum i tantal su veoma duktilni i dobro rade kada su hladni.
Struktura molekula - kao porijeklo. Zatim je u ringu prikazan saradnik S8. Atomski radijus sumpora se smatra jednakim 0,104 nm.
Atomski radijusi izračunati iz međuatomskih udaljenosti u jednostavne supstance ah, nm. Atomski radijusi nemetala izračunavaju se na isti način kao polovina međuatomske udaljenosti u molekulima ili kristalima jednostavnih supstanci.
Atomski radijusi niobija i tantala se skoro poklapaju (vidi tabelu 33), jonski radijusi istog oksidacionog stanja su takođe veoma blizu jedan drugom, pa su njihova jedinjenja veoma slična po svojstvima. Metali podgrupe VB su vatrostalni, imaju dobra mehanička svojstva, jako zavise od sadržaja nečistoća vodonika, ugljenika, kiseonika i azota. Ove nečistoće povećavaju tvrdoću, čine metale krhkim i manje duktilnim. Otopljeni vakuumski elektronski snop, niobijum i tantal su veoma duktilni i dobro rade kada su hladni. U uobičajenim uvjetima, ovi metali su pasivni, jer su prekriveni stabilnim zaštitnim oksidnim filmom. At visoke temperature stupaju u interakciju s kisikom, halogenima, dušikom, ugljikom, vodonikom, ugljičnim dioksidom i vodenom parom. Tantal na 600 C i više je obložen jakim, vatrostalnim, slabo provodljivim oksidom Ta20b, koji se ne može reducirati u vodiku.
Atomski radijus vanadijuma je primjetno manji od niobijuma, a kada se prelazi od niobija do tantala, atomski radijus se praktički ne mijenja, unatoč činjenici da tantal ima novi elektronski sloj. Niobijum i tantal u oksidacionom stanju 5 takođe imaju iste jonske radijuse, što uzrokuje veliku sličnost u hemijskim svojstvima ovih elemenata.
Vrste precipitata iz prezasićene čvrste otopine. Atomski radijus aluminijuma je 0 143 nm, bakra - 0 128 nm, cinka - 0 138 nm.
U skladu s tim, atomski radijus se smanjuje sa 155 A u slučaju litijuma na 077 A u slučaju ugljika. Tačke topljenja i ključanja se postepeno povećavaju; ovi pokazatelji, poput tvrdoće i drugih sličnih svojstava, odražavaju snagu veze između atoma date supstance; tačka topljenja se povećava sa 186 za litijum na 3500 za ugljenik, a tačka ključanja raste sa 1336 za litijum na 4200 za ugljenik.
Distribucija elektronske gustine na komunikacijskoj liniji između atoma u kristalima. a - novalent-nan veza (dijamant C, isprekidana linija - elektronska gustina valentnog para elektrona. b - jonska veza (NaCl, isprekidana linija - oblast spoljnih elektronskih orbita. c - metalna veza (A1, isprekidana linija - gustina elektrona) u međuatomskom prostoru.Atomski radijusi gata u strukturama jednostavnih supstanci (elemenata) sa metalnim međuatomskim razmacima u strukturama jedinjenja sa istom vrstom veze dobro se opisuju zbirom atomskih radijusa.Si - C u silicijum karbidu (0 189 nm) se praktično poklapa sa zbirom naznačenih poluprečnika gat (Si) 0 117 nm, rJT (C) 0 077 nm, što je jednako 0 194 nm.
Atomski radijus uranijuma je velik, jednak je 1 54 A, ionski radijusi - 1 03 A, U4 - 0 93 A, U5 - 0 87 A i U6 - 0 83 A.
Atomski radijus cezijuma je 262 A.
Atomski radijusi bora, dušika i silicijuma su 0,80; 0 74 i 1 17 A - Predvidite ponašanje ovih elemenata u slučajevima ispod, uz pretpostavku da su atomi čvrste kugle, i uporedite rezultate koje ste predvidjeli sa eksperimentalnim podacima.
Atomski radijusi vanadijuma, niobijuma i tantala su 1 34, redom; 1 46 i 1 46 A - Zašto se atomski radijusi niobija i tantala poklapaju.
Atomski radijusi prijelaznih elemenata manji su od atomskih polumjera neprijelaznih elemenata, što odražava veću snagu veze u metalima prijelaznih elemenata.
Atomski radijusi metalnih katalizatora moraju biti u određenim granicama, jer će inače atomi vodika u cikloheksanu biti predaleko od atoma katalizatora koji ih privlači, ili prsten atoma ugljika neće ležati na rešetki. Katalizatori dehidrogenacije cikloheksana imaju atomski radijus od 1236-1397 A.
Atomski radijusi elemenata podgrupe bakra su mali: gs 128 pm; / - d g Ai 1 44 rm.
Jedna od najvažnijih karakteristika hemijskih elemenata uključenih u formiranje hemijska veza, je veličina atoma (jona): s njegovim povećanjem, jačina međuatomskih veza opada. Veličina atoma (jona) obično je određena vrijednošću njegovog polumjera ili prečnika. Budući da atom (jon) nema jasne granice, koncept "atomskog (jonskog) radijusa" podrazumijeva da se 90-98% elektronske gustine atoma (jona) nalazi u sferi ovog polumjera. Poznavanje vrijednosti atomskih (jonskih) radijusa omogućava procjenu međunuklearnih udaljenosti u kristalima (tj. strukture ovih kristala), budući da se za mnoge probleme najkraće udaljenosti između jezgara atoma (jona) mogu smatrati zbir njihovih atomskih (jonskih) radijusa, iako je takva aditivnost približna i nije zadovoljena u svim slučajevima.
Ispod atomski radijushemijski element(o ionskom radijusu, vidi dolje), uključeni u formiranje hemijske veze, u opštem slučaju, složili su se da razumeju polovinu ravnotežne međunuklearne udaljenosti između najbližih atoma u kristalnoj rešetki elementa. Ovaj koncept, koji je prilično jednostavan ako posmatramo atome (jone) kao krute sfere, zapravo se ispostavlja složenim i često dvosmislenim. Atomski (jonski) radijus hemijskog elementa nije konstantna vrednost, već varira u zavisnosti od niza faktora, od kojih su najvažniji tip hemijske veze
i koordinacioni broj.
Ako se formira isti atom (jon) u različitim kristalima različite vrste hemijska veza, tada će imati nekoliko radijusa - kovalentna u kristalu sa kovalentnom vezom; jonski u kristalu sa ionskom vezom; metalik u metalu; van der Waalsa u molekularnom kristalu. Uticaj vrste hemijske veze može se videti u sledećem primeru. U dijamantu, sve četiri hemijske veze su kovalentne i formiraju se sp 3-hibridi, pa su sva četiri susjeda datog atoma na istom i
na istoj udaljenosti od njega d= 1,54 A˚) i kovalentni poluprečnik ugljenika u dijamantu će biti
je jednako 0,77 A˚. U kristalu arsena, udaljenost između atoma vezanih kovalentnim vezama ( d 1 = 2,52 A˚), mnogo manje nego između atoma vezanih van der Waalsovim silama ( d 2 = 3,12 A˚), tako da će As imati kovalentni radijus od 1,26 A˚ i van der Waals od 1,56 A˚.
Atomski (jonski) radijus se također vrlo oštro mijenja s promjenom koordinacijskog broja (ovo se može primijetiti tokom polimorfnih transformacija elemenata). Što je manji koordinacijski broj, to je manji stepen ispunjenosti prostora atomima (jonima) i manja su međunuklearna rastojanja. Povećanje koordinacijskog broja uvijek je praćeno povećanjem međunuklearnih udaljenosti.
Iz navedenog proizilazi da se atomski (jonski) radijusi različitih elemenata koji učestvuju u formiranju hemijske veze mogu porediti samo kada formiraju kristale u kojima se ostvaruje ista vrsta hemijske veze, a ovi elementi u formiranim kristalima imaju isti koordinacioni brojevi.
Razmotrimo detaljnije glavne karakteristike atomskih i ionskih radijusa.
Ispod kovalentni radijusi elemenata Uobičajeno je da se razumije polovina ravnotežne međunuklearne udaljenosti između najbližih atoma povezanih kovalentnom vezom.
Karakteristika kovalentnih radijusa je njihova postojanost u različitim "kovalentnim strukturama" sa istim koordinacionim brojem Z j. Osim toga, kovalentni radijusi su, po pravilu, aditivno vezani jedan za drugi, to jest, udaljenost A–B je polovina zbira udaljenosti A–A i B–B u prisustvu kovalentnih veza i ista koordinacijski brojevi u sve tri strukture.
Postoje normalni, tetraedarski, oktaedarski, kvadratni i linearni kovalentni radijusi.
Normalni kovalentni radijus atoma odgovara slučaju kada atom formira onoliko kovalentnih veza koliko odgovara njegovom mjestu u periodnom sistemu: za ugljik - 2, za dušik - 3, itd. To rezultira različitim vrijednostima normalni radijusi u zavisnosti od višestrukosti (reda) veza (jednostruka, dvostruka, trostruka). Ako se veza formira kada se hibridni elektronski oblaci preklapaju, onda govore o tetraedarskom
(Z k = 4, sp 3-hibridne orbitale), oktaedarske ( Z k = 6, d 2sp 3-hibridne orbitale), kvadratne ( Z k = 4, dsp 2-hibridne orbitale), linearne ( Z k = 2, sp-hibridne orbitale) kovalentni radijusi.
Korisno je znati sljedeće o kovalentnim radijusima (vrijednosti kovalentnih radijusa za određeni broj elemenata date su u).
1. Kovalentni radijusi, za razliku od ionskih, ne mogu se tumačiti kao poluprečnici atoma koji imaju sferni oblik. Kovalentni radijusi se koriste samo za izračunavanje međunuklearnih udaljenosti između atoma ujedinjenih kovalentnim vezama, a ne govore ništa o udaljenostima između atoma istog tipa koji nisu kovalentno povezani.
2. Vrijednost kovalentnog radijusa određena je višestrukošću kovalentne veze. Trostruka veza je kraća od dvostruke veze, koja je zauzvrat kraća od jednostruke veze, pa je kovalentni polumjer trostruke veze manji od kovalentnog polumjera dvostruke veze, koji je manji
single. Treba imati na umu da poredak višestrukosti odnosa ne mora biti cijeli broj. Takođe može biti frakciona ako je veza rezonantna (molekul benzena, jedinjenje Mg2 Sn, vidi dole). U ovom slučaju, kovalentni radijus ima srednju vrijednost između vrijednosti koje odgovaraju cjelobrojnim redovima višestrukosti veze.
3. Ako je veza mešovite kovalentno-jonske prirode, ali sa visokim stepenom kovalentne komponente veze, onda se može uvesti koncept kovalentnog radijusa, ali uticaj jonske komponente veze na njen vrijednost se ne može zanemariti. U nekim slučajevima, ovaj efekat može dovesti do značajnog smanjenja kovalentnog radijusa, ponekad do 0,1 A˚. Nažalost, pokušaji da se predvidi veličina ovog efekta u raznim
slučajevi još nisu bili uspješni.
4. Vrijednost kovalentnog radijusa ovisi o vrsti hibridnih orbitala koje učestvuju u formiranju kovalentne veze.
Jonski radijusi, naravno, ne može se definirati kao polovina zbroja udaljenosti između jezgara najbližih iona, budući da se, po pravilu, veličine kationa i aniona naglo razlikuju. Osim toga, simetrija jona može se donekle razlikovati od sferne. Ipak, za prave jonske kristale ispod jonski radijus Uobičajeno je razumjeti radijus lopte, koji je približno ion.
Jonski radijusi se koriste za približne procjene međunuklearnih udaljenosti u ionskim kristalima. Pretpostavlja se da je udaljenost između najbližeg kationa i anjona jednaka zbiru njihovih ionskih radijusa. Tipična greška u određivanju međunuklearnih udaljenosti u smislu jonskih radijusa u takvim kristalima je ≈0,01 A˚.
Postoji nekoliko sistema ionskih radijusa koji se razlikuju u vrijednostima ionskih radijusa pojedinih jona, ali dovode do približno istih međunuklearnih udaljenosti. Prvi rad na određivanju jonskih radijusa izveo je V. M. Goldshmit 1920-ih. U njemu je autor koristio, s jedne strane, međunuklearne udaljenosti u ionskim kristalima izmjerene rendgenskom strukturnom analizom, a s druge strane vrijednosti ionskih radijusa F– i O2– određene pomoću
metoda refraktometrije. Većina drugih sistema se također oslanja na međunuklearne udaljenosti u kristalima određene difrakcijskim metodama i na neke "referentne" vrijednosti ionskog radijusa određenog jona. U najpoznatijem sistemu
Pauling, ova referentna vrijednost je jonski radijus jona O2− peroksida, jednak
1.40A˚. Ova vrijednost za O2– dobro se slaže sa teorijskim proračunima. U sistemu G. B. Bokiya i N. V. Belova, koji se smatra jednim od najpouzdanijih, jonski radijus O2– uzima se jednakim 1,36 A˚.
1970-ih i 1980-ih pokušali su se direktno odrediti radijusi jona mjerenjem elektronske gustine pomoću rendgenske strukturne analize, s tim da se za granicu jona uzima minimum gustine elektrona na liniji koja spaja jezgra. . Pokazalo se da ova direktna metoda dovodi do precijenjenih vrijednosti ionskih radijusa kationa i do podcijenjenih vrijednosti ionskih radijusa aniona. Osim toga, pokazalo se da se vrijednosti ionskih radijusa određene direktnom metodom ne mogu prenijeti s jednog spoja na drugo, a odstupanja od aditivnosti su prevelika. Stoga se takvi jonski radijusi ne koriste za predviđanje međunuklearnih udaljenosti.
Korisno je znati sljedeće o ionskim radijusima (u donjim tabelama date su vrijednosti ionskih radijusa prema Bokiyu i Belovu).
1. Jonski radijus za jone istog elementa varira u zavisnosti od njegovog naboja, a za isti ion zavisi od koordinacionog broja. U zavisnosti od koordinacijskog broja razlikuju se tetraedarski i oktaedarski ionski radijusi.
2. Unutar jednog vertikalni red, tačnije, unutar jedne grupe, periodično
sistem jonskih radijusa sa ista naplata povećavaju se s povećanjem atomskog broja elementa, jer se povećava broj ljuski koje zauzimaju elektroni, a time i veličina jona.
|
Radijus, A˚ |
3. Za pozitivno nabijene jone atoma iz istog perioda, ionski radijusi se brzo smanjuju sa povećanjem naboja. Brzo smanjenje se objašnjava djelovanjem dva glavna faktora u jednom smjeru: jakim privlačenjem “vlastitih” elektrona od strane katjona, čiji se naboj povećava s povećanjem atomskog broja; povećanje jačine interakcije između kationa i anjona koji ga okružuju s povećanjem naboja kationa.
|
Radijus, A˚ |
4. Za negativno nabijene jone atoma iz istog perioda, ionski radijusi rastu sa povećanjem negativni naboj. Dva faktora o kojima smo govorili u prethodnom paragrafu u ovom slučaju djeluju u suprotnim smjerovima, a prevladava prvi faktor (povećanje negativnog naboja anjona je praćeno povećanjem njegovog ionskog radijusa), dakle, povećanje ionskih radijusa sa povećanje negativnog naboja se dešava mnogo sporije nego smanjenje u prethodnom slučaju.
|
Radijus, A˚ |
5. Za isti element, odnosno sa istom početnom elektronskom konfiguracijom, poluprečnik kationa je manji od poluprečnika anjona. To je zbog smanjenja privlačenja vanjskih "dodatnih" elektrona na jezgro aniona i povećanja efekta screeninga zbog unutrašnjih elektrona (kation ima nedostatak elektrona, dok anion ima višak).
|
Radijus, A˚ |
6. Veličine jona sa istim nabojem prate periodičnost periodnog sistema. Međutim, vrijednost ionskog radijusa nije proporcionalna naboju jezgra Z, što je zbog jakog privlačenja elektrona od strane jezgra. Osim toga, lantanidi i aktinidi, u čijim se serijama radijusi atoma i iona s istim nabojem ne povećavaju, već opadaju s povećanjem atomskog broja (tzv. lantanidna kontrakcija i aktinidna kontrakcija), izuzetak su od periodične ovisnosti .11
11 Kontrakcija lantanida i kontrakcija aktinida nastaju zbog činjenice da u lantanidima i aktinidima elektroni dodani s povećanjem atomskog broja ispunjavaju interni d i f- školjke sa glavnim kvantni broj manji od glavnog kvantnog broja datog perioda. Istovremeno, prema kvantnomehaničkim proračunima u d a posebno u f stanjima, elektron je mnogo bliži jezgru nego u s i str dakle stanja datog perioda sa velikim kvantnim brojem d i f-elektroni se nalaze u unutrašnjim delovima atoma, iako je punjenje ovih stanja elektronima ( mi pričamo o elektronskim nivoima u energetskom prostoru) se dešava na drugačiji način.
metalni radijusi smatraju se jednakim polovini najkraće udaljenosti između jezgara atoma u kristalizirajućoj strukturi metalnog elementa. Zavise od koordinacionog broja. Ako uzmemo metalni radijus bilo kojeg elementa na Z k = 12 po jedinici, zatim sa Z k = 8, 6 i 4 metalni radijusi istog elementa će biti 0,98 respektivno; 0,96; 0,88. Metalni radijusi imaju svojstvo aditivnosti. Poznavanje njihovih vrijednosti omogućava približno predviđanje parametara kristalnih rešetki intermetalnih spojeva.
Atomske radijuse metala karakteriziraju sljedeće karakteristike (podaci o vrijednostima atomskih polumjera metala mogu se naći u).
1. Metalni atomski radijusi prijelaznih metala općenito su manji od metalnih atomskih radijusa neprijelaznih metala, što odražava veću snagu veze u prijelaznim metalima. Ova karakteristika je zbog činjenice da metali prelaznih grupa i metali koji su im najbliži u periodičnom sistemu imaju elektronske d-ljuske i elektroni unutra d-država mogu učestvovati u formiranju hemijske veze. Jačanje veze može biti dijelom zbog pojave kovalentne komponente veze, a dijelom zbog van der Waalsove interakcije jonskih jezgara. U kristalima željeza i volframa, na primjer, elektroni u d-države daju značajan doprinos energiji vezivanja.
2. Unutar jedne vertikalne grupe, kako se krećemo odozgo prema dolje, atomski radijusi metala se povećavaju, što je posljedica sekvencijalnog povećanja broja elektrona (povećava se broj ljuski koje zauzimaju elektroni).
3. U istom periodu, tačnije počevši od alkalni metal do sredine grupe prijelaznih metala, u smjeru slijeva na desno, radijusi atomskog metala se smanjuju. Povećanje istim redoslijedom električni naboj atomsko jezgro i dolazi do povećanja broja elektrona u valentnoj ljusci. Sa povećanjem broja vezanih elektrona po atomu, metalna veza je ojačana, a istovremeno se zbog povećanja naboja jezgra povećava privlačenje jezgra (unutrašnjih) elektrona od strane jezgra, pa se vrijednost metalnog atomskog radijusa se smanjuje.
4. Prelazni metali grupa VII i VIII iz istog perioda u prvoj aproksimaciji imaju skoro iste poluprečnike metala. Očigledno, kada su u pitanju elementi koji imaju 5 i više d-elektroni, povećanje nuklearnog naboja i povezani efekti privlačenja elektrona jezgra, koji dovode do smanjenja atomskog metalnog radijusa, kompenziraju se efektima uzrokovanim povećanjem broja elektrona u atomu (jonu) koji ne djeluju učestvuju u formiranju metalne veze, što dovodi do povećanja metalnog radijusa (povećanje broja stanja koje zauzimaju elektroni).
5. Povećanje poluprečnika (vidi paragraf 2) za prelazne elemente, koje se dešava tokom prelaska iz četvrtog u peti period, nije primećeno za prelazne elemente na
prelazak iz petog u šesti period; metalni atomski radijusi odgovarajućih (vertikalno poređenje) elemenata u ova posljednja dva perioda su gotovo isti. Očigledno je to zbog činjenice da su elementi koji se nalaze između njih upotpunjeni relativno duboko f-ljuske, pa se povećanje naboja jezgra i povezani efekti privlačenja pokazuju značajnijim od efekata povezanih sa povećanjem broja elektrona (kontrakcija lantanida).
|
Element iz 4 perioda |
Radijus, A˚ |
Element iz perioda 5 |
Radijus, A˚ |
Element iz perioda 6 |
Radijus, A˚ |
6. Obično su metalni radijusi mnogo veći od ionskih, ali se ne razlikuju toliko značajno od kovalentnih radijusa istih elemenata, iako su svi bez izuzetka veći od kovalentnih. Velika razlika u vrijednostima metalnog atomskog i ionskog radijusa istih elemenata objašnjava se činjenicom da veza, koja svoj nastanak duguje gotovo slobodnim provodnim elektronima, nije jaka (otuda uočene relativno velike međuatomske udaljenosti u metalna rešetka). Značajno manja razlika u vrijednostima metalnog i kovalentnog radijusa istih elemenata može se objasniti ako metalnu vezu posmatramo kao neku posebnu "rezonantnu" kovalentna veza.
Ispod van der Waalsov radijus Uobičajeno je da se razumije polovina ravnotežne međunuklearne udaljenosti između najbližih atoma povezanih van der Waalsovom vezom. Van der Waalsov radijus određuju efektivne veličine atoma plemenitog plina. Osim toga, kako slijedi iz definicije, van der Waalsov atomski radijus se može smatrati polovicom međunuklearne udaljenosti između najbližih atoma istog imena, povezanih van der Waalsovom vezom i koji pripadaju različitim molekulima (na primjer, u molekularni kristali). Kada se atomi približavaju jedni drugima na udaljenosti manjoj od zbira njihovih van der Waalsovih radijusa, dolazi do snažnog međuatomskog odbijanja. Stoga van der Waalsovi atomski radijusi karakteriziraju minimalne dopuštene kontakte atoma koji pripadaju različitim molekulima. Podaci o vrijednostima van der Waalsovih atomskih radijusa za neke atome mogu se naći u).
Poznavanje van der Waalsovih atomskih radijusa omogućava određivanje oblika molekula i njihovog pakiranja u molekularnim kristalima. Van der Waalsovi radijusi su mnogo veći od svih poluprečnika istih gore navedenih elemenata, što se objašnjava slabošću van der Waalsovih sila.






