Toplota fuzije vode. Pitcher filteri, kertridži. Mlaznica svemirske rakete
Tretman vode
Pitcher filteri, kertridži
Svojstva leda za njegove modifikacije
Poruka:
Zdravo Oleg, ja sam student druge godine Kuzbasske države tehnički institut, radi naučni rad. I suočio sam se s problemom: nigdje ne mogu pronaći svojstva leda za sve njegove modifikacije (specifična toplina fuzije, specifični otpor, brzina prostiranja poprečnog i uzdužnog zvučni talasi, koeficijent apsorpcija ovih talasa, sklonost pucanju, kao i mehanička svojstva). Možete li mi "dobaciti" vama poznate informacije o ovim pitanjima, na čemu ću vam biti iskreno zahvalan.
Ista supstanca na nižem nivou atmosferski pritisak ima nižu specifičnu toplotu. Osetljiva toplota je količina toplote koju organizam može primiti bez uticaja na njegovu molekularnu strukturu. Ako se ne promijeni, molekularna struktura ne mijenja stanje. Kako se molekularna struktura ne mijenja, dolazi do promjene temperature, zbog čega se naziva toplinskim kapacitetom.
Latentna toplota je energija potrebna za promjenu faze tvari. Ako je promjena iz čvrstog u tečno, naziva se termonuklearna toplina. Ako se prijelaz iz tekućeg u plinovito stanje naziva toplinom isparavanja. Kada se toplota primeni na supstancu koja je dostigla temperaturu na kojoj menja svoje stanje, nije moguće podići temperaturu, već jednostavno promeniti njeno stanje. Ovisno o tvari, latentna toplina se obično može mjeriti u kalorijama po gramu ili kilodžulima po kilogramu.
Zdravo Dmitry.
Nažalost takva potpune informacije o fizičkim i mehaničkim svojstvima, nemam, pošto nisam posebno proučavao led i njegova svojstva. Evo šta znam o ovoj temi:
U prirodi je poznato 14 modifikacija leda. Istina, sve osim nama poznatog leda, koji kristališe u heksagonalnoj singoniji i koji se označava kao led I, nastaje u egzotičnim uslovima - na veoma niskim temperaturama (oko -110150 0 C) i visokim pritiscima, kada se uglovi vodoničnih veza u molekuli vode se menjaju i formiraju se sistemi, različiti od heksagonalnih. Takvi uslovi podsećaju na kosmičke uslove i ne postoje na Zemlji. Na primjer, na temperaturama ispod -110 ° C, vodena para se taloži na metalnoj ploči u obliku oktaedara i kocki veličine nekoliko nanometara - to je takozvani kubični led. Ako je temperatura nešto iznad –110 °C, a koncentracija pare vrlo niska, na ploči se formira sloj izuzetno gustog amorfnog leda.

voda: latentna toplota tačka topljenja: 80 kalorija po gramu, latentna toplota isparavanja: 540 kalorija po gramu. Čelik: Latentna toplota fuzije: 50 kalorija. Magnezijum: Latentna toplota fuzije: 72 kalorije. Nikl: Latentna toplota fuzije: 58 kalorija. Kiseonik: Latentna toplota fuzije: 3 kalorije.
Cink: Latentna toplota fuzije: 28 kalorija. Ledeni kalorimetar: istorijski i eksperimentalni pristup nastavi hemije na fakultetu. Pored uobičajene prednosti ledenog kalorimetra koji može mjeriti spore promjene topline, ovdje opisani instrument je izuzetno jednostavan za izradu i rad. Specifična toplota metala aluminijuma, bakra, olova i kalaja određena je pomoću ledenog kalorimetra napravljenog od lako dostupnih materijala.
Neki podaci o strukturnim modifikacijama leda, temperaturi, pritisku, gustoći i propusnosti prikazani su u Tabeli 1 i Tablici 2.
Tab. jedan . - Neki podaci o strukturama modifikacija leda
Bilješka. 1A=10 -10 m.
Tab. 2 . - Temperatura, pritisak, gustina i dielektrična konstanta razni led
Ključne riječi: Lavoisier; kalorimetar; specifična toplota. Medalja za kalorije i antisocijalne akcije na komunikaciji kalorija. Pogledat ćemo kako to učiniti. Kao prediktori medikamentozne kalorimetrije za liječenje bolesti lijekova, implementacije koje se koriste za liječenje, ne postoji adekvatna kontrola zdravstvenog stanja i okruženje.
Ne postoji internacionalni primalac prema opštoj temperaturi, preovlađujući aquedido. Оооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооеееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееее. Prema "mehaničkim teorijama", takođe grčkog porijekla, toplota nastaje kretanjem sastavnih čestica materije. Lavoisier i Laplace spomenuli su mehaničku hipotezu, u kojoj je toplina živa sila koja je rezultat neosjetljivih kretanja molekula, čiji je intenzitet proporcionalan proizvodu mase puta kvadrata brzine.
Kristali svih modifikacija leda građeni su od molekula vode H 2 O, povezanih vodoničnim vezama u trodimenzionalni okvir ( pirinač. jedan ). Molekul vode se jednostavno može zamisliti kao tetraedar (piramida sa trouglastom bazom). U njegovom središtu je atom kisika, na dva vrha - atom vodika, čiji elektroni sudjeluju u formiranju kovalentna veza sa kiseonikom. Dva preostala vrha su zauzeta parovima valentnih elektrona kisika, koji ne sudjeluju u stvaranju intramolekularnih veza, pa se nazivaju usamljenim.
Iz toga su izveli princip očuvanja toplote u mešavini tela i princip nepromenljivosti zbira toplote koja se oslobađa i apsorbuje kada se vrati u prvobitno stanje nakon niza kombinacija ili promena stanja. Nisu iznijeli nijednu hipotezu, ali su dodali da bi mogle biti istinite. 2, 3. Lavoisier je bio veliki zagovornik kalorija. Ova teorija je vjerovala da su sva tijela u svom unutrašnjem dijelu nevidljiva tečna supstanca odvratna masa, kalorijski sadržaj, je da tijelo više temperature ima veću kalorijsku vrijednost od drugog, niže temperature. 9, 10.
Fig.1 . Struktura ledaI.
Led je najviše proučavan Ith prirodne modifikacije. U strukturi leda, svaki molekul vode učestvuje u 4 veze usmjerene na vrhove tetraedra. Kada proton jednog molekula stupi u interakciju s parom nepodijeljenih elektrona kisika drugog molekula, nastaje vodikova veza, koja je manje jaka od intramolekularne veze, ali dovoljno moćna da drži susjedne molekule vode u blizini. Svaki molekul može istovremeno formirati četiri vodikove veze s drugim molekulima pod strogo određenim uglovima jednakim 109°28" usmjerenim na vrhove tetraedra, koji ne dozvoljavaju stvaranje guste strukture tokom smrzavanja. Istovremeno, u strukturama leda I, Ic, VII i VIII ovaj tetraedar je tačan. U strukturama leda II, III, V i VI tetraedri su primetno izobličeni. U strukturama leda VI, VII i VIII Mogu se razlikovati 2 sistema vodoničnih veza koji se međusobno sijeku. Ova nevidljiva skela vodoničnih veza raspoređuje molekule u mrežastu mrežu, sličnu strukturi saću sa šupljim kanalima. Ako se led zagrije, struktura mreže se urušava: molekuli vode počinju padati u praznine mreže, što dovodi do gušće tekuće strukture - dakle, voda je teža od leda.
Teorija kalorijskog mišljenja kao materije napuštena je u korist teorije topline kao energije, uglavnom zato što se zagrijavanje objekata ne može objasniti osim izvorom topline. Toplota, kao i tok energije, uvijek putuje od jednog sistema na najvišoj temperaturi do drugog na nižoj temperaturi kada su u kontaktu. jedanaest.
Pitcher filteri, kertridži
Tokom godina, proučavanje toplote je opadalo sa svoje dominantne pozicije u naučnoj avangardi, što sugeriše definitivnu poziciju u ukupnoj strukturi hemije. Trenutno, kalorimetrija pruža vrijedne podatke za hemičare i razvoj teorija o hemijske interakcije. 1.
Mnogo toga u strukturi leda i njegovim svojstvima izgleda neobično. Na čvorovima kristalne rešetke leda atomi kiseonika su raspoređeni na uredan način, formirajući pravilni heksagoni, a atomi vodonika zauzimaju različite pozicije duž veza. Stoga je moguće 6 ekvivalentnih orijentacija molekula vode u odnosu na njihove susjede. Neki od njih su isključeni, jer je prisustvo 2 protona u isto vrijeme na istoj vodikovnoj vezi malo vjerovatno, ali ostaje dovoljna nesigurnost u orijentaciji molekula vode. Ovakvo ponašanje atoma je netipično, jer se u čvrstoj materiji svi povinuju istom zakonu: ili su svi atomi uređeni, pa je to kristal, ili nasumično, a onda je amorfna supstanca. Ovakva neobična struktura može se realizovati u većini modifikacija leda - I, III, V, VI i VII(i očigledno u ic), te u strukturi leda II, VIII i IX molekule vode su orijentaciono uređene. Prema J. Bernalu, led je kristalan u odnosu na atome kiseonika i staklast u odnosu na atome vodonika.
Uloga topline topljenja leda i kristalizacije vode u prirodi
Cilj ovog rada bio je da se utvrdi specifični toplotni kapacitet metalnih tela u izuzetno jednostavnom izotermnom kalorimetrijskom sistemu koji treba izgraditi i obraditi, izrađen od lako dostupnih materijala, upoređujući dobijene vrednosti sa poznatim teorijskim vrednostima, pokazujući mogućnost korišćenja ovu vrstu kalorimetra. Ova praksa je odlična ponuda za posao za preddiplomske laboratorije.
Izrada kalorimetrijskog sistema. Postoji uporedna slika Lavoisierovog kalorimetra i kalorimetra predloženog u ovom radu. U kutiji od stiropora napravljene su dvije rupe, jedna na dnu kutije kako bi se omogućilo crijevo da prođe, a druga sa strane kutije, omogućavajući da se otopljeni led skupi iz unutrašnjosti stiropora. Lonac je postavljen unutar stiropora poduprt stativom.
Ipak, obični led, koji nastaje pri atmosferskom pritisku i topi se na 0°C, je najpoznatija, ali još uvijek neu potpunosti shvaćena supstanca. U vezi sa rasprostranjena voda i led na Zemlji, razlika između svojstava leda i svojstava drugih supstanci igra važnu ulogu u prirodnim procesima. Zbog svoje manje gustine od vode, led formira plutajući pokrivač na površini vode, koji štiti rijeke i akumulacije od smrzavanja dna. Odnos između brzine protoka i napona u polikristalnom ledu je hiperboličan; uz njegov približni opis jednadžbom snage, eksponent raste kako napon raste.
Dvije čaše su služile kao oslonac za kalorimetar. Metalna tijela su zagrijana na magnetnoj miješalici uz zagrijavanje, smještena pored kalorimetra. Može se vidjeti jeftino kolo ledenog kalorimetra koji je napravljen od metalne školjke prekrivene žicom u aluminijskom aparatu za kafu. Aparat za kafu je stavljen u kutiju od stiropora. Za eksperiment, aparat za kafu i kutija od stiropora napunjeni su ledom. Za topljenje leda postavljene su dvije slavine: jedna na dnu aparata za kafu, druga na stiropor.
Osim toga, brzina strujanja leda je direktno proporcionalna energiji aktivacije i obrnuto proporcionalna apsolutnoj temperaturi, tako da se s padom temperature led po svojim svojstvima približava apsolutnoj temperaturi. čvrsto telo. U prosjeku, na temperaturi blizu topljenja, fluidnost leda je 106 puta veća od one u stijenama. Zbog svoje tečnosti, led se ne nakuplja na jednom mjestu, već se stalno kreće u obliku glečera.
Voda ispuštena iz slavine skupljena je u posudu da bi se odredila masa rastopljenog leda. Određivanje specifičnog toplotnog kapaciteta metala. Za eksperiment, kutija od stiropora bila je potpuno ispunjena usitnjenim ledom do ruba unutrašnje posude. Uzorak prethodno izvaganog metala stavljen je u metalni dren u čašu sa 600 ml vode na 96°C u trajanju od 10 minuta. Nekoliko minuta prije dodavanja uzorka metala u kalorimetar, unutrašnja posuda je djelomično ispunjena ledom. Zagrijano metalno kućište je brzo dodano u kalorimetar i malo leda je bačeno na površinu metala unutar kalorimetra.
Led se teško otopi, koliko god to čudno zvučalo. Da nema vodoničnih veza koje povezuju molekule vode, otopila bi se na –90°C. U isto vrijeme, kada se smrzava, voda se ne smanjuje u volumenu, kao što se događa kod većine poznate supstance, a povećava se - zbog formiranja mrežne strukture leda.
Zbog vrlo visoke refleksije leda (0,45) i snijega (do 0,95), površina koju pokrivaju u prosjeku iznosi oko 72 miliona hektara godišnje. km 2 u visokim i srednjim geografskim širinama obje hemisfere - prima sunčevu toplinu 65% manje od norme i snažan je izvor hlađenja zemljine površine, što u velikoj mjeri određuje savremenu geografsku klimatsku zonalnost. Ljeti, u polarnim područjima, sunčevo zračenje je veće nego u ekvatorijalnom pojasu, ali temperatura ostaje niska, jer se značajan dio apsorbirane topline troši na topljenje leda, koji ima vrlo visoku toplinu topljenja.
Tajmer je označio 15 minuta, što je bilo ukupno vrijeme u kojem je metal došao u kontakt sa ledom. Nakon 15 minuta uzeta je određena količina vode iz česme. Ova masa rastopljenog leda je izvagana da bi se odredila specifična toplota metala. Analiza je izvršena samo sa korpom, koju treba koristiti kao referentni uzorak eksperimenata. Sve analize su obavljene u 5 ponavljanja.
Kad god dva sistema različite temperature smeštene unutar termoizolovane posude, dolazi do prenosa energije u obliku toplote iz sistema na najvišu temperaturu u sistem na najnižoj temperaturi dok se ne postigne termička ravnoteža između njih. Ovaj princip je nulti zakon termodinamike.
Ostala neobična svojstva leda uključuju stvaranje elektromagnetno zračenje njegove rastuće kristale. Poznato je da se većina nečistoća rastvorenih u vodi ne prenosi na led kada počne da raste; smrzavaju se. Stoga, čak i na najprljavijoj lokvi, ledeni film je čist i proziran. U tom slučaju nečistoće se nakupljaju na granici čvrstog i tekućeg medija, u obliku dva sloja električnih naboja različitog predznaka, što uzrokuje značajnu potencijalnu razliku. Nabijeni sloj nečistoće pomiče se zajedno sa donjom granicom mladi led i emituje elektromagnetne talase. Zahvaljujući tome, proces kristalizacije se može detaljno posmatrati. Dakle, kristal koji raste u dužinu u obliku igle zrači drugačije od onog prekrivenog bočnim nastavcima, a zračenje rastućih zrna se razlikuje od onoga koje nastaje kada kristali pucaju. Iz oblika, redoslijeda, frekvencije i amplitude impulsa zračenja može se odrediti brzina kojom se led smrzava i kakva se struktura leda dobija.
Stoga se materijal koji ima visoku specifičnu toplinu zagrijava i hladi mnogo sporije od materijala koji ima nisku specifičnu toplinu. Važno je napomenuti da vrijednost specifične topline ima mala odstupanja u zavisnosti od temperature. 10. Izotermni kalorimetar je prvi razvijen iu njemu je kalorimetrijski eksperiment izveden na konstantna temperatura. 1 U ledenom kalorimetru, toplota se prenosi sa metala na visoke temperature do leda, zbog čega se topi.
Pošto je ovaj sistem termički izolovan od okoline, količina toplote koju primi metal jednaka je količini toplote koju apsorbuje led, što izjednačava jednačine 1 i 2, imamo. Dakle, specifični toplinski kapaciteti svih tijela mogu se odrediti jednačinom 3, gdje voda djeluje kao referentni organ.
Tab. 3 . - Neka svojstva leda I
| Nekretnina | Značenje | Bilješka |
| toplotni kapacitet, cal/(G°C) toplota topljenja, cal/g Toplota isparavanja, cal/g | Snažno opada sa smanjenjem temperature |
|
| Koeficijent toplinske ekspanzije, 1/°C Eksperiment je izveden u tri primjerka. Tek nakon 1 min metal je stavljen u kalorimetar i počele su se pojavljivati prve kapi. Dobijeni rezultati su vrlo bliski onima koji se nalaze u literaturi i prikazani su u tabeli 1. Rezultati su pokazali da se ovaj jednostavan sistem može koristiti u nastavnoj praksi za određivanje specifičnih toplotnih kapaciteta metala. Razlika između eksperimentalnih podataka mora biti uzrokovana razlikama u temperaturi okoline i formiranjem ledenih blokova koji ometaju protok vode. Mnogi naučnici iz Lavoisierovog vremena smatrali su da je bilo teško dobiti konzistentne rezultate koristeći ledeni kalorimetar jer u to vrijeme nisu posjedovali izolacijske materijale kao što je stiropor, koji je omogućavao prikladniju izolaciju od jagnjeće kože korišćene u to vrijeme. Međutim, zimi su postigli odlične rezultate. | 9,1 10 -5 (0°C) | |
| toplotna provodljivost, cal/(cm sec°C) | ||
| Indeks prelamanja: za običnu gredu za izvanrednu gredu | ||
| Specifična električna provodljivost, ohm -1 ·cm -1 | Prividna energija aktivacije 11 kcal/mol Takav eksperiment će omogućiti studentima dodiplomskih studija da se povežu sa istorijom i radom izuzetno važnog hemičara Antoinea Laurenta Lavoisiera. Omogućava stvaranje laganog izotermnog kalorimetra, uz uključivanje važnih koncepata kao što su toplina, specifična toplina i nulti zakon termodinamike. Štaviše, pokazuje genijalnost zaštitnika nauke i omogućava studentima da reprodukuju eksperimente ovih naučnika, koji su bili kamen temeljac za razvoj hemije. Rezultati su pokazali da je moguće pronaći konzistentne vrijednosti specifičnih toplotnih kapaciteta bliske onima u literaturi. Ledeno otapanje latentne toplote. Latentna toplota fuzije leda je ono što se dešava kada voda promeni svoje fizičko stanje. U ovom konkretnom slučaju, od čvrsto stanje u tečnost. |
|
| površinska električna provodljivost, ohm -1 | Prividna energija aktivacije 32 kcal/mol |
|
| Youngov modul dina/cm | 9 10 10 (-5°C) | Polycrystalline led |
| otpor, Mn/m 2 : drobljenje | Polikristalni led Polikristalni led Smatra se da je toplota oblik energije i da je izmjena toplote između kalorimetra i spoljašnje okruženje zanemarljivo, možemo pretpostaviti da za sistem koji se sastoji od leda, vode i aluminijske posude. Količina primljene toplote = količina isporučene toplote. I modul u gornjoj jednačini je postavljen jer je primljena količina topline negativna. Iz ove gornje jednačine, ako je druga jednačina. Ova odstupanja se propagiraju korištenjem jednačine. Primjenom parcijalnih izvoda u jednadžbi. Izmjerite i zabilježite težinu aluminijske posude; Uz pomoć epruvete u posudu i aluminijum ulijemo 300 ml vode iz slavine i izmjerimo masu seta; Izmjerili smo podešenu temperaturu; Mjerimo početnu temperaturu zraka između posude i stakla; Izmjerite masu stakla unutar leda; Sav led sipamo u aluminijsku kadu koja već sadrži vodu; Mjerimo staklo koje se koristi u proizvodu; Zabilježite ravnotežnu temperaturu; Mjerimo temperaturu zraka između stakla i posude. Polikristalni led |
|
| Prosečan efektivni viskozitet, pz | Polikristalni led |
|
| Eksponent stepena zakona strujanja | ||
| Energija aktivacije tokom deformacije i mehaničke relaksacije, kcal/mol | Linearno raste za 0,0361 kcal/(krtica°C) 0 do 273,16 K |
Bilješka. 1 cal / (g ° C) = 4,186 kjl(kg(TO) ; 1 ohm -1 cm -1 =100 sim/m; 1 dina/cm=10 -3 n/m; 1 cal/(cm(sec°S)=418,68 uto/(m(TO) ; 1 pz= 10 -1 n(sec/m 2 .
Prirodno ledI obično mnogo čistiji od vode, jer rastvorljivost supstanci (osim NH 4 F) u ledu je izuzetno niska. Led II, s druge strane, stabilizuje se samo u prisustvu gasova u tragovima; u čistom obliku, niko ga nije primio zbog njegove nestabilnosti. Ako se, na primjer, stvori pritisak uz pomoć helijuma, on će se sigurno otopiti u ledenoj vodi. Postoje dokazi da je argon, još jedan inertni plin pogodan za korištenje u ovoj postavci, također sposoban formirati čvrste otopine s ledom. Međutim, niko nije posebno proučavao takva klatratna jedinjenja leda sa plemenitim gasovima.
Ice II, III i V modifikacije dugo čuvano na atmosferskom pritisku, ako temperatura ne prelazi -170°C. Kada se zagrije na približno -150°C, led se pretvara u kocki ledaic.
Located led II na dijagramu stanja između Ice III i led IX. Razlikuju se jedni od drugih po redoslijedu protona, dok im je okvir kisika isti: spirale nekih molekula vode, kao da su nanizane na osi drugih molekula vode. Kada su vjerovatnoće da proton zauzme jedno ili drugo mjesto jednake, led će biti neuređen.
Rice. 2. dijagram stanja kristalni led
Međutim, svi eksperimenti s egzotičnim ledom u pravilu su povezani s njihovim hlađenjem na temperature suhog leda, tekućeg dušika, pa čak i helijuma, kao i sa kompresijom do tlaka od tisuća atmosfera. Opšti pogled rezultati se mogu dobiti gledanjem slika, gdje je prikazan dijagram stanja kristalnog leda.
Mnogi ledovi pod visokim pritiskom mogu se skladištiti pod normalnim pritiskom. Da biste to učinili, ohlade se u tekućem dušiku, a zatim se pritisak otpusti. Na tako stvrdnutom ledu provedene su glavne studije. Pokazali su da je njihova struktura veoma raznolika.
Struktura prvog leda pod visokim pritiskom, Ice II, identifikovani su u zoru istraživanja u ovoj oblasti, kada su se 1964. pojavili prvi moćni instrumenti za difrakciju rendgenskih zraka. Kako se ispostavilo, ovaj led se sastoji od šupljih stubova formiranih rebrastim ciklusima sa šest karika. Svaki stupac je okružen sa šest istih kolona, pomaknutih jedna u odnosu na drugu za trećinu perioda. Struktura ovog leda može se dobiti ako se dio saća leda I h razbije i pretvori u ažurne okvire koji povezuju ostatak saća. U ovom slučaju, veličina rezultirajućih heksagonalnih kanala uvelike se povećava - led II ima najšire kanale, njihov promjer je 3 Å. Takvi kanali mogu sadržavati helijum, neon, pa čak i molekule vodonika.
Rice. 3 . Struktura ledaII
Hidrati plemenitih gasova, kao što je helijum, mogu se dobiti iz leda II na dva načina. Prvo primenite (u atmosferi helijuma) pritisak od 0,28-0,5 GPa na vodu i ohladite je na 250-270K. Iako su led III i V stabilni u ovoj oblasti dijagrama, hidrat će se dobiti na osnovu leda II. Zanimljivo je da su protoni u njemu već uređeni. (Obično se naručuju tek kada se već formirani led jako ohladi.)
Drugo, moguće je rastvoriti helijum u njemu led I h pri niskoj temperaturi i pritisku od 0,3 GPa. Pojava helijuma dovodi do širenja kristalne rešetke, a zatim njegovo zagrijavanje na 180K pomaže da se podvrgne strukturnoj transformaciji.
Relativna lakoća dobijanja čvrstih rastvora u ledu II, kao i njegov veliki potencijal skladištenja gasovitog vodonika (jedan molekul gasa na šest molekula vode) privlači pažnju praktičnih naučnika na to: mogućnost njegove primene u vodiku o energetici se aktivno raspravlja.
Kada se vodena para kondenzuje na hladnijoj podlozi, amorfnog leda. Oba ova oblika leda Ice II i amorfni led mogu se spontano transformirati u heksagonalni ledštaviše, što je viša temperatura.
Ice IV modifikacija je metastabilna faza leda. Mnogo se lakše formira i posebno je stabilan ako je teška voda izložena pritisku.
Kriva topljenja leda V i VII testiran do pritiska 20 H/m 2 (200 hiljada kgf/cm 2 ). Pod ovim pritiskom led VII se topi na 400°C.
Ice VIII je niskotemperaturna uređena forma Ice VII.
Ice IX- metastabilna faza koja se javlja tokom prehlađenja Ice III i u suštini predstavlja njen niskotemperaturni oblik.
Polimorfizam leda je prvi otkrio G. Tamman 1900. godine, a detaljno ga je proučio P. Bridgeman 1912. Tabela. Na slikama 3 i 4 prikazani su podaci o strukturama modifikacija leda i nekim njihovim svojstvima.
Posljednje dvije modifikacije leda - XIII i XIV- otkrili su naučnici sa Oksforda sasvim nedavno, 2006. godine. Pretpostavku da bi trebali postojati kristali leda s monoklinskim i rombičnim rešetkama bilo je teško potvrditi: viskoznost vode na temperaturi od -160 °C je vrlo visoka, a molekuli čiste prehlađene vode teško se spoje u tolikoj količini. da se formira kristalno jezgro. To je postignuto uz pomoć katalizatora - hlorovodonične kiseline, koja je povećala pokretljivost molekula vode na niskim temperaturama. U zemaljskoj prirodi takve modifikacije leda se ne mogu formirati, ali se mogu pojaviti na zamrznutim satelitima drugih planeta.
NEKA FIZIČKA I MEHANIČKA SVOJSTVA LEDA.
Stabilnost leda je multifaktorski fenomen koji zavisi od mnogih faktora koji se moraju uzeti u obzir u proračunima:
TVRDOĆA LEDA. Sposobnost leda da se odupre prodiranju drugog tijela koje ne prima trajne deformacije. Definira se kao omjer djelotvornog opterećenja P i površine formiranog udubljenja S. Tvrdoća H = P/S je prosječna vrijednost pritiska u udubljenju. Ovisno o temperaturi leda i vremenu primjene opterećenja (kratko vrijeme odgovara dinamičkoj tvrdoći, dugo vrijeme statičkoj tvrdoći), vrijednosti H mogu se razlikovati za više od reda veličine.
ICE TEXTURE. Karakteristika strukture leda, zbog prostornog rasporeda zraka, mineralnih i organskih inkluzija.
Uzimajući u obzir inkluzije zraka, led se dijeli na monolitna(bez vidljivih inkluzija) i porozna(sa prisustvom inkluzija, koje mogu imati ujednačenu, slojevitu i vertikalno vlaknastu distribuciju).
Prema veličini inkluzija, led se dijeli na fino vezikularno(uključci manji od 0,2 mm), srednji balon(uključci od 0,2 do 0,5 mm), grubo pjenušavo(uključci od 0,5 do 1,0 mm), velika šupljina(uključci preko 1,0 mm).
Oblik inkluzija je ovalan, cjevast, razgranat i transformirajući. Prema svom porijeklu, inkluzije se dijele na primarni (autogeni), sekundarni (ksenogeni) i teksturirano (kataklastično).
TEMPERATURA OTOPLJENJA LEDA. Temperatura na kojoj se led topi pri konstantnom vanjskom pritisku. Topljenje morski led ne nastaje na određenoj temperaturi, kao kod svježeg leda, već kontinuirano, od trenutka kada je temperatura ispod 0°C do tačke smrzavanja morska voda dati salinitet.
Promjena temperature u ledu u vremenu kada mu se dovodi toplina
1 - 2 - grijanje ledom;2 - 3 - topljeni led:3 - 4- grijanje vode;t pl - temperatura topljenja leda.
Otapanje leda pri atmosferskom pritisku događa se na temperaturi od 0,01°C (u praktičnim proračunima se pretpostavlja 0°C). Količina toplote koja se mora predati 1 kg leda na tački taljenja da bi se pretvorio u vodu naziva se specifična toplota fuzije L sq. Specifična toplota topljenje slatkovodnog leda u normalnim uslovima jednako je specifičnoj toploti kristalizacije vode 33,3·10 4 J/kg.
TOPLOTNA PROVODNOST LEDA (koeficijent toplinske provodljivosti). Parametar koji karakterizira brzinu promjene temperature leda u nestacionarnim termičkim procesima. Toplotna difuzivnost leda
a= λ/Cpρ),
gdje je Cp - specifični toplotni kapacitet leda pri konstantan pritisak, ρ - gustina leda, λ - koeficijent toplotne provodljivosti, numerički jednak porastu temperature jedinične zapremine leda kao rezultat toplotnog fluksa koji odgovara koeficijentu toplotne provodljivosti Cp .
Ice II je romboedaran. Ima sličnosti, što nije iznenađujuće, sa Iceom I po tome što se sastoji od valovitih šesteročlanih prstenova spojenih sa drugim prstenom ispod njega. Međutim, susjedni prstenovi ne formiraju potpunu heksagonalnu mrežu, već umjesto okružujućih trostrukih osa zavrtnja. Dijagram ispod prikazuje prstenove u Ice I (lijevo) i Ice II (desno). Visine prstenova oko osi vijaka prikazane su na desnom dijagramu. Budući da prstenovi zatvaraju slobodna mjesta, struktura Ice II zapravo ima manje praznog prostora i gušća je. Gustina je 1,17 gm/cc.
Ako vam struktura iznad izgleda poznato, trebala bi. Atomi kiseonika imaju isti raspored kao atomi ugljenika u dijamantu. Ovaj oblik leda se zove Ice Ic.
Na lijevoj strani je kubna jedinična ćelija Ice Ic, s prikazanim samo kisikom. O-H-O veze su narandžaste boje.
Dijagram ispod pokazuje odnos kubične jedinične ćelije prema bliskim slojevima pakiranja.
Led Ic nastaje iz pare ispod oko -80 C i čini se da je metastabilan oblik leda, iako ima gotovo istu gustinu kao Ice Ih. Led Ih se ne mijenja u Ice Ic na vrlo niskim temperaturama, ali Ice Ic se lako vraća u Ice Ih kada se zagrije iznad -80 C. Ice Ic se može formirati u ekstremno visokim oblacima i neke karakteristike haloa koje nisu lako objašnjive u smislu heksagonalnog leda pripisane su Ice Ic .
Prikazana je struktura Ice II. Postoje dva seta prstenova sa neznatno različitim stupnjevima valovitosti, prikazanih zelenom i svijetloplavom. U smislu dimenzija c-ose, jedan set je centriran na visinama 0, 1/3, 2/3 i jedan, a drugi na 1/6, 1/2 i 5/6. Dva seta se naizmjenično okomito i skupljaju oko trostrukih osa zavrtnja. Ako dva skupa prstenova označimo kao P i Q, tada su prstenovi povezani oko svake trostruke ose na način P-Q-P-Q-P-Q-. Karike u dvije vrste prstenova su crvene i ljubičaste, unakrsne veze su tamnoplave.
Ice II je tetragonalni. Jedinična ćelija je kubične dimenzije (6,83 Angstromunita sa strane) ali tetragonalne simetrije. Gustina je 1,14 gm/cc. Tetraedarske O-H-O veze su donekle izobličene. Na dijagramu ispod, atomi kiseonika su prikazani plavom bojom sa većim atomima bliže posmatraču. O-H-O veze su crvene, sa debljim linijama bliže gledaocu. Veze koje završavaju strelicom upućuju na dublji nivo, one sa šiljatim krajevima upućuju na viši nivo. Prikazano je nekoliko nivoa strukture. Atomi prikazani kao iste veličine mogu zapravo biti na neznatno različitim visinama. Na primjer, skupovi od tri atoma u obliku slova L pod pravim kutom su zapravo blago nagnuti u odnosu na ravan dijagrama. Nagnuti kvadrati kisika okružuju četverostruke zavojne ose.
Lijevo je pogled odozgo na strukturu Ice Ih. Crvene tačke na nekim atomima označavaju B sloj sa O-H-O vezama koje upućuju na sljedeći B sloj. Ostali atomi su u A sloju i imaju O-H-O veze koje pokazuju nadolje do sljedećeg A sloja.
Polimorfi leda visokog pritiska
Led pokazuje veliki broj polimorfa kao što je prikazano lijevo. Led u vašem čaju je Ice I.
Ice I se pretvara u Ice II ili Ice III na oko 2 kb. U podnožju Antarktičke ledene kape (debljine 5 km) pritisak je samo oko 0,5 kb. Dakle, led na zemlji nikada ne postane dovoljno gust da se pretvori u gušću fazu. Dostižemo veće pritiske u kori, ali na temperaturama daleko iznad tačaka topljenja bilo koje vrste leda.
Međutim, guste faze leda gotovo sigurno postoje u unutrašnjosti velikih satelita u vanjskom Sunčevom sistemu i vjerovatno se lako proizvode metamorfizmom udara tokom udara meteoroida.
Ice V je monoklinski. Na dijagramu ispod, atomi kiseonika su prikazani plavom bojom sa većim atomima bliže posmatraču. O-H-O veze su crvene, sa debljim linijama bliže gledaocu. Veze koje završavaju strelicom upućuju na dublji nivo, one sa šiljatim krajevima upućuju na viši nivo. Prikazano je nekoliko nivoa strukture. Atomi prikazani kao iste veličine mogu zapravo biti na neznatno različitim visinama. Jedinična ćelija je prikazana sivom bojom (jedan skup ivica ide horizontalno i uglavnom je skriven atomima i vezama, ali je tu. Pogledajte pomno).
Led VI je tetragonalni, sa a = 6,27 Angstroma jedinica i c = 5,79 - skoro kubnim. Gustina je 1,31 gm/cc. Može se opisati kao "samo-klatrat". Klatrat je molekul okružen kavezom molekula vode. U Ice VI, postoje klasteri od pet molekula vode, centralni molekul u tetraedarskom kavezu od četiri druga. Centri klastera leže na uglovima i centrima tetragonalne rešetke centrirane na telo, a okolni molekuli su 3/8c iznad i ispod centralnog molekula.
Usko zbijene strukture ne dozvoljavaju tetraedarske veze baš dobro. Led VI i Ice VII postižu svoju gustinu tako što imaju dvije međusobno prožimajuće, ali nepovezane rešetke. U ovom dijagramu O-H-O veze u dvije odvojene mreže prikazane su crvenom i ljubičastom bojom.
atomi kiseonika su prikazani plavom bojom sa većim atomima bliže posmatraču. Dve mreže O-H-O veza su u crvenoj i ljubičastoj boji, sa debljim linijama bliže posmatraču. Veze koje završavaju strelicom pokazuju na dublji nivo, one sa šiljastim krajevima pokazuju na viši nivo. Prikazano je nekoliko nivoa strukture.
Na neki način je Ice VII najlakše razumjeti, jer se sastoji od dvije međusobno prožimajuće Ice Ic rešetke.
Dva međusobno prožimajuća seta rešetki prikazana su narandžastom i crvenom bojom. Jedinična ćelija se sastoji od osam tjelesno centriranih kocki.
Ice VII ima gustinu od 1,66 gm/cc.
Jedinična ćelija Ice VII sastoji se od kockica u centru tijela, koje su prilično čvrsto zbijene. Struktura leda zasnovana na čvrsto zbijenim molekulima vode zahtijevala bi jako izobličene veze, a teoretski proračuni sugeriraju da je IceVII stabilan oblik do najmanje 200 kilobara. Pri Zemljinoj gravitaciji, 200 kilobara odgovaralo bi dubini od oko 1500 kilometara leda, uzimajući u obzir promjene faza.
Pri ekstremno visokim pritiscima mogli bismo očekivati da se molekuli vode u potpunosti razbiju i da se formira zbijena struktura s ionskom vezom.
Tokom topljenja, prostorna rešetka je uništena kristalno telo. Ovaj proces troši određenu količinu energije iz nekog vanjskog izvora. Kao rezultat, unutrašnja energija tijela se povećava tokom procesa topljenja.
Količina topline potrebna za promjenu tijela iz čvrstog u tekuće stanje na tački taljenja naziva se toplina fuzije.
U procesu očvršćavanja tijela, naprotiv, unutrašnja energija tijela se smanjuje. Telo odaje toplotu okolnim telima. Prema zakonu održanja energije, količina toplote koju telo apsorbuje tokom topljenja (na temperaturi topljenja) jednaka je količini toplote koju ovo telo odaje tokom očvršćavanja (na temperaturi očvršćavanja).
Specifična toplota fuzije
Toplota fuzije zavisi od mase topljene supstance i njenih svojstava. Ovisnost topline fuzije o vrsti tvari karakterizira specifična toplina fuzije ove tvari.
Specifična toplina fuzije tvari je omjer topline fuzije tijela iz ove tvari i mase tijela.
Označimo toplotu fuzije kroz Q pl , tjelesne težine t i specifična toplota fuzije slovom λ . Onda
Dakle, da bi se rastopilo kristalno tijelo s masom m, uzeto na temperaturi topljenja, potrebna je količina topline jednaka
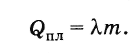 (8.8.2)
(8.8.2)
Toplina kristalizacije
Prema zakonu održanja energije, količina toplote koja se oslobađa tokom kristalizacije tela (na temperaturi kristalizacije) jednaka je
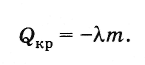 (8.8.3)
(8.8.3)
Iz formule (8.8.1) slijedi da je specifična toplina fuzije u SI izražena u džulima po kilogramu.
Specifična toplota topljenja leda je prilično visoka, 333,7 kJ/kg. Specifična toplota fuzije olova je samo 23 kJ/kg, a zlata 65,7 kJ/kg.
Formule (8.8.2) i (8.8.3) se koriste u rješavanju zadataka za sastavljanje jednačina toplotnog bilansa u slučajevima kada se radi o topljenju i očvršćavanju kristalnih tijela.
Uloga topline topljenja leda i kristalizacije vode u prirodi
Apsorpcija toplote tokom topljenja leda i njeno oslobađanje tokom smrzavanja vode imaju značajan uticaj na promenu temperature vazduha, posebno u blizini vodenih površina. Svi ste verovatno primetili da tokom velikih snežnih padavina obično nastupi zagrevanje.
Veoma važno veliki značaj specifična toplota topljenja leda. Čak i krajem XVIII veka. Škotski naučnik D. Black (1728-1799), koji je otkrio postojanje topline fuzije i kristalizacije, napisao je: „Ako led nije imao značajnu toplinu fuzije, tada bi se u proljeće čitava masa leda morala otopiti za nekoliko minuta ili sekundi, pošto se toplota iz vazduha neprekidno prenosi na led. Ali onda bi posljedice toga bile strašne: na kraju krajeva, čak i u postojećoj situaciji, velike poplave i jaki tokovi vode nastaju kada se tope velike mase leda i snijega.
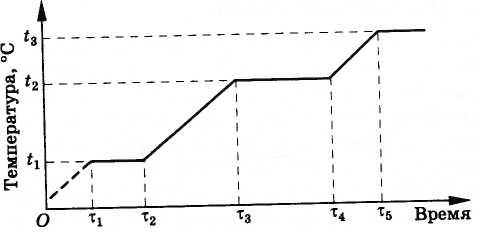
Mlaznica svemirske rakete
Navedimo zanimljiv tehnički primjer praktične upotrebe topline fuzije i isparavanja. U proizvodnji mlaznice za svemirska raketa Treba uzeti u obzir da mlaz gasova koji izlazi iz mlaznice rakete ima temperaturu od oko 4000 °C. U prirodi praktički ne postoje materijali koji bi u svom čistom obliku mogli izdržati takvu temperaturu. Stoga se za hlađenje materijala mlaznice za vrijeme sagorijevanja goriva treba pribjeći raznim trikovima.
Mlaznica je izrađena metalurgijom praha. Vatrostalni metalni prah (volfram) stavlja se u šupljinu kalupa. Zatim se podvrgava kompresiji. Prašak se sinteruje, što rezultira poroznom strukturom nalik plovućcu. Zatim se ovaj "plovac" impregnira bakrom (njegova tačka topljenja je samo 1083 ° C).
Dobiveni materijal naziva se pseudo-legura. Slika 8.31 prikazuje fotografiju mikrostrukture pseudolegure. Na bijeloj pozadini okvira od volframa vidljive su bakrene inkluzije nepravilnog oblika. Ova legura može, koliko god to izgledalo nevjerovatno, kratko raditi čak i na temperaturi plinova nastalih pri sagorijevanju goriva, odnosno iznad 4000°C.

To se dešava na sledeći način. U početku, temperatura legure raste sve dok ne dostigne tačku topljenja bakra t 1 (Sl. 8.32). Nakon toga, temperatura mlaznice se neće mijenjati sve dok se sav bakar ne otopi (vremenski interval od τ 1 do τ 2 ). U budućnosti temperatura ponovo raste sve dok bakar ne proključa. Ovo se dešava na temperaturi t 2 = 2595 °S, niže od tačke topljenja volframa (3380 °S). Dok sav bakar ne proključa, temperatura mlaznice se neće ponovo promeniti, jer bakar koji isparava uzima toplotu od volframa (vremenski interval od τ 3 do τ 4 ). Naravno, mlaznica neće raditi onoliko dugo koliko želite. Nakon što bakar ispari, volfram će ponovo početi da se zagrijava. Međutim, raketni motor radi samo nekoliko minuta, a za to vrijeme mlaznica nema vremena da se pregrije i otopi.