Vodorodning spektral chiziqlarining to'lqin uzunliklari. Mutlaq minimal. Kvant nazariyasi bizning dunyomizni qanday tushuntiradi
Bor tomonidan ilgari surilgan postulatlar vodorod atomining spektrini hisoblash imkonini berdi va vodorodga o'xshash tizimlar- zaryadli yadrodan tashkil topgan tizimlar Ze va bitta elektron (masalan, He +, Li 2+ ionlari), shuningdek, nazariy jihatdan Ridberg doimiysini hisoblang.
Bordan so'ng, vodorodga o'xshash tizimdagi elektronning aylana statsionar orbitalari bilan chegaralangan harakatini ko'rib chiqaylik. Rezerford tomonidan taklif qilingan (208.1) m e v 2 /r=Ze 2 /(4 0 r 2) tenglamani va (210.1) tenglamani birgalikda yechib, n-chi statsionar orbita radiusi ifodasini olamiz:
bu yerda n=1, 2, 3, ... . (212.1) ifodadan kelib chiqadiki, orbitalarning radiuslari butun sonlar kvadratiga mutanosib ravishda o'sadi.
Vodorod atomi (Z=1) uchun n=1 da birinchi elektron orbitasining radiusi deyiladi. birinchi Bor radiusi(a), teng

bu gazlarning kinetik nazariyasiga asoslangan hisob-kitoblarga mos keladi. Statsionar orbitalarning radiuslarini o'lchash mumkin emasligi sababli, nazariyani sinab ko'rish uchun tajribada o'lchash mumkin bo'lgan shunday miqdorlarga murojaat qilish kerak. Bu miqdor vodorod atomlari tomonidan chiqarilgan va so'rilgan energiyadir.
Vodorodga o'xshash sistemadagi elektronning umumiy energiyasi uning kinetik energiyasi (m e v 2 / 2) va yig'indisiga teng. potentsial energiya yadroning elektrostatik maydonida (-Ze 2 / (4 0 r)):

(biz m e v 2 /2 = 1/2 Ze2(4 0 r) ekanligini hisobga oldik (qarang.
(208.1)). N-chi statsionar orbita radiusi uchun kvantlangan qiymatlarni (212.1) hisobga olgan holda, biz elektron energiyasi faqat quyidagi ruxsat etilgan diskret qiymatlarni olishi mumkinligini aniqlaymiz:

bu erda minus belgisi elektronning bog'langan holatda ekanligini bildiradi.
(212.3) formuladan kelib chiqadiki, atomning energiya holatlari qiymatga qarab o'zgaruvchan energiya darajalari ketma-ketligini hosil qiladi. P. Butun son n atomning energiya darajalarini aniqlaydigan ifodada (212.3) deyiladi bosh kvant soni. n=1 bo'lgan energiya holati asosiy (normal) davlat; /r > 1 bo'lgan holatlar hayajonlangan. Atomning asosiy holatiga mos keladigan energiya darajasi deyiladi asosiy (normal) Daraja; boshqa barcha darajalar hayajonlangan.
Berib n turli xil butun son qiymatlari, biz vodorod atomi uchun olamiz

(Z=1), (212.3) formula bo'yicha, mumkin bo'lgan energiya darajalari, sxematik shaklda keltirilgan. 294. Vodorod atomining ortishi bilan energiyasi n ortadi (uning salbiy qiymati kamayadi) va energiya darajalari qiymatga mos keladigan chegaraga yaqinlashadi n= . Shunday qilib, vodorod atomi eng kam energiyaga ega (E 1 = - 13,55 eV) da n= 1 va maksimal (E 1 \u003d 0) n \u003d da (elektron atomdan chiqarilganda). Shuning uchun E =0 qiymati mos keladi ionlanish atom (undan elektronni yirtib tashlang).
Borning ikkinchi postulatiga ko'ra (qarang (210.2)), vodorod atomining (Z=1) statsionar holatdan o'tishida. nBilan yuqori energiya statsionar holatga m kamroq energiya bilan kvant chiqariladi
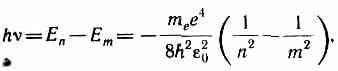
radiatsiya chastotasi qaerdan

R=m e e 4 /(8 soat 3 2 0 ).
Hisoblashda foydalanish R universal konstantalarning zamonaviy qiymatlari, biz vodorod atomi uchun empirik formulalarda Ridberg doimiysining eksperimental qiymatiga to'g'ri keladigan qiymatni olamiz (qarang: §209). Bu tasodif Bor tomonidan olingan formulaning to'g'riligini ishonchli tarzda isbotlaydi
(212.3) vodorodga o'xshash tizimning energiya darajalari uchun.
Masalan, formulaga almashtirish
(212.4) m=1 va n=2, 3, 4, ..., biz Liman qatorini tashkil etuvchi chiziqlar guruhini olamiz (209-bandga qarang) va elektronlarning qo'zg'aluvchan darajalardan o'tishlariga mos keladigan (n=2, 3, 4, .. .) asosiyda (m=1). Xuddi shunday, m=2, 3, 4, 5 ni almashtirganda,
6 va ularning tegishli qiymatlari n § 209 da tasvirlangan Balmer, Paschen, Braket, Pfund va Xamfri (ularning ba'zilari sxematik tarzda 294-rasmda ko'rsatilgan) qatorini olamiz. Shuning uchun vodorod atomining spektrini miqdoriy jihatdan tushuntirgan Bor nazariyasiga ko'ra, spektral qatorlar atomning berilganidan yuqorida joylashgan qo'zg'aluvchan holatlardan ma'lum holatga o'tishi natijasida hosil bo'lgan nurlanishga mos keladi.
Vodorod atomining yutilish spektri chiziqqa o'xshaydi, lekin faqat Lyman seriyasini o'z ichiga oladi. Bu Bor nazariyasi bilan ham izohlanadi. Erkin vodorod atomlari odatda asosiy holatda bo'lgani uchun (eng past energiyaga ega statsionar holat). n= 1), u holda atomlarga tashqaridan ma'lum energiya berilganda faqat o'tishlarni kuzatish mumkin
atomlarni asosiy holatdan hayajonlanganlarga (Liman seriyasi paydo bo'ladi).
Bor nazariyasi atom fizikasining rivojlanishidagi katta qadam boʻlib, kvant mexanikasini yaratishda muhim qadam boʻldi. Biroq, bu nazariya ichki qarama-qarshiliklarga ega (bir tomondan klassik fizika qonunlarini qo'llaydi, ikkinchi tomondan, u kvant postulatlariga asoslanadi). U vodorod atomi va vodorodga o'xshash tizimlarning spektrlarini o'rganib chiqdi va chastotalarni hisobladi spektral chiziqlar, ammo ularning intensivligini tushuntirib bera olmadi va savolga javob bera olmadi: nima uchun muayyan o'tishlar sodir bo'ladi? Bor nazariyasining jiddiy kamchiligi uni vodorod atomidan keyingi eng oddiy atomlardan biri bo'lgan geliy atomining spektrini tasvirlash uchun ishlatishning mumkin emasligi edi.
test savollari
Nima uchun atomning yadro modeli muvaffaqiyatsizlikka uchradi?
Nima uchun vodorod atomining turli qator spektral chiziqlari ichida Balmer seriyasi birinchi bo'lib o'rganildi?
m va sonlari qanday ma'noni bildiradi n umumlashtirilgan Balmer formulasida?
Qavs qatorining qisqa to'lqinli chegarasiga vodorod atomining nurlanish chastotasi qanday?
Bor postulatlarining ma'nosini tushuntiring. Ular qanday tushuntirishadi chiziqli spektr atom? Shakldagi egri chiziqning qaysi qismlarida. 293 elastik va qaysi atomlar bilan elektronlarning noelastik to'qnashuvi kuzatiladi?
Frank va Gerts tajribalaridan qanday asosiy ma'lumotlarni olish mumkin? Bor modelidan foydalanib, vodorod atomi n=3 va n=4 holatlarga oʻtganda paydo boʻladigan spektral chiziqlarni koʻrsating.
Vodorod atomining birinchi ikkita spektral seriyasining har birining uchta chizig'ini to'lqin uzunligi shkalasida chizing.
Nima uchun vodorod atomining yutilish spektri faqat Liman qatorini o'z ichiga oladi? (212.3) formulani E n =-13,55/n 2 shaklida yozish mumkinligini ko'rsating, bu erda E elektron voltlarda ifodalanadi.
Vazifalar
27.1. Vodorod atomi spektrining ultrabinafsha qatoridagi (Liman seriyasi) maksimal va minimal foton energiyalarini aniqlang.
27.2. Balmer seriyasining chegarasiga mos keladigan to'lqin uzunligini aniqlang.
27.3. Bor nazariyasidan foydalanib, vodorod atomining ikkinchi orbitasi bo'ylab harakatlanadigan elektronning orbital magnit momentini aniqlang.
27.4. Bor nazariyasidan foydalanib, to‘lqin uzunligi =1,212 10 -7 m bo‘lgan foton chiqishi bilan elektronning qo‘zg‘alilgan holatdan (n=2) asosiy holatga o‘tishida orbital mexanik impulsning o‘zgarishini aniqlang.[ L = h=1,05 10 -3 4 J s]
27.5. Vodorod atomining ionlanish potentsialini aniqlang.
27.6. Vodorod atomining ionlanish energiyasi ekanligiga asoslanadi E men \u003d 13,6 eV, ushbu atomning ikkinchi qo'zg'alish potentsialini aniqlang.
27.7 . Vodorod atomining ionlanish energiyasi £" = 13,6 eV ekanligiga asoslanib, Lyman seriyasining eng uzun to'lqin uzunligi chizig'iga mos keladigan foton energiyasini elektron voltlarda aniqlang.
* I.Rydberg (1854-1919) - shved olimi, spektroskopiya sohasidagi mutaxassis.
Noyob gazlarning emissiya spektrlarini (ya'ni, alohida atomlarning emissiya spektrlarini) o'rganish shuni ko'rsatdiki, har bir gaz alohida spektral chiziqlar yoki bir-biriga yaqin joylashgan chiziqlar guruhidan iborat aniq belgilangan chiziqli spektrga ega. Eng oddiy atom - vodorod atomining spektri eng ko'p o'rganilgan.
Shveytsariyalik olim I. Balmer (1825-1898) vodorod atomining o'sha davrda ma'lum bo'lgan barcha spektral chiziqlarini tavsiflovchi empirik formulani oldi. spektrning ko'rinadigan hududi:
qaerda R "= 1,10 10 7 m -1 - doimiyRidberg . v = c/ ekan, u holda formula
(209.1) chastotalar uchun qayta yozilishi mumkin:

bu erda R \u003d R "c \u003d 3,29 10 15 s -1 ham Ridberg doimiysi.
(209.1) va (209.2) ifodalardan kelib chiqadiki, spektral chiziqlar turli qiymatlarda farqlanadi. n, deb nomlangan qatorlar guruhini yoki qatorini hosil qiladi Balmer seriyasi. O'sish bilan n seriyaning chiziqlari yaqinlashmoqda; ma'nosi n= belgilaydi qator chegarasi, unga uzluksiz spektr yuqori chastotalar tomondan qo'shiladi.
Keyinchalik (20-asr boshlarida) vodorod atomi spektrida yana bir qancha qatorlar topildi. DA spektrning ultrabinafsha mintaqasi joylashgan Lyman seriyasi:

DA infraqizil spektr ham topilgan: Paschen seriyasi
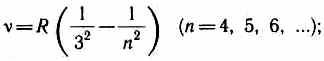
Qavslar seriyasi
Pfund seriyasi

Humphrey seriyasi

Vodorod atomi spektridagi barcha yuqoridagi qatorlar bitta formula bilan tavsiflanishi mumkin Balmerning umumlashtirilgan formulasi bo'yicha:

bu yerda m har bir berilgan qatorda o‘zgarmas qiymatga ega, m= 1, 2, 3, 4, 5, 6 (qatorni belgilaydi), n m+1 dan boshlab butun son qiymatlarini oladi (ushbu qatorning alohida satrlarini belgilaydi).
Murakkabroq spektrlarni - ishqoriy metallar bug'lari spektrlarini (masalan, Li, Na, K) o'rganish ular tartibsiz joylashgan chiziqlar to'plami bilan ifodalanganligini ko'rsatdi. Rydberg ularni uchta seriyaga bo'lishga muvaffaq bo'ldi, ularning har biri Balmer seriyasining chiziqlari kabi joylashgan.
Yuqoridagi ketma-ket formulalar empirik tarzda tanlangan va uzoq vaqt davomida ular juda yuqori aniqlik bilan eksperimental tarzda tasdiqlangan bo'lsa-da, nazariy asosga ega emas edi. Yuqoridagi ketma-ket formulalar shakli, ulardagi butun sonlarning hayratlanarli takrorlanishi, Ridberg doimiysining universalligi chuqur jismoniy hissiyot klassik fizika doirasida ochib bo'lmaydigan qonuniyatlarni topdi.
§210. Bor postulatlari
Atomning sifat jihatidan yangi - kvant nazariyasini yaratishga birinchi urinish 1913 yilda daniyalik fizigi Nils Bor (1885-1962) tomonidan qilingan. U oʻz oldiga chiziq spektrlarining empirik qonuniyatlarini, atomning Rezerfordning yadroviy modelini, yorugʻlik chiqishi va yutilishining kvant tabiatini bir butunga bogʻlashni maqsad qilib qoʻydi. Bor o'z nazariyasini ikkita postulatga asosladi.
Borning birinchi postulati (statsionar holat postulati): atomda statsionar (vaqt o'tishi bilan o'zgarmas) holatlar mavjud bo'lib, ularda u energiya chiqarmaydi. Atomning statsionar holatlari elektronlar harakatlanadigan statsionar orbitalarga mos keladi. Statsionar orbitalarda elektronlarning harakati elektromagnit to'lqinlarning emissiyasi bilan birga kelmaydi.
Atomning statsionar holatida aylana orbita bo'ylab harakatlanadigan elektron shartni qondiradigan burchak momentumining diskret kvantlangan qiymatlariga ega bo'lishi kerak.
m e vr n = h(n= 1, 2, 3, ...), (210.1)
qayerda m e elektronning massasi, v- uning tezligi r n radiusning n-orbitasi bo‘ylab, h=h/(2). Borning ikkinchi postulati (chastotalar qoidasi): elektron bir statsionar orbitadan ikkinchisiga o'tganda, bitta foton energiya bilan chiqariladi (so'riladi).
h =E n -E m , (210.2)
mos keladigan statsionar holatlarning energiya farqiga teng ( E n va E m - mos ravishda atomning nurlanishdan oldingi va keyingi statsionar holatlarining energiyalari (yutilish)). Da E m < E n foton chiqariladi (atomning yuqori energiyali holatdan past energiyali holatga o'tishi, ya'ni elektronning yadrodan uzoqroq orbitadan yaqinroq orbitaga o'tishi), E m. > E n- uning yutilishi (atomning yuqori energiyaga ega bo'lgan holatga o'tishi, ya'ni elektronning yadrodan uzoqroq orbitaga o'tishi). Mumkin diskret chastotalar to'plami v = = (E n -E m )/h kvant o'tishlarini amalga oshiradi va atomning chiziqli spektrini aniqlaydi.
Uning spektral qatorlari eng yaxshi o'rganilgan. Ular Ridberg formulasiga yaxshi bo'ysunadilar:
1 l = R (1 n ′ 2 - 1 n 2) (\displaystyle (\frac (1)(\lambda ))=R\left((\frac (1)((n))^(2))) -(\frac (1)(n^(2)))\o'ng)),qayerda R= 109 677 sm -1 vodorod uchun Ridberg doimiysi, n'- seriyaning asosiy darajasi.
Asosiy energiya darajasiga o'tish paytida paydo bo'ladigan spektral chiziqlar deyiladi rezonansli, boshqa - bo'ysunuvchi.
Spektral qatorlar fizikasi
Vodorod atomi yadro atrofida aylanadigan elektrondan iborat. Elektron va yadro protonlari orasidagi elektromagnit kuch to'plamning mavjudligiga sabab bo'ladi kvant holatlari elektron, ularning har biri o'z energiyasiga ega. Bu holatlar Bor modelida alohida elektron orbitalari sifatida tasvirlangan. Har bir orbita yoki holat n butun soniga mos keladi.
Spektral emissiya elektron yuqori energiya holatidan pastroq holatga o'tganda sodir bo'ladi. Pastroq energiya holati n' va yuqori energiya holati n bilan belgilanadi. Chiqarilgan fotonning energiyasi ikki holat o'rtasidagi farqga to'g'ri keladi. Har bir holatning energiyasi doimo bir xil bo'lganligi sababli, ular orasidagi farq ham har doim bir xil bo'ladi va o'tish doimo doimiy energiyaga ega bo'lgan fotonni chiqaradi.
Spektral chiziqlar ketma-ket n' bo'yicha guruhlangan. Chiziqlar yunoncha harflardagi eng past chastotadan ketma-ket nomlanadi. Masalan, 2 → 1 qatori Lyman-alfa (Ly-a) chizig'i va 7 → 3 Paschen-delta (Pa-d) deb ataladi.
Vodorodda bu qatorlarga kirmaydigan chiziqlar mavjud, masalan, 21 santimetr chiziq. Bu chiziqlar atomdagi kam uchraydigan jarayonlarga, masalan, o'ta nozik o'tishlarga mos keladi. Yupqa tuzilish, shuningdek, relyativistik ta'sirlar tufayli ikki yoki undan ko'p yaqin to'plangan nozik chiziqlar kabi ko'rinadigan yagona spektral chiziqlarni ham o'z ichiga oladi.
Lyman seriyasi
ochiq T. Lyman 1906 yilda. Seriyaning barcha chiziqlari ultrabinafsha diapazonida. Seriya Rydberg formulasiga mos keladi n' = 1 va n = 2, 3, 4, … ; chiziq L a = 1216 Å - vodorodning rezonans chizig'i. Seriya chegarasi 911,8 Å.
Balmer seriyasi
1885 yilda I. Ya. Balmer tomonidan kashf etilgan. Seriyaning dastlabki to'rtta qatori ko'rinadigan diapazonda va Balmerdan ancha oldin ma'lum bo'lgan, u ularning to'lqin uzunliklari uchun empirik formulani taklif qilgan va uning asosida ultrabinafsha mintaqada ushbu seriyaning boshqa chiziqlari mavjudligini taxmin qilgan. Seriya Rydberg formulasiga mos keladi n' = 2 va n = 3, 4, 5, … ; chiziq H a = 6565 Å, seriya chegarasi - 3647 Å.
Paschen seriyasi
Brackett seriyasi
1922 yilda F.S.Brakett tomonidan kashf etilgan. Seriyaning barcha chiziqlari yaqin infraqizil diapazonda. Seriya Rydberg formulasiga mos keladi n' = 4 va n = 5, 6, 7, … ; chiziq B a = 40 522 Å. Seriya chegarasi 14,588 Å.
Pfund seriyasi
1924 yilda A. G. Pfund tomonidan kashf etilgan. Seriyaning chiziqlari yaqin (o'rtaning bir qismi) infraqizil diapazonda. Seriya Rydberg formulasiga mos keladi n' = 5 va n = 6, 7, 8, … ; chiziq Pf a = 74 598 Å. Seriya chegarasi 22,794 Å.
Vodorodning spektral chiziqlari
Vodorodning ko'rinadigan diapazondagi chiziqli spektrini tushuntirishga birinchi urinish 1885 yilda maktab o'qituvchisi va matematik Iogann Balmer (1825-1898) tomonidan qilingan. Balmer chastotalarni payqab qoldi f spektrning ko'rinadigan qismidagi bu chiziqlar formula bilan tasvirlanishi mumkin
f ~(1/2 2)-(1/n 2).
~ belgisi proportsional degan ma'noni anglatadi, ya'ni quyida muhokama qilinadigan doimiy omil mavjudligini bildiradi. Ushbu tenglamada n - 2 dan katta butun son, ya'ni 3, 4, 5 va hokazo.
Spektrning ko'rinadigan qismidagi bu chiziqlar Balmer seriyasi deb ataladi. Keyinchalik spektrning ultrabinafsha va infraqizil qismlarida chiziqlar topildi. Ular o'zlarining kashfiyotchilari sharafiga mos ravishda Lyman va Paschen seriyalari deb nomlandilar - Amerikalik fizik va spektroskopist Teodor Liman (1874-1954) va nemis fizigi Lui Karl Geynrix Fridrix Paschen (1865-1947) edi. 1888 yilda shved fizigi va spektroskopisti Iogannes Rydberg (1854-1919) vodorod yoyi chiroqining emissiyasida va quyosh va yulduz nurlarining yutilish spektrlarida ko'rinadigan barcha spektral chiziqlarni tavsiflovchi formulani nashr etdi. Vodorodning spektral chiziqlari chastotasi uchun Ridberg formulasi shaklga ega
f =R H [(1/ n 1 2)-(1/n 2 2)],
qayerda n 1 - 1 dan boshlanadigan butun sonlar va n 2 - katta bo'lishi kerak bo'lgan boshqa butun sonlar n bitta. Ma'nosi n 1 =1 Lyman seriyasini beradi, n 1 \u003d 2 - Balmer, n 1 \u003d 3 - Pashenning seriyasi.
Doimiy R H vodorod atomi uchun Ridberg doimiysi deb ataladi. Uning qiymati R H=109677,6 sm-1 va to'lqinlar soni bilan ifodalanadi ( sm- bitta). Ridberg formulasida ushbu qiymatdan foydalanganda spektral chiziqlarning chastotalari butun sonlar bilan aniqlanadi. n 1 va n 2 to'lqin raqamlari bilan ifodalanadi. Natijani gertsga aylantirish uchun olingan qiymatni yorug'lik tezligiga, ya'ni 3 10 10 ga ko'paytirish kerak. sm/sek. Spektral chiziqning to'lqin uzunligini topish uchun to'lqinlar sonida ifodalangan chastotaning o'zaro nisbatini olish kerak, ya'ni bittasini to'lqinlar sonida ifodalangan chastotaga bo'lish kerak. Masalan, agar n 1 =2, va n 2 = 3, keyin
f =R H[(1/2 2)-(1/3 2)] = R H[(1/4)-(1/9)] = 1,52 10 4 sm -1
to'lqinlar soni sifatida ifodalangan chastotadir. Bu raqamning o'zaro nisbati 6,56 10 -5 ga teng sm = 656 10 -9 m = = 656 nm. Shunday qilib, to'lqin uzunligi 656 ga teng nm- rasmda ko'rsatilgan Balmer seriyasidagi qizil chiziq. 9.2.
Rasmni muhokama qilganda. 8.7 biz allaqachon qutidagi zarracha uchun kvant energiya darajalari orasidagi optik o'tishlarning diskretligini muhokama qildik. Shaklda. 8.7 qutidagi zarracha holatlari orasidagi o'tishlarni ko'rsatadi, unda n =1 ga aylanadi n =2 va n =1 ga aylanadi n =3. Shu munosabat bilan, vodorod atomidagi optik o'tishlar butun sonlarga bog'liq bo'lgan diskret chastotalar to'plamiga mos kelishi ajablanarli emas. Biroq, 1888 yilda, Ridberg formulasi olinganda, Rydberg formulasi bo'yicha butun sonlar orqali bog'langan energiya darajalarini kvantlash g'oyasini diskretlar orasidagi optik o'tishlar deb tushunishga hali 12 yil qolgan edi. vodorod atomi bilan bog'liq energiya darajalari.
Guruch. 9.3. Lyman va Balmer seriyali vodorod emissiya liniyalarini yaratuvchi ba'zi energiya darajalarining diagrammasi. Pastga yo'naltirilgan o'qlar yorug'likning vodorod tomonidan qanday chiqarilishini ko'rsatadi, masalan, boshq chiroqda. Absorbtsiyadan so'ng, rasmda quyuq chiziqlar beradi. 9.2, o'qlar yuqoriga qaratilgan. Darajalar orasidagi intervallar o'lchov uchun emas, balki an'anaviy tarzda ko'rsatilgan.
Lyman va Balmer seriyasini keltirib chiqaradigan energiya darajalarining ba'zilari shaklda ko'rsatilgan. 9.3. Bu erda pastga qaragan o'qlar vodorod yoyi chiroqida kuzatiladigan emissiya chiziqlariga to'g'ri keladi. Dastlab yuqori energiya darajasida bo'lgan vodorod atomi oxir-oqibat pastroq darajaga o'tadi. Energiya foton chiqarish orqali saqlanadi. Energiyani tejash uchun foton asl orasidagi farqga teng energiyani olib yurishi kerak, undan yuqori energiya darajasi va past energiya yakuniy darajasi. Mumkin bo'lgan eng kichik qiymat n Ridberg formulasidagi 1 1 ga teng va n 2 ko'proq bo'lishi kerak n bitta. 2-1 bilan belgilangan strelka darajadan emissiyaga mos keladi n = Har bir daraja uchun 2 n =1.
Lyman seriyasidagi keyingi eng katta nurlanish energiyasi sathidan o'tish orqali olinadi n = Har bir daraja uchun 3 n =1. Rydberg formulasida keyingi mumkin bo'lgan qiymat n 1 2 ga teng va n 2 ko'proq bo'lishi kerak n bitta. Shuning uchun Balmer seriyasidagi emissiya chizig'ining eng past energiyasi 3-2 deb belgilangan. Vodorod atomi darajasida bo'lganda n =3, darajaga o'tadi n =2, energiya tejamkorligi to'lqin uzunligi 656 bo'lgan fotonning chiqishi bilan ta'minlanadi. nm. Vodorod atomlariga yorug'lik tushganda, yutilish sodir bo'ladi, uni xuddi shu diagrammada yuqoriga qaratilgan o'qlar bilan tasvirlash mumkin.






